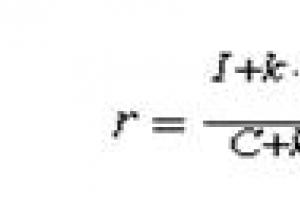Określ rodzaj wiązania chemicznego w cząsteczce fluoru. Rodzaje wiązań chemicznych. Kowalencyjne polarne wiązanie chemiczne
(pierwszy elektron)
(według Paulinga)
| F | 9 |
| 18,9984 | |
| 2s 2 2p 5 | |
| Fluor | |
Właściwości chemiczne
Najbardziej aktywny niemetal, gwałtownie oddziałuje z prawie wszystkimi substancjami (rzadkimi wyjątkami są fluoroplasty), a z większością z nich - ze spalaniem i wybuchem. Kontakt fluoru z wodorem prowadzi nawet przy bardzo wysokich temperaturach do zapłonu i wybuchu niskie temperatury(do -252°C). Nawet woda i platyna: uran dla przemysłu nuklearnego spala się w atmosferze fluoru.
trifluorek chloru ClF 3 - środek fluorujący i silny utleniacz paliwo rakietowe
sześciofluorek siarki SF 6 - izolator gazowy w przemyśle elektrycznym
fluorki metali (na przykład W i V), które mają trochę użyteczne właściwości
freony są dobrymi czynnikami chłodniczymi
teflon - chemicznie obojętne polimery
heksafluoroglinian sodu - do późniejszej produkcji aluminium metodą elektrolizy
różne związki fluor
Technologia rakietowa
Związki fluoru są szeroko stosowane w technice rakietowej jako utleniacz paliwa.Zastosowanie w medycynie
Związki fluoru są szeroko stosowane w medycynie jako substytuty krwi.
Rola biologiczna i fizjologiczna
Fluor jest pierwiastkiem niezbędnym dla organizmu. W organizmie człowieka fluor występuje głównie w szkliwie zębów jako część fluorapatytu - Ca 5 F (PO 4) 3 . Przy niewystarczającym (mniej niż 0,5 mg / litr woda pitna) lub nadmierne (powyżej 1 mg/litr) spożycie fluoru przez organizm może rozwinąć choroby zębów: odpowiednio próchnicę i fluorozę (cętkowane szkliwo) oraz kostniakomięsak.
W celu zapobiegania próchnicy zaleca się stosowanie past do zębów z dodatkami fluoru lub picie wody fluorkowanej (do stężenia 1 mg/l) lub stosowanie miejscowych aplikacji 1-2% roztworu fluorku sodu lub fluorku cynawego. Takie działania mogą zmniejszyć prawdopodobieństwo wystąpienia próchnicy o 30-50%.
Maksymalne dopuszczalne stężenie związanego fluoru w powietrzu obiektów przemysłowych wynosi 0,0005 mg/litr.
Dodatkowe informacje
Fluor, Fluor, F(9)
Fluor (Fluor, French i German Fluor) otrzymano w stanie wolnym w 1886 roku, ale jego związki znane są od dawna i były szeroko stosowane w metalurgii i produkcji szkła. Pierwsza wzmianka o fluorycie (CaP,) pod nazwą fluoryt (Fliisspat) pochodzi z XVI wieku. Jedna z prac przypisywanych legendarnemu Wasilijowi Walentynowi wspomina o malowanych na różne kolory kamieniach – topnikach (Fliisse od łac. O tym samym piszą Agricola i Libavius. Ten ostatni wprowadza specjalne nazwy dla tego topnika - fluoryt (Flusspat) i stop mineralny. Wielu autorów pism chemicznych i technicznych z XVII i XVIII wieku. opisać różne rodzaje fluoryt. W Rosji kamienie te nazywano plavik, spalt, splunął; Łomonosow sklasyfikował te kamienie jako selenity i nazwał je drzewcem lub strumieniem (strumień kryształu). Rosyjscy mistrzowie, a także kolekcjonerzy kolekcji minerałów (na przykład w XVIII wieku książę P.F. Golicyn) wiedzieli, że niektóre rodzaje drzewców po podgrzaniu (na przykład w gorąca woda) świecić w ciemności. Jednak nawet Leibniz w swojej historii fosforu (1710) wspomina w związku z tym termofosfor (Thermophosphorus).
Najwyraźniej chemicy i chemicy rzemieślnicy zapoznali się z kwasem fluorowodorowym nie później niż w XVII wieku. W 1670 r. norymberski rzemieślnik Schwanhard użył fluorytu zmieszanego z kwasem siarkowym do wytrawiania wzorów na szklanych kielichach. Jednak w tamtym czasie natura fluorytu i kwasu fluorowodorowego była całkowicie nieznana. Uważano na przykład, że kwas krzemowy ma działanie trawiące w procesie Schwanharda. Ten błędny pogląd wyeliminował Scheele, udowadniając, że w reakcji fluorytu z kwasem siarkowym kwas krzemowy otrzymuje się w wyniku erozji szklanej retorty przez powstały kwas fluorowodorowy. Ponadto Scheele ustalił (1771), że fluoryt to połączenie ziemi wapiennej ze specjalnym kwasem, który nazwano „kwasem szwedzkim”.
Lavoisier rozpoznał rodnik kwasu fluorowodorowego (rodnik fluorowy) jako ciało proste i umieścił go w swojej tabeli ciał prostych. W mniej więcej czysta forma kwas fluorowodorowy uzyskano w 1809 roku. Gay-Lussaca i Tenarda przez destylację fluorytu z kwasem siarkowym w ołowianej lub srebrnej retorcie. Podczas tej operacji obaj badacze zostali otruci. Prawdziwą naturę kwasu fluorowodorowego ustalił w 1810 roku Ampère. Odrzucił opinię Lavoisiera, że kwas fluorowodorowy musi zawierać tlen i udowodnił analogię tego kwasu z kwasem solnym. Ampère przekazał swoje odkrycia Davy'emu, który krótko wcześniej ustalił elementarną naturę chloru. Davy w pełni zgodził się z argumentami Ampere'a i poświęcił wiele wysiłku na uzyskanie wolnego fluoru poprzez elektrolizę kwasu fluorowodorowego i innymi sposobami. Biorąc pod uwagę silne korozyjne działanie kwasu fluorowodorowego na szkło, a także na tkanki roślinne i zwierzęce, Ampere zaproponował nazwanie zawartego w nim pierwiastka fluorem (gr. zniszczenie, śmierć, zaraza, plaga itp.). Jednak Davy nie zaakceptował tej nazwy i zaproponował inną – fluor (Fluor) przez analogię do ówczesnej nazwy chloru – chlor (Chlor), obie nazwy są nadal używane w język angielski. W języku rosyjskim zachowała się nazwa nadana przez Ampere.
Liczne próby wyizolowania wolnego fluoru w XIX wieku nie przyniosło pomyślnych rezultatów. Dopiero w 1886 roku Moissanowi udało się tego dokonać i otrzymać wolny fluor w postaci żółtozielonego gazu. Ponieważ fluor jest niezwykle agresywnym gazem, Moissan musiał pokonać wiele trudności, zanim znalazł materiał odpowiedni do aparatury w eksperymentach z fluorem. U-rurka do elektrolizy kwasu fluorowodorowego w temperaturze 55°C (chłodzona płynnym chlorkiem metylu) została wykonana z platyny z czopami fluorytowymi. Po chemii i właściwości fizyczne wolny fluor, znalazł szerokie zastosowanie. Teraz fluor jest jednym z krytyczne komponenty synteza substancji fluoroorganicznych o szerokim zakresie. W literaturze rosyjskiej początek XIX V. fluor nazywano inaczej: podstawa kwasu fluorowodorowego, fluor (Dvigubsky, 1824), fluor (Iovsky), fluor (Shcheglov, 1830), fluor, fluor, fluor. Hess od 1831 roku wprowadził nazwę fluor.
Zadanie numer 1
Z zaproponowanej listy wybierz dwa związki, w których występuje jonowe wiązanie chemiczne.
- 1. Ca(ClO2) 2
- 2. HClO 3
- 3.NH4Cl
- 4. HClO 4
- 5.Cl2O7
Odpowiedź: 13
W zdecydowanej większości przypadków obecność wiązania typu jonowego w związku można stwierdzić po tym, że jego jednostki strukturalne obejmują jednocześnie atomy typowego metalu i atomy niemetalu.
Na tej podstawie ustalamy, że w związku nr 1 występuje wiązanie jonowe - Ca(ClO 2) 2, ponieważ w jego wzorze widać atomy typowego wapnia metalicznego oraz atomy niemetali - tlenu i chloru.
Jednak na tej liście nie ma już związków zawierających zarówno atomy metali, jak i niemetali.
Wśród wskazanych w zadaniu związków znajduje się chlorek amonu, w którym wiązanie jonowe jest zrealizowane pomiędzy kationem amonowym NH 4 + a jonem chlorkowym Cl − .
Zadanie numer 2
Z proponowanej listy wybierz dwa związki, w których typ wiązanie chemiczne taki sam jak w cząsteczce fluoru.
1) tlen
2) tlenek azotu (II)
3) bromowodór
4) jodek sodu
Wpisz numery wybranych połączeń w polu odpowiedzi.
Odpowiedź: 15
Cząsteczka fluoru (F 2) składa się z dwóch atomów jednego niemetalicznego pierwiastka chemicznego, dlatego wiązanie chemiczne w tej cząsteczce jest kowalencyjne niepolarne.
Wiązanie kowalencyjne niespolaryzowane może powstać tylko między atomami tego samego pierwiastka chemicznego niemetalu.
Spośród proponowanych opcji tylko tlen i diament mają wiązanie kowalencyjne niepolarne. Cząsteczka tlenu jest dwuatomowa, składa się z atomów jednego pierwiastka chemicznego niemetalu. Diament ma budowę atomową iw swojej strukturze każdy atom węgla, który jest niemetalem, jest związany z 4 innymi atomami węgla.
Tlenek azotu (II) jest substancją składającą się z cząsteczek utworzonych przez atomy dwóch różnych niemetali. Od elektroujemności różne atomy są zawsze różne, wspólna para elektronów w cząsteczce jest przesunięta do pierwiastka bardziej elektroujemnego, w tym przypadku do tlenu. Zatem wiązanie w cząsteczce NO jest kowalencyjnie polarne.
Bromowodór składa się również z cząsteczek dwuatomowych zbudowanych z atomów wodoru i bromu. Wspólna para elektronów tworząca wiązanie H-Br jest przesunięta do bardziej elektroujemnego atomu bromu. Wiązanie chemiczne w cząsteczce HBr jest również kowalencyjnie polarne.
Jodek sodu jest substancją jonową utworzoną przez kation metalu i anion jodkowy. Wiązanie w cząsteczce NaI powstaje w wyniku przeniesienia elektronu z 3 S-orbitale atomu sodu (atom sodu zamienia się w kation) do niedopełnienia 5 P-orbital atomu jodu (atom jodu zamienia się w anion). Takie wiązanie chemiczne nazywamy jonowym.
Zadanie numer 3
Z proponowanej listy wybierz dwie substancje między cząsteczkami, z których tworzą się wiązania wodorowe.
- 1. C 2 H 6
- 2.C2H5OH
- 3.H2O
- 4. CH 3 OCH 3
- 5. CH 3 COCH 3
Wpisz numery wybranych połączeń w polu odpowiedzi.
Odpowiedź: 23
Wyjaśnienie:
Wiązania wodorowe zachodzą w substancjach o strukturze molekularnej, w których występuje kolet wiązania H-O, H-N, HF-F. Te. wiązania kowalencyjne atomu wodoru z atomami trójki pierwiastki chemiczne o najwyższej elektroujemności.
Tak więc, oczywiście, istnieją wiązania wodorowe między cząsteczkami:
2) alkohole
3) fenole
5) amoniak
6) pierwszorzędowe i drugorzędowe aminy
7) kwas fluorowodorowy
Zadanie numer 4
Z zaproponowanej listy wybierz dwa związki z jonowym wiązaniem chemicznym.
- 1. PCl 3
- 2.CO2
- 3.NaCl
- 4. H2S
- 5. MgO
Wpisz numery wybranych połączeń w polu odpowiedzi.
Odpowiedź: 35
Wyjaśnienie:
W zdecydowanej większości przypadków można stwierdzić, że w związku występuje wiązanie typu jonowego na podstawie faktu, że skład jednostek strukturalnych substancji obejmuje jednocześnie atomy typowego metalu i atomy niemetalu.
Na tej podstawie ustalamy, że w związku nr 3 (NaCl) i 5 (MgO) występuje wiązanie jonowe.
Notatka*
Oprócz powyższej cechy, obecność wiązania jonowego w związku można stwierdzić, jeśli jego jednostka strukturalna zawiera kation amonowy (NH 4 +) lub jego organiczne analogi - kationy alkiloamoniowe RNH 3 +, dialkiloamoniowy R 2 NH 2 + , trialkiloamoniowy R3NH+ lub tetraalkiloamoniowy R4N+, gdzie R oznacza pewien rodnik węglowodorowy. Na przykład, typ jonowy wiązanie zachodzi w związku (CH 3) 4 NCl pomiędzy kationem (CH 3) 4 + a jonem chlorkowym Cl - .
Zadanie numer 5
Z proponowanej listy wybierz dwie substancje o tym samym typie budowy.
4) sól kuchenna
Wpisz numery wybranych połączeń w polu odpowiedzi.
Odpowiedź: 23
Zadanie numer 8
Z proponowanej listy wybierz dwie substancje o budowie niemolekularnej.
2) tlen
3) biały fosfor
5) krzem
Wpisz numery wybranych połączeń w polu odpowiedzi.
Odpowiedź: 45
Zadanie numer 11
Z zaproponowanej listy wybierz dwie substancje, w cząsteczkach których występuje podwójne wiązanie między atomami węgla i tlenu.
3) formaldehyd
4) kwas octowy
5) gliceryna
Wpisz numery wybranych połączeń w polu odpowiedzi.
Odpowiedź: 34
Zadanie numer 14
Z proponowanej listy wybierz dwie substancje z wiązaniem jonowym.
1) tlen
3) tlenek węgla (IV)
4) chlorek sodu
5) tlenek wapnia
Wpisz numery wybranych połączeń w polu odpowiedzi.
Odpowiedź: 45
Zadanie numer 15
Z proponowanej listy wybierz dwie substancje o takiej samej sieci krystalicznej jak diament.
1) krzemionka SiO2
2) tlenek sodu Na2O
3) tlenek węgla WSPÓŁ
4) fosfor biały P 4
5) krzem Si
Wpisz numery wybranych połączeń w polu odpowiedzi.
Odpowiedź: 15
Zadanie numer 20
Z proponowanej listy wybierz dwie substancje, w cząsteczkach których występuje jedno wiązanie potrójne.
- 1. HCOOH
- 2.HCOH
- 3. C 2 H 4
- 4. N 2
- 5.C2H2
Wpisz numery wybranych połączeń w polu odpowiedzi.
Odpowiedź: 45
Wyjaśnienie:
Aby znaleźć poprawną odpowiedź, narysuj wzory strukturalne związki z prezentowanej listy:
Widzimy zatem, że potrójne wiązanie istnieje w cząsteczkach azotu i acetylenu. Te. poprawne odpowiedzi 45
Zadanie numer 21
Z proponowanej listy wybierz dwie substancje, w cząsteczkach których występuje kowalencyjne wiązanie niepolarne.
Tematyka kodyfikatora USE: Kowalencyjne wiązanie chemiczne, jego odmiany i mechanizmy powstawania. Charakterystyka wiązania kowalencyjnego (biegunowość i energia wiązania). Wiązanie jonowe. Połączenie metalowe. wiązanie wodorowe
Wewnątrzcząsteczkowe wiązania chemiczne
Rozważmy najpierw wiązania, które powstają między cząstkami w cząsteczkach. Takie połączenia to tzw wewnątrzcząsteczkowy.
wiązanie chemiczne między atomami pierwiastków chemicznych ma charakter elektrostatyczny i powstaje z powodu oddziaływania elektronów zewnętrznych (walencyjnych)., w mniejszym lub większym stopniu utrzymywane przez dodatnio naładowane jądra związane atomy.
Kluczową koncepcją jest tutaj ELEKTROGNATOWNOŚĆ. To ona określa rodzaj wiązania chemicznego między atomami i właściwości tego wiązania.
to zdolność atomu do przyciągania (trzymania) zewnętrzny(wartościowość) elektrony. Elektroujemność jest określona przez stopień przyciągania zewnętrznych elektronów do jądra i zależy głównie od promienia atomu i ładunku jądra.
Elektroujemność jest trudna do jednoznacznego określenia. L. Pauling sporządził tabelę względnej elektroujemności (opartej na energiach wiązań cząsteczek dwuatomowych). Najbardziej elektroujemnym pierwiastkiem jest fluor ze znaczeniem 4 .
Należy zauważyć, że w różnych źródłach można znaleźć różne skale i tabele wartości elektroujemności. Nie należy się tego bać, ponieważ tworzenie wiązania chemicznego odgrywa pewną rolę atomów i jest w przybliżeniu taka sama w każdym systemie.
Jeżeli jeden z atomów w wiązaniu chemicznym A:B silniej przyciąga elektrony, wówczas para elektronów jest przesunięta w jego stronę. Więcej różnica elektroujemności atomów, tym bardziej para elektronów jest przesunięta.
Jeśli wartości elektroujemności oddziałujących atomów są równe lub w przybliżeniu równe: EO(A)≈EO(V), to wspólna para elektronów nie jest przemieszczana do żadnego z atomów: O: B. Takie połączenie nazywa się kowalencyjne niepolarne.
Jeśli elektroujemność oddziałujących atomów różni się, ale niewiele (różnica elektroujemności wynosi w przybliżeniu od 0,4 do 2: 0,4<ΔЭО<2 ), wtedy para elektronów zostaje przesunięta do jednego z atomów. Takie połączenie nazywa się kowalencyjny polarny .
Jeśli elektroujemność oddziałujących atomów znacznie się różni (różnica elektroujemności jest większa niż 2: ΔEO>2), wówczas jeden z elektronów prawie całkowicie przechodzi do innego atomu wraz z formacją jony. Takie połączenie nazywa się joński.
Główne typy wiązań chemicznych to - kowalencyjny, joński I metaliczny znajomości. Rozważmy je bardziej szczegółowo.
kowalencyjne wiązanie chemiczne
wiązanie kowalencyjne – to wiązanie chemiczne utworzony przez tworzenie wspólnej pary elektronów A:B . W tym przypadku dwa atomy zachodzić na siebie orbitale atomowe. Wiązanie kowalencyjne powstaje w wyniku interakcji atomów z niewielką różnicą elektroujemności (z reguły między dwoma niemetalami) lub atomy jednego pierwiastka.
Podstawowe własności wiązań kowalencyjnych
- orientacja,
- nasycenie,
- biegunowość,
- polaryzowalność.
Te właściwości wiązań wpływają na chemiczne i fizyczne właściwości substancji.
Kierunek komunikacji charakteryzuje budowę chemiczną i postać substancji. Kąty między dwoma wiązaniami nazywane są kątami wiązań. Na przykład w cząsteczce wody kąt wiązania H-O-H wynosi 104,45 o, więc cząsteczka wody jest polarna, aw cząsteczce metanu kąt wiązania H-C-H wynosi 108 o 28 ′.
Nasycenie to zdolność atomów do tworzenia ograniczonej liczby kowalencyjnych wiązań chemicznych. Liczba wiązań, które może utworzyć atom, nazywa się.
Biegunowość wiązania powstają w wyniku nierównomiernego rozkładu gęstości elektronów między dwoma atomami o różnej elektroujemności. Wiązania kowalencyjne dzielą się na polarne i niepolarne.
Polaryzowalność połączenia są zdolność wiązań elektronowych do przemieszczania się pod wpływem zewnętrznego pola elektrycznego(w szczególności pole elektryczne innej cząstki). Polaryzowalność zależy od ruchliwości elektronów. Im dalej elektron znajduje się od jądra, tym jest bardziej mobilny, a zatem cząsteczka jest bardziej polaryzowalna.
Kowalencyjne niepolarne wiązanie chemiczne
Istnieją 2 rodzaje wiązań kowalencyjnych: POLARNY I NIEPOLARNY .
Przykład . Rozważ strukturę cząsteczki wodoru H 2 . Każdy atom wodoru przenosi 1 niesparowany elektron na swoim zewnętrznym poziomie energetycznym. Aby wyświetlić atom, używamy struktury Lewisa - jest to schemat struktury zewnętrznego poziomu energii atomu, w którym elektrony są oznaczone kropkami. Modele struktury punktowej Lewisa są dobrą pomocą przy pracy z elementami drugiego okresu.
H. + . H=H:H
Zatem cząsteczka wodoru ma jedną wspólną parę elektronów i jedno wiązanie chemiczne H – H. Ta para elektronów nie jest przemieszczana do żadnego z atomów wodoru, ponieważ elektroujemność atomów wodoru jest taka sama. Takie połączenie nazywa się kowalencyjne niepolarne .
Wiązanie kowalencyjne niespolaryzowane (symetryczne). - jest to wiązanie kowalencyjne utworzone przez atomy o równej elektroujemności (z reguły te same niemetale), a zatem o równomiernym rozkładzie gęstości elektronów między jądrami atomów.
Moment dipolowy wiązań niespolaryzowanych wynosi 0.
Przykłady: H2 (H-H), O2 (O=O), S8.
Kowalencyjne polarne wiązanie chemiczne
kowalencyjne wiązanie polarne jest wiązaniem kowalencyjnym występującym pomiędzy atomy o różnej elektroujemności (zazwyczaj, różne niemetale) i charakteryzuje się przemieszczenie wspólną parę elektronów do bardziej elektroujemnego atomu (polaryzacja).
Gęstość elektronów jest przesunięta do atomu bardziej elektroujemnego - dlatego pojawia się na nim częściowy ładunek ujemny (δ-), a na atomie mniej elektroujemnym pojawia się częściowy ładunek dodatni (δ+, delta +).
Im większa różnica elektroujemności atomów, tym wyższa biegunowość połączenia, a nawet więcej moment dipolowy . Pomiędzy sąsiednimi cząsteczkami i ładunkami o przeciwnych znakach działają dodatkowe siły przyciągania, które rosną wytrzymałość znajomości.
Polarność wiązań wpływa na właściwości fizyczne i chemiczne związków. Mechanizmy reakcji, a nawet reaktywność sąsiednich wiązań zależą od polarności wiązania. Biegunowość wiązania często decyduje polarność cząsteczki a tym samym bezpośrednio wpływa na takie właściwości fizyczne jak temperatura wrzenia i topnienia, rozpuszczalność w rozpuszczalnikach polarnych.
Przykłady: HC1, CO2, NH3.
Mechanizmy powstawania wiązania kowalencyjnego
Kowalencyjne wiązanie chemiczne może zachodzić za pomocą 2 mechanizmów:
1. mechanizm wymiany tworzenie kowalencyjnego wiązania chemicznego ma miejsce, gdy każda cząsteczka dostarcza jeden niesparowany elektron do utworzenia wspólnej pary elektronów:
A . + . B=A:B
2. Tworzenie wiązania kowalencyjnego to taki mechanizm, w którym jedna z cząstek zapewnia nieudostępnioną parę elektronów, a druga cząsteczkę zapewnia wolny orbital dla tej pary elektronów:
A: + B=A:B
W tym przypadku jeden z atomów zapewnia nieudostępnioną parę elektronów ( dawca), a drugi atom zapewnia wolny orbital dla tej pary ( akceptor). W wyniku powstania wiązania zarówno energia elektronów maleje, tj. jest to korzystne dla atomów.
Wiązanie kowalencyjne utworzone przez mechanizm donor-akceptor, nie jest inny przez właściwości innych wiązań kowalencyjnych utworzonych przez mechanizm wymiany. Tworzenie wiązania kowalencyjnego przez mechanizm donor-akceptor jest typowe dla atomów albo z dużą liczbą elektronów na zewnętrznym poziomie energetycznym (donory elektronów), albo odwrotnie, z bardzo małą liczbą elektronów (akceptory elektronów). Możliwości walencyjne atomów są omówione bardziej szczegółowo w odpowiednich.
Wiązanie kowalencyjne jest tworzone przez mechanizm donor-akceptor:
- w cząsteczce tlenek węglaCO(wiązanie w cząsteczce jest potrójne, 2 wiązania są tworzone przez mechanizm wymiany, jedno przez mechanizm donor-akceptor): C≡O;
- V jon amonowy NH4+, w jonach aminy organiczne na przykład w jonie metyloamoniowym CH3-NH2+;
- V złożone związki, wiązanie chemiczne między atomem centralnym a grupami ligandów, na przykład w tetrahydroksoglinianie sodu Na wiązanie między glinem a jonami wodorotlenkowymi;
- V kwas azotowy i jego sole- azotany: HNO 3 , NaNO 3 , w niektórych innych związkach azotu;
- w cząsteczce ozon O 3 .
Główne cechy wiązania kowalencyjnego
Wiązanie kowalencyjne z reguły powstaje między atomami niemetali. Główne cechy wiązania kowalencyjnego to długość, energia, krotność i kierunkowość.
Krotność wiązań chemicznych
Krotność wiązań chemicznych - Ten liczba wspólnych par elektronów między dwoma atomami w związku. Wielość wiązań można dość łatwo określić na podstawie wartości atomów tworzących cząsteczkę.
Na przykład , w cząsteczce wodoru H 2 krotność wiązań wynosi 1, ponieważ każdy wodór ma tylko 1 niesparowany elektron na zewnętrznym poziomie energetycznym, dlatego powstaje jedna wspólna para elektronów.
W cząsteczce tlenu O 2 krotność wiązań wynosi 2, ponieważ każdy atom ma 2 niesparowane elektrony na swoim zewnętrznym poziomie energetycznym: O=O.
W cząsteczce azotu N 2 krotność wiązań wynosi 3, ponieważ pomiędzy każdym atomem znajdują się 3 niesparowane elektrony na zewnętrznym poziomie energetycznym, a atomy tworzą 3 wspólne pary elektronowe N≡N.
Długość wiązania kowalencyjnego
Długość wiązania chemicznego
to odległość między środkami jąder atomów tworzących wiązanie. Określa się go eksperymentalnymi metodami fizycznymi. Długość wiązania można oszacować w przybliżeniu zgodnie z zasadą addytywności, zgodnie z którą długość wiązania w cząsteczce AB jest w przybliżeniu równa połowie sumy długości wiązań w cząsteczkach A 2 i B 2: 
Długość wiązania chemicznego można z grubsza oszacować wzdłuż promieni atomów, tworząc wiązanie lub dzięki wielości komunikacji jeśli promienie atomów nie są bardzo różne.
Wraz ze wzrostem promienia atomów tworzących wiązanie, długość wiązania będzie rosła.
Na przykład
Wraz ze wzrostem liczby wiązań między atomami (których promienie atomowe nie różnią się lub nieznacznie różnią), długość wiązań będzie się zmniejszać.
Na przykład . W szeregu: C–C, C=C, C≡C długość wiązania maleje.
Energia więzi
Miarą siły wiązania chemicznego jest energia wiązania. Energia więzi jest określona przez energię potrzebną do rozerwania wiązania i usunięcia atomów tworzących to wiązanie na nieskończoną odległość od siebie.
Wiązanie kowalencyjne jest bardzo trwałe. Jego energia waha się od kilkudziesięciu do kilkuset kJ/mol. Im większa energia wiązania, tym większa siła wiązania i odwrotnie.
Siła wiązania chemicznego zależy od długości wiązania, polaryzacji wiązania i krotności wiązań. Im dłuższe wiązanie chemiczne, tym łatwiej je rozerwać, a im niższa energia wiązania, tym mniejsza jego siła. Im krótsze wiązanie chemiczne, tym silniejsze i tym większa energia wiązania.
Na przykład, w szeregu związków HF, HCl, HBr od lewej do prawej siła wiązania chemicznego maleje, ponieważ długość wiązania wzrasta.
Jonowe wiązanie chemiczne
Wiązanie jonowe jest wiązaniem chemicznym opartym na elektrostatyczne przyciąganie jonów.
jony powstają w procesie przyjmowania lub oddawania elektronów przez atomy. Na przykład atomy wszystkich metali słabo utrzymują elektrony zewnętrznego poziomu energii. Dlatego atomy metali są scharakteryzowane właściwości regenerujące zdolność do oddawania elektronów.
Przykład. Atom sodu zawiera 1 elektron na trzecim poziomie energetycznym. Łatwo go oddając, atom sodu tworzy znacznie bardziej stabilny jon Na +, z konfiguracją elektronową szlachetnego gazu neonowego Ne. Jon sodu zawiera 11 protonów i tylko 10 elektronów, więc całkowity ładunek jonu wynosi -10+11 = +1:
+11Na) 2 ) 8 ) 1 - 1e = +11 Na +) 2 ) 8
Przykład. Atom chloru ma 7 elektronów na swoim zewnętrznym poziomie energetycznym. Aby uzyskać konfigurację stabilnego obojętnego atomu argonu Ar, chlor musi przyłączyć 1 elektron. Po przyłączeniu elektronu powstaje stabilny jon chloru, składający się z elektronów. Całkowity ładunek jonu wynosi -1:
+17Kl) 2 ) 8 ) 7 + 1e = +17 Kl — ) 2 ) 8 ) 8
Notatka:
- Właściwości jonów różnią się od właściwości atomów!
- Stabilne jony mogą tworzyć się nie tylko atomy, ale również grupy atomów. Na przykład: jon amonowy NH 4 +, jon siarczanowy SO 4 2- itp. Wiązania chemiczne utworzone przez takie jony są również uważane za jonowe;
- Wiązania jonowe są zwykle tworzone pomiędzy metale I niemetale(grupy niemetali);
Powstałe jony są przyciągane z powodu przyciągania elektrycznego: Na + Cl -, Na 2 + SO 4 2-.
Uogólnijmy wizualnie różnice między typami wiązań kowalencyjnych i jonowych:
wiązanie chemiczne metali
połączenie metalowe jest relacją utworzoną względnie wolne elektrony między jony metali tworząc sieć krystaliczną.
Atomy metali na zewnętrznym poziomie energetycznym zwykle mają od jednego do trzech elektronów. Promienie atomów metali są z reguły duże - dlatego atomy metali, w przeciwieństwie do niemetali, dość łatwo oddają zewnętrzne elektrony, tj. są silnymi środkami redukującymi
Oddziaływania międzycząsteczkowe
Osobno warto rozważyć interakcje zachodzące między poszczególnymi cząsteczkami w substancji - oddziaływania międzycząsteczkowe . Oddziaływania międzycząsteczkowe są rodzajem oddziaływań między neutralnymi atomami, w których nie powstają nowe wiązania kowalencyjne. Siły oddziaływania między cząsteczkami zostały odkryte przez van der Waalsa w 1869 roku i nazwane jego imieniem. Siły Van dar Waalsa. Siły Van der Waalsa dzielą się na orientacja, wprowadzenie I dyspersja . Energia oddziaływań międzycząsteczkowych jest znacznie mniejsza niż energia wiązania chemicznego.
Orientacyjne siły przyciągania powstają między cząsteczkami polarnymi (oddziaływanie dipol-dipol). Siły te powstają między cząsteczkami polarnymi. Oddziaływania indukcyjne jest oddziaływaniem między cząsteczką polarną i niepolarną. Cząsteczka niepolarna jest spolaryzowana w wyniku działania cząsteczki polarnej, która generuje dodatkowe przyciąganie elektrostatyczne.
Szczególnym rodzajem oddziaływań międzycząsteczkowych są wiązania wodorowe. - są to międzycząsteczkowe (lub wewnątrzcząsteczkowe) wiązania chemiczne, które powstają między cząsteczkami, w których występują silnie spolaryzowane wiązania kowalencyjne - H-F, H-O lub H-N. Jeśli w cząsteczce są takie wiązania, to między cząsteczkami będą dodatkowe siły przyciągania .
Mechanizm Edukacji Wiązanie wodorowe jest częściowo elektrostatyczne, a częściowo donorowo-akceptorowe. W tym przypadku atom pierwiastka silnie elektroujemnego (F, O, N) pełni rolę donora pary elektronów, a przyłączone do tych atomów atomy wodoru pełnią rolę akceptora. Scharakteryzowano wiązania wodorowe orientacja w kosmosie i nasycenie .
Wiązanie wodorowe można oznaczyć kropkami: H ··· O. Im większa elektroujemność atomu połączonego z wodorem i im mniejszy jego rozmiar, tym silniejsze wiązanie wodorowe. Jest to przede wszystkim charakterystyczne dla związków fluor z wodorem , jak również do tlen z wodorem , mniej azot z wodorem .
Wiązania wodorowe występują między następującymi substancjami:
— fluorowodór HF(gaz, roztwór fluorowodoru w wodzie - kwas fluorowodorowy), woda H 2 O (para wodna, lód, woda w stanie ciekłym):
— roztwór amoniaku i amin organicznych- między cząsteczkami amoniaku i wody;
— związki organiczne, w których występują wiązania O-H lub N-H: alkohole, kwasy karboksylowe, aminy, aminokwasy, fenole, anilina i jej pochodne, białka, roztwory węglowodanów - monosacharydów i disacharydów.
Wiązanie wodorowe wpływa na właściwości fizyczne i chemiczne substancji. Zatem dodatkowe przyciąganie między cząsteczkami utrudnia wrzenie substancji. Substancje z wiązaniami wodorowymi wykazują nienormalny wzrost temperatury wrzenia.
Na przykład Z reguły wraz ze wzrostem masy cząsteczkowej obserwuje się wzrost temperatury wrzenia substancji. Jednak w wielu substancjach H 2 O-H 2 S-H 2 Se-H 2 Te nie obserwujemy liniowej zmiany temperatur wrzenia.
Mianowicie o godz temperatura wrzenia wody jest nienormalnie wysoka - nie mniej niż -61 o C, jak pokazuje nam prosta, ale znacznie więcej, +100 o C. Ta anomalia jest tłumaczona obecnością wiązań wodorowych między cząsteczkami wody. Dlatego w normalnych warunkach (0-20 o C) woda jest płyn według stanu fazy.
Wolny fluor składa się z cząsteczek dwuatomowych. Z chemicznego punktu widzenia fluor można scharakteryzować jako jednowartościowy niemetal, a ponadto najbardziej aktywny ze wszystkich niemetali. Wynika to z kilku powodów, między innymi z łatwości rozkładu cząsteczki F 2 na pojedyncze atomy – energia potrzebna do tego to tylko 159 kJ/mol (wobec 493 kJ/mol dla O 2 i 242 kJ/mol dla C 12). Atomy fluoru mają znaczne powinowactwo elektronowe i są stosunkowo małe. Dlatego ich wiązania walencyjne z atomami innych pierwiastków okazują się silniejsze niż podobne wiązania innych metaloidów (np. wiązanie H-C1).
Wiązanie F-F charakteryzuje się odległością jądrową 1,42 A. W przypadku termicznej dysocjacji fluoru uzyskano następujące dane obliczeniowe:
Atom fluoru w stanie podstawowym ma strukturę zewnętrznej warstwy elektronowej 2s 2 2p 5 i jest jednowartościowy. Wzbudzenie stanu trójwartościowego związane z przeniesieniem jednego elektronu 2p na poziom 3s wymaga wydatku 1225 kJ/mol i praktycznie nie jest realizowane.
Powinowactwo elektronowe obojętnego atomu fluoru szacuje się na 339 kJ/mol. Jon F - charakteryzuje się efektywnym promieniem 1,33 A i energią hydratacji 485 kJ/mol. Dla promienia kowalencyjnego fluoru zwykle przyjmuje się wartość 71 pm (tj. połowę odległości międzyjądrowej w cząsteczce F2).
Wiązanie chemiczne to zjawisko elektronowe, w którym co najmniej jeden elektron, który znajdował się w polu siłowym swojego jądra, znajduje się jednocześnie w polu siłowym innego jądra lub kilku jąder.
Większość substancji prostych i wszystkie substancje złożone (związki) składają się z atomów oddziałujących ze sobą w określony sposób. Innymi słowy, między atomami powstaje wiązanie chemiczne. Kiedy tworzy się wiązanie chemiczne, energia jest zawsze uwalniana, tj. Energia utworzonej cząstki musi być mniejsza niż całkowita energia początkowych cząstek.
Najprostszym modelem wiązania jonowego jest przejście elektronu z jednego atomu do drugiego, w wyniku którego powstają przeciwnie naładowane jony o stabilnych konfiguracjach elektronowych, pomiędzy którymi powstaje przyciąganie elektrostatyczne:
X → X + + mi - ; Y + mi - → Y - ; X+Y-
Hipotezę powstawania jonów i występowania między nimi przyciągania elektrostatycznego po raz pierwszy wysunął niemiecki naukowiec W. Kossel (1916).
Innym modelem wiązania jest współdzielenie elektronów przez dwa atomy, w wyniku czego powstają również stabilne konfiguracje elektronowe. Takie wiązanie nazywa się kowalencyjnym, w 1916 roku amerykański naukowiec G. Lewis zaczął rozwijać swoją teorię.
Wspólnym punktem obu teorii było powstawanie cząstek o stabilnej konfiguracji elektronowej pokrywającej się z konfiguracją elektronową gazu szlachetnego.
Na przykład przy tworzeniu fluorku litu realizowany jest jonowy mechanizm tworzenia wiązań. Atom litu (3 Li 1s 2 2s 1) traci elektron i zamienia się w kation (3 Li + 1s 2) o elektronowej konfiguracji helu. Fluor (9 F 1s 2 2s 2 2p 5) przyjmuje elektron, tworząc anion (9 F - 1s 2 2s 2 2p 6) o elektronowej konfiguracji neonu. Między jonem litu Li+ a jonem fluoru F- powstaje przyciąganie elektrostatyczne, dzięki któremu powstaje nowy związek - fluorek litu.
Gdy powstaje fluorowodór, jedyny elektron atomu wodoru (1s) i niesparowany elektron atomu fluoru (2p) znajdują się w polu działania obu jąder - atomu wodoru i atomu fluoru. W ten sposób powstaje wspólna para elektronów, co oznacza redystrybucję gęstości elektronowej i pojawienie się maksymalnej gęstości elektronowej. W rezultacie dwa elektrony są teraz związane z jądrem atomu wodoru (konfiguracja elektronowa atomu helu), a osiem elektronów zewnętrznego poziomu energetycznego jest związanych z jądrem fluoru (konfiguracja elektronowa atomu neonu):
Wskazuje na to pojedyncza kreska między symbolami elementów: H-F.Wiązanie utworzone przez jedną parę elektronów nazywa się wiązaniem pojedynczym.
Szczególnym przypadkiem jest tworzenie powłok dwuelektronowych dla jonu litu i atomu wodoru.Tendencja do tworzenia stabilnej powłoki ośmioelektronowej poprzez przeniesienie elektronu z jednego atomu do drugiego (wiązanie jonowe) lub przez współdzielenie elektronów (wiązanie kowalencyjne) nazywana jest regułą oktetu.
Istnieją jednak związki, które nie przestrzegają tej zasady. Na przykład atom berylu we fluorku berylu BeF 2 ma tylko powłokę czteroelektronową; atom boru charakteryzuje się sześcioma powłokami elektronowymi (kropki oznaczają elektrony zewnętrznego poziomu energetycznego):
Jednocześnie w związkach takich jak chlorek fosforu (V) i fluorek siarki (VI), fluorek jodu (VII), powłoki elektronowe atomów centralnych zawierają więcej niż osiem elektronów (fosfor - 10; siarka - 12; jod - 14):

W większości koniunkcji elementu d reguła oktetu również nie jest przestrzegana.
We wszystkich powyższych przykładach wiązanie chemiczne powstaje między atomami różnych pierwiastków; nazywa się heteroatomowym. Jednak wiązanie kowalencyjne może również tworzyć się między identycznymi atomami. Na przykład cząsteczka wodoru powstaje poprzez współdzielenie 15 elektronów każdego atomu wodoru, w wyniku czego każdy atom uzyskuje stabilną konfigurację elektronową dwóch elektronów. Oktet powstaje podczas tworzenia cząsteczek innych prostych substancji, takich jak fluor:

Tworzenie wiązania chemicznego można również przeprowadzić przez uspołecznienie czterech lub sześciu elektronów. W pierwszym przypadku powstaje wiązanie podwójne, czyli dwie uogólnione pary elektronów, w drugim - wiązanie potrójne (trzy uogólnione pary elektronów).
Na przykład, gdy tworzy się cząsteczka azotu N2, wiązanie chemiczne jest tworzone przez socjalizację sześciu elektronów: trzech niesparowanych elektronów p z każdego atomu. Aby uzyskać konfigurację ośmioelektronową, powstają trzy wspólne pary elektronów:
Podwójne wiązanie jest oznaczone dwoma kreskami, potrójne wiązanie przez trzy. Cząsteczkę azotu N 2 można przedstawić w następujący sposób: N≡N.
W cząsteczkach dwuatomowych utworzonych z atomów jednego pierwiastka maksymalna gęstość elektronowa znajduje się w środku linii międzyjądrowej. Ponieważ nie ma rozdzielenia ładunków między atomami, ten rodzaj wiązania kowalencyjnego nazywa się niepolarnym. Wiązanie heteroatomowe jest zawsze mniej lub bardziej polarne, ponieważ maksymalna gęstość elektronów jest przesunięta w kierunku jednego z atomów, dzięki czemu uzyskuje częściowy ładunek ujemny (oznaczony jako σ-). Atom, od którego przesunięta jest maksymalna gęstość elektronów, uzyskuje częściowy ładunek dodatni (oznaczony jako σ+). Cząstki obojętne elektrycznie, w których środki cząstkowych ładunków ujemnych i cząstkowych dodatnich nie pokrywają się w przestrzeni, nazywane są dipolami. Biegunowość wiązania mierzy się momentem dipolowym (μ), który jest wprost proporcjonalny do wielkości ładunków i odległości między nimi.

Ryż. Schematyczne przedstawienie dipola
Spis wykorzystanej literatury
- Popkow V. A., Puzakov S. A. Chemia ogólna: podręcznik. - M .: GEOTAR-Media, 2010. - 976 s.: ISBN 978-5-9704-1570-2. [Z. 32-35]
W 1916 r. zaproponowano pierwsze skrajnie uproszczone teorie budowy cząsteczek, w których zastosowano reprezentacje elektroniczne: teorię amerykańskiego fizykochemika G. Lewisa (1875-1946) i niemieckiego naukowca W. Kossela. Zgodnie z teorią Lewisa tworzenie wiązania chemicznego w cząsteczce dwuatomowej obejmuje elektrony walencyjne dwóch atomów jednocześnie. Dlatego na przykład w cząsteczce wodoru zamiast liczby pierwszej walencyjnej zaczęli rysować parę elektronów, która tworzy wiązanie chemiczne:
Wiązanie chemiczne utworzone przez parę elektronów nazywa się wiązaniem kowalencyjnym. Cząsteczka fluorowodoru jest przedstawiona w następujący sposób:
Różnica między cząsteczkami substancji prostych (H2, F2, N2, O2) a cząsteczkami substancji złożonych (HF, NO, H2O, NH3) polega na tym, że te pierwsze nie mają momentu dipolowego, a te drugie mają. Moment dipolowy m definiuje się jako iloczyn wartości bezwzględnej ładunku q i odległości między dwoma przeciwstawnymi ładunkami r:
Moment dipolowy m cząsteczki dwuatomowej można wyznaczyć na dwa sposoby. Po pierwsze, ponieważ cząsteczka jest elektrycznie obojętna, znany jest całkowity ładunek dodatni cząsteczki Z" (jest on równy sumie ładunków jąder atomowych: Z" = ZA + ZB). Znając odległość międzyjądrową re, można określić położenie środka ciężkości dodatniego ładunku cząsteczki. Wartość m cząsteczek znajduje się w eksperymencie. Dlatego możesz znaleźć r" - odległość między środkami ciężkości dodatniego i całkowitego ujemnego ładunku cząsteczki:
Po drugie, możemy założyć, że gdy para elektronów tworząca wiązanie chemiczne zostanie przesunięta do jednego z atomów, na tym atomie pojawi się nadmiar ładunku ujemnego -q, a na drugim pojawi się ładunek +q. Odległość między atomami wynosi re:
Moment dipolowy cząsteczki HF wynosi 6,4×10-30 Cl×m, odległość międzyjądrowa H-F wynosi 0,917×10-10 m. Obliczenie q" daje: q" = 0,4 ładunku elementarnego (tj. ładunku elektronu). Ponieważ na atomie fluoru pojawił się nadmiar ładunku ujemnego, oznacza to, że para elektronów tworząca wiązanie chemiczne w cząsteczce HF jest przesunięta do atomu fluoru. Takie wiązanie chemiczne nazywa się kowalencyjnym wiązaniem polarnym. Cząsteczki typu A2 nie mają momentu dipolowego. Wiązania chemiczne tworzące te cząsteczki to tzw kowalencyjne wiązania niespolaryzowane.
Teoria Kossela zaproponowano opisanie cząsteczek tworzonych przez aktywne metale (alkalia i ziemie alkaliczne) oraz aktywne niemetale (halogeny, tlen, azot). Zewnętrzne elektrony walencyjne atomów metali są najbardziej oddalone od jądra atomowego i dlatego są stosunkowo słabo zatrzymywane przez atom metalu. Dla atomów pierwiastków chemicznych znajdujących się w tym samym rzędzie układu okresowego, przy ruchu od lewej do prawej ładunek jądra cały czas wzrasta, a dodatkowe elektrony znajdują się w tej samej warstwie elektronowej. Prowadzi to do tego, że zewnętrzna powłoka elektronowa kurczy się, a elektrony są coraz mocniej trzymane w atomie. Dlatego w cząsteczce MeX możliwe staje się przeniesienie słabo zatrzymanego zewnętrznego elektronu walencyjnego metalu z wydatkiem energii równym potencjałowi jonizacji do powłoki elektronowej walencyjnej atomu niemetalu z uwolnieniem energii równej powinowactwu elektronowemu . W efekcie powstają dwa jony: Me+ i X-. Oddziaływanie elektrostatyczne tych jonów jest wiązaniem chemicznym. Ten typ połączenia nazywa się joński.
Jeśli wyznaczymy momenty dipolowe cząsteczek MeX parami, okaże się, że ładunek z atomu metalu nie przenosi się całkowicie na atom niemetalu, a wiązanie chemiczne w takich cząsteczkach lepiej opisać jako wiązanie kowalencyjne silnie polarne. Dodatnie kationy metali Me + i ujemne aniony atomów niemetali X- występują zwykle w miejscach sieci krystalicznej kryształów tych substancji. Ale w tym przypadku każdy dodatni jon metalu najpierw oddziałuje elektrostatycznie z najbliższymi anionami niemetali, następnie z kationami metali i tak dalej. Oznacza to, że w kryształach jonowych wiązania chemiczne ulegają delokalizacji, a każdy jon ostatecznie oddziałuje ze wszystkimi innymi jonami wchodzącymi do kryształu, który jest gigantyczną cząsteczką.
Oprócz dobrze zdefiniowanych właściwości atomów, takich jak ładunki jąder atomowych, potencjały jonizacji, powinowactwo elektronowe, w chemii stosuje się również mniej zdefiniowane właściwości. Jednym z nich jest elektroujemność. Został wprowadzony do nauki przez amerykańskiego chemika L. Paulinga. Rozważmy najpierw dla pierwiastków z pierwszych trzech okresów dane dotyczące pierwszego potencjału jonizacji i powinowactwa elektronowego.
Prawidłowości potencjałów jonizacji i powinowactwa elektronowego są w pełni wyjaśnione strukturą walencyjnych powłok elektronowych atomów. Powinowactwo elektronowe izolowanego atomu azotu jest znacznie mniejsze niż powinowactwo atomów metali alkalicznych, chociaż azot jest aktywnym niemetalem. To właśnie w cząsteczkach podczas interakcji z atomami innych pierwiastków chemicznych azot udowadnia, że jest aktywnym niemetalem. To właśnie próbował zrobić L. Pauling, wprowadzając „elektroujemność” jako zdolność atomów pierwiastków chemicznych do przemieszczania względem siebie pary elektronów podczas formowania kowalencyjne wiązania polarne. Skalę elektroujemności pierwiastków chemicznych zaproponował L. Pauling. Najwyższą elektroujemność w dowolnych jednostkach bezwymiarowych przypisał fluorowi - 4,0, tlenowi - 3,5, chlorowi i azotowi - 3,0, bromowi - 2,8. Charakter zmiany elektroujemności atomów w pełni odpowiada prawom wyrażonym w układzie okresowym. Dlatego użycie pojęcia elektroujemność„po prostu tłumaczy na inny język te wzorce zmian właściwości metali i niemetali, które są już odzwierciedlone w układzie okresowym.
Wiele metali w stanie stałym to prawie idealnie uformowane kryształy.. W węzłach sieci krystalicznej w krysztale znajdują się atomy lub dodatnie jony metali. Elektrony tych atomów metali, z których powstały jony dodatnie, występują w postaci gazu elektronowego w przestrzeni między węzłami sieci krystalicznej i należą do wszystkich atomów i jonów. Decydują o charakterystycznym metalicznym połysku, wysokiej przewodności elektrycznej i cieplnej metali. Typ wiązanie chemiczne, które jest przeprowadzane przez uspołecznione elektrony w krysztale metalu, nazywa sięwiązanie metaliczne.
W 1819 roku francuscy naukowcy P. Dulong i A. Petit eksperymentalnie ustalili, że molowa pojemność cieplna prawie wszystkich metali w stanie krystalicznym wynosi 25 J/mol. Teraz możemy łatwo wyjaśnić, dlaczego tak jest. Atomy metali w węzłach sieci krystalicznej są zawsze w ruchu - wykonują ruchy oscylacyjne. Ten złożony ruch można rozłożyć na trzy proste ruchy oscylacyjne w trzech wzajemnie prostopadłych płaszczyznach. Każdy ruch oscylacyjny ma swoją własną energię i własne prawo jej zmiany wraz ze wzrostem temperatury - własną pojemność cieplną. Graniczna wartość pojemności cieplnej dla dowolnego ruchu oscylacyjnego atomów jest równa R - Uniwersalnej Stałej Gazowej. Trzy niezależne ruchy wibracyjne atomów w krysztale będą odpowiadać pojemności cieplnej równej 3R. Kiedy metale są ogrzewane, począwszy od bardzo niskich temperatur, ich pojemność cieplna wzrasta od zera. W temperaturze pokojowej i wyższej pojemność cieplna większości metali osiąga swoją maksymalną wartość - 3R.
Po podgrzaniu sieć krystaliczna metali ulega zniszczeniu i przechodzą one w stan stopiony. Przy dalszym ogrzewaniu metale odparowują. W oparach wiele metali występuje w postaci cząsteczek Me2. W tych cząsteczkach atomy metali są w stanie tworzyć kowalencyjne wiązania niepolarne.
Fluor jest pierwiastkiem chemicznym (symbol F, liczba atomowa 9), niemetalem należącym do grupy halogenów. Jest najbardziej aktywną i elektroujemną substancją. W normalnej temperaturze i ciśnieniu cząsteczka fluoru jest bladożółta i ma wzór F 2 . Podobnie jak inne halogenki, fluor cząsteczkowy jest bardzo niebezpieczny i powoduje poważne oparzenia chemiczne w kontakcie ze skórą.
Stosowanie
Fluor i jego związki są szeroko stosowane m.in. do produkcji farmaceutyków, agrochemikaliów, paliw i smarów oraz tekstyliów. jest używany do trawienia szkła, podczas gdy plazma fluorowa jest używana do produkcji półprzewodników i innych materiałów. Niskie stężenia jonów F w paście do zębów i wodzie pitnej mogą pomóc w zapobieganiu próchnicy zębów, podczas gdy wyższe stężenia występują w niektórych insektycydach. Wiele środków do znieczulenia ogólnego to pochodne wodorofluorowęglowodoru. Izotop 18 F jest źródłem pozytonów do obrazowania medycznego za pomocą pozytonowej tomografii emisyjnej, a sześciofluorek uranu jest używany do separacji i produkcji izotopów uranu w elektrowniach jądrowych.
Historia odkrycia
Minerały zawierające związki fluoru były znane na wiele lat przed wyizolowaniem tego pierwiastka chemicznego. Na przykład mineralny fluoryt (lub fluoryt), składający się z fluorku wapnia, został opisany w 1530 roku przez George'a Agricolę. Zauważył, że może być używany jako topnik, substancja, która pomaga obniżyć temperaturę topnienia metalu lub rudy i pomaga oczyścić pożądany metal. Dlatego fluor ma swoją łacińską nazwę od słowa fluere („przepływ”).
W 1670 roku dmuchacz szkła Heinrich Schwanhard odkrył, że szkło zostało wytrawione przez działanie fluorku wapnia (fluorsparu) potraktowanego kwasem. Carl Scheele i wielu późniejszych badaczy, w tym Humphry Davy, Joseph-Louis Gay-Lussac, Antoine Lavoisier, Louis Thénard, eksperymentowali z kwasem fluorowodorowym (HF), który można było łatwo uzyskać przez potraktowanie CaF stężonym kwasem siarkowym.
Ostatecznie stało się jasne, że HF zawiera nieznany wcześniej pierwiastek. Jednak ze względu na nadmierną reaktywność substancji tej nie udało się wyizolować przez wiele lat. Jest nie tylko trudny do oddzielenia od związków, ale natychmiast reaguje z innymi ich składnikami. Izolacja pierwiastkowego fluoru z kwasu fluorowodorowego jest niezwykle niebezpieczna, a wczesne próby oślepiły i zabiły kilku naukowców. Ci ludzie stali się znani jako „męczennicy fluoru”.

Odkrycie i produkcja
Wreszcie w 1886 roku francuski chemik Henri Moissan zdołał wyizolować fluor przez elektrolizę mieszaniny stopionych fluorków potasu i kwasu fluorowodorowego. Za to otrzymał w 1906 roku Nagrodę Nobla w dziedzinie chemii. Jego podejście elektrolityczne jest nadal stosowane do przemysłowej produkcji tego pierwiastka chemicznego.
Pierwsza produkcja fluoru na dużą skalę rozpoczęła się podczas II wojny światowej. Był wymagany na jednym z etapów tworzenia bomby atomowej w ramach Projektu Manhattan. Fluor był używany do produkcji sześciofluorku uranu (UF 6 ), który z kolei służył do oddzielania od siebie dwóch izotopów 235 U i 238 U. Obecnie gazowy UF 6 jest potrzebny do produkcji wzbogaconego uranu dla energetyki jądrowej.

Najważniejsze właściwości fluoru
W układzie okresowym pierwiastek znajduje się na szczycie grupy 17 (dawniej grupy 7A), która nazywa się halogenem. Inne halogeny obejmują chlor, brom, jod i astat. Ponadto F znajduje się w drugim okresie między tlenem a neonem.
Czysty fluor jest gazem korozyjnym (wzór chemiczny F 2 ) o charakterystycznym ostrym zapachu, który występuje w stężeniu 20 nl na litr objętości. Jako najbardziej reaktywny i elektroujemny ze wszystkich pierwiastków łatwo tworzy związki z większością z nich. Fluor jest zbyt reaktywny, aby istnieć w postaci elementarnej i ma takie powinowactwo do większości materiałów, w tym krzemu, że nie można go przygotować ani przechowywać w szklanych pojemnikach. W wilgotnym powietrzu reaguje z wodą, tworząc nie mniej niebezpieczny kwas fluorowodorowy.
Fluor, oddziałując z wodorem, eksploduje nawet w niskich temperaturach iw ciemności. Reaguje gwałtownie z wodą, tworząc kwas fluorowodorowy i gazowy tlen. Różne materiały, w tym drobno rozproszone metale i szkło, palą się jasnym płomieniem w strumieniu gazowego fluoru. Ponadto ten pierwiastek chemiczny tworzy związki z gazami szlachetnymi kryptonem, ksenonem i radonem. Nie reaguje jednak bezpośrednio z azotem i tlenem.
Pomimo ekstremalnej aktywności fluoru, obecnie dostępne są metody jego bezpiecznego obchodzenia się i transportu. Pierwiastek można przechowywać w pojemnikach ze stali lub monelu (stop niklu), ponieważ na powierzchni tych materiałów tworzą się fluorki, które uniemożliwiają dalszą reakcję.
Fluorki to substancje, w których fluor występuje w postaci ujemnie naładowanego jonu (F-) w połączeniu z niektórymi pierwiastkami naładowanymi dodatnio. Związki fluoru z metalami należą do najbardziej stabilnych soli. Po rozpuszczeniu w wodzie dzielą się na jony. Innymi formami fluoru są kompleksy takie jak - i H 2 F + .

izotopy
Istnieje wiele izotopów tego halogenu, od 14 F do 31 F. Ale skład izotopowy fluoru obejmuje tylko jeden z nich, 19 F, który zawiera 10 neutronów, ponieważ jako jedyny jest stabilny. Izotop promieniotwórczy 18 F jest cennym źródłem pozytonów.
Wpływ biologiczny
Fluor w organizmie występuje głównie w kościach i zębach w postaci jonów. Fluoryzacja wody pitnej w stężeniu poniżej jednej części na milion znacznie zmniejsza częstość występowania próchnicy - wynika z danych National Research Council of the National Academy of Sciences of the United States. Z drugiej strony nadmierne gromadzenie się fluoru może prowadzić do fluorozy, która objawia się cętkami na zębach. Efekt ten obserwuje się zwykle na terenach, gdzie zawartość tego pierwiastka w wodzie pitnej przekracza stężenie 10 ppm.
Fluor pierwiastkowy i sole fluoru są toksyczne i należy się z nimi obchodzić bardzo ostrożnie. Należy starannie unikać kontaktu ze skórą lub oczami. Reakcja ze skórą powoduje, że szybko wnika w tkanki i wchodzi w reakcję z wapniem w kościach, trwale je uszkadzając.

Fluor w środowisku
Roczna światowa produkcja minerału fluorytu wynosi około 4 mln t, a łączna pojemność eksplorowanych złóż mieści się w granicach 120 mln t. Głównymi obszarami wydobycia tego minerału są Meksyk, Chiny i Europa Zachodnia.
Fluor występuje naturalnie w skorupie ziemskiej, gdzie można go znaleźć w skałach, węglu i glinie. Fluorki są uwalniane do powietrza w wyniku erozji wietrznej gleb. Fluor jest 13. najbardziej rozpowszechnionym pierwiastkiem chemicznym w skorupie ziemskiej - jego zawartość wynosi 950 ppm. W glebach jego średnie stężenie wynosi około 330 ppm. Fluorowodór może być uwalniany do powietrza w wyniku przemysłowych procesów spalania. Fluorki znajdujące się w powietrzu spadają na ziemię lub do wody. Kiedy fluor tworzy wiązanie z bardzo małymi cząsteczkami, może pozostawać w powietrzu przez długi czas.
W atmosferze 0,6 miliardowej części tego pierwiastka chemicznego występuje w postaci mgły solnej i organicznych związków chloru. Na terenach miejskich stężenie sięga 50 części na miliard.

Znajomości
Fluor jest pierwiastkiem chemicznym, który tworzy szeroką gamę związków organicznych i nieorganicznych. Chemicy mogą zastąpić nim atomy wodoru, tworząc w ten sposób wiele nowych substancji. Wysoce reaktywny chlorowiec tworzy związki z gazami szlachetnymi. W 1962 roku Neil Bartlett zsyntetyzował heksafluoroplatynian ksenonu (XePtF6). Uzyskano również fluorki kryptonu i radonu. Innym związkiem jest fluorowodorek argonu, który jest stabilny tylko w ekstremalnie niskich temperaturach.
Aplikacja na skalę przemysłową
W stanie atomowym i molekularnym fluor jest używany do trawienia plazmowego w produkcji półprzewodników, płaskich wyświetlaczy i układów mikroelektromechanicznych. Kwas fluorowodorowy służy do wytrawiania szkła w lampach i innych produktach.
Wraz z niektórymi jego związkami fluor jest ważnym składnikiem w produkcji farmaceutyków, agrochemikaliów, paliw i smarów oraz tekstyliów. Pierwiastek chemiczny jest potrzebny do produkcji fluorowcowanych alkanów (halonów), które z kolei znalazły szerokie zastosowanie w systemach klimatyzacyjnych i chłodniczych. Później takie użycie chlorofluorowęglowodorów zostało zakazane, ponieważ przyczyniają się one do niszczenia warstwy ozonowej w górnych warstwach atmosfery.

Sześciofluorek siarki jest wyjątkowo obojętnym, nietoksycznym gazem zaliczanym do gazów cieplarnianych. Bez fluoru produkcja tworzyw sztucznych o niskim współczynniku tarcia, takich jak teflon, nie jest możliwa. Wiele środków znieczulających (np. sewofluran, desfluran i izofluran) to pochodne CFC. Heksafluoroglinian sodu (kriolit) jest stosowany w elektrolizie aluminium.
Związki fluoru, w tym NaF, są stosowane w pastach do zębów w celu zapobiegania próchnicy. Substancje te są dodawane do miejskich wodociągów w celu fluoryzacji wody, jednak praktyka ta jest uważana za kontrowersyjną ze względu na wpływ na zdrowie ludzi. W wyższych stężeniach NaF jest stosowany jako środek owadobójczy, zwłaszcza do zwalczania karaluchów.
W przeszłości fluorki stosowano do redukcji rud i zwiększania ich płynności. Fluor jest ważnym składnikiem w produkcji sześciofluorku uranu, który służy do rozdzielania jego izotopów. 18 F, radioaktywny izotop o czasie trwania 110 minut, emituje pozytony i jest często używany w medycznej pozytronowej tomografii emisyjnej.
Właściwości fizyczne fluoru
Podstawowe cechy pierwiastka chemicznego to:
- Masa atomowa 18,9984032 g/mol.
- Konfiguracja elektroniczna 1s 2 2s 2 2p 5 .
- Stopień utlenienia wynosi -1.
- Gęstość 1,7 g/l.
- Temperatura topnienia 53,53 K.
- Temperatura wrzenia 85,03 K.
- Pojemność cieplna 31,34 J/(K mol).
Nazywa się cząstki chemiczne utworzone z dwóch lub więcej atomów Cząsteczki(rzeczywiste lub warunkowe jednostki formuły substancje wieloatomowe). Atomy w cząsteczkach są połączone chemicznie.
Wiązanie chemiczne to elektryczna siła przyciągania, która utrzymuje cząsteczki razem. Każde wiązanie chemiczne w wzory strukturalne wydaje się linia walencyjna, Na przykład:
H - H (wiązanie między dwoma atomami wodoru);
H 3 N - H + (wiązanie między atomem azotu cząsteczki amoniaku a kationem wodoru);
(K +) - (I -) (wiązanie między kationem potasu a jonem jodkowym).
Wiązanie chemiczne tworzy para elektronów (), która we wzorach elektronowych cząstek złożonych (cząsteczek, jonów złożonych) jest zwykle zastępowana linią walencyjną, w przeciwieństwie do własnych, niewspółdzielonych par elektronowych atomów, np.:
Wiązanie chemiczne to tzw kowalencyjny, jeśli powstaje w wyniku uspołecznienia pary elektronów przez oba atomy.
W cząsteczce F 2 oba atomy fluoru mają taką samą elektroujemność, dlatego posiadanie pary elektronów jest dla nich takie samo. Takie wiązanie chemiczne nazywa się niepolarnym, ponieważ każdy atom fluoru ma gęstość elektronów to samo w formuła elektroniczna cząsteczki można warunkowo podzielić między nimi po równo:
W cząsteczce HCl wiązanie chemiczne już istnieje polarny, ponieważ gęstość elektronów na atomie chloru (pierwiastku o większej elektroujemności) jest znacznie większa niż na atomie wodoru:
Wiązanie kowalencyjne, na przykład H - H, można utworzyć, dzieląc elektrony dwóch neutralnych atomów:
H + H > H – H
Ten mechanizm wiązania nazywa się giełda Lub równowartość.
Zgodnie z innym mechanizmem to samo wiązanie kowalencyjne H - H powstaje, gdy para elektronów jonu wodorkowego H jest uspołeczniona przez kation wodoru H +:
H + + (:H) - > H - H
Kation H+ w tym przypadku to tzw akceptor i anion H - dawca para elektronów. Mechanizm tworzenia wiązania kowalencyjnego w tym przypadku będzie akceptujący dawcę, Lub koordynowanie.
Nazywa się wiązania pojedyncze (H - H, F - F, H - CI, H - N). a-linki, określają geometryczny kształt cząsteczek.
Wiązania podwójne i potrójne () zawierają jeden składnik a i jeden lub dwa składniki a; ?-komponent, który jest głównym i warunkowo utworzony jako pierwszy, jest zawsze silniejszy niż ?-komponenty.
Fizyczne (właściwie mierzalne) cechy wiązania chemicznego to jego energia, długość i biegunowość.
Energia wiązań chemicznych (mi cv) to ciepło uwalniane podczas tworzenia tego wiązania i zużywane na jego zerwanie. Dla tych samych atomów zawsze występuje pojedyncze wiązanie słabszy niż wielokrotność (podwójna, potrójna).
Długość wiązania chemicznego (l s) - odległość międzyjądrowa. Dla tych samych atomów zawsze występuje pojedyncze wiązanie dłużej niż wielokrotność.
Biegunowość mierzona jest komunikacja elektryczny moment dipolowy p- iloczyn rzeczywistego ładunku elektrycznego (na atomach danego wiązania) przez długość dipola (tj. długość wiązania). Im większy moment dipolowy, tym wyższa polaryzacja wiązania. Rzeczywiste ładunki elektryczne na atomach w wiązaniu kowalencyjnym mają zawsze mniejszą wartość niż stopnie utlenienia pierwiastków, ale mają taki sam znak; na przykład dla wiązania H + I -Cl -I rzeczywiste ładunki to H + 0 "17 -Cl -0" 17 (cząstka dwubiegunowa lub dipol).
Polarność cząsteczek określony przez ich skład i geometryczny kształt.
Niepolarny (p = O) będzie:
a) cząsteczki prosty substancje, ponieważ zawierają tylko niepolarne wiązania kowalencyjne;
B) wieloatomowy Cząsteczki złożony substancje, jeśli ich kształt geometryczny symetryczny.
Na przykład cząsteczki CO 2, BF 3 i CH 4 mają następujące kierunki równych (wzdłuż długości) wektorów wiązań:

Kiedy dodaje się wektory wiązań, ich suma zawsze znika, a cząsteczki jako całość są niepolarne, chociaż zawierają wiązania polarne.
polarny (s> O) będzie:
A) dwuatomowy Cząsteczki złożony substancje, ponieważ zawierają tylko wiązania polarne;
B) wieloatomowy Cząsteczki złożony substancje, jeśli ich struktura asymetrycznie, tj. ich kształt geometryczny jest albo niekompletny, albo zniekształcony, co prowadzi do pojawienia się całkowitego dipola elektrycznego, na przykład w cząsteczkach NH 3, H 2 O, HNO 3 i HCN.
Jony złożone, takie jak NH 4 + , SO 4 2- i NO 3 - , w zasadzie nie mogą być dipolami, mają tylko jeden ładunek (dodatni lub ujemny).
Wiązanie jonowe powstaje podczas elektrostatycznego przyciągania kationów i anionów przy prawie zerowym uspołecznieniu pary elektronów, na przykład między K + i I -. Atom potasu ma brak gęstości elektronowej, atom jodu ma nadmiar. To połączenie jest brane pod uwagę ograniczające przypadku wiązania kowalencyjnego, ponieważ para elektronów jest praktycznie w posiadaniu anionu. Takie połączenie jest najbardziej typowe dla związków typowych metali i niemetali (CsF, NaBr, CaO, K 2 S, Li 3 N) oraz substancji z klasy soli (NaNO 3, K 2 SO 4, CaCO 3). Wszystkie te związki w warunkach pokojowych są substancjami krystalicznymi, które łączy wspólna nazwa kryształy jonowe(kryształy zbudowane z kationów i anionów).
Istnieje inny rodzaj połączenia, tzw wiązanie metaliczne, w którym elektrony walencyjne są tak luźno utrzymywane przez atomy metali, że w rzeczywistości nie należą do konkretnych atomów.
Atomy metali, pozostawione bez wyraźnie należących do nich zewnętrznych elektronów, stają się niejako jonami dodatnimi. Tworzą się metalowa siatka krystaliczna. Zbiór uspołecznionych elektronów walencyjnych ( gaz elektronowy) utrzymuje dodatnie jony metali razem i w określonych miejscach sieci.
Oprócz kryształów jonowych i metalicznych występują również atomowy I molekularny substancje krystaliczne, w których miejscach sieci znajdują się odpowiednio atomy lub cząsteczki. Przykłady: diament i grafit - kryształy o sieci atomowej, jod I 2 i dwutlenek węgla CO 2 (suchy lód) - kryształy o sieci molekularnej.
Wiązania chemiczne istnieją nie tylko wewnątrz cząsteczek substancji, ale mogą również tworzyć się między cząsteczkami, na przykład dla ciekłego HF, wody H 2 O i mieszaniny H 2 O + NH 3:

wiązanie wodorowe powstaje w wyniku sił przyciągania elektrostatycznego cząsteczek polarnych zawierających atomy najbardziej elektroujemnych pierwiastków - F, O, N. Na przykład wiązania wodorowe są obecne w HF, H 2 O i NH 3, ale nie ma ich w HCl, H2S i PH3.
Wiązania wodorowe są niestabilne i dość łatwo pękają, na przykład gdy topnieje lód i gotuje się woda. Jednak na zerwanie tych wiązań zużywana jest dodatkowa energia, a zatem temperatury topnienia (Tabela 5) i temperatury wrzenia substancji z wiązaniami wodorowymi

(na przykład HF i H 2 O) są znacznie wyższe niż w przypadku podobnych substancji, ale bez wiązań wodorowych (na przykład odpowiednio HCl i H 2 S).
Wiele związków organicznych tworzy również wiązania wodorowe; Wiązanie wodorowe odgrywa ważną rolę w procesach biologicznych.
Przykłady zadań z części A1. Substancje z tylko wiązaniami kowalencyjnymi są
1) SiH4, Cl2O, CaBr2
2) NF 3, NH 4 Cl, P 2 O 5
3) CH4, HNO3, Na(CH3O)
4) CCl2O, I2, N2O
2–4. wiązanie kowalencyjne
2. singiel
3. podwójny
4. potrójny
obecny w materii
5. W cząsteczkach występują wiązania wielokrotne
6. Cząstki zwane rodnikami są
7. Jedno z wiązań jest tworzone przez mechanizm donor-akceptor w zestawie jonów
1) S04 2-, NH4 +
2) H30+, NH4+
3) PO 4 3-, NR 3 -
4) PH 4 + , SO 3 2-
8. Najtrwalszy I krótki wiązanie - w cząsteczce
9. Substancje tylko z wiązaniami jonowymi - w zestawie
2) NH4Cl, SiCl4
10–13. Sieć krystaliczna materii
13. Va (OH) 2
1) metalowe