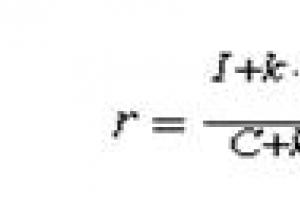Odredite vrstu hemijske veze u molekulu fluora. Vrste hemijskih veza. Kovalentna polarna hemijska veza
(prvi elektron)
(prema Paulingu)
| F | 9 |
| 18,9984 | |
| 2s 2 2p 5 | |
| Fluor | |
Hemijska svojstva
Najaktivniji nemetal, nasilno stupa u interakciju s gotovo svim tvarima (rijetki iznimci su fluoroplasti), a s većinom njih - sa izgaranjem i eksplozijom. Kontakt fluora sa vodonikom dovodi do paljenja i eksplozije čak i na vrlo visokim temperaturama niske temperature(do -252°C). Čak i voda i platina: uranijum za nuklearnu industriju sagorevaju u atmosferi fluora.
klor trifluorid ClF 3 - fluorizirajuće sredstvo i snažno oksidacijsko sredstvo raketno gorivo
sumpor heksafluorid SF 6 - plinoviti izolator u elektroindustriji
metalni fluoridi (na primjer, W i V), koji imaju neke korisna svojstva
freoni su dobra rashladna sredstva
teflon - hemijski inertni polimeri
natrijum heksafluoroaluminat - za naknadnu proizvodnju aluminijuma elektrolizom
razna jedinjenja fluor
Raketna tehnologija
Jedinjenja fluora se široko koriste u raketnoj tehnologiji kao oksidatori pogonskog goriva.Primjena u medicini
Jedinjenja fluora se široko koriste u medicini kao zamjene za krv.
Biološka i fiziološka uloga
Fluor je vitalni element za tijelo. U ljudskom tijelu, fluor se uglavnom nalazi u zubnoj caklini kao dio fluorapatita - Ca 5 F (PO 4) 3 . Sa nedostatkom (manje od 0,5 mg/l pije vodu) ili prekomjerna (više od 1 mg/l) konzumacija fluora u tijelu može dovesti do razvoja zubnih bolesti: karijesa i fluoroze (pjegave cakline) i osteosarkoma, respektivno.
Za prevenciju karijesa preporučuje se upotreba pasta za zube sa fluoridnim aditivima ili pijenje fluorisane vode (do koncentracije od 1 mg/l), ili lokalne aplikacije 1-2% rastvora natrijum fluorida ili kalaj fluorida. Takve radnje mogu smanjiti vjerojatnost karijesa za 30-50%.
Maksimalna dozvoljena koncentracija vezanog fluora u vazduhu industrijskih prostorija je 0,0005 mg/litar.
Dodatne informacije
Fluor, Fluorum, F(9)
Fluor (Fluor, Francuski i Njemački Fluor) je u slobodnom stanju dobijen 1886. godine, ali su njegovi spojevi odavno poznati i široko se koriste u metalurgiji i proizvodnji stakla. Prvi pomen fluorita (CaP,) pod imenom fluorit (Fliisspat) datira iz 16. stoljeća. U jednom od djela koje se pripisuje legendarnom Vasiliju Valentinu spominje se kamenje obojeno u razne boje - flukse (Fliisse od latinskog fluere - teći, sipati), koje se koristilo kao fluks pri topljenju metala. Agricola i Libavius pišu o istom. Potonji uvodi posebne nazive za ovaj fluks - fluorov špat (Flusspat) i mineralna talina. Mnogi autori hemijskih i tehničkih spisa 17. i 18. veka. opisati različite vrste fluorit. U Rusiji se ovo kamenje zvalo plavik, spalt, spat; Lomonosov je ovo kamenje klasifikovao kao selenite i nazvao ih spar ili fluks (kristalni fluks). Ruski majstori, kao i kolekcionari kolekcija minerala (na primjer, u 18. vijeku, knez P.F. Golitsyn) znali su da su neke vrste bata kada se zagrijavaju (na primjer, u vruća voda) sjaj u mraku. Međutim, čak i Leibniz u svojoj istoriji fosfora (1710) spominje u vezi s tim termofosfor (Thermophosphorus).
Očigledno, hemičari i hemičari zanatlije upoznali su se sa fluorovodoničnom kiselinom najkasnije u 17. veku. Godine 1670., nirnberški majstor Schwanhard koristio je fluorit pomiješan sa sumpornom kiselinom za graviranje dizajna na staklenim peharima. Međutim, u to vrijeme priroda fluorita i fluorovodonične kiseline bila je potpuno nepoznata. Vjerovalo se, na primjer, da silicijumska kiselina ima efekat jetkanja u Schwanhardovom procesu. Ovo pogrešno mišljenje otklonio je Scheele, dokazujući da se u interakciji fluorita sa sumpornom kiselinom dobiva silicijumska kiselina kao rezultat erozije staklene retorte nastalom fluorovodoničnom kiselinom. Osim toga, Scheele je ustanovio (1771.) da je fluorit kombinacija vapnenačke zemlje sa posebnom kiselinom, koja je nazvana "švedska kiselina".
Lavoisier je prepoznao radikal fluorovodonične kiseline (radical fluorique) kao jednostavno tijelo i uključio ga u svoju tablicu jednostavnih tijela. U manje-više čista forma fluorovodonična kiselina dobijena je 1809. Gay-Lussac i Tenard destilacijom fluorita sa sumpornom kiselinom u olovnoj ili srebrnoj retorti. Tokom ove operacije, oba istraživača su otrovana. Pravu prirodu fluorovodonične kiseline ustanovio je 1810. Amper. On je odbacio Lavoisierovo mišljenje da fluorovodonična kiselina mora sadržavati kiseonik i dokazao analogiju ove kiseline sa hlorovodoničnom kiselinom. Amper je prijavio svoja otkrića Davyju, koji je neposredno prije toga utvrdio elementarnu prirodu hlora. Davy se u potpunosti složio s Ampereovim argumentima i uložio je mnogo truda u dobivanje slobodnog fluora elektrolizom fluorovodonične kiseline i na druge načine. Uzimajući u obzir snažno korozivno djelovanje fluorovodonične kiseline na staklo, kao i na biljna i životinjska tkiva, Ampere je predložio da se element koji se u njemu nalazi nazove fluorom (grčki - uništenje, smrt, kuga, kuga itd.). Međutim, Davy nije prihvatio ovo ime i predložio je drugi - fluor (fluor) po analogiji sa tadašnjim imenom hlora - hlor (hlor), oba naziva se još uvijek koriste u engleski jezik. U ruskom jeziku sačuvano je ime koje je dao Ampere.
Brojni pokušaji da se izoluje slobodni fluor u 19. veku nije dovela do uspješnih rezultata. Tek 1886. Moissan je to uspio i dobiti slobodan fluor u obliku žuto-zelenog plina. Budući da je fluor neobično agresivan plin, Moissan je morao savladati mnoge poteškoće prije nego što je pronašao materijal pogodan za aparat u eksperimentima s fluorom. U-cijev za elektrolizu fluorovodonične kiseline na 55°C (hlađena tekućim metil hloridom) izrađena je od platine sa fluoričnim čepovima. Nakon hemijskog i fizička svojstva slobodan fluor, našao je široku primjenu. Sada je fluor jedan od njih kritične komponente sinteza fluoroorganskih supstanci širokog spektra. U ruskoj književnosti početkom XIX V. fluor se zvao drugačije: baza fluorovodonične kiseline, fluor (Dvigubsky, 1824), fluor (Iovsky), fluor (Shcheglov, 1830), fluor, fluor, fluor. Hess je 1831. uveo naziv fluor.
Zadatak broj 1
Sa predložene liste izaberite dva jedinjenja u kojima postoji ionska hemijska veza.
- 1. Ca(ClO 2) 2
- 2. HClO 3
- 3.NH4Cl
- 4. HClO 4
- 5.Cl2O7
Odgovor: 13
U velikoj većini slučajeva, prisutnost ionskog tipa veze u spoju može se odrediti činjenicom da njegove strukturne jedinice istovremeno uključuju atome tipičnog metala i atome nemetala.
Na osnovu toga utvrđujemo da postoji jonska veza u jedinjenju broj 1 - Ca(ClO 2) 2, jer u njegovoj formuli se mogu vidjeti atomi tipičnog metala kalcijuma i atomi nemetala - kiseonika i hlora.
Međutim, na ovoj listi više nema spojeva koji sadrže i metalne i nemetalne atome.
Među jedinjenjima navedenim u zadatku nalazi se amonijum hlorid u kojem se ostvaruje jonska veza između amonijum kationa NH 4 + i hloridnog jona Cl − .
Zadatak broj 2
Sa predložene liste izaberite dva jedinjenja u kojima je tip hemijska veza isto kao u molekulu fluora.
1) kiseonik
2) dušikov oksid (II)
3) bromovodonik
4) natrijum jodid
Zapišite brojeve odabranih veza u polje za odgovor.
Odgovor: 15
Molekul fluora (F 2) se sastoji od dva atoma jednog hemijskog elementa nemetala, stoga je hemijska veza u ovom molekulu kovalentna nepolarna.
Kovalentna nepolarna veza može se ostvariti samo između atoma istog hemijskog elementa nemetala.
Od predloženih opcija, samo kisik i dijamant imaju kovalentnu nepolarnu vezu. Molekula kiseonika je dvoatomska, sastoji se od atoma jednog hemijskog elementa nemetala. Dijamant ima atomsku strukturu i u njegovoj strukturi svaki atom ugljika, koji je nemetal, vezan je za 4 druga ugljikova atoma.
Dušikov oksid (II) je supstanca koja se sastoji od molekula formiranih od atoma dva različita nemetala. Pošto je elektronegativnost različitih atoma su uvijek različiti, zajednički elektronski par u molekuli se pomjera na elektronegativniji element, u ovom slučaju na kisik. Dakle, veza u molekulu NO je kovalentno polarna.
Bromovodik se također sastoji od dvoatomskih molekula sastavljenih od atoma vodika i broma. Zajednički elektronski par koji formira H-Br vezu je pomjeren na elektronegativniji atom broma. Hemijska veza u molekulu HBr je također kovalentno polarna.
Natrijum jodid je jonska supstanca formirana od metalnog kationa i jodidnog anjona. Veza u molekuli NaI nastaje zbog prijenosa elektrona iz 3 s-orbitale atoma natrija (atom natrijuma se pretvara u kation) do nedovoljno popunjenog 5 str-orbitala atoma joda (atom joda se pretvara u anjon). Takva hemijska veza naziva se jonskom.
Zadatak broj 3
Sa predloženog popisa odaberite dvije tvari između molekula čiji se formiraju vodikove veze.
- 1. C 2 H 6
- 2.C2H5OH
- 3.H2O
- 4. CH 3 OCH 3
- 5. CH 3 COCH 3
Zapišite brojeve odabranih veza u polje za odgovor.
Odgovor: 23
Objašnjenje:
Vodikove veze se odvijaju u supstancama molekularne strukture u kojima se nalaze koleta H-O veze, H-N, H-F. One. kovalentne veze atoma vodika sa atomima tri hemijski elementi sa najvećom elektronegativnošću.
Dakle, očito, postoje vodikove veze između molekula:
2) alkoholi
3) fenola
5) amonijak
6) primarni i sekundarni amini
7) fluorovodonična kiselina
Zadatak broj 4
Sa predložene liste izaberite dva jedinjenja sa ionskom hemijskom vezom.
- 1. PCl 3
- 2.CO2
- 3.NaCl
- 4. H 2 S
- 5. MgO
Zapišite brojeve odabranih veza u polje za odgovor.
Odgovor: 35
Objašnjenje:
U velikoj većini slučajeva može se zaključiti da postoji ionski tip veze u spoju po tome što sastav strukturnih jedinica tvari istovremeno uključuje atome tipičnog metala i atome nemetala.
Na osnovu toga utvrđujemo da postoji jonska veza u jedinjenju broj 3 (NaCl) i 5 (MgO).
Bilješka*
Pored gore navedenog obilježja, o prisutnosti ionske veze u spoju se može reći ako njegova strukturna jedinica sadrži amonijum kation (NH 4 +) ili njegove organske analoge - katjone alkilamonijum RNH 3 +, dialkilamonijum R 2 NH 2 + , trialkilamonijum R 3 NH + ili tetraalkilamonijum R 4 N + , gde je R neki ugljikovodični radikal. Na primjer, jonski tip veza se odvija u spoju (CH 3) 4 NCl između kationa (CH 3) 4 + i hloridnog jona Cl - .
Zadatak broj 5
Sa predložene liste odaberite dvije supstance iste vrste strukture.
4) kuhinjska so
Zapišite brojeve odabranih veza u polje za odgovor.
Odgovor: 23
Zadatak broj 8
Sa predložene liste odaberite dvije supstance nemolekularne strukture.
2) kiseonik
3) bijeli fosfor
5) silicijum
Zapišite brojeve odabranih veza u polje za odgovor.
Odgovor: 45
Zadatak broj 11
Sa predložene liste odaberite dvije tvari u čijim molekulima postoji dvostruka veza između atoma ugljika i kisika.
3) formaldehid
4) sirćetna kiselina
5) glicerin
Zapišite brojeve odabranih veza u polje za odgovor.
Odgovor: 34
Zadatak broj 14
Sa predložene liste izaberite dve supstance sa ionskom vezom.
1) kiseonik
3) ugljen monoksid (IV)
4) natrijum hlorid
5) kalcijum oksid
Zapišite brojeve odabranih veza u polje za odgovor.
Odgovor: 45
Zadatak broj 15
Sa predložene liste izaberite dve supstance sa istim tipom kristalne rešetke kao dijamant.
1) silicijum SiO 2
2) natrijum oksid Na 2 O
3) ugljen monoksid CO
4) bijeli fosfor P 4
5) silicijum Si
Zapišite brojeve odabranih veza u polje za odgovor.
Odgovor: 15
Zadatak broj 20
Sa predložene liste izaberite dve supstance u čijim molekulima postoji jedna trostruka veza.
- 1. HCOOH
- 2.HCOH
- 3. C 2 H 4
- 4. N 2
- 5.C2H2
Zapišite brojeve odabranih veza u polje za odgovor.
Odgovor: 45
Objašnjenje:
Da biste pronašli tačan odgovor, nacrtajte strukturne formule jedinjenja sa predstavljene liste:
Dakle, vidimo da trostruka veza postoji u molekulima dušika i acetilena. One. tačni odgovori 45
Zadatak broj 21
Sa predložene liste odaberite dvije supstance u čijim molekulima postoji kovalentna nepolarna veza.
Teme USE kodifikatora: Kovalentna hemijska veza, njene vrste i mehanizmi nastanka. Karakteristike kovalentne veze (polaritet i energija veze). Jonska veza. Metalni priključak. vodoničnu vezu
Intramolekularne hemijske veze
Razmotrimo prvo veze koje nastaju između čestica unutar molekula. Takve veze se nazivaju intramolekularno.
hemijska veza između atoma hemijskih elemenata ima elektrostatičku prirodu i nastaje zbog interakcije vanjskih (valentnih) elektrona, u manjem ili većem stepenu drže pozitivno nabijena jezgra vezanih atoma.
Ključni koncept je ovdje ELEKTRONEGNATIVNOST. Ona je ta koja određuje vrstu kemijske veze između atoma i svojstva ove veze.
je sposobnost atoma da privuče (zadrži) vanjski(valencija) elektrona. Elektronegativnost je određena stepenom privlačenja vanjskih elektrona na jezgro i uglavnom ovisi o radijusu atoma i naboju jezgra.
Elektronegativnost je teško jednoznačno odrediti. L. Pauling je sastavio tablicu relativne elektronegativnosti (zasnovanu na energijama veze dvoatomskih molekula). Najelektronegativniji element je fluor sa značenjem 4 .
Važno je napomenuti da u različitim izvorima možete pronaći različite skale i tablice vrijednosti elektronegativnosti. Ovo se ne treba plašiti, jer formiranje hemijske veze igra ulogu atoma, a približno je isto u svakom sistemu.
Ako jedan od atoma u hemijskoj vezi A:B jače privlači elektrone, tada se elektronski par pomera prema njemu. Više razlika u elektronegativnosti atoma, više se elektronski par pomera.
Ako su vrijednosti elektronegativnosti atoma u interakciji jednake ili približno jednake: EO(A)≈EO(V), tada zajednički elektronski par nije pomjeren ni na jedan od atoma: A: B. Takva veza se zove kovalentne nepolarne.
Ako se elektronegativnost atoma u interakciji razlikuje, ali ne mnogo (razlika u elektronegativnosti je otprilike od 0,4 do 2: 0,4<ΔЭО<2 ), tada se elektronski par pomjera na jedan od atoma. Takva veza se zove kovalentna polarna .
Ako se elektronegativnost atoma u interakciji značajno razlikuje (razlika u elektronegativnosti je veća od 2: ΔEO>2), tada jedan od elektrona gotovo potpuno prelazi na drugi atom, sa formiranjem joni. Takva veza se zove jonski.
Glavne vrste hemijskih veza su − kovalentna, jonski I metalik veze. Razmotrimo ih detaljnije.
kovalentna hemijska veza
kovalentna veza – to je hemijska veza formirana od strane formiranje zajedničkog elektronskog para A:B . U ovom slučaju dva atoma preklapanje atomske orbitale. Kovalentna veza nastaje interakcijom atoma s malom razlikom u elektronegativnosti (u pravilu, između dva nemetala) ili atoma jednog elementa.
Osnovna svojstva kovalentnih veza
- orijentacija,
- zasićenost,
- polaritet,
- polarizabilnost.
Ova svojstva veze utiču na hemijska i fizička svojstva supstanci.
Smjer komunikacije karakteriše hemijsku strukturu i oblik supstanci. Uglovi između dvije veze nazivaju se uglovi veze. Na primjer, u molekuli vode vezni ugao H-O-H je 104,45 o, pa je molekul vode polarni, a u molekuli metana vezni ugao H-C-H je 108 o 28 ′.
Zasićenost je sposobnost atoma da formiraju ograničen broj kovalentnih hemijskih veza. Broj veza koji atom može formirati naziva se.
Polaritet veze nastaju zbog neravnomjerne raspodjele elektronske gustine između dva atoma različite elektronegativnosti. Kovalentne veze se dijele na polarne i nepolarne.
Polarizabilnost veze su sposobnost veznih elektrona da budu pomjereni vanjskim električnim poljem(posebno, električno polje druge čestice). Polarizabilnost ovisi o pokretljivosti elektrona. Što je elektron udaljeniji od jezgre, to je pokretniji i, shodno tome, molekul je više polarizabilan.
Kovalentna nepolarna hemijska veza
Postoje 2 vrste kovalentne veze - POLAR I NON-POLARNI .
Primjer . Razmotrimo strukturu molekule vodonika H 2 . Svaki atom vodonika nosi 1 nespareni elektron na svom vanjskom energetskom nivou. Za prikaz atoma koristimo Lewisovu strukturu - ovo je dijagram strukture vanjskog energetskog nivoa atoma, kada su elektroni označeni tačkama. Modeli Lewisove tačke strukture su dobra pomoć pri radu sa elementima drugog perioda.
H. + . H=H:H
Dakle, molekul vodonika ima jedan zajednički elektronski par i jednu H–H hemijsku vezu. Ovaj elektronski par nije pomjeren ni na jedan od atoma vodika, jer elektronegativnost atoma vodika je ista. Takva veza se zove kovalentne nepolarne .
Kovalentna nepolarna (simetrična) veza - ovo je kovalentna veza koju formiraju atomi s jednakom elektronegativnošću (u pravilu isti nemetali) i, prema tome, s ravnomjernom raspodjelom elektronske gustoće između jezgara atoma.
Dipolni moment nepolarnih veza je 0.
Primjeri: H 2 (H-H), O 2 (O=O), S 8 .
Kovalentna polarna hemijska veza
kovalentna polarna veza je kovalentna veza koja se javlja između atomi različite elektronegativnosti (obično, različitih nemetala) i karakteriziran je pomak zajednički elektronski par u elektronegativniji atom (polarizacija).
Gustoća elektrona se pomjera na elektronegativniji atom - stoga se na njemu pojavljuje djelomični negativni naboj (δ-), a na manje elektronegativnom atomu (δ+, delta +) pojavljuje se djelomični pozitivni naboj.
Što je veća razlika u elektronegativnosti atoma, to je veća polaritet veze i još više dipolni moment . Između susjednih molekula i naboja suprotnog predznaka djeluju dodatne privlačne sile koje se povećavaju snagu veze.
Polaritet veze utiče na fizička i hemijska svojstva jedinjenja. Mehanizmi reakcije, pa čak i reaktivnost susjednih veza zavise od polariteta veze. Polaritet veze često određuje polaritet molekula i na taj način direktno utiče na fizička svojstva kao što su tačka ključanja i tačka topljenja, rastvorljivost u polarnim rastvaračima.
primjeri: HCl, CO 2 , NH 3 .
Mehanizmi za formiranje kovalentne veze
Kovalentna hemijska veza može nastati pomoću 2 mehanizma:
1. mehanizam razmene formiranje kovalentne hemijske veze je kada svaka čestica daje jedan nespareni elektron za formiranje zajedničkog elektronskog para:
A . + . B= A:B
2. Formiranje kovalentne veze je takav mehanizam u kojem jedna od čestica daje nepodijeljeni elektronski par, a druga čestica daje praznu orbitalu za ovaj elektronski par:
O: + B= A:B
U ovom slučaju, jedan od atoma daje nepodijeljeni elektronski par ( donator), a drugi atom daje praznu orbitalu za ovaj par ( akceptor). Kao rezultat formiranja veze, energija oba elektrona se smanjuje, tj. ovo je korisno za atome.
Kovalentna veza formirana mehanizmom donor-akceptor, nije drugačije po svojstvima drugih kovalentnih veza formiranih mehanizmom razmjene. Formiranje kovalentne veze mehanizmom donor-akceptor tipično je za atome ili sa velikim brojem elektrona na vanjskom energetskom nivou (donori elektrona), ili obrnuto, sa vrlo malim brojem elektrona (akceptori elektrona). Valentne mogućnosti atoma su detaljnije razmotrene u odgovarajućim.
Kovalentnu vezu formira mehanizam donor-akceptor:
- u molekulu ugljen monoksid CO(veza u molekulu je trostruka, 2 veze se formiraju mehanizmom razmene, jedna donor-akceptorskim mehanizmom): C≡O;
- V amonijum jona NH 4 +, u jonima organski amini, na primjer, u metilamonijum jonu CH 3 -NH 2 + ;
- V kompleksna jedinjenja, hemijska veza između centralnog atoma i grupa liganada, na primer, u natrijum tetrahidroksoaluminatu Na veza između aluminijuma i hidroksidnih jona;
- V dušične kiseline i njenih soli- nitrati: HNO 3 , NaNO 3 , u nekim drugim azotnim jedinjenjima;
- u molekulu ozona O 3 .
Glavne karakteristike kovalentne veze
Kovalentna veza, u pravilu, nastaje između atoma nemetala. Glavne karakteristike kovalentne veze su dužina, energija, višestrukost i usmjerenost.
Višestrukost hemijskih veza
Višestrukost hemijskih veza - Ovo broj zajedničkih elektronskih parova između dva atoma u spoju. Višestrukost veze može se prilično lako odrediti iz vrijednosti atoma koji formiraju molekul.
Na primjer , u molekulu vodonika H 2 višestrukost veze je 1, jer svaki vodonik ima samo 1 nespareni elektron na vanjskom energetskom nivou, stoga se formira jedan zajednički elektronski par.
U molekulu kiseonika O 2, multiplicitet veze je 2, jer svaki atom ima 2 nesparena elektrona na svom vanjskom energetskom nivou: O=O.
U molekulu azota N 2, višestrukost veze je 3, jer između svakog atoma postoje 3 nesparena elektrona na vanjskom energetskom nivou, a atomi formiraju 3 zajednička elektronska para N≡N.
Dužina kovalentne veze
Dužina hemijske veze
je udaljenost između centara jezgara atoma koji formiraju vezu. Određuje se eksperimentalnim fizičkim metodama. Dužina veze može se približno procijeniti, prema pravilu aditivnosti, prema kojem je dužina veze u molekuli AB približno jednaka polovini zbroja dužina veze u molekulima A 2 i B 2: 
Dužina hemijske veze može se grubo proceniti duž poluprečnika atoma, formiranje veze, ili mnogostrukošću komunikacije ako radijusi atoma nisu mnogo različiti.
Sa povećanjem radijusa atoma koji formiraju vezu, dužina veze će se povećati.
Na primjer
Sa povećanjem brojnosti veza između atoma (čiji se atomski radijusi ne razlikuju, ili se neznatno razlikuju), dužina veze će se smanjiti.
Na primjer . U nizu: C–C, C=C, C≡C, dužina veze se smanjuje.
Energija veze
Mjera snage hemijske veze je energija veze. Energija veze je određena energijom koja je potrebna za prekid veze i uklanjanje atoma koji formiraju ovu vezu na beskonačnu udaljenost jedan od drugog.
Kovalentna veza je veoma izdržljiv. Njegova energija se kreće od nekoliko desetina do nekoliko stotina kJ/mol. Što je energija veze veća, to je veća snaga veze i obrnuto.
Jačina hemijske veze zavisi od dužine veze, polariteta veze i višestrukosti veze. Što je hemijska veza duža, to je lakše prekinuti, a što je manja energija veze, to je manja njena snaga. Što je hemijska veza kraća, to je jača i veća je energija veze.
Na primjer, u nizu jedinjenja HF, HCl, HBr s lijeva na desno jačina hemijske veze smanjuje se, jer dužina veze se povećava.
Jonska hemijska veza
Jonska veza je hemijska veza zasnovana na elektrostatičko privlačenje jona.
joni nastaju u procesu prihvatanja ili odavanja elektrona od strane atoma. Na primjer, atomi svih metala slabo drže elektrone vanjskog energetskog nivoa. Zbog toga se karakteriziraju atomi metala obnavljajuća svojstva sposobnost doniranja elektrona.
Primjer. Atom natrijuma sadrži 1 elektron na 3. energetskom nivou. Lako ga odajući, atom natrijuma formira mnogo stabilniji Na + jon, sa elektronskom konfiguracijom plemenitog neonskog gasa Ne. Natrijum jon sadrži 11 protona i samo 10 elektrona, tako da je ukupni naboj jona -10+11 = +1:
+11N / A) 2 ) 8 ) 1 - 1e = +11 N / A +) 2 ) 8
Primjer. Atom hlora ima 7 elektrona na svom vanjskom energetskom nivou. Da bi stekao konfiguraciju stabilnog inertnog atoma argona Ar, klor treba da poveže 1 elektron. Nakon vezivanja elektrona, formira se stabilan jon hlora koji se sastoji od elektrona. Ukupan naboj jona je -1:
+17Cl) 2 ) 8 ) 7 + 1e = +17 Cl — ) 2 ) 8 ) 8
Bilješka:
- Svojstva jona se razlikuju od svojstava atoma!
- Stabilni joni mogu se formirati ne samo atomi, ali takođe grupe atoma. Na primjer: amonijum jon NH 4 +, sulfatni jon SO 4 2-, itd. Hemijske veze formirane od takvih jona takođe se smatraju jonskim;
- Jonske veze se obično formiraju između metali I nemetali(grupe nemetala);
Nastali ioni se privlače zbog električne privlačnosti: Na + Cl -, Na 2 + SO 4 2-.
Hajde da vizuelno generalizujemo razlika između tipa kovalentne i jonske veze:
hemijska veza metala
metalni spoj je odnos koji se formira relativno slobodnih elektrona između metalni joni formirajući kristalnu rešetku.
Atomi metala na vanjskom energetskom nivou obično imaju jedan do tri elektrona. Radijusi atoma metala su, u pravilu, veliki - dakle, atomi metala, za razliku od nemetala, prilično lako doniraju vanjske elektrone, tj. su jaki redukcioni agensi
Intermolekularne interakcije
Odvojeno, vrijedi razmotriti interakcije koje se javljaju između pojedinačnih molekula u tvari - intermolekularne interakcije . Intermolekularne interakcije su vrsta interakcije između neutralnih atoma u kojoj se ne pojavljuju nove kovalentne veze. Sile interakcije između molekula otkrio je van der Waals 1869. godine i dobio ime po njemu. Van dar Waalsove snage. Van der Waalsove snage se dijele na orijentacija, indukcija I disperzija . Energija međumolekularnih interakcija je mnogo manja od energije hemijske veze.
Orijentacijske sile privlačenja nastaju između polarnih molekula (dipol-dipol interakcija). Ove sile nastaju između polarnih molekula. Induktivne interakcije je interakcija između polarnog i nepolarnog molekula. Nepolarna molekula je polarizirana djelovanjem polarnog, što stvara dodatnu elektrostatičku privlačnost.
Posebna vrsta međumolekularne interakcije su vodikove veze. - to su intermolekularne (ili intramolekularne) hemijske veze koje nastaju između molekula u kojima postoje jako polarne kovalentne veze - H-F, H-O ili H-N. Ako postoje takve veze u molekulu, onda će ih postojati i između molekula dodatne sile privlačenja .
Mehanizam obrazovanja Vodikova veza je dijelom elektrostatička, a dijelom donorsko-akceptorska. U ovom slučaju atom jako elektronegativnog elementa (F, O, N) djeluje kao donor elektronskog para, a atomi vodika povezani s tim atomima djeluju kao akceptor. Karakterizirane su vodonične veze orijentacija u svemiru i saturation .
Vodikova veza se može označiti tačkama: H ··· O. Što je veća elektronegativnost atoma spojenog na vodonik, i što je manja njegova veličina, to je jača vodikova veza. Prvenstveno je karakterističan za jedinjenja fluor sa vodonikom , kao i do kiseonik sa vodonikom , manje azot sa vodonikom .
Vodikove veze nastaju između sljedećih supstanci:
— fluorovodonik HF(gas, rastvor fluorovodonika u vodi - fluorovodonična kiselina), vode H 2 O (para, led, tečna voda):
— rastvor amonijaka i organskih amina- između molekula amonijaka i vode;
— organska jedinjenja u kojima se vezuju O-H ili N-H: alkoholi, karboksilne kiseline, amini, aminokiseline, fenoli, anilin i njegovi derivati, proteini, rastvori ugljenih hidrata - monosaharidi i disaharidi.
Vodikova veza utiče na fizička i hemijska svojstva supstanci. Dakle, dodatno privlačenje između molekula otežava ključanje tvari. Supstance sa vodoničnim vezama pokazuju abnormalno povećanje tačke ključanja.
Na primjer U pravilu, s povećanjem molekularne težine, uočava se povećanje točke ključanja tvari. Međutim, u nizu supstanci H 2 O-H 2 S-H 2 Se-H 2 Te ne uočavamo linearnu promjenu u tačkama ključanja.
Naime, kod tačka ključanja vode je nenormalno visoka - ne manje od -61 o C, kako nam pokazuje prava linija, ali mnogo više, +100 o C. Ova anomalija se objašnjava prisustvom vodoničnih veza između molekula vode. Dakle, u normalnim uslovima (0-20 o C), voda je tečnost po faznom stanju.
Slobodni fluor se sastoji od dvoatomskih molekula. Sa hemijske tačke gledišta, fluor se može okarakterisati kao monovalentni nemetal, i, štaviše, najaktivniji od svih nemetala. To je zbog brojnih razloga, uključujući lakoću razgradnje molekule F 2 na pojedinačne atome - energija potrebna za to je samo 159 kJ/mol (nasuprot 493 kJ/mol za O 2 i 242 kJ/mol za C 12). Atomi fluora imaju značajan afinitet prema elektronima i relativno su male veličine. Stoga se ispostavlja da su njihove valentne veze s atomima drugih elemenata jače od sličnih veza drugih metaloida (na primjer, energija H-F veze je - 564 kJ/mol naspram 460 kJ/mol za H-O vezu i 431 kJ/mol za H-C1 veza).
F-F vezu karakterizira nuklearna udaljenost od 1,42 A. Za termičku disocijaciju fluora proračunom su dobijeni sljedeći podaci:
Atom fluora u osnovnom stanju ima strukturu vanjskog elektronskog sloja 2s 2 2p 5 i monovalentan je. Pobuđivanje trovalentnog stanja povezano sa prelaskom jednog 2p elektrona na nivo 3s zahteva utrošak od 1225 kJ/mol i praktično se ne ostvaruje.
Elektronski afinitet neutralnog atoma fluora procjenjuje se na 339 kJ/mol. Ion F - karakteriše efektivni radijus od 1,33 A i energija hidratacije od 485 kJ/mol. Za kovalentni radijus fluora obično se uzima vrijednost od 71 pm (tj. polovina međunuklearne udaljenosti u molekulu F2).
Hemijsko vezivanje je elektronska pojava u kojoj se barem jedan elektron, koji se nalazio u polju sila njegovog jezgra, nalazi u polju sila drugog jezgra ili više jezgara istovremeno.
Većina jednostavnih supstanci i sve složene supstance (spojevi) sastoje se od atoma koji međusobno deluju na određeni način. Drugim riječima, između atoma se uspostavlja hemijska veza. Kada se formira hemijska veza, energija se uvek oslobađa, tj. energija formirane čestice mora biti manja od ukupne energije početnih čestica.
Prijelaz elektrona s jednog atoma na drugi, koji rezultira stvaranjem suprotno nabijenih iona sa stabilnim elektronskim konfiguracijama, između kojih se uspostavlja elektrostatička privlačnost, najjednostavniji je model ionskog veza:
X → X + + e - ; Y + e - → Y - ; X+Y-
Hipotezu o formiranju jona i nastanku elektrostatičke privlačnosti između njih prvi je izneo nemački naučnik W. Kossel (1916).
Drugi model vezivanja je dijeljenje elektrona sa dva atoma, zbog čega se formiraju i stabilne elektronske konfiguracije. Takva veza se naziva kovalentna, a 1916. godine američki naučnik G. Lewis počeo je da razvija njenu teoriju.
Zajednička tačka u obe teorije bilo je formiranje čestica sa stabilnom elektronskom konfiguracijom koja se poklapa sa elektronskom konfiguracijom plemenitog gasa.
Na primjer, u formiranju litijum fluorida ostvaruje se jonski mehanizam stvaranja veze. Atom litija (3 Li 1s 2 2s 1) gubi elektron i pretvara se u kation (3 Li + 1s 2) sa elektronskom konfiguracijom helijuma. Fluor (9 F 1s 2 2s 2 2p 5) prihvata elektron, formirajući anjon (9 F - 1s 2 2s 2 2p 6) sa elektronskom konfiguracijom neona. Između litijum jona Li + i iona fluora F - nastaje elektrostatička privlačnost, zbog čega nastaje novo jedinjenje - litijum fluorid.
Kada nastaje fluorovodonik, jedini elektron atoma vodika (1s) i nespareni elektron atoma fluora (2p) nalaze se u polju djelovanja oba jezgra – atoma vodika i atoma fluora. Tako nastaje zajednički elektronski par, što znači preraspodjelu elektronske gustine i pojavu maksimalne elektronske gustine. Kao rezultat toga, dva elektrona su sada povezana s jezgrom atoma vodika (elektronska konfiguracija atoma helija), a osam elektrona vanjskog energetskog nivoa povezano je s jezgrom fluora (elektronska konfiguracija atoma neona):
Označeno je jednom crticom između simbola elemenata: H-F.Veza koju ostvaruje jedan elektronski par naziva se jednostruka veza.
Formiranje dvoelektronskih ljuski za litijum jon i atom vodika je poseban slučaj.Tendencija da se formira stabilna ljuska od osam elektrona prijenosom elektrona s jednog atoma na drugi (jonska veza) ili dijeljenjem elektrona (kovalentna veza) naziva se oktetno pravilo.
Postoje, međutim, spojevi koji ne slijede ovo pravilo. Na primjer, atom berilijuma u berilijum fluoridu BeF 2 ima samo ljusku od četiri elektrona; šest elektronskih ljuski karakteristično je za atom bora (tačke označavaju elektrone vanjskog energetskog nivoa):
Istovremeno, u jedinjenjima kao što su fosfor (V) hlorid i sumpor (VI) fluorid, jod (VII) fluorid, elektronske ljuske centralnih atoma sadrže više od osam elektrona (fosfor - 10; sumpor - 12; jod - 14):

U većini konjukcija d-elemenata, pravilo okteta se također ne poštuje.
U svim gornjim primjerima, kemijska veza se formira između atoma različitih elemenata; naziva se heteroatomskim. Međutim, između identičnih atoma može se formirati i kovalentna veza. Na primjer, molekula vodika nastaje dijeljenjem 15 elektrona svakog atoma vodika, zbog čega svaki atom dobiva stabilnu elektronsku konfiguraciju od dva elektrona. Oktet se formira tokom formiranja molekula drugih jednostavnih supstanci, kao što je fluor:

Formiranje hemijske veze može se izvesti i socijalizacijom četiri ili šest elektrona. U prvom slučaju nastaje dvostruka veza, koja predstavlja dva generalizirana para elektrona, u drugom - trostruka veza (tri generalizirana elektronska para).
Na primjer, kada se formira molekul dušika N 2, kemijska veza se formira socijalizacijom šest elektrona: tri nesparena p elektrona iz svakog atoma. Da bi se postigla konfiguracija od osam elektrona, formiraju se tri zajednička elektronska para:
Dvostruka veza je označena sa dve crtice, trostruka sa tri. Molekul dušika N 2 može se predstaviti na sljedeći način: N≡N.
U dvoatomskim molekulima formiranim od atoma jednog elementa, maksimalna gustoća elektrona nalazi se na sredini međunuklearne linije. Budući da ne postoji razdvajanje naboja između atoma, ova vrsta kovalentne veze naziva se nepolarna. Heteroatomska veza je uvijek manje ili više polarna, budući da je maksimalna gustoća elektrona pomjerena prema jednom od atoma, zbog čega dobiva djelomični negativni naboj (označen σ-). Atom sa kojeg je pomaknut maksimum elektronske gustine dobija parcijalni pozitivan naboj (označen σ+). Električno neutralne čestice kod kojih se centri parcijalnih negativnih i djelomičnih pozitivnih naboja ne poklapaju u prostoru nazivaju se dipoli. Polaritet veze se mjeri dipolnim momentom (μ), koji je direktno proporcionalan veličini naboja i udaljenosti između njih.

Rice. Šematski prikaz dipola
Spisak korišćene literature
- Popkov V. A., Puzakov S. A. Opća hemija: udžbenik. - M.: GEOTAR-Media, 2010. - 976 str.: ISBN 978-5-9704-1570-2. [Sa. 32-35]
Godine 1916. predložene su prve krajnje pojednostavljene teorije strukture molekula u kojima su korištene elektronske reprezentacije: teorija američkog fizičkog hemičara G. Lewisa (1875-1946) i njemačkog naučnika W. Kossela. Prema Lewisovoj teoriji, formiranje hemijske veze u dvoatomskom molekulu uključuje valentne elektrone dva atoma odjednom. Stoga su, na primjer, u molekuli vodika, umjesto valentnog prama, počeli crtati elektronski par koji formira kemijsku vezu:
Hemijska veza koju formira elektronski par naziva se kovalentna veza. Molekul vodonik fluorida je prikazan na sljedeći način:
Razlika između molekula jednostavnih supstanci (H2, F2, N2, O2) i molekula složenih supstanci (HF, NO, H2O, NH3) je u tome što prvi nemaju dipolni moment, dok drugi imaju. Dipolni moment m definiran je kao proizvod apsolutne vrijednosti naboja q i udaljenosti između dva suprotna naboja r:
Dipolni moment m dvoatomske molekule može se odrediti na dva načina. Prvo, pošto je molekul električno neutralan, poznat je ukupni pozitivni naboj molekula Z" (jednak je zbiru naelektrisanja atomskih jezgara: Z" = ZA + ZB). Poznavajući međunuklearnu udaljenost re, može se odrediti lokacija težišta pozitivnog naboja molekula. Vrijednost m molekula nalazi se iz eksperimenta. Dakle, možete pronaći r" - udaljenost između centara gravitacije pozitivnog i ukupnog negativnog naboja molekula:
Drugo, možemo pretpostaviti da kada se elektronski par koji formira kemijsku vezu pomakne na jedan od atoma, neki višak negativnog naboja -q "pojavi se na ovom atomu, a naboj + q" na drugom atomu. Udaljenost između atoma je re:
Dipolni moment HF molekula je 6,4×10-30 Cl×m, međunuklearna udaljenost H-F je 0,917×10-10 m. Izračunavanje q" daje: q" = 0,4 elementarnog naboja (tj. naboja elektrona). Budući da se na atomu fluora pojavio višak negativnog naboja, to znači da je elektronski par koji formira hemijsku vezu u molekulu HF pomaknut na atom fluora. Takva hemijska veza naziva se kovalentna polarna veza. Molekuli tipa A2 nemaju dipolni moment. Hemijske veze koje formiraju ove molekule nazivaju se kovalentne nepolarne veze.
Kosselova teorija je predložen za opisivanje molekula formiranih od aktivnih metala (zemnoalkalijskih i zemnoalkalnih) i aktivnih nemetala (halogeni, kisik, dušik). Vanjski valentni elektroni atoma metala su najudaljeniji od atomskog jezgra i stoga ih atom metala relativno slabo zadržava. Za atome hemijskih elemenata koji se nalaze u istom redu Periodnog sistema, kada se kreću s leva na desno, naelektrisanje jezgra se stalno povećava, a dodatni elektroni se nalaze u istom elektronskom sloju. To dovodi do činjenice da se vanjski omotač elektrona skuplja i da se elektroni sve čvršće drže u atomu. Stoga, u molekuli MeX, postaje moguće premjestiti slabo zadržani vanjski valentni elektron metala uz utrošak energije jednak potencijalu ionizacije u valentnu elektronsku ljusku atoma nemetala uz oslobađanje energije jednako afinitetu elektrona . Kao rezultat, formiraju se dva jona: Me+ i X-. Elektrostatička interakcija ovih jona je hemijska veza. Ova vrsta veze se zove jonski.
Odredimo li dipolne momente MeX molekula u parovima, ispada da se naboj s atoma metala ne prenosi u potpunosti na atom nemetala, a kemijsku vezu u takvim molekulima bolje je opisati kao kovalentnu visokopolarnu vezu. Pozitivni metalni katjoni Me + i negativni anjoni nemetala X- obično postoje na mjestima kristalne rešetke kristala ovih supstanci. Ali u ovom slučaju, svaki pozitivni ion metala prije svega elektrostatički stupa u interakciju s najbližim nemetalnim anionima, zatim s metalnim kationima itd. To jest, u ionskim kristalima, hemijske veze su delokalizovane, i svaki ion na kraju stupa u interakciju sa svim ostalim ionima koji ulaze u kristal, koji je džinovski molekul.
Uz dobro definisane karakteristike atoma, kao što su naboji atomskih jezgara, jonizacioni potencijali, afinitet prema elektronu, u hemiji se koriste i manje definisane karakteristike. Jedna od njih je elektronegativnost. U nauku ga je uveo američki hemičar L. Pauling. Razmotrimo prvo za elemente prva tri perioda podatke o prvom jonizacijskom potencijalu i o afinitetu elektrona.
Pravilnosti u jonizacionim potencijalima i afinitetu elektrona u potpunosti se objašnjavaju strukturom valentnih elektronskih omotača atoma. Elektronski afinitet izolovanog atoma dušika je mnogo manji od atoma alkalnog metala, iako je dušik aktivan nemetal. Upravo u molekulama pri interakciji s atomima drugih kemijskih elemenata dušik dokazuje da je aktivan nemetal. To je L. Pauling pokušao učiniti, uvodeći "elektronegativnost" kao sposobnost atoma hemijskih elemenata da pomjere elektronski par prema sebi tokom formiranja kovalentne polarne veze. L. Pauling je predložio skalu elektronegativnosti za hemijske elemente. Najveću elektronegativnost u proizvoljnim bezdimenzionalnim jedinicama pripisao je fluoru - 4,0, kiseoniku - 3,5, hloru i azotu - 3,0, bromu - 2,8. Priroda promjene elektronegativnosti atoma u potpunosti odgovara zakonima koji su izraženi u Periodnom sistemu. Dakle, upotreba koncepta elektronegativnost„jednostavno prevodi na drugi jezik one obrasce u promjeni svojstava metala i nemetala koji se već odražavaju u Periodnom sistemu.
Mnogi metali u čvrstom stanju su gotovo savršeno formirani kristali.. Na čvorovima kristalne rešetke u kristalu su atomi ili pozitivni ioni metala. Elektroni onih atoma metala od kojih su nastali pozitivni ioni su u obliku elektronskog plina u prostoru između čvorova kristalne rešetke i pripadaju svim atomima i ionima. Oni određuju karakterističan metalni sjaj, visoku električnu provodljivost i toplotnu provodljivost metala. Tip hemijsko povezivanje, koje izvode socijalizovani elektroni u metalnom kristalu, naziva semetalna veza.
Godine 1819. francuski naučnici P. Dulong i A. Petit eksperimentalno su ustanovili da je molarni toplotni kapacitet gotovo svih metala u kristalnom stanju 25 J/mol. Sada možemo lako objasniti zašto je to tako. Atomi metala u čvorovima kristalne rešetke su uvijek u pokretu - oni čine oscilatorna kretanja. Ovo složeno kretanje može se razložiti na tri jednostavna oscilatorna kretanja u tri međusobno okomite ravni. Svako oscilatorno kretanje ima svoju energiju i svoj zakon njene promjene s povećanjem temperature – svoj toplinski kapacitet. Granična vrijednost toplotnog kapaciteta za bilo koje oscilatorno kretanje atoma jednaka je R - univerzalnoj plinskoj konstanti. Tri nezavisna vibracijska kretanja atoma u kristalu će odgovarati toplotnom kapacitetu jednakom 3R. Kada se metali zagrijavaju, počevši od vrlo niskih temperatura, njihov toplinski kapacitet raste od nule. Na sobnim i višim temperaturama, toplinski kapacitet većine metala dostiže svoju maksimalnu vrijednost - 3R.
Kada se zagrije, kristalna rešetka metala se uništava i oni prelaze u rastopljeno stanje. Daljnjim zagrijavanjem metali isparavaju. U parama, mnogi metali postoje kao molekuli Me2. U ovim molekulima, atomi metala mogu formirati kovalentne nepolarne veze.
Fluor je hemijski element (simbol F, atomski broj 9), nemetal koji pripada halogenoj grupi. To je najaktivnija i elektronegativna supstanca. Pri normalnoj temperaturi i pritisku, molekul fluora je blijedožut sa formulom F 2 . Kao i drugi halogenidi, molekularni fluor je veoma opasan i izaziva teške hemijske opekotine u kontaktu sa kožom.
Upotreba
Fluor i njegova jedinjenja se široko koriste, uključujući proizvodnju farmaceutskih proizvoda, agrohemikalija, goriva i maziva, te tekstila. koristi se za jetkanje stakla, dok se fluorova plazma koristi za proizvodnju poluvodiča i drugih materijala. Niske koncentracije F jona u pasti za zube i vodi za piće mogu pomoći u prevenciji karijesa, dok se veće koncentracije nalaze u nekim insekticidima. Mnogi opći anestetici su derivati fluorougljika. Izotop 18 F je izvor pozitrona za medicinsko snimanje pozitronskom emisionom tomografijom, a uran heksafluorid se koristi za odvajanje izotopa uranijuma i proizvodnju za nuklearne elektrane.
Istorija otkrića
Minerali koji sadrže jedinjenja fluora bili su poznati mnogo godina pre izolovanja ovog hemijskog elementa. Na primjer, mineral fluorit (ili fluorit), koji se sastoji od kalcijum fluorida, opisao je 1530. George Agricola. Primijetio je da se može koristiti kao fluks, supstanca koja pomaže u snižavanju tačke topljenja metala ili rude i pomaže u pročišćavanju željenog metala. Stoga je fluor dobio svoje latinsko ime od riječi fluere ("tok").
Godine 1670., stakloduvač Heinrich Schwanhard otkrio je da se staklo gravira djelovanjem kalcijum fluorida (fluoridi) tretiranog kiselinom. Carl Scheele i mnogi kasniji istraživači, uključujući Humphryja Davyja, Josepha-Louisa Gay-Lussaca, Antoinea Lavoisiera, Louis Thénarda, eksperimentirali su s fluorovodoničnom kiselinom (HF), koja se lako dobijala tretiranjem CaF koncentriranom sumpornom kiselinom.
Na kraju je postalo jasno da HF sadrži ranije nepoznati element. Međutim, zbog svoje prevelike reaktivnosti, ova supstanca nije mogla biti izolirana dugi niz godina. Ne samo da se teško odvaja od jedinjenja, već odmah reaguje sa ostalim njihovim komponentama. Izolacija elementarnog fluora iz fluorovodonične kiseline je izuzetno opasna, a rani pokušaji zaslijepili su i ubili nekoliko naučnika. Ovi ljudi su postali poznati kao "fluoridni mučenici".

Otkriće i proizvodnja
Konačno, 1886. godine, francuski hemičar Henri Moissan uspio je izolovati fluor elektrolizom mješavine rastopljenih kalijevih fluorida i fluorovodonične kiseline. Za to je dobio Nobelovu nagradu za hemiju 1906. Njegov elektrolitički pristup i danas se koristi za industrijsku proizvodnju ovog hemijskog elementa.
Prva velika proizvodnja fluora počela je tokom Drugog svetskog rata. To je bilo potrebno za jednu od faza stvaranja atomske bombe u sklopu Manhattan projekta. Fluor je korišten za proizvodnju uranijum heksafluorida (UF 6 ), koji je zauzvrat korišten za razdvajanje dva izotopa 235 U i 238 U. Danas je plinoviti UF 6 potreban za proizvodnju obogaćenog uranijuma za nuklearnu energiju.

Najvažnija svojstva fluora
U periodnom sistemu, element se nalazi na vrhu grupe 17 (ranije grupa 7A), koja se naziva halogen. Ostali halogeni uključuju hlor, brom, jod i astatin. Osim toga, F je u drugom periodu između kisika i neona.
Čisti fluor je korozivni gas (hemijska formula F 2 ) karakterističnog oštrog mirisa koji se nalazi u koncentraciji od 20 nl po litri zapremine. Kao najreaktivniji i najelektronegativniji od svih elemenata, lako stvara spojeve s većinom njih. Fluor je previše reaktivan da bi postojao u svom elementarnom obliku i ima takav afinitet za većinu materijala, uključujući silicijum, da se ne može pripremiti ili čuvati u staklenim posudama. U vlažnom zraku reagira s vodom, stvarajući ništa manje opasnu fluorovodoničnu kiselinu.
Fluor, u interakciji s vodonikom, eksplodira čak i na niskim temperaturama iu mraku. Burno reaguje sa vodom i formira fluorovodoničnu kiselinu i gas kiseonika. Različiti materijali, uključujući fino raspršene metale i stakla, gore jarkim plamenom u mlazu gasovitog fluora. Osim toga, ovaj kemijski element stvara spojeve sa plemenitim plinovima kriptonom, ksenonom i radonom. Međutim, ne reagira direktno s dušikom i kisikom.
Uprkos ekstremnoj aktivnosti fluora, metode za njegovo sigurno rukovanje i transport su sada postale dostupne. Element se može čuvati u čeličnim ili monel (legura bogata niklom) posudama, jer se na površini ovih materijala formiraju fluoridi koji sprečavaju dalju reakciju.
Fluoridi su tvari u kojima je fluor prisutan kao negativno nabijeni ion (F-) u kombinaciji s nekim pozitivno nabijenim elementima. Jedinjenja fluora sa metalima spadaju među najstabilnije soli. Kada se rastvore u vodi, dele se na jone. Drugi oblici fluora su kompleksi kao što su - i H 2 F + .

izotopi
Postoji mnogo izotopa ovog halogena, u rasponu od 14 F do 31 F. Ali izotopski sastav fluora uključuje samo jedan od njih, 19 F, koji sadrži 10 neutrona, jer je jedini stabilan. Radioaktivni izotop 18 F je vrijedan izvor pozitrona.
Biološki uticaj
Fluor se u tijelu uglavnom nalazi u kostima i zubima u obliku jona. Fluorizacija vode za piće u koncentraciji manjoj od jednog dijela na milion značajno smanjuje učestalost karijesa - prema Nacionalnom istraživačkom vijeću Nacionalne akademije nauka Sjedinjenih Država. S druge strane, prekomjerno nakupljanje fluora može dovesti do fluoroze, koja se manifestira išaranim zubima. Ovaj efekat se obično primećuje u područjima gde sadržaj ovog hemijskog elementa u vodi za piće prelazi koncentraciju od 10 ppm.
Elementarni fluor i fluoridne soli su toksični i njima se mora rukovati s velikom pažnjom. Treba pažljivo izbjegavati kontakt s kožom ili očima. Reakcija sa kožom proizvodi koja brzo prodire u tkiva i reaguje sa kalcijumom u kostima, trajno ih oštećujući.

Fluor u okolini
Godišnja svjetska proizvodnja minerala fluorita je oko 4 miliona tona, a ukupan kapacitet istraženih nalazišta je unutar 120 miliona tona.Glavna područja za vađenje ovog minerala su Meksiko, Kina i Zapadna Evropa.
Fluor se prirodno nalazi u zemljinoj kori, gdje se može naći u stijenama, uglju i glini. Fluoridi se oslobađaju u zrak erozijom tla vjetrom. Fluor je 13. najzastupljeniji hemijski element u zemljinoj kori - njegov sadržaj je 950 ppm. U zemljištu, njegova prosječna koncentracija je oko 330 ppm. Vodonik-fluorid se može ispustiti u zrak kao rezultat industrijskih procesa sagorijevanja. Fluoridi koji se nalaze u vazduhu završavaju padanjem na zemlju ili u vodu. Kada fluor formira vezu sa vrlo malim česticama, može ostati u vazduhu duži vremenski period.
U atmosferi je 0,6 milijarditi deo ovog hemijskog elementa prisutno u obliku slane magle i organskih jedinjenja hlora. U urbanim sredinama koncentracija dostiže 50 delova na milijardu.

Veze
Fluor je hemijski element koji formira širok spektar organskih i neorganskih jedinjenja. Hemičari mogu njime zamijeniti atome vodika, stvarajući tako mnoge nove tvari. Visoko reaktivni halogen stvara spojeve s plemenitim plinovima. Godine 1962. Neil Bartlett je sintetizirao ksenon heksafluoroplatinat (XePtF6). Takođe su dobijeni kripton i radon fluoridi. Drugo jedinjenje je argon fluorohidrid, koji je stabilan samo na ekstremno niskim temperaturama.
Industrijska primjena
U atomskom i molekularnom stanju, fluor se koristi za plazma jetkanje u proizvodnji poluprovodnika, ravnih displeja i mikroelektromehaničkih sistema. Fluorovodonična kiselina se koristi za jetkanje stakla u lampama i drugim proizvodima.
Uz neke od svojih spojeva, fluor je važna komponenta u proizvodnji farmaceutskih proizvoda, agrohemikalija, goriva i maziva, te tekstila. Hemijski element je neophodan za proizvodnju halogeniranih alkana (halona), koji su, zauzvrat, bili široko korišteni u sistemima za klimatizaciju i hlađenje. Kasnije je takva upotreba hlorofluorougljika zabranjena jer doprinose uništavanju ozonskog omotača u gornjoj atmosferi.

Sumpor heksafluorid je izuzetno inertan, netoksičan gas klasifikovan kao gas staklene bašte. Bez fluora, proizvodnja plastike niskog trenja kao što je teflon nije moguća. Mnogi anestetici (npr. sevofluran, desfluran i izofluran) su derivati CFC-a. Natrijum heksafluoroaluminat (kriolit) se koristi u elektrolizi aluminijuma.
Jedinjenja fluora, uključujući NaF, koriste se u pastama za zube za sprječavanje karijesa. Ove supstance se dodaju u komunalne vodovode kako bi se obezbijedila fluorizacija vode, međutim ova praksa se smatra kontroverznom zbog uticaja na zdravlje ljudi. U višim koncentracijama, NaF se koristi kao insekticid, posebno za suzbijanje žohara.
U prošlosti su se fluoridi koristili za smanjenje ruda i povećanje njihove fluidnosti. Fluor je važna komponenta u proizvodnji uranijum heksafluorida, koji se koristi za odvajanje njegovih izotopa. 18 F, radioaktivni izotop sa 110 minuta, emituje pozitrone i često se koristi u medicinskoj pozitronskoj emisionoj tomografiji.
Fizička svojstva fluora
Osnovne karakteristike hemijskog elementa su sledeće:
- Atomska masa 18,9984032 g/mol.
- Elektronska konfiguracija 1s 2 2s 2 2p 5 .
- Oksidacijsko stanje je -1.
- Gustina 1,7 g/l.
- Tačka topljenja 53,53 K.
- Tačka ključanja 85,03 K.
- Toplotni kapacitet 31,34 J/(K mol).
Hemijske čestice nastale od dva ili više atoma nazivaju se molekule(stvarno ili uslovno jedinice formule poliatomske supstance). Atomi u molekulima su hemijski vezani.
Hemijska veza je električna sila privlačenja koja drži čestice zajedno. Svaka hemijska veza u strukturne formule izgleda valentna linija, Na primjer:
H - H (veza između dva atoma vodonika);
H 3 N - H + (veza između atoma dušika molekule amonijaka i vodonikovog kationa);
(K +) - (I -) (veza između kalijum katjona i jodidnog jona).
Hemijsku vezu formira par elektrona (), koji se u elektronskim formulama složenih čestica (molekula, kompleksnih jona) obično zamjenjuje valentnom linijom, za razliku od njihovih vlastitih, nepodijeljenih elektronskih parova atoma, na primjer:
Hemijska veza se naziva kovalentno, ako nastane socijalizacijom para elektrona od strane oba atoma.
U molekuli F 2 oba atoma fluora imaju istu elektronegativnost, pa im je posedovanje elektronskog para isto. Takva hemijska veza se naziva nepolarna, jer ima svaki atom fluora elektronska gustina isto u elektronska formula molekule se mogu uslovno podijeliti između njih podjednako:
U molekulu HCl, hemijska veza već postoji polarni, budući da je elektronska gustina na atomu hlora (element sa većom elektronegativnošću) mnogo veća nego na atomu vodika:
Kovalentna veza, na primjer H - H, može se formirati dijeljenjem elektrona dva neutralna atoma:
H + H > H – H
Ovaj mehanizam vezivanja se zove razmjena ili ekvivalentno.
Prema drugom mehanizmu, ista kovalentna veza H - H nastaje kada je elektronski par hidridnog jona H socijalizovan od strane vodikovog katjona H +:
H + + (:H) - > H - H
H + kation u ovom slučaju se zove akceptor i anjon H - donator elektronski par. Mehanizam formiranja kovalentne veze u ovom slučaju će biti donor-akceptor, ili koordiniranje.
Jednostruke veze (H - H, F - F, H - CI, H - N) nazivaju se a-linkovi, oni određuju geometrijski oblik molekula.
Dvostruke i trostruke veze () sadrže jednu?-komponentu i jednu ili dvije?-komponente; ?-komponenta, koja je glavna i uslovno formirana prva, uvijek je jača od?-komponente.
Fizičke (zapravo mjerljive) karakteristike hemijske veze su njena energija, dužina i polaritet.
Energija hemijske veze (E cv) je toplota koja se oslobađa tokom formiranja ove veze i troši se na njeno raskidanje. Za iste atome, jednostruka veza je uvijek slabiji nego višestruki (dvostruki, trostruki).
Dužina hemijske veze (l s) - međunuklearna udaljenost. Za iste atome, jednostruka veza je uvijek duže nego višestruka.
Polaritet komunikacija se mjeri električni dipolni moment str- proizvod stvarnog električnog naboja (na atomima date veze) dužine dipola (tj. dužine veze). Što je veći dipolni moment, veći je polaritet veze. Stvarni električni naboji atoma u kovalentnoj vezi su uvijek manje vrijednosti od oksidacijskih stanja elemenata, ali se poklapaju u predznaku; na primjer, za H + I -Cl -I vezu, pravi naboji su H +0 "17 -Cl -0" 17 (bipolarna čestica ili dipol).
Polaritet molekula određena njihovim sastavom i geometrijskim oblikom.
Nepolarni (p = O) bice:
a) molekule jednostavno tvari, jer sadrže samo nepolarne kovalentne veze;
b) poliatomski molekule kompleks tvari, ako je njihov geometrijski oblik simetrično.
Na primjer, molekule CO 2, BF 3 i CH 4 imaju sljedeće smjerove vektora jednakih (dužnih) veza:

Kada se dodaju vektori veze, njihov zbir uvijek nestaje, a molekuli kao cjelina su nepolarni, iako sadrže polarne veze.
Polar (str> O) bit će:
A) dijatomski molekule kompleks tvari, jer sadrže samo polarne veze;
b) poliatomski molekule kompleks tvari, ako je njihova struktura asimetrično, odnosno njihov geometrijski oblik je ili nepotpun ili izobličen, što dovodi do pojave totalnog električnog dipola, na primjer, u molekulima NH 3, H 2 O, HNO 3 i HCN.
Kompleksni joni, kao što su NH 4 + , SO 4 2- i NO 3 - , u principu ne mogu biti dipoli, oni nose samo jedno (pozitivno ili negativno) naelektrisanje.
Jonska veza nastaje tokom elektrostatičkog privlačenja kationa i anjona bez gotovo socijalizacije para elektrona, na primjer, između K + i I -. Atom kalija ima nedostatak elektronske gustine, atom joda ima višak. Ova veza se razmatra ograničavajući slučaju kovalentne veze, pošto je par elektrona praktično u posedu anjona. Takva veza je najtipičnija za spojeve tipičnih metala i nemetala (CsF, NaBr, CaO, K 2 S, Li 3 N) i tvari klase soli (NaNO 3, K 2 SO 4, CaCO 3). Sva ova jedinjenja u sobnim uslovima su kristalne supstance, koje su ujedinjene zajedničkim imenom jonski kristali(kristali izgrađeni od kationa i anjona).
Postoji još jedna vrsta veze koja se zove metalna veza, u kojoj su valentni elektroni toliko labavo držani atomima metala da zapravo ne pripadaju određenim atomima.
Atomi metala, koji su ostali bez vanjskih elektrona koji im jasno pripadaju, postaju, takoreći, pozitivni ioni. Oni se formiraju metalna kristalna rešetka. Skup socijaliziranih valentnih elektrona ( elektronski gas) drži pozitivne ione metala zajedno i na određenim mjestima rešetke.
Pored jonskih i metalnih kristala, postoje i kristali atomski I molekularni kristalne supstance, na čijim mestima se nalaze atomi, odnosno molekuli. Primjeri: dijamant i grafit - kristali s atomskom rešetkom, jod I 2 i ugljični dioksid CO 2 (suhi led) - kristali s molekularnom rešetkom.
Hemijske veze postoje ne samo unutar molekula tvari, već se mogu formirati i između molekula, na primjer, za tekući HF, vodu H 2 O i mješavinu H 2 O + NH 3:

vodoničnu vezu nastaje zbog sila elektrostatičkog privlačenja polarnih molekula koje sadrže atome najelektronegativnijih elemenata - F, O, N. Na primjer, vodikove veze su prisutne u HF, H 2 O i NH 3, ali ih nema u HCl, H 2 S i PH 3.
Vodikove veze su nestabilne i prilično lako pucaju, na primjer, kada se led otopi i voda proključa. Međutim, na razbijanje ovih veza troši se nešto dodatne energije, a samim tim i tačke topljenja (tabela 5) i tačke ključanja supstanci sa vodikovim vezama

(na primjer, HF i H 2 O) su znatno veće nego za slične tvari, ali bez vodikovih veza (na primjer, HCl i H 2 S).
Mnoga organska jedinjenja takođe formiraju vodonične veze; Vodikova veza igra važnu ulogu u biološkim procesima.
Primjeri zadataka dijela A1. Supstance sa samo kovalentnim vezama su
1) SiH 4, Cl 2 O, CaBr 2
2) NF 3, NH 4 Cl, P 2 O 5
3) CH 4 , HNO 3 , Na(CH 3 O)
4) CCl 2 O, I 2, N 2 O
2–4. kovalentna veza
2. samac
3. duplo
4. trostruko
prisutan u materiji
5. Višestruke veze su prisutne u molekulima
6. Čestice koje se nazivaju radikali su
7. Jednu od veza formira mehanizam donor-akceptor u setu jona
1) SO 4 2-, NH 4 +
2) H 3 O +, NH 4 +
3) PO 4 3-, NO 3 -
4) PH 4 + , SO 3 2-
8. Najizdržljiviji I kratko veza - u molekulu
9. Supstance samo sa jonskim vezama - u kompletu
2) NH 4 Cl, SiCl 4
10–13. Kristalna rešetka materije
13. Va (OH) 2
1) metal