Termodünaamiliste funktsioonide muutumine adsorptsiooni ajal. Adsorptsiooniprotsesside termodünaamika. Adsorptsiooniprotsesside riistvarakujundus
Adsorptsioon(ladina keelest ad - on, at ja sorbeo - I absorben), aine kontsentratsiooni muutus (tavaliselt - suurenemine) liidese lähedal ("absorptsioon pinnal"). Põhjus adsorptsioon- pinnalähedaste molekulidevaheliste sidemete küllastumatus, s.t. adsorptsiooni olemasolu jõuväli. Keha, mis sellise välja tekitab, nimetatakse adsorbendiks, ainet, mille molekule saab adsorbeerida, adsorbaadiks ja juba adsorbeerunud ainet adsorbaadiks. Protsess vastupidine adsorptsioon nimetatakse desorptsiooniks.
Adsorptsioonivälja olemus on erinev. Kui adsorptsioon on seotud van der Waalsi sidemetega, siis adsorptsioon nimetatakse füüsiliseks. Kui need on valentssidemed, st. adsorptsioon möödub pinna moodustumisega keemilised ühendid, See adsorptsioon nimetatakse kemikaaliks kemisorptsioon. Olulised omadused kemisorptsioon näitab: pöördumatus, kõrged termilised mõjud (sadu kJ / mol), aktiveeritud iseloom. Vahepealseid liike on palju adsorptsioon füüsikalise ja keemilise vahel adsorptsioon. Näiteks, adsorptsioon põhjustatud vesiniksidemete moodustumisest. Võimalik ka erinevad tüübid füüsiline adsorptsioon. Dispersioonide molekulidevahelised tõmbejõud on kõige levinumad, kuna need on mis tahes keemilise pinnaga (mittespetsiifilise) pinnaga adsorbentide puhul ligikaudu konstantsed adsorptsioon). Füüsiline adsorptsioon võivad olla põhjustatud elektrostaatilisest jõududest (ioonide, dipoolide või kvadrupoolide vastastikmõju); kus adsorptsioon määrab adsorptsiooni molekulide keemiline olemus (nn spetsiifiline adsorptsioon). Olulist rolli mängib ka liidese geomeetria. kui pind on tasane, siis on adsorptsioon avatud pind, kergelt või tugevalt kaarduva pinna korral - umbes adsorptsioon adsorbendi poorides.
Teoorias adsorptsioon Eristada staatika (adsorbent-adsorbaadi süsteem on termodünaamilises tasakaalus) ja kineetika (tasakaal puudub).
Adsorptsiooni staatika
Adsorptsiooni termodünaamika
.Termodünaamika alused adsorptsioon lõi J. Gibbs 70ndatel. 19. sajand Gibbsi sõnul on liidese lähedal asuvas tasakaalus kahefaasilises süsteemis kõigi ulatuslike omaduste (välja arvatud maht) kohalikes väärtustes mõningane muutus. Siiski peetakse faase homogeenseks kuni neid eraldava geomeetrilise pinnani. Seetõttu ei ole ühegi ulatusliku omaduse väärtus süsteemi kui terviku jaoks võrdne selle omaduse väärtuste summaga homogeensetes faasides ja . Erinevus on tingitud eralduspinnaga seotud kahemõõtmelisest pinnafaasist. Sest pinnafaasil pole siis paksust V0=+ ja =-, kus V- maht.
Esitatud esitused võimaldavad meil taandada termodünaamilise põhivõrrandi kujule:
kus G on Gibbsi vaba energia, S on entroopia, liidese pinge, s on liidese pindala ja n i- vastav keemiline potentsiaal ja moolide arv i- see komponent. Indeks näitab vastava omaduse väärtust pinnafaasis. Legendre'i teisendus võimaldab võrrandit (1) muuta isotermiliste tingimuste jaoks:
Kogust nimetatakse Gibbsiks adsorptsioon ja seda tähistatakse sümboliga G, (väljendatud mol / cm 2). Kahekomponendilise süsteemi jaoks:
Jaotuspinna asukohta saab valida meelevaldselt. Eelkõige võib selle sätte valik rahuldada tingimust Г 1 =0. Sellist pinda nimetatakse ekvimolekulaarseks. Selle jaoks võetakse kasutusele tähis Г 2 = Г 2 (1). See tähendab peamist Gibbsi adsorptsioonivõrrandit:
Kui adsorbent on ühes kahest faasist täielikult lahustumatu, =const ja üleminek võrrandist (2) võrrandisse (3) ei nõua tingimust Г 1 =0. Seega Gibbid adsorptsioon on selle komponendi liig reaalses kahefaasilises süsteemis võrreldes sellise süsteemiga, kus mõlemad faasid oleksid kuni eralduspinnani rangelt homogeensed. Lisaks Gibbsi liigsetele kogustele adsorptsioon, mängib tema teoorias olulist rolli adsorptsioon, mida mõistetakse komponendi täieliku sisuna i kosmoses W, millel on adsorptsioonijõud. Täieliku sisu tähistamine läbi A ja eeldades, et komponent iühes põhifaasis täielikult lahustumatud, on meil:
kus c i- keskendumine i-th komponent hulgifaasis. Väikeste s i:
Adsorptsioon võib esineda mis tahes kahe faasi vahelisel mis tahes liidesel, eelkõige vedelik-vedelik (vedelik-gaas, vedelik-vedelik) või tahke-gaas (tahke-gaas, tahke-vedelik) liideses. Vedelik-vedelik süsteemides saab α mõõta funktsioonina ja võrrandi (3) abil eksperimentaalselt määrata Г 2 (1). Teisel juhul mõõdetakse G 2 (1) määramiseks mis tahes meetodiga n i 0 , ja i-nda komponendi kontsentratsioonid nendes ruumalades. Siit arvutatakse G i(1) . Seda meetodit nimetatakse mahuliseks (või volumetriliseks). Kaalu (gravimeetrilise) meetodiga määratakse kogus otse i- liidese komponent.
Adsorptsiooni isoterm
.Tasakaalulises adsorptsioonisüsteemis on tasakaalu määravad parameetrid a i osalised rõhud R(või koos i) ja temperatuuri T. Need on seotud niinimetatud termilise võrrandiga:
Kell adsorptsioon individuaalne adsorbent ( i=1) see võrrand on järgmisel kujul:
Kolm erijuhtu termiline võrrand(Millal T, r või a- konstandid) mängivad teoorias erilist rolli adsorptsioon:
a=- isotermi võrrand adsorptsioon,
T=- isobaari võrrand adsorptsioon,
R-- isosteeri võrrand adsorptsioon.
Funktsioonide spetsiifiline tüüp ja selle määravad vaadeldava süsteemi omadused. Kui üks neist on näiteks tuntud mõne väärtuse poolest T= const, siis ilmselgelt saavad teatavaks ka teised kaks. Sel juhul ei pea olema teada sõltuvuste analüütilist vormi. Neid saab empiiriliselt anda väärtuste kogumina a, r Ja T.
Teoorias adsorptsioon tavaliselt on küsimus funktsiooni vormis A=(p)r, st. isotermi võrrandi kohta adsorptsioon. See probleem on seotud kaasnevate termiliste mõjudega adsorptsioon. Peamiste termodünaamiliste funktsioonide väärtuste muutuse arvutamisel ülemineku korral dn mooli adsorptiivset ainet massifaasist pinnafaasi tasakaalusüsteemis at p = const, on võimalikud kaks juhtumit: esimesel juhul võetakse arvesse ainult adsorbaadi muutumist adsorbaadiks, kuna adsorbent adsorptsioon termodünaamiliselt muutumatu ja selle roll on olla adsorptsioonivälja allikas; teises võetakse arvesse ka adsorbendi muutust.
Kuna süsteem on tasakaalus, on adsorbaadi ja adsorbaadi keemilised potentsiaalid samad; adsorbatsiooni entroopia, mis on tingitud molekulide liikuvuse vähenemisest at adsorptsioon väiksem kui adsorptsiooni entroopia. Seetõttu on inertse adsorbendi puhul entalpia alati negatiivne, s.t. adsorptsioon eksotermiline. Adsorbendi entroopia muutuse arvessevõtmine võib seda järeldust muuta. Näiteks polümeeride poolt ainete sorptsiooni käigus, milles polümeer pundub, võib viimaste entroopia (makromolekulide liikuvuse suurenemise tõttu) nii tugevasti suureneda, et adsorptsioon muutub endotermiliseks. Järgnevalt ainult eksotermiline adsorptsioon.
Eristada integraal-, diferentsiaal-, isosteerilist ja keskmist soojust adsorptsioon. integraalne soojus K võrdne entalpia kaotusega (at V= const - pidev siseenergia) muutmisel adsorptsioon alates a 1 enne a 2(konkreetsel juhul võib see olla 1 \u003d 0): Q \u003d - (H 2 - H 1). Seda väärtust nimetatakse tavaliselt adsorbendi massiks ja seda väljendatakse J/kg.
Diferentsiaalsoojus q(J / mol) on võrdne entalpia kaoga dH kui see muutub A peal da. Seda väljendab suhtumine q = - (dH/da). See on ilmne
Isosteeriline soojus q st on võrdne:
kus on adsorbaadi ja adsorbaadi molaarmahtude vahe. Seda saab näidata  ideaalse gaasiadsorbendi jaoks:
ideaalse gaasiadsorbendi jaoks:
Sissejuhatuse tähendus qsi kuna selle määramine ei nõua kalorimeetrilisi andmeid (nt K Ja q) ja seda saab mõõtmistulemuste põhjal arvutada võrrandi (9) abil adsorptsioon. Tutvustame ka keskmist kuumust K(J/mol):
Kasvamisega A parameeter K alati suureneb, a q võib väheneda, suureneda või jääda muutumatuks. Kasvamisega A ebaühtlase pinnaga adsorptsioon esineb üha vähem aktiivsetes piirkondades, mis viib vähenemiseni q. Sel juhul aga adsorbeerunud molekulide vahelised keskmised kaugused vähenevad, mille tulemusena suurenevad nendevahelised tõmbejõud ja q suureneb. Kahe nimetatud mõju suhe määrab sõltuvuse kulgemise q=f(a). Väga suurelt A tõrjuvad jõud hakkavad domineerima ka selles piirkonnas. q väheneb alati koos kasvuga a.
Väga väikeste pinnakatete korral isotermi võrrand adsorptsioon on Henry võrrandi kujuga:
kus K H on Henry koefitsient. Tõepoolest, väga väikesele A Adsorptsioonikiht on sarnane kahemõõtmelise ideaalgaasiga, seega on selle olekuvõrrand: rt, kus on kahemõõtmeline rõhk, on pindala, mille hõivab üks mool ainet. Seega, võttes arvesse, et =- ja kasutades võrrandit (3), saame võrrandi (12). Henry võrrand nõuab seda q oli pidev. Suurte täidiste puhul see võrrand enam ei kehti. Seetõttu tegi G. Freindlich (1906) ettepaneku kirjeldada isoterme adsorptsioon järgmine empiiriline võrrand (Freundlichi võrrand):
Kus k Ja n- konstandid. Seda võrrandit kasutatakse sageli interpolatsioonivalemina, kuigi väikese puhul R ei lähe võrrandisse (12) ja väga suures plaanis R toob kaasa piiramatu kasvu, mis on vastuolus kogemustega A.
Range isotermiteooria adsorptsioon lõi I. Langmuir (1914-18). Teooria põhineb järgneval. mudel: 1) adsorbendi pind on energeetiliselt identsete aktiivtsentrite kogum, millele adsorbeeritakse (lokaliseeritakse) adsorbaadi molekulid; 2) ühel tsentril on adsorbeerunud ainult üks molekul; juures adsorptsioon moodustub ainult üks adsorptsioon. kiht (ühekihiline); 3) adsorptsioon sellel keskusel ei mõjuta adsorptsioon teistel keskustel, st interaktsioonil. adsorbeeritud molekule võib tähelepanuta jätta.
Langmuiri modell helistas. lokaliseeritud monomolekulaarne adsorptsioonühtlasel pinnal. isotermi võrrand adsorptsioon võib-olla vastavad sellele mudelile. abil saadud meetodid (molekulaar-kineetilised, termodünaamilised, statistilised-termodünaamilised). Niisiis, adsorptsioon tasakaalu saab väljendada järgmiselt. skeem:
Molekulivaba. Adsorptsioon gaasis + adsorptsioon. keerulise faasi keskus (hõivatud keskus)
Molekulide kontsentratsioon gaasis on võrdeline p-ga, vabade molekulide kontsentratsiooniga. tsentrite väärtus ( a t - a), Kus ja t - keskuste koguarv, hõivatud keskuste arv, adsorptsiooni kontsentratsioon. kompleksid-väärtus adsorptsioon Seetõttu on tasakaalukonstant: K p \u003d p (a t - A)/ adsorptsioon Siit saame Langmuiri võrrandi:
Kus b-T. helistas adsorptsioon koefitsient võrdne K p -1. Väga madala rõhu piirkonnas bp" 1 ja a = (a m b)p, mis vastab Henry võrrandile, milles KH= a m b. Väga kõrge rõhu piirkonnas br 1 ja aa t; kus adsorptsioon ei sõltu enam survest. Tasakaalukonstant b-1 on seotud reaktsiooni isobaarilise potentsiaali standardväärtusega:
Langmuiri mudel nõuab, et diff. soojus ja entroopia adsorptsioon ei sõltunud pinna täituvuse astmest.
võrrand (14) on range avaldis, mis vastab Langmuiri mudelile, kuid praktikas on see harva õigustatud, kuna mudel ise on idealiseeritud adsorptsioonÕpetus adsorptsioon 20ndatest 20. sajandil vahendites. kraad ehitati ühe või teise Langmuiri oletuse nõrgenemise või kõrvaldamise alusel adsorptsioon
Langmuir on juba pakkunud välja kirjeldusviisi adsorptsioon ebahomogeensel pinnal (st eeldusel, et kõik keskused pole ühesugused). Kombineerides identsed keskused rühmadesse ja eeldades, et võrrand (14) kehtib iga rühma kohta, võime eeldada, et adsorptsioon kogu pinna ulatuses väljendatakse võrrandi (14) liikmete summaga:
Eeldusel, et adsorptsiooni arv keskused võivad olla mida kirjeldab vaba väärtuste jaotuse pidev funktsioon. energia, Ya.B. Zel'dovich sai valemist (16) eksponentsiaalfunktsiooni jaoks võrrandi (13) tüüpi.
adsorptsioon ebahomogeensetel pindadel – suur teooria peatükk adsorptsioon Tema peamine integraalvõrrandi ülesanne-lahendus:
Kus f(lk) - nn. empiiriline isoterm adsorptsioon, -see või mõni muu f-funktsioon tsentrite arvu jaotusest vabade väärtuste järgi. energiat,( b, p)- lokaalne isoterm adsorptsioon, mida tavaliselt peetakse Langmuiri isotermiks adsorptsioon
Langmuiri teist oletust on tehtud palju katseid ümber lükata. adsorptsioon Sellel teel polümolekulaarse teooria adsorptsioon, pakkusid välja S. Brunauer, P. Emmet ja E. Teller (BET teooria). Teooria eeldab, et kriitilisest temperatuurist madalamal temperatuuril adsorbeerub iga molekul esimesse kihti (adsorptsioonisoojus qi,), on teise kihi moodustavate molekulide keskus jne. Eeldatakse, et kuumus adsorptsioon kõikides kihtides, välja arvatud esimene, on võrdne kondensatsioonisoojuse. See mudel annab võrrandi:
Kus c = exp[(q 1 -)/RT]. võrrand (18) koordinaatides a, p/p s vastab S-kõverale. Koordinaatides p/p s ,
isoterm adsorptsioon võrrandi (18) kohaselt peaks olema lineaarne. Selle sirge kalle (tavaliselt vahemikus 0,05 p/p s 0,30) ja selle poolt ära lõigatud lõik y-teljel annavad väärtused vastavalt. a t Ja Koos. BET-teooria laialdane kasutamine on tingitud asjaolust, et selle autorid kaaluvad tegelikult adsorptsioon lokaliseerimata, tuvastage konstant a t mitte diskreetsete adsorbentide arvuga. keskused, kuid adsorbaadi molekulide arv esimeses kihis lähimas tihendis (at R= ps). Seetõttu, tutvustades ideed selle kihi ühe molekuli poolt hõivatud ala kohta, nõustume:
Kus s- adsorbeerida pindala adsorptsioon Reeglina mõõdetakse selleks isotermi adsorptsioon lämmastikku ja võta see selle molekuli jaoks = 0,162 nm 2. Tavaliselt tehtud sarnane arvutus s Langmuiri mudeli järgi ei ole õige, sest see meetod kehtib ilmselgelt ainult lokaliseerimata puhul adsorptsioon
polümolekulaarsete teoorias adsorptsioon suure panuse andis J. de Boer, kes näitas eksperimentaalselt, et keskmise kihtide arvu (rohkem kui esimene) sõltuvus kõikidest pindadest on keemiliselt lähedal. loodus, alates p/p s väljendatakse universaalse kõveraga (nn t-kõver). Samuti võimaldab see hinnata adsorbentide pindalasid.
Langmuiri mudelis püüti arvestada ka interaktsiooni. adsorberite vahel. molekulid. Niisiis, T. Hill ja J. de Boer, uskudes, et adsorptsiooni oleku võrrand. kiht on van der Waalsi võrrandi kahemõõtmeline analoog, oleme saanud järgmise. isotermi võrrand adsorptsioon:
kus = a/a t, a ja van der Waalsi võrrandi b konstandid adsorptsioon R. Fowler ja E. Guggenheim, võttes arvesse interaktsiooni. adsorber molekulid, tuletati võrrand:
kus on konstant, mis on seotud molekulide paarilise interaktsiooniga.
On veel üks mehhanism, mis viib täiendavale adsorptsioon adsorbendid alla nende kriitilise taseme. temperatuur poorsetel adsorbentidel suhteliselt kõrgetel väärtustel p/p s . See on kapillaarkondensatsioon. Kui poori moodustub nõgus adsorbeeritud menisk, algab kondenseerumine selles p/p s Kelvini võrrandi järgi:
kus on adsorbaadi pindpinevus, V - tema molaarmaht, meniski r-kõverusraadius adsorptsioon Kapillaarkondensatsioon põhjustab isotermi järsu tõusu adsorptsioon Sellisel juhul jälgitakse sageli (kuid mitte alati) nn. adsorptsioon hüsterees, st. adsorptsiooni mittevastavus. ja desorbeerib. isotermi harud. Reeglina on see tingitud asjaolust, et meniski kuju juures adsorptsioon ja desorptsioon ei sobi.
Adsorbendi pooride suuruse määramiseks kasutatakse kapillaarkondensatsiooni adsorptsioon Vastavalt võrrandile (22) iga väärtuse jaoks p/p s arvutada meniski kõverusraadius adsorptsioon Sellest, arvestades adsorptsiooni paksust. kiht (nt piki t-kõverat), üleminekupiirkonna kuju kihist meniskile ja sõltuvus kõverusest väga väikese r juures , leida antud hetkel täidetud pooride lineaarne suurus (efektiivne raadius r ef). p/p s . Selliste pooride mahu määrab kasv adsorptsioon siinkohal isotermil. Saadud andmete põhjal koostatakse pooride mahu jaotuskõver piki nende raadiusi. Meetod on rakendatav r ef 1,5 nm juures. Tavaliselt tehakse arvutus desorptsiooni teel. isotermi harud, kuid rangemad kaasaegsed. teooria nõuab, et kõvera koostamisel tuleb arvesse võtta mõlemat haru.
Adsorptsiooni potentsiaaliteooria ja mikropooride mahulise täitmise teooria. Mudel adsorptsioon, mis erineb põhimõtteliselt Langmuiri omast, pakkus välja 1914. aastal M. Polyaki. Selle mudeli kohaselt on adsorbendi pinna lähedal potentsiaalne adsorptsioon. jõuväli, mis väheneb koos kaugusega pinnast. Selle tulemusena suureneb adsorptsiooni rõhk, mis on võrdne p-ga pinnast kaugemal, selle lähedal ja jõuab teatud kaugusel väärtuseni p s, mille juures adsorptiivne aine kondenseerub. Liidese ja geomeetri vahelise kihi maht. punktide koht, kus p = p s , täidetud vedelikuga, mis on omistatud füüsikaliste normaalväärtustele. puistevedelike omadused. Pööratav isotermiline töö ja adsorptsioon. jõud, mis on määratud võrrandiga = RTlnp / p s, kutsutakse. adsorptsioon potentsiaal ja kogu kontseptsioon on potentsiaalse teooria adsorptsioon Teatud mahu jaoks V adsorptsioon kiht on potentsiaal sõltuv temperatuurist (tänu dispersioonijõudude sõltumatusele temperatuurist). See temperatuurimuutus võimaldab ümber arvutada adsorptsioonühest t-ryst teise, kuigi isotermi võrrandid adsorptsioon väljatoodud teooria põhjal ei olnud võimalik järeldada. Polyani mudelit on laialdaselt ja edukalt kasutanud paljud. autorite sõnul sisaldas see aga kahte väga haavatavat sätet: 1) eeldus, et parim adsorptsioon. filmil on normaalsed füüsilised väärtused. lahtise vedeliku omadused (seda eeldust katsed ei kinnitanud); 2) funktsiooni temperatuurimuutus =f(V), Teooria aluseks olevad tulemused kinnitati ligikaudu katsega ainult väga peeneks poorsete adsorbentide puhul.
Kasutades potentsiaalset teooriat, M.M. Dubinin pakkus välja ja arendas välja mikropooride mahulise täitmise teooria (TOZM). On oletatud, et see teooria kehtib ainult mikropoorsete adsorbentide kohta. Selliste adsorbentide omadus, mille puhul pooride lineaarsed mõõtmed on r1 nm, on see, et kogu nende pooride maht on adsorbentidega "täidetud". valdkonnas. Seetõttu, millal adsorptsioon neid ei täideta kihtidena, vaid mahuliselt. Vaadeldaval juhul ei ole väärtus adsorptsioon. potentsiaali ja kuni kemikaali märgini. adsorbatsioonipotentsiaal, mõõdetuna kemikaali tasemest. normaalse vedeliku potentsiaal samal temperatuuril. Kogu adsorbeerivate pooride komplekt on jagatud kolme klassi: mikropoorid ( r 0,6 nm), mesopoorid (0,6-20 nm) ja makropoorid ( r 20 nm). adsorptsioon mikropoorides toimub TOZM skeemi järgi, st. mahuliselt, mesopoorides - vastavalt kihtide kaupa täitmise mehhanismile, mis on lõpetatud kapillaarkondensatsiooniga. Makropoorid adsorptsiooni ajal. tasakaal ei mängi mingit rolli.
Tutvustame pooride mahtude f-tsii jaotuse kontseptsiooni kemikaalide väärtustel. adsorbeerida neis potentsiaali, M.M. Dubinin ja L. V. Raduškevitš said TOZM-i adsorptsiooniisotermi võrrandi, mis tavaliselt kirjutatakse järgnevalt. vorm:

Kus n, E ja 0 -parameetrid ( a 0 = a juures p = ps). Sõltuvus temperatuurist a 0:
kus = -(dao/dT); a 0 0 = a 0 at T \u003d T 0. Valikud P Ja E temperatuurist praktiliselt sõltumatu. Enamikel juhtudel P= 2. Ainult juhtudel, kui esialgne kuumeneb adsorptsioon väga suur n > 2. Isotermide ümberarvutamiseks adsorptsioonühest adsorptsiooniainest teise, eeldatakse ligikaudu, et E 1 /E 2 P 1 /P= ja et a 01 /a 02 V 1 /V 2, kus P i- langevarjur, Vi- adsorbendi molaarmaht adsorptsioon
Iga mikropoorset adsorbenti iseloomustatakse vastavalt TOZM-ile kahe parameetriga: W- mikropooride maht ( W 0 = = a 0 V 0) ja E 0 -karakteristikud. energia; W0 ja E 0 tähistavad standardset adsorbenti, tavaliselt benseeni.
Kasutades arusaama, et tõelises adsorbendis on erineva suurusega poorid, ja tutvustades väärtuste jaotust E s dispersioon, mis on võrdne F. Stekliga, pakkus välja võrrandi (23) üldistuse, mida nimetatakse Dubinini-Stöckli võrrandiks:

Kus B0- konstant seotud E võrrandis (23) ja y= ![]() . Sest adsorptsioonis naibi tehnika. laialt levisid mikropoorsed adsorbendid (aktiivsöed, tseoliidid, peeneks poorsed kserogeelid), TOZM-i kasutatakse mitte ainult füüsikalistes ja keemilistes. teadusuuringutes, aga ka inseneriarvutustes.
. Sest adsorptsioonis naibi tehnika. laialt levisid mikropoorsed adsorbendid (aktiivsöed, tseoliidid, peeneks poorsed kserogeelid), TOZM-i kasutatakse mitte ainult füüsikalistes ja keemilistes. teadusuuringutes, aga ka inseneriarvutustes.
Gaasi ja vedeliku segude adsorptsioon. Praktikas tegelevad nad alati mitte üksiku adsorbendi, vaid gaaside või vedelate lahuste seguga. Seetõttu on vaja teooriat üldistada adsorptsioon mitmekomponendilise adsorptsiooni puhul adsorptsioon Põhimõtteliselt võib alustada mis tahes mudelist adsorptsioon ja laiendada seda antud juhtumile. Kell adsorptsioon gaasisegu, see saavutatakse mitte ainult võrrandite suurema komplitseerimisega, vaid ka nende täienduste sisseviimisega. empiiriline interaktsiooniga seotud või sellega seotud parameetrid. heterogeensed molekulid või üldisemalt mõne in-in mõjuga koefitsiendile. teiste tegevust. Ainult Langmuiri mudel võimaldab saada isotermi võrrandit adsorptsioon parameetriteta segud, mis ei sisaldu võrrandites adsorptsioon individuaalne in-in. Selleks piisab, kui arvestada, et segust k-nda komponendi adsorptsiooni käigus i adsorptsiooni osad. keskused võivad olla hõivatud teiste molekulidega. Sellepärast:
Millal adsorptsioon vedelad lahused, sõltumata nende kontsentratsioonist, on adsorbendi kogu pind täidetud adsorptsioon Järelikult adsorptsioon k-nda komponendi molekulidega kaasneb teatud arvu ülejäänud komponentide molekulide väljatõrjumine, s.o. adsorptsioon on konkurentsivõimeline.
Eristage molekulaarset ja ioonilist adsorptsioon lahendusi. Esimene tekib siis, kui adsorptsioon mitteelektrolüütide lahused, teine elektrolüütide lahus. Molekulaarne adsorptsioon on tavaliselt väljendatud üleliigsed väärtused. Konkurentsivõimeline iseloom adsorptsioon põhjustab väärtust A m.b. nii positiivseid kui negatiivseid. väljendades adsorptsioon i-selle komponendi f-ioonina selle mooliosast lahuses x i-, meil on see G i= O punktis x i= 0 ja x i = 1 (võimalik muutus adsorptsioonis oleva aine maht. kiht on tähelepanuta jäetud). Seetõttu isoterm adsorptsioon on üks või mitu äärmused.
isotermi võrrand adsorptsioon Mitteelektrolüütide kahekomponentsed lahused, mis on usaldusväärselt põhjendatud termodünaamiliselt, on kujul:

kus indeks s näitab adsorptsiooni. faas, - ( dn s 2 / dn s 1) näitab, mitu mooli teist komponenti tõrjub üks mool esimesest välja, mis tähendab erinevust kemikaali terminite (standardosade) vahel. potentsiaal, mis sõltub ainult temperatuurist.
Peamine selle ja mitmete teiste isotermvõrrandite kasutamise probleem adsorptsioon-koefitsiendi sõltuvuse määramine. komponentide aktiivsus adsorptsioonis. kiht selle koostisest adsorptsioon Rakenduse kõige olulisem küsimus adsorptsioon ainete eraldamiseks või puhastamiseks - selle komponentlahuse suhtes selektiivse adsorbendi valimine adsorptsioon
Iooniline adsorptsioon, reeglina ei ole samaväärne adsorptsioon Preim adsorbeeritakse pinnale elektrolüüdi lahusest. katioonid või anioonid. Tänu elektrile (Coulombi) jõud pinnale tekivad elektriline kahekordne kiht.
Kui adsorbent sisaldab ioone või pinnafunktsiooni. rühmad, mis on võimelised antud lahustis ioniseeruma, siis toimub adsorbendi ja elektrolüüdi lahuse vahel ioonivahetus. Adsorbenti sel juhul nimetatakse. ioonivaheti.
Adsorptsiooni kineetika
adsorptsioon, nagu iga tegelik protsess, toimub ajas. Nii et täielik teooria adsorptsioon peaks sisaldama kineetikat käsitlevat jaotist adsorptsioon elementaarne tegu adsorptsioon viiakse läbi peaaegu koheselt (välja arvatud kemisorptsioon). Seega ajasõltuvused adsorptsioon on määratletud põhiosas difusioonimehhanism, st adsorptsiooni kohaletoimetamine adsorptsioon Kui adsorptsioon avatud pinnal ei ole hetkeline, selline protsess toimub välises difusioonipiirkonnas; samas kui difusiooniseadused ei ole spetsiifilised adsorptsioon Poorsete adsorbentide puhul lisaks välisele. difusioon, olulist rolli hakkab mängima vnutr. difusioon, st. adsorbendi ülekandmine adsorbendi pooridesse kontsentratsioonigradiendi olemasolul. Sellise ülekande mehhanism võib sõltuda adsorbaadi kontsentratsioonist ja pooride suurusest.
On molekulaarne, Knudseni ja pinna (Volmeri) difusioon. Molekulaarne difusioon viiakse läbi, kui pikkus on vaba. molekulide hulk poorides on väiksem kui pooride suurus, Knudseni pikkus on siis, kui see pikkus ületab pooride suurust. Pinddifusiooni ajal liiguvad molekulid üle adsorbendi pinna ilma massifaasi üleminekuta. Kuid koefitsiendi väärtused difusioonid ei ole erinevate difusioonimehhanismide puhul ühesugused. Paljudes juhtudel ei ole võimalik eksperimentaalselt täpselt kindlaks teha, kuidas difusioon toimub ja seetõttu nn. efektiivne koefitsient. difusioon, kirjeldades protsessi tervikuna.
Peamine eksperimentaalne kineetikat käsitlev materjal adsorptsioon teenindab nn. kineetiline kõver, st. f-tion \u003d a / a võrdne \u003d f(t) kus on suhteline adsorptsioon võrdne adsorptsiooni hetkeväärtuse suhtega A To a võrdne selle väärtusega hetkel t. Kineetika tõlgendamiseks Lihtsamal juhul eeldatakse, et adsorbendi tera mahult on täiesti ühtlane poorne struktuur (seda mudelit nimetatakse kvaasihomogeenseks). Tähendab. kvaasihomogeense mudeli täiustamine – arusaam, et iga tera sisaldab suuremate ja peenemate pooridega piirkondi. Difusiooni sellises teras kirjeldab kaks dets. koefitsiendid.
Lahtise pinna puhul, võttes Langmuiri mudelit, on kineetikat lihtne saada. võrrand adsorptsioon Tasakaalu saavutamise kiirus on kiiruste erinevus adsorptsioon ja desorptsioon. Eeldades, nagu tavaliselt kineetikas, et protsesside kiirused on võrdelised reageerivate ainete kontsentratsioonidega, saame:
kus k reklaami ja k dec on vastavalt kiiruskonstandid. adsorptsioon ja desorptsioon. Eeldatakse, et rõhk gaasifaasis on konstantne. Selle võrrandi integreerimisel alates t= 0 mis tahes väärtusele t saame:
Seega on f puhul:= võrdne. Nii et lõpuks on meil:
kus k = k reklaami + k dets.
Temperatuuri mõju kiirusele adsorptsioon mida väljendatakse Arrheniuse võrrandiga sarnase võrrandiga adsorptsioon Temperatuuri tõustes suureneb k reklaamide arv eksponentsiaalselt. Sest difusioon adsorbendi poorides on seotud aktiveerimisest ülesaamisega. tõkkeid, ei ole k reklaami ja k des temperatuurisõltuvused samad.
Teadmised difusioonikiirustest on olulised mitte ainult teooria jaoks adsorptsioon, aga ka balli arvutamiseks. adsorptsioon protsessid. Sel juhul tegelevad nad tavaliselt mitte adsorbendi üksikute teradega, vaid nende kihtidega. Protsessi kineetikat kihis väljendavad väga keerulised sõltuvused. Kihi igas punktis antud ajahetkel väärtus adsorptsioon ei ole määratud ainult isotermi võrrandi vormiga adsorptsioon ja protsessi kineetika seadused, aga ka aero- või hüdrodünaamika. tingimused gaasi või vedeliku voolamiseks terade ümber. Protsessi kineetikat adsorbendi kihis, erinevalt ühe tera kineetikast, nimetatakse. dünaamika adsorptsioon, üldine skeemülesannete lahendamine, mis on järgmine: koostatakse diferentsiaalide süsteem. võrrandid osatuletistes, võttes arvesse kihi omadusi, isotermi adsorptsioon, difusioonikarakteristikud (difusioonikoefitsient, massiülekande tüübid piki kihti ja terade sees), aero- ja hüdrodünaamiline. voolu omadused adsorptsioon Määratakse alg- ja piirtingimused. Selle võrrandisüsteemi lahendus viib põhimõtteliselt suuruste väärtusteni adsorptsioon antud ajahetkel kihi antud punktis. Reeglina analüütiline lahenduse saab vaid kõige lihtsamatel juhtudel, seetõttu lahendatakse selline ülesanne numbriliselt arvuti abil.
Dünaamika eksperimentaalses uuringus adsorptsioon läbi adsorbendikihi juhitakse kindlaksmääratud omadustega gaasi- või vedelikuvoog ja uuritakse väljuva voolu koostist aja funktsioonina. Imendunud aine välimus kihi taga nn. läbimurre ja aeg läbimurdeni – kaitsetegevuse aeg. Selle kihi taga oleva komponendi kontsentratsiooni sõltuvus kutsutavast ajast. väljundkõver. Need kõverad on peamised eksperimentaalne materjal, mis võimaldab hinnata dünaamika mustreid adsorptsioon
Adsorptsiooniprotsesside riistvarakujundus
Tehnoloogiaid on palju. adsorptsiooni tehnikad. protsessid. Laialt levinud tsükliline. (perioodilised) paigaldised fikseeritud adsorbendikihiga, osn. mille sõlm on üks või mitu. granuleeritud adsorbendiga täidetud õõnsate kolonnide kujul valmistatud adsorberid. Adsorbeeritud komponente sisaldav gaasi (või vedeliku) voog juhitakse läbi adsorbendikihi kuni läbimurdeni adsorptsioon Pärast seda regenereeritakse adsorberis olev adsorbent ja gaasivool suunatakse teise adsorberisse. Adsorbendi regenereerimine hõlmab mitmeid etappe, millest peamine on desorptsioon, s.o. eelnevalt imendunud aine vabanemine adsorbendist adsorptsioon Desorptsioon viiakse läbi kuumutamise, gaasifaasi rõhu vähendamise, väljatõrjumise (nt elav aur) või nende meetodite kombineerimise teel. Sest ajad adsorptsioon ja regenereerimine ei lange kokku, valige nii palju samaaegselt töötavaid ja regenereeritud adsorbereid, et kogu protsess jätkuks pidevalt.
Tehnika järgi. ja majanduslik kaalutlustel regenereerimine ei ole lõppenud adsorptsioon Seetõttu on adsorbendi töövõime võrdne antud tingimustes saavutatava maksimumi vahega adsorptsioon ja pärast regenereerimist adsorbendis järelejäänud adsorbaadi kogus. Selle tulemusena isotermid adsorptsioon protsessile vastav adsorberis ei tohiks olla liiga järsk.
Kirjeldatud skeemil on võimalikud kaks võimalust: 1) sihtprodukt adsorbeeritakse gaasivoost peaaegu täielikult ja seejärel sisaldub see desorbaadis, kust see ühel või teisel viisil ekstraheeritakse; 2) sihttoode adsorbeerub halvemini kui teised gaasisegu komponendid ja seejärel sisaldub see väljuvas gaasivoos. Esimese variandi kohaselt töötavad näiteks viskoositehastes rekuperatsiooniseadmed, mis püüavad heitgaasidest kinni ja suunavad CS 2 tsüklisse tagasi. Selliste käitiste tootlikkus ulatub sadadesse tuhandetesse m 3 puhastatud gaasi tunnis; mitte liiga peente mikropooridega adsorbent aktiivsüsi, s.t. kivisüsi, milles konstant E vastavalt TOZM-ile (vt eespool) on 20-25 kJ / mol. See väärtus E 0 vastab mitte liiga järsule isotermile, mis tagab head regenereerimistingimused. Selliseid süsi nimetatakse taastumine. Desorptsioon viiakse läbi elava auruga. Energia säästmiseks juhitakse külma ja kuuma gaasi voolud läbi soojusvahetite.
Väga oluline on näiteks gaaside ja vedelike kuivatamine naftagaasid enne töötlemist või loomulik. gaasid enne transportimist; silikageeli adsorbendid või tseoliidid. Desorptsioon viiakse läbi kuumutamise teel. Kuna tseoliidi desorptsiooni seostatakse kõrgete energiakuludega, kasutatakse kombineeritud adsorbenti: peamist. massi niiskust imab kergesti regenereeritav silikageel ja sügav järelkuivatamine tseoliitiga.
Termilise regenereerimise ajal hõlmab kogu tsükkel adsorptsioon, adsorbent kuumutamine, selle desorptsioon ja jahutamine. Suur number etapid määrab protsessi madala intensiivsuse ja suure energiamahukuse adsorptsioon Seetõttu nn. lühitsüklilised paigaldused, mille kogu tsükkel võtab mitu. minutit. Nendes tarnitakse adsorberisse gaas keskmise all. surve, mis seejärel vabaneb ja toimub desorptsioon. Kogu protsess on peaaegu isotermiline (hälbe isotermilisusest põhjustab ainult soojuse eraldumine adsorptsioon ja soojuse neeldumine desorptsiooni ajal). Tsükli etapid: adsorptsioon, rõhu vähendamine, desorptsioon, rõhu tõus. Näiteks on tehas, kus hapnikuga rikastatud õhku toodetakse tseoliidiga.
Liikuva adsorbendikihiga paigaldustes (nn hüpersorberites) langeb viimane gravitatsiooni mõjul aeglaselt alla, eemaldatakse põhjast. adsorberi osad ja siseneb nn. õhulift, mis on adsorptsiooniga paralleelne vertikaalne toru. veerg. Läbi selle toru liigub alt üles õhuvool, mis tõstab adsorbeerivad terad üles. osa veerust. Töödeldud gaasivool siseneb adsorberi keskossa ja liigub adsorbendi suhtes vastuvoolu üles. Veeru ülaosas on pidev adsorptsioon, allosas - adsorbendi regenereerimine (vt ka adsorptsiooni puhastamine).
Keev- ("keev") adsorbendikihiga seadmetes viib adsorberisse altpoolt sisenev gaasivool adsorbendi suspensiooni. See suurendab järsult adsorbendi ja gaasi vahelise massiülekande efektiivsust ja vähendab kestust adsorptsioon ja desorptsioon. Sellistel seadmetel on kõrge tootlikkus. Nende laialdast levikut takistavad kõrged nõuded karusnahale. adsorbendi terade tugevus (ebapiisav tugevus põhjustab adsorbendi märkimisväärseid kadusid selle hõõrdumise ja aparaadist kaasahaaramise tõttu).
Peamine nõuded adsorbentidele: suur adsorbent. mahutavus, s.t. need peaksid olema hajutatud kehad suure löögiga. pinnaga või suure pooride mahuga; chem. pinna iseloom peab tagama tõhusa adsorptsioon andmete sisestamine nendes tingimustes; chem. ja termiline. vastupidavus, taastatavus, kättesaadavus. max. laialt on levinud aktiivsöed, mõnede oksiidide kserogeelid (silikageelgeelid, alumiiniumoksiidgeelid jne), tseoliidid; mittepoorsetest adsorbentidest-tech. süsinik (tahm) ja väga hajutatud SiO 2 (aerosiil, "valge tahm").
Adsorptsioonitehnoloogia kasutusvaldkonnad
Nähtuse kohta adsorptsioon paljude poolt asutatud viisid õhu puhastamiseks kahjulikest lisanditest (vt. gaasi puhastamine), vesi (vt Veepuhastus), samuti suhkrusiirupid suhkru valmistamiseks, puuviljamahlad ja muud toidus olevad vedelikud. prom-sti, määrdeõlide jäätmed. Niiskuse kui kahjuliku lisandi eemaldamine gaasidest ja vedelikest tahkete adsorbentide abil on üks olulisi adsorptsiooni harusid. tehnikad (vt ka gaasi kuivatamine).
Adsorptsiooni kohta. protsessid põhinevad ainete segude peeneraldamisel ja teatud komponentide eraldamisel keerukatest segudest. Näiteks alkaanide isomeeride eraldamine pindaktiivsete ainete tootmiseks normaalsete süsivesinike saamiseks, õlide eraldamine mootorikütuste tootmisel. Sest gaasisegud adsorptsioon eraldusmeetodeid kasutatakse hapnikuga rikastatud õhu saamiseks (kuni peaaegu puhta O 2-ni); paljudes juhtudel konkureerivad need meetodid edukalt destilleerimisega (vt. õhu eraldamine).
Kiiresti arenev adsorbentide kasutusvaldkond. tehnoloogia-meditsiin, kus see teenib ekstrakti kahjulikud ained verest (hemosorptsiooni meetod) jne fiziol. vedelikud. Kõrged nõuded steriilsusele seavad sobivate adsorbentide valimisel väga keerulise ülesande. Nende hulka kuuluvad spetsiaalselt valmistatud aktiivsöed.
Lit.: Brunauer S., Gaaside ja aurude adsorptsioon, trans. inglise keelest, 1. kd, M., 1948; de Boer Ya, Adsorptsiooni dünaamiline olemus, trans. inglise keelest, M., 1962; Adsorptsioon ja poorsus, toim. M. M. Dubinina [et al.], M., 1976; Keliev N.V., Adsorptsioonitehnoloogia alused, 2. väljaanne, M., 1984; Young D.M., Crowell A.D., Gaaside füüsikaline adsorptsioon, L., 1962. M.M. Dubinin, V.V. Serpinski.
Valige artikli pealkirja esimene täht:
Adsorptsioon toimub faasi piiril. Seetõttu on pinnanähtuste termodünaamilist kirjeldust mõistlik käsitleda kui erijuhtum heterogeensete süsteemide termodünaamika.
Riis. 3.4. Gibbsi adsorptsioon: 1- kahefaasiline võrdlussüsteem, 2- tõeline kahefaasiline süsteem ebahomogeense piirkonnaga
Heterogeensete süsteemide termodünaamika kasutusalad liitlikkuse põhimõte, mis on järgmine: kõik heterogeense süsteemi ekstensiivsed omadused on võrdsed vastavate ekstensiivsete omaduste summaga, mis faasidel oleksid olnud enne nende kokkupuudet. Tähistame faasid α ja β-ga (joonis 4). Siis ideaalse süsteemi korral, nii et liidese lähedal olevate faaside omadused langevad kokku nende mahuomadustega, siseenergia U, ruumala V, massi (moolide arvu) n korral on heterogeenses süsteemis entroopia S pärast tasakaalu saavutamist, seosed kehtivad:
U = U α + U β , V = V α + V β , n = n α + n β , S = S α + S β
See eeldab, et temperatuur ja rõhk mõlemas faasis on samad.
Tõeliste heterogeensete süsteemide puhul annab kahe faasi vahelise liidese üleminekupiirkond täiendava panuse süsteemi ulatuslikesse omadustesse. Pinnanähtuste ilmnemisel tuleks arvestada erinevusega tegeliku heterogeense süsteemi ekstensiivsete omaduste ja mudelsüsteemi ekstensiivsete omaduste vahel, milles pinnanähtusi ei esine. Sellist süsteemi nimetatakse võrdlussüsteemiks. Võrdlussüsteemil on samad intensiivsed parameetrid (T, P, C i …) ja sama maht V kui tegelikul süsteemil (joonis 4).
Termodünaamilise vaatenurga all mõistetakse adsorptsiooniväärtust G kui aine n s liigset kogust, väljendatuna moolides või grammides, mis on tõelisel heterogeensel süsteemil võrdlussüsteemiga võrreldes faasi pindalaga seotud. eraldumisel või adsorbendi A pindalale. Eeldatakse, et võrdlussüsteemil on samad intensiivsed parameetrid (T, P, C i) ja sama maht (V = V α + V β) kui tegelikul süsteemil. (joonis 4).
G \u003d (n - n α - n β) / A \u003d n s / A 3.11
Reaalse süsteemi üleminekupiirkonna ülemäärased termodünaamilised funktsioonid (tähistatakse indeksiga s) saab kirjutada järgmiselt.
U s = U - U α - U β , n s = n - n α - n β , S s = S - S α - S β jne.
Adsorptsiooni eksperimentaalsed mõõtmised annavad adsorptsiooni alati täpselt komponendi liigväärtusena tõeline süsteem võrreldes valitud võrdlussüsteemiga. Näiteks gaasi adsorbeerimisel tahkel adsorbendil või komponentide adsorbeerimisel tahkel faasil määratakse adsorptsiooniväärtuste leidmiseks adsorbaadi algkontsentratsioonide muutus pärast faaside α ja β kokkupuudet.
n i s = V(C i o - C i),
Kus C i o– i-nda komponendi algkontsentratsioon, C i on i-nda komponendi kontsentratsioon pärast külgnevate faaside vahel tasakaalu saavutamist. Eeldatakse, et maht V ei muutu. Siiski kontsentratsioon i- kolmas komponent C i, mis on saadud katseliselt, määratakse mahus V' liidese kohal, võtmata arvesse üleminekukihi ebahomogeense piirkonna mahtu Vα liideses, kus kontsentratsioon on C i α. Seega, kuna reaalses süsteemis on ebahomogeenne piirkond, saab süsteemi kogumahtu esitada järgmiselt. V = V' + Vα. Terve kogus i- kolmas komponent C i o jagatud nende kahe köite vahel:
V C i o = V' C i + V α C i α,
ja komponendi moolide arv i, liidesele adsorbeeritud, on võrdne
n i s = (V’C i + V α C i α) – (V’ + V α)C i = V α (C i α – C i) 3.12
Need. Eksperimentaalselt määratud adsorptsioon on i-nda komponendi liig mahus V α võrreldes selle komponendi kogusega samas mahus liidesest kaugel. Seda tüüpi adsorptsiooni nimetatakse Gibbsi adsorptsiooniks. .
V α C i α helistas täielik sisu mina- komponent adsorptsioonikihis. Väga madalate kontsentratsioonide piirkonnas C i mahus V' muudatus V α C i võrrandi (3.2) võib tähelepanuta jätta ja arvesse võtta mõõdetud väärtust V α C i α täielik sisu mina- th komponent adsorptsioonikihis, näiteks gaasi adsorptsioonil tahkel adsorbendil madalal rõhul.
Praegune lehekülg: 6 (raamatul on kokku 19 lehekülge) [ligipääsetav lugemisväljavõte: 13 lk]
Font:
100% +
34. Adsorptsioonijõudude olemus
Adsorbendi molekulide interaktsioon adsorbendi pinnaga nn. füüsiline adsorptsioon võib olla tingitud erinevatest põhjustest. Seejärel saab potentsiaali, mis määrab ühe adsorbeeriva molekuli interaktsiooni mittepolaarse adsorptsiooni ühe aatomiga, väljendada järgmiselt:
θ = −Kr 6 +Br 12 ,
kus r on osakeste tsentrite vaheline kaugus; C on dispersiooni külgetõmbekonstant; B on konstant, mis iseloomustab tõukejõudude energiat.
On üsna ilmne, et suhteliselt kaugetel distantsidel peaksid domineerima külgetõmbejõud, lähistel aga tõukejõud. Samuti peavad teatud vahemaadel need jõud olema võrdsed, mis vastab miinimumile tasuta energiat. Kuid on oluline märkida, et adsorptsiooni ajal toimivad dispersioonijõud iga mittepolaarse osakese vahel samaaegselt.
Kuna osakeste interaktsioonienergia võib kaugusega kiiresti väheneda, piisab adsorptsioonijõudude potentsiaali määramiseks lähimate adsorbeerivate aatomite summeerimisest. On oluline, et komplekssete mittepolaarsete molekulide adsorptsiooni korral saab potentsiaalset energiat ligikaudselt arvutada molekuli ühikute kõigi potentsiaalsete adsorptsioonienergiate summana.
Kui adsorbent koosneb ioonidest, saab juba teadaolevate dispersioonijõudude toimele lisanduda dipoolide tõmbejõu induktsioonijõud, mis indutseeritakse adsorbendi molekulides elektrivälja abil, mis omakorda tekib. adsorbentvõre ioonide poolt.
Sellise interaktsiooni korral võib induktiivjõudude osatähtsus adsorptsiooni interaktsioonis olla võrdeline adsorptsioonimolekuli polariseeritavusega ja väljatugevuse ruuduga sellel adsorbeerival pinnal.
Kui seevastu polaarsed adsorbeerivad molekulid adsorbeeritakse polaarsele adsorbendile, siis sel juhul polariseerivad dipoolid adsorbendi aatomeid, s.t justkui tekitaksid neis elektrimomente. Selle mõju tõttu lisandub dispersioonile induktiivne interaktsioon.
Induktiivne interaktsioon ise on tavaliselt väike ja sõltuvalt adsorptiivse molekuli dipoolist ja adsorbendi polariseeritavusest võib ulatuda suurte väärtusteni. Juhul, kui molekulid adsorbeeritakse adsorbendile, mille pinnal on ioonid või dipoolid, nn. adsorbendi ioonide või dipoolide vastastikmõju adsorbendi elektrostaatilise väljaga.
Sel juhul saavad adsorptiivsed molekulid isegi adsorbendi väljas orienteeruda ja toimub orienteeriv Coulombi interaktsioon. Tavaliselt juhtub nii, et induktiivse ja orientatsioonilise vastastikmõju energiad on väiksemad kui dispersiooni interaktsiooni energia ja seetõttu eeldatakse, et molekulidevahelise tõmbeenergia määrab dispersioonitõmbeenergia.
Samuti võib adsorptsiooni põhjuseks olla vesiniksideme moodustumine. Seda tüüpi side võib tekkida adsorptsiooni käigus adsorbentidel, mis sisaldavad molekulide hüdroksüülrühmi, nagu vesi, alkoholid, ammoniaak ja amiinid pinnal. Vesiniksideme moodustumisel võib adsorbendi ja adsorbendi interaktsioonienergia olla üsna suur ja sellise adsorptsiooni käigus eralduv soojus on palju suurem kui molekulide kuju ja suurusega sarnaste ainete adsorptsioonisoojus. kuid ei moodusta vesiniksidet.
Oluline on märkida, et teades pinnakihi termodünaamilist kirjeldust "adsorbent-adsorbent" piiril, selle struktuuri, erinevat tüüpi jõudude olemust, protsessi dünaamikat, võib jätkata keerukamate ainete uurimist. adsorptsiooniprotsessid.
35. Adsorptsioon kui ainete spontaanne kontsentratsioon faasiliidesel, mis vähendavad liideste pinget
Pindaktiivsed ained jagunevad kahte suurde rühma: aktiivne ja passiivne ained.
Pindaktiivsed ained on võimelised kogunema pinnakihti ja sel juhul toimub positiivne adsorptsioon. G > 0.
Seda tüüpi ainetel peab olema pindpinevus, mis omakorda peab olema väiksem kui lahusti pindpinevus, vastasel juhul oleks aine akumuleerumine pinnakihti ebasoodne ja neil peab olema suhteliselt madal lahustuvus. Piisavalt hea lahustuvusega kipuvad pindaktiivsete ainete molekulid jätma pinna sügavale lahusesse. Seetõttu surutakse pindaktiivsed ained eelistatavalt vedeliku põhiosast välja pinnale.
Kuid ainete kogunemisel lahuse piirile nende ainete molekulides, mis omavahel nõrgalt interakteeruvad, väheneb molekulidevaheline interaktsioon pinnakihis ja pindpinevus langeb.
Pindaktiivsed ained veekihi suhtes on mitut tüüpi orgaanilisi ühendeid, piisavalt suure süsivesinikradikaaliga rasvhappeid, nende hapete sooli (seebid), sulfoonhappeid ja nende sooli, samuti erinevat tüüpi alkoholid ja amiinid. iseloomulik tunnus enamik molekule on nende difiilsus: molekul koosneb kahest osast polaarsest rühmast ja mittepolaarsest süsivesinikradikaalist. Märkimisväärse dipoolmomendi ja hästi niisutava polaarse rühma omamine võib määrata pindaktiivse aine afiinsuse vesikeskkonna suhtes. Kuid süsivesinikradikaal on põhjus, mis vähendab nende ühendite lahustuvust.
Pind mitteaktiivsed pindaktiivsed ained- seda tüüpi ained, kaldudes vedeliku pinnalt oma mahusse lahkuma, selle tulemusena nn. negatiivne adsorptsioon G < 0. Поверностно-инактивные вещества также обладают значительным поверхностным натяжением, значительно большим, чем натяжение у растворителя (иначе эти вещества способны самопроизвольно накапливаться в поверхностном слое), также обладают высокой растворимостью, что способствует их стремлению уйти с поверхности жидкости в объем. Взаимодействие между молекулами поверхностно-инактивного вещества и растворителя всегда больше, чем взаимодействие между самими молекулами растворителя, поэтому они и стремятся перейти в объем раствора. Pind-inaktiivsed ained vee suhtes on palju anorgaanilisi elektrolüüte: happed, leelised, soolad. Pind-inaktiivsete ainete molekulidel ei ole hüdrofoobset osa ja need võivad vees laguneda tugevalt hüdreerivateks ioonideks.
Näited Pind-inaktiivsed ained on ka mõned orgaanilised ühendid, milles molekuli mittepolaarne osa puudub või on väga väike. Nende ainete hulka kuuluvad sipelghape, aminoäädikhape.
Mittevesilahustites on anorgaanilised elektrolüüdid samuti võimelised pindpinevust suurendama ja see sõltub lahustist.
Näiteks, kui metanooli lisada naatriumjodiidi, suureneb pindpinevus oluliselt; etanooli puhul on pindpinevus ligikaudu 2 korda suurem. Ainete pinnaaktiivsus võib sõltuda mitte ainult aine olemusest, vaid ka lahusti omadustest. Kui mõnel lahustil on kõrge pindpinevus, võib sellel lahustunud ainel olla märkimisväärne pindaktiivsus.
36. Adsorptsiooniteooriad
Vaatleme kõige levinumaid adsorptsiooniteooriaid, mis kirjeldavad üksikuid adsorptsioonitüüpe "tahke-gaasi" või "tahke-lahuse" liidesel.
I. Langmuiri monomolekulaarse adsorptsiooni teooria.
1. Adsorptsioon on lokaalne ja seda põhjustavad keemilistele lähedased jõud.
2. Adsorptsioon toimub ainult aktiivsetel keskustel - adsorbendi pinna eenditel või süvenditel, mida iseloomustab vabade valentside olemasolu. Aktiivseid keskusi peetakse sõltumatuteks ja identseteks.
3. Iga aktiivne keskus on võimeline suhtlema ainult ühe adsorbaadi molekuliga; pinnal võib tekkida ainult üks kiht adsorbeeritud molekule.
4. Adsorptsiooniprotsess on pöörduv ja tasakaaluline; adsorbeeritud molekuli hoiab aktiivne keskus mõnda aega, pärast mida see desorbeerub; Mõne aja pärast tekib dünaamiline tasakaal.
Maksimaalne võimalik adsorptsiooni väärtus G o saavutatakse tingimusel, et kõik aktiivsed keskused on hõivatud adsorbaadi molekulidega. Monomolekulaarse adsorptsiooni isotermi võrrand, mis on seotud adsorptsiooniväärtusega G adsorbaadi kontsentratsiooniga KOOS, paistab nagu:
Kus b- antud paari "adsorbent - adsorbatsioon" väärtuse konstant (desorptsiooni ja adsorptsiooni kiiruskonstantide suhe), mis on arvuliselt võrdne adsorbaadi kontsentratsiooniga, mille juures on hõivatud pooled aktiivsetest keskustest.

Langmuiri adsorptsiooni isotermi graafik on näidatud joonisel 2. Konstant b defineerime graafiliselt, tõmmates punktis adsorptsiooniisotermile puutuja KOOS= 0. Gaaside adsorptsiooni protsessi kirjeldamisel võrrandis võib kontsentratsiooni asendada osarõhu proportsionaalse väärtusega. Monomolekulaarse adsorptsiooni teooria I. Langmuir kasutatakse gaaside ja lahustunud ainete adsorptsiooni protsesside kirjeldamiseks adsorbaadi madalal rõhul (kontsentratsioonil).
Polanyi polümolekulaarse adsorptsiooni teooria kirjeldab s-kujulisi adsorptsiooniisoterme, mille kuju näitab adsorbeerunud molekulide võimalikku interaktsiooni adsorbaadiga.
1. Adsorptsiooni põhjustavad füüsilised jõud.
2. Adsorbendi pind on homogeenne, aktiivsed keskused puuduvad; adsorptsioonijõud moodustavad adsorbendi pinna lähedal pideva jõuvälja.
3. Adsorptsioonijõud toimivad adsorbaadi molekuli suurusest suuremal kaugusel, st adsorbendi pinna lähedal on teatud adsorptsiooniruumala, mis adsorptsiooni käigus täitub adsorbaadi molekulidega.
4. Adsorbaadi molekuli külgetõmbejõud adsorbendi pinna poolt ei sõltu teiste molekulide olemasolust adsorptsioonimahus, mille tulemusena on võimalik polümolekulaarne adsorptsioon.
5. Adsorptsioonijõud ei sõltu temperatuurist ja seetõttu ei muutu temperatuuri muutumisel adsorptsiooni maht.
Freundlichi võrrand. Adsorbendi pind on ebahomogeenne, interaktsioon toimub adsorbeerunud osakeste vahel, aktiivsed keskused ei ole üksteisest täiesti sõltumatud. G. Freindlich pakkus välja, et adsorbeeritud gaasi või lahustunud aine moolide arv adsorbendi massiühiku kohta (nn spetsiifiline adsorptsioon X/m), peaks olema proportsionaalne adsorbendi tasakaalurõhuga (gaasi puhul) või tasakaalukontsentratsiooniga (lahusest adsorbeeritud ainete puhul), mis on tõstetud teatud võimsuseni, mis on alati väiksem kui ühtsus:
x / m = aP n x / m = aC n.
eksponendid n ja proportsionaalsustegur A määratakse eksperimentaalselt.
37. Adsorptsiooniprotsessi termodünaamika. Gibbsi adsorptsiooni võrrand
Adsorptsiooni nähtuse uurimiseks "lahuse-gaasi" piiril on vaja luua seos adsorbeeritud aine liia vahel pinnakihis ( G), pindaktiivse aine kontsentratsioon lahuses ( Koos) ja pindpinevus ( σ ) "lahuse-gaasi" faasi piiril. Otstarbekam on vaadelda nähtusi termodünaamilisest vaatenurgast ja seostada lahustunud aine adsorptsiooni pinna vaba energia või selle pindpinevuse muutumisega. See ühendus tekkis W. Gibbs V 1876, mis sai nime "Gibbsi adsorptsiooni võrrand":
G = – Koos / RT x dσ/dc.
Võite ikka ette kujutada Gibbsi võrrand, põhineb termodünaamikal, kasutades isobaar-isotermilist potentsiaali G, keemilised potentsiaalid μ 1 Ja μ 2, ja ka kasutades n 1 Ja n 2 komponentide moolide arv. Olles seda analüüsinud, võttes arvesse entroopiat S, maht V ja survet P, saame kirjutada järgmise võrrandi:
dG=– SDT+VdP+σds+ μ 1 d n 1 + μ 2 päeva 2.
Võrdsustame selle nulliga ja, võttes arvesse konstantset temperatuuri ja rõhku, lihtsustub see vormi võrrandiks:
sd σ + n 1 p μ 1 + n2d μ 1 = 0.
Võttes arvesse asjaolu, et lahjendatud lahuste puhul väljendatakse teise komponendi keemilist potentsiaali järgmiselt:
μ 2 = μ 2 0 +RT ln c,
ja arvestades, et temperatuur on konstantne
dμ 2 =rtdnc,
asendades selle võrrandi
![]()
saame soovitud Gibbsi adsorptsiooni võrrandi. Võrrandi põhjal on näha, et kui pindpinevus σ suureneb koos keskendumisega Koos, siis on lahustunud aine kontsentratsioon pinnakihil väiksem kui lahuse mahus (nn negatiivne adsorptsioon) ja kui pindpinevus σ väheneb kontsentratsiooni suurenedes Koos, siis on kontsentratsioon kihis suurem kui mahus (positiivne adsorptsioon) ja lõpuks, kui σ ei sõltu Koos, siis on aine kontsentratsioon pinnal olevas kihis ja mahus sama. Gibbsi võrrand tuletati termodünaamika abil. Seda võrrandit on praktikas raske kontrollida, mis on tingitud lahustunud aine kontsentratsiooni määramise keerukusest kihilisel pinnal. Kogenud B. McBen leidis, et seadme abil lõigati lahuse pinnalt ära väga õhuke vedelikukiht. Gibbsi võrrandi kõigi parameetrite edasine määramine näitas, et katseliselt leitud adsorptsiooni väärtused langesid kokku Gibbsi võrrandi abil arvutatud väärtustega katsevea piires. Mis tahes vedeliku pinna homogeensuse ja sileduse tõttu on selle pinnal adsorptsiooni uurimisel tavapärased ideed aktiivsete keskuste kohta täiesti rakendamatud. Kriitilisel temperatuuril kaob külgnevate faaside vahe ja pindpinevus muutub reeglina nulliks. Gaaside ja aurude adsorptsioonil on nii suur praktiline rakendus, et kirjandusest, eriti tehnilisest, võib leida seda mõistet, mida kasutatakse ainult tahkete ainete pinnal toimuvate protsesside puhul.
See kontseptsioon, nagu ka kõige üldisemad adsorptsioonimustrid, nagu vaadeldav Gibbsi võrrand, on rakendatavad kõigi faasipiiride puhul. Kasutades Gibbsi võrrandit ja kõiki sellest tulenevaid sätteid, olles määranud Г väärtuse, on võimalik konstrueerida adsorptsiooni isoterm.
38. Adsorptsiooni iseärasused mikropoorsetel materjalidel. Polani potentsiaali teooria. Adsorptsioonipotentsiaal
Glade'i teooria käsitleb lokaliseerimata füüsilist adsorptsiooni, mis on otseselt tingitud van der Waalsi jõududest adsorbendi ja adsorbaadi vahel (seda võib pidada esimeseks positsiooniks). Selle teooria teine positsioon on adsorbendi jõu (või potentsiaali) välja mõiste, mis ulatub pinnast märkimisväärsele kaugusele; sellel väljal ilmuv adsorptsioonikiht on polümolekulaarne. Kui arvestada gaaside adsorptsiooni, siis selle kihi tihedus väheneb pinnast teatud normaalset pidi. Kui arvestada aurude adsorptsiooni, moodustub pinnale teatud paksusega vedelikukiht. Polanyi teoorias käsitletakse välja ekvipotentsiaalpindade seeriana, iga pind vastab teatud potentsiaali väärtusele ε , ja iga järgmine pind on eelmisest väiksem. Iga selline pind ruumis lõikab välja teatud mahuga kihid, mis on tähistatud kui v i. Polanyi teooria ülesanne on leida üleminek isotermi tavalistest koordinaatidest ( x, lk) välja parameetritele ε i Ja v i koos nende peamiste parameetrite vahelise seose edasise loomisega. Probleemi esimene osa, mille Polanyi püstitas, on üsna keeruline ja paljudel juhtudel ei saa sellel olla kindlaid lahendusi, kuid aurude adsorptsiooni puhul lahendatakse see osa probleemist esimeses lähenduses väga lihtsalt. Vedeliku adsorptsioonikihi puhul on ruumala täidetud osa võrdne:
v i \u003d x (M / d),
Kus d on aine tihedus vedelas olekus.
M. Polyany toob oma teoorias sisse veel ühe sätte nn puudumise kohta. väli sõelumine adsorptsiooni protsessis, väärtus ε selles teoorias on ruumi konstantne väärtus (midagi gravitatsioonipotentsiaali sarnast), sõltumata sellest, kas antud punkti ja tahke pinna vahel on teatud adsorbeeritud molekulid või kas kogu ruum on vaba. Polyani tutvustab kontseptsiooni adsorptsioonipotentsiaal ε , mis on auru kokkusurumise isotermiline töö, kui see viiakse tasakaalurõhult üle R puistefaasis pinnast kaugel pinnakihi küllastunud aururõhuga piirkonda p 0 siis potentsiaali määramise avaldis näeb välja järgmine:
ε = RT ln R 0 / R.
Sellise võrrandi abil saab koordinaatidelt x, p minna koordinaatidele ε Ja v ja saada kõver, mida nimetatakse "iseloomulikuks". Polanyi avastas oma katsetes, et sellistel saadud isotermide katseandmetest koostatud kõveratel on järgmine omadus: need on T suhtes muutumatud ehk teisisõnu kõik seda tüüpi kõverad võivad asuda ühel kõveral. ε −ε .
M. Polyany aktsepteeris seda seisukohta postulaadina, st:
Polyany näidatud vara on tohutu praktiline väärtus, võib see ühest eksperimentaalsest adsorptsiooniisotermist konstrueerida isotermide perekonna.
Polanyi teooria ei anna isotermi analüütilist avaldist ega potentsiaali ja ruumala funktsiooni, kuid võimaldab arvutada iga temperatuuri koordinaadi, kui on teada vähemalt üks isoterm. See tulemus on väga oluline tehnoloogilised arvutused, sest samal adsorbendil olevate sarnaste gaaside puhul võivad adsorptsioonikõverad olla üksteise lähedal ja paljudel juhtudel kattuda.
39. Adsorptsiooni iseloomulik kõver. Temperatuuri invariantsus ja tunnuskõverate afiinsus
Adsorbendi pinnale tekkiv jõuväli võib olla mitmes mõttes sarnane gravitatsiooniväljaga. Adsorptsiooniväljas saab kujutada potentsiaalseid pindu, st pindu, millele on iseloomulik sama adsorptsioonipotentsiaal. Adsorptsioonipotentsiaali mõiste all θ ei tohiks mõista midagi muud kui tööd, mis tehakse adsorptsioonijõudude vastu, kui 1 mooli adsorbatsiooni suunatakse välja teatud punktist teatud gaasifaasi. Maksimaalne adsorptsioonipotentsiaal eksisteerib "adsorbendi-adsorptsioonimahu" piiril. Kuid piiril "ruumala - gaasifaas" (see on koht, kus adsorptsioonijõudude toime lõpeb) peab adsorptsioonipotentsiaal olema võrdne nulliga. Adsorptsioonipotentsiaali muutust koos adsorptsioonimahu muutumisega saab esitada kõverate kujul. Esimesena tegi seda M. Polyani. Seda tüüpi kõverad ei sõltu temperatuurist ja võivad olla iseloomulikud igale konkreetsele adsorbendile; seda tüüpi kõveraid nimetatakse tavaliselt adsorptsiooni tunnuskõverateks. Polümolekulaarse adsorptsiooni teooria eeldab, et gaasi olekuvõrrand kehtib adsorptsiooni hulga kohta. Järelikult on isotermid, mis iseloomustavad adsorbaadi tiheduse sõltuvust ruumalast erinevatel temperatuuridel, sarnased rõhu sõltuvuse mahust isotermidega. Madalatel temperatuuridel võivad pinnale mõjuvad adsorptsioonijõud põhjustada auru kondenseerumist teatud tihedusega vedelikuks. Kriitilisest madalamal temperatuuril täitub kondenseerumise ajal kogu adsorptsioonimaht vedelikuga. Sel juhul kulgeb adsorptsioonikõver peaaegu paralleelselt abstsissteljega, mis on seotud vedeliku madala kokkusurutavusega. Seejärel langeb adsorptsioonikõver "ruumala-gaasifaasi" piiril järsult allapoole ja vastavalt sellele jõuab adsorbaadi tihedus gaasifaasi teatud tiheduse väärtuseni. Kriitilisest kõrgemal temperatuuril võib adsorbent käituda ideaalse gaasina ja graafikut väljendatakse ideaalse gaasi sõltuvuse isotermina, eeldusel, et pV = RT. Sellistes tingimustes on adsorbeeritud gaasi maksimaalne tihedus adsorbendi pinnal ja minimaalne tihedus gaasifaasi vahetus läheduses. Veelgi enam, sel juhul on oluline märkida, et adsorptsioonikihis oleva adsorbaadi tihedus ei ulatu kusagil vedeliku enda tiheduseni. Ja kui temperatuur on kriitilisele väga lähedal, väljendatakse tiheduse sõltuvust mahust isotermile lähedase kõveraga, mida kirjeldatakse van der Waalsi võrrand. Selle stsenaariumi korral on osa adsorbeeritud ainest adsorbeeritud mahus vedelas olekus ja osa adsorbeeritud ainest gaasilises olekus. Siis väheneb kõver kõige järsemalt selles osas, mis vastab üleminekule vedelikult gaasile. Kui ühe adsorptsiooni eksperimentaalsest adsorptsiooni isotermist koostada karakteristiku kõver ja teades vastavaid afiinsuskoefitsiente mõne teise adsorptsiooni suhtes, saab leida adsorptsiooni isotermi ja konstrueerida selle teise adsorptsiooni jaoks. Adsorptsiooni potentsiaaliteooria võimaldab arvutada erinevate aurude erinevaid adsorptsiooniisoterme samal adsorbendil, pealegi kasutades ühe auru adsorptsiooniisotermist saadud tunnuskõverat, kuna adsorptsioonipotentsiaali suhe ei sõltu adsorptsioonimahtudest .
afiinsus(ladina keelest affinis - "seotud") - afiinsuskromatograafia. Valkude puhastamise ja eraldamise meetod põhineb nende selektiivsel interaktsioonil ligandiga, mis on kovalentselt seotud inertse kandjaga (afiinsuskromatograafia). Toksilise aine afiinsuse mõõtmine retseptori suhtes on tegelikult eksperimentaalne uuring inkubatsioonikeskkonda lisatud aine koguse ja interaktsiooni tulemusena moodustunud toksilise aine-retseptori kompleksi koguse vahel.
Adsorptsiooniprotsesside termodünaamika.
| Parameetri nimi | Tähendus |
| Artikli teema: | Adsorptsiooniprotsesside termodünaamika. |
| Rubriik (temaatiline kategooria) | Haridus |
Adsorptsiooniprotsesside klassifitseerimise põhimääratlused ja meetodid.
Adsorptsioon viitab nähtustele, mis tekivad pinnaenergia spontaanse vähenemise tagajärjel.
Adsorptsioon- heterogeense süsteemi komponentide spontaanse pöörduva või pöördumatu ümberjaotumise protsess pinnakihi ja homogeense faasi ruumala vahel.
Mitmekomponentsetes süsteemides on pinnakihile eelistatavam komponent, mis alandab liideste pinget. Ühekomponentsetes süsteemides muutub pinnakihi moodustumise käigus selle struktuur (aatomite ja molekulide teatud orientatsioon, polarisatsioon), nn. autoadsorptsioon.
Nimetatakse tihedamat faasi, millel adsorptsiooni interaktsioonid lokaliseeritakse adsorbent. Aine, mis on ümber jaotatud homogeense faasi mahu ja pinnakihi vahel, on tähistatud terminiga ʼʼ adsorbeeridaʼʼ.
Mõnel juhul on adsorptsiooniprotsess pöörduv. Sel juhul võib osa adsorbeerunud molekule teatud tingimustel molekulaarkineetiliste nähtuste tulemusena pinnakihist faasi ruumalasse minna. Adsorptsiooni pöördprotsessi nimetatakse desorptsioon.
Adsorptsiooniprotsesside klassifitseerimise meetodid.
Adsorptsiooniprotsesside klassifikatsioon interakteeruvate faaside agregatsiooni oleku järgi. Võttes arvesse sõltuvust külgnevate faaside koondseisundist, eristatakse järgmist tüüpi adsorptsiooniprotsesse:
Gaaside adsorptsioon tahketel adsorbentidel;
Lahustunud ainete adsorptsioon "tahke-vedelik" ja "vedelik-vedelik" liidestel;
Pindaktiivsete ainete adsorptsioon ʼʼvedelik-gaasʼʼ liidesel.
Adsorptsiooniprotsesside klassifikatsioon adsorbendi ja adsorbaadi interaktsiooni mehhanismi järgi. Adsorptsiooni võib pidada adsorbaadi molekulide interaktsiooniks adsorbendi aktiivsete tsentritega. Vastavalt nende interaktsiooni mehhanismile jagunevad järgmised adsorptsiooni tüübid:
1) füüsikaline (molekulaarne) adsorptsioon- interaktsioon adsorbaadi ja adsorbendi molekulide vahel toimub tänu van der Waalsi jõududele, vesiniksidemetele (ilma keemilised reaktsioonid);
2) keemiline adsorptsioon (kemisorptsioon)– adsorbaadi molekulide kinnitumine adsorbendi aktiivsetele kohtadele toimub erinevat tüüpi keemiliste reaktsioonide tulemusena (välja arvatud ioonivahetusreaktsioonid);
3) ioonivahetusadsorptsioon (ioonivahetus) - adsorbeeritava aine ümberjaotumine lahuse ja tahke faasi (ioonivaheti) vahel vastavalt ioonivahetusreaktsioonide mehhanismile.
Adsorptsiooniprotsesside kvantitatiivseks kirjeldamiseks kasutatakse kahte suurust.
1) Absoluutne adsorptsioon on adsorbaadi kogus (mol) või mass (kg) adsorbendi pindala või massiühiku kohta. Nimetus - A; ühik: mol/m 2, mol/kg, kg/m 2, kg/kᴦ.
2) Gibbsi (liigne) adsorptsioon on adsorbeeritava aine liig teatud paksusega pinnakihis võrreldes selle kogusega homogeense faasi mahus adsorbendi pinna- või massiühiku kohta. Nimetus - G; ühik: mol/m 2, mol/kᴦ.
Absoluutse ja liigse adsorptsiooni vahelist seost saab illustreerida võrrandi abil:
G \u003d A – c * h (3,1)
kus c on aine tasakaalukontsentratsioon faasi mahus, mol/m3;
h on pinnakihi paksus, tinglikult võetuna 10–9 m.
Mitmekomponentsetes heterogeensetes süsteemides, kui üks või teine komponent jaotatakse ümber homogeense faasi ruumala ja pinnakihi vahel, kehtib pinna siseenergia ülejäägi võrrand:
U = T * S + s * s + Sm i * n i (3.2)
Viides kõik võrrandi liikmed liidese pinna pindalaühikusse, saame:
U s = T * S s + s + Sm i * Г i (3.3)
kus Г i = n i / s on pinnakihi i-nda komponendi liig, see tähendab Gibbsi adsorptsioon.
Ühekomponendilise süsteemi korral on võrrand (3.3) järgmine:
G s = s + m * Г (3,4)
kus G s = U s - T * S s on pinna Gibbsi energia või pinnaühiku pindala loomise töö;
m * Г - adsorbeeritud aine aine tihendamine pinnakihis.
Võrrandi (3.4) põhjal võime järeldada, et adsorptsiooni käigus koosneb töö liidese pinna moodustamiseks pinna moodustamise tööst (adsorbaadifaasi põhimassis sidussidemete purustamine) ja pinnakihis oleva aine tihendamisest.
Adsorbendi ja adsorbaadi dünaamilise tasakaalu seisundis, heterogeense süsteemi Gibbsi energia muutus ΔG = 0, kirjeldatakse adsorptsiooniprotsessi termodünaamikat võrrandiga nn. Gibbsi põhiline adsorptsioonivõrrand:
Ds = SГ i * dm i (3,5)
See võrrand on universaalne, kuna see kehtib igat tüüpi adsorptsiooniprotsesside jaoks
Gibbsi adsorptsioonivõrrandi erijuhud.
1) Adsorptsioon lahustest.
Süsteemi i-nda komponendi keemilise potentsiaali jaoks adsorptsiooni ajal liidestel "vedelik-tahke adsorbent" ja "vedelik-gaas" kehtivad võrrandid:
m i = m i 0 + R*T*ln a i (3,6)
dm i = R*T* d ln a i (3,7)
kus m i 0 on süsteemi i-nda komponendi keemiline potentsiaal at standardtingimused;
a i – süsteemi i-nda komponendi aktiivsus standardtingimustes.
Selle põhjal on Gibbsi adsorptsiooni võrrand järgmine:
Г i = - a i / R*T * (ds / da i) (3.8)
Mitteelektrolüütide lahuste puhul võtame a i \u003d c i, siis:
Г i \u003d - s / R * T * (ds / ds) (3,9)
Elektrolüütide lahuste jaoks:
Г i = - с ± n / R*T * (ds / dс ± n) (3.10)
kus c ± on lahuse keskmine ioonkontsentratsioon;
n on stöhhiomeetriline koefitsient.
2) Ainete adsorptsioon gaasifaasist.
Vastavalt Mendelejevi-Claiperoni võrrandile:
P \u003d c * R * T (3,11)
Sellega seoses on Gibbsi võrrand gaaside adsorptsiooni kohta tahketel adsorbentidel kirjutatud järgmisel kujul:
Г i = - Р / R*T * (ds / dР) (3.12)
Praktikas võimaldab Gibbsi adsorptsioonivõrrand arvutada liidese kihis olevate ainete adsorptsioonihulka, mille pindpinevus määratakse, lähtudes pindpinevuse mõõtmisest vedeliku kontsentratsiooni või tasakaalulise gaasi rõhu erinevatel väärtustel. .
Adsorptsiooniprotsesside termodünaamika. - mõiste ja liigid. Kategooria "Adsorptsiooniprotsesside termodünaamika" klassifikatsioon ja omadused. 2017, 2018.
Kahe aatomi interaktsiooni korral:
U on interaktsioonienergia;
U = U + U TÕMBA.
 - Lennard-Jonesi võrrand
, c, b, m = konst
- Lennard-Jonesi võrrand
, c, b, m = konst
Tahke pinnaga aatomite interaktsiooni korral on vaja kõik vastastikmõjud kokku võtta.
x on kaugus pinnast
r - tõmbejõudude toimeraadius
dV - helitugevus
n on pinnamolekulide arv
U ADS. on adsorptsiooni interaktsiooni energia



Adsorptsiooni korral suureneb külgetõmme. Ja mittepolaarset-mittepolaarset tüüpi interaktsiooni korral paikneb adsorptsioon valdavalt süvendites.
elektrostaatiline interaktsioon.
Polaarne adsorbent – mittepolaarne adsorbaat
Mittepolaarne adsorbent – polaarne adsorbent
Polaarne adsorbent on polaarne adsorbent.
M  adsorbaadi molekul on kujutatud dipoolina ja adsorbent juhina, milles adsorbaadi molekul indutseerib dipooli peegelsümmeetriliselt antud suhtes.
adsorbaadi molekul on kujutatud dipoolina ja adsorbent juhina, milles adsorbaadi molekul indutseerib dipooli peegelsümmeetriliselt antud suhtes.
X - kaugus keskelt
Suheldes tekib potentsiaal:
 ,
,
 on dipoolmoment.
on dipoolmoment.
Potentsiaal kipub võtma maksimumväärtuse, s.t. dipoolid kalduvad orienteeruma pinnaga risti.
Kuna temperatuuri tõus soodustab Browni liikumise kasvu, põhjustab see adsorptsiooniprotsessi aeglustumist.
Elektrostaatilise interaktsiooni korral paikneb adsorbaat valdavalt eenditel.
Adsorptsiooni põhivõrrand.
Adsorptsiooni korral jaotatakse komponent ümber, mis tähendab, et keemiline potentsiaal muutub. Adsorptsiooni protsessi võib pidada pinnaenergia üleminekuks keemiliseks energiaks.
Kihi maht = 0, siis termodünaamika seaduse üldistatud võrrand I ja II:
T = const; (1) = (2) => 

Kahekomponendilise süsteemi jaoks:
,
 ,
,
 =>
=>
=>
 - Gibbsi adsorptsiooni võrrand
.
- Gibbsi adsorptsiooni võrrand
.
Televiisori adsorptsiooni korral. kere - gaas:, 
 ,
,

 - isoterm
- isoterm
 - isobaar
- isobaar
 - isopükne
- isopükne
 - isosteer
- isosteer
Isoterm, isopükne, isosteer on omavahel seotud.
Sest adsorptsiooni funktsioon 



Henry isoterm Langmuiri isoterm



Termodünaamika. Adsorptsioon.
Tihendatud kandja jaoks:
 ,
,
 ,
,
 - Gibbsi energia lahutamatu muutus
.
- Gibbsi energia lahutamatu muutus
.

P-rõhk kumeral pinnal, P S-rõhk tasasel pinnal
 - adsorptsioonipotentsiaal
- adsorptsioonipotentsiaal
Diferentsiaalne muutus sisemises 
 , Г = konst
, Г = konst
- diferentsiaalne entroopia muutus
- adsorptsiooni diferentsiaalentalpia
 - isosteeriline adsorptsioonisoojus
- isosteeriline adsorptsioonisoojus
 - kondensatsioonisoojus
- kondensatsioonisoojus
 - adsorptsiooni netosoojus
- adsorptsiooni netosoojus

 ,
,




Qa on lahutamatu adsorptsioonisoojus, 
Qra on lahutamatu adsorptsiooni netosoojus,

Henry võrrand
Adsorptsiooni uurimist takistab pinna ebahomogeensus, mistõttu homogeensete pindade puhul saadakse kõige lihtsamad seaduspärasused.
Vaatleme gaaside vastasmõju tahke pinnaga, kui gaas läheb ruumalalt tasakaaluolekust pinnal tasakaaluolekusse. See juhtum on analoogne gaaside tasakaaluga gravitatsiooniväljas.
 ,
,
 ,
=>
,
=> -Henry võrrand
-Henry võrrand
 - jaotuskoefitsient
- jaotuskoefitsient
Adsorptsiooni käigus toimub keemiliste potentsiaalide muutus.
Hulgifaasi jaoks: 
Pinnagaasi jaoks: 
Tasakaaluseisundis  , st.
, st.

Henry võrrandis ei sõltu konstant kontsentratsioonist
Henry võrrand kehtib madala rõhu ja kontsentratsiooni piirkonnas. Kontsentratsiooni suurenedes on võimalik kahte tüüpi kõrvalekaldeid Henry seadusest:
1 - positiivsed kõrvalekalded, D väheneb, A väheneb
2 - negatiivsed kõrvalekalded, D - suureneb, A - suureneb.
Hälbe tüübi määrab ühe või teise adsorbendi-adsorbaadi interaktsiooni tüübi ülekaal.
Tugeva kleepuva interaktsiooni korral suurenevad aktiivsuskoefitsiendid - positiivne kõrvalekalle. Kohesiivsete interaktsioonide korral täheldatakse negatiivseid kõrvalekaldeid.
monomolekulaarne adsorptsioon.
Langmuiri isoterm.
Lihtsamad seaduspärasused saadi Henry teoorias. Langmuir pakkus välja teooria, mille kohaselt peetakse adsorptsiooni kvaasikeemiliseks reaktsiooniks. Kus:
Pind on energeetiliselt ühtlane.
Adsorptsioon on lokaliseeritud, iga adsorptsioonikeskus interakteerub ühe adsorbaadi molekuliga.
Adsorbaadi molekulid ei interakteeru üksteisega.
Adsorptsioon on ühekihiline.

 - pind,
- pind,  - adsorbeerida,
- adsorbeerida,  - adsorptsioonikompleks.
- adsorptsioonikompleks.
 , siis adsorptsioonisaitide kontsentratsioon:
, siis adsorptsioonisaitide kontsentratsioon:  ,
, - adsorptsiooni piiramine.
- adsorptsiooni piiramine.
 , siis reaktsioonikonstant:
, siis reaktsioonikonstant: 

 - Langmuiri võrrand.
- Langmuiri võrrand.
Adsorptsioon versus kontsentratsioon
1 )
)
 ,
,

2) kõrge kontsentratsiooniga piirkond
 - adsorptsiooni piiramine, monomolekulaarse kihi moodustumine
- adsorptsiooni piiramine, monomolekulaarse kihi moodustumine
Gibbsi energia jaoks: .
g on entroopia tegur.
Henry isotermi puhul iseloomustab Gibbsi energia adsorbaadi üleminekut põhiolekust standardolekusse pinnal. Langmuiri isotermi puhul  iseloomustab adsorbendi ja adsorbaadi afiinsusastet.
iseloomustab adsorbendi ja adsorbaadi afiinsusastet.
 leitud van't Hoffi isobaarist.
leitud van't Hoffi isobaarist.

 , Siis
, Siis  , järelikult
, järelikult  .
.

 - pinna täidisaste.
- pinna täidisaste.




 - vabade töökohtade arv,
- vabade töökohtade arv,  - hõivatud kohtade arv.
- hõivatud kohtade arv.
 ,
,

Need. kõrgete kontsentratsioonide piirkonnas on vabade kohtade arv pöördvõrdeline adsorbaadi kogusega.
Gaaside segu adsorptsioon homogeensel pinnal.
Sel juhul käsitletakse adsorptsiooniprotsessi kahe paralleelse reaktsioonina.
 (1)
(1)

 (2)
(2)


Gaaside segu adsorptsioon ebahomogeensel pinnal.
Mittehomogeense pinna puhul ei tohiks piirduda keskmiste täidistega.
Konkurentsi tulemusena on võimalik erinevate adsorbaatide lokaliseerimine erinevat tüüpi kohtades.
Sel juhul suhe  .
.
 ,
,
 on adsorbaadi küllastusauru rõhk.
on adsorbaadi küllastusauru rõhk.
 ,
,
 on adsorptsioonisoojus.
on adsorptsioonisoojus.
"+" - sümbaatiline sõltuvus, "-" - antibaatiline sõltuvus, "H" - korrelatsioon puudub.
"+" - adsorptsioon toimub sama mehhanismi järgi. Energeetiliselt kõige soodsamates piirkondades adsorbeerub valdavalt pinna suhtes kõrge afiinsusega gaas.
"-" - adsorptsioon toimub erinevate mehhanismide kaudu ja kuni teatud ajahetkeni puudub pinna pärast konkurents.
Monomolekulaarne adsorptsioon realiseerub valdavalt gaaside füüsilise adsorptsiooni käigus madalatel väärtustel lk, samuti vedeliku/gaasi liidesel.
Polümolekulaarne adsorptsioon.
BET teooria(Brunauer, Emmet, Teller).
Juhul, kui monokihi moodustumine on pinnaenergia kompenseerimiseks ebapiisav, on adsorptsioon polümolekulaarne ja seda võib pidada sundkondensatsiooni tulemuseks pinnajõudude toimel.
Põhisätted:
Kui adsorbaadi molekul tabab hõivatud kohta, moodustub mitmekordne komplekt.
Lähemale jõudes lk To lk s vabade adsorptsioonikohtade arv väheneb. Esialgu üksik-, paaris- jne kohtade arv suureneb ja seejärel väheneb. komplektid.
Kell lk =lk s adsorptsioon muutub kondenseerumiseks.
Horisontaalseid interaktsioone pole.
Esimese kihi jaoks tehakse Langmuiri isoterm.
Pinda peetakse adsorptsioonikohtade komplektiks. Kehtib dünaamilise tasakaalu tingimus: vabade kohtade kondenseerumiskiirus on võrdne hõivatud kohtadest aurustumise kiirusega.
a on kondensatsioonikoefitsient (pinnal kondenseerunud molekulide osa);
 ,
,
Zm on maksimaalne vabade kohtade arv.
 - aatomite vibratsiooni sagedus pinnaga risti.
- aatomite vibratsiooni sagedus pinnaga risti.
Esimese kihi dünaamilise tasakaalu tingimused on järgmised:



 , Siis
, Siis
 - Langmuiri võrrand.
- Langmuiri võrrand.
Teise kihi puhul on tõsi: 
I-nda kihi jaoks: 
Lihtsuse huvides eeldatakse, et a ja ν on kõigi kihtide jaoks samad, välja arvatud esimene. Kõigi kihtide puhul, välja arvatud esimene, on adsorptsioonisoojus konstantne. Viimase kihi puhul on adsorptsioonisoojus võrdne kondenseerumissoojusega. Selle tulemusena võrrand
 (*)
(*)
C- pidev,
BET-teooria puhul konstant KOOS iseloomustab puhta adsorptsiooni Gibbsi energiat. Võrrand sisaldab ainult ühte konstanti ja see võrrand on väga oluline ka adsorbendi eripinna määramisel.
Kuna adsorptsiooni tulemusena eraldub soojust, siis eripindade määramine toimub madalatel temperatuuridel.
 ????????????
????????????


Teooria peamine viga– Horisontaalsete interaktsioonide tähelepanuta jätmine vertikaalsete vastasmõjude kasuks.
Võrrand on vahemikus  0,05 kuni 0,3.
0,05 kuni 0,3.
Kus  <
0,05 – существенное влияние оказывает
неоднородность поверхности.
<
0,05 – существенное влияние оказывает
неоднородность поверхности.
 > 0,3 - adsorbaadi interaktsioon - adsorbaadi mõju.
> 0,3 - adsorbaadi interaktsioon - adsorbaadi mõju.
Adsorbaadi-adsorbaadi interaktsioonide arvestamine.
Interaktsioonid ilmnevad adsorptsiooni ajal hargnenud molekulide või molekulide mittepolaarsel pinnal. võimeline moodustama ühendusi. Sel juhul muutub adsorptsiooniisotermide kuju.
A  sorbent ei ole polaarne.
sorbent ei ole polaarne.
Graafik 1 vastab nõrkadele interaktsioonidele adsorbaat-adsorbaat, tugev adsorbaat-adsorbent.
Graafik 2 vastab tugevale adsorbaadi-adsorbaadi interaktsioonile, tugevale adsorbaadi-adsorbendi interaktsioonile.
Graafik 3 vastab tugevale adsorbaadi-adsorbaadi interaktsioonile, nõrgale adsorbaadi-adsorbendi interaktsioonile.
 ,
,

Adsorbaadi molekulide interaktsiooni korral on vaja arvestada aktiivsuskoefitsientide muutustega. Ja see võrrand on kirjutatud järgmiselt:
 - Frunkini, Fowleri, Guggenheimi võrrand.
- Frunkini, Fowleri, Guggenheimi võrrand.
k on külgetõmbe konstant.
Polani potentsiaali teooria.
See teooria ei tuleta ühtegi adsorptsiooni isotermi tüüpi, vaid võimaldab arvutada isoterme erinevatel temperatuuridel.
Adsorptsioon on adsorptsioonipotentsiaali toime tõttu adsorbaadi tõmbumise tulemus adsorbendi pinnale, mis ei sõltu teiste molekulide olemasolust ning sõltub pinna ja adsorbaadi molekuli vahelisest kaugusest.
 ,
,
 - adsorptsioonipotentsiaal.
- adsorptsioonipotentsiaal.
Kuna pind on ebahomogeenne, asendatakse kaugus adsorptsioonimahuga  .adsorptsiooni maht on antud väärtusele vastava pinna ja punkti vahele jääv ruumala
.adsorptsiooni maht on antud väärtusele vastava pinna ja punkti vahele jääv ruumala  .
.
Adsorptsioonipotentsiaal on 1 mooli adsorbaadi ülekandmine väljaspool etteantud adsorptsioonimahtu antud adsorptsioonimahu punkti (või töö, mille käigus viiakse 1 mooli adsorbaadi küllastunud auru, mis on vedeliku adsorbaadi puudumisel tasakaalus adsorbent aurufaasi, mis on adsorbendiga tasakaalus).

Iseloomulik kõver
 - adsorptsioonipotentsiaal,
- adsorptsioonipotentsiaal, 
Teatud adsorbendi ja erinevate adsorbaatide puhul kehtib järgmine: 
Erinevat tüüpi adsorbaatide jaoks  ,
,
Kus  adsorptsiooni isotermide potentsiaal suhtelisel rõhul
adsorptsiooni isotermide potentsiaal suhtelisel rõhul  adsorbaadi 1 ja adsorbaadi 2 jaoks. See suhe on konstantne väärtus.
adsorbaadi 1 ja adsorbaadi 2 jaoks. See suhe on konstantne väärtus.
 - afiinsuskoefitsient
- afiinsuskoefitsient
Kapillaaride kondenseerumise teooria.
Adsorptsiooniprotsessi kulg sõltub suuresti poorse keha struktuurist.
|
mikropoorne | |
|
Üleminekupoorne | |
|
Makropoorne |
Mikropoorsete sorbentide puhul adsorptsioonijõudude väljad kattuvad. Makropoorsete sorbentide puhul toimivad poorid transpordikanalitena. Kondensatsiooniprotsessid on kõige olulisemad mööduvate poorsete kehade puhul. Kapillaaride kondenseerumine algab teatud väärtustest lk Ja  kui osa pinnaenergiast on juba kompenseeritud. Vajalik tingimus on, et pind peab olema isekandev. Protsessi kirjeldatakse Thompsoni-Kelvini võrrand.
kui osa pinnaenergiast on juba kompenseeritud. Vajalik tingimus on, et pind peab olema isekandev. Protsessi kirjeldatakse Thompsoni-Kelvini võrrand.

 - märgumise korral on kõveruskese gaasifaasis.
- märgumise korral on kõveruskese gaasifaasis.
Kapillaarkondensatsiooni korral on adsorptsiooni isotermil hüstereesivorm. Alumine haru vastab adsorptsiooniprotsessile ja ülemine haru vastab desorptsiooniprotsessile.
Igat tüüpi poore saab vähendada kolme tüüpi:
|
kooniline |
Silindriline ühe suletud otsaga |
Silindriline kahe lahtise otsaga |
|
Protsessi täitmine toimub pooride põhjast. Adsorptsiooni isoterm ja desorptsiooni isoterm langevad sel juhul kokku, kuna adsorptsiooniprotsess algab sfäärist ja desorptsiooniprotsess algab ka mõne sfääri kadumisega.
↓ |
Hüstereesi pole. Edasi- ja tagasikäiku kirjeldatakse võrrandiga:
|
Põhja pole kuskil, pooride täitmine läheb mööda silindri seinu.
silinder: Isoterm ja sellel on hüstereesi vorm.
↓ |
IN  märgumistingimustes tekib kondenseerumine madalamal rõhul, mis on energeetiliselt soodne. Desorptsiooniharust saadakse pooride suuruse jaotuskõverad.
märgumistingimustes tekib kondenseerumine madalamal rõhul, mis on energeetiliselt soodne. Desorptsiooniharust saadakse pooride suuruse jaotuskõverad.
Diferentsiaalkõvera maksimum nihutatakse integraali käändepunkti suhtes vasakule. Väikeste pooride kogumaht on väike, kuid sellel on suured pinnad. Kui pooride suurus suureneb, suureneb nende maht  , ja ala as
, ja ala as  , tänu sellele täheldatakse diferentsiaalkõvera maksimumi nihet.
, tänu sellele täheldatakse diferentsiaalkõvera maksimumi nihet.
Adsorptsioon tahke-vedeliku liidesel.
Tahke-gaasi liidese adsorptsiooni korral jätsime ühe komponendi tähelepanuta. Tahke-vedeliku liidesel toimuva adsorptsiooni korral tõrjub adsorbaat lahusti molekulid adsorbendi pinnalt välja.
 ,
,
Õige võrrand on:

 ,
,
N 1, N 2 - lahusti ja komponendi moolifraktsioonid, N 1 + N 2 \u003d 1, siis
 ,
=>
,
=>
 , siis - faasipiiri tahke aine - vedelik adsorptsiooni võrrand.
, siis - faasipiiri tahke aine - vedelik adsorptsiooni võrrand.
Adsorptsioon (G) > 0 at  <
0
<
0
Kui väärtused  komponent ja lahusti on väga erinevad, antud juhul sõltuvus G alates N väärtusel on ekstreemum N
~ 0,5.
komponent ja lahusti on väga erinevad, antud juhul sõltuvus G alates N väärtusel on ekstreemum N
~ 0,5.
E  kui
kui  on sarnased väärtused, sel juhul võib adsorptsiooni märk muutuda. Sõltuvus G alates N ristub x-teljega
on sarnased väärtused, sel juhul võib adsorptsiooni märk muutuda. Sõltuvus G alates N ristub x-teljega
Funktsioon Ristmik G(N) abstsissteljega nimetatakse adsorptsiooni aseotroop. See tähendab, et kahte komponenti ei saa sellel adsorbendil eraldada.
Adsorptsiooni isotermi võrrand vahetuskonstandiga.
Tahke-vedeliku liidesel adsorptsiooni ajal jaotuvad komponendid pidevalt ümber adsorbendi pinna ja lahuse mahu vahel.
 - komponendid (- - viita pinnale)
- komponendid (- - viita pinnale)

 ,
,
 ,
, .
.
 ,
,


Adsorptsioon vedeliku-gaasi liidesel
R  Vaatleme kontsentratsiooniprofiili muutust vedeliku-gaasi liidese ületamisel. Olgu komponent 2 lenduv.
Vaatleme kontsentratsiooniprofiili muutust vedeliku-gaasi liidese ületamisel. Olgu komponent 2 lenduv.
Cs on kontsentratsioon pinnakihis.
Põhineb liigse adsorptsiooni määratlusel

Kui komponent ei ole lenduv, kirjutatakse adsorptsiooni väärtus järgmiselt:
P  ri
ri 

Võrrandis  mateeria olemust kirjeldab tuletis
mateeria olemust kirjeldab tuletis  .
.
Pindpinevuse isoterm võib olla kujul 1 või 2:
1 - pindaktiivsed ained
2 - pindaktiivsed ained
Pinnaaktiivsus g on ainete võime vähendada süsteemi pindpinevust.

 - pinnakihi paksus
- pinnakihi paksus
C s on komponendi kontsentratsioon pinnakihis
KOOS- mahu kontsentratsioon
Homoloogilise seeria jaoks kehtib reegel:
 - Traubeau Duclose reegel
- Traubeau Duclose reegel
Homoloogsete seeriate puhul näeb adsorptsiooni isoterm välja järgmine:
Kirjutame A asemel D, kuna pinnakihis on adsorptsioon liigne.
Pindpinevuse isoterm:

 on puhta lahusti pindpinevus.
on puhta lahusti pindpinevus.
 - põhiline adsorptsioonivõrrand;
- põhiline adsorptsioonivõrrand;
 - Langmuiri võrrand.
- Langmuiri võrrand.
Lahendame need koos:

- Šiškovski võrrand.
B on homoloogse seeria konstant.
A- ühelt homoloogilt teisele liikudes suureneb see 3-3,5 korda 
![]()
1 - madala kontsentratsiooniga piirkond
![]()
2 - keskmine kontsentratsioon
3 - monomolekulaarne kiht
Pindaktiivsed ained on amfifiilsed molekulid, st. Termin "polaarne rühm" ja mittepolaarne süsivesinikradikaal.
o on molekuli polaarne osa.
| on molekuli mittepolaarne osa.
Polaarses lahustis on pindaktiivse aine molekulid orienteeritud nii, et molekuli polaarne osa on lahusti poole, samal ajal kui mittepolaarne osa surutakse gaasifaasi.
Shishkovsky võrrandis  , on see homoloogsete seeriate puhul konstantne.
, on see homoloogsete seeriate puhul konstantne.
Pinnaktiivne tegevus hakkab ilmnema n>5. Monomolekulaarse kihi kontsentratsioonist kõrgemate kontsentratsioonide korral toimub pindaktiivsete ainete lahustes mitsellistumine.
Mitsell- nimetatakse amfifiilsete pindaktiivsete ainete molekulide agregaati, mille süsivesinikradikaalid moodustavad tuuma ja polaarsed rühmad muudetakse vesifaasiks.
Mitsellimass - mitsellimass.
H  molekulide arv on agregatsiooni arv.
molekulide arv on agregatsiooni arv.
Sfäärilised mitsellid
Mitsellimise korral luuakse lahuses tasakaal
CMC on mitselli kriitiline kontsentratsioon.
Kuna me käsitleme mitselli eraldi faasina:
Homoloogilise seeria jaoks on empiiriline võrrand:
a on funktsionaalrühma lahustumisenergia.
b on adsorptsioonipotentsiaali juurdekasv, adsorptsiooni töö metüleenühiku kohta.
on adsorptsioonipotentsiaali juurdekasv, adsorptsiooni töö metüleenühiku kohta.
Süsivesiniku tuuma olemasolu mitsellides võimaldab vees lahustumatud ühenditel lahustuda pindaktiivsete ainete vesilahustes, seda nähtust nimetatakse solubiliseerimiseks (mis lahustub, on solubilisaat, pindaktiivne aine on solubilisaator).
Muda võib olla täiesti mittepolaarne, sisaldada nii polaarseid kui ka mittepolaarseid osi ning olla orienteeritud nagu pindaktiivse aine molekul.
Igal juhul toimub solubiliseerimise ajal mitsellaarse massi ja agregatsiooniarvu suurenemine mitte ainult solubilisaadi kaasamise tõttu, vaid ka tasakaaluseisundi säilitamiseks vajalike pindaktiivsete ainete molekulide arvu suurenemise tõttu.
Solubiliseerimine on seda tõhusam, seda väiksem on solubilisaadi molekulmass.

 ~ 72 mN/m.
~ 72 mN/m.
 ~ 33 mN/m.
~ 33 mN/m.
Pindaktiivsete ainete efektiivsus sõltub CMC suurusest.
2D pinnakihi rõhk

→ -pindpinevusjõud.
- kahemõõtmeline rõhk.
Pinnakiht on jõud, mis on võrdne pindaktiivse aine lahuse ja puhta lahusti pindpinevuste vahega, mis on suunatud puhtale pinnale.
Tekib tasakaal lahuse ja pinnakihi vahel



Kell  on ala, kus
on ala, kus  lineaarselt sõltuv kontsentratsioonist.
lineaarselt sõltuv kontsentratsioonist.
G [mol/m2].
 pindala, mille hõivab üks mool ainet
pindala, mille hõivab üks mool ainet
Siis saab kahemõõtmeline rõhuisoterm kuju 
 on kahemõõtmeline rõhu isoterm.
on kahemõõtmeline rõhu isoterm.
Sõltuvus  S M-st:
S M-st:

Kell  - kahemõõtmeline rõhk suureneb järsult. Kell
- kahemõõtmeline rõhk suureneb järsult. Kell  kahemõõtmeline on deformeerunud, mis põhjustab järsu kasvu
kahemõõtmeline on deformeerunud, mis põhjustab järsu kasvu  .
.
Mõlemalt poolt samade faasidega piiratud kilet nimetatakse kahepoolseks. Sellistes filmides täheldatakse emalahuse pidevat liikumist.
Alla 5 nm paksuseid kilesid nimetatakse mustadeks kiledeks.

Adsorptsioonikihtidel peaks olema kaks omadust: viskoossus ja kerge liikuvus, voolavus ja elastsus.
Marangoni efekt on isetervendav.
Gibbsi kolmnurk,  - ülerõhk.
- ülerõhk.
Kile on venitatud ja kuna osa vedelikust on kadunud, tormavad pindaktiivsed ained vabasse ruumi. Gibbsi kolmnurk.
Kehade adsorptsioonitugevuse mõju.
Kile pinnal on alati adsorptsioonikiht, mille jaoks , siis
Langmuiri võrrand:


 kahemõõtmeliseks rõhuks
kahemõõtmeliseks rõhuks
 - Shishkovsky võrrandi analoog
- Shishkovsky võrrandi analoog
elektrokineetilised nähtused. Kahekordne elektriline kiht (DES).
Helemholtzi mudel. Gouy-Chapmani teooria.
1808 lend

U – kujuline toru, sellesse sukeldatud 2 elektroodi. Rikutakse anumate suhtlemise seadust ja toimub vedeliku taseme muutus torus - elektrokineetilised nähtused.
Kineetilised nähtused:
elektroforees
Elektroosmoos
Voolu (voolu) potentsiaal
Settimispotentsiaal
1 ja 2 tekivad potentsiaalide erinevuse rakendamisel, 3 ja 4 kolloidosakeste mulgustamine ja settimine põhjustavad potentsiaalide erinevuse ilmnemist.
Elektroosmoos on dispersioonikeskkonna liikumine statsionaarse hajutatud faasi suhtes elektrivoolu toimel.
elektroforees on hajutatud faasi osakeste liikumine elektrivoolu toimel statsionaarse dispersioonikeskkonna suhtes.
P  Elektrokineetiliste nähtuste esinemise põhjuseks on laengute ruumiline eraldumine ja kahekordse elektrikihi tekkimine.
Elektrokineetiliste nähtuste esinemise põhjuseks on laengute ruumiline eraldumine ja kahekordse elektrikihi tekkimine.
Elektriline topeltkiht on lamekondensaator, ühe plaadi moodustavad potentsiaali määravad ioonid, teise kontrainoosid. Ioonid on samuti saastunud, kuna potentsiaali määravad koioonid surutakse põhiosa lahusesse. Plaatide vaheline kaugus  . Potentsiaal langeb lineaarselt, potentsiaalide vahe
. Potentsiaal langeb lineaarselt, potentsiaalide vahe  .
.
Väline potentsiaalide erinevus põhjustab nihkemooduli ilmnemise  on jõudude paar pindalaühiku kohta, mis toimivad piki tahke keha pinda.
on jõudude paar pindalaühiku kohta, mis toimivad piki tahke keha pinda.

Tasakaalus on nihkemoodul võrdne viskoosse hõõrdemooduliga (  ).
).

Meie tingimustes  ,
,

 - Helemholtz-Smalukovski võrrand
- Helemholtz-Smalukovski võrrand
 - lineaarse kiiruse nihke i faasid.
- lineaarse kiiruse nihke i faasid.
E on elektrivälja tugevus.
 - plaatide potentsiaalide erinevus
- plaatide potentsiaalide erinevus
 - elektroforeetiline liikuvus [m 2 /(V * s)].
- elektroforeetiline liikuvus [m 2 /(V * s)].
Helemholtzi mudel ei võta arvesse molekulide soojusliikumist. Tegelikkuses on ioonide jaotus topeltkihis keerulisem.
Gouy ja Chapman tuvastasid järgmised DES-i põhjused:
Iooni üleminek ühest faasist teise, kui tasakaal on saavutatud.
Tahkefaasilise aine ioniseerimine.
Pinna täiendamine dispersioonikeskkonnas olevate ioonidega.
Polarisatsioon välisest vooluallikast.
Elektrilisel topeltkihil on hägune või hajus struktuur. Ioonid kipuvad hajutatud kihis ühtlaselt jaotuma.
Hajus kiht koosneb kontrainoonidest, kihi pikkuse määrab nende kineetiline energia. Absoluutsele nullile kalduval temperatuuril on kontrainoosid võimalikult lähedased potentsiaali määravatele ioonidele.
See teooria põhineb kahel võrrandil:
Boltzmanni võrrand

 - töötada elektrostaatilise vastasmõju jõudude vastu.
- töötada elektrostaatilise vastasmõju jõudude vastu.
 on laengu puistetihedus.
on laengu puistetihedus.

Poissoni võrrand 
Kuna DEL paksus on palju väiksem kui osakeste suurus ja lameda DEL puhul on tuletis koordinaatide suhtes  Ja
Ja  on tühistatud.
on tühistatud. 
e y jaoks y-ga<<1 функцию можно разложить в ряд Маклорена:

Piirdume kahe sarja liikmega, siis:


 - DEL paksus on vahemaa, milleni DEL potentsiaal väheneb eüks kord.
- DEL paksus on vahemaa, milleni DEL potentsiaal väheneb eüks kord.
Mida madalam on temperatuur, seda vähem  . Kell Т→0 – korter DES. Mida suurem on kontsentratsioon, seda rohkem mina, seda vähem
. Kell Т→0 – korter DES. Mida suurem on kontsentratsioon, seda rohkem mina, seda vähem  .
.





 “–” tähendab, et potentsiaal väheneb vahemaa kasvades. =>
“–” tähendab, et potentsiaal väheneb vahemaa kasvades. =>
=>

 ,
,
 - potentsiaal väheneb eksponentsiaalselt.
- potentsiaal väheneb eksponentsiaalselt.
Pinnalaengu tiheduse potentsiaal: 
Pinnalaeng on vastupidise märgiga ruumilaeng, mis on integreeritud üle kauguse.




=>


Kus potentsiaal väheneb 2,7 korda - 
Kahekihiline mahutavus 
Teooria miinuseks on see, et ei arvestata Helemholtzi kihi olemasolu, s.t. ei arvesta  , sellest ka vead põhiparameetrite määramisel. Samuti ei selgita see erineva iseloomuga ioonide mõju elektrilise kaksikkihi paksusele.
, sellest ka vead põhiparameetrite määramisel. Samuti ei selgita see erineva iseloomuga ioonide mõju elektrilise kaksikkihi paksusele.
Sterni teooria. Kolloidse mitselli struktuur.
Elektriline topeltkiht koosneb kahest osast: tihe ja hajus. Tihe kiht moodustub potentsiaali moodustavate ioonide koostoimel spetsiifiliselt adsorbeerunud ioonidega. Need ioonid on reeglina osaliselt või täielikult dehüdreeritud ja neil võib olla kas sama või vastupidine laeng kui potentsiaali määravatel ioonidel. See sõltub elektrostaatilise interaktsiooni energia suhtest  ja spetsiifiline adsorptsioonipotentsiaal
ja spetsiifiline adsorptsioonipotentsiaal  . Tiheda kihi ioonid on fikseeritud. Teine osa ioonidest asub difuusses kihis, need ioonid on vabad ja võivad liikuda sügavale lahusesse, s.t. kõrgema kontsentratsiooniga piirkonnast madalama kontsentratsiooniga piirkonda. Laengu kogutihedus koosneb kahest osast.
. Tiheda kihi ioonid on fikseeritud. Teine osa ioonidest asub difuusses kihis, need ioonid on vabad ja võivad liikuda sügavale lahusesse, s.t. kõrgema kontsentratsiooniga piirkonnast madalama kontsentratsiooniga piirkonda. Laengu kogutihedus koosneb kahest osast.

 - Helmholtzi kihi laeng
- Helmholtzi kihi laeng
 -Hajutatud kihi laeng
-Hajutatud kihi laeng
Pinnal on teatud arv adsorptsioonikeskusi, millest igaüks interakteerub ühe vastasiooniga. Sellise kvaasikeemilise reaktsiooni konstant on:

 , Kus
, Kus  - vastasioonide molaarosa lahuses
- vastasioonide molaarosa lahuses
Helmholtzi jaotus
Potentsiaal väheneb lineaarselt
Gouy potentsiaali jaotus. Tihedat kihti pole, potentsiaal väheneb väärtusest eksponentsiaalselt 
Ahtri jaotus.
Algselt on potentsiaalne vähenemine lineaarne ja seejärel eksponentsiaalne.
Kui elektroforeesi puhul rakendatakse elektrivälja, siis ei liigu otseselt mitte tahke faasi osake, vaid tahke faasi osake koos ümbritsevate ioonide kihiga. DES kordab hajutatud faasi osakese kuju. Potentsiaali rakendamisel rebitakse osa hajutatud kihist ära. Murdejoont nimetatakse libisev piir.
Libisemispiiril hajutatud kihi osa eraldumise tulemusena tekkivat potentsiaali nimetatakse nn. elektrokineetiline potentsiaal(Zeta potentsiaal  ).
).
Dispergeeritud faasi osakest, mida ümbritseb vastasioonide kiht ja kahekordne elektrikiht, nimetatakse mitsell.
Kolloidsete mitsellide kirjutamise reeglid:


1-1 laadimiselektrolüüti
T on hajutatud faasi osake.
AA on piir tiheda ja hajutatud osa vahel.
BB on libisemispiir.
Libisemispiir võib, aga ei pruugi ühtida joonega AA.
Nimetatakse pH väärtust, mille juures zeta potentsiaal on null isoelektriline punkt.
CaCl 2 + Na 2 SO 4 → CaSO 4 ↓ + 2NaCl
1. Üle CaCl 2
CaCl 2 ↔ Ca 2+ + 2Cl -
(CaSO 4 m∙nCa 2+ 2( n-x)Cl - ) 2 x + x Cl - - rekordilised mitsellid.
CaSO 4 m - täitematerjal.
CaSO 4 m∙nCa 2+ on tuum.
CaSO 4 m∙nCa 2+ 2( n-x)Cl - osake.
2. Üle Na 2 SO 4
Na 2 SO 4 ↔ 2 Na + + SO 4 2-
(CaSO 4 m∙nSO 4 2- 2(n-x)Na + ) 2x- 2xNa + - mitsell
CaSO 4 m - täitematerjal.
CaSO 4 m∙nSO 4 2 + on tuum.
CaSO 4 m∙nSO 4 2- 2(n-x)Na + - osake
Helemholtz-Smoluchowski võrrand

 - piiride nihke lineaarne kiirus (elektroosmoosi korral).
- piiride nihke lineaarne kiirus (elektroosmoosi korral).
 - potentsiaalide erinevus kondensaatori plaatidel (elektroosmoosi korral).
- potentsiaalide erinevus kondensaatori plaatidel (elektroosmoosi korral).


 - lahuse mahuline voolukiirus, S- ruut ristlõige rakud.
- lahuse mahuline voolukiirus, S- ruut ristlõige rakud.

E on elektrivälja tugevus.


 (elektroosmoosi jaoks).
(elektroosmoosi jaoks).
Voolupotentsiaali jaoks:

 - potentsiaal
- potentsiaal
 - membraani rõhk
- membraani rõhk
Reeglina on elektroforeetiliste ja elektroosmootsete liikuvuste väärtus väiksem kui arvutatud. Selle põhjuseks on:
Lõõgastav efekt (hajunud faasi osakese liikumise ajal rikutakse ioonse atmosfääri sümmeetriat).
Elektroforeetiline pidurdamine (lisahõõrde tekkimine vastasioonide liikumise tagajärjel).
Voolujoonte moonutamine elektrit juhtivate osakeste korral.
Pindpinevuse ja potentsiaali seos. Lippmanni võrrand.
DEL moodustumine toimub spontaanselt, kuna süsteem soovib oma pinnaenergiat vähendada. Püsivuse kontekstis T Ja lk Termodünaamika esimese ja teise seaduse üldistatud võrrand näeb välja järgmine:
 (2)
(2)
(3), (1)=(3) =>
=>

 - 1. Lippmanni võrrand.
- 1. Lippmanni võrrand.
 on pinnalaengu tihedus.
on pinnalaengu tihedus.
 - diferentsiaalmahtuvus.
- diferentsiaalmahtuvus.
 - 2. Lippmanni võrrand.
- 2. Lippmanni võrrand.
KOOS- mahutavus.
Lahendame 1. Lippmanni võrrandi ja põhiadsorptsioonivõrrandi:
 ,
,


 , Siis
, Siis
 - Nernsti võrrand
- Nernsti võrrand
 ,
,
 ,
,




 - elektrokapillaarkõvera (ECC) võrrand.
- elektrokapillaarkõvera (ECC) võrrand.
IN  :
: , Aga
, Aga 
Katioonsed pindaktiivsed ained (CSAS) vähendavad ECC katoodharu.
Anioonsed pindaktiivsed ained (ASS) vähendavad ECC anoodset haru.
Mitteioonsed pindaktiivsed ained (NSA) vähendavad ECC keskmist osa.
Hajutatud süsteemide stabiilsus. Kiilumissurve.
Dispergeeritud süsteemid võib jagada:
Termodünaamiliselt ebastabiilsed süsteemid võivad metastabiilsesse olekusse ülemineku tõttu olla kineetiliselt stabiilsed.
Stabiilsust on kahte tüüpi:
Sedimentatsiooni stabiilsus (gravitatsiooni suhtes).
Agregatiivne stabiilsus. (seoses kleepimisega)
Koagulatsioon on osakeste kokkukleepumise protsess, mis viib agregatiivse stabiilsuse kadumiseni. Koagulatsiooni võivad põhjustada temperatuuri, pH, segamise, ultraheli muutused.
Eristage koagulatsiooni:
Pööratav.
Pöördumatu.
Koagulatsioon toimub elektrolüütide sisseviimisega.
Koagulatsiooni reeglid:

Film- see on süsteemi osa, mis asub kahe liidese vahel.
lahutav surve tekib kile paksuse järsu vähenemisega lähenevate pinnakihtide koosmõjul.

«-» - kui kile paksus väheneb, suureneb eraldusrõhk.
P 0 on rõhk mahufaasis, mis on vahekihi jätk.
P 1 on rõhk filmis.
Stabiilsuse teooria. DLFO (Deryagin, Landau, Fairway, Overbeck).
DLVO teooria kohaselt eristatakse eraldusrõhus kahte komponenti:
elektrostaatiline P E (positiivne, see on tingitud elektrostaatilisest tõukejõust). Vastab Gibbsi energia vähenemisele koos kile paksuse suurenemisega.
Molekulaarne PM (negatiivne, atraktiivsete jõudude toime tõttu). Seda põhjustab kile kokkusurumine keemiliste pindjõudude toimel, jõudude toimeraadius on kümnendik nm energiaga suurusjärgus 400 kJ/mol.
Kogu interaktsioonienergia:

 - süsteem on agregaadi stabiilne
- süsteem on agregaadi stabiilne
 - ebastabiilne süsteem
- ebastabiilne süsteem
P  positiivne komponent.
positiivne komponent.
Kasv on tingitud potentsiaalse energia suurenemisest õhukeste kilede kokkusurumisel. Paksude kilede puhul kompenseeritakse ioonide liigne energia ja see on võrdne dispersioonikeskkonna põhiosa energia interaktsiooniga.
Kui  (
( - kile paksus,
- kile paksus,  - iooni raadius) kile hõrenemine toob kaasa molekulide ja ioonide kadumise ja vähenemise selles minimaalse pinnaenergiaga. Naaberosakeste arv väheneb, mille tulemusena suureneb kilesse jäävate osakeste potentsiaalne energia.
- iooni raadius) kile hõrenemine toob kaasa molekulide ja ioonide kadumise ja vähenemise selles minimaalse pinnaenergiaga. Naaberosakeste arv väheneb, mille tulemusena suureneb kilesse jäävate osakeste potentsiaalne energia.


DLVO teooria käsitleb osakeste vastastikmõju plaatide vastastikmõjuna.

Osakesed ei interakteeru



 - Laplace'i võrrand,
- Laplace'i võrrand,  ,
,


Nõrgalt laetud pindadele
Kõrgelt laetud pindade jaoks:

Molekulaarne komponent on kahe aatomi vastastikmõju:
 ~
~
Aatomi interaktsioon pinnaga:

Võtame kaks rekordit:
D  Molekulaarse komponendi saamiseks on vaja kokku võtta kõik parempoolse ja vasaku plaadi aatomite interaktsioonienergiad.
Molekulaarse komponendi saamiseks on vaja kokku võtta kõik parempoolse ja vasaku plaadi aatomite interaktsioonienergiad.
Kus  - Hamakeri konstant (arvestab interakteeruvate kehade olemust).
- Hamakeri konstant (arvestab interakteeruvate kehade olemust).
See. osakeste interaktsioonienergiat süsteemis saab väljendada potentsiaalikõverate abil.
I on esmane potentsiaalne miinimum. See on pöördumatu koagulatsiooni tsoon, domineerivad tõmbejõud.
II - agregatiivse stabiilsuse tsoon, domineerivad tõukejõud.
III - sekundaarse potentsiaali miinimum (või flokulatsioonitsoon). Dispergeeritud faasi osakeste vahel on elektrolüüdikiht ja osakesed saab eraldada ja viia agregatiivse stabiilsuse tsooni.

Kõver 1 – süsteem on agregatiivselt stabiilne.
Kõver 2 on stabiilne tsoonis I, mitte stabiilne tsoonis II.
Kõver 3 - süsteemis toimus koagulatsioon.
Kõver 4 – punktis 4 interaktsiooni koguenergia U=0,  , vastab see äärmuspunkt kiire hüübimise algusele.
, vastab see äärmuspunkt kiire hüübimise algusele.
On kaks juhtumit:
1. Pinnad on nõrgalt laetud:
U \u003d U E + U M = 0
 (1)
(1)
2)

 (2)
(2)



 - see on kihi paksus, mis vastab hüübimisprotsessi algusele.
- see on kihi paksus, mis vastab hüübimisprotsessi algusele.






 - nõrgalt laetud pindadele
- nõrgalt laetud pindadele
 Siis
Siis 
2. Tugevalt laetud pindade puhul:
 (1)
(1)
2)

 (2)
(2)


 (3)
(3)
 ,
,
Teeme ruudu (3)

Koagulatsioon:
Spetsiifilise adsorptsiooni korral saab ioone adsorbeerida superekvivalentses koguses nii, et pind võib oma laengut muuta. Pinda laaditakse.
Spetsiifilise adsorptsiooni korral saab adsorbeeruda mitte ainult vastandmärgiga, vaid ka ühe iooni ioone.
Kui adsorbeeritakse pinnaga sama märgiga ioonid, siis pinnakihis ei toimu mitte potentsiaali langus, vaid selle kasv.

Neutraliseeriv koagulatsioon (toimub nõrgalt laetud osakeste osalusel ja sõltub mitte ainult koaguleeriva elektrolüüdi laengust, vaid ka potentsiaalist tihedate ja hajusate kihtide piiril).
Smoluchowski kiire koagulatsiooni teooria.

Hüübimiskiiruse sõltuvus elektrolüütide kontsentratsioonist.
I – hüübimismäär on madal,
II - hüübimiskiirus on praktiliselt võrdeline elektrolüüdi kontsentratsiooniga.
III - kiire koagulatsiooni piirkond, kiirus ei sõltu praktiliselt kontsentratsioonist.
Põhisätted:
Esialgne sool on monodispersne, sarnased osakesed on sfäärilise kujuga.
Kõik osakeste kokkupõrked on tõhusad.
Kui kaks primaarset osakest põrkuvad, moodustub sekundaarne osake. Sekundaarne + esmane = tertsiaarne. Primaarne, sekundaarne, tertsiaarne - paljusus.
Keemilise kineetika osas saab hüübimisprotsessi kirjeldada võrrandiga:
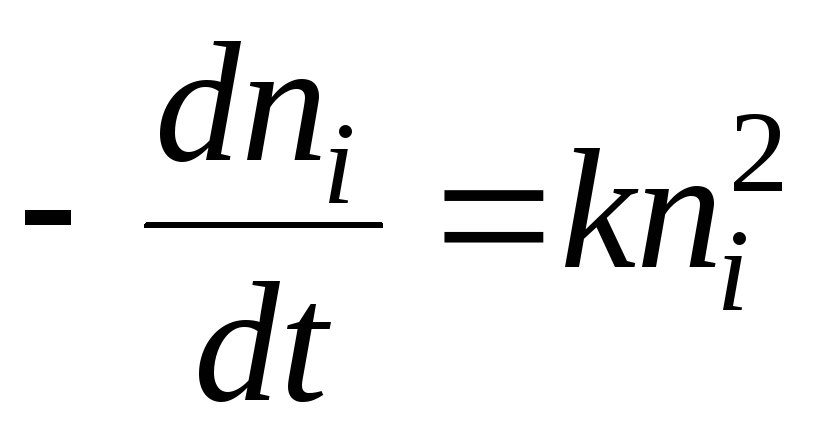
Lahenduseks on võrrand: 
 - poolkoagulatsiooni aeg. See on aeg, mille jooksul sooli osakeste arv väheneb 2 korda.
- poolkoagulatsiooni aeg. See on aeg, mille jooksul sooli osakeste arv väheneb 2 korda.

 ,
,
 ,
,
 ,
,


Kui paljusus suureneb, nihkub koagulatsioonikõverate maksimum suuremate väärtuste poole  .
.
Puudused:
Monodisperssuse eeldus.
Eeldus kõigi kokkupõrgete tõhususe kohta.




 - kera,
- kera, ,
,





