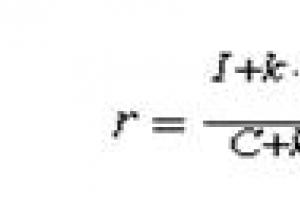Traube reegel, selle tõlgendus ja illustreerivad näited. Duclos-Traube reegel. Dubinini mikropooride mahulise täitmise teooria üldistatud võrrand, selle võrrandi erijuhud
See reegel töötab pindaktiivsete ainete homoloogsete seeriate lahustes ja on sõnastatud järgmiselt:
Süsivesinikradikaali pikkuse suurenemisega ühe CH rühma võrra 2 , pinnaaktiivsus suureneb homoloogses seerias 3–3,5 korda.
Illustreerime seda reeglit graafiliselt:

Joon.2.21. Sama homoloogse seeria pindaktiivsete ainete lahuste (1,2,3 - CH rühmade arv) pindpinevuse (a) ja adsorptsiooni (b) isotermid 2 - süsivesiniku radikaalis)
Pange tähele, et väärtus G ∞ ühe homoloogse seeria jaoks jääb püsiv. Seda seletatakse asjaoluga, et monokihi mahtuvus sõltub sel juhul ainult pindalast, mille pindaktiivse aine molekul selles kihis hõivab. Karboksüülhapete ja alkoholide seerias määrab selle ala polaarse rühma suurus, mis on sama terve pindaktiivsete ainete seeria puhul.
Seda reeglit järgitakse tõeliselt lahustuvate pindaktiivsete ainete puhul. Sest Pinnaaktiivsus määratakse lõpmatult lahjendatud süsteemide jaoks, on lihtne selgitada selle sõltuvust süsivesinikradikaali pikkusest. Mida pikem on radikaal, seda tugevamalt surutakse pindaktiivse aine molekul vesilahusest välja, sest radikaali sattumine vette suurendab ΔG ja molekulide pinnale jõudmise protsess on energeetiliselt väga soodne.
Šiškovski võrrand ( * )
Pindaktiivsete ainete molekulide adsorptsiooni korral faasipiiril võib kasutada mõlemat pakutud adsorptsioonivõrrandit homogeensel pinnal. Võrdleme neid üksteisega:
 =
=
 (2.56)
(2.56)
Eraldage muutujad ja integreerige need võrrandid:

 ,
(2.57)
,
(2.57)
 , (2.58)
, (2.58)
Kuna pindaktiivsete ainete lahustes on nende kõrge pindaktiivsuse tõttu absoluutse adsorptsiooni väärtused A peaaegu võrdne liigse adsorptsiooniga G, seega saab saadud võrrandi kirjutada kujul:. (2,59)
Saadud võrrandit nimetatakse Šiškovski võrrandid. Algselt tuletas ta selle empiiriliselt, et kirjeldada pindpinevuse sõltuvust pindaktiivse aine kontsentratsioonist:
Võrrand (2.60) sisaldab koefitsiente B ja A, mille füüsikaline tähendus on näha ülaltoodud tuletatud võrrandist (2.59).
Võrrandis on võimalik jälgida seost pindpinevuse ja adsorptsiooni vahel Frumkin (*) :
 , (2.61)
, (2.61)
millest järeldub, et sama adsorptsiooni korral vähendavad kõik homoloogid pindpinevust sama väärtuse ∆σ võrra.
Pinnaaktiivsuse erinevus pindaktiivsete ainete homoloogses seerias tuleneb nende erinevatest adsorptsiooniomadustest, s.o. sama G väärtus saavutatakse lühikese ahelaga pindaktiivsete ainete puhul oluliselt kõrgema C juures kui pika ahelaga pindaktiivsete ainete puhul. Aga kui homoloogide kontsentratsioonid on sellised, et nende adsorptsioonid on samad, siis nad vähendavad σ sama palju.
Pindaktiivse aine molekuli geomeetriliste mõõtmete eksperimentaalne määramine
Näitame, et teades monokihi mahtuvuse väärtust, saame arvutada S o- polaarrühma poolt hõivatud ala ja δ - pindaktiivse aine molekuli süsivesinikradikaali pikkus. Arvutatud andmeid saab võrrelda teiste sõltumatult määratud meetoditega.
 ,
,
Polaarrühma poolt hõivatud ala  (2.62)
(2.62)
Ühe molekuli poolt hõivatud maht V 1 = δ S o (2.63)
Ühekihi molaarmassi saab määrata järgmise valemiga:
M = ρ δS o N a , (2.64)
kus ρ on pindaktiivse aine tihedus, N a on Avogadro arv (*) . Ja sellest ajast peale
S o *N a \u003d 1 / G ∞, siis saab süsivesinikradikaali pikkuse määrata võrrandi põhjal:
 . (2.65)
. (2.65)
Saadud võrrandi arvukad eksperimentaalsed kontrollid näitasid head kokkulepet ülaltoodud võrrandist arvutatud ja muude meetoditega mõõdetud δ väärtuste vahel.
Faasi pinnakihi struktuuri tunnused.
Vahefaas, mis sisaldab ühte või mitut molekulaarset kihti
Iseärasused:
– Puhta aine mahu sees on kõik molekulidevahelise interaktsiooni jõud tasakaalus
– Kõikide pinnamolekulidele mõjuvate jõudude resultant on suunatud vedeliku sisse
– Pinnanähtused on tühised, kui kehamassi ja pinna suhe on kehamassi kasuks
– Pinnanähtused omandavad tähtsuse siis, kui aine on killustatud või kõige õhema kihi (kile) kujul
1 cm 3 nool 10 -7, S = 6000 m 2
1 mm vere nool 4 - 5 miljonit erütrotsüüti; 1l nool> 30 ml lahtrid, S = 1000 m 2
S alveoolid = 800 -1000 m 2; S maksa kapillaarid = 600 m 2
Gibbsi pinnaenergia
σ – pindpinevus
Gibbsi energia vähendamine:
Vähendades pindala (jämedad osakesed)
Pindpinevust (sorptsioon) vähendades
403)pind pinevus
Pinnaühiku loomiseks tehtud töö
Ühikud J / m 2
Vedeliku pinda piirava ja selle pinna vähendamise suunas suunatud joone pikkuse ühiku kohta mõjuv jõud
Ühikud N/m2
Pindpinevuse sõltuvus ainete olemusest, temperatuurist ja rõhust.
Vedelike pindpinevus väheneb temperatuuri tõustes ja muutub kriitilise temperatuuri lähedal nulliks. Rõhu suurenedes pindpinevus vedeliku-gaasi piirpinnal väheneb, kuna gaasifaasis molekulide kontsentratsioon suureneb ja jõud väheneb. Lahustunud ained võivad suurendada, vähendada ja praktiliselt mõjutada vedelike praktilist pinget. Vedeliku-vedeliku liidese pindpinevus sõltub külgnevate faaside olemusest. See on seda suurem, seda väiksem on erinevate molekulide vahelise molekulaarse interaktsiooni jõud.
Vedeliku pindpinevuse mõõtmise meetodid.
Vedeliku pinnalt rõnga lahtirebimise meetod
Meetod kapillaarist voolava teatud koguse uuritava vedeliku tilkade arvu loendamiseks (stalagmomeetriline)
Meetod rõhu määramiseks, mis on vajalik õhumulli eemaldamiseks vedelikku sukeldatud kapillaarist (Rehbinderi meetod)
Meetod vedeliku tõusu kõrguse mõõtmiseks kapillaaris, mille seinad on sellest hästi märjaks
Lahustunud aine jaotus pinnakihi ja faasi ruumala vahel.
teoreetiliselt on võimalik ette kujutada kolme lahustunud aine jaotumise juhtumit pinnakihi ja faasi ruumala vahel: 1) lahustunud aine kontsentratsioon pinnakihis on suurem kui faasi mahus. ) lahustunud aine kontsentratsioon pinnakihis on väiksem, kui faaside mahus 3) lahustunud aine kontsentratsioon pealiskihis on sama, mis faaside mahus.
Lahustunud ainete klassifitseerimine nende mõju järgi vedeliku (vee) pindpinevusele.
klassifikatsioon.1) lahustunud madalamas pinges p-la. Alkoholid, teile 2) lahustunud sisaldus suurendab veidi naatriumisisaldust. Inorg to-you, alused, soolad. sahharoos.
Gibbsi võrrand lahustunud ainete adsorptsiooni iseloomustamiseks. Võrrandi analüüs.
Г=-(C/RT)*(∆σ/∆C). Adsorptsiooni G-väärtus lahuse pinnal. ∆σ/∆C-pov aktiivsus in-va Analüüs: ∆σ/∆C=0, Г=0. See on NVD. ∆σ/∆C>0, G<0-поверхностно инактивные в-ва. ∆σ/∆C<0, Г>0-pindaktiivne aine.
Pindaktiivsete ainete molekulaarstruktuur ja omadused.
sv-va: Piiratud lahustuvus
Nende pindpinevus on väiksem kui vedelikel
Muutke dramaatiliselt vedeliku pinnaomadusi
Struktuur: Amfifiilne – molekuli erinevaid osi iseloomustab erinev seos lahustiga
Hüdrofoobsed omadused: süsivesinikradikaal
Hüdrofiilsed omadused: OH, NH 2, SO 3 H
Pindaktiivsete ainete klassifikatsioon, näited.
Molekulaarne või mitteioonne - alkoholid, sapp, valgud
Ioonsed anioonsed seebid, sulfoonhapped ja nende soolad, karboksüülhapped
Ioonsed katioonsed - orgaanilised lämmastikku sisaldavad alused ja nende soolad
Pindaktiivsete ainete olemuse mõju nende pinnaaktiivsusele. Duclos-Traube reegel.
Ahela pikenemine radikaali - CH 2 - poolt suurendab rasvhapete adsorbeerumisvõimet 3,2 korda
Kohaldatav ainult lahjendatud lahuste ja toatemperatuurilähedaste temperatuuride puhul, sest desorptsioon suureneb temperatuuri tõustes
Loe:
|
Nagu juba märgitud, peavad lahuse-gaasi liidesel adsorbeeruvad pindaktiivsete ainete (pindaktiivsete ainete) molekulid olema amfifiilsed, st omama polaarseid ja mittepolaarseid osi.
Pindaktiivsete ainete molekulide polaarosa võivad olla piisavalt suure dipoolmomendiga rühmad: -СООН, - ОН, -NH 2, - SH, -CN, -NO 2 .-СNS,
CHO, -SO 3 N.
Pindaktiivse aine molekuli mittepolaarne osa on tavaliselt alifaatsed või aromaatsed radikaalid. Süsivesiniku radikaali pikkus mõjutab tugevalt molekuli pinnaaktiivsust.
Duclos ja seejärel Traube, uurides küllastunud rasvhapete homoloogse seeria vesilahuste pindpinevusi, leidsid, et nende ainete pindaktiivsus lahuse-õhu piirpinnal on seda suurem, mida pikem on süsivesinikradikaal. Veelgi enam, kui süsivesinikradikaali pikendatakse ühe - CH 2 - rühma võrra, suureneb pinnaaktiivsus 3-3,5 korda (keskmiselt 3,2 korda). See positsioon sai tuntuks kui Duclos-Traube reegel .
Teine sõnastus sellest taandub järgmisele: kui rasvhappeahel kasvab eksponentsiaalselt, suureneb pinnaaktiivsus eksponentsiaalselt.
Mis on sellise sõltuvuse põhjus (füüsiline tähendus), mille kehtestas esmalt Duclos ja seejärel üldisemal kujul Traube? See seisneb selles, et ahela pikkuse suurenemisega rasvhappe lahustuvus väheneb ja seeläbi suureneb selle molekulide kalduvus liikuda mahult pinnakihile. Näiteks võihape seguneb veega igati, palderjanhape annab vaid 4% lahuse, kõik teised suurema molekulmassiga rasvhapped lahustuvad vees veelgi vähem.
Duclos-Traube reeglit, nagu hiljem leiti, ei järgita mitte ainult rasvhapete, vaid ka teiste homoloogseid seeriaid moodustavate pindaktiivsete ainete, alkoholide, amiinide jne puhul. Selle teoreetilise (termodünaamilise) põhjenduse andis Langmuir.
Kui pindaktiivset ainet sisestatakse vette, suruvad praktiliselt mittehüdreeruvad süsivesinikahelad veemolekulid lahku, kaasates selle struktuuri. Selle saavutamiseks tuleb töötada molekulaarjõudude vastu, kuna veemolekulide omavaheline interaktsioon on palju suurem kui veemolekulide ja pindaktiivsete ainete molekulide vahel. Pöördprotsess - pindaktiivsete ainete molekulide vabanemine liidese pinnale süsivesinike ahelate orientatsiooniga gaasi mittepolaarses faasis - toimub spontaanselt süsteemi Gibbsi energia vähenemise ja süsteemi töö "kasu" abil. adsorptsioon. Mida pikem on süsivesinikradikaal, seda suurem on veemolekulide arv, mida see eraldab ja seda suurem on pindaktiivse aine molekulide kalduvus pinnale tulla, s.t. seda suurem on nende adsorptsioon ja adsorptsiooni töö. Adsorptsiooni töö ahela pikendamisel ühe lüli võrra - CH 2 - suureneb sama väärtuse võrra, mis viib adsorptsiooni tasakaalukonstandi (adsorptsioonikoefitsiendi K) suurenemiseni sama palju kordi (3,2 korda temperatuuril 20 ° C). ) . See omakorda toob kaasa pinnaaktiivsuse suurenemise ~3,2 korda.
Tuleb märkida, et selle koostise puhul järgitakse Duclos-Traube'i reeglit ainult vesilahuste ja toatemperatuurilähedaste temperatuuride puhul.
Samade pindaktiivsete ainete lahuste puhul mittepolaarsetes lahustites on Duclos-Traube'i reegel vastupidine: süsivesinikradikaali pikkuse suurenemisega suureneb pindaktiivsete ainete lahustuvus ja need kipuvad pinnakihist lahusesse minema.
Rohkemaga kõrged temperatuurid keskmine tegur3,2 väheneb, kaldudes piirühikule: temperatuuri tõustes molekulaarse desorptsiooni tulemusena pinnaaktiivsus väheneb ja homoloogse rea liikmete pindaktiivsuse erinevus silub.
1. Valmistage kolme alkoholi (või orgaanilise happe) lahused 0,2, 0,1, 0,05, 0,025 ja 0,0125 M. üks homoloogne seeria.
2. Määrake seadme ja Rebinderi meetodi abil nende pindpinevuste väärtused, kirjutage tulemused ja arvutused tabelisse 3.6.
3. Joonistage ühele graafikule kõigi samasse homoloogsesse seeriasse kuuluvate pindaktiivsete ainete lahuste pindpinevus isotermid.
4. Arvutage graafikult kõigi lahuste pinnaaktiivsused Ds/DC kõikide kontsentratsioonide korral algsetest lineaarsetest graafikutest.
5. Arvutage homoloogse rea lähimate naabrite pinnaaktiivsuste suhe.
6. Tehke järeldus Duclos-Traube'i reegli teostatavuse kohta.
Tabel 3.6.
| Lahendused | KOOS, mol/l | P \u003d h 2 - h 1 | s, päeva/cm | Ds/DC |
| 0 | P o = | s o = | ||
| 0,0125 | ||||
| 0,025 | ||||
| 0,05 | ||||
| 0,1 | ||||
| 0,2 | ||||
| 0,0125 | ||||
| 0,025 | ||||
| 0,05 | ||||
| 0,1 | ||||
| 0,2 | ||||
| 0,0125 | ||||
| 0,025 | ||||
| 0,05 | ||||
| 0,1 | ||||
| 0,2 |
KONTROLLKÜSIMUSED:
Enne töö tegemist:
1. Sõnasta töö eesmärk.
2. Kirjeldage mõõtmisprotseduuri pindpinevuse määramiseks Rehbinderi meetodil.
3. Rääkige meile pindaktiivsete ainete lahuste pindaktiivsuse määramise ja adsorptsiooni arvutamise protseduur Gibbsi järgi.
4. Selgitage Duclos-Traube reegli teostatavuse kontrollimise korda ja arvutusi.
Oma töö kaitsmiseks toimige järgmiselt.
1. Pindpinevus on ...
2. Täpsustage vedelike pindpinevust mõjutavad tegurid.
3. Kas pehme ja kareda vee, mille proovid on sama temperatuuriga, pindpinevus on erinev? Põhjenda oma vastust.
4. Selgitage mõistete "absorptsioon" ja "adsorptsioon" erinevust. Tooge näiteid adsorptsiooni ja absorptsiooni kohta.
5. Joonistage graafikud adsorptsiooni sõltuvuse kohta pindaktiivse aine kontsentratsioonist temperatuuridel T 1 ja T 2, arvestades, et T 2< Т 1.
6. Joonistage graafikud pindpinevuse sõltuvusest pindaktiivse aine kontsentratsioonist temperatuuridel T 1 ja T 2, arvestades, et T 2 > T 1.
7. Määrake pindala aniliini C 6 H 5 NH 2 molekuli kohta selle õhupiiril, kui aniliini piirav adsorptsioon on G ¥ = 6,0 10 -9 kmol / m 2.
8. Too näide protsessist, mille käigus vee pindpinevus muutub nulliks.
9. Valige allolevast ühendite seeriast need, mis suurendavad vee pindpinevust: NaOH, NH 4 OH, C 6 H 5 NH 2, CH 3 -CH 2 -CH 2 -CH 2 -COOH, CH 3 -CH 2 ONa, KCNS
10. Kui erinevad on sama kontsentratsiooniga (madalatel kontsentratsioonidel) etüül- (CH 3 -CH 2 OH) ja butüül- (CH 3 -CH 2 -CH 2 -CH 2 OH) alkoholide pinnaaktiivsused.
11. Millistel järgmistest ühenditest on sama kontsentratsiooni juures suurim adsorptsiooniväärtus: HCOOH, CH 3 -COOH või CH 3 -CH 2 -COOH? Põhjenda oma vastust.
GAASIKROMATOGRAAFIA
Ainete segu eraldamise kromatograafiline meetod seisneb selles, et segu moodustavad ained liiguvad koos mittesorbeeriva kandegaasiga piki sorbendi pinda ( statsionaarne faas) ning nende ainete sorptsiooni- ja desorptsiooniprotsessid toimuvad pidevalt. Statsionaarne faas asetatakse düüsi kujul torusse, mida nimetatakse kromatograafiliseks kolonniks ja millest peavad läbima kõik sissevõetud ained, misjärel registreeritakse need kolonni väljalaskeavas kromatograafilise detektoriga. Ainete liikumine piki kolonni toimub ainult koos kandegaasi vooluga, samal ajal kui sorbeeritud olekus nad ei liigu suunas. Seetõttu, mida pikem on adsorbeeritud olekus üksiku aine molekulide keskmine "eluiga", seda väiksem on nende keskmine kiirus piki kolonni. Joonisel 3.1 on kujutatud detektori poolt nelja aine segu jaoks salvestatud kromatogramm.
Riis. 4.1 Nelja aine segu tüüpiline kromatogramm.
Nool joonisel 4.1 näitab segu sisenemise hetke kandegaasi voolu kolonni sisselaskeava juures. Kogu aeg, mille jooksul aine läbib kolonni ( säilitusaeg ) t u on kandegaasiga liikumise aja summa t0 ja adsorbeeritud olekus veedetud koguaeg t R (korrigeeritud säilitusaeg):
t u = t o + t R 4.1
t 0 on kõigi ainete puhul sama, kuna need liiguvad mööda kolonni koos kandegaasiga selle lineaarkiirusel u 0 . Kuna ainete jäämine adsorbeeritud olekus toimub eraldatavate ainete molekulide interaktsiooni tõttu vedela kile molekulidega (jaotuskromatograafia) või tahke faasi pinnaga (adsorptsioonkromatograafia), siis t R sõltub statsionaarse faasi olemus. Segu komponentidel, mis erinevad antud statsionaarse faasiga interaktsiooni energia poolest, on erinevad t R väärtused. Näiteks nende interaktsioonide energia süsivesinike derivaatide puhul määratakse süsivesinike ahela pikkuse ja funktsionaalrühmade olemasoluga, mistõttu korrigeeritud retentsiooniaja t R väärtus on kvalitatiivne omadus antud aine konstantsetes katsetingimustes: temperatuur ja kandegaasi mahuline kiirus (w ).
Keskmine liini kiirus segu i-nda komponendi liikumine mööda kolonni u i = l/t u , Kus l- veeru pikkus, mida kirjeldab põhivõrrand:
 4.2
4.2
u 0 - kandegaasi kiirus;
 - Henry koefitsient, s.o. i-nda aine jaotustegur statsionaarse ja gaasifaasi vahel;
- Henry koefitsient, s.o. i-nda aine jaotustegur statsionaarse ja gaasifaasi vahel;
C a ja C on vastavalt aine kontsentratsioonid nendes faasides tasakaaluolekus;
 nimetatakse faasisuhteks ja see on võrdne statsionaarse faasi mahu V a suhtega, milles toimub sorptsioon liikuva (gaasi) faasi ruumalasse kolonnis. V = wt o., w on kandegaasi mahuline kiirus
.
nimetatakse faasisuhteks ja see on võrdne statsionaarse faasi mahu V a suhtega, milles toimub sorptsioon liikuva (gaasi) faasi ruumalasse kolonnis. V = wt o., w on kandegaasi mahuline kiirus
.
Tulenevalt sellest, et Г i eest erinevaid aineid segud erinevad üksteisest, nende liikumine piki kolonni toimub erinevatel keskmistel kiirustel, mis viib nende eraldumiseni. Mittesorbeerivad ained ja ka kandegaas läbivad kogu kolonni pikkuse aja t 0 jooksul. Seega
 , 4.З
, 4.З
need.  , 4.4
, 4.4
Kus
 , 4.5
, 4.5
Parema ja vasaku külje korrutamine w, saame
 , 4.6
, 4.6
V R- korrigeeritud retentsioonimaht , sõltub ainult statsionaarse faasi mahust kolonnis ja Henry koefitsiendist. Kahe komponendi 1 ja 2 suhteline peetav maht, mis on võrdne, ei sõltu V a , vaid ainult ainete olemusest ja temperatuurist
 , 4.7
, 4.7
Seega on suhteline peetav maht aine kõige reprodutseeritavam kvalitatiivne tunnus võrreldes t u , t R ja V R .
FÜÜSIKALINE JA KOLLOIDNE KEEMIA
Loengute kokkuvõte Lõuna-Föderaalülikooli (RSU) bioloogiateaduskonna üliõpilastele
4.1 PINNÄHTED JA ADSORPTSIOON
4.1.2 Adsorptsioon lahuse-auru liidesel
Vedelates lahustes on pindpinevus σ funktsioon lahustunud aine kontsentratsioonist. Joonisel fig. 4.1 on näidatud kolm võimalikku pindpinevuse sõltuvust lahuse kontsentratsioonist (nn pindpinevusisotermid). Nimetatakse aineid, mille lisamine lahustile vähendab pindpinevust pindaktiivsed(pindaktiivsed ained), ained, mille lisamine suurendab või ei muuda pindpinevust - pinna-inaktiivne(PIAV).
Riis. 4.1 Pinna isotermid Riis. 4.2 Adsorptsiooni isoterm
PIAV-i (1, 2) ja pindaktiivse aine lahuste pinge lahuse-auru liidesel
Pindaktiivne aine (3)
Pindpinevus ja sellest tulenevalt pinnaenergia vähenemine toimub pindaktiivse aine adsorptsiooni tulemusena vedeliku-auru liidesel, s.o. asjaolu, et pindaktiivse aine kontsentratsioon lahuse pinnakihis on suurem kui lahuse sügavuses.
Adsorptsiooni kvantitatiivne mõõt lahuse-auru liidesel on pinna ülejääk G (gamma), võrdub lahustunud aine moolide arvuga pinnakihis. Kvantitatiivne seos lahustunud aine adsorptsiooni (pinna liia) ja lahuse pindpinevuse muutumise vahel lahuse kontsentratsiooni suurenemisega määrab Gibbsi adsorptsiooni isoterm:
Pindaktiivse aine adsorptsiooni isotermi graafik on näidatud joonisel fig. 4.2. Võrrandist (IV.5) järeldub, et protsessi suund – aine kontsentratsioon pinnakihis või, vastupidi, selle olemasolu vedelfaasis – määratakse tuletise märgiga d σ / dС. Selle tuletise negatiivne väärtus vastab aine akumuleerumisele pinnakihti (G > 0), positiivne väärtus vastab aine madalamale kontsentratsioonile pinnakihis võrreldes selle kontsentratsiooniga lahuse põhimassis.
Väärtust g \u003d -d σ / dС nimetatakse ka lahustunud aine pinnaaktiivsuseks. Pindaktiivsete ainete pindaktiivsus teatud kontsentratsioonil C 1 määratakse graafiliselt, tõmmates pindpinevusisotermi puutuja punktis C = C 1 ; sel juhul on pindaktiivsus arvuliselt võrdne kontsentratsioonitelje puutuja kalde puutujaga:
On lihtne näha, et kontsentratsiooni suurenedes pindaktiivsete ainete pindaktiivsus väheneb. Seetõttu määratakse aine pindaktiivsus tavaliselt lahuse lõpmatult väikese kontsentratsiooni juures; sel juhul sõltub selle väärtus, tähisega g o, ainult pindaktiivse aine ja lahusti olemusest. Uurides orgaaniliste ainete vesilahuste pindpinevusi, kehtestasid Traube ja Duclos homoloogsete pindaktiivsete ainete seeria jaoks järgmise rusikareegli:
Mis tahes homoloogses seerias madalatel kontsentratsioonidel suurendab süsinikuahela pikenemine ühe CH2 rühma võrra pinnaaktiivsust 3–3,5 korda.
Rasvhapete vesilahuste puhul kirjeldab pindpinevuse sõltuvust kontsentratsioonist empiiriline Šiškovski võrrand :
![]() (IV.6a)
(IV.6a)
Siin on b ja K empiirilised konstandid ning b väärtus on kogu homoloogilise jada jaoks sama ning K väärtus suureneb rea iga järgmise liikme puhul 3–3,5 korda.

Riis. 4.3 Piirake pindaktiivsete ainete molekulide orientatsiooni pinnakihis
Enamiku pindaktiivsete ainete molekulid on amfifiilse struktuuriga, s.t. sisaldavad nii polaarset rühma kui ka mittepolaarset süsivesinikradikaali. Selliste molekulide paiknemine pinnakihis on energeetiliselt kõige soodsam tingimusel, et molekulid on polaarse rühma poolt orienteeritud polaarsele faasile (polaarne vedelik) ja mittepolaarne rühm mittepolaarsele faasile (gaas või mittepolaarne vedelik). Lahuse madala kontsentratsiooni korral rikub termiline liikumine pindaktiivse aine molekulide orientatsiooni; kontsentratsiooni suurenemisega adsorptsioonikiht küllastub ja liidesele moodustub "vertikaalselt" orienteeritud pindaktiivsete ainete molekulide kiht (joon. 4.3). Sellise monomolekulaarse kihi moodustumine vastab pindaktiivse aine lahuse pindpinevuse minimaalsele väärtusele ja adsorptsiooni G maksimaalsele väärtusele (joonis 4.1-4.2); pindaktiivse aine kontsentratsiooni edasisel suurenemisel lahuses pindpinevus ja adsorptsioon ei muutu.
Autoriõigus © S. I. Levchenkov, 1996-2005.
Keemiku käsiraamat 21
Keemia ja keemiatehnoloogia
Duclos Traube, reegel
Sõnastage Duclos-Traube'i reegel ja selgitage selle füüsilist tähendust. Millise pinnakilede struktuuri juures seda reeglit järgitakse Milline on selle reegli pöörduvus
Duclos-Traube reegli füüsiline tähendus
Kolloidsetel pindaktiivsetel ainetel on kõrge pindaktiivsus, mis sõltub peamiselt süsivesinikradikaali pikkusest. Radikaali pikkuse suurenemine ühe rühma võrra. -CH2- põhjustab pinnaaktiivsuse suurenemist ligikaudu 3,2 korda (Duclos-Traube'i reegel). Seda reeglit järgitakse peamiselt tõeliselt lahustuvate pindaktiivsete ainete puhul. Kuna pinnaaktiivsuse määrab süsteemi lõpmatu lahjendus, on selle sõltuvust süsivesinikradikaali pikkusest lihtne selgitada. Mida pikem on radikaal, seda tugevamini surutakse pindaktiivse aine molekul vesilahusest välja (lahustuvus väheneb).
Saadud suhte r (n-s) / r (u) avaldis peegeldab Duclos-Traube'i reeglit.
See reegel on täidetud ainult pindaktiivsete ainete vesilahuste puhul. Pindaktiivsete ainete lahuste puhul mittepolaarsetes lahustites väheneb pinnaaktiivsus süsivesinikradikaali pikkuse suurenemisega (Duclos-Traube'i reegli ümberpööramine).
Pindpinevuste kontsentratsiooni sõltuvuste kogu mitmekesisust saab esitada kolme tüüpi kõveratega (joonis 43). Pindaktiivseid aineid iseloomustavad 1. tüüpi kõverad. Pindaktiivsed ained on vähem polaarsed kui lahusti ja nende pindpinevus on väiksem kui lahustil. Lahusti molekulide interaktsiooni intensiivsus pindaktiivsete ainete molekulidega on väiksem kui lahusti molekulide omavahelise vastasmõju intensiivsus. Seoses veega, polaarse lahustiga, on pindaktiivsed ained orgaanilised ühendid, mis koosnevad süsivesinikradikaalist (hüdrofoobne või oleofiilne osa) ja karboksüülhapete, nende soolade, alkoholide, amiinide polaarsest rühmast (hüdrofiilne osa). See molekuli amfifiilne struktuur on tunnusmärk pindaktiivset ainet. Süsivesinike ahelad, millel puudub püsiv dipoolmoment, on hüdrofoobsed, interakteeruvad üksteisest nõrgemini veemolekulidega ja surutakse pinnale. Seetõttu on orgaanilised ained, millel pole polaarset rühma (näiteks parafiinid, nafteenid), vees praktiliselt lahustumatud. Polaarsed rühmad nagu -OH, -COOH, -NH jne omavad suurt afiinsust vee suhtes, on hästi hüdreeritud ja sellise rühma olemasolu molekulis määrab pindaktiivse aine lahustuvuse. Seega sõltub pindaktiivsete ainete lahustuvus vees süsivesinikradikaali pikkusest (homoloogilises seerias lahustuvus väheneb pikkuse kasvades). Näiteks karboksüülhapped i - C4 lahustuvad vees lõpmatult, C5 - C12 hapete lahustuvus väheneb märgatavalt C-aatomite arvu suurenemisel ja kui süsivesinike ahela pikkus on üle i2, on need praktiliselt lahustumatu. Pindaktiivse aine molekuli süsivesiniku radikaali pikkuse suurenemine ühe CHa rühma võrra toob kaasa pinnaaktiivsuse suurenemise 3,2–3,5 korda (seda reeglit nimetatakse Duclos-Traube reegliks).
Langmuiri ideed adsorptsiooni kohta võimaldavad selgitada ka tuntud Duclos-Traube reeglit (1878), mis sarnaselt Šiškovski võrrandiga loodi eksperimentaalselt madalamate rasvhapete lahuste jaoks. Selle reegli kohaselt on kahe naaberhomoloogi, mis vastavad samale A-le, kontsentratsioonide suhe konstantne ja ligikaudu 3,2. Sama järelduseni võib jõuda Šiškovski võrrandi põhjal. Meil on n-nda ja (n + 1)-nda homoloogi jaoks (4.42).
Võrrand (39) määrab kindlaks pinnapõlemisaktiivsuse sõltuvuse otsese küllastunud süsivesinikradikaali pikkusest ja sisaldab sisuliselt Duclos-Traube reeglina tuntud seaduspärasust. Tõepoolest, seeria (n + 1) liikme jaoks võime kirjutada
Vastavalt võrrandile (42) sõltub Duclos-Trauberi reegli koefitsiendi p väärtus LS-i juurdekasvu väärtusest. Selle väärtuse vähenemine viib homoloogide pinnaaktiivsuse erinevuse vähenemiseni ja vastupidi.
Duclos-Traube reeglit saab Langmuiri sõnul põhjendada järgmiselt. Oletame, et pinnakihi paksus on võrdne O-ga. Siis on keskmine kontsentratsioon selles kihis Г/0. Termodünaamikast on teada, et maksimaalset tööd A, mis on vajalik gaasi kokkusurumiseks ruumalast Fi mahuni Vit, saab esitada kui
Suhe (VI. 37) peegeldab Duclos-Traube reeglit. See on konstantne väärtus ja vesilahuste puhul temperatuuril 20 °C on 3,2. Muul temperatuuril kui 20 °C on konstandil teised väärtused. Pinna aktiivsus on võrdeline ka Langmuiri võrrandis (või Shishkovsky võrrandis) sisalduva konstandiga, kuna Kr = KAoo (III. 17) ja monokihi Loo-mahtuvus on antud homoloogse rea korral konstantne. Orgaanilise keskkonna puhul on Duclos-Traube'i reegel vastupidine; pinnaaktiivsus väheneb pindaktiivse aine süsivesinikradikaali pikkuse suurenedes.
On lihtne näha, et võrrandid (76) ja (77) on sarnased võrrandiga (39), mis väljendab Duclos-Traube'i reeglit. See näitab seost pindaktiivsete ainete lahuste mahu- ja pinnaomaduste vahel ning rõhutab adsorptsiooni ja mitsellide moodustumise nähtuste ühisust. Tõepoolest, pindaktiivsete ainete homoloogsetes seerias muutub CMC väärtus ligikaudu pöördvõrdeliselt pinnaaktiivsusega, nii et naaberhomoloogide CMC suhe vastab Duclos-Traube'i reegli koefitsiendile.
Sellest võrrandist on näha, et süsivesinike ahela pikendamisel CH2 rühma võrra peaks adsorptsiooni töö suurenema konstantse väärtuse võrra. See tähendab, et madalatel kontsentratsioonidel, mille puhul järgitakse ainult Duclos-Traube'i reeglit, on kõik CH rühmad ahelas pinna suhtes samas asendis, mis on võimalik ainult siis, kui ahelad on pinnaga paralleelsed, st asuvad. selle kallal. Pindaktiivsete ainete molekulide pinnakihis orientatsiooni küsimuse juurde tuleme tagasi selles jaotises hiljem.
See tähendab, et G on pöördvõrdeline. Nüüd kirjutatakse Duclose-Traube'i reegel järgmiselt
Eespool sõnastatud Duclos-Traube'i reegel on täidetud toatemperatuurile lähedasel temperatuuril. Kõrgematel temperatuuridel suhe 3,2 väheneb, kaldudes ühtsusele, kuna temperatuuri tõustes molekulide desorptsiooni tulemusena pinnaaktiivsus väheneb ja homoloogide pinnaaktiivsuse erinevus silub.
See seletus on aga vastuolus tõsiasjaga, et samadel objektidel mõõdetud Goo väärtused vastavad molekulide seisvale, mitte lamavale asendile, mistõttu on need n-st peaaegu sõltumatud. Duclos-Traube on rahul, adsorbeeritud molekulid asuvad pinnal ja nende tiheduse kasvades tõusevad nad järk-järgult. Kuid on ilmne, et selline tõlgendus ei sobi kokku Langmuiri isotermi range rakendamisega, mille puhul eeldatakse, et Goo on konstantne väärtus, mis ei sõltu adsorptsioonikihi täiteastmest.
Seda, mil määral järgitakse Duclos-Traube'i reeglit rasvhapete homoloogsete seeriate puhul, on näha tabelis olevatest andmetest. V, 4. Duclos-Traube'i reeglit ei järgita mitte ainult rasvhapete, vaid ka teiste homoloogsete seeriate puhul - alkoholid, amiinid jne.
Duclos-Traube'i reegli teine sõnastus on see, et kui rasvhappeahela pikkus suureneb eksponentsiaalselt, suureneb pinnaaktiivsus eksponentsiaalselt. Sarnast seost tuleb jälgida ka siis, kui molekul on piklik ja väärtuse jA puhul, kuna ainete pindaktiivsus piisavalt madalatel kontsentratsioonidel on võrdeline kapillaarkonstandi erikonstandiga.
Samuti tuleb märkida, et Duclos-Traube reeglit järgitakse ainult pindaktiivsete ainete vesilahuste puhul. Samade ainete lahuste puhul mittepolaarsetes lahustites on Duclos-Traube'i reegel ümberpööratud, kuna suurenedes
Esimeses lähenduses võib ka eeldada, et mida paremini keskkond adsorbenti lahustab, seda halvem on adsorptsioon selles keskkonnas. See säte on üks Duclos-Traube'i reegli tühistamise põhjusi. Seega, kui rasvhappe adsorptsioon toimub hüdrofiilsel adsorbendil (näiteks silikageelil) süsivesinikkeskkonnast (näiteks benseenist), siis adsorptsioon ei suurene happe molekulmassi suurenemisega järgmiselt. Duclos-Traube reeglist, kuid väheneb, kuna kõrgemad rasvhapped lahustuvad paremini mittepolaarses keskkonnas.
On selge, et sellist Duclos-Traube'i reegli ümberpööramist ei saa täheldada sileda pinnaga mittepoorsete adsorbentide puhul.
Duclos-Traube reegel
Lahustuvate pindaktiivsete ainete Duclos-Traube'i reegel on täidetud laias kontsentratsioonivahemikus, alustades lahjendatud lahustest ja lõpetades pinnakihtide maksimaalse küllastumisega. Sel juhul saab Traube'i koefitsienti väljendada pinnakihi küllastumisele vastavate kontsentratsioonide suhtena
Duclos-Traube reeglil on oluline teoreetiline ja praktiline väärtus. See näitab õiget suunda väga aktiivsete pikkade ahelatega pindaktiivsete ainete sünteesis.
Kuidas formuleeritakse Duclos-Traube'i reegel Kuidas seda saab kirjutada Kuidas näevad välja kahe naaberhomoloogi pindpinevusisotermid süsinikuaatomite arvuga n ja n -
Seose Shishkovsky võrrandis sisalduvate konstantide ja pindaktiivsete ainete molekulide struktuuri vahel saab tuvastada Duclose ja Traube'i loodud mustrile viidates. Duclos leidis, et pindaktiivsete ainete võime alandada vee pindpinevust homoloogses seerias suureneb süsinikuaatomite arvu suurenemisega. Traube täiendas Duclose tähelepanekuid. Nende teadlaste leitud pinnaaktiivsuse ja süsinikuaatomite arvu vahelist seost nimetati Duclos-Traube'i reegliks. Kui homoloogses reas süsinikuaatomite arv suureneb aritmeetilises progressioonis, suureneb pinnaaktiivsus eksponentsiaalselt ja molekuli süsivesiniku osa suurenemine ühe CH3 rühma võrra vastab pinnaaktiivsuse suurenemisele umbes 3-3,5 korda (keskmiselt 3,2 korda).
Duclos-Traube'i reegel on kõige täpsem madalate lahustunud aine kontsentratsioonide korral. Sellepärast
Duclos-Traube reeglist tuleneb oluline järeldus: pindala molekuli kohta adsorptsioonikihi maksimaalse küllastumise korral jääb ühe homoloogse seeria piires konstantseks.
Alifaatsed pöörduvad konkureerivad inhibiitorid. Nagu näha jooniselt fig. 37, ei ole aktiivse tsentri afiinsuskoht inhibiitormolekulis (alkanoolid) alifaatse ahela struktuuri suhtes väga spetsiifiline. Olenemata sellest, kas alifaatne ahel on normaalne või hargnenud, määrab KOH alkanooli pöörduva seondumise efektiivsuse aktiivtsentriga K-rühma hüdrofoobsus, nimelt log i väärtus, mis iseloomustab ahela tugevust. kompleks, suureneb lineaarselt (ühtsuselähedase kaldega) nende ühendite jaotusastmega 1 R vee ja standardse orgaanilise faasi (n-oktanool) vahel. Sel juhul täheldatud juurdekasvu väärtus tasuta energiat CHa rühma ülekanne veest aktiivsesse keskkeskkonda on ligikaudu -700 cal/mol (2,9 kJ/mol) (homoloogilise seeria alumiste liikmete puhul). See väärtus on lähedane vaba energia juurdekasvu väärtusele, mis tuleneb kolloidkeemias tuntud Duclos-Traube reeglist ja on iseloomulik vedela CH-rühma veest mittevesilikuks (hüdrofoobseks) üleminekul. ) keskmine. Kõik see võimaldab käsitleda kümotrüpsiini aktiivse tsentri hüdrofoobset piirkonda valgugloobuli pinnakihis paikneva orgaanilise lahusti tilgana. See tilk kas adsorbeerib hüdrofoobse inhibiitori veest liidesele või ekstraheerib selle mõnevõrra süvendatuna täielikult. Hüdrofoobse piirkonna mikroskoopilise struktuuri seisukohalt oleks õigem käsitleda seda mitselli fragmendina, kuid selline detailimine tundub ebavajalik, kuna on teada, et n- ülemineku vaba energia. alkaanid veest dodetsüülsulfaatmitselli mikroskoopilisse keskkonda erineb vähe vabast energiast, mis tekib samade ühendite vabanemisel veest makroskoopilisse vedelasse mittepolaarsesse faasi.
Adsorptsioon orgaanilisest faasist. Sel juhul läheb naaber (vesi)faasi ainult polaarne rühm. Järelikult määrab adsorptsiooni töö ainult orgaanilises faasis ja vees olevate polaarsete rühmade molekulidevahelise interaktsiooni energia erinevus, st nende energiaoleku muutus üleminekul orgaanilisest vedelikust vette. Kuna süsivesinikradikaalid jäävad orgaanilisse faasi, on PAAUdaO ja orgaanilisest faasist adsorptsiooni töö V0. Sellisel juhul ei tohiks adsorptsiooni töö sõltuda süsivesinikradikaali pikkusest ja Duclos-Traube reeglit ei tohiks järgida. Tõepoolest, nagu näitavad eksperimentaalsed andmed, adsorbeeritakse kõik normaalsed alkoholid ja happed parafiinsetest süsivesinikest veega piiril ligikaudu võrdselt. Seda on hästi illustreeritud joonisel fig. 4 . Suurus-
Järelikult on ühendi pindaktiivsus seda suurem, mida tugevamalt avaldub molekuli polaarne asümmeetria. Pindaktiivse aine molekuli mittepolaarse osa mõju pinnaaktiivsusele avaldub kõige enam homoloogsetes seeriates (joonis 20.1). G. Duclos avastas selle seaduspärasuse, mille siis täpsemalt sõnastas P. Traube reeglina, mida nimetatakse Duclos-Traube reegliks.
P väärtust nimetatakse Traube'i koefitsiendiks. Duclos-Traube reegli teoreetilise seletuse andis hiljem I. Langmuir. Ta arvutas kahe naaberhomoloogi energiakasvu nende süsivesinike ahelate üleminekul veest õhku ja leidis, et erinevus, mis vastab ühe CH3 rühma ülemineku energiale, on homoloogses reas konstantne ja on lähedane 3 kJ / mol. . Energia suurenemine on tingitud asjaolust, et kui mittepolaarne ahel surutakse vesikeskkonnast õhku, ühinevad vee dipoolid ja süsteemi Gibbsi energia väheneb. Samal ajal väheneb Gibbsi energia ja keskkonda läinud pindaktiivse aine ahel, mille suhtes tal on kõrge polaarsusafiinsus.
Pindaktiivse aine ahela pikkuse mõju. Homoloogilises seerias väheneb pindaktiivse aine molekulmassiga CMC väärtus ligikaudu pöördvõrdeliselt pinnaaktiivsusega (CMCl 1/0m). Naaberhomoloogide puhul on CMC suhtarvuks Duclos-Traube'i reegli koefitsient (CMC) / (CMC) +1 Р = 3,2.
Langmuir näitas, et Duclos-Traube reegli abil saab arvutada rühma ülekande energia - Hj - lahuse mahust gaasifaasi. Tõepoolest, pidades b adsorptsiooni tasakaalu konstandiks [lk. 61 Näidati, et K ekvivalentväärtuse korral kehtib K = kJ, vastavalt standardse reaktsiooni isotermi võrrandile on meil
Vaadake lehti, kus seda terminit mainitakse Duclos Traube, reegel: Colloidal Chemistry 1982 (1982) — [ c.54 ]
pinna aktiivsus. Pindaktiivsed ja pind-inaktiivsed ained. Duclos-Traube reegel.
pinna aktiivsus, aine võime liidesel adsorptsiooni ajal alandada pindpinevust (liidespinevus). Adsorptsioon G in-va ja sellest põhjustatud pindpinevuste s vähenemine on seotud kontsentratsiooniga Koos in-va faasis, millest aine adsorbeerub liidese pinnale, Gibbsi võrrand (1876):  Kus R- gaasi konstant, T-abs. temperatuur (vt Adsorptsioon). Tuletis
mõõdab aine võimet alandada pindpinevust antud liidese piiril ja seda nimetatakse ka. pinna aktiivsus. Tähistatud G (J. Gibbsi auks), mõõdetuna J m / mol (gibbs).
Kus R- gaasi konstant, T-abs. temperatuur (vt Adsorptsioon). Tuletis
mõõdab aine võimet alandada pindpinevust antud liidese piiril ja seda nimetatakse ka. pinna aktiivsus. Tähistatud G (J. Gibbsi auks), mõõdetuna J m / mol (gibbs).
Pindaktiivsed ained (pindaktiivsed ained), ained, mille adsorptsioon vedelikust teise faasiga (vedel, tahke või gaasiline) piirpinnal viib keskmise. pindpinevuse alandamine (vt Pinnaaktiivsus). Kõige üldisemal ja praktilisemal juhul on adsorbeeritud pindaktiivse aine molekulidel (ioonidel) amfifiilne struktuur, st nad koosnevad polaarsest rühmast ja mittepolaarsest süsivesinikradikaalist (amfifiilsed molekulid). Pinna aktiivsus mittepolaarse faasi suhtes (gaas, vedel süsivesinik, mittepolaarne pind tahke keha) sisaldab süsivesiniku radikaali, mis surutakse polaarkeskkonnast välja. Pindaktiivsete ainete vesilahuses moodustub õhuga piiril adsorptsiooniline monomolekulaarne kiht süsivesinikradikaalidega, mis on orienteeritud õhu poole. Kui see küllastub, paiknevad pinnakihis kondenseeruvad pindaktiivse aine molekulid (ioonid) pinnaga risti (normaalne orientatsioon).
Pindaktiivsete ainete kontsentratsioon adsorptsioonikihis on mitu suurusjärku kõrgem kui vedeliku põhiosas, seetõttu võivad pindaktiivsed ained isegi tühise veesisalduse korral (0,01–0,1 massiprotsenti) vähendada vee pindpinevust. piir õhuga 72,8 kuni 10 -3 kuni 25 10 -3 J/m 2, s.o. peaaegu süsivesinikvedelike pindpinevusele. Sarnane nähtus leiab aset ka pindaktiivse aine vesilahuse ja vedeliku süsivesinike vahelisel piiril, mis loob eeldused emulsioonide tekkeks.
Sõltuvalt pindaktiivsete ainete olekust lahuses eristatakse tinglikult tõeliselt lahustuvaid (molekulaarselt dispergeeritud) ja kolloidseid pindaktiivseid aineid. Sellise jaotuse tingimus on, et sama pindaktiivne aine võib kuuluda mõlemasse rühma, olenevalt tingimustest ja keemiast. lahusti olemus (polaarsus). Mõlemad pindaktiivsete ainete rühmad adsorbeeritakse faasipiiridel, st neil on lahustes pinnaaktiivsus, samas kui ainult kolloidsetel pindaktiivsetel ainetel on kolloidse (mitsellaarse) faasi moodustumisega seotud omadused. Need pindaktiivsete ainete rühmad erinevad mõõtmeteta suuruse väärtuse poolest, mida nimetatakse. hüdrofiilne-lipofiilne tasakaal (HLB) ja määratakse suhtega:
Duclos-Traube reegel- sõltuvus, mis ühendab orgaanilise aine vesilahuse pinnaaktiivsust selle molekulis oleva süsivesinikradikaali pikkusega. Selle reegli kohaselt suureneb süsivesinikradikaali pikkuse suurenemisel ühe СН 2 rühma võrra aine pinnaaktiivsus keskmiselt 3,2 korda Pinnaaktiivsus sõltub pindaktiivse aine molekulide struktuurist; viimased koosnevad tavaliselt polaarsest osast (suure dipoolmomendiga rühmad) ja mittepolaarsest osast (alifaatsed või aromaatsed radikaalid). Orgaaniliste ainete homoloogse seeria piires väheneb kontsentratsioon, mis on vajalik vesilahuse pindpinevuse langetamiseks teatud tasemeni, 3-3,5 korda, kui süsiniku radikaal suureneb ühe -СΗ 2 -rühma võrra.
Reegli sõnastas I. Traube (saksa) venelane. 1891. aastal paljude ainete (karboksüülhapete, estrite, alkoholide, ketoonide) veelahuste kohta tehtud katsete tulemusena. E. Duclose varasemad uurimused, kuigi need olid hingelt Traube teostele lähedased, ei pakkunud selget kontsentratsiooni sõltuvust, mistõttu väliskirjandus reegel kannab ainult Traube nime. . Traube reegli termodünaamilise tõlgenduse andis 1917. aastal I. Langmuir.
Duclos-Traube reegel
Suur inglise-vene ja vene-inglise sõnaraamat. 2001 .
Duclos-Traube reegel- Duclos Traube'i reegel: ühe homoloogse seeria ainete süsinikuahela pikkuse suurenemisega suureneb mittepolaarse adsorbendi adsorptsioon polaarsest lahustist umbes 3 korda süsivesinike ahela suurenemisega ühe metüleenrühma CH2 võrra. ... ... Keemilised terminid
Duclose reegel- Traube sõltuvus, mis seob orgaanilise aine vesilahuse pinnaaktiivsuse selle molekulis oleva süsivesinikradikaali pikkusega. Selle reegli järgi süsivesinikradikaali pikkuse suurenemisega ühe rühma võrra ... ... Wikipedia
Üldine keemia: õpik. A. V. Žolnin; toim. V. A. Popkova, A. V. Žolnina. . 2012 .
Vaadake, mis on "Duclos-Traube'i reegel" teistes sõnaraamatutes:
PINNASURVE- (tasane rõhk, kahemõõtmeline rõhk), puhta vedeliku pinna ja sama vedeliku adsorptsiooniga kaetud pinna liidese (barjääri) pikkuse ühiku kohta mõjuv jõud. pindaktiivse aine kiht. P. d. küljele suunatud ... ... Physical Encyclopedia
Ravim- I Meditsiin Meditsiinisüsteem teaduslikud teadmised ning praktilised tegevused, mille eesmärk on tervise tugevdamine ja säilitamine, inimeste eluea pikendamine, inimeste haiguste ennetamine ja ravi. Nende ülesannete täitmiseks uurib M. struktuuri ja ... ... Medical Encyclopedia
IMmuunsus- IMmuunsus. Sisu: ajalugu ja tänapäeva. I. õpetuse seis. 267 I. kui kohanemisnähtust. 283 I. kohalik. 285 I. loomamürkidele. 289 I. algloomaga. ja spiroheet, infektsioonid. 291 I. kuni ... ... Big Medical Encyclopedia
Traube-Duclos reegel;
Nagu juba märgitud, peavad lahuse-gaasi liidesele adsorbeeruvad pindaktiivsed molekulid olema amfifiilsed; millel on polaarsed ja mittepolaarsed osad.
Duclos ja seejärel Traube, uurides küllastunud rasvhapete homoloogse seeria vesilahuste pindpinevusi, leidsid, et nende ainete pindaktiivsus (-) lahuse ja õhu piirpinnal on seda suurem, mida pikem on süsivesinikradikaali pikkus. , ja keskmiselt suureneb see iga rühma -CH 2 - puhul 3-3,5 korda. Seda olulist mustrit nimetatakse Traube-Duclos reeglid.
Traube reegel — Dukloglasiit:
normaalsete rasvhapete homoloogses reas suureneb nende pindaktiivsus (-) vee suhtes järsult 3-3,5 korda iga rühma -CH 2 - puhul võrdse molaarse kontsentratsiooni korral.
Teine Traube reegli sõnastus — Duclos: "Kui rasvhappeahela pikkus suureneb eksponentsiaalselt, suureneb pinnaaktiivsus eksponentsiaalselt." Traube reegel — Duclos on hästi illustreeritud joonisel 18.1.
Nagu jooniselt näha, mida kõrgem on aine homoloogses reas, seda rohkem alandab see vee pindpinevust antud kontsentratsiooni juures.
Traube reegliga kehtestatud sõltuvuse põhjus — Duclos seisneb selles, et radikaali pikkuse suurenemisega rasvhappe lahustuvus väheneb ja selle molekulide kalduvus liikuda mahult pinnakihile suureneb. On kindlaks tehtud, et Traube valitseb — Duclost ei täheldata mitte ainult rasvhapete, vaid ka teiste homoloogsete seeriate puhul - alkoholid, amiinid jne.
Riis. 18.1 Traube reegel — Duclos:
1- äädikhape, 2- propioonhape, 3- võihape, 4- palderjanhape.
1) ainult madalatel kontsentratsioonidel, kui väärtus - - on maksimaalne;
2) toatemperatuurile lähedase temperatuuri jaoks. Kõrgematel temperatuuridel koefitsient 3–3,5 väheneb ja kipub ühtlustuma. Temperatuuri tõus soodustab molekulide desorptsiooni ja seetõttu väheneb nende pindaktiivsus (homoloogide pinnaaktiivsuse erinevus silub);
3) ainult vesilahuste puhul. pindaktiivset ainet.
Ameerika füüsikakeemik Langmuir leidis, et Traube'i reegel kehtib ainult väikeste pindaktiivsete ainete kontsentratsioonide puhul lahuses, mille pinnal on adsorbeerunud molekulid vaba paigutusega (joonis 18.6).
Riis. 18.6 Adsorbeeritud molekulide asukoht liideses:
a – madalatel kontsentratsioonidel; b - keskmise kontsentratsiooniga;
c - küllastunud kihis maksimaalse võimaliku adsorptsiooniga
DUCLAU-TRAUBE REEGEL
Gibbsi võrrandist järeldub, et tuletise väärtus on aine adsorptsiooni ajal käitumise tunnus, kuid selle väärtus muutub kontsentratsiooni muutumisel (vt joonis 3.2). Sellele suurusele iseloomuliku konstandi kuju andmiseks võetakse selle piirväärtus (c 0 juures). P. A. Rebinder (1924) nimetas seda väärtust pinnaaktiivsuseks g:
[g] = J – m 3 / m 2 -mol \u003d J – m/mol või N-m2/mol.
Mida rohkem pindpinevus väheneb adsorbeeritud aine kontsentratsiooni suurenedes, seda suurem on selle aine pindaktiivsus ja seda suurem on selle Gibbsi adsorptsioon.
Pinnaaktiivsust saab graafiliselt defineerida kui kõvera =f(c) kõverale tõmmatud puutuja kalde puutuja negatiivset väärtust selle lõikepunktis y-teljega.
Seega pindaktiivsete ainete puhul: g > 0; 0. TID-de puhul: g 0, Г i
See seletab ka sahharoosi passiivsust, mille molekulis koos mittepolaarse süsivesiniku skeletiga on palju polaarseid rühmi, mistõttu on molekulis polaarsete ja mittepolaarsete osade tasakaal.
2. Homoloogilises seerias on pinnaaktiivsuse (g) muutuses selged mustrid: see suureneb süsivesinikradikaali pikkuse kasvades.