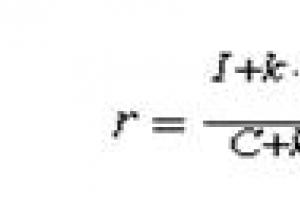Бөлме температурасында тұздардың суда ерігіштігі. Неліктен тұздар суда ериді? Қышқылдардың су қабатында ерігіштігі
Су - біздің планетамыздағы негізгі химиялық қосылыстардың бірі. Оның ең қызықты қасиеттерінің бірі - сулы ерітінділерді түзу мүмкіндігі. Ал ғылым мен техниканың көптеген салаларында тұздың суда ерігіштігі маңызды рөл атқарады.
Ерігіштік қабілеттілікті білдіреді әртүрлі заттарсұйықтықтармен - еріткіштермен - біртекті (гомогенді) қоспалармен қалыптасады. Бұл қаныққан ерітіндіні еріту және қалыптастыру үшін қолданылатын материалдың көлемі, оның ерігіштігін анықтайды, осы заттың массалық үлесімен немесе оның концентрацияланған ерітіндідегі мөлшерімен салыстырылады.
Еріту қабілетіне қарай тұздар келесідей жіктеледі:
- еритін заттарға 100 г суда 10 г артық ерітілетін заттар жатады;
- аз еритіндерге еріткіштегі мөлшері 1 г аспайтындар жатады;
- 100 г суда ерімейтін заттың концентрациясы 0,01-ден аз.
Еріту үшін қолданылатын заттың полярлығы еріткіштің полярлығына ұқсас болған жағдайда, ол ериді. Әртүрлі полярлықтарда, ең алдымен, затты сұйылту мүмкін емес.
Еріту қалай жүреді
Егер тұздың суда ерігені туралы айтатын болсақ, онда көптеген тұздар үшін бұл әділ мәлімдеме. Арнайы кесте бар, оған сәйкес ерігіштік мөлшерін дәл анықтауға болады. Су әмбебап еріткіш болғандықтан, ол басқа сұйықтықтармен, газдармен, қышқылдармен және тұздармен жақсы араласады.
Ең бірі жақсы мысалдарҚатты заттың суда еруін күн сайын дерлік ас үйде, ас тұзын пайдаланып ыдыс-аяқты дайындау кезінде байқауға болады. Сонымен тұз неліктен суда ериді?
бастап мектеп курсыХимия, су мен тұздың молекулалары полярлы екенін көпшілік есте сақтайды. Бұл олардың электрлік полюстерінің қарама-қарсы екенін білдіреді, бұл жоғары диэлектрлік өтімділікке әкеледі. Су молекулалары басқа заттың иондарын қоршайды, мысалы, біздің жағдайдағыдай, NaCl. Бұл жағдайда консистенциясы бойынша біртекті сұйықтық пайда болады.
Температура әсері
Тұздардың ерігіштігіне әсер ететін бірнеше факторлар бар. Ең алдымен, бұл еріткіштің температурасы. Ол неғұрлым жоғары болса, сұйықтықтағы бөлшектердің диффузиялық коэффициентінің мәні соғұрлым жоғары болады және масса алмасу жылдамырақ болады.
Дегенмен, мысалы, ас тұзының (NaCl) судағы ерігіштігі іс жүзінде температураға тәуелді емес, өйткені оның ерігіштік коэффициенті t 20 ° C кезінде 35,8 және 78 ° C температурада 38,0. Бірақ мыс сульфаты (CaSO4) судың температурасы артқан сайын нашар ериді.
Ерігіштікке әсер ететін басқа факторлар:
- Ерітілген бөлшектердің мөлшері - фазалық бөлудің үлкен ауданымен еру тезірек жүреді.
- Қарқынды орындалғанда массаның тиімдірек тасымалдануына ықпал ететін араластыру процесі.
- Қоспалардың болуы: кейбіреулері еріту процесін жылдамдатады, ал басқалары диффузияға кедергі келтіреді, процестің жылдамдығын төмендетеді.
Тұздың еру механизмі туралы бейнеролик
Анықтама тұздардиссоциация теориясының шеңберінде. Тұздар әдетте үш топқа бөлінеді: орташа, қышқыл және негізгі.Орташа тұздарда сәйкес қышқылдың барлық сутегі атомдары металл атомдарымен, қышқылдық тұздарда жартылай ғана, сәйкес негіздің ОН тобындағы негіздік тұздарда жартылай қышқыл қалдықтарымен ауыстырылады.
Сондай-ақ тұздардың басқа да түрлері бар, мысалы қос тұздар,құрамында екі түрлі катион және бір анион бар: CaCO 3 MgCO 3 (доломит), KCl NaCl (силвинит), KAl (SO 4) 2 (калий алюминийі); аралас тұздар,құрамында бір катион және екі түрлі анион бар: CaOCl 2 (немесе Ca(OCl)Cl); күрделі тұздар,соның ішінде күрделі ион,бірнеше атоммен байланысқан орталық атомнан тұрады лигандтар: K 4 (сары қан тұзы), K 3 (қызыл қан тұзы), Na, Cl; гидратталған тұздар(кристаллогидраттар), құрамында молекулалар бар кристалдану суы: CuSO 4 5H 2 O( көк витриол), Na 2 SO 4 10H 2 O (Глаубер тұзы).
Тұздардың атауыанион атауынан кейін катион атауынан түзіледі.
Оттегісіз қышқылдардың тұздары үшін бейметалдың атына жұрнақ қосылады. идентификатор,мысалы, натрий хлориді NaCl, темір (H) сульфиді FeS және т.б.
Құрамында оттегі бар қышқылдардың тұздарын атағанда тотығу дәрежелері жоғары болған жағдайда элемент атауының латын түбіріне жалғау қосылады. — ам, төменгі тотығу дәрежелері жағдайында аяқталу -бұл.Кейбір қышқылдардың атауларында префикс металл емес заттардың ең төменгі тотығу дәрежесін белгілеу үшін қолданылады. гипо-,перхлорлы және перманганикалық қышқылдардың тұздары үшін префиксті қолданыңыз пер-,мысалы: кальций карбонаты CaCO 3,темір (III) сульфаты Fe 2 (SO 4) 3, темір (II) сульфиті FeSO 3, калий гипохлориті KOSl, калий хлориті KOSl 2, калий хлораты KOSl 3, калий перхлораты KOSl 4, калий перманганаты, KMnO24 калий перманганаты 2 O 7.
Қышқылдық және негіздік тұздарқышқылдар мен негіздердің толық емес түрленуінің өнімі ретінде қарастыруға болады. Халықаралық номенклатура бойынша қышқыл тұзының құрамына кіретін сутегі атомы префикспен белгіленеді. гидро-, OH тобы - префикс гидрокси, NaHS - натрий гидросульфиді, NaHSO 3 - натрий гидросульфиті, Mg (OH) Cl - магний гидроксихлориді, Al (OH) 2 Cl - алюминий дигидроксихлориді.
Күрделі иондардың атауларында алдымен лигандтар көрсетіледі, содан кейін сәйкес тотығу дәрежесін көрсететін металдың аты (жақшадағы рим цифрлары) көрсетіледі. Күрделі катион атауларында металдардың орысша атаулары қолданылады, мысалы: Cl 2 – тетрамминдік мыс (Р) хлориді, 2 SO 4 – диамминдік күміс (1) сульфаты. Күрделі аниондардың атауларында -at жұрнағы бар металдардың латынша атаулары қолданылады, мысалы: K[Al(OH) 4 ] - калий тетрагидоксиалюминаты, Na - натрий тетрагидроксихроматы, K 4 - калий гексацианоферраты (Н) .
Гидратталған тұздардың атаулары (кристалды гидраттар) екі жолмен қалыптасады. Жоғарыда сипатталған күрделі катиондарды атау жүйесін пайдалануға болады; мысалы, мыс сульфатын SO 4 H 2 0 (немесе CuSO 4 5H 2 O) тетрааквамыс (II) сульфаты деп атауға болады. Дегенмен, ең танымал гидратталған тұздар үшін көбінесе су молекулаларының саны (гидратация дәрежесі) сөзге сандық префикспен көрсетіледі. «гидрат»,мысалы: CuSO 4 5H 2 O - мыс (I) сульфаты пентагидраты, Na 2 SO 4 10H 2 O - натрий сульфаты декагидраты, CaCl 2 2H 2 O - кальций хлоридінің дигидраты.

Тұздардың ерігіштігі
Суда ерігіштігі бойынша тұздар еритін (Р), ерімейтін (Н) және аз еритін (М) болып бөлінеді. Тұздардың ерігіштігін анықтау үшін қышқылдардың, негіздердің және тұздардың суда ерігіштігінің кестесін қолданыңыз. Қолда үстел болмаса, ережелерді қолдануға болады. Оларды есте сақтау оңай.
1. Азот қышқылының барлық тұздары ериді – нитраттар.
2. Тұз қышқылының барлық тұздары ериді - хлоридтер, AgCl (H), PbCl қоспағанда 2 (М).
3. BaSO-дан басқа күкірт қышқылының барлық тұздары – сульфаттар ериді 4 (H), PbSO 4 (H).
4. Натрий және калий тұздары ериді.
5. Na тұздарынан басқа барлық фосфаттар, карбонаттар, силикаттар және сульфидтер ерімейді. + және Қ + .
Барлық химиялық қосылыстардың ішінде тұздар заттардың ең көп класы болып табылады. Бұл қатты заттар, олар бір-бірінен түсі мен суда ерігіштігімен ерекшеленеді. IN басы XIXВ. Швед химигі И.Берцелиус қышқылдардың негіздермен әрекеттесу өнімдері немесе қышқылдағы сутегі атомдарын металмен алмастыру арқылы алынған қосылыстар деп тұздардың анықтамасын тұжырымдаған. Осы негізде тұздар орташа, қышқылдық және негіздік болып бөлінеді. Орташа немесе қалыпты тұздар қышқылдағы сутегі атомдарын металмен толық алмастыру өнімдері.
Мысалы:
На 2 CO 3 - натрий карбонаты;
CuSO 4 - мыс (II) сульфаты және т.б.
Мұндай тұздар қышқыл қалдығының металл катиондары мен аниондарына диссоциацияланады:
Na 2 CO 3 \u003d 2Na + + CO 2 -
Қышқыл тұздары – қышқылдағы сутегі атомдарының металмен толық емес орын ауыстыруының өнімдері. Қышқыл тұздарға, мысалы, NaHCO 3 металл катионынан және қышқылдық жалғыз зарядталған HCO 3 - қалдығынан тұратын ас содасы жатады. Қышқыл кальций тұзы үшін формула келесідей жазылады: Ca (HCO 3) 2. Бұл тұздардың атаулары префиксті қосу арқылы орташа тұздардың атауларынан тұрады. гидро- , Мысалы:
Mg (HSO 4) 2 - магний гидросульфаты.
Қышқыл тұздарын келесідей диссоциациялайды:
NaHCO 3 \u003d Na + + HCO 3 -
Mg (HSO 4) 2 \u003d Mg 2+ + 2HSO 4 -
Негіздік тұздар – бұл негіздегі гидроксотоптардың қышқыл қалдығымен толық емес орын ауыстыруының өнімдері. Мысалы, мұндай тұздарға сіз П.Бажовтың еңбектерінде оқыған әйгілі малахит (CuOH) 2 CO 3 жатады. Ол екі негізгі CuOH+ катионынан және CO 3 2- қышқыл қалдығының қос зарядты анионынан тұрады. CuOH + катионының заряды +1 болады, сондықтан молекулада осындай екі катион және бір қос зарядты CO 3 2- анион электрлік бейтарап тұзға біріктіріледі.
Мұндай тұздардың атаулары кәдімгі тұздармен бірдей болады, бірақ префиксті қосу арқылы гидроксо, (CuOH) 2 CO 3 - мыс (II) гидроксокарбонаты немесе AlOHCl 2 - алюминий гидроксохлориді. Негізгі тұздардың көпшілігі ерімейді немесе аз ериді.
Соңғысы келесідей диссоциацияланады:
AlOHCl 2 \u003d AlOH 2 + + 2Cl -

Тұздың қасиеттері


Алғашқы екі алмасу реакциясы бұрын егжей-тегжейлі талқыланған.
Үшінші реакция да алмасу реакциясы болып табылады. Ол тұз ерітінділері арасында ағып, тұнбаның түзілуімен бірге жүреді, мысалы:

Тұздардың төртінші реакциясы металдың металл кернеулерінің электрохимиялық қатарындағы орнымен байланысты («Металл кернеулерінің электрохимиялық қатарын» қараңыз). Әрбір металл тұз ерітінділерінен оның оң жағында орналасқан барлық басқа металдарды бірқатар кернеулермен ығыстырып шығарады. Бұл келесі шарттарға бағынады:
1) екі тұз да (әрекеттесетін де, реакция нәтижесінде түзілетін) де ерігіш болуы керек;
2) металдар сумен әрекеттеспеуі керек, сондықтан I және II топтардың негізгі топшаларының металдары (соңғылары үшін Садан бастап) тұз ерітінділерінен басқа металдарды ығыстырмайды.


Тұздарды алу әдістері
алу жолдары және Химиялық қасиеттерітұздар. Тұздарды кез келген дерлік кластағы бейорганикалық қосылыстардан алуға болады. Осы әдістермен қатар аноксид қышқылдарының тұздарын металл мен бейметалдың (Cl, S және т.б.) тікелей әрекеттесуінен алуға болады.
Көптеген тұздар қыздырғанда тұрақты болады. Алайда аммоний тұздары, сондай-ақ активтілігі төмен металдардың кейбір тұздары, әлсіз қышқылдар және элементтері жоғары немесе төмен тотығу дәрежесін көрсететін қышқылдар қыздырғанда ыдырайды.
CaCO 3 \u003d CaO + CO 2
2Ag 2 CO 3 \u003d 4Ag + 2CO 2 + O 2
NH 4 Cl \u003d NH 3 + HCl
2KNO 3 \u003d 2KNO 2 + O 2
2FeSO 4 \u003d Fe 2 O 3 + SO 2 + SO 3
4FeSO 4 \u003d 2Fe 2 O 3 + 4SO 2 + O 2
2Cu(NO 3) 2 \u003d 2CuO + 4NO 2 + O 2
2AgNO 3 \u003d 2Ag + 2NO 2 + O 2
NH 4 NO 3 \u003d N 2 O + 2H 2 O
(NH 4) 2 Cr 2 O 7 \u003d Cr 2 O 3 + N 2 + 4H 2 O
2KSlO 3 \u003d MnO 2 \u003d 2KCl + 3O 2
4KClO 3 \u003d 3KSlO 4 + KCl
Ерігіштік кестесі химиялық элементтер- бұл ең танымал бейорганикалық қышқылдардың, негіздердің және тұздардың судағы ерігіштігі көрсетілген кесте.
Анықтама 1
Химиялық ерігіштік кестесі 20 °C температурада ерігіштігін көрсетеді, температура жоғарылағанда ерігіштік артады.
Зат суда ериді, егер оның ерігіштігі 100 г суда 1 г артық болса, ал 0,1 г/100 г-ден аз болса, ерімейді.Мысалы, химиядағы ерігіштік кестесінде литийді табу арқылы оның барлығы дерлік екеніне көз жеткізуге болады. оның тұздары ерітінділер түзеді.
Суретте. 1 және сур. 2 фотосурет ұсынылды толық кестеқышқыл қалдықтарының атауларымен химиядағы ерігіштігі.
Сурет 1. Химиядан ерігіштіктің фотокесте 2018-2019 ж
Сурет 2. Қышқылдар мен қышқыл қалдықтары бар химия кестесі
Тұздың атын жасау үшін периодтық жүйені және ерігіштігін пайдалану керек. Периодтық жүйедегі металдың атауы қышқыл қалдығының атына қосылады, мысалы:
$\mathrm(Zn_3(PO_4)_2)$ - мырыш фосфаты; $\mathrm(FeSO_4)$ - темір(II) сульфаты.
Мәтін атауы бар жақшада металдың валенттілігін, егер олардың бірнешеуі болса, көрсету қажет. Темір жағдайында $\mathrm(Fe_2(SO_4)_3)$ тұзы - темір(III) сульфаты да бар.
Химияда ерігіштік кестесін қолдану арқылы нені білуге болады
Химиядағы заттардың тұнбамен ерігіштік кестесі реакцияның жүру мүмкіндігін анықтау үшін қолданылады, өйткені тұнбаның немесе газдың түзілуі реакцияның қайтымсыз жүруі үшін қажет.
Тұздардың, қышқылдардың және негіздердің ерігіштік кестесі негіз болып табылады, онсыз химиялық білімді толық меңгеру мүмкін емес. Негіздер мен тұздардың ерігіштігі мектеп оқушыларын ғана емес, сонымен қатар оқытуға көмектеседі кәсіби адамдар. Бұл білімсіз көптеген өмірлік өнімдерді жасау мүмкін емес.
Қышқылдардың, тұздардың және негіздердің суда ерігіштігінің кестесі
Тұздар мен негіздердің суда ерігіштік кестесі меңгеруге көмектесетін нұсқаулық болып табылады химиялық негіздер. Төмендегі ескертпелер төмендегі кестені түсінуге көмектеседі.
- P - еритін затты көрсетеді;
- Н – ерімейтін зат;
- М – зат сулы ортада аз ериді;
- РК – зат күшті органикалық қышқылдар әсер еткенде ғана ери алады;
- Сызықша мұндай тіршілік иесінің табиғатта жоқ екенін айтады;
- NK – қышқылдарда да, суда да ерімейді;
- ? - сұрақ белгісі бүгінгі күні заттың ерігені туралы нақты ақпараттың жоқтығын көрсетеді.

Көбінесе кестені химиктер мен мектеп оқушылары, студенттер зертханалық зерттеулер үшін пайдаланады, оның барысында белгілі бір реакциялардың пайда болу шарттарын белгілеу қажет. Кестеге сәйкес, заттың тұзды немесе қышқылдық ортада қалай әрекет ететінін, тұнбаның болуы мүмкін екенін анықтау керек. Зерттеулер мен тәжірибелер кезіндегі тұнба реакцияның қайтымсыздығын көрсетеді. Бұл бүкіл зертханалық жұмыстың барысына әсер етуі мүмкін маңызды сәт.