Termodynaamisten funktioiden muutos adsorption aikana. Adsorptioprosessien termodynamiikka. Adsorptioprosessien laitteistosuunnittelu
Adsorptio(latinasta ad - on, at ja sorbeo - absorboin), muutos (yleensä - nousu) aineen pitoisuudessa lähellä rajapintaa ("absorptio pinnalla"). Syy adsorptio- molekyylien välisten sidosten tyydyttymättömyys lähellä pintaa, ts. adsorption olemassaolo voimakenttä. Sellaisen kentän luovaa kappaletta kutsutaan adsorbentiksi, ainetta, jonka molekyylit voivat adsorboitua, kutsutaan adsorbaatiksi ja jo adsorboitua ainetta kutsutaan adsorbaattiksi. Prosessi käänteinen adsorptio kutsutaan desorptioksi.
Adsorptiokentän luonne on erilainen. Jos adsorptio liittyy van der Waalsin sidoksiin, niin adsorptio kutsutaan fyysiseksi. Jos nämä ovat valenssisidoksia, ts. adsorptio kulkee pinnan muodostumisen mukana kemialliset yhdisteet, Tuo adsorptio kutsutaan kemikaaliksi kemisorptio. Tärkeitä ominaisuuksia kemisorptio osoittaa: peruuttamattomuus, korkeat lämpövaikutukset (satoja kJ / mol), aktivoitu luonne. Välityyppejä on monia adsorptio fysikaalisen ja kemiallisen välillä adsorptio. Esimerkiksi, adsorptio johtuen vetysidosten muodostumisesta. Myös mahdollista eri tyyppejä fyysistä adsorptio. Dispersion molekyylien välisten vetovoimavoimien esiintyminen on yleisintä, koska ne ovat suunnilleen vakioita adsorbenteille, joilla on minkä tahansa kemiallinen pinta (epäspesifinen). adsorptio). Fyysinen adsorptio voi johtua sähköstaattisista voimista (ionien, dipolien tai kvadrupolien välinen vuorovaikutus); jossa adsorptio määräytyy adsorptioaineen molekyylien kemiallisen luonteen mukaan (ns. spesifinen adsorptio). Myös käyttöliittymän geometrialla on tärkeä rooli. jos pinta on tasainen, niin se on adsorptio avoin pinta, jos pinta on hieman tai voimakkaasti kaareva - noin adsorptio adsorbentin huokosissa.
Teoriassa adsorptio Erottele staattinen (adsorbentti-adsorbaattijärjestelmä on termodynaamisessa tasapainossa) ja kinetiikka (tasapainoa ei ole) välillä.
Adsorptiostatiikka
Adsorption termodynamiikka
.Termodynamiikan perusteet adsorptio ne loi J. Gibbs 70-luvulla. 1800-luvulla Gibbsin mukaan kaksivaiheisessa tasapainojärjestelmässä rajapinnan lähellä tapahtuu jonkin verran muutosta kaikkien laajojen ominaisuuksien paikallisissa arvoissa (tilavuutta lukuun ottamatta). Faaseja pidetään kuitenkin homogeenisina johonkin ne erottavaan geometriseen pintaan asti. Siksi minkään laajan ominaisuuden arvo koko järjestelmälle ei ole yhtä suuri kuin tämän ominaisuuden arvojen summa homogeenisissa vaiheissa ja . Ero johtuu erotuspintaan liittyvästä kaksiulotteisesta pintafaasista. Koska pintafaasilla ei siis ole paksuutta V0=+ ja =-, missä V-äänenvoimakkuutta.
Esitettyjen esitysten avulla voimme pelkistää perustermodynaamisen yhtälön muotoon:
missä G on Gibbsin vapaa energia, S on entropia, on rajapintojen jännitys, s on rajapinta-ala ja n i- vastaava kemiallinen potentiaali ja moolien lukumäärä i- se komponentti. Indeksi ilmaisee vastaavan ominaisuuden arvon pintavaiheessa. Legendre-muunnos mahdollistaa yhtälön (1) muokkaamisen isotermisille olosuhteille:
Määrää kutsutaan Gibbsiksi adsorptio ja se on merkitty symbolilla G, (ilmaistuna mol / cm2). Kaksikomponenttiselle järjestelmälle:
Jakopinnan sijainti voidaan valita mielivaltaisesti. Erityisesti tämän säännöksen valinta voi täyttää ehdon Г 1 =0. Tällaista pintaa kutsutaan ekvimolekulaariseksi. Sitä varten otetaan käyttöön merkintä Г 2 = Г 2 (1). Tämä tarkoittaa pääasiallista Gibbsin adsorptioyhtälöä:
Jos adsorbentti on täysin liukenematon yhteen kahdesta faasista, =const ja siirtyminen yhtälöstä (2) yhtälöön (3) ei vaadi ehtoa Г 1 =0. Siis Gibbit adsorptio on tämän komponentin ylimäärä todellisessa kaksivaiheisessa järjestelmässä verrattuna sellaiseen järjestelmään, jossa molemmat faasit olisivat tiukasti homogeenisia erotuspintaan asti. Gibbsin ylimääräisten määrien lisäksi adsorptio, on tärkeä rooli hänen teoriassaan adsorptio, joka ymmärretään komponentin koko sisällöksi i avaruudessa W, jolla on adsorptiovoimia. Ilmaisee koko sisällön A ja olettaen, että komponentti i täysin liukenematon johonkin bulkkifaasiin, meillä on:
missä c i- keskittyminen i-th komponentti bulkkivaiheessa. Pienille s i:
Adsorptio voi esiintyä missä tahansa kahden faasin rajapinnassa, erityisesti neste-neste (neste-kaasu, neste-neste) tai kiinteä-neste (kiinteä-kaasu, kiinteä-neste) rajapinnassa. Neste-nestejärjestelmissä α voidaan mitata funktiona ja määrittää kokeellisesti Г 2 (1) yhtälön (3) avulla. Toisessa tapauksessa G2(1) määritetään millä tahansa menetelmällä n i 0 , , ja i:nnen komponentin pitoisuudet näissä tilavuuksissa. Tästä G lasketaan i(1) . Tätä menetelmää kutsutaan volumetriseksi (tai volumetriseksi). Painomenetelmällä (gravimetrisella) määrä määritetään suoraan i- käyttöliittymän komponentti.
Adsorptioisotermi
.Tasapainoadsorptiojärjestelmässä tasapainon määräävät parametrit ovat a i osittaisia paineita R(tai kanssa i) ja lämpötila T. Ne liittyvät ns. lämpöyhtälöön:
klo adsorptio yksittäinen adsorbentti ( i=1) tämä yhtälö on muodossa:
Kolme erikoistapausta lämpöyhtälö(Kun T, r tai a- vakioilla) on erityinen rooli teoriassa adsorptio:
a=- isotermiyhtälö adsorptio,
T=- isobar-yhtälö adsorptio,
R-- isosteriyhtälö adsorptio.
Toimintojen erityinen tyyppi ja määräytyy tarkasteltavana olevan järjestelmän ominaisuuksien mukaan. Jos jokin niistä esimerkiksi tunnetaan jostain arvosta T= const, niin ilmeisesti myös kaksi muuta tulevat tunnetuksi. Tässä tapauksessa ei ole välttämätöntä tietää riippuvuuksien analyyttistä muotoa. Ne voidaan antaa empiirisesti arvojen joukkona a, r Ja T.
Teoriassa adsorptio yleensä kysymys on funktion muodosta A=(p)r, so. isotermiyhtälöstä adsorptio. Tämä ongelma liittyy siihen liittyviin lämpövaikutuksiin adsorptio. Laskettaessa tärkeimpien termodynaamisten funktioiden arvojen muutosta siirtymän tapauksessa dn moolia adsorptiota massafaasista pintafaasiin tasapainojärjestelmässä p = const, kaksi tapausta on mahdollista: ensimmäisessä tapauksessa vain adsorbaatin muuttuminen adsorbaatiksi otetaan huomioon, koska adsorbentti adsorptio termodynaamisesti muuttumaton ja sen tehtävänä on toimia adsorptiokentän lähteenä; toisessa otetaan huomioon myös adsorbentin muutos.
Koska järjestelmä on tasapainossa, adsorbaatin ja adsorbaatin kemialliset potentiaalit ovat samat; adsorbaattientropia johtuen molekyylien liikkuvuuden vähenemisestä adsorptio pienempi kuin adsorptioaineen entropia. Siksi inertillä adsorbentilla entalpia on aina negatiivinen, ts. adsorptio eksoterminen. Adsorbentin entropian muutoksen huomioon ottaminen voi muuttaa tätä johtopäätöstä. Esimerkiksi polymeerien sorption aikana aineita, joissa polymeeri turpoaa, jälkimmäisen entropia (johtuen makromolekyylien liikkuvuuden lisääntymisestä) voi kasvaa niin voimakkaasti, että adsorptio muuttuu endotermiseksi. Seuraavassa vain eksoterminen adsorptio.
Erottele integraali-, differentiaali-, isosteerinen ja keskilämpö adsorptio. integroitu lämpö K yhtä suuri kuin entalpian menetys (at V= const - vakio sisäinen energia) vaihdettaessa adsorptio alkaen a 1 ennen a 2(tietyssä tapauksessa se voi olla 1 \u003d 0): Q \u003d - (H 2 - H 1). Tätä arvoa viitataan yleensä adsorbentin massaan ja ilmaistaan J/kg.
Ero lämpö q(J / mol) on yhtä suuri kuin entalpian menetys dH kun se muuttuu A päällä da. Se ilmaistaan asenteella q = - (dH/da). Se on selvää
Isosteerinen lämpö q st on yhtä suuri kuin:
missä on ero adsorbaatin ja adsorbaatin moolitilavuuksien välillä. Sen voi osoittaa  ihanteellinen kaasuadsorbentti:
ihanteellinen kaasuadsorbentti:
Esittelyn merkitys qsi siinä mielessä, että sen määrittäminen ei vaadi kalorimetrisiä tietoja (esim K Ja q) ja se voidaan laskea yhtälöllä (9) mittaustuloksista adsorptio. Esittelemme myös keskilämmön K(J/mol):
Kasvun kanssa A parametri K kasvaa aina, a q voi pienentyä, kasvaa tai pysyä ennallaan. Kasvun kanssa A epätasaisella pinnalla adsorptio esiintyy yhä vähemmän aktiivisilla alueilla, mikä johtaa laskuun q. Tässä tapauksessa adsorboituneiden molekyylien keskimääräiset etäisyydet kuitenkin pienenevät, minkä seurauksena niiden väliset vetovoimat kasvavat ja q lisääntyy. Kahden mainitun vaikutuksen välinen suhde määrää riippuvuuden kulun q=f(a). Erittäin suurena A hylkivät voimat alkavat vallita myös tällä alueella. q vähenee aina kasvun myötä a.
Hyvin pienille pinnoille isotermiyhtälö adsorptio on Henryn yhtälön muoto:
missä K H on Henryn kerroin. Todellakin, hyvin pienille A Adsorptiokerros on samanlainen kuin kaksiulotteinen ideaalikaasu, joten sen tilayhtälö on: rt, missä on kaksiulotteinen paine, on pinta-ala, jonka yksi mooli ainetta vie. Näin ollen, kun otetaan huomioon, että =-, ja käyttämällä yhtälöä (3), saadaan yhtälö (12). Henryn yhtälö vaatii sitä q oli jatkuvaa. Suurille täytteille tämä yhtälö ei enää päde. Siksi G. Freindlich (1906) ehdotti isotermien kuvaamista adsorptio seuraava empiirinen yhtälö (Freundlichin yhtälö):
Missä k Ja n- vakiot. Tätä yhtälöä käytetään usein interpolointikaavana, vaikka se on pieni R ei mene yhtälöön (12), ja erittäin suuressa määrin R johtaa rajattomaan kasvuun, mikä on ristiriidassa kokemuksen kanssa A.
Tiukka isotermiteoria adsorptio loi I. Langmuir (1914-18). Teoria perustuu seuraavaan. malli: 1) adsorbentin pinta on joukko energeettisesti identtisiä aktiivisia keskuksia, joihin adsorbaattimolekyylit adsorboituvat (lokalisoituvat); 2) vain yksi molekyyli on adsorboitu yhteen keskukseen; klo adsorptio muodostuu vain yksi adsorptio. kerros (yksikerros); 3) adsorptio tässä keskustassa ei vaikuta adsorptio muissa keskuksissa, eli vuorovaikutuksessa. adsorboituneet molekyylit voidaan jättää huomiotta.
Langmuir malli soi. paikallinen monomolekyylinen adsorptio tasaisella pinnalla. isotermiyhtälö adsorptio vastaa ehkä tätä mallia. avulla saatu menetelmät (molekyylikineettiset, termodynaamiset, tilastollis-termodynaamiset). Eli adsorptio tasapaino voidaan ilmaista seuraavasti. kaava:
Molekyyli vapaa. Adsorptio kaasussa + adsorptio. monimutkainen vaihekeskus (varattu keskus)
Molekyylien pitoisuus kaasussa on verrannollinen p:hen, vapaan aineen pitoisuuteen. keskukset-arvo ( a t - a), Missä ja T - keskusten kokonaismäärä, miehitettyjen keskusten lukumäärä, adsorptiopitoisuus. kompleksit-arvo adsorptio Siksi tasapainovakio on: K p \u003d p (a t - A)/ adsorptio Tästä saamme Langmuirin yhtälön:
Missä b-T. nimeltään adsorptio kerroin yhtä suuri kuin K p -1. Erittäin alhaisten paineiden alueella bp" 1 ja a = (a m b)p, joka vastaa Henryn yhtälöä, jossa KH= a m b. Erittäin korkeiden paineiden alueella br 1 ja aa t; jossa adsorptio ei ole enää riippuvainen paineesta. Tasapainovakio b-1 liittyy reaktion isobaarisen potentiaalin standardiarvoon:
Langmuir-malli edellyttää, että diff. lämpöä ja entropiaa adsorptio ei riipu pinnan täyttöasteesta.
yhtälö (14) on tiukka lauseke, joka vastaa Langmuirin mallia, mutta se on harvoin perusteltu käytännössä, koska malli itsessään on idealisoitu adsorptio Oppi adsorptio 20-luvulta lähtien 20. vuosisata keinoin. tutkinto rakennettiin yhden tai toisen Langmuir-oletuksen heikentämisen tai eliminoinnin pohjalta adsorptio
Langmuir on jo ehdottanut tapaa kuvailla adsorptio epähomogeenisella pinnalla (eli olettaen, että kaikki keskukset eivät ole samoja). Yhdistämällä identtiset keskukset ryhmiin ja olettaen, että yhtälö (14) pätee jokaiseen ryhmään, voimme olettaa, että adsorptio koko pinnalla ilmaistaan yhtälön (14) ehtojen summalla:
Olettaen, että adsorption määrä keskukset voivat olla kuvataan vapaan arvojen jakauman jatkuvalla funktiolla. energia, Ya.B. Zel'dovich sai kaavasta (16) eksponentiaaliselle funktiolle tyypin (13) yhtälön.
adsorptio epähomogeenisilla pinnoilla - suuri luku teoriassa adsorptio Hänen tärkein integraaliyhtälön tehtävä-ratkaisu:
Missä f(s) - niin sanottu. empiirinen isotermi adsorptio, -se tai toinen f-tio keskusten lukumäärän jakautumisesta vapaiden arvojen perusteella. energiaa,( b, p)- paikallinen isotermi adsorptio, jota yleensä pidetään Langmuirin isoterminä adsorptio
Langmuirin toisen oletuksen hylkäämiseksi on tehty monia yrityksiä. adsorptio Tällä tiellä polymolekyylien teoria adsorptio, ehdottivat S. Brunauer, P. Emmet ja E. Teller (BET-teoria). Teoria olettaa, että kriittisen lämpötilan alapuolella olevassa lämpötilassa jokainen molekyyli adsorboituu ensimmäiseen kerrokseen (adsorptiolämpö qi,), on keskus molekyyleille, jotka muodostavat toisen kerroksen ja niin edelleen. Oletetaan, että lämpö adsorptio kaikissa kerroksissa ensimmäistä lukuun ottamatta on yhtä suuri kuin kondensaatiolämpö. Tämä malli johtaa yhtälöön:
Missä c = exp[(q 1 -)/RT]. yhtälö (18) koordinaateissa a, p/p s vastaa S-käyrää. Koordinaateissa p/p s,
isotermi adsorptio yhtälön (18) mukaan tulee olla lineaarinen. Tämän suoran jyrkkyys (yleensä välillä 0,05 p/p s 0,30) ja sen katkaiseva jana y-akselilla antavat arvot ts. a t Ja Kanssa. BET-teorian laaja käyttö johtuu siitä, että sen kirjoittajat itse asiassa ottavat huomioon adsorptio lokalisoimaton, tunnista vakio a t ei erillisten adsorbenttien lukumäärällä. keskukset, mutta adsorbaattimolekyylien lukumäärä ensimmäisessä kerroksessa lähimmässä pakkauksessa (at R= ps). Siksi, kun esittelemme ajatuksen yhden molekyylin vallasta tässä kerroksessa, hyväksymme:
Missä s- adsorboi pinta-alaa adsorptio Yleensä isotermi mitataan tätä varten adsorptio typpeä ja ota se sen molekyyliksi = 0,162 nm 2. Yleisesti suoritettu samanlainen laskelma s Langmuirin mallin mukaan ei pidä paikkaansa, koska Tämä menetelmä koskee tietysti vain lokalisoimattomia adsorptio
polymolekyyliteoriassa adsorptio suuren panoksen antoi J. de Boer, joka osoitti kokeellisesti, että kerrosten keskimääräisen lukumäärän (enemmän kuin ensimmäinen) riippuvuus kaikista pinnoista on kemiallisesti lähellä. luonto, alkaen p/p s ilmaistaan universaalilla käyrällä (ns. t-käyrä). Sen avulla voidaan myös arvioida adsorbenttien pinta-alat.
Langmuir-mallissa yritettiin ottaa huomioon myös vuorovaikutus. adsorbenttien välillä. molekyylejä. Joten, T. Hill ja J. de Boer uskoen, että yhtälö adsorptiotila. kerros on van der Waalsin yhtälön kaksiulotteinen analogi, olemme saaneet seuraavan. isotermiyhtälö adsorptio:
missä = a/a t, a ja van der Waalsin yhtälön b vakiot adsorptio R. Fowler ja E. Guggenheim, vuorovaikutus huomioon ottaen. adsorbentti molekyylit, johdettu yhtälö:
jossa on vakio, joka liittyy molekyylien parittaiseen vuorovaikutukseen.
On toinen mekanismi, joka johtaa ylimääräisiin adsorptio adsorbentit alle niiden kriittisen. huokoisille adsorbenteille suhteellisen korkeilla arvoilla p/p s. Tämä on kapillaarikondensaatiota. Jos huokoseen muodostuu kovera adsorboitunut meniski, kondensaatio alkaa siinä p/p s Kelvin-yhtälön mukaan:
missä on adsorbaatin pintajännitys, V -hänen molaaritilavuus, meniskin r-kaarevuussäde adsorptio Kapillaarikondensaatio johtaa isotermin voimakkaaseen nousuun adsorptio Tässä tapauksessa havaitaan usein (mutta ei aina) ns. adsorptio hystereesi, ts. adsorption epäsuhta. ja desorboivat. isotermin haarat. Yleensä tämä johtuu siitä, että meniskin muoto on adsorptio ja desorptio eivät täsmää.
Kapillaarikondensaatiota käytetään adsorbentin huokoskoon määrittämiseen adsorptio Yhtälön (22) mukaan jokaiselle arvolle p/p s laske meniskin kaarevuussäde adsorptio Siitä, kun otetaan huomioon adsorption paksuus. kerros (esim. t-käyrää pitkin), siirtymäalueen muoto kerroksesta meniskille ja riippuvuus kaarevuudesta hyvin pienellä r:llä , etsi tietyllä hetkellä täytettyjen huokosten lineaarinen koko (tehollinen säde r ef). p/p s. Tällaisten huokosten tilavuus määräytyy kasvun mukaan adsorptio tässä vaiheessa isotermissä. Saatujen tietojen perusteella muodostetaan huokostilavuuden jakautumiskäyrä niiden säteitä pitkin. Menetelmää voidaan soveltaa r ef 1,5 nm:ssä. Yleensä laskenta suoritetaan desorptiolla. isotermin haarat, mutta tiukempi moderni. teoria edellyttää, että molemmat haarat otetaan huomioon käyrän muodostamisessa.
Adsorption potentiaaliteoria ja mikrohuokosten tilavuuden täytön teoria. Malli adsorptio M. Polyaki ehdotti vuonna 1914, että se on pohjimmiltaan erilainen kuin Langmuir. Tämän mallin mukaan adsorptiopotentiaalia on lähellä adsorbentin pintaa. voimakenttä pienenee etäisyyden mukaan pinnasta. Tämän seurauksena adsorptioaineen paine, joka on yhtä suuri kuin p kaukana pinnasta, kasvaa lähellä sitä ja saavuttaa jollain etäisyydellä arvon ps, jossa adsorptioaine tiivistyy. Rajapinnan ja geomin välisen kerroksen tilavuus. pisteiden paikka, joissa p = p s , täytetty nesteellä, mikä johtuu fysikaalisten normaaliarvoista. bulkkinesteen ominaisuudet. Käännettävä isoterminen työ ja adsorptio. voimat, jotka määritetään yhtälöllä = RTlnp / p s, kutsutaan. adsorptio potentiaalia, ja koko käsite on potentiaaliteoria adsorptio Tietylle tilavuudelle V adsorptio kerros on potentiaaliriippuvainen lämpötilasta (johtuen dispersiovoimien riippumattomuudesta lämpötilasta). Tämä lämpötilainvarianssi mahdollistaa uudelleenlaskennan adsorptio yhdestä t-ry:stä toiseen, vaikka isotermiyhtälöt adsorptio sitä ei voitu päätellä esitetyn teorian perusteella. Monet ovat käyttäneet Polyani-mallia laajasti ja menestyksekkäästi. kirjoittajat kuitenkin sisälsivät kaksi erittäin haavoittuvaa säännöstä: 1) oletus, että hienoin adsorptio. kalvolla on normaalit fyysiset arvot. bulkkinesteen ominaisuudet (tätä oletusta ei vahvistettu kokeilla); 2) funktion lämpötilan invarianssi =f(V), teorian taustalla oleva tutkimus vahvistettiin suunnilleen kokeella vain erittäin hienojakoisille adsorbenteille.
Potentiaaliteoriaa käyttäen M.M. Dubinin ehdotti ja kehitti teorian mikrohuokosten tilavuustäytteestä (TOZM). On oletettu, että tämä teoria koskee vain mikrohuokoisia adsorbentteja. Tällaisten adsorbenttien ominaisuus, joissa huokosten lineaariset mitat ovat r1 nm, on se, että niiden huokosten koko tilavuus on "täytetty" adsorbenteilla. ala. Siksi milloin adsorptio niitä ei täytetä kerroksittain, vaan tilavuuden mukaan. Tarkasteltavana olevassa tapauksessa arvo ei ole adsorptio. potentiaalia ja kemikaalin merkkiin asti. adsorboitumispotentiaali, mitattuna kemikaalin tasosta. normaalin nesteen potentiaali samassa lämpötilassa. Koko adsorboivien huokosten sarja on jaettu kolmeen luokkaan: mikrohuokoset ( r 0,6 nm), mesohuokoset (0,6 nm - 20 nm) ja makrohuokoset ( r 20 nm). adsorptio mikrohuokosissa tapahtuu TOZM-kaavion mukaisesti, ts. tilavuudellisesti, mesohuokosissa - kerros kerrokselta täytettävän mekanismin mukaan, täydennettynä kapillaarikondensaatiolla. Makrohuokoset adsorption aikana. tasapainolla ei ole merkitystä.
Esittelyssä huokostilavuuksien f-tsii-jakauman käsite kemikaalien arvoilla. adsorboida niihin potentiaalia, M.M. Dubinin ja L. V. Raduškevitš saivat TOZM-adsorptioisotermin yhtälön, joka yleensä kirjoitetaan seuraavaan. muoto:

Missä n, E ja 0 -parametrit ( a 0 = a klo p = ps). Lämpötilariippuvuus a 0:
missä = -(dao/dT); a 0 0 = a 0 klo T \u003d T 0. Vaihtoehdot P Ja E käytännössä lämpötilasta riippumaton. Useimmissa tapauksissa P= 2. Vain tapauksissa, joissa alkulämpenee adsorptio hyvin suuri n > 2. Isotermien uudelleen laskeminen adsorptio yhdestä adsorptioaineesta toiseen, oletetaan suunnilleen, että E1/E2P1/P= ja että a 01 /a 02 V 1 /V 2, jossa P i- laskuvarjo, Vi- adsorbentin moolitilavuus adsorptio
Jokaiselle mikrohuokoiselle adsorbentille on tunnusomaista TOZM:n mukaan kaksi parametria: W- mikrohuokosten tilavuus ( W 0 = = a 0 V 0) ja E 0 -ominaisuus. energia; W0 ja E 0 tarkoittavat standardiadsorbenttia, tavallisesti bentseeniä.
Käyttämällä käsitystä, että todellisessa adsorbentissa on erikokoisia huokosia, ja esittelemällä arvojen jakautumisen E s varianssi yhtä suuri kuin F. Stekli ehdotti yhtälön (23) yleistystä, jota kutsutaan Dubinin-Stöckli-yhtälöksi:

Missä B0- vakio liittyy E yhtälössä (23) ja y= ![]() . Koska adsorptiossa naibin tekniikka. mikrohuokoiset adsorbentit (aktiivihiilet, zeoliitit, hienohuokoiset kserogeelit) yleistyivät, TOZM:ää ei käytetä vain fysikaalisessa ja kemiallisessa. tutkimusta, mutta myös teknisiä laskelmia.
. Koska adsorptiossa naibin tekniikka. mikrohuokoiset adsorbentit (aktiivihiilet, zeoliitit, hienohuokoiset kserogeelit) yleistyivät, TOZM:ää ei käytetä vain fysikaalisessa ja kemiallisessa. tutkimusta, mutta myös teknisiä laskelmia.
Kaasu- ja nesteseosten adsorptio. Käytännössä ne eivät aina käsittele yksittäistä adsorbenttia, vaan kaasujen tai nestemäisten liuosten seosta. Siksi teorian yleistäminen on tarpeen adsorptio monikomponenttisen adsorption tapauksessa adsorptio Periaatteessa voidaan aloittaa mistä tahansa mallista adsorptio ja laajentaa se tähän tapaukseen. klo adsorptio kaasuseos, tämä ei saavuteta vain yhtälöiden monimutkaisemmalla, vaan myös lisäämällä niihin. empiirinen vuorovaikutukseen liittyvät tai siihen liittyvät parametrit. heterogeeniset molekyylit tai yleisemmin jonkin in-in:n vaikutus kertoimeen. muiden toimintaa. Vain Langmuirin malli mahdollistaa isotermiyhtälön saamisen adsorptio seokset ilman parametreja, jotka eivät sisälly yhtälöihin adsorptio yksilöllinen sisääntulo. Tätä varten riittää, kun otetaan huomioon, että k:nnen komponentin adsorption aikana seoksesta i komponentit ovat osa adsorptiota. keskukset voivat olla muiden molekyylien miehittämä. Siksi:
Kun adsorptio nestemäisillä liuoksilla, niiden pitoisuudesta riippumatta, adsorbentin koko pinta on täytetty adsorptio Näin ollen adsorptio k:nnen komponentin molekyylien syrjäyttämiseen liittyy jäljellä olevien komponenttien tietty määrä molekyylejä, ts. adsorptio on kilpailukykyinen.
Erota molekulaarinen ja ioninen adsorptio ratkaisuja. Ensimmäinen tapahtuu, kun adsorptio ei-elektrolyyttiliuokset, toinen elektrolyyttiliuos. Molekyyli adsorptio ilmaistaan yleensä ylimääräisiä arvoja. Kilpailukykyinen luonne adsorptio aiheuttaa arvon A m.b. sekä positiivista että negatiivista. ilmaiseva adsorptio i-komponentin f-tiona sen mooliosuudesta liuoksessa x i- Meillä on tuo G i= O kohdassa x i= 0 ja x i = 1 (mahdollinen muutos adsorptiossa olevan aineen tilavuus. kerros jätetään huomiotta). Siksi isotermi adsorptio on yksi tai useampi ääripäät.
isotermiyhtälö adsorptio ei-elektrolyyttien binääriliuoksilla, jotka on luotettavasti perusteltu termodynaamisesti, on muoto:

jossa indeksi s osoittaa adsorptiota. vaihe, - ( dn s 2 / dn s 1) näyttää kuinka monta moolia toista komponenttia syrjäyttää yksi mooli ensimmäistä komponenttia, kemikaalin termien (standardiosien) välinen ero. potentiaali, joka riippuu vain lämpötilasta.
Main tämän ja useiden muiden isotermiyhtälöiden käytön ongelma adsorptio-kertoimen riippuvuuden määrittäminen. komponenttien aktiivisuus adsorptiossa. kerros sen koostumuksesta adsorptio Hakemuksen tärkein kysymys adsorptio aineiden erottamiseen tai puhdistamiseen - valikoivan adsorbentin valinta suhteessa tähän komponenttiliuokseen adsorptio
Ioninen adsorptio, ei yleensä ole vastaava adsorptio Preim adsorboituu pinnalle elektrolyyttiliuoksesta. kationeja tai anioneja. Sähkön ansiosta Pintaan kohdistuvat (Coulomb) voimat muodostuvat sähköinen kaksoiskerros.
Jos adsorbentti sisältää ioneja tai pintafunktiota. ryhmiä, jotka pystyvät ionisoitumaan tietyssä liuottimessa, tapahtuu ioninvaihtoa adsorbentin ja elektrolyyttiliuoksen välillä. Adsorbenttia kutsutaan tässä tapauksessa. ioninvaihdin.
Adsorptiokinetiikka
adsorptio, kuten mikä tahansa todellinen prosessi, tapahtuu ajoissa. Täydellinen teoria siis adsorptio tulee sisältää kinetiikkaa käsittelevä osio adsorptio alkeellinen teko adsorptio suoritetaan lähes välittömästi (lukuun ottamatta kemisorptiota). Eli aikariippuvuudet adsorptio määritellään pääosassa diffuusiomekanismi, eli adsorptioaineen syöttö paikalle adsorptio Jos adsorptio avoimella pinnalla ei ole hetkellinen, tällainen prosessi tapahtuu ulkoisella diffuusioalueella; kun taas diffuusion lait eivät ole erityisiä adsorptio Huokoisten adsorbenttien tapauksessa ulk. diffuusio, tärkeä rooli alkaa olla vnutr. diffuusio, ts. adsorbentin siirto adsorbentin huokosissa, kun niissä on pitoisuusgradientti. Tällaisen siirron mekanismi voi riippua adsorbaattipitoisuudesta ja huokoskoosta.
On olemassa molekyyli-, Knudsen- ja pintadiffuusio (Volmer). Molekyylidiffuusio suoritetaan, jos pituus on vapaa. molekyylien valikoima huokosissa on pienempi kuin huokoskoko, Knudsenin pituus on, jos tämä pituus ylittää huokoskoon. Pintadiffusion aikana molekyylit liikkuvat adsorbentin pinnalla siirtymättä bulkkifaasiin. Kuitenkin kertoimen arvot diffuusiot eivät ole samoja eri diffuusiomekanismeille. Monessa tapauksissa ei ole mahdollista määrittää kokeellisesti tarkasti, kuinka diffuusio tapahtuu, ja siksi ns. efektiivinen kerroin. diffuusio, joka kuvaa prosessia kokonaisuutena.
Main kokeellinen kinetiikkaa käsittelevää materiaalia adsorptio palvelee ns. kineettinen käyrä, ts. f-tion \u003d a / a yhtä suuri \u003d f(t) missä on suhteellinen adsorptio yhtä suuri kuin adsorption nykyisen arvon suhde A Vastaanottaja a sama kuin sen ajankohtainen arvo t. Kineetiikan tulkitsemiseen Käyrä yksinkertaisimmassa tapauksessa oletetaan, että adsorptiorakeella on tilavuudeltaan täysin tasainen huokoinen rakenne (tätä mallia kutsutaan kvasihomogeeniseksi). Keinot. kvasihomogeenisen mallin parantaminen - käsitys, että jokainen rake sisältää alueita, joissa on suurempia ja hienompia huokosia. Diffuusiota sellaisessa rakeessa kuvataan kahdella dec. kertoimet.
Avoimella pinnalla, Langmuir-mallilla, kinetiikka on helppo saada. yhtälö adsorptio Tasapainon lähestymisnopeus on nopeuksien ero adsorptio ja desorptio. Olettaen, kuten kinetiikassa tavallista, että prosessien nopeudet ovat verrannollisia reagoivien aineiden pitoisuuksiin, meillä on:
missä k ads ja k dec ovat vastaavasti nopeusvakiot. adsorptio ja desorptio. Kaasufaasin paineen oletetaan olevan vakio. Kun integroidaan tämä yhtälö kohteesta t= 0 mihin tahansa arvoon t saamme:
Näin ollen f:llä meillä on:= yhtä suuri. Meillä on siis vihdoin:
missä k = k mainosta + k dec.
Lämpötilan vaikutus nopeuteen adsorptio ilmaistaan yhtälöllä, joka on samanlainen kuin Arrhenius-yhtälö adsorptio Lämpötilan noustessa k mainokset lisääntyvät eksponentiaalisesti. Koska diffuusio adsorbentin huokosissa liittyy aktivaation voittamiseen. esteitä, k ads:n ja k des:n lämpötilariippuvuudet eivät ole samat.
Diffuusionopeuksien tuntemus on tärkeää paitsi teorian kannalta adsorptio, mutta myös prom. adsorptio prosessit. Tässä tapauksessa ne eivät yleensä käsittele yksittäisiä adsorbentin rakeita, vaan niiden kerroksia. Prosessin kinetiikka kerroksessa ilmaistaan hyvin monimutkaisin riippuvuuksin. Tason jokaisessa pisteessä tiettynä aikana, arvo adsorptio ei määritetä vain isotermiyhtälön muotoa adsorptio ja prosessin kinetiikan lait, mutta myös aero- tai hydrodynaamiset. olosuhteet kaasun tai nesteen virtaukselle jyvien ympärillä. Prosessin kinetiikkaa adsorbenttikerroksessa, toisin kuin yksittäisen rakeen kinetiikkaa, kutsutaan. dynamiikka adsorptio, yleinen kaava ongelmien ratkaiseminen, joka on seuraava: kootaan differentiaalijärjestelmä. yhtälöt osittaisina derivaattaina, ottaen huomioon kerroksen ominaisuudet, isotermi adsorptio, diffuusioominaisuudet (diffuusiokerroin, massansiirron tyypit kerrosta pitkin ja rakeiden sisällä), aero- ja hydrodynaaminen. virtausominaisuudet adsorptio Alku- ja reunaehdot asetetaan. Tämän yhtälöjärjestelmän ratkaisu johtaa periaatteessa suureiden arvoihin adsorptio tietyllä ajanhetkellä kerroksen tietyssä kohdassa. Pääsääntöisesti analyyttinen Ratkaisu voidaan saada vain yksinkertaisimpiin tapauksiin, joten tällainen ongelma ratkaistaan numeerisesti tietokoneen avulla.
Kokeellisessa dynamiikan tutkimuksessa adsorptio kaasu- tai nestevirta, jolla on määritellyt ominaisuudet, johdetaan adsorbenttikerroksen läpi ja lähtevän virran koostumusta tarkastellaan ajan funktiona. Imeytyneen aineen ulkonäkö kerroksen takana on nimeltään. läpimurto ja aika läpimurtoon - suojatoimien aika. Tämän kerroksen takana olevan komponentin pitoisuuden riippuvuus kutsutusta ajasta. lähtökäyrä. Nämä käyrät toimivat pääasiallisina kokeellinen materiaali, jonka avulla on mahdollista arvioida dynamiikan kuvioita adsorptio
Adsorptioprosessien laitteistosuunnittelu
Teknologioita on monia. adsorptiotekniikat. prosessit. Laajalle levinnyt syklinen. (jaksolliset) asennukset kiinteällä adsorptioainekerroksella, osn. jonka solmu on yksi tai useampi. adsorbentit, jotka on valmistettu rakeisella adsorbentilla täytettyjen onttojen pylväiden muodossa. Adsorboituja komponentteja sisältävä kaasu- (tai neste-) virta johdetaan adsorptiokerroksen läpi läpimurtoon asti adsorptio Sen jälkeen adsorbentissa oleva adsorbentti regeneroidaan ja kaasuvirtaus lähetetään toiseen adsorberiin. Adsorbentin regenerointi sisältää useita vaiheita, joista tärkein on desorptio, ts. aiemmin imeytyneen aineen vapautuminen adsorptioaineesta adsorptio Desorptio suoritetaan kuumentamalla, poistamalla paine kaasufaasista, syrjäyttämällä (esim. elävällä höyryllä) tai näiden menetelmien yhdistelmällä. Koska ajat adsorptio ja regenerointi eivät kohtaa, valitse sellainen määrä samanaikaisesti toimivia ja regeneroituja adsorboijia, että koko prosessi jatkuu jatkuvasti.
Tekniikan mukaan. ja taloudellinen Kun otetaan huomioon, uudistumista ei saada loppuun asti adsorptio Siksi adsorbentin työkyky on yhtä suuri kuin tietyissä olosuhteissa saavutettavan maksimin välinen ero adsorptio ja adsorbentissa regeneroinnin jälkeen jäljellä olevan adsorbaatin määrä. Tämän seurauksena isotermit adsorptio Vastaava prosessi adsorberissa ei saa olla liian jyrkkä.
Kuvatussa kaaviossa kaksi vaihtoehtoa ovat mahdollisia: 1) kohdetuote adsorboidaan kaasuvirrasta lähes täydellisesti, ja sitten se sisällytetään desorbaattiin, josta se uutetaan tavalla tai toisella; 2) kohdetuote adsorboituu huonommin kuin muut kaasuseoksen komponentit, ja sitten se sisältyy ulos tulevaan kaasuvirtaan. Ensimmäisen vaihtoehdon mukaan toimivat esimerkiksi viskoositehtaiden rekuperaatioyksiköt, jotka ottavat pois pakokaasuista ja palauttavat CS 2:n kiertoon. Tällaisten laitosten tuottavuus saavuttaa satoja tuhansia m 3 puhdistettua kaasua tunnissa; adsorboiva aktiivihiili, jossa ei ole liian hienoja mikrohuokosia, ts. kivihiili, jossa vakio E TOZM:n mukaan (katso edellä) on 20-25 kJ / mol. Tämä arvo E 0 vastaa ei liian jyrkkää isotermiä, joka tarjoaa hyvät regeneraatioolosuhteet. Tällaisia hiilejä kutsutaan elpyminen. Desorptio suoritetaan elävällä höyryllä. Energian säästämiseksi kylmää ja kuumaa kaasua johdetaan lämmönvaihtimien läpi.
Esimerkiksi kaasujen ja nesteiden kuivaus on erittäin tärkeää öljykaasut ennen käsittelyä tai luonnollista. kaasut ennen kuljetusta; silikageeliadsorbentit tai zeoliitit. Desorptio suoritetaan kuumentamalla. Koska zeoliitin desorptio liittyy korkeisiin energiakustannuksiin, käytetään yhdistettyä adsorptioainetta: pääasiallista. massa kosteutta imee helposti regeneroituva silikageeli ja syvä jälkikuivaus zeoliittiin.
Lämpöregeneraation aikana koko sykli sisältää adsorptio, adsorbenttilämmitys, sen desorptio ja jäähdytys. Iso luku vaiheet määrittää prosessin alhaisen intensiteetin ja korkean energiaintensiteetin adsorptio Siksi ns. lyhyen syklin asennukset, joissa koko sykli kestää useita. pöytäkirja. Niissä kaasua syötetään adsorberiin keskiarvon alaisena. paine, joka sitten vapautetaan ja tapahtuu desorptio. Koko prosessi on lähes isoterminen (poikkeama isotermisuudesta johtuu vain lämmön vapautumisesta adsorptio ja lämmön absorptio desorption aikana). Syklin vaiheet: adsorptio, paineenalennus, desorptio, paineen nousu. Esimerkki on laitos, jossa on zeoliittia tuottamaan hapella rikastettua ilmaa.
Asennuksissa, joissa on liikkuva adsorbenttikerros (ns. hypersorbereissa), jälkimmäinen laskeutuu hitaasti painovoiman vaikutuksesta, poistetaan pohjasta. adsorbentin osia ja menee ns. airlift, joka on adsorption suuntainen pystyputki. sarakkeessa. Tämän putken läpi kulkee ilmavirta alhaalta ylöspäin, mikä nostaa adsorboivat rakeet ylös. osa saraketta. Prosessoitu kaasuvirtaus tulee adsorbentin keskiosaan ja liikkuu ylöspäin vastavirtaan adsorbenttia vastaan. Sarakkeen yläosassa on jatkuva adsorptio, alareunassa - adsorbentin regenerointi (katso myös adsorptiopuhdistus).
Laitoksissa, joissa on leijukerros ("kiehuva") adsorbenttipedi, alhaalta adsorberiin tuleva kaasuvirta tuo adsorbentin suspensioon. Tämä lisää jyrkästi adsorbentin ja kaasun välisen massansiirron tehokkuutta ja lyhentää kestoa adsorptio ja desorptio. Tällaisilla asennuksilla on korkea tuottavuus. Niiden laajaa leviämistä haittaavat korkeat vaatimukset turkille. adsorbenttirakeiden lujuus (riittämätön lujuus aiheuttaa merkittäviä adsorbentin häviöitä sen hankauksen ja laitteesta kulkeutumisen vuoksi).
Main vaatimukset adsorbenteille: suuri adsorbentti. kapasiteetti, ts. niiden tulisi olla hajallaan olevia runkoja suurella tahdilla. pinta tai suuri huokostilavuus; chem. pinnan luonteen on oltava tehokas adsorptio tiedot sisään näissä olosuhteissa; chem. ja lämpö. kestävyys, uusiutuvuus, saatavuus. max. aktiivihiilet, joidenkin oksidien kserogeelit (silikageelit, alumiinioksidigeelit jne.), zeoliitit ovat yleistyneet; ei-huokoisista adsorbenteista-tech. hiili (noki) ja erittäin dispergoitunut SiO 2 (aerosiili, "valkoinen noki").
Adsorptiotekniikan sovellusalat
Ilmiöstä adsorptio monien perustama tapoja puhdistaa ilma haitallisista epäpuhtauksista (katso. kaasun puhdistus), vettä (katso Vedenkäsittely), sekä sokerisiirapit sokerinvalmistukseen, hedelmämehut ja muut elintarvikkeissa olevat nesteet. prom-sti, jätteet voiteluöljyt. Kosteuden poistaminen haitallisena epäpuhtautena kaasuista ja nesteistä kiinteillä adsorbenteilla on yksi tärkeimmistä adsorption haaroista. tekniikat (katso myös kaasukuivaus).
Adsorptiossa. prosessit perustuvat aineseosten hienojakoiseen erottamiseen ja tiettyjen komponenttien eristämiseen monimutkaisista seoksista. Esimerkkejä ovat alkaanien isomeerien erottaminen normaalien hiilivetyjen saamiseksi pinta-aktiivisten aineiden tuotantoa varten, öljyjen erottaminen moottoripolttoaineiden tuotannossa. varten kaasuseokset adsorptio erotusmenetelmiä käytetään hapella rikastetun ilman saamiseksi (lähes puhtaaseen O 2:een asti); monessa tapauksissa nämä menetelmät kilpailevat menestyksekkäästi tislauksen kanssa (katso. ilmanerotus).
Nopeasti kehittyvä adsorbenttien käyttöalue. teknologia-lääketiede, jossa se palvelee poimimista haitallisia aineita verestä (hemosorptiomenetelmä) jne. fiziol. nesteitä. Korkeat steriiliysvaatimukset muodostavat erittäin vaikean tehtävän valita sopivia adsorbentteja. Näitä ovat erityisesti valmistetut aktiivihiilet.
Lit.: Brunauer S., Kaasujen ja höyryjen adsorptio, trans. englannista, osa 1, M., 1948; de Boer Ya, Adsorption dynaaminen luonne, käänn. Englannista, M., 1962; Adsorption and Porosity, toim. M. M. Dubinina [et ai.], M., 1976; Keliev N.V., Fundamentals of adsorption technology, 2. painos, M., 1984; Young D.M., Crowell A.D., Physical adsorption of gases, L., 1962. M.M. Dubinin, V.V. Serpinsky.
Valitse ensimmäinen kirjain artikkelin otsikosta:
Adsorptio tapahtuu vaiheen rajalla. Siksi on järkevää tarkastella pintailmiöiden termodynaamista kuvausta erikoistapaus heterogeenisten järjestelmien termodynamiikka.
Riisi. 3.4. Gibbs-adsorptio: 1 - kaksivaiheinen vertailujärjestelmä, 2 - todellinen kaksivaiheinen järjestelmä epähomogeenisella alueella
Heterogeenisten järjestelmien termodynamiikka käyttää additiivisuusperiaate, joka on seuraava: heterogeenisen järjestelmän kaikki ekstensiiviset ominaisuudet ovat yhtä suuria kuin niiden vastaavien ekstensiivisten ominaisuuksien summa, jotka faasit olisivat olleet ennen kosketusta. Merkitään vaiheet α:lla ja β:lla (kuva 4). Sitten ideaaliselle järjestelmälle, jossa rajapinnan lähellä olevien faasien ominaisuudet ovat samat kuin niiden bulkkiominaisuudet, sisäisellä energialla U, tilavuus V, massa (moolimäärä) n, entropia S tasapainon jälkeen heterogeenisessa järjestelmässä, suhteet ovat voimassa:
U = U α + U β , V = V α + V β , n = n α + n β , S = S α + S β
Tämä olettaa, että lämpötila ja paine molemmissa vaiheissa ovat samat.
Todellisissa heterogeenisissä järjestelmissä siirtymäalue kahden vaiheen rajapinnassa lisää lisäosuutta järjestelmän laajoihin ominaisuuksiin. Jos pintailmiöitä esiintyy, tulee ottaa huomioon ero todellisen heterogeenisen järjestelmän ekstensiivisten ominaisuuksien ja sellaisen mallijärjestelmän ekstensiivisten ominaisuuksien välillä, joissa ei ole pintailmiöitä. Tällaista järjestelmää kutsutaan vertailujärjestelmäksi. Vertailujärjestelmässä on samat intensiiviset parametrit (T, P, C i …) ja sama tilavuus V kuin todellisessa järjestelmässä (kuva 4).
Termodynaamisesta näkökulmasta adsorptioarvolla G tarkoitetaan aineen ns-ylimäärää, joka ilmaistaan mooliina tai grammoina, joka todellisella heterogeenisellä järjestelmällä on vertailujärjestelmään verrattuna suhteessa faasin pinta-alaan. erotukseen tai adsorbentin A pinta-alaan. Oletetaan, että vertailujärjestelmällä on samat intensiiviset parametrit (T, P, C i) ja sama tilavuus (V = V α + V β) kuin todellisessa järjestelmässä (Kuva 4).
G \u003d (n - n α - n β) / A \u003d n s / A 3.11
Tosijärjestelmän siirtymäalueen ylimääräiset termodynaamiset funktiot (merkitty indeksillä s) voidaan kirjoittaa
U s = U - U α - U β , n s = n - n α - n β , S s = S - S α - S β jne.
Adsorption kokeelliset mittaukset antavat adsorption aina täsmälleen komponentin ylimääränä todellinen järjestelmä verrattuna valittuun vertailujärjestelmään. Esimerkiksi adsorboitaessa kaasua kiinteään adsorbenttiin tai adsorboitaessa komponentteja kiinteään faasiin adsorptioarvojen löytämiseksi määritetään adsorbaatin alkupitoisuuksien muutos faasien α ja β kosketuksen jälkeen.
n i s = V(C i o - C i),
Missä C i o– i:nnen komponentin alkupitoisuus, C i on i:nnen komponentin pitoisuus vierekkäisten faasien välisen tasapainon saavuttamisen jälkeen. Oletetaan, että tilavuus V ei muutu. Kuitenkin keskittyminen i- komponentti C i kokeellisesti saatu, määritetään tilavuudesta V' rajapinnan yläpuolella ottamatta huomioon siirtymäkerroksen epähomogeenisen alueen tilavuutta Vα rajapinnassa, jossa pitoisuus on C i α. Siten, koska todellisessa järjestelmässä on epähomogeeninen alue, järjestelmän kokonaistilavuus voidaan esittää muodossa V = V' + Va. Koko määrä i- komponentti C i o jaettu näiden kahden osan kesken:
V C i o = V' C i + V α C i α ,
ja komponentin moolien lukumäärä i, joka on adsorboitu käyttöliittymään, on yhtä suuri kuin
n i s = (V’C i + V α C i α) – (V’ + V α)C i = V α (C i α – C i) 3.12
Nuo. kokeellisesti määritetty adsorptio on i:nnen komponentin ylimäärä tilavuudessa Vα verrattuna tämän komponentin määrään samassa tilavuudessa kaukana rajapinnasta. Tämän tyyppistä adsorptiota kutsutaan Gibbs-adsorptioksi. .
V α C i α nimeltään täysi sisältö minä- adsorptiokerroksen komponentti. Erittäin alhaisten pitoisuuksien alueella C i määrässä V' muutos V a C i yhtälö (3.2) voidaan jättää huomiotta ja mitattu arvo voidaan ottaa huomioon V α C i α täysi sisältö minä- th komponentti adsorptiokerroksessa, esimerkiksi kaasun adsorptiossa kiinteälle adsorptioaineelle alhaisissa paineissa.
Nykyinen sivu: 6 (kirjassa on yhteensä 19 sivua) [saatava lukuote: 13 sivua]
Fontti:
100% +
34. Adsorptiovoimien luonne
Adsorbentin molekyylien välinen vuorovaikutus adsorbentin pinnan kanssa ns. fyysinen adsorptio voi johtua useista syistä. Sitten potentiaali, joka määrittää yhden adsorptiomolekyylin vuorovaikutuksen ei-polaarisen adsorptioaineen yhden atomin kanssa, voidaan ilmaista seuraavasti:
θ = −Cr 6 +Br 12 ,
missä r on hiukkasten keskusten välinen etäisyys; C on dispersion vetovoimavakio; B on vakio, joka kuvaa hylkivien voimien energiaa.
On aivan selvää, että suhteellisen kaukaisilla etäisyyksillä vetovoimat ja lähietäisyydet hylkivät voimat tulisivat vallita. Myös tietyillä etäisyyksillä näiden voimien on oltava samat, mikä vastaa minimiä ilmaista energiaa. Mutta on tärkeää huomata, että adsorption aikana dispersiovoimat vaikuttavat samanaikaisesti jokaisen ei-polaarisen hiukkasen välillä.
Koska hiukkasten vuorovaikutusenergia voi pienentyä nopeasti etäisyyden myötä, riittää, että lähimmille adsorptioatomeille suoritetaan summaus adsorptiovoimien potentiaalin määrittämiseksi. On tärkeää, että kompleksisten ei-polaaristen molekyylien adsorption tapauksessa potentiaalienergia voidaan laskea likimäärin molekyylin yksiköiden kaikkien potentiaalisten adsorptioenergioiden summana.
Jos adsorbentti koostuu ioneista, niin jo tunnettujen dispersiovoimien vaikutusta voidaan täydentää dipolien induktiovoimilla, jotka indusoituvat adsorbentin molekyyleissä sähkökentällä, joka puolestaan syntyy. adsorptiohilan ionien vaikutuksesta.
Tällaisella vuorovaikutuksella induktiivisten voimien osuus adsorptiovuorovaikutuksessa voi olla verrannollinen adsorptiomolekyylin polarisoituvuuteen ja kentänvoimakkuuden neliöön tällä adsorptiopinnalla.
Jos toisaalta polaarisia adsorbenttimolekyylejä adsorboituu polaariseen adsorbenttiin, niin dipolit tässä tapauksessa polarisoivat adsorbentin atomit, eli ikään kuin ne aiheuttaisivat niissä sähkömomentteja. Tästä vaikutuksesta johtuen induktiivinen vuorovaikutus lisätään dispersioon.
Itse induktiivinen vuorovaikutus on yleensä pieni ja adsorptiomolekyylin dipolista ja adsorbentin polarisoituvuudesta riippuen voi saavuttaa suuria arvoja. Siinä tapauksessa, että molekyylit adsorboituvat adsorbenttiin, jonka pinnalla on ioneja tai dipoleja, ns. adsorbentin ionien tai dipolien vuorovaikutus itse adsorbentin sähköstaattisen kentän kanssa.
Tällöin adsorptiomolekyylit voivat jopa orientoitua adsorbentin kentässä ja tapahtuu orientaatio-Coulomb-vuorovaikutusta. Yleensä tapahtuu, että induktiivisten ja suuntautuvien vuorovaikutusten energiat ovat pienempiä kuin dispersiovuorovaikutusten energia, ja siksi oletetaan, että molekyylien välisen vetovoiman määrää dispersion vetovoiman energia.
Myös vetysidoksen muodostuminen voi toimia adsorption syynä. Tämän tyyppinen sidos voi syntyä adsorption aikana adsorbenttien pinnalle, jotka sisältävät molekyylien, kuten veden, alkoholien, ammoniakin ja amiinien, hydroksyyliryhmiä. Kun muodostuu vetysidos, adsorptioaineen ja adsorbentin vuorovaikutusenergia voi olla melko suuri, ja tällaisen adsorption aikana vapautuva lämpö on paljon suurempi kuin muodoltaan ja kooltaan samankaltaisten molekyylien adsorptiolämpö. mutta eivät muodosta vetysidosta.
On tärkeää huomata, että kun tiedetään pintakerroksen termodynaaminen kuvaus "adsorbentti - adsorbentti" rajalla, sen rakenne, erityyppisten voimien luonne, prosessin dynamiikka, voidaan edetä monimutkaisempien tutkimiseen. adsorptioprosessit.
35. Rajapintojen jännitystä vähentävien aineiden adsorptio spontaanina pitoisuutena faasirajapinnalle
Pinta-aktiiviset aineet jaetaan kahteen suureen ryhmään: aktiivinen ja passiivinen aineita.
Pinta-aktiiviset aineet pystyvät kerääntymään pintakerrokseen, ja tässä tapauksessa tapahtuu positiivinen adsorptio. G > 0.
Tällaisilla aineilla tulee olla pintajännitys, jonka puolestaan tulee olla pienempi kuin liuottimen pintajännitys, muuten aineen kerääntyminen pintakerrokseen olisi epäedullista ja niiden liukoisuuden tulee olla suhteellisen alhainen. Riittävän hyvällä liukoisuudella pinta-aktiivisten aineiden molekyylit pyrkivät jättämään pinnan syvälle liuokseen. Siksi pinta-aktiiviset aineet työnnetään ensisijaisesti ulos nesteen massasta pintaan.
Mutta kun aineita kertyy liuoksen rajalle näiden aineiden molekyyleihin, jotka ovat heikosti vuorovaikutuksessa keskenään, molekyylien välinen vuorovaikutus pintakerroksessa vähenee ja pintajännitys laskee.
Pinta-aktiiviset aineet vesikerrokseen verrattuna on monenlaisia orgaanisia yhdisteitä, rasvahappoja, joissa on riittävän suuri hiilivetyradikaali, näiden happojen suolat (saippuat), sulfonihapot ja niiden suolat sekä erilaisia alkoholit ja amiinit. ominaispiirre useimmat molekyylit ovat niiden difiilisyyttä: molekyyli koostuu kahdesta osasta polaarista ryhmää ja ei-polaarisesta hiilivetyradikaalista. Merkittävä dipolimomentti ja hyvin hydratoituva polaarinen ryhmä voivat määrittää pinta-aktiivisen aineen affiniteetin vesipitoiseen ympäristöön. Mutta hiilivetyradikaali on syy, joka alentaa näiden yhdisteiden liukoisuutta.
Pinta-aktiiviset pinta-aktiiviset aineet- tämäntyyppiset aineet, jotka pyrkivät poistumaan nesteen pinnalta tilavuuteensa, minkä seurauksena ns. negatiivinen adsorptio G < 0. Поверностно-инактивные вещества также обладают значительным поверхностным натяжением, значительно большим, чем натяжение у растворителя (иначе эти вещества способны самопроизвольно накапливаться в поверхностном слое), также обладают высокой растворимостью, что способствует их стремлению уйти с поверхности жидкости в объем. Взаимодействие между молекулами поверхностно-инактивного вещества и растворителя всегда больше, чем взаимодействие между самими молекулами растворителя, поэтому они и стремятся перейти в объем раствора. Pinta-aktiiviset aineet veteen liittyy monia epäorgaanisia elektrolyyttejä: happoja, emäksiä, suoloja. Pinta-inaktiivisten aineiden molekyyleissä ei ole hydrofobista osaa, ja ne voivat hajota vedessä voimakkaasti hydratoiviksi ioneiksi.
Esimerkkejä pinta-inaktiiviset aineet ovat myös joitain orgaanisia yhdisteitä, joissa molekyylin ei-polaarinen osa puuttuu tai on hyvin pieni. Näitä aineita ovat muurahaishappo, aminoetikkahappo.
Ei-vesipitoisissa liuottimissa epäorgaaniset elektrolyytit pystyvät myös lisäämään pintajännitystä, ja tämä riippuu liuottimesta.
Esimerkiksi, kun natriumjodidia lisätään metanoliin, pintajännitys kasvaa suuresti; etanolin pintajännitys on noin 2 kertaa suurempi. Aineiden pinta-aktiivisuus voi riippua paitsi aineen luonteesta myös liuottimen ominaisuuksista. Jos jollakin liuottimella on korkea pintajännitys, tällä liuenneella aineella voi olla merkittävää pinta-aktiivisuutta.
36. Adsorptioteoriat
Tarkastellaan yleisimpiä adsorptioteorioita, jotka kuvaavat yksittäisiä adsorptiotyyppejä "kiinteä-kaasu"- tai "kiinteä-liuos"-rajapinnassa.
I. Langmuirin teoria monomolekulaarisesta adsorptiosta.
1. Adsorptio on paikallista ja sen aiheuttavat voimat, jotka ovat lähellä kemiallisia voimia.
2. Adsorptio tapahtuu vain aktiivisissa keskuksissa - adsorbentin pinnalla olevissa ulkonemissa tai syvennyksissä, joille on ominaista vapaiden valenssien läsnäolo. Aktiivisia keskuksia pidetään itsenäisinä ja identtisinä.
3. Jokainen aktiivinen keskus pystyy olemaan vuorovaikutuksessa vain yhden adsorbaattimolekyylin kanssa; pintaan voi muodostua vain yksi kerros adsorboituja molekyylejä.
4. Adsorptioprosessi on palautuva ja tasapainoinen; aktiivinen keskus säilyttää adsorboituneen molekyylin jonkin aikaa, minkä jälkeen se desorboituu; Jonkin ajan kuluttua dynaaminen tasapaino saavutetaan.
Suurin mahdollinen adsorptioarvo G o saavutetaan sillä ehdolla, että kaikki aktiiviset keskukset ovat adsorbaattimolekyylien miehittämiä. Monomolekulaarisen adsorption isotermiyhtälö, joka liittyy adsorptioarvoon G adsorbaattipitoisuuden kanssa KANSSA, näyttää:
Missä b- vakio tietylle "adsorptio-adsorbaatti"-arvoparille (desorption ja adsorption nopeusvakioiden suhde), joka on numeerisesti yhtä suuri kuin adsorbaatin konsentraatio, jossa puolet aktiivisista keskuksista on varattu.

Langmuirin adsorptioisotermin käyrä on esitetty kuvassa 2. Vakio b määrittelemme graafisesti piirtämällä tangentin adsorptioisotermille pisteeseen KANSSA= 0. Kaasujen adsorptioprosessia kuvattaessa yhtälössä pitoisuus voidaan korvata osapaineen suhteellisella arvolla. Monomolekyylisen adsorption teoria I. Langmuir soveltuu kuvaamaan kaasujen ja liuenneiden aineiden adsorptioprosesseja adsorbaatin matalilla paineilla (pitoisuuksilla).
Polanyin polymolekulaarisen adsorption teoria kuvaa s-muotoisia adsorptioisotermejä, joiden muoto osoittaa adsorboituneiden molekyylien mahdollisen vuorovaikutuksen adsorbaatin kanssa.
1. Adsorptio johtuu fyysisistä voimista.
2. Adsorbentin pinta on homogeeninen, aktiivisia keskuksia ei ole; adsorptiovoimat muodostavat jatkuvan voimakentän lähellä adsorbentin pintaa.
3. Adsorptiovoimat vaikuttavat adsorbaattimolekyylin kokoa suuremmalla etäisyydellä, ts. adsorptioaineen pinnan lähellä on tietty adsorptiotilavuus, joka täyttyy adsorbaattimolekyyleillä adsorption aikana.
4. Adsorbaattimolekyylin vetovoima adsorptiopinnalla ei riipu muiden molekyylien läsnäolosta adsorptiotilavuudessa, minkä seurauksena polymolekyyliadsorptio on mahdollista.
5. Adsorptiovoimat eivät riipu lämpötilasta, ja siksi lämpötilan muutoksen myötä adsorptiotilavuus ei muutu.
Freundlichin yhtälö. Adsorbentin pinta on epähomogeeninen, adsorboituneiden hiukkasten välillä tapahtuu vuorovaikutusta, aktiiviset keskukset eivät ole täysin riippumattomia toisistaan. G. Freindlich ehdotti, että adsorboituneen kaasun tai liuenneen aineen moolimäärä adsorptioaineen massayksikköä kohti (ns. spesifinen adsorptio X/m), on oltava verrannollinen adsorbentin tasapainopaineeseen (kaasulle) tai tasapainopitoisuuteen (liuoksesta adsorboituneet aineet), joka on nostettu tiettyyn tehoon, joka on aina pienempi kuin yksikkö:
x / m = aP n x / m = aC n.
eksponentit n ja suhteellisuustekijä A määritetty kokeellisesti.
37. Adsorptioprosessin termodynamiikka. Gibbsin adsorptioyhtälö
Adsorptioilmiön tutkimiseksi "liuos - kaasu" rajalla on tarpeen määrittää suhde adsorboituneen aineen ylimäärän välillä pinnalla olevassa kerroksessa ( G), pinta-aktiivisen aineen pitoisuus liuoksessa ( Kanssa) ja pintajännitys ( σ ) "liuos-kaasu" -vaiheen rajalla. On tarkoituksenmukaisempaa tarkastella ilmiöitä termodynaamisesta näkökulmasta ja liittää liuenneen aineen adsorptio pinnan vapaan energian tai sen pintajännityksen muutokseen. Tämä yhteys tehtiin W. Gibbs V 1876, joka nimettiin "Gibbsin adsorptioyhtälö":
G = – Kanssa / RT x dσ/DC.
Voit silti kuvitella Gibbsin yhtälö, perustuu termodynamiikkaan, käyttäen isobaari-isotermistä potentiaalia G, kemialliset potentiaalit μ 1 Ja μ 2, ja myös käyttää n 1 Ja n 2 komponenttien moolien lukumäärä. Analysoituaan sen entropian huomioon ottaen S, äänenvoimakkuus V ja paineita P, voimme kirjoittaa seuraavan yhtälön:
dG=– SDT+VdP+σds+ μ 1 d n 1 + μ 2 päivää 2.
Yhdistämme sen nollaan, ja kun otetaan huomioon vakiolämpötila ja paine, se yksinkertaistuu muotoon yhtälö:
sd σ + n 1 d μ 1 + n2d μ 1 = 0.
Ottaen huomioon, että laimeiden liuosten tapauksessa toisen komponentin kemiallinen potentiaali ilmaistaan seuraavasti:
μ 2 = μ 2 0 +RT ln c,
ja koska lämpötila on vakio
dμ 2 =rtdnc,
korvaamalla tämän yhtälön
![]()
saamme halutun Gibbsin adsorptioyhtälön. Yhtälön perusteella voidaan nähdä, että jos pintajännitys σ lisääntyy keskittymisen myötä Kanssa, silloin liuenneen aineen pitoisuus pintakerroksessa on pienempi kuin liuoksen tilavuudessa (ns. negatiivinen adsorptio), ja jos pintajännitys σ vähenee keskittymisen kasvaessa Kanssa, silloin kerroksen pitoisuus on suurempi kuin tilavuudessa (positiivinen adsorptio), ja lopuksi, jos σ ei riipu Kanssa, silloin aineen pitoisuus pinnalla olevassa kerroksessa ja tilavuudessa on sama. Gibbsin yhtälö johdettiin termodynamiikasta. Tätä yhtälöä on vaikea todentaa käytännössä, mikä johtuu liuenneen aineen pitoisuuden määrittämisen monimutkaisuudesta kerroksellisessa pinnassa. Kokenut B. McBen havaitsi, että laitetta käyttämällä leikattiin pois erittäin ohut nestekerros liuoksen pinnasta. Kaikkien Gibbs-yhtälön parametrien lisämääritykset osoittivat, että kokeellisesti löydetyt adsorptioarvot osuivat yhteen Gibbs-yhtälön avulla kokeellisessa virheessä laskettujen arvojen kanssa. Minkä tahansa nesteen pinnan homogeenisuuden ja sileyden vuoksi, tutkittaessa adsorptiota sen pinnalla, tavanomaiset ajatukset aktiivisista keskuksista ovat täysin soveltumattomia. Kriittisessä lämpötilassa vierekkäisten faasien välinen ero katoaa ja pintajännitys on pääsääntöisesti yhtä suuri kuin nolla. Kaasujen ja höyryjen adsorptiolla on niin laaja käytännön sovellus, että kirjallisuudesta, erityisesti teknisestä, löytyy tämä käsite, jota käytetään vain kiinteiden aineiden pinnalla tapahtuvien prosessien yhteydessä.
Tämä käsite, samoin kuin yleisimmät adsorptiomallit, kuten tarkasteltu Gibbsin yhtälö, soveltuvat kaikkiin vaiherajoihin. Käyttämällä Gibbsin yhtälöä ja kaikkia siitä johtuvia ehtoja, kun on määritetty Г:n arvo, on mahdollista muodostaa adsorptioisotermi.
38. Adsorption erityispiirteet mikrohuokoisille materiaaleille. Polanin potentiaaliteoria. Adsorptiopotentiaali
Gladen teoria ottaa huomioon lokalisoimattoman fyysisen adsorption, joka johtuu suoraan van der Waalsin voimista adsorbentin ja adsorbaatin välillä (tätä voidaan pitää ensimmäisenä asemana). Tämän teorian toinen asema on käsite adsorbentin voima- (tai potentiaali-) kentästä, joka ulottuu huomattavan etäisyyden päähän pinnasta; tässä kentässä näkyvä adsorptiokerros on polymolekyylinen. Jos tarkastelemme kaasujen adsorptiota, tämän kerroksen tiheys pienenee tiettyä normaalia pitkin pinnasta. Jos tarkastellaan höyryn adsorptiota, pinnalle muodostuu tietyn paksuinen nestekerros. Polanyin teoriassa kenttää pidetään sarjana ekvipotentiaalipintoja, jokainen pinta vastaa tiettyä potentiaalin arvoa ε , ja jokainen seuraava pinta on pienempi kuin edellinen. Jokainen tällainen pinta avaruudessa leikkaa pois tietyn tilavuuden kerrokset, joita kutsutaan nimellä v i. Polanyin teorian tehtävänä on löytää siirtymä isotermin tavallisista koordinaateista ( x, s) kenttäparametreihin ε i Ja v i, jolloin näiden pääparametrien välinen yhteys muodostetaan edelleen. Ensimmäinen osa ongelmasta, jonka Polanyi asetti, on melko monimutkainen, eikä monissa tapauksissa voi olla varmoja ratkaisuja, mutta höyryadsorption tapauksessa tämä ongelman osa ratkaistaan ensimmäisessä approksimaatiossa hyvin yksinkertaisesti. Nestemäiselle adsorptiokerrokselle tilavuuden täytetty osa on yhtä suuri kuin:
v i \u003d x (M / d),
Missä d on aineen tiheys nestemäisessä tilassa.
M. Polyany esittelee teoriassaan toisen säännöksen ns. kentän seulonta adsorptioprosessissa, arvo ε Tässä teoriassa avaruus on vakioarvo (jotain kuin gravitaatiopotentiaali) riippumatta siitä, onko tietyn pisteen ja kiinteän pinnan välissä tiettyjä adsorboituneita molekyylejä vai onko kaikki tila vapaata. Polyani esittelee konseptin adsorptiopotentiaali ε , joka on isoterminen työ höyryn puristamisessa, kun se siirretään tasapainopaineesta R bulkkifaasissa kaukana pinnasta pintakerroksen alueelle, jossa on kylläinen höyrynpaine p 0 silloin potentiaalin määrittämislauseke näyttää tältä:
ε = RT ln R 0 / R.
Tällaisen yhtälön avulla voidaan siirtyä koordinaateista x, p koordinaatteihin ε Ja v ja saada käyrä, jota kutsutaan "ominaiseksi". Polanyi havaitsi kokeissaan, että tällaisilla saatujen isotermien kokeellisista tiedoista konstruoiduilla käyrillä on seuraava ominaisuus: ne ovat invariantteja T:n suhteen, eli toisin sanoen kaikki tämän tyyppiset käyrät voivat olla yhdellä käyrällä ε −ε .
M. Polyany hyväksyi tämän kannan postulaattina, eli:
Ilmoitetulla Polyanyn omaisuudella on valtava käytännön arvoa, se voi muodostaa isotermien perheen yhdestä kokeellisesta adsorptioisotermistä.
Polanyin teoria ei anna analyyttistä lauseketta isotermille tai potentiaalin tilavuuden funktiolle, mutta sallii koordinaatin laskemisen mille tahansa lämpötilalle, jos ainakin yksi isotermi tunnetaan. Tämä tulos on erittäin tärkeä teknisiä laskelmia, koska samanlaisten kaasujen kohdalla samalla adsorbentilla adsorptiokäyrät voivat olla lähellä toisiaan ja voivat monissa tapauksissa olla päällekkäisiä.
39. Adsorption ominaiskäyrä. Lämpötilainvarianssi ja ominaiskäyrien affiniteetti
Adsorbentin pinnalle ilmestyvä voimakenttä voi olla monessa suhteessa samanlainen kuin gravitaatiokenttä. Adsorptiokentässä voidaan esittää potentiaalisia pintoja, eli pintoja, joille on ominaista sama adsorptiopotentiaali. Adsorptiopotentiaalin käsitteen alla θ ei tulisi ymmärtää muuta kuin työtä, joka tehdään adsorptiovoimia vastaan siirrettäessä 1 mooli adsorbaattia tietystä pisteestä kentällä tiettyyn kaasufaasiin. Suurin adsorptiopotentiaali on "adsorptio-adsorptiotilavuuden" rajalla. Mutta rajalla "tilavuus - kaasufaasi" (tähän adsorptiovoimien toiminta päättyy) adsorptiopotentiaalin on oltava yhtä suuri kuin nolla. Adsorptiopotentiaalin muutos adsorptiotilavuuden muutoksella voidaan esittää käyrien muodossa. Tämän teki ensin M. Polyani. Tämäntyyppiset käyrät eivät riipu lämpötilasta ja voivat olla ominaisia jokaiselle tietylle adsorptioaineelle; tällaisia käyrätyyppejä kutsutaan yleensä adsorption ominaiskäyriksi. Polymolekyylisen adsorption teoria olettaa, että kaasun tilayhtälö pätee adsorption määrään. Tästä johtuen isotermit, jotka kuvaavat adsorbaatin tiheyden riippuvuutta tilavuudesta eri lämpötiloissa, muistuttavat paineen tilavuuden riippuvuuden isotermejä. Matalissa lämpötiloissa pintaan kohdistuvat adsorptiovoimat voivat saada höyryn tiivistymään tietyn tiheyden omaavaksi nesteeksi. Kriittistä alhaisemmissa lämpötiloissa kondensaation aikana koko adsorptiotilavuus täyttyy nesteellä. Tässä tapauksessa adsorptiokäyrä kulkee lähes samansuuntaisesti abskissa-akselin kanssa, mikä liittyy nesteen alhaiseen kokoonpuristumiseen. Sitten adsorptiokäyrä "tilavuus - kaasufaasi" rajalla laskee jyrkästi alas, ja vastaavasti adsorbaatin tiheys saavuttaa kaasufaasin tietyn tiheyden arvon. Kriittistä korkeammissa lämpötiloissa adsorbentti voi käyttäytyä kuin ihanteellinen kaasu, ja käyrä ilmaistaan ihanteellisen kaasun riippuvuuden isoterminä, edellyttäen että pV = RT. Tällaisissa olosuhteissa adsorboidulla kaasulla on maksimitiheys adsorbentin pinnalla ja pienin tiheys kaasufaasin välittömässä läheisyydessä. Lisäksi tässä tapauksessa on tärkeää huomata, että adsorptiokerroksessa olevan adsorbaatin tiheys ei missään saavuttaa itse nesteen tiheyttä. Ja jos lämpötila on hyvin lähellä kriittistä, tiheyden riippuvuus tilavuudesta ilmaistaan käyrällä, joka on ulkonäöltään lähellä isotermiä, joka on kuvattu van der Waalsin yhtälö. Tässä skenaariossa osa adsorboituneesta aineesta on adsorboituneessa tilavuudessa nestemäisessä tilassa ja osa adsorboituneesta aineesta on kaasumaisessa tilassa. Silloin käyrä pienenee jyrkimmin siinä osassa, joka vastaa siirtymistä nesteestä kaasuun. Jos jonkin adsorptioaineen kokeellisesta adsorptioisotermistä muodostetaan ominaiskäyrä ja tiedetään vastaavat affiniteettikertoimet jollekin muulle adsorptiolle, voidaan löytää adsorptioisotermi ja muodostaa se toiselle adsorptiolle. Adsorptiopotentiaaliteoria mahdollistaa eri höyryjen eri adsorptioisotermien laskemisen samalle adsorptioaineelle, lisäksi käyttämällä yhden höyryn adsorptioisotermistä saatua ominaiskäyrää, koska adsorptiopotentiaalin suhde ei riipu adsorptiotilavuuksista .
affiniteetti(latinasta affinis - "sukulainen") - affiniteettikromatografia. Proteiinien puhdistus- ja erotusmenetelmä perustuu niiden selektiiviseen vuorovaikutukseen ligandin kanssa, joka on kovalenttisesti sidottu inerttiin kantajaan (affiniteettikromatografia). Myrkyllisen aineen reseptoriaffiniteetin mittaaminen on itse asiassa kokeellinen tutkimus inkubaatioalustaan lisätyn aineen määrän ja vuorovaikutuksen tuloksena muodostuneen toksisen aineen ja reseptorikompleksin määrän välisestä suhteesta.
Adsorptioprosessien termodynamiikka.
| Parametrin nimi | Merkitys |
| Artikkelin aihe: | Adsorptioprosessien termodynamiikka. |
| Otsikko (teemaattinen luokka) | koulutus |
Adsorptioprosessien luokittelun perusmääritelmät ja menetelmät.
Adsorptio viittaa ilmiöihin, jotka tapahtuvat pintaenergian spontaanin vähenemisen seurauksena.
Adsorptio- heterogeenisen järjestelmän komponenttien spontaani palautuva tai palautumaton uudelleenjakautuminen pintakerroksen ja homogeenisen faasin tilavuuden välillä.
Monikomponenttijärjestelmissä rajapintajännitystä alentava komponentti on parempi kuin pintakerros. Yksikomponenttisysteemeissä pintakerroksen muodostumisen aikana sen rakenne muuttuu (atomien ja molekyylien tietty orientaatio, polarisaatio), ns. automaattinen adsorptio.
Kutsutaan tiheämpää vaihetta, johon adsorptiovuorovaikutukset lokalisoituvat adsorbentti. Aine, joka on jakautunut uudelleen homogeenisen faasin tilavuuden ja pintakerroksen välillä, on merkitty termillä ʼʼ adsorboidaʼʼ.
Joissakin tapauksissa adsorptioprosessi on palautuva. Tällöin tietyissä olosuhteissa osa adsorboituneista molekyyleistä voi siirtyä pintakerroksesta faasin tilavuuteen molekyylikineettisten ilmiöiden seurauksena. Adsorption käänteistä prosessia kutsutaan desorptio.
Adsorptioprosessien luokittelumenetelmät.
Adsorptioprosessien luokittelu vuorovaikutuksessa olevien vaiheiden aggregaatiotilan mukaan. Ottaen huomioon riippuvuuden vierekkäisten vaiheiden kokonaistilasta erotetaan seuraavat adsorptioprosessit:
Kaasujen adsorptio kiinteisiin adsorbentteihin;
Liuenneiden aineiden adsorptio ʼʼkiinteä-nesteʼʼ ja ʼʼneste-nesteʼʼ -rajapinnoilla;
Pinta-aktiivisten aineiden adsorptio ʼʼneste-kaasuʼʼ -rajapinnassa.
Adsorptioprosessien luokittelu adsorptioaineen ja adsorbaatin vuorovaikutusmekanismin mukaan. Adsorptiota voidaan pitää adsorbaattimolekyylien vuorovaikutuksena adsorbentin aktiivisten keskusten kanssa. Niiden vuorovaikutusmekanismin mukaan seuraavat adsorptiotyypit jaetaan:
1) fysikaalinen (molekyylinen) adsorptio- adsorbaatin ja adsorbentin molekyylien välinen vuorovaikutus tapahtuu van der Waalsin voimien, vetysidosten (ilman kemialliset reaktiot);
2) kemiallinen adsorptio (kemisorptio)– adsorbaattimolekyylien kiinnittyminen adsorbentin aktiivisiin kohtiin tapahtuu erityyppisten kemiallisten reaktioiden seurauksena (lukuun ottamatta ioninvaihtoreaktioita);
3) ioninvaihtoadsorptio (ioninvaihto) - adsorboituneen aineen uudelleenjakautuminen liuoksen ja kiinteän faasin (ioninvaihdin) välillä ioninvaihtoreaktioiden mekanismin mukaisesti.
Adsorptioprosessien kvantitatiiviseen kuvaamiseen käytetään kahta määrää.
1) Absoluuttinen adsorptio on adsorbaatin määrä (mol) tai massa (kg) adsorbentin pinta-alayksikköä tai massaa kohti. Nimitys - A; yksikkö: mol/m 2, mol/kg, kg/m 2, kg/kᴦ.
2) Gibbsin (ylimääräinen) adsorptio on pintakerroksen tietyn paksuinen adsorbaattiaineen ylimäärä verrattuna sen määrään homogeenisen faasin tilavuudessa adsorbentin pinta-alayksikköä tai massaa kohti. Nimitys - G; yksikkö: mol/m 2, mol/kᴦ.
Absoluuttisen ja ylimääräisen adsorption välinen suhde voidaan havainnollistaa käyttämällä yhtälöä:
G \u003d A - c * h (3.1)
missä c on aineen tasapainopitoisuus faasin tilavuudessa, mol/m3;
h on pintakerroksen paksuus, joka on ehdollisesti 10 -9 m.
Monikomponenttisissa heterogeenisissä järjestelmissä, kun yksi tai toinen komponentti jakautuu uudelleen homogeenisen faasin tilavuuden ja pintakerroksen välillä, pinnan ylimääräisen sisäisen energian yhtälö pätee:
U = T * S + s * s + Sm i * n i (3.2)
Tuomalla kaikki yhtälön ehdot rajapinnan pinnan yksikköpinta-alaan, saamme:
U s = T * S s + s + Sm i * Г i (3.3)
missä Г i = n i / s on pintakerroksen i:nnen komponentin ylimäärä eli Gibbsin adsorptio.
Yksikomponenttisessa järjestelmässä yhtälö (3.3) on seuraavanlainen:
G s = s + m * Г (3.4)
missä G s = U s - T * S s on pinnan Gibbsin energia tai työ pinnan yksikköpinta-alan luomiseksi;
m * Г - adsorboituneen aineen aineen tiivistyminen pintakerroksessa.
Yhtälön (3.4) perusteella voimme päätellä, että adsorption aikana työ rajapinnan luomiseksi koostuu pinnan muodostamisesta (koostuvien sidosten rikkomisesta suurimmassa osassa adsorbaattifaasia) ja aineen tiivistämisestä pintakerroksessa.
Dynaamisen tasapainon tilassa adsorbentin ja adsorbaatin välillä heterogeenisen järjestelmän Gibbsin energian muutos ΔG = 0, adsorptioprosessin termodynamiikkaa kuvaa yhtälö ns. Gibbsin perusadsorptioyhtälö:
Ds = SГ i * dm i (3,5)
Tämä yhtälö on universaali, koska se pätee kaikentyyppisille adsorptioprosesseille
Gibbsin adsorptioyhtälön erityistapaukset.
1) Adsorptio liuoksista.
Järjestelmän i:nnen komponentin kemialliselle potentiaalille adsorption aikana rajapinnoilla "neste - kiinteä adsorbentti" ja "neste - kaasu" yhtälöt ovat voimassa:
m i = m i 0 + R*T*ln a i (3.6)
dm i = R*T* d ln a i (3.7)
missä m i 0 on järjestelmän i:nnen komponentin kemiallinen potentiaali at vakioolosuhteet;
a i – järjestelmän i:nnen komponentin aktiivisuus standardiolosuhteissa.
Tämän perusteella Gibbsin adsorptioyhtälö on seuraavanlainen:
Г i = - a i / R*T * (ds / da i) (3.8)
Ei-elektrolyyttiliuoksille otamme a i \u003d c i, sitten:
Г i \u003d - s / R * T * (ds / ds) (3.9)
Elektrolyyttiliuoksille:
Г i = - с ± n / R*T * (ds / dс ± n) (3.10)
missä c ± on liuoksen keskimääräinen ionipitoisuus;
n on stoikiometrinen kerroin.
2) Aineiden adsorptio kaasufaasista.
Mendelejev-Claiperon yhtälön mukaisesti:
P \u003d c * R * T (3,11)
Tässä suhteessa Gibbsin yhtälö kaasujen adsorptiolle kiinteisiin adsorbentteihin on kirjoitettu seuraavassa muodossa:
Г i = - Р / R*T * (ds / dР) (3.12)
Käytännössä Gibbsin adsorptioyhtälö mahdollistaa pintajännityksen määrittämisen perusteella rajapintakerroksessa olevien aineiden adsorptiomäärän laskemisen pintajännityksen mittauksen perusteella erilaisilla nestepitoisuuden tai kaasun tasapainopaineen arvoilla. .
Adsorptioprosessien termodynamiikka. - käsite ja tyypit. Luokan "Adsorptioprosessien termodynamiikka" luokitus ja ominaisuudet. 2017, 2018.
Kahden atomin vuorovaikutuksessa:
U on vuorovaikutusenergia;
U = U + U VEDÄ.
 - Lennard-Jones yhtälö
, c, b, m = vakio
- Lennard-Jones yhtälö
, c, b, m = vakio
Atomien vuorovaikutuksessa kiinteän pinnan kanssa on tarpeen laskea yhteen kaikki vuorovaikutukset.
x on etäisyys pintaan
r - vetovoimien vaikutussäde
dV - äänenvoimakkuus
n on pintamolekyylien lukumäärä
U ADS. on adsorption vuorovaikutusenergia



Adsorption tapauksessa vetovoima lisääntyy. Ja ei-polaarisen ja ei-polaarisen tyypin vuorovaikutuksen tapauksessa adsorptio sijoittuu pääasiassa painaumiin.
sähköstaattinen vuorovaikutus.
Polaarinen adsorbentti - ei-polaarinen adsorbaatti
Ei-polaarinen adsorbentti - polaarinen adsorbaatti
Polaarinen adsorbentti on polaarinen adsorbaatti.
M  adsorbaattimolekyyli esitetään dipolina ja adsorbentti johtimena, jossa adsorbaattimolekyyli indusoi dipolin peilisymmetrisesti annettuun nähden.
adsorbaattimolekyyli esitetään dipolina ja adsorbentti johtimena, jossa adsorbaattimolekyyli indusoi dipolin peilisymmetrisesti annettuun nähden.
X - etäisyys keskelle
Vuorovaikutuksessa syntyy potentiaalia:
 ,
,
 on dipolimomentti.
on dipolimomentti.
Potentiaalilla on taipumus saada maksimiarvo, ts. dipolit pyrkivät suuntautumaan kohtisuoraan pintaan nähden.
Koska lämpötilan nousu edistää Brownin liikkeen kasvua, se johtaa adsorptioprosessin hidastumiseen.
Sähköstaattisen vuorovaikutuksen tapauksessa adsorbaatti sijoittuu pääasiassa ulkonemiin.
Perusadsorptioyhtälö.
Adsorption tapauksessa komponentti jakautuu uudelleen, mikä tarkoittaa, että kemiallinen potentiaali muuttuu. Adsorptioprosessia voidaan pitää pintaenergian muuttumisena kemialliseksi energiaksi.
Kerroksen tilavuus = 0, sitten termodynamiikan lain yleistetty yhtälö I ja II:
T = const; (1) = (2) => 

Kaksikomponenttiselle järjestelmälle:
,
 ,
,
 =>
=>
=>
 - Gibbsin adsorptioyhtälö
.
- Gibbsin adsorptioyhtälö
.
Jos kyseessä on television adsorptio. runko - kaasu:, 
 ,
,

 -isotermi
-isotermi
 -isobaari
-isobaari
 -isopykne
-isopykne
 - isosteri
- isosteri
Isotermi, isopycne ja isostere liittyvät toisiinsa.
Koska adsorptiotoiminto 



Henryn isotermi Langmuirin isotermi



Termodynamiikka. Adsorptio.
Tiivistetylle materiaalille:
 ,
,
 ,
,
 - olennainen muutos Gibbsin energiassa
.
- olennainen muutos Gibbsin energiassa
.

P-paine kaarevan pinnan yli, P S-paine tasaisella pinnalla
 - adsorptiopotentiaali
- adsorptiopotentiaali
Differentiaalinen muutos entrapyssa 
 , Г = vakio
, Г = vakio
- differentiaalinen entropian muutos
- adsorption differentiaalinen entalpia
 - isosteerinen adsorptiolämpö
- isosteerinen adsorptiolämpö
 - kondensaatiolämpö
- kondensaatiolämpö
 - adsorptiolämpö
- adsorptiolämpö

 ,
,




Qa on adsorptiolämpö, 
Qra on adsorption kiinteä nettolämpö,

Henryn yhtälö
Adsorption tutkimista vaikeuttaa pinnan epähomogeenisuus, joten homogeenisille pinnoille saadaan yksinkertaisimmat säännönmukaisuudet.
Tarkastellaan kaasujen vuorovaikutusta kiinteän pinnan kanssa, kun kaasu siirtyy tilavuudessa tasapainotilasta pinnalla olevaan tasapainotilaan. Tämä tapaus on analoginen kaasujen tasapainon kanssa gravitaatiokentässä.
 ,
,
 ,
=>
,
=> -Henryn yhtälö
-Henryn yhtälö
 - jakautumiskerroin
- jakautumiskerroin
Adsorptioprosessissa tapahtuu muutos kemiallisissa potentiaaleissa.
Joukkovaiheessa: 
Pintakaasulle: 
Tasapainotilassa  , eli
, eli

Henryn yhtälössä vakio ei riipu pitoisuudesta
Henryn yhtälö pätee alhaisten paineiden ja pitoisuuksien alueella. Kun pitoisuus kasvaa, kahdenlaisia poikkeamia Henryn laista ovat mahdollisia:
1 - positiiviset poikkeamat, D pienenee, A pienenee
2 - negatiiviset poikkeamat, D - kasvaa, A - kasvaa.
Poikkeaman tyypin määrää jonkin tai toisen tyyppisen adsorbentti-adsorbaatti-vuorovaikutuksen vallitsevuus.
Vahvalla liimavuorovaikutuksella aktiivisuuskertoimet kasvavat - positiivinen poikkeama. Kohesiivisten vuorovaikutusten tapauksessa havaitaan negatiivisia poikkeamia.
monomolekyylinen adsorptio.
Langmuirin isotermi.
Yksinkertaisimmat säännönmukaisuudet saatiin Henryn teoriasta. Langmuir ehdotti teoriaa, jonka mukaan adsorptiota pidetään kvasikemiallisena reaktiona. Jossa:
Pinta on energisesti tasainen.
Adsorptio on paikallista, jokainen adsorptiokeskus on vuorovaikutuksessa yhden adsorbaattimolekyylin kanssa.
Adsorbaattimolekyylit eivät ole vuorovaikutuksessa toistensa kanssa.
Adsorptio on yksikerroksinen.

 - pinta,
- pinta,  - adsorboitua,
- adsorboitua,  - adsorptiokompleksi.
- adsorptiokompleksi.
 , sitten adsorptiokohtien pitoisuus:
, sitten adsorptiokohtien pitoisuus:  ,
, - adsorption rajoittaminen.
- adsorption rajoittaminen.
 , sitten reaktiovakio:
, sitten reaktiovakio: 

 - Langmuirin yhtälö.
- Langmuirin yhtälö.
Adsorptio vs. pitoisuus
1 )
)
 ,
,

2) korkeiden pitoisuuksien alue
 - adsorption rajoittaminen, monomolekyylikerroksen muodostuminen
- adsorption rajoittaminen, monomolekyylikerroksen muodostuminen
Gibbsin energialle: .
g on entropiatekijä.
Henryn isotermin tapauksessa Gibbsin energia luonnehtii adsorbaatin siirtymistä massassa olevasta standarditilasta pinnalla olevaan standarditilaan. Langmuirin isotermin tapauksessa  kuvaa adsorbentin ja adsorbaatin affiniteettiastetta.
kuvaa adsorbentin ja adsorbaatin affiniteettiastetta.
 löytyi van't Hoff isobarista.
löytyi van't Hoff isobarista.

 , Sitten
, Sitten  , siis
, siis  .
.

 - pinnan täyttöaste.
- pinnan täyttöaste.




 - avoimien työpaikkojen määrä,
- avoimien työpaikkojen määrä,  - varattujen paikkojen määrä.
- varattujen paikkojen määrä.
 ,
,

Nuo. korkeiden pitoisuuksien alueella vapaiden kohtien lukumäärä on kääntäen verrannollinen adsorbaatin määrään.
Kaasuseoksen adsorptio homogeeniselle pinnalle.
Tässä tapauksessa adsorptioprosessia pidetään kahtena rinnakkaisena reaktiona.
 (1)
(1)

 (2)
(2)


Kaasuseoksen adsorptio epähomogeeniselle pinnalle.
Epähomogeenisen pinnan tapauksessa ei pidä rajoittua keskikokoisiin täytteisiin.
Kilpailun seurauksena erilaisten adsorbaattien lokalisointi on mahdollista erityyppisille kohteille.
Tässä tapauksessa suhde  .
.
 ,
,
 on adsorbaatin kyllästyshöyryn paine.
on adsorbaatin kyllästyshöyryn paine.
 ,
,
 on adsorptiolämpö.
on adsorptiolämpö.
"+" - symbaattinen riippuvuus, "-" - antibaattinen riippuvuus, "H" - ei korrelaatiota.
"+" - adsorptio etenee saman mekanismin mukaisesti. Energeettisesti edullisimmilla alueilla adsorboituu pääasiassa kaasu, jolla on korkea affiniteetti pintaan.
"-" - adsorptio etenee erilaisten mekanismien kautta ja tiettyyn hetkeen asti pinnasta ei ole kilpailua.
Monomolekulaarinen adsorptio tapahtuu pääasiassa kaasujen fysikaalisen adsorption aikana pienillä arvoilla s, sekä neste/kaasu rajapinnassa.
Polymolekyylinen adsorptio.
BET teoria(Brunauer, Emmet, Teller).
Siinä tapauksessa, että yksikerroksisen kerroksen muodostuminen ei riitä kompensoimaan pintaenergiaa, adsorptio on polymolekyylistä ja sitä voidaan pitää pintavoimien vaikutuksen alaisena pakotetun kondensaation tuloksena.
Perussäännökset:
Kun adsorbaattimolekyyli osuu varattuun kohtaan, muodostuu moninkertainen joukko.
Kun pääset lähemmäksi s Vastaanottaja s s vapaiden adsorptiokohtien määrä vähenee. Aluksi sinkkujen, nelinpelien jne. paikkojen määrä kasvaa ja sitten vähenee. sarjat.
klo s =s s adsorptio muuttuu kondensaatioksi.
Vaakasuuntaisia vuorovaikutuksia ei ole.
Ensimmäiselle kerrokselle suoritetaan Langmuirin isotermi.
Pintaa pidetään adsorptiokohtien sarjana. Dynaamisen tasapainon ehto on voimassa: tiivistymisnopeus vapaissa paikoissa on yhtä suuri kuin haihtumisnopeus miehitetyistä paikoista.
a on kondensaatiokerroin (pinnalle kondensoituneiden molekyylien osuus);
 ,
,
Zm on vapaita paikkoja enimmäismäärä.
 - atomien värähtelytaajuus pintaan nähden kohtisuorassa suunnassa.
- atomien värähtelytaajuus pintaan nähden kohtisuorassa suunnassa.
Ensimmäisen kerroksen dynaamiset tasapainoolosuhteet ovat:



 , Sitten
, Sitten
 - Langmuirin yhtälö.
- Langmuirin yhtälö.
Toinen kerros on totta: 
I:nnelle kerrokselle: 
Yksinkertaisuuden vuoksi oletetaan, että a ja ν ovat samat kaikille kerroksille paitsi ensimmäiselle. Kaikissa kerroksissa paitsi ensimmäistä adsorptiolämpö on vakio. Viimeisen kerroksen adsorptiolämpö on yhtä suuri kuin kondensaatiolämpö. Tämän seurauksena yhtälö
 (*)
(*)
C- vakio,
BET-teorian tapauksessa vakio KANSSA luonnehtii puhtaan adsorption Gibbsin energiaa. Yhtälö sisältää vain yhden vakion, ja tämä yhtälö on myös erittäin tärkeä määritettäessä adsorbentin ominaispinta-ala.
Koska adsorption seurauksena vapautuu lämpöä, ominaispintojen määritys suoritetaan matalissa lämpötiloissa.
 ????????????
????????????


Teorian suurin virhe– Horisontaalisten vuorovaikutusten huomiotta jättäminen vertikaalisten vuorovaikutusten hyväksi.
Yhtälö on alueella  0,05 - 0,3.
0,05 - 0,3.
Missä  <
0,05 – существенное влияние оказывает
неоднородность поверхности.
<
0,05 – существенное влияние оказывает
неоднородность поверхности.
 > 0,3 - adsorbaatin vuorovaikutus - adsorbaatti vaikuttaa.
> 0,3 - adsorbaatin vuorovaikutus - adsorbaatti vaikuttaa.
Adsorbaatti-adsorbaatti-vuorovaikutusten huomioon ottaminen.
Vuorovaikutuksia ilmenee adsorption aikana haarautuneiden molekyylien tai molekyylien ei-polaariselle pinnalle. pystyy muodostamaan yhdistyksiä. Tässä tapauksessa adsorptioisotermien muoto muuttuu.
A  sorbentti ei ole polaarinen.
sorbentti ei ole polaarinen.
Kaavio 1 vastaa heikkoja vuorovaikutuksia adsorbaatti-adsorbaatti, vahva adsorbaatti-adsorbentti.
Kaavio 2 vastaa voimakasta adsorbaatti-adsorbaatti-vuorovaikutusta, voimakasta adsorbaatti-adsorbaatti-vuorovaikutusta.
Kaavio 3 vastaa voimakasta adsorbaatti-adsorbaatti-vuorovaikutusta, heikkoa adsorbaatti-adsorbaatti-vuorovaikutusta.
 ,
,

Adsorbaattimolekyylien välisessä vuorovaikutuksessa on tarpeen ottaa huomioon muutokset aktiivisuuskertoimissa. Ja tämä yhtälö kirjoitetaan seuraavasti:
 - Frunkinin, Fowlerin, Guggenheimin yhtälö.
- Frunkinin, Fowlerin, Guggenheimin yhtälö.
k on vetovoiman vakio.
Polanin potentiaaliteoria.
Tämä teoria ei johda minkäänlaista adsorptioisotermiä, mutta mahdollistaa isotermien laskemisen eri lämpötilassa.
Adsorptio on seurausta adsorboivan aineen vetovoimasta adsorptioaineen pintaan adsorptiopotentiaalin vaikutuksesta, joka ei riipu muiden molekyylien läsnäolosta ja riippuu pinnan ja adsorbaattimolekyylin välisestä etäisyydestä.
 ,
,
 - adsorptiopotentiaali.
- adsorptiopotentiaali.
Koska pinta on epähomogeeninen, etäisyys korvataan adsorptiotilavuudella  .adsorptiotilavuus on pinnan ja annettua arvoa vastaavan pisteen välissä oleva tilavuus
.adsorptiotilavuus on pinnan ja annettua arvoa vastaavan pisteen välissä oleva tilavuus  .
.
Adsorptiopotentiaali on työ, jossa siirretään 1 mooli adsorbaattia annetun adsorptiotilavuuden ulkopuolella tiettyyn adsorptiotilavuuden pisteeseen (tai työ siirretään 1 mooli adsorbaatin kylläistä höyryä, joka on tasapainossa nestemäisen adsorbaatin kanssa ilman adsorbentti höyryfaasiin tasapainossa adsorbentin kanssa).

Ominainen käyrä
 - adsorptiopotentiaali,
- adsorptiopotentiaali, 
Tietyn adsorbentin ja eri adsorbaattien osalta seuraava pätee: 
Erityyppisille adsorbaateille  ,
,
Missä  adsorptioisotermien potentiaali suhteellisissa paineissa
adsorptioisotermien potentiaali suhteellisissa paineissa  adsorbaatille 1 ja adsorbaatille 2. Tämä suhde on vakioarvo.
adsorbaatille 1 ja adsorbaatille 2. Tämä suhde on vakioarvo.
 - affiniteettikerroin
- affiniteettikerroin
Kapillaarikondensaatioteoria.
Adsorptioprosessin kulku riippuu suurelta osin huokoisen kappaleen rakenteesta.
|
mikrohuokoinen | |
|
Siirtymävaiheen huokoinen | |
|
Makrohuokoinen |
Mikrohuokoisten sorbenttien tapauksessa adsorptiovoimien kentät menevät päällekkäin. Makrohuokoisten sorbenttien tapauksessa huokoset toimivat kuljetuskanavina. Kondensaatioprosessit ovat merkittävimpiä ohimenevissä huokoisissa kappaleissa. Kapillaarikondensaatio alkaa tietyistä arvoista s Ja  kun osa pintaenergiasta on jo kompensoitu. Edellytyksenä on, että pinnan on oltava itsekantava. Prosessi kuvataan Thompson-Kelvin yhtälö.
kun osa pintaenergiasta on jo kompensoitu. Edellytyksenä on, että pinnan on oltava itsekantava. Prosessi kuvataan Thompson-Kelvin yhtälö.

 - kostutustapauksessa kaarevuuskeskus on kaasufaasissa.
- kostutustapauksessa kaarevuuskeskus on kaasufaasissa.
Kapillaarikondensaatiossa adsorptioisotermillä on hystereesimuoto. Alempi haara vastaa adsorptioprosessia ja ylempi haara vastaa desorptioprosessia.
Kaiken tyyppiset huokoset voidaan vähentää kolmeen tyyppiin:
|
kartiomainen |
Sylinterimäinen, yksi suljettu pää |
Sylinterimäinen, jossa kaksi avointa päätä |
|
Prosessitäyttö suoritetaan huokosen pohjalta. Adsorptioisotermi ja desorptioisotermi ovat tässä tapauksessa samat, koska adsorptioprosessi alkaa pallosta ja desorptioprosessi alkaa myös joidenkin pallojen katoamisesta.
↓ |
Hystereesiä ei ole. Eteenpäin ja taaksepäin isku kuvataan yhtälöllä:
|
Pohjaa ei ole missään, huokosen täyttö kulkee sylinterin seiniä pitkin.
sylinteri: Isotermi ja sillä on hystereesimuoto.
↓ |
SISÄÄN  kostutusolosuhteissa kondensaatiota tapahtuu alemmilla paineilla, mikä on energeettisesti suotuisaa. Desorptiohaarasta saadaan huokoskoon jakautumiskäyrät.
kostutusolosuhteissa kondensaatiota tapahtuu alemmilla paineilla, mikä on energeettisesti suotuisaa. Desorptiohaarasta saadaan huokoskoon jakautumiskäyrät.
Differentiaalikäyrän maksimi siirtyy vasemmalle suhteessa integraalin käännepisteeseen. Pienten huokosten kokonaistilavuus on pieni, mutta pinta-ala on suuri. Kun huokosten koko kasvaa, niiden tilavuus kasvaa  , ja alue as
, ja alue as  , tästä johtuen havaitaan differentiaalikäyrän maksimin siirtymä.
, tästä johtuen havaitaan differentiaalikäyrän maksimin siirtymä.
Adsorptio kiinteän nesteen rajapinnassa.
Kiinteän kaasun rajapinnassa tapahtuvan adsorption tapauksessa jätimme huomioimatta yhden komponentin. Jos kyseessä on adsorptio kiinteän ja nesteen rajapinnalla, adsorbaatti syrjäyttää liuotinmolekyylit adsorbentin pinnalta.
 ,
,
Oikea yhtälö on:

 ,
,
N 1, N 2 - liuottimen ja komponentin mooliosuudet, N 1 + N 2 \u003d 1, sitten
 ,
=>
,
=>
 , sitten - adsorptioyhtälö faasirajalle kiinteä aine - neste.
, sitten - adsorptioyhtälö faasirajalle kiinteä aine - neste.
Adsorptio (G) > 0 at  <
0
<
0
Jos arvot  komponentti ja liuotin ovat hyvin erilaisia, tässä tapauksessa riippuvuus G alkaen N arvossa on ääriarvo N
~ 0,5.
komponentti ja liuotin ovat hyvin erilaisia, tässä tapauksessa riippuvuus G alkaen N arvossa on ääriarvo N
~ 0,5.
E  jos
jos  on samat arvot, tässä tapauksessa adsorption merkki voi muuttua. Riippuvuus G alkaen N ylittää x-akselin
on samat arvot, tässä tapauksessa adsorption merkki voi muuttua. Riippuvuus G alkaen N ylittää x-akselin
Toiminto Risteys G(N) abskissa-akselilla kutsutaan adsorptioatseotrooppi. Tämä tarkoittaa, että kahta komponenttia ei voida erottaa tässä adsorptioaineessa.
Adsorptioisotermiyhtälö vaihtovakiolla.
Adsorption aikana kiinteän nesteen rajapinnassa komponentit jakautuvat jatkuvasti uudelleen adsorbentin pinnan ja liuoksen tilavuuden välillä.
 - komponentit (- - viittaa pintaan)
- komponentit (- - viittaa pintaan)

 ,
,
 ,
, .
.
 ,
,


Adsorptio neste-kaasu rajapinnassa
R  Tarkastellaan pitoisuusprofiilin muutosta nesteen ja kaasun rajapinnan ylittäessä. Olkoon komponentti 2 haihtuva.
Tarkastellaan pitoisuusprofiilin muutosta nesteen ja kaasun rajapinnan ylittäessä. Olkoon komponentti 2 haihtuva.
Cs on pintakerroksen pitoisuus.
Perustuu ylimääräisen adsorption määritelmään

Jos komponentti ei ole haihtuva, adsorptioarvo kirjoitetaan seuraavasti:
P  ri
ri 

Yhtälössä  aineen luonne kuvataan derivaatalla
aineen luonne kuvataan derivaatalla  .
.
Pintajännitysisotermi voi olla muotoa 1 tai 2:
1 - pinta-aktiiviset aineet
2 - pinta-aktiiviset aineet
Pinta-aktiivisuus g on aineiden kyky alentaa järjestelmän pintajännitystä.

 - pintakerroksen paksuus
- pintakerroksen paksuus
C s on komponentin pitoisuus pintakerroksessa
KANSSA– tilavuuspitoisuus
Homologiselle sarjalle on sääntö:
 - Traubeau Duclosin sääntö
- Traubeau Duclosin sääntö
Homologisissa sarjoissa adsorptioisotermi näyttää tältä:
Kirjoitamme D:n A:n sijaan, koska pintakerroksessa adsorptio on liiallista.
Pintajännityksen isotermi:

 on puhtaan liuottimen pintajännitys.
on puhtaan liuottimen pintajännitys.
 - perusadsorptioyhtälö;
- perusadsorptioyhtälö;
 - Langmuirin yhtälö.
- Langmuirin yhtälö.
Ratkaistaan ne yhdessä:

- Shishkovskyn yhtälö.
B on homologisen sarjan vakio.
A- kun siirrytään homologista toiseen, se kasvaa 3-3,5 kertaa 
![]()
1 - alhaisten pitoisuuksien alue
![]()
2 - keskimääräinen pitoisuus
3 - yksimolekyylinen kerros
Pinta-aktiiviset aineet ovat amfifiilisiä molekyylejä, ts. Käsitteet sisältävät polaarisen ryhmän ja ei-polaarisen hiilivetyradikaalin.
o on molekyylin polaarinen osa.
| on molekyylin ei-polaarinen osa.
Polaarisessa liuottimessa pinta-aktiivisen aineen molekyylit on suunnattu siten, että molekyylin polaarinen osa on liuotinta päin, kun taas ei-polaarinen osa työnnetään kaasufaasiin.
Shishkovsky-yhtälössä  , se on vakio homologiselle sarjalle.
, se on vakio homologiselle sarjalle.
Pinta-aktiivista toimintaa alkaa näkyä n>5. Konsentraatioissa, jotka ovat suurempia kuin monomolekyylikerroksen pitoisuus, pinta-aktiivisten aineiden liuoksissa tapahtuu misellisaatiota.
Miselli- kutsutaan amfifiilisten pinta-aktiivisten aineiden molekyylien aggregaattia, jonka hiilivetyradikaalit muodostavat ytimen ja polaariset ryhmät muuttuvat vesifaasiksi.
Misellimassa - misellimassa.
H  molekyylien lukumäärä on aggregaatioiden lukumäärä.
molekyylien lukumäärä on aggregaatioiden lukumäärä.
Pallomaiset misellit
Misellisaation tapauksessa liuokseen saadaan aikaan tasapaino
CMC on kriittinen misellipitoisuus.
Koska pidämme miselliä erillisenä vaiheena:
Homologiselle sarjalle on olemassa empiirinen yhtälö:
a on funktionaalisen ryhmän liukenemisenergia.
b on adsorptiopotentiaalin lisäys, adsorption työ metyleeniyksikköä kohti.
on adsorptiopotentiaalin lisäys, adsorption työ metyleeniyksikköä kohti.
Hiilivetyytimen läsnäolo miselleissä mahdollistaa veteen liukenemattomien yhdisteiden liukenemisen pinta-aktiivisten aineiden vesiliuoksiin, tätä ilmiötä kutsutaan solubilisaatioksi (mikä liukenee on solubilisaatti, pinta-aktiivinen aine on liuotusaine).
Muta voi olla täysin ei-polaarinen, se voi sisältää sekä polaarisia että ei-polaarisia osia, ja se on suunnattu kuten pinta-aktiivinen molekyyli.
Joka tapauksessa liukenemisen aikana misellimassan ja aggregaatiomäärän kasvua ei tapahdu pelkästään solubilisaatin sisällyttämisen vuoksi, vaan myös tasapainotilan ylläpitämiseen tarvittavien pinta-aktiivisten aineiden molekyylien lukumäärän lisääntymisen vuoksi.
Liuottaminen on sitä tehokkaampaa, mitä pienempi on solubilisaatin molekyylipaino.

 ~ 72 mN/m.
~ 72 mN/m.
 ~ 33 mN/m.
~ 33 mN/m.
Pinta-aktiivisten aineiden tehokkuus riippuu CMC:n suuruudesta.
2D pintakerroksen paine

→ -pintajännitysvoimat.
- kaksiulotteinen paine.
Pintakerros on voima, joka on yhtä suuri kuin pinta-aktiivisen aineen ja puhtaan liuottimen pintajännitysten välinen ero, joka on suunnattu puhtaaseen pintaan.
Liuoksen ja pintakerroksen välille muodostuu tasapaino



klo  on alue, jossa
on alue, jossa  lineaarisesti pitoisuudesta riippuvainen.
lineaarisesti pitoisuudesta riippuvainen.
G [mol/m2].
 pinta-ala, jonka yksi mooli ainetta vie
pinta-ala, jonka yksi mooli ainetta vie
Silloin kaksiulotteisella paineisotermillä on muoto 
 on kaksiulotteinen paineisotermi.
on kaksiulotteinen paineisotermi.
Riippuvuus  S M:ltä:
S M:ltä:

klo  - kaksiulotteinen paine kasvaa jyrkästi. klo
- kaksiulotteinen paine kasvaa jyrkästi. klo  kaksiulotteinen on epämuodostunut, mikä aiheuttaa voimakkaan kasvun
kaksiulotteinen on epämuodostunut, mikä aiheuttaa voimakkaan kasvun  .
.
Molemmilta puolilta samojen vaiheiden rajoittamaa kalvoa kutsutaan kaksipuoliseksi. Tällaisissa elokuvissa havaitaan emäliuoksen jatkuvaa liikettä.
Alle 5 nm paksuja kalvoja kutsutaan mustiksi kalvoiksi.

Adsorptiokerroksilla tulisi olla kaksi ominaisuutta: viskositeetti ja helppo liikkuvuus, juoksevuus ja elastisuus.
Marangoni-vaikutus parantaa itseään.
Gibbsin kolmio,  - ylipaine.
- ylipaine.
Kalvo venyy ja koska osa nesteestä on poissa, pinta-aktiiviset aineet ryntäävät vapaaseen tilaan. Gibbsin kolmio.
Kappaleiden adsorptiovoiman vaikutus.
Kalvon pinnalla on aina adsorptiokerros, jolle sitten
Langmuirin yhtälö:


 kaksiulotteiseen paineeseen
kaksiulotteiseen paineeseen
 - Shishkovsky-yhtälön analogi
- Shishkovsky-yhtälön analogi
elektrokineettiset ilmiöt. Kaksinkertainen sähköinen kerros (DES).
Helemholtzin malli. Gouy-Chapmanin teoria.
1808 lento

U – muotoiltu putki, upotettu siihen 2 elektrodia. Kommunikaatiosuonten lakia rikotaan ja putken nestetaso muuttuu - sähkökineettisiä ilmiöitä.
Kineettiset ilmiöt:
elektroforeesi
Elektroosmoosi
Virtaus (virtaus)potentiaali
Sedimentaatiopotentiaali
1 ja 2 syntyvät, kun potentiaalieroa sovelletaan, 3 ja 4 kolloidisten hiukkasten lävistys ja sedimentaatio aiheuttavat potentiaalieron ilmaantumisen.
Elektroosmoosi on dispersioväliaineen liike suhteessa paikallaan olevaan dispergoituun faasiin sähkövirran vaikutuksesta.
elektroforeesi on dispergoidun faasin hiukkasten liike suhteessa kiinteään dispersioväliaineeseen sähkövirran vaikutuksesta.
P  Syynä sähkökineettisten ilmiöiden esiintymiseen on varausten avaruudellinen erottuminen ja kaksinkertaisen sähkökerroksen ilmaantuminen.
Syynä sähkökineettisten ilmiöiden esiintymiseen on varausten avaruudellinen erottuminen ja kaksinkertaisen sähkökerroksen ilmaantuminen.
Sähköinen kaksoiskerros on litteä kondensaattori, yksi levy on muodostettu potentiaalin määräävistä ioneista, toinen vastainoista. Ionit ovat myös kontaminoituneita, kun potentiaalin määrääviä ko-ioneja työnnetään liuoksen pääosaan. Levyjen välinen etäisyys  . Potentiaali laskee lineaarisesti, potentiaaliero
. Potentiaali laskee lineaarisesti, potentiaaliero  .
.
Ulkoinen potentiaaliero aiheuttaa leikkausmoduulin ilmaantumisen  on voimapari pinta-alayksikköä kohti, jotka vaikuttavat kiinteän kappaleen pintaa pitkin.
on voimapari pinta-alayksikköä kohti, jotka vaikuttavat kiinteän kappaleen pintaa pitkin.

Tasapainotilassa leikkausmoduuli on yhtä suuri kuin viskoosi kitkakerroin (  ).
).

Omissa olosuhteissamme  ,
,

 - Helemholtz-Smalukovskin yhtälö
- Helemholtz-Smalukovskin yhtälö
 - lineaarisen nopeuden siirtymä i vaiheet.
- lineaarisen nopeuden siirtymä i vaiheet.
E on sähkökentän voimakkuus.
 - potentiaaliero levyjen välillä
- potentiaaliero levyjen välillä
 - elektroforeettinen liikkuvuus [m 2 /(V * s)].
- elektroforeettinen liikkuvuus [m 2 /(V * s)].
Helemholtzin malli ei ota huomioon molekyylien lämpöliikettä. Todellisuudessa ionien jakautuminen kaksoiskerroksessa on monimutkaisempi.
Gouy ja Chapman tunnistivat seuraavat DES:n syyt:
Ionin siirtyminen faasista toiseen, kun tasapaino on saavutettu.
Kiinteän faasin ionisaatio.
Pinnan täydentäminen dispersioväliaineessa olevilla ioneilla.
Polarisaatio ulkoisesta virtalähteestä.
Sähköisellä kaksoiskerroksella on epäselvä tai hajanainen rakenne. Ionit ovat yleensä jakautuneet tasaisesti koko diffuusikerroksessa.
Diffuusi kerros koostuu vastainioneista, kerroksen pituus määräytyy niiden kineettisen energian mukaan. Absoluuttiseen nollaan pyrkivässä lämpötilassa vastainoot ovat mahdollisimman lähellä potentiaalin määrääviä ioneja.
Tämä teoria perustuu kahteen yhtälöön:
Boltzmannin yhtälö

 - toimii sähköstaattisen vuorovaikutuksen voimia vastaan.
- toimii sähköstaattisen vuorovaikutuksen voimia vastaan.
 on bulkkivaraustiheys.
on bulkkivaraustiheys.

Poissonin yhtälö 
Koska DEL-paksuus on paljon pienempi kuin hiukkaskoko, ja tasaiselle DEL:lle, derivaatta suhteessa koordinaatteihin  Ja
Ja  on kumottu.
on kumottu. 
e y:lle y:n kanssa<<1 функцию можно разложить в ряд Маклорена:

Rajoitamme itsemme kahteen sarjan jäseneen, sitten:


 - DEL-paksuus on etäisyys, jolla DEL-potentiaali pienenee e kerran.
- DEL-paksuus on etäisyys, jolla DEL-potentiaali pienenee e kerran.
Mitä matalampi lämpötila, sitä vähemmän  . Kohdassa Т→0 – tasainen DES. Mitä suurempi pitoisuus, sitä enemmän minä, sitä vähemmän
. Kohdassa Т→0 – tasainen DES. Mitä suurempi pitoisuus, sitä enemmän minä, sitä vähemmän  .
.





 “–” tarkoittaa, että potentiaali pienenee etäisyyden myötä. =>
“–” tarkoittaa, että potentiaali pienenee etäisyyden myötä. =>
=>

 ,
,
 - potentiaali pienenee eksponentiaalisesti.
- potentiaali pienenee eksponentiaalisesti.
Pintavaraustiheyden potentiaali: 
Pintavaraus on avaruusvaraus, jolla on päinvastainen etumerkki, integroitu etäisyyden yli.




=>


Kun potentiaali pienenee 2,7 kertaa - 
Kaksikerroksinen kapasiteetti 
Teorian haittana on, että Helemholtz-kerroksen läsnäoloa ei oteta huomioon, ts. ei ota huomioon  , tästä syystä pääparametrien määrittämisessä tapahtuvat virheet. Se ei myöskään selitä erilaisten ionien vaikutusta sähköisen kaksoiskerroksen paksuuteen.
, tästä syystä pääparametrien määrittämisessä tapahtuvat virheet. Se ei myöskään selitä erilaisten ionien vaikutusta sähköisen kaksoiskerroksen paksuuteen.
Sternin teoria. Kolloidisen misellin rakenne.
Sähköinen kaksoiskerros koostuu kahdesta osasta: tiheä ja diffuusi. Tiheä kerros muodostuu potentiaalia muodostavien ionien vuorovaikutuksen seurauksena spesifisesti adsorboituneiden ionien kanssa. Nämä ionit ovat pääsääntöisesti osittain tai kokonaan dehydratoituneita ja niillä voi olla joko sama tai päinvastainen varaus kuin potentiaalin määräävillä ioneilla. Se riippuu sähköstaattisen vuorovaikutuksen energiasuhteesta  ja spesifinen adsorptiopotentiaali
ja spesifinen adsorptiopotentiaali  . Tiheän kerroksen ionit ovat kiinteät. Toinen osa ioneista sijaitsee diffuusikerroksessa, nämä ionit ovat vapaita ja voivat siirtyä syvälle liuokseen, ts. korkeamman pitoisuuden alueelta alhaisemman pitoisuuden alueelle. Varauksen kokonaistiheys koostuu kahdesta osasta.
. Tiheän kerroksen ionit ovat kiinteät. Toinen osa ioneista sijaitsee diffuusikerroksessa, nämä ionit ovat vapaita ja voivat siirtyä syvälle liuokseen, ts. korkeamman pitoisuuden alueelta alhaisemman pitoisuuden alueelle. Varauksen kokonaistiheys koostuu kahdesta osasta.

 - Helmholtzin kerrosvaraus
- Helmholtzin kerrosvaraus
 -Diffuusi kerrosvaraus
-Diffuusi kerrosvaraus
Pinnalla on tietty määrä adsorptiokeskuksia, joista jokainen on vuorovaikutuksessa yhden vastaionin kanssa. Tällaisen kvasikemiallisen reaktion vakio on:

 , Missä
, Missä  - vastaionien mooliosuus liuoksessa
- vastaionien mooliosuus liuoksessa
Helmholtzin jakelu
Potentiaali pienenee lineaarisesti
Gouyn potentiaalin jakautuminen. Tiheää kerrosta ei ole, potentiaali pienenee eksponentiaalisesti arvosta 
Stern jakelu.
Aluksi potentiaalin pieneneminen on lineaarinen ja sitten eksponentiaalinen.
Kun sähkökenttää käytetään elektroforeesissa, kiinteän faasin hiukkanen ei liiku suoraan, vaan kiinteän faasin hiukkanen, jossa on ympäröivä ionikerros. DES toistaa dispergoidun faasin hiukkasen muodon. Kun potentiaalia käytetään, osa diffuusikerroksesta repeytyy irti. Katkoviivaa kutsutaan liukuva raja.
Potentiaalia, joka syntyy liukastumisrajalla diffuusikerroksen osan irtoamisen seurauksena, kutsutaan ns. elektrokineettinen potentiaali(Zetan potentiaali  ).
).
Dispergoituneen faasin hiukkasta, jonka ympärillä on vastaionikerros ja kaksinkertainen sähköinen kerros, kutsutaan miselli.
Säännöt kolloidisten misellien kirjoittamiseen:


1-1 latauselektrolyyttiä
T on dispergoidun faasin hiukkanen.
AA on raja tiheän ja hajanaisen osan välillä.
BB on liukastumisraja.
Luistoraja voi olla tai ei ole sama kuin linja AA.
pH-arvoa, jossa zeta-potentiaali on nolla, kutsutaan isoelektrinen piste.
CaCl 2 + Na 2 SO 4 → CaSO 4 ↓ + 2NaCl
1. Yli CaCl 2
CaCl 2 ↔ Ca 2+ + 2Cl -
(CaSO 4 m∙nCa 2+ 2( n-x)Cl - ) 2 x + x Cl - - ennätys misellejä.
CaSO 4 m - kiviaines.
CaSO 4 m∙nCa 2+ on ydin.
CaSO 4 m∙nCa 2+ 2( n-x)Cl - hiukkanen.
2. Yli Na 2 SO 4
Na 2SO 4 ↔2Na + + SO 4 2-
(CaSO 4 m∙nSO 4 2- 2(n-x)Na + ) 2x- 2xNa + -miselli
CaSO 4 m - kiviaines.
CaSO 4 m∙nSO 4 2 + on ydin.
CaSO 4 m∙nSO 4 2- 2(n-x)Na + - hiukkanen
Helemholtz-Smoluchowskin yhtälö

 - rajojen lineaarinen siirtymänopeus (elektrosmoosissa).
- rajojen lineaarinen siirtymänopeus (elektrosmoosissa).
 - potentiaaliero kondensaattorilevyissä (sähköosmoosissa).
- potentiaaliero kondensaattorilevyissä (sähköosmoosissa).


 - liuoksen tilavuusvirtausnopeus, S- neliö poikkileikkaus soluja.
- liuoksen tilavuusvirtausnopeus, S- neliö poikkileikkaus soluja.

E on sähkökentän voimakkuus.


 (sähköosmoosiin).
(sähköosmoosiin).
Virtauspotentiaalille:

 -potentiaalia
-potentiaalia
 - kalvopaine
- kalvopaine
Pääsääntöisesti elektroforeettisten ja sähköosmoottisten liikkuvuuksien arvo on pienempi kuin lasketut. Tämä johtuu siitä, että:
Rentouttava vaikutus (hajotetun faasin hiukkasen liikkeen aikana ionisen ilmakehän symmetria rikkoutuu).
Elektroforeettinen jarrutus (lisäkitkan esiintyminen vastaionien liikkeen seurauksena).
Virtauslinjojen vääristyminen sähköä johtavien hiukkasten tapauksessa.
Pintajännityksen ja potentiaalin välinen suhde. Lippmannin yhtälö.
DEL:n muodostuminen tapahtuu spontaanisti johtuen järjestelmän halusta vähentää pintaenergiaansa. Vakiuden kontekstissa T Ja s termodynamiikan ensimmäisen ja toisen lain yleinen yhtälö näyttää tältä:
 (2)
(2)
(3), (1)=(3) =>
=>

 - 1. Lippmann-yhtälö.
- 1. Lippmann-yhtälö.
 on pintavarauksen tiheys.
on pintavarauksen tiheys.
 - differentiaalinen kapasitanssi.
- differentiaalinen kapasitanssi.
 - 2. Lippmann-yhtälö.
- 2. Lippmann-yhtälö.
KANSSA-kapasiteetti.
Ratkaisemme 1. Lippmann-yhtälön ja perusadsorptioyhtälön:
 ,
,


 , Sitten
, Sitten
 - Nernstin yhtälö
- Nernstin yhtälö
 ,
,
 ,
,




 - sähkökapillaarikäyrän (ECC) yhtälö.
- sähkökapillaarikäyrän (ECC) yhtälö.
SISÄÄN  :
: , Mutta
, Mutta 
Kationiset pinta-aktiiviset aineet (CSAS) vähentävät ECC:n katodista haaraa.
Anioniset pinta-aktiiviset aineet (ASS) vähentävät ECC:n anodista haaraa.
Ionittomat pinta-aktiiviset aineet (NSA) vähentävät ECC:n keskiosaa.
Hajautettujen järjestelmien vakaus. Kiilapaine.
Hajautetut järjestelmät voidaan jakaa:
Termodynaamisesti epästabiilit järjestelmät voivat olla kineettisesti stabiileja johtuen siirtymisestä metastabiiliin tilaan.
Vakautta on kahta tyyppiä:
Sedimentaatiostabiilisuus (suhteessa painovoimaan).
Aggregatiivinen vakaus. (liittymiseen liittyen)
Koagulaatio on prosessi, jossa hiukkaset tarttuvat yhteen, mikä johtaa aggregatiivisen stabiilisuuden menettämiseen. Koagulaatio voi johtua lämpötilan, pH:n, sekoituksen, ultraäänen muutoksista.
Erota koagulaatio:
Käännettävä.
Peruuttamaton.
Koagulaatio etenee elektrolyyttien lisäämisellä.
Koagulaatiosäännöt:

Elokuva- Tämä on järjestelmän osa, joka sijaitsee kahden rajapinnan välissä.
irtoavaa painetta tapahtuu, kun kalvon paksuus pienenee jyrkästi lähestyvien pintakerrosten vuorovaikutuksen seurauksena.

«-» - kun kalvon paksuus pienenee, irtoamispaine kasvaa.
P 0 on paine bulkkivaiheessa, joka on välikerroksen jatkoa.
P 1 on kalvon paine.
Vakauden teoria. DLFO (Deryagin, Landau, Fairway, Overbeck).
DLVO-teorian mukaan erotuspaineessa erotetaan kaksi komponenttia:
sähköstaattinen P E (positiivinen, se johtuu sähköstaattisen hylkimisen voimista). Vastaa Gibbsin energian vähenemistä kalvon paksuuden kasvaessa.
Molekyyli PM (negatiivinen, houkuttelevien voimien vaikutuksesta). Se johtuu kalvon puristumisesta kemiallisten pintavoimien vaikutuksesta, voimien vaikutussäde on nm:n kymmenesosat energialla luokkaa 400 kJ/mol.
Kokonaisvuorovaikutusenergia:

 - järjestelmä on aggregaatin vakaa
- järjestelmä on aggregaatin vakaa
 - epävakaa järjestelmä
- epävakaa järjestelmä
P  positiivinen komponentti.
positiivinen komponentti.
Kasvu johtuu potentiaalienergian lisääntymisestä ohuiden kalvojen puristamisen aikana. Paksuilla kalvoilla ylimääräinen ionienergia kompensoituu ja on yhtä suuri kuin energiavuorovaikutus suurimmassa osassa dispersioväliainetta.
Jos  (
( -kalvon paksuus,
-kalvon paksuus,  - ionin säde) kalvon oheneminen johtaa siihen, että siinä olevat molekyylit ja ionit katoavat ja vähenevät mahdollisimman pienellä pintaenergialla. Naapurihiukkasten määrä vähenee, minkä seurauksena kalvoon jäävien hiukkasten potentiaalienergia kasvaa.
- ionin säde) kalvon oheneminen johtaa siihen, että siinä olevat molekyylit ja ionit katoavat ja vähenevät mahdollisimman pienellä pintaenergialla. Naapurihiukkasten määrä vähenee, minkä seurauksena kalvoon jäävien hiukkasten potentiaalienergia kasvaa.


DLVO-teoria pitää hiukkasten vuorovaikutusta levyjen vuorovaikutuksena.

Hiukkaset eivät ole vuorovaikutuksessa



 - Laplacen yhtälö,
- Laplacen yhtälö,  ,
,


Heikosti varautuneille pinnoille
Erittäin varautuneille pinnoille:

Molekyylikomponentti on kahden atomin vuorovaikutus:
 ~
~
Atomin vuorovaikutus pinnan kanssa:

Otetaan kaksi ennätystä:
D  Molekyylikomponentin saamiseksi on tarpeen laskea yhteen kaikki oikean ja vasemman levyn atomien vuorovaikutusenergiat.
Molekyylikomponentin saamiseksi on tarpeen laskea yhteen kaikki oikean ja vasemman levyn atomien vuorovaikutusenergiat.
Missä  - Hamakerin vakio (ottaa huomioon vuorovaikutuksessa olevien kappaleiden luonteen).
- Hamakerin vakio (ottaa huomioon vuorovaikutuksessa olevien kappaleiden luonteen).
Että. systeemin hiukkasten vuorovaikutusenergia voidaan ilmaista potentiaalikäyrien avulla.
I on ensisijainen potentiaalinen minimi. Tämä on peruuttamattoman hyytymisen vyöhyke, vetovoimat vallitsevat.
II - aggregatiivisen vakauden vyöhyke, hylkivät voimat vallitsevat.
III - sekundaaripotentiaalin minimi (tai flokkulaatiovyöhyke). Dispergoituneen faasin hiukkasten välissä on elektrolyyttikerros, ja hiukkaset voidaan erottaa ja siirtää aggregatiivisen stabiilisuuden vyöhykkeelle.

Käyrä 1 – järjestelmä on aggregatiivisesti vakaa.
Käyrä 2 on vakaa vyöhykkeellä I, ei stabiili vyöhykkeellä II.
Käyrä 3 - järjestelmässä tapahtui koagulaatio.
Käyrä 4 - pisteessä 4 vuorovaikutuksen kokonaisenergia U=0,  Tämä ääripiste vastaa nopean koagulaation alkamista.
Tämä ääripiste vastaa nopean koagulaation alkamista.
Tapauksia on kaksi:
1. Pinnat ovat heikosti varautuneet:
U \u003d U E + U M \u003d 0
 (1)
(1)
2)

 (2)
(2)



 - tämä on koagulaatioprosessin alkua vastaavan kerroksen paksuus.
- tämä on koagulaatioprosessin alkua vastaavan kerroksen paksuus.






 - heikosti varautuneille pinnoille
- heikosti varautuneille pinnoille
 Sitten
Sitten 
2. Erittäin varautuneille pinnoille:
 (1)
(1)
2)

 (2)
(2)


 (3)
(3)
 ,
,
Nelitetään (3)

Koagulaatio:
Spesifisessä adsorptiossa ioneja voidaan adsorboida superekvivalenttina määränä siten, että pinta voi muuttaa varaustaan. Pinta latautuu.
Spesifisen adsorption tapauksessa ei vain vastakkaisten merkkien ioneja, vaan myös yhden ionin ioneja voidaan adsorboida.
Jos pinnan kanssa samanmerkkisiä ioneja adsorboituu, pintakerroksessa ei tapahdu potentiaalin laskua, vaan sen kasvua.

Neutralisoiva koagulaatio (tapahtuu heikosti varautuneiden hiukkasten osallistuessa ja ei riipu vain koaguloivan elektrolyytin varauksesta, vaan myös potentiaalista tiheiden ja diffuusien kerrosten rajalla).
Smoluchowskin nopean koagulaation teoria.

Koagulaationopeuden riippuvuus elektrolyyttipitoisuudesta.
I – hyytymisnopeus on alhainen,
II - hyytymisnopeus on käytännössä verrannollinen elektrolyyttipitoisuuteen.
III - nopean hyytymisen alue, nopeus on käytännössä riippumaton keskittymisestä.
Avainkohdat:
Alkuperäinen sooli on monodispersinen, samankaltaisilla hiukkasilla on pallomainen muoto.
Kaikki hiukkasten törmäykset ovat tehokkaita.
Kun kaksi primäärihiukkasta törmäävät, muodostuu toissijainen hiukkanen. Toissijainen + ensisijainen = tertiäärinen. Ensisijainen, toissijainen, tertiäärinen - monikertaisuus.
Kemiallisen kinetiikan kannalta koagulaatioprosessia voidaan kuvata yhtälöllä:
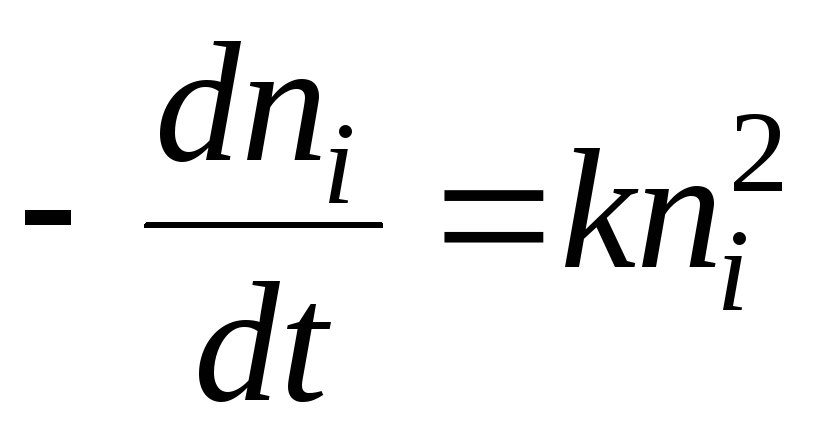
Ratkaisu on yhtälö: 
 - puolihyytymisaika. Tämä on aika, jonka aikana soolihiukkasten määrä vähenee 2 kertaa.
- puolihyytymisaika. Tämä on aika, jonka aikana soolihiukkasten määrä vähenee 2 kertaa.

 ,
,
 ,
,
 ,
,


Kun monikertaisuus kasvaa, hyytymiskäyrien maksimi siirtyy kohti suurempia arvoja  .
.
Virheet:
Oletus monodisperssyydestä.
Oletus kaikkien törmäysten tehokkuudesta.




 - pallo,
- pallo, ,
,





