ಹೊರಹೀರುವಿಕೆಯ ಸಮಯದಲ್ಲಿ ಥರ್ಮೋಡೈನಾಮಿಕ್ ಕಾರ್ಯಗಳಲ್ಲಿನ ಬದಲಾವಣೆಗಳು. ಹೊರಹೀರುವಿಕೆ ಪ್ರಕ್ರಿಯೆಗಳ ಥರ್ಮೋಡೈನಾಮಿಕ್ಸ್. ಹೊರಹೀರುವಿಕೆ ಪ್ರಕ್ರಿಯೆಗಳ ಯಂತ್ರಾಂಶ ವಿನ್ಯಾಸ
ಹೊರಹೀರುವಿಕೆ(ಲ್ಯಾಟಿನ್ ಜಾಹೀರಾತು - ಆನ್, ನಲ್ಲಿ ಮತ್ತು ಸೋರ್ಬಿಯೊ - ಹೀರಿಕೊಳ್ಳುವಿಕೆಯಿಂದ), ಹಂತದ ಇಂಟರ್ಫೇಸ್ ("ಮೇಲ್ಮೈಯಲ್ಲಿ ಹೀರಿಕೊಳ್ಳುವಿಕೆ") ಬಳಿ ಇರುವ ವಸ್ತುವಿನ ಸಾಂದ್ರತೆಯ ಬದಲಾವಣೆ (ಸಾಮಾನ್ಯವಾಗಿ ಹೆಚ್ಚಳ). ಕಾರಣ ಹೊರಹೀರುವಿಕೆ- ಮೇಲ್ಮೈ ಬಳಿ ಇಂಟರ್ಮೋಲಿಕ್ಯುಲರ್ ಬಂಧಗಳ ಅಪರ್ಯಾಪ್ತತೆ, ಅಂದರೆ. ಹೊರಹೀರುವಿಕೆಯ ಅಸ್ತಿತ್ವ ಬಲ ಕ್ಷೇತ್ರ. ಅಂತಹ ಕ್ಷೇತ್ರವನ್ನು ರಚಿಸುವ ದೇಹವನ್ನು ಆಡ್ಸರ್ಬೆಂಟ್ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ, ಅದರ ಅಣುಗಳನ್ನು ಹೀರಿಕೊಳ್ಳಬಹುದಾದ ವಸ್ತುವನ್ನು ಆಡ್ಸರ್ಬೆಂಟ್ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ ಮತ್ತು ಈಗಾಗಲೇ ಹೀರಿಕೊಳ್ಳಲ್ಪಟ್ಟ ವಸ್ತುವನ್ನು ಆಡ್ಸರ್ಬೇಟ್ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ರಿವರ್ಸ್ ಪ್ರಕ್ರಿಯೆ ಹೊರಹೀರುವಿಕೆ, ನಿರ್ಜಲೀಕರಣ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ.
ಹೊರಹೀರುವಿಕೆ ಕ್ಷೇತ್ರದ ಸ್ವರೂಪವು ವಿಭಿನ್ನವಾಗಿದೆ. ಹೊರಹೀರುವಿಕೆ ವ್ಯಾನ್ ಡೆರ್ ವಾಲ್ಸ್ ಬಂಧಗಳೊಂದಿಗೆ ಸಂಬಂಧ ಹೊಂದಿದ್ದರೆ, ಆಗ ಹೊರಹೀರುವಿಕೆಭೌತಿಕ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಇವು ವೇಲೆನ್ಸಿ ಬಾಂಡ್ಗಳಾಗಿದ್ದರೆ, ಅಂದರೆ. ಹೊರಹೀರುವಿಕೆಮೇಲ್ಮೈ ರಚನೆಯೊಂದಿಗೆ ಸಂಭವಿಸುತ್ತದೆ ರಾಸಾಯನಿಕ ಸಂಯುಕ್ತಗಳು, ಅದು ಹೊರಹೀರುವಿಕೆರಾಸಾಯನಿಕ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ, ಅಥವಾ ರಾಸಾಯನಿಕ ಹೀರಿಕೊಳ್ಳುವಿಕೆ. ಪ್ರಮುಖ ವೈಶಿಷ್ಟ್ಯಗಳು ರಾಸಾಯನಿಕ ಹೀರಿಕೊಳ್ಳುವಿಕೆಪ್ರದರ್ಶನಗಳು: ಬದಲಾಯಿಸಲಾಗದ, ಹೆಚ್ಚಿನ ಉಷ್ಣ ಪರಿಣಾಮಗಳು (ನೂರಾರು kJ/mol), ಸಕ್ರಿಯ ಪಾತ್ರ. ಹಲವಾರು ಮಧ್ಯಂತರ ವಿಧಗಳಿವೆ ಹೊರಹೀರುವಿಕೆಭೌತಿಕ ಮತ್ತು ರಾಸಾಯನಿಕಗಳ ನಡುವೆ ಹೊರಹೀರುವಿಕೆ. ಉದಾಹರಣೆಗೆ, ಹೊರಹೀರುವಿಕೆಹೈಡ್ರೋಜನ್ ಬಂಧಗಳ ರಚನೆಯಿಂದ ಉಂಟಾಗುತ್ತದೆ. ಸಹ ಸಾಧ್ಯ ವಿವಿಧ ರೀತಿಯಭೌತಿಕ ಹೊರಹೀರುವಿಕೆ. ಯಾವುದೇ ರಾಸಾಯನಿಕ ಪ್ರಕೃತಿಯ (ಅನಿರ್ದಿಷ್ಟವಲ್ಲದ) ಮೇಲ್ಮೈ ಹೊಂದಿರುವ ಆಡ್ಸರ್ಬೆಂಟ್ಗಳಿಗೆ ಅವು ಸರಿಸುಮಾರು ಸ್ಥಿರವಾಗಿರುತ್ತವೆ ಎಂಬ ಅಂಶದಿಂದಾಗಿ ಪ್ರಸರಣ ಇಂಟರ್ಮೋಲಿಕ್ಯುಲರ್ ಆಕರ್ಷಕ ಶಕ್ತಿಗಳ ಸಂಭವವು ಅತ್ಯಂತ ಸಾಮಾನ್ಯವಾದ ಘಟನೆಯಾಗಿದೆ. ಹೊರಹೀರುವಿಕೆ) ಭೌತಿಕ ಹೊರಹೀರುವಿಕೆಸ್ಥಾಯೀವಿದ್ಯುತ್ತಿನ ಶಕ್ತಿಗಳಿಂದ ಉಂಟಾಗಬಹುದು (ಅಯಾನುಗಳು, ದ್ವಿಧ್ರುವಿಗಳು ಅಥವಾ ಕ್ವಾಡ್ರುಪೋಲ್ಗಳ ನಡುವಿನ ಪರಸ್ಪರ ಕ್ರಿಯೆಗಳು); ಇದರಲ್ಲಿ ಹೊರಹೀರುವಿಕೆಆಡ್ಸರ್ಬೆಂಟ್ ಅಣುಗಳ ರಾಸಾಯನಿಕ ಸ್ವಭಾವದಿಂದ ನಿರ್ಧರಿಸಲಾಗುತ್ತದೆ (ನಿರ್ದಿಷ್ಟ ಎಂದು ಕರೆಯಲ್ಪಡುವ ಹೊರಹೀರುವಿಕೆ) ಇಂಟರ್ಫೇಸ್ನ ಜ್ಯಾಮಿತಿಯು ಸಹ ಒಂದು ಪ್ರಮುಖ ಪಾತ್ರವನ್ನು ವಹಿಸುತ್ತದೆ. ಮೇಲ್ಮೈ ಸಮತಟ್ಟಾಗಿದ್ದರೆ, ಅದು ಹೊರಹೀರುವಿಕೆತೆರೆದ ಮೇಲ್ಮೈ, ಸ್ವಲ್ಪ ಅಥವಾ ಬಲವಾಗಿ ಬಾಗಿದ ಮೇಲ್ಮೈ ಸಂದರ್ಭದಲ್ಲಿ - ಸುಮಾರು ಹೊರಹೀರುವಿಕೆಆಡ್ಸರ್ಬೆಂಟ್ನ ರಂಧ್ರಗಳಲ್ಲಿ.
ಸಿದ್ಧಾಂತದಲ್ಲಿ ಹೊರಹೀರುವಿಕೆಸ್ಟ್ಯಾಟಿಕ್ಸ್ (ಆಡ್ಸರ್ಬೆಂಟ್-ಆಡ್ಸೋರ್ಬೇಟ್ ಸಿಸ್ಟಮ್ ಥರ್ಮೋಡೈನಾಮಿಕ್ ಸಮತೋಲನದಲ್ಲಿದೆ) ಮತ್ತು ಚಲನಶಾಸ್ತ್ರ (ಯಾವುದೇ ಸಮತೋಲನವಿಲ್ಲ) ನಡುವೆ ವ್ಯತ್ಯಾಸವನ್ನು ಗುರುತಿಸಿ.
ಅಡ್ಸರ್ಪ್ಶನ್ ಸ್ಟ್ಯಾಟಿಕ್ಸ್
ಹೊರಹೀರುವಿಕೆಯ ಥರ್ಮೋಡೈನಾಮಿಕ್ಸ್
.ಥರ್ಮೋಡೈನಾಮಿಕ್ಸ್ನ ಮೂಲಭೂತ ಅಂಶಗಳು ಹೊರಹೀರುವಿಕೆ 70 ರ ದಶಕದಲ್ಲಿ ಜೆ. ಗಿಬ್ಸ್ ರಚಿಸಿದರು. XIX ಶತಮಾನ ಗಿಬ್ಸ್ ಪ್ರಕಾರ, ಹಂತದ ಇಂಟರ್ಫೇಸ್ ಬಳಿ ಸಮತೋಲನದ ಎರಡು-ಹಂತದ ವ್ಯವಸ್ಥೆಯಲ್ಲಿ ಎಲ್ಲಾ ವ್ಯಾಪಕ ಗುಣಲಕ್ಷಣಗಳ (ವಾಲ್ಯೂಮ್ ಹೊರತುಪಡಿಸಿ) ಸ್ಥಳೀಯ ಮೌಲ್ಯಗಳಲ್ಲಿ ಕೆಲವು ಬದಲಾವಣೆಗಳಿವೆ. ಆದಾಗ್ಯೂ, ಹಂತಗಳನ್ನು ಪ್ರತ್ಯೇಕಿಸುವ ನಿರ್ದಿಷ್ಟ ಜ್ಯಾಮಿತೀಯ ಮೇಲ್ಮೈಯವರೆಗೆ ಏಕರೂಪವೆಂದು ಪರಿಗಣಿಸಲಾಗುತ್ತದೆ. ಆದ್ದರಿಂದ, ಒಟ್ಟಾರೆಯಾಗಿ ಸಿಸ್ಟಮ್ಗೆ ಯಾವುದೇ ವ್ಯಾಪಕ ಆಸ್ತಿಯ ಮೌಲ್ಯವು ಏಕರೂಪದ ಹಂತಗಳಲ್ಲಿ ಈ ಆಸ್ತಿಯ ಮೌಲ್ಯಗಳ ಮೊತ್ತಕ್ಕೆ ಸಮನಾಗಿರುವುದಿಲ್ಲ ಮತ್ತು . ವ್ಯತ್ಯಾಸವು ಬೇರ್ಪಡಿಸುವ ಮೇಲ್ಮೈಗೆ ಸಂಬಂಧಿಸಿದ ಎರಡು ಆಯಾಮದ ಮೇಲ್ಮೈ ಹಂತಕ್ಕೆ ಕಾರಣವಾಗಿದೆ. ಏಕೆಂದರೆ ಮೇಲ್ಮೈ ಹಂತವು ದಪ್ಪವನ್ನು ಹೊಂದಿರುವುದಿಲ್ಲ ವಿ 0=+ ಮತ್ತು =-, ಅಲ್ಲಿ ವಿ-ಪರಿಮಾಣ.
ಪ್ರಸ್ತುತಪಡಿಸಿದ ವಿಚಾರಗಳು ಮೂಲಭೂತ ಥರ್ಮೋಡೈನಾಮಿಕ್ ಸಮೀಕರಣವನ್ನು ರೂಪಕ್ಕೆ ತಗ್ಗಿಸಲು ನಮಗೆ ಅವಕಾಶ ಮಾಡಿಕೊಡುತ್ತವೆ:
ಇಲ್ಲಿ G ಎಂಬುದು ಗಿಬ್ಸ್ ಮುಕ್ತ ಶಕ್ತಿ, S ಎಂಬುದು ಎಂಟ್ರೊಪಿ, ಇಂಟರ್ಫೇಶಿಯಲ್ ಟೆನ್ಷನ್, s ಎಂಬುದು ಇಂಟರ್ಫೇಸ್ ಏರಿಯಾ, ಮತ್ತು n i- ಅನುಗುಣವಾದ ರಾಸಾಯನಿಕ ಸಾಮರ್ಥ್ಯ ಮತ್ತು ಮೋಲ್ಗಳ ಸಂಖ್ಯೆ i- ಆ ಘಟಕ. ಸೂಚ್ಯಂಕವು ಮೇಲ್ಮೈ ಹಂತದಲ್ಲಿ ಅನುಗುಣವಾದ ಆಸ್ತಿಯ ಮೌಲ್ಯವನ್ನು ಸೂಚಿಸುತ್ತದೆ. ಐಸೊಥರ್ಮಲ್ ಪರಿಸ್ಥಿತಿಗಳಿಗಾಗಿ ಸಮೀಕರಣ (1) ಅನ್ನು ಮಾರ್ಪಡಿಸಲು ಲೆಜೆಂಡ್ರೆ ರೂಪಾಂತರವು ನಿಮಗೆ ಅನುಮತಿಸುತ್ತದೆ:
ಪ್ರಮಾಣವನ್ನು ಗಿಬ್ಸ್ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ ಹೊರಹೀರುವಿಕೆಮತ್ತು G ಚಿಹ್ನೆಯಿಂದ ಗೊತ್ತುಪಡಿಸಲಾಗಿದೆ (mol/cm2 ನಲ್ಲಿ ವ್ಯಕ್ತಪಡಿಸಲಾಗಿದೆ). ಎರಡು-ಘಟಕ ವ್ಯವಸ್ಥೆಗಾಗಿ:
ವಿಭಜಿಸುವ ಮೇಲ್ಮೈಯ ಸ್ಥಾನವನ್ನು ನಿರಂಕುಶವಾಗಿ ಆಯ್ಕೆ ಮಾಡಬಹುದು. ನಿರ್ದಿಷ್ಟವಾಗಿ ಹೇಳುವುದಾದರೆ, ಈ ಸ್ಥಾನದ ಆಯ್ಕೆಯು Г 1 =0 ಸ್ಥಿತಿಯನ್ನು ಪೂರೈಸುತ್ತದೆ. ಅಂತಹ ಮೇಲ್ಮೈಯನ್ನು ಈಕ್ವಿಮೋಲಿಕ್ಯುಲರ್ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಇದಕ್ಕಾಗಿ, Г 2 = Г 2 (1) ಎಂಬ ಪದನಾಮವನ್ನು ಪರಿಚಯಿಸಲಾಗಿದೆ. ಇದು ಮೂಲ ಗಿಬ್ಸ್ ಹೊರಹೀರುವಿಕೆ ಸಮೀಕರಣವನ್ನು ಸೂಚಿಸುತ್ತದೆ:
ಆಡ್ಸರ್ಬೆಂಟ್ ಎರಡು ಹಂತಗಳಲ್ಲಿ ಒಂದರಲ್ಲಿ ಸಂಪೂರ್ಣವಾಗಿ ಕರಗದಿದ್ದರೆ, = const, ಮತ್ತು ಸಮೀಕರಣ (2) ನಿಂದ ಸಮೀಕರಣಕ್ಕೆ (3) ಪರಿವರ್ತನೆಗೆ Г 1 =0 ಸ್ಥಿತಿಯ ಅಗತ್ಯವಿರುವುದಿಲ್ಲ. ಹೀಗಾಗಿ, ಗಿಬ್ಸ್ ಹೊರಹೀರುವಿಕೆವಿಭಜಿಸುವ ಮೇಲ್ಮೈಯವರೆಗೆ ಎರಡೂ ಹಂತಗಳು ಕಟ್ಟುನಿಟ್ಟಾಗಿ ಏಕರೂಪವಾಗಿರುವ ವ್ಯವಸ್ಥೆಗೆ ಹೋಲಿಸಿದರೆ ನಿಜವಾದ ಎರಡು-ಹಂತದ ವ್ಯವಸ್ಥೆಯಲ್ಲಿ ನೀಡಿದ ಘಟಕದ ಹೆಚ್ಚುವರಿ. ಗಿಬ್ಸ್ ಹೆಚ್ಚುವರಿ ಪ್ರಮಾಣಗಳ ಜೊತೆಗೆ ಹೊರಹೀರುವಿಕೆ, ತನ್ನ ಸಿದ್ಧಾಂತದಲ್ಲಿ ದೊಡ್ಡ ಪಾತ್ರವನ್ನು ವಹಿಸುತ್ತದೆ ಹೊರಹೀರುವಿಕೆ, ಘಟಕದ ಸಂಪೂರ್ಣ ವಿಷಯವೆಂದು ತಿಳಿಯಲಾಗಿದೆ iಬಾಹ್ಯಾಕಾಶದಲ್ಲಿ ಡಬ್ಲ್ಯೂ, ಇದರಲ್ಲಿ ಹೊರಹೀರುವಿಕೆ ಶಕ್ತಿಗಳು ತಮ್ಮನ್ನು ತಾವು ಪ್ರಕಟಪಡಿಸುತ್ತವೆ. ಮೂಲಕ ಸಂಪೂರ್ಣ ವಿಷಯಗಳನ್ನು ಸೂಚಿಸುತ್ತದೆ ಎಮತ್ತು ಘಟಕ ಎಂದು ಊಹಿಸಿ iಬೃಹತ್ ಹಂತಗಳಲ್ಲಿ ಒಂದರಲ್ಲಿ ಸಂಪೂರ್ಣವಾಗಿ ಕರಗುವುದಿಲ್ಲ, ನಾವು ಹೊಂದಿದ್ದೇವೆ:
ಅಲ್ಲಿ ಸಿ i- ಏಕಾಗ್ರತೆ iಬೃಹತ್ ಹಂತದಲ್ಲಿ ಆ ಘಟಕದ. ಸಣ್ಣ ಸಿ ನಲ್ಲಿ i:
ಹೊರಹೀರುವಿಕೆಯಾವುದೇ ಎರಡು ಹಂತಗಳ ನಡುವಿನ ಯಾವುದೇ ಇಂಟರ್ಫೇಸ್ನಲ್ಲಿ ನಿರ್ದಿಷ್ಟವಾಗಿ ದ್ರವ-ದ್ರವ (ದ್ರವ-ಅನಿಲ, ದ್ರವ-ದ್ರವ) ಅಥವಾ ಘನ-ದ್ರವ (ಘನ-ಅನಿಲ, ಘನ-ದ್ರವ) ಇಂಟರ್ಫೇಸ್ನಲ್ಲಿ ಸಂಭವಿಸಬಹುದು. ದ್ರವ-ದ್ರವ ವ್ಯವಸ್ಥೆಗಳಲ್ಲಿ, a ಅನ್ನು ಕಾರ್ಯವಾಗಿ ಅಳೆಯಬಹುದು ಮತ್ತು G 2 (1) ಅನ್ನು ಸಮೀಕರಣ (3) ಬಳಸಿಕೊಂಡು ಪ್ರಾಯೋಗಿಕವಾಗಿ ನಿರ್ಧರಿಸಬಹುದು. ಎರಡನೆಯ ಪ್ರಕರಣದಲ್ಲಿ, G 2 (1) ನ ನಿರ್ಣಯವನ್ನು ಯಾವುದೇ ವಿಧಾನದಿಂದ ಅಳೆಯಲಾಗುತ್ತದೆ n i 0 , ಮತ್ತು ಈ ಸಂಪುಟಗಳಲ್ಲಿ i-th ಘಟಕದ ಸಾಂದ್ರತೆ. ಇಲ್ಲಿಂದ ನಾವು ಜಿ ಲೆಕ್ಕಾಚಾರ ಮಾಡುತ್ತೇವೆ i(1) ಈ ವಿಧಾನವನ್ನು ವಾಲ್ಯೂಮೆಟ್ರಿಕ್ (ಅಥವಾ ವಾಲ್ಯೂಮೆಟ್ರಿಕ್) ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ತೂಕದ (ಗ್ರಾವಿಮೆಟ್ರಿಕ್) ವಿಧಾನದೊಂದಿಗೆ, ಪ್ರಮಾಣ i- ಇಂಟರ್ಫೇಸ್ನಲ್ಲಿ ಆ ಘಟಕ.
ಹೊರಹೀರುವಿಕೆ ಐಸೊಥರ್ಮ್
.ಸಮತೋಲನ ಹೊರಹೀರುವಿಕೆ ವ್ಯವಸ್ಥೆಯಲ್ಲಿ, ಸಮತೋಲನವನ್ನು ನಿರ್ಧರಿಸುವ ನಿಯತಾಂಕಗಳು a iಭಾಗಶಃ ಒತ್ತಡಗಳು ಆರ್(ಅಥವಾ ಜೊತೆ i) ಮತ್ತು ತಾಪಮಾನ ಟಿ. ಅವು ಉಷ್ಣ ಸಮೀಕರಣ ಎಂದು ಕರೆಯಲ್ಪಡುವ ಮೂಲಕ ಸಂಬಂಧಿಸಿವೆ:
ನಲ್ಲಿ ಹೊರಹೀರುವಿಕೆವೈಯಕ್ತಿಕ ಹೀರಿಕೊಳ್ಳುವ ( i=1) ಈ ಸಮೀಕರಣವು ರೂಪವನ್ನು ಪಡೆಯುತ್ತದೆ:
ಮೂರು ವಿಶೇಷ ಪ್ರಕರಣಗಳು ಉಷ್ಣ ಸಮೀಕರಣ(ಯಾವಾಗ ಟಿ, ಆರ್ಅಥವಾ ಎ- ಸ್ಥಿರಾಂಕಗಳು) ಸಿದ್ಧಾಂತದಲ್ಲಿ ವಿಶೇಷ ಪಾತ್ರವನ್ನು ವಹಿಸುತ್ತವೆ ಹೊರಹೀರುವಿಕೆ:
a=- ಐಸೊಥರ್ಮ್ ಸಮೀಕರಣ ಹೊರಹೀರುವಿಕೆ,
T=- ಐಸೊಬಾರ್ ಸಮೀಕರಣ ಹೊರಹೀರುವಿಕೆ,
ಆರ್-- ಐಸೊಸ್ಟೆರ್ ಸಮೀಕರಣ ಹೊರಹೀರುವಿಕೆ.
ನಿರ್ದಿಷ್ಟ ರೀತಿಯ ಕಾರ್ಯಗಳನ್ನು ಪರಿಗಣನೆಯಲ್ಲಿರುವ ವ್ಯವಸ್ಥೆಯ ಗುಣಲಕ್ಷಣಗಳಿಂದ ನಿರ್ಧರಿಸಲಾಗುತ್ತದೆ. ಅವುಗಳಲ್ಲಿ ಒಂದು, ಉದಾಹರಣೆಗೆ, ಯಾವುದೇ ಮೌಲ್ಯಕ್ಕೆ ಹೆಸರುವಾಸಿಯಾಗಿದ್ದರೆ T= const, ನಂತರ, ನಿಸ್ಸಂಶಯವಾಗಿ, ಇತರ ಎರಡು ಸಹ ಕರೆಯಲಾಗುತ್ತದೆ. ಈ ಸಂದರ್ಭದಲ್ಲಿ, ಅವಲಂಬನೆಗಳ ವಿಶ್ಲೇಷಣಾತ್ಮಕ ಪ್ರಕಾರವನ್ನು ತಿಳಿದುಕೊಳ್ಳುವುದು ಅನಿವಾರ್ಯವಲ್ಲ. ಅವುಗಳನ್ನು ಪ್ರಾಯೋಗಿಕವಾಗಿ ಮೌಲ್ಯಗಳ ಗುಂಪಾಗಿ ನಿರ್ದಿಷ್ಟಪಡಿಸಬಹುದು a, pಮತ್ತು ಟಿ.
ಸಿದ್ಧಾಂತದಲ್ಲಿ ಹೊರಹೀರುವಿಕೆಸಾಮಾನ್ಯವಾಗಿ ಕ್ರಿಯೆಯ ಸ್ವರೂಪದ ಪ್ರಶ್ನೆಯನ್ನು ನಿರ್ಧರಿಸಲಾಗುತ್ತದೆ ಎ=(p) g, ಅಂದರೆ. ಐಸೊಥರ್ಮ್ ಸಮೀಕರಣದ ಬಗ್ಗೆ ಹೊರಹೀರುವಿಕೆ. ಈ ಸಮಸ್ಯೆಯು ಜೊತೆಯಲ್ಲಿರುವ ಉಷ್ಣ ಪರಿಣಾಮಗಳಿಂದಾಗಿ ಹೊರಹೀರುವಿಕೆ. ಪರಿವರ್ತನೆಯ ಸಂದರ್ಭದಲ್ಲಿ ಮುಖ್ಯ ಥರ್ಮೋಡೈನಾಮಿಕ್ ಕಾರ್ಯಗಳ ಮೌಲ್ಯಗಳಲ್ಲಿನ ಬದಲಾವಣೆಗಳನ್ನು ಲೆಕ್ಕಾಚಾರ ಮಾಡುವಾಗ dnಒಂದು ಸಮತೋಲನ ವ್ಯವಸ್ಥೆಯಲ್ಲಿ ಬೃಹತ್ ಹಂತದಿಂದ ಮೇಲ್ಮೈ ಹಂತದವರೆಗೆ ಹೊರಹೀರುವಿಕೆಯ ಮೋಲ್ಗಳು p = const ಎರಡು ಪ್ರಕರಣಗಳು ಸಾಧ್ಯ: ಮೊದಲನೆಯದರಲ್ಲಿ, ಆಡ್ಸರ್ಬೆಂಟ್ ಅನ್ನು ಆಡ್ಸೋರ್ಬೇಟ್ ಆಗಿ ಪರಿವರ್ತಿಸುವುದನ್ನು ಮಾತ್ರ ಗಣನೆಗೆ ತೆಗೆದುಕೊಳ್ಳಲಾಗುತ್ತದೆ, ಏಕೆಂದರೆ ಆಡ್ಸರ್ಬೆಂಟ್ ನಲ್ಲಿ ಹೊರಹೀರುವಿಕೆಥರ್ಮೋಡೈನಮಿಕ್ ಆಗಿ ಬದಲಾಗದೆ ಮತ್ತು ಅದರ ಪಾತ್ರವು ಹೊರಹೀರುವಿಕೆ ಕ್ಷೇತ್ರದ ಮೂಲವಾಗಿ ಕಾರ್ಯನಿರ್ವಹಿಸುತ್ತದೆ; ಎರಡನೆಯದರಲ್ಲಿ, ಆಡ್ಸರ್ಬೆಂಟ್ನಲ್ಲಿನ ಬದಲಾವಣೆಯನ್ನು ಸಹ ಗಣನೆಗೆ ತೆಗೆದುಕೊಳ್ಳಲಾಗುತ್ತದೆ.
ವ್ಯವಸ್ಥೆಯು ಸಮತೋಲನದಲ್ಲಿರುವುದರಿಂದ, ಆಡ್ಸೋರ್ಬೇಟ್ ಮತ್ತು ಹೊರಹೀರುವಿಕೆಯ ರಾಸಾಯನಿಕ ವಿಭವಗಳು ಒಂದೇ ಆಗಿರುತ್ತವೆ; ಅಣುಗಳ ಚಲನಶೀಲತೆಯ ಇಳಿಕೆಯಿಂದಾಗಿ ಆಡ್ಸೋರ್ಬೇಟ್ನ ಎಂಟ್ರೊಪಿ ಹೊರಹೀರುವಿಕೆಆಡ್ಸರ್ಬೆಂಟ್ನ ಕಡಿಮೆ ಎಂಟ್ರೊಪಿ. ಆದ್ದರಿಂದ, ಜಡ ಆಡ್ಸರ್ಬೆಂಟ್ನೊಂದಿಗೆ, ಎಂಥಾಲ್ಪಿ ಯಾವಾಗಲೂ ಋಣಾತ್ಮಕವಾಗಿರುತ್ತದೆ, ಅಂದರೆ. ಹೊರಹೀರುವಿಕೆಬಹಿಷ್ಕೃತ. ಆಡ್ಸರ್ಬೆಂಟ್ನ ಎಂಟ್ರೊಪಿಯಲ್ಲಿನ ಬದಲಾವಣೆಯನ್ನು ಗಣನೆಗೆ ತೆಗೆದುಕೊಂಡು ಈ ತೀರ್ಮಾನವನ್ನು ಬದಲಾಯಿಸಬಹುದು. ಉದಾಹರಣೆಗೆ, ಪಾಲಿಮರ್ ಉಬ್ಬುವ ಪದಾರ್ಥಗಳು ಪಾಲಿಮರ್ಗಳಿಂದ ಸೋರ್ಪ್ಶನ್ ಆಗಿದ್ದರೆ, ನಂತರದ ಎಂಟ್ರೊಪಿ (ಸ್ಥೂಲ ಅಣುಗಳ ಚಲನಶೀಲತೆಯ ಹೆಚ್ಚಳದಿಂದಾಗಿ) ತುಂಬಾ ಹೆಚ್ಚಾಗುತ್ತದೆ. ಹೊರಹೀರುವಿಕೆಎಂಡೋಥರ್ಮಿಕ್ ಆಗುತ್ತದೆ. ಕೆಳಗಿನವುಗಳಲ್ಲಿ, ಲೇಖನವು ಎಕ್ಸೋಥರ್ಮಿಕ್ ಅನ್ನು ಮಾತ್ರ ಪರಿಗಣಿಸುತ್ತದೆ ಹೊರಹೀರುವಿಕೆ.
ಅವಿಭಾಜ್ಯ, ಭೇದಾತ್ಮಕ, ಐಸೊಸ್ಟೆರಿಕ್ ಮತ್ತು ಸರಾಸರಿ ಶಾಖಗಳಿವೆ ಹೊರಹೀರುವಿಕೆ. ಸಮಗ್ರ ಶಾಖ ಪ್ರಎಂಥಾಲ್ಪಿಯ ನಷ್ಟಕ್ಕೆ ಸಮನಾಗಿರುತ್ತದೆ (ನಲ್ಲಿ ವಿ=ಸ್ಥಿರ - ಸ್ಥಿರ ಆಂತರಿಕ ಶಕ್ತಿ) ಬದಲಾಯಿಸುವಾಗ ಹೊರಹೀರುವಿಕೆನಿಂದ a 1ಮೊದಲು a 2(ನಿರ್ದಿಷ್ಟ ಸಂದರ್ಭದಲ್ಲಿ ಅದು 1 = 0 ಆಗಿರಬಹುದು): Q= -(H 2 - H 1) ಈ ಮೌಲ್ಯವು ಸಾಮಾನ್ಯವಾಗಿ ಆಡ್ಸರ್ಬೆಂಟ್ ದ್ರವ್ಯರಾಶಿಗೆ ಸಂಬಂಧಿಸಿದೆ ಮತ್ತು J/kg ನಲ್ಲಿ ವ್ಯಕ್ತಪಡಿಸಲಾಗುತ್ತದೆ.
ಭೇದಾತ್ಮಕ ಶಾಖ q(J/mol) ಎಂಥಾಲ್ಪಿ ನಷ್ಟಕ್ಕೆ ಸಮಾನವಾಗಿರುತ್ತದೆ dHಅದು ಬದಲಾದಾಗ ಎಮೇಲೆ ಡಾ. ಇದು ಮನೋಭಾವದಿಂದ ವ್ಯಕ್ತವಾಗುತ್ತದೆ q = - (dH/da). ಎಂಬುದು ಸ್ಪಷ್ಟ
ಐಸೊಸ್ಟೆರಿಕ್ ಶಾಖ q ಸ್ಟ ಅನ್ನು ಇದಕ್ಕೆ ಸಮಾನವಾಗಿ ತೆಗೆದುಕೊಳ್ಳಲಾಗುತ್ತದೆ:
ಆಡ್ಸೋರ್ಬೇಟ್ ಮತ್ತು ಆಡ್ಸಾರ್ಪ್ಟಿವ್ನ ಮೋಲಾರ್ ಪರಿಮಾಣಗಳ ನಡುವಿನ ವ್ಯತ್ಯಾಸ ಎಲ್ಲಿದೆ. ಎಂದು ತೋರಿಸಬಹುದು  ಆದರ್ಶ ಅನಿಲ ಹೀರಿಕೊಳ್ಳುವಿಕೆಗಾಗಿ:
ಆದರ್ಶ ಅನಿಲ ಹೀರಿಕೊಳ್ಳುವಿಕೆಗಾಗಿ:
ಪರಿಚಯದ ಅರ್ಥ q siಅದರ ನಿರ್ಣಯಕ್ಕೆ ಕ್ಯಾಲೋರಿಮೆಟ್ರಿಕ್ ಡೇಟಾ ಅಗತ್ಯವಿಲ್ಲ (ಉದಾಹರಣೆಗೆ ಪ್ರಮತ್ತು q) ಮತ್ತು ಇದನ್ನು ಮಾಪನ ಫಲಿತಾಂಶಗಳ ಆಧಾರದ ಮೇಲೆ ಸಮೀಕರಣ (9) ಬಳಸಿ ಲೆಕ್ಕ ಹಾಕಬಹುದು ಹೊರಹೀರುವಿಕೆ. ಮಧ್ಯಮ ಶಾಖವನ್ನು ಸಹ ಪರಿಚಯಿಸಲಾಗಿದೆ ಪ್ರ(J/mol):
ಬೆಳವಣಿಗೆಯೊಂದಿಗೆ ಎನಿಯತಾಂಕ ಪ್ರಯಾವಾಗಲೂ ಹೆಚ್ಚಾಗುತ್ತದೆ, ಎ qಕಡಿಮೆಯಾಗಬಹುದು, ಹೆಚ್ಚಾಗಬಹುದು ಅಥವಾ ಬದಲಾಗದೆ ಉಳಿಯಬಹುದು. ಬೆಳವಣಿಗೆಯೊಂದಿಗೆ ಎಏಕರೂಪದ ಮೇಲ್ಮೈಯೊಂದಿಗೆ ಹೊರಹೀರುವಿಕೆಹೆಚ್ಚು ಕಡಿಮೆ ಸಕ್ರಿಯ ಪ್ರದೇಶಗಳಲ್ಲಿ ಸಂಭವಿಸುತ್ತದೆ, ಇದು ಇಳಿಕೆಗೆ ಕಾರಣವಾಗುತ್ತದೆ q. ಆದಾಗ್ಯೂ, ಇದು ಹೀರಿಕೊಳ್ಳುವ ಅಣುಗಳ ನಡುವಿನ ಸರಾಸರಿ ಅಂತರವನ್ನು ಕಡಿಮೆ ಮಾಡುತ್ತದೆ, ಇದರ ಪರಿಣಾಮವಾಗಿ ಅವುಗಳ ನಡುವಿನ ಆಕರ್ಷಕ ಶಕ್ತಿಗಳು ಹೆಚ್ಚಾಗುತ್ತವೆ, ಮತ್ತು qಹೆಚ್ಚಾಗುತ್ತದೆ. ಉಲ್ಲೇಖಿಸಲಾದ ಎರಡು ಪರಿಣಾಮಗಳ ನಡುವಿನ ಸಂಬಂಧವು ಅವಲಂಬನೆಯ ಹಾದಿಯನ್ನು ನಿರ್ಧರಿಸುತ್ತದೆ q=f(a). ಬಹಳ ದೊಡ್ಡದಕ್ಕಾಗಿ ಎವಿಕರ್ಷಣ ಶಕ್ತಿಗಳು ಈ ಪ್ರದೇಶದಲ್ಲಿ ಮೇಲುಗೈ ಸಾಧಿಸಲು ಪ್ರಾರಂಭಿಸುತ್ತವೆ qಬೆಳವಣಿಗೆಯೊಂದಿಗೆ ಯಾವಾಗಲೂ ಕಡಿಮೆಯಾಗುತ್ತದೆ ಎ.
ಅತ್ಯಂತ ಸಣ್ಣ ಮೇಲ್ಮೈ ವ್ಯಾಪ್ತಿಗಳಿಗೆ, ಐಸೊಥರ್ಮ್ ಸಮೀಕರಣ ಹೊರಹೀರುವಿಕೆಹೆನ್ರಿಯ ಸಮೀಕರಣದ ರೂಪವನ್ನು ಹೊಂದಿದೆ:
ಇಲ್ಲಿ K H ಹೆನ್ರಿ ಗುಣಾಂಕವಾಗಿದೆ. ವಾಸ್ತವವಾಗಿ, ತುಂಬಾ ಚಿಕ್ಕದಾಗಿದೆ ಎಹೊರಹೀರುವಿಕೆ ಪದರವು ಎರಡು ಆಯಾಮದ ಆದರ್ಶ ಅನಿಲವನ್ನು ಹೋಲುತ್ತದೆ, ಆದ್ದರಿಂದ ಅದರ ಸ್ಥಿತಿಯ ಸಮೀಕರಣವು ರೂಪವನ್ನು ಹೊಂದಿದೆ: = RT,ಎರಡು ಆಯಾಮದ ಒತ್ತಡವು ಒಂದು ವಸ್ತುವಿನ ಒಂದು ಮೋಲ್ನಿಂದ ಆಕ್ರಮಿಸಲ್ಪಟ್ಟಿರುವ ಪ್ರದೇಶವಾಗಿದೆ. ಇಲ್ಲಿಂದ, =- ಮತ್ತು ಸಮೀಕರಣವನ್ನು (3) ಬಳಸಿ, ನಾವು ಸಮೀಕರಣವನ್ನು (12) ಪಡೆಯುತ್ತೇವೆ. ಹೆನ್ರಿಯ ಸಮೀಕರಣವು ಅದನ್ನು ಬಯಸುತ್ತದೆ qಸ್ಥಿರವಾಗಿತ್ತು. ದೊಡ್ಡ ಭರ್ತಿಗಳಲ್ಲಿ, ಈ ಸಮೀಕರಣವು ಹಿಡಿದಿಟ್ಟುಕೊಳ್ಳುವುದನ್ನು ನಿಲ್ಲಿಸುತ್ತದೆ. ಆದ್ದರಿಂದ, G. ಫ್ರೆಂಡ್ಲಿಚ್ (1906) ಐಸೋಥರ್ಮ್ಗಳನ್ನು ವಿವರಿಸಲು ಪ್ರಸ್ತಾಪಿಸಿದರು ಹೊರಹೀರುವಿಕೆಕೆಳಗಿನ ಪ್ರಾಯೋಗಿಕ ಸಮೀಕರಣ (ಫ್ರೆಂಡ್ಲಿಚ್ ಸಮೀಕರಣ):
ಎಲ್ಲಿ ಕೆಮತ್ತು ಎನ್- ಸ್ಥಿರಾಂಕಗಳು. ಈ ಸಮೀಕರಣವನ್ನು ಸಾಮಾನ್ಯವಾಗಿ ಇಂಟರ್ಪೋಲೇಷನ್ ಸೂತ್ರವಾಗಿ ಬಳಸಲಾಗುತ್ತದೆ, ಆದರೂ ಚಿಕ್ಕದಾಗಿದೆ ಆರ್ಸಮೀಕರಣ (12) ಆಗಿ ರೂಪಾಂತರಗೊಳ್ಳುವುದಿಲ್ಲ, ಆದರೆ ಬಹಳ ದೊಡ್ಡದು ಆರ್ಅನುಭವಕ್ಕೆ ಹೊಂದಿಕೆಯಾಗದ ಅನಿಯಮಿತ ಹೆಚ್ಚಳಕ್ಕೆ ಕಾರಣವಾಗುತ್ತದೆ ಎ.
ಕಠಿಣ ಐಸೊಥರ್ಮ್ ಸಿದ್ಧಾಂತ ಹೊರಹೀರುವಿಕೆ I. ಲ್ಯಾಂಗ್ಮುಯಿರ್ (1914-18) ರಚಿಸಿದರು. ಸಿದ್ಧಾಂತವು ಈ ಕೆಳಗಿನವುಗಳನ್ನು ಆಧರಿಸಿದೆ. ಮಾದರಿ: 1) ಆಡ್ಸರ್ಬೆಂಟ್ನ ಮೇಲ್ಮೈ ಶಕ್ತಿಯುತವಾಗಿ ಒಂದೇ ರೀತಿಯ ಸಕ್ರಿಯ ಕೇಂದ್ರಗಳ ಒಂದು ಗುಂಪಾಗಿದೆ, ಅದರ ಮೇಲೆ ಆಡ್ಸರ್ಬೆಂಟ್ ಅಣುಗಳನ್ನು ಹೀರಿಕೊಳ್ಳಲಾಗುತ್ತದೆ (ಸ್ಥಳೀಕರಿಸಲಾಗಿದೆ); 2) ಒಂದು ಕೇಂದ್ರದಲ್ಲಿ ಕೇವಲ ಒಂದು ಅಣುವನ್ನು ಹೀರಿಕೊಳ್ಳಲಾಗುತ್ತದೆ, ಅಂದರೆ. ನಲ್ಲಿ ಹೊರಹೀರುವಿಕೆಕೇವಲ ಒಂದು ಆಡ್ಸರ್ಬೆಂಟ್ ರಚನೆಯಾಗುತ್ತದೆ. ಪದರ (ಮೊನೊಲೇಯರ್); 3) ಹೊರಹೀರುವಿಕೆಈ ಕೇಂದ್ರದಲ್ಲಿ ಪರಿಣಾಮ ಬೀರುವುದಿಲ್ಲ ಹೊರಹೀರುವಿಕೆಇತರ ಕೇಂದ್ರಗಳಲ್ಲಿ, ಅಂದರೆ ಪರಸ್ಪರ ಕ್ರಿಯೆ. ಹೊರಹೀರುವ ಅಣುಗಳನ್ನು ನಿರ್ಲಕ್ಷಿಸಬಹುದು.
ಲ್ಯಾಂಗ್ಮುಯಿರ್ ಮಾದರಿಯನ್ನು ಕರೆಯಲಾಗುತ್ತದೆ ಸ್ಥಳೀಯ ಮಾನೋಮಾಲಿಕ್ಯುಲರ್ ಹೊರಹೀರುವಿಕೆಏಕರೂಪದ ಮೇಲ್ಮೈಯಲ್ಲಿ. ಐಸೊಥರ್ಮ್ ಸಮೀಕರಣ ಹೊರಹೀರುವಿಕೆ, ಈ ಮಾದರಿಗೆ ಅನುಗುಣವಾಗಿ, m.b. ಡಿಕಾಂಪ್ ಬಳಸಿ ಪಡೆಯಲಾಗಿದೆ. ವಿಧಾನಗಳು (ಆಣ್ವಿಕ-ಚಲನಶಾಸ್ತ್ರ, ಉಷ್ಣಬಲ, ಸಂಖ್ಯಾಶಾಸ್ತ್ರೀಯ-ಥರ್ಮೋಡೈನಾಮಿಕ್). ಹೌದು, adsorbts. ಸಮತೋಲನವನ್ನು ಈ ಕೆಳಗಿನಂತೆ ವ್ಯಕ್ತಪಡಿಸಬಹುದು. ಯೋಜನೆ:
ಅಣು ಮುಕ್ತ ಆಡ್ಸರ್ಬ್ಟ್ಸ್. ಅನಿಲದಲ್ಲಿ + ಆಡ್ಸರ್ಬ್. ಸಂಕೀರ್ಣ ಹಂತದ ಕೇಂದ್ರ (ಕಾರ್ಯನಿರತ ಕೇಂದ್ರ)
ಅನಿಲದಲ್ಲಿನ ಅಣುಗಳ ಸಾಂದ್ರತೆಯು p ಗೆ ಅನುಪಾತದಲ್ಲಿರುತ್ತದೆ, ಇದು ಉಚಿತದ ಸಾಂದ್ರತೆಯಾಗಿದೆ. ಕೇಂದ್ರಗಳು-ಪ್ರಮಾಣ ( a t-a),ಎಲ್ಲಿ ಮತ್ತು ಟಿ -ಕೇಂದ್ರಗಳ ಒಟ್ಟು ಸಂಖ್ಯೆ, ಆಕ್ರಮಿತ ಕೇಂದ್ರಗಳ ಎ-ಸಂಖ್ಯೆ, ಹೊರಹೀರುವಿಕೆ ಸಾಂದ್ರತೆ. ಸಂಕೀರ್ಣಗಳು-ಗಾತ್ರ ಹೊರಹೀರುವಿಕೆಆದ್ದರಿಂದ, ಸಮತೋಲನ ಸ್ಥಿರಾಂಕ: K p = p(a t -ಎ)/ ಹೊರಹೀರುವಿಕೆಇಲ್ಲಿಂದ ನಾವು ಲ್ಯಾಂಗ್ಮುಯಿರ್ ಸಮೀಕರಣವನ್ನು ಪಡೆಯುತ್ತೇವೆ:
ಎಲ್ಲಿ ಬಿ-ಟಿ. ಎಂದು ಕರೆದರು ಹೀರಿಕೊಳ್ಳುತ್ತದೆ. ಗುಣಾಂಕ, ಸಮಾನ ಕೆ ಆರ್ -1ಅತ್ಯಂತ ಕಡಿಮೆ ಒತ್ತಡದ ಪ್ರದೇಶದಲ್ಲಿ br " 1 ಮತ್ತು a = (a m b)p,ಇದು ಹೆನ್ರಿಯ ಸಮೀಕರಣಕ್ಕೆ ಅನುರೂಪವಾಗಿದೆ, ಇದರಲ್ಲಿ ಕೆ ಎಚ್= ಒಂದು ಎಂ ಬಿ.ಅತಿ ಹೆಚ್ಚು ಒತ್ತಡದ ಪ್ರದೇಶದಲ್ಲಿ bр 1 ಮತ್ತು aa t;ಇದರಲ್ಲಿ ಹೊರಹೀರುವಿಕೆಇನ್ನು ಮುಂದೆ ಒತ್ತಡವನ್ನು ಅವಲಂಬಿಸಿರುವುದಿಲ್ಲ. ಸಮತೋಲನ ಸ್ಥಿರ ಬಿ -1ಐಸೊಬಾರಿಕ್ ಪ್ರತಿಕ್ರಿಯೆ ವಿಭವದ ಪ್ರಮಾಣಿತ ಮೌಲ್ಯಕ್ಕೆ ಸಂಬಂಧಿಸಿದೆ:
ಲ್ಯಾಂಗ್ಮುಯಿರ್ನ ಮಾದರಿಯು ವಿಭಿನ್ನತೆಯನ್ನು ಬಯಸುತ್ತದೆ ಶಾಖ ಮತ್ತು ಎಂಟ್ರೊಪಿ ಹೊರಹೀರುವಿಕೆಮೇಲ್ಮೈ ತುಂಬುವಿಕೆಯ ಮಟ್ಟವನ್ನು ಅವಲಂಬಿಸಿಲ್ಲ.
ಸಮೀಕರಣವು (14) ಲ್ಯಾಂಗ್ಮುಯಿರ್ ಮಾದರಿಗೆ ಅನುಗುಣವಾದ ಕಟ್ಟುನಿಟ್ಟಾದ ಅಭಿವ್ಯಕ್ತಿಯಾಗಿದೆ, ಆದರೆ ಮಾದರಿಯು ಸ್ವತಃ ಆದರ್ಶೀಕರಿಸಲ್ಪಟ್ಟಿರುವುದರಿಂದ ಇದು ಪ್ರಾಯೋಗಿಕವಾಗಿ ಅಪರೂಪವಾಗಿ ಸಮರ್ಥಿಸಲ್ಪಡುತ್ತದೆ ಹೊರಹೀರುವಿಕೆಎಂಬ ಸಿದ್ಧಾಂತ ಹೊರಹೀರುವಿಕೆ 20 ರಿಂದ 20 ನೆಯ ಶತಮಾನ ಅರ್ಥದಲ್ಲಿ. ಒಂದು ಅಥವಾ ಇನ್ನೊಂದು ಲ್ಯಾಂಗ್ಮುಯಿರ್ ಊಹೆಯನ್ನು ದುರ್ಬಲಗೊಳಿಸುವ ಅಥವಾ ಹೊರತುಪಡಿಸಿದ ಆಧಾರದ ಮೇಲೆ ಪದವಿಯನ್ನು ನಿರ್ಮಿಸಲಾಗಿದೆ ಹೊರಹೀರುವಿಕೆ
ಲ್ಯಾಂಗ್ಮುಯಿರ್ ಈಗಾಗಲೇ ವಿವರಿಸಲು ಒಂದು ಮಾರ್ಗವನ್ನು ಪ್ರಸ್ತಾಪಿಸಿದ್ದಾರೆ ಹೊರಹೀರುವಿಕೆಏಕರೂಪವಲ್ಲದ ಮೇಲ್ಮೈಯಲ್ಲಿ (ಅಂದರೆ ಎಲ್ಲಾ ಕೇಂದ್ರಗಳು ಒಂದೇ ಆಗಿರುವುದಿಲ್ಲ ಎಂಬ ಊಹೆಯ ಅಡಿಯಲ್ಲಿ). ಒಂದೇ ರೀತಿಯ ಕೇಂದ್ರಗಳನ್ನು ಗುಂಪುಗಳಾಗಿ ಸಂಯೋಜಿಸುವ ಮೂಲಕ ಮತ್ತು ಸಮೀಕರಣವು (14) ಪ್ರತಿ ಗುಂಪಿಗೆ ಅನ್ವಯಿಸುತ್ತದೆ ಎಂದು ನಾವು ಊಹಿಸಬಹುದು ಹೊರಹೀರುವಿಕೆಸಂಪೂರ್ಣ ಮೇಲ್ಮೈಯಲ್ಲಿ ಸಮೀಕರಣದ ನಿಯಮಗಳ ಮೊತ್ತದಿಂದ ವ್ಯಕ್ತಪಡಿಸಲಾಗುತ್ತದೆ (14):
ಆಡ್ಸರ್ಬ್ಟ್ಗಳ ಸಂಖ್ಯೆ ಎಂದು ಊಹಿಸಿ. ಕೇಂದ್ರಗಳು m.b. ಉಚಿತ ಮೌಲ್ಯಗಳ ಪ್ರಕಾರ ವಿತರಣೆಯ ನಿರಂತರ ಕಾರ್ಯದಿಂದ ವಿವರಿಸಲಾಗಿದೆ. ಶಕ್ತಿ, Ya.B.Zeldovich ಫಾರ್ಮುಲಾ (16) ದಿಂದ ಘಾತೀಯ ಕ್ರಿಯೆಗೆ ವಿಧದ ಸಮೀಕರಣವನ್ನು ಪಡೆಯಲಾಗಿದೆ (13).
ಹೊರಹೀರುವಿಕೆಏಕರೂಪದ ಮೇಲ್ಮೈಗಳಲ್ಲಿ - ಸಿದ್ಧಾಂತದ ದೊಡ್ಡ ಅಧ್ಯಾಯ ಹೊರಹೀರುವಿಕೆಇದರ ಮುಖ್ಯ ಸಮಗ್ರ ಸಮೀಕರಣದ ಕಾರ್ಯ-ಪರಿಹಾರ:
ಎಲ್ಲಿ ಎಫ್(ಪು) - ಕರೆಯಲ್ಪಡುವ ಪ್ರಾಯೋಗಿಕ ಐಸೊಥರ್ಮ್ ಹೊರಹೀರುವಿಕೆ, - ಉಚಿತ ಮೌಲ್ಯಗಳ ಪ್ರಕಾರ ಕೇಂದ್ರಗಳ ಸಂಖ್ಯೆಯ ವಿತರಣೆಯ ಒಂದು ಅಥವಾ ಇನ್ನೊಂದು ಕಾರ್ಯ. ಶಕ್ತಿ, ( b, p)-ಸ್ಥಳೀಯ ಐಸೋಥರ್ಮ್ ಹೊರಹೀರುವಿಕೆ, ಇದನ್ನು ಸಾಮಾನ್ಯವಾಗಿ ಲ್ಯಾಂಗ್ಮುಯಿರ್ ಐಸೋಥರ್ಮ್ ಎಂದು ತೆಗೆದುಕೊಳ್ಳಲಾಗುತ್ತದೆ ಹೊರಹೀರುವಿಕೆ
ಲ್ಯಾಂಗ್ಮುಯಿರ್ ಅವರ ಎರಡನೇ ಊಹೆಯನ್ನು ತಿರಸ್ಕರಿಸುವ ನಿಟ್ಟಿನಲ್ಲಿ ಹಲವು ಪ್ರಯತ್ನಗಳನ್ನು ಮಾಡಲಾಗಿದೆ. ಹೊರಹೀರುವಿಕೆಈ ಹಾದಿಯಲ್ಲಿ, ಪಾಲಿಮೋಲಿಕ್ಯುಲರ್ ಸಿದ್ಧಾಂತ ಹೊರಹೀರುವಿಕೆ, S. ಬ್ರೂನೌರ್, P. ಎಮ್ಮೆಟ್ ಮತ್ತು E. ಟೆಲ್ಲರ್ (BET ಸಿದ್ಧಾಂತ) ಪ್ರಸ್ತಾಪಿಸಿದರು. ನಿರ್ಣಾಯಕ ತಾಪಮಾನಕ್ಕಿಂತ ಕಡಿಮೆ ತಾಪಮಾನದಲ್ಲಿ, ಪ್ರತಿ ಅಣುವು ಮೊದಲ ಪದರದಲ್ಲಿ ಹೀರಿಕೊಳ್ಳುತ್ತದೆ ಎಂದು ಸಿದ್ಧಾಂತವು ಪ್ರತಿಪಾದಿಸುತ್ತದೆ (ಹೀರಿಕೊಳ್ಳುವ ಶಾಖ ಕ್ವಿ,), ಎರಡನೇ ಪದರವನ್ನು ರೂಪಿಸುವ ಅಣುಗಳಿಗೆ ಕೇಂದ್ರವಾಗಿದೆ, ಇತ್ಯಾದಿ. ಶಾಖ ಎಂದು ನಂಬಲಾಗಿದೆ ಹೊರಹೀರುವಿಕೆಮೊದಲನೆಯದನ್ನು ಹೊರತುಪಡಿಸಿ ಎಲ್ಲಾ ಪದರಗಳಲ್ಲಿ, ಘನೀಕರಣದ ಶಾಖಕ್ಕೆ ಸಮನಾಗಿರುತ್ತದೆ.ಈ ಮಾದರಿಯು ಸಮೀಕರಣಕ್ಕೆ ಕಾರಣವಾಗುತ್ತದೆ:
ಎಲ್ಲಿ c =ಎಕ್ಸ್[(q 1 -)/RT]. ಸಮೀಕರಣ (18) ನಿರ್ದೇಶಾಂಕಗಳಲ್ಲಿ a, p/p sಎಸ್-ಆಕಾರದ ವಕ್ರರೇಖೆಗೆ ಅನುರೂಪವಾಗಿದೆ. ನಿರ್ದೇಶಾಂಕಗಳಲ್ಲಿ p/p s,
ಐಸೊಥರ್ಮ್ ಹೊರಹೀರುವಿಕೆಸಮೀಕರಣದ ಪ್ರಕಾರ (18) ರೇಖೀಯವಾಗಿರಬೇಕು. ಈ ಸರಳ ರೇಖೆಯ ಇಳಿಜಾರು (ಸಾಮಾನ್ಯವಾಗಿ 0.05 p/p s 0.30 ವ್ಯಾಪ್ತಿಯಲ್ಲಿ) ಮತ್ತು ಆರ್ಡಿನೇಟ್ ಅಕ್ಷದ ಮೇಲೆ ಕತ್ತರಿಸಿದ ವಿಭಾಗವು ಕ್ರಮವಾಗಿ ಮೌಲ್ಯಗಳನ್ನು ನೀಡುತ್ತದೆ. ಒಂದು ಟಿಮತ್ತು ಜೊತೆಗೆ. BET ಸಿದ್ಧಾಂತದ ವ್ಯಾಪಕ ಪ್ರಸರಣವು ಅದರ ಲೇಖಕರು ವಾಸ್ತವವಾಗಿ ನಂಬುತ್ತಾರೆ ಎಂಬ ಅಂಶದಿಂದಾಗಿ ಹೊರಹೀರುವಿಕೆಸ್ಥಳೀಯವಲ್ಲದ, ಸ್ಥಿರವನ್ನು ಗುರುತಿಸಿ ಒಂದು ಟಿಡಿಸ್ಕ್ರೀಟ್ ಆಡ್ಸರ್ಬ್ಗಳ ಸಂಖ್ಯೆಯೊಂದಿಗೆ ಅಲ್ಲ. ಕೇಂದ್ರಗಳು, ಮತ್ತು ದಟ್ಟವಾದ ಪ್ಯಾಕಿಂಗ್ನೊಂದಿಗೆ ಮೊದಲ ಪದರದಲ್ಲಿ ಆಡ್ಸೋರ್ಬೇಟ್ ಅಣುಗಳ ಸಂಖ್ಯೆಯೊಂದಿಗೆ ಆರ್= ps).ಆದ್ದರಿಂದ, ಈ ಪದರದಲ್ಲಿ ಒಂದು ಅಣುವಿನಿಂದ ಆಕ್ರಮಿಸಿಕೊಂಡಿರುವ ಪ್ರದೇಶದ ಕಲ್ಪನೆಯನ್ನು ಪರಿಚಯಿಸಿ, ನಾವು ಸ್ವೀಕರಿಸುತ್ತೇವೆ:
ಎಲ್ಲಿ s-ಹೊರಹೀರುವ ಮೇಲ್ಮೈ ಪ್ರದೇಶ ಹೊರಹೀರುವಿಕೆನಿಯಮದಂತೆ, ಈ ಉದ್ದೇಶಕ್ಕಾಗಿ ಐಸೊಥರ್ಮ್ ಅನ್ನು ಅಳೆಯಲಾಗುತ್ತದೆ ಹೊರಹೀರುವಿಕೆಸಾರಜನಕ ಮತ್ತು ಅದರ ಅಣುವಿಗೆ = 0.162 nm 2 ಎಂದು ಊಹಿಸಿ. ಸಾಮಾನ್ಯವಾಗಿ ನಡೆಸಲಾಗುವ ಇದೇ ಲೆಕ್ಕಾಚಾರ ರು Langmuir ಮಾದರಿಯ ಪ್ರಕಾರ ಸರಿಯಾಗಿಲ್ಲ, ಏಕೆಂದರೆ ಈ ವಿಧಾನವು ನಿಸ್ಸಂಶಯವಾಗಿ ಸ್ಥಳೀಯವಲ್ಲದವರಿಗೆ ಮಾತ್ರ ಅನ್ವಯಿಸುತ್ತದೆ ಹೊರಹೀರುವಿಕೆ
ಪಾಲಿಮೋಲಿಕ್ಯುಲರ್ ಸಿದ್ಧಾಂತದೊಳಗೆ ಹೊರಹೀರುವಿಕೆರಾಸಾಯನಿಕ ಗುಣಲಕ್ಷಣಗಳಲ್ಲಿ ಹೋಲುವ ಎಲ್ಲಾ ಮೇಲ್ಮೈಗಳ ಮೇಲೆ (ಮೊದಲನೆಯದಕ್ಕಿಂತ ಹೆಚ್ಚಿನ) ಪದರಗಳ ಸರಾಸರಿ ಸಂಖ್ಯೆಯ ಅವಲಂಬನೆಯನ್ನು ಪ್ರಾಯೋಗಿಕವಾಗಿ ತೋರಿಸಿದ J. ಡಿ ಬೋಯರ್ ಅವರು ಪ್ರಮುಖ ಕೊಡುಗೆ ನೀಡಿದರು. ಪ್ರಕೃತಿ, ನಿಂದ p/p sಯುನಿವರ್ಸಲ್ ಕರ್ವ್ (ಟಿ-ಕರ್ವ್ ಎಂದು ಕರೆಯಲ್ಪಡುವ) ಮೂಲಕ ವ್ಯಕ್ತಪಡಿಸಲಾಗುತ್ತದೆ. ಆಡ್ಸರ್ಬೆಂಟ್ಗಳ ಮೇಲ್ಮೈ ಪ್ರದೇಶಗಳನ್ನು ಅಂದಾಜು ಮಾಡಲು ಸಹ ಇದು ಸಾಧ್ಯವಾಗಿಸುತ್ತದೆ.
ಲ್ಯಾಂಗ್ಮುಯಿರ್ ಮಾದರಿಯಲ್ಲಿ ಪರಸ್ಪರ ಕ್ರಿಯೆಯನ್ನು ಗಣನೆಗೆ ತೆಗೆದುಕೊಳ್ಳಲು ಪ್ರಯತ್ನಿಸಲಾಯಿತು. adsorbir ನಡುವೆ. ಅಣುಗಳು. ಆದ್ದರಿಂದ, ಟಿ. ಹಿಲ್ ಮತ್ತು ಜೆ. ಡಿ ಬೋಯರ್, ಹೊರಹೀರುವಿಕೆಯ ಸ್ಥಿತಿಯ ಸಮೀಕರಣವನ್ನು ನಂಬುತ್ತಾರೆ. ಪದರವು ವ್ಯಾನ್ ಡೆರ್ ವಾಲ್ಸ್ ಸಮೀಕರಣದ ಎರಡು ಆಯಾಮದ ಅನಲಾಗ್ ಆಗಿದೆ, ನಾವು ಈ ಕೆಳಗಿನವುಗಳನ್ನು ಪಡೆದುಕೊಂಡಿದ್ದೇವೆ. ಐಸೊಥರ್ಮ್ ಸಮೀಕರಣ ಹೊರಹೀರುವಿಕೆ:
ಎಲ್ಲಿ = a/a t, aಮತ್ತು ವ್ಯಾನ್ ಡೆರ್ ವಾಲ್ಸ್ ಸಮೀಕರಣದ ಬಿ-ಸ್ಥಿರಗಳು ಹೊರಹೀರುವಿಕೆ R. ಫೌಲರ್ ಮತ್ತು E. ಗುಗೆನ್ಹೀಮ್, ಪರಸ್ಪರ ಕ್ರಿಯೆಯನ್ನು ಗಣನೆಗೆ ತೆಗೆದುಕೊಳ್ಳುತ್ತಾರೆ. adsorbir. ಅಣುಗಳು, ನಾವು ಸಮೀಕರಣವನ್ನು ಪಡೆದುಕೊಂಡಿದ್ದೇವೆ:
ಅಲ್ಲಿ ಅಣುಗಳ ಜೋಡಿಯಾಗಿ ಪರಸ್ಪರ ಕ್ರಿಯೆಗೆ ಸಂಬಂಧಿಸಿದ ಸ್ಥಿರವಾಗಿರುತ್ತದೆ.
ಪೂರಕತೆಗೆ ಕಾರಣವಾಗುವ ಮತ್ತೊಂದು ಕಾರ್ಯವಿಧಾನವಿದೆ. ಹೊರಹೀರುವಿಕೆಆಡ್ಸಾರ್ಪ್ಟಿವ್ಗಳು ಅವುಗಳ ನಿರ್ಣಾಯಕ ಮೌಲ್ಯಕ್ಕಿಂತ ಕಡಿಮೆ. ತುಲನಾತ್ಮಕವಾಗಿ ಹೆಚ್ಚಿನ ಮೌಲ್ಯಗಳಲ್ಲಿ ಸರಂಧ್ರ ಆಡ್ಸರ್ಬೆಂಟ್ಗಳ ಮೇಲೆ ತಾಪಮಾನ p/p sಇದು ಕ್ಯಾಪಿಲ್ಲರಿ ಘನೀಕರಣವಾಗಿದೆ. ರಂಧ್ರದಲ್ಲಿ ಆಡ್ಸೋರ್ಬೇಟ್ನ ಕಾನ್ಕೇವ್ ಚಂದ್ರಾಕೃತಿ ರೂಪುಗೊಂಡಿದ್ದರೆ, ಘನೀಕರಣವು ಅದರಲ್ಲಿ ಪ್ರಾರಂಭವಾಗುತ್ತದೆ ಕೆಲ್ವಿನ್ ಸಮೀಕರಣದ ಪ್ರಕಾರ p/p s:
ಆಡ್ಸೋರ್ಬೇಟ್ನ ಮೇಲ್ಮೈ ಒತ್ತಡ ಎಲ್ಲಿದೆ, ವಿ -ಅವನಮೋಲಾರ್ ಪರಿಮಾಣ, ಚಂದ್ರಾಕೃತಿಯ ವಕ್ರತೆಯ ಆರ್-ತ್ರಿಜ್ಯ ಹೊರಹೀರುವಿಕೆಕ್ಯಾಪಿಲ್ಲರಿ ಸಾಂದ್ರೀಕರಣವು ಐಸೋಥರ್ಮ್ನಲ್ಲಿ ತೀಕ್ಷ್ಣವಾದ ಏರಿಕೆಗೆ ಕಾರಣವಾಗುತ್ತದೆ ಹೊರಹೀರುವಿಕೆಈ ಸಂದರ್ಭದಲ್ಲಿ, ಕರೆಯಲ್ಪಡುವ. ಹೀರಿಕೊಳ್ಳುತ್ತದೆ. ಹಿಸ್ಟರೆಸಿಸ್, ಅಂದರೆ. ಹೊರಹೀರುವಿಕೆ ಅಸಾಮರಸ್ಯ ಮತ್ತು ನಿರ್ಜಲೀಕರಣ. ಐಸೊಥರ್ಮ್ ಶಾಖೆಗಳು. ನಿಯಮದಂತೆ, ಇದು ಚಂದ್ರಾಕೃತಿಯ ಆಕಾರವು ಯಾವಾಗ ಎಂಬ ಅಂಶದಿಂದಾಗಿ ಹೊರಹೀರುವಿಕೆಮತ್ತು ನಿರ್ಜಲೀಕರಣವು ಹೊಂದಿಕೆಯಾಗುವುದಿಲ್ಲ.
ಆಡ್ಸರ್ಬೆಂಟ್ನ ರಂಧ್ರದ ಗಾತ್ರವನ್ನು ನಿರ್ಧರಿಸಲು ಕ್ಯಾಪಿಲರಿ ಘನೀಕರಣವನ್ನು ಬಳಸಲಾಗುತ್ತದೆ ಹೊರಹೀರುವಿಕೆಪ್ರತಿ ಮೌಲ್ಯಕ್ಕೆ ಸಮೀಕರಣದ ಪ್ರಕಾರ (22). p/p sಚಂದ್ರಾಕೃತಿ ವಕ್ರತೆಯ ತ್ರಿಜ್ಯವನ್ನು ಲೆಕ್ಕಹಾಕಿ ಹೊರಹೀರುವಿಕೆಅದರಿಂದ, ಆಡ್ಸರ್ಬ್ಟ್ಗಳ ದಪ್ಪವನ್ನು ಗಣನೆಗೆ ತೆಗೆದುಕೊಳ್ಳುವುದು. ಪದರ (ಉದಾಹರಣೆಗೆ, ಟಿ-ಕರ್ವ್ ಉದ್ದಕ್ಕೂ), ಪದರದಿಂದ ಚಂದ್ರಾಕೃತಿಗೆ ಪರಿವರ್ತನೆಯ ಪ್ರದೇಶದ ಆಕಾರ ಮತ್ತು ಅತಿ ಚಿಕ್ಕ r ನಲ್ಲಿ ವಕ್ರತೆಯ ಅವಲಂಬನೆ , ಕೊಟ್ಟಿರುವ ರಂಧ್ರಗಳ ರೇಖೀಯ ಗಾತ್ರವನ್ನು (ಪರಿಣಾಮಕಾರಿ ತ್ರಿಜ್ಯ r ಎಫ್) ಕಂಡುಹಿಡಿಯಿರಿ p/p sಅಂತಹ ರಂಧ್ರಗಳ ಪರಿಮಾಣವನ್ನು ಹೆಚ್ಚಳದಿಂದ ನಿರ್ಧರಿಸಲಾಗುತ್ತದೆ ಹೊರಹೀರುವಿಕೆಈ ಐಸೊಥರ್ಮ್ ಪಾಯಿಂಟ್ನಲ್ಲಿ. ಪಡೆದ ಡೇಟಾವನ್ನು ಬಳಸಿಕೊಂಡು, ಅವುಗಳ ತ್ರಿಜ್ಯಗಳ ಮೇಲೆ ರಂಧ್ರದ ಪರಿಮಾಣದ ವಿತರಣೆಯ ವಕ್ರರೇಖೆಯನ್ನು ನಿರ್ಮಿಸಲಾಗಿದೆ. ವಿಧಾನವು r ef 1.5 nm ನಲ್ಲಿ ಅನ್ವಯಿಸುತ್ತದೆ. ಸಾಮಾನ್ಯವಾಗಿ ನಿರ್ಜಲೀಕರಣವನ್ನು ಬಳಸಿಕೊಂಡು ಲೆಕ್ಕಾಚಾರವನ್ನು ಕೈಗೊಳ್ಳಲಾಗುತ್ತದೆ. ಐಸೊಥರ್ಮ್ನ ಶಾಖೆಗಳು, ಆದರೆ ಹೆಚ್ಚು ಕಟ್ಟುನಿಟ್ಟಾದ ಆಧುನಿಕ. ಸಿದ್ಧಾಂತವು ವಕ್ರರೇಖೆಯನ್ನು ನಿರ್ಮಿಸಲು ಎರಡೂ ಶಾಖೆಗಳನ್ನು ಗಣನೆಗೆ ತೆಗೆದುಕೊಳ್ಳುವ ಅಗತ್ಯವಿದೆ.
ಹೊರಹೀರುವಿಕೆಯ ಸಂಭಾವ್ಯ ಸಿದ್ಧಾಂತ ಮತ್ತು ಮೈಕ್ರೋಪೋರ್ಗಳ ಪರಿಮಾಣದ ಭರ್ತಿಯ ಸಿದ್ಧಾಂತ.ಮಾದರಿ ಹೊರಹೀರುವಿಕೆ, ಲ್ಯಾಂಗ್ಮುಯಿರ್ಗಿಂತ ಮೂಲಭೂತವಾಗಿ ವಿಭಿನ್ನವಾಗಿದೆ, ಇದನ್ನು 1914 ರಲ್ಲಿ M. ಪಾಲಿಯಾಕಿ ಪ್ರಸ್ತಾಪಿಸಿದರು. ಈ ಮಾದರಿಯ ಪ್ರಕಾರ, ಆಡ್ಸರ್ಬೆಂಟ್ನ ಮೇಲ್ಮೈ ಬಳಿ ಸಂಭಾವ್ಯ ಆಡ್ಸರ್ಬೆಂಟ್ ಇದೆ. ಮೇಲ್ಮೈಯಿಂದ ದೂರದಲ್ಲಿ ಕಡಿಮೆಯಾಗುವ ಬಲ ಕ್ಷೇತ್ರ. ಪರಿಣಾಮವಾಗಿ, ಆಡ್ಸರ್ಬೆಂಟ್ನ ಒತ್ತಡವು ಮೇಲ್ಮೈಯಿಂದ ದೂರದ p ಗೆ ಸಮಾನವಾಗಿರುತ್ತದೆ, ಅದರ ಹತ್ತಿರ ಹೆಚ್ಚಾಗುತ್ತದೆ ಮತ್ತು ಸ್ವಲ್ಪ ದೂರದಲ್ಲಿ ps ಮೌಲ್ಯವನ್ನು ತಲುಪುತ್ತದೆ, ಇದರಲ್ಲಿ ಆಡ್ಸರ್ಬೆಂಟ್ ಸಾಂದ್ರೀಕರಿಸುತ್ತದೆ. ಇಂಟರ್ಫೇಸ್ ಮತ್ತು ಜಿಯೋಮ್ ನಡುವಿನ ಪದರದ ಪರಿಮಾಣ. ಬಿಂದುಗಳ ಸ್ಥಳ p = p s, ದ್ರವದಿಂದ ತುಂಬಿರುತ್ತದೆ, ಇದಕ್ಕೆ ಸಾಮಾನ್ಯ ಭೌತಿಕ ಮೌಲ್ಯಗಳನ್ನು ನಿಗದಿಪಡಿಸಲಾಗಿದೆ. ಬೃಹತ್ ದ್ರವದ ಗುಣಲಕ್ಷಣಗಳು. ರಿವರ್ಸಿಬಲ್ ಐಸೊಥರ್ಮಲ್ ಕೆಲಸ ಮತ್ತು ಹೀರಿಕೊಳ್ಳುವಿಕೆ. ಸಮೀಕರಣದಿಂದ ನಿರ್ಧರಿಸಲ್ಪಟ್ಟ ಬಲಗಳು = RTlnp/p s, ಕರೆಯಲಾಗುತ್ತದೆ. ಹೀರಿಕೊಳ್ಳುತ್ತದೆ. ಸಂಭಾವ್ಯ, ಮತ್ತು ಸಂಪೂರ್ಣ ಪರಿಕಲ್ಪನೆಯು ಸಂಭಾವ್ಯ ಸಿದ್ಧಾಂತವಾಗಿದೆ ಹೊರಹೀರುವಿಕೆನೀಡಿದ ಪರಿಮಾಣಕ್ಕಾಗಿ ವಿಹೀರಿಕೊಳ್ಳುತ್ತದೆ. ಪದರವು ತಾಪಮಾನದಿಂದ ಸಂಭಾವ್ಯವಾಗಿ ಸ್ವತಂತ್ರವಾಗಿದೆ (ತಾಪಮಾನದಿಂದ ಪ್ರಸರಣ ಶಕ್ತಿಗಳ ಸ್ವಾತಂತ್ರ್ಯದಿಂದಾಗಿ). ಈ ತಾಪಮಾನ ವ್ಯತ್ಯಾಸವು ಮರು ಲೆಕ್ಕಾಚಾರ ಮಾಡಲು ಸಾಧ್ಯವಾಗಿಸುತ್ತದೆ ಹೊರಹೀರುವಿಕೆಐಸೊಥರ್ಮ್ ಸಮೀಕರಣಗಳ ಹೊರತಾಗಿಯೂ, ಒಂದು ತಾಪಮಾನದಿಂದ ಇನ್ನೊಂದಕ್ಕೆ ಹೊರಹೀರುವಿಕೆಪ್ರಸ್ತುತಪಡಿಸಿದ ಸಿದ್ಧಾಂತದ ಆಧಾರದ ಮೇಲೆ ನಿರ್ಣಯಿಸಲು ಸಾಧ್ಯವಾಗಲಿಲ್ಲ. ಪಾಲಿಯಾನಿ ಮಾದರಿಯನ್ನು ಅನೇಕರು ವ್ಯಾಪಕವಾಗಿ ಮತ್ತು ಯಶಸ್ವಿಯಾಗಿ ಬಳಸಿದ್ದಾರೆ. ಲೇಖಕರು, ಆದಾಗ್ಯೂ, ಇದು ಎರಡು ಅತ್ಯಂತ ದುರ್ಬಲವಾದ ನಿಬಂಧನೆಗಳನ್ನು ಒಳಗೊಂಡಿದೆ: 1) ಅತ್ಯುತ್ತಮ ಆಡ್ಸರ್ಬ್ಟ್ಗಳು ಎಂಬ ಊಹೆ. ಚಲನಚಿತ್ರವು ಸಾಮಾನ್ಯ ಭೌತಿಕ ಮೌಲ್ಯಗಳನ್ನು ಹೊಂದಿದೆ. ಬೃಹತ್ ದ್ರವದ ಗುಣಲಕ್ಷಣಗಳು (ಈ ಊಹೆಯನ್ನು ಪ್ರಯೋಗಗಳಿಂದ ದೃಢೀಕರಿಸಲಾಗಿಲ್ಲ); 2) ಕ್ರಿಯೆಯ ತಾಪಮಾನ ವ್ಯತ್ಯಾಸ =f(V),ಆಧಾರವಾಗಿರುವ ಸಿದ್ಧಾಂತವು ಅತ್ಯಂತ ಸೂಕ್ಷ್ಮ-ಸರಂಧ್ರ ಆಡ್ಸರ್ಬೆಂಟ್ಗಳಿಗೆ ಮಾತ್ರ ಪ್ರಯೋಗದ ಮೂಲಕ ದೃಢೀಕರಿಸಲ್ಪಟ್ಟಿದೆ.
ಸಂಭಾವ್ಯ ಸಿದ್ಧಾಂತವನ್ನು ಬಳಸಿಕೊಂಡು, M.M. ಡುಬಿನಿನ್ ಸೂಕ್ಷ್ಮ ರಂಧ್ರಗಳ (VFM) ಪರಿಮಾಣವನ್ನು ತುಂಬುವ ಸಿದ್ಧಾಂತವನ್ನು ಪ್ರಸ್ತಾಪಿಸಿದರು ಮತ್ತು ಅಭಿವೃದ್ಧಿಪಡಿಸಿದರು. ಈ ಸಿದ್ಧಾಂತವು ಮೈಕ್ರೋಪೋರಸ್ ಆಡ್ಸರ್ಬೆಂಟ್ಗಳಿಗೆ ಮಾತ್ರ ಅನ್ವಯಿಸುತ್ತದೆ ಎಂದು ಪ್ರತಿಪಾದಿಸಲಾಗಿದೆ. ಅಂತಹ ಆಡ್ಸರ್ಬೆಂಟ್ಗಳ ವಿಶಿಷ್ಟತೆ, ಇದರಲ್ಲಿ ರೇಖೀಯ ರಂಧ್ರದ ಗಾತ್ರಗಳು r1 nm ಆಗಿರುತ್ತವೆ, ಅವುಗಳ ರಂಧ್ರಗಳ ಸಂಪೂರ್ಣ ಪರಿಮಾಣವು ಆಡ್ಸರ್ಬೆಂಟ್ಗಳೊಂದಿಗೆ "ತುಂಬಿಹೋಗಿದೆ". ಕ್ಷೇತ್ರ. ಆದ್ದರಿಂದ, ಯಾವಾಗ ಹೊರಹೀರುವಿಕೆಅವುಗಳನ್ನು ಪದರದಿಂದ ಪದರವಲ್ಲ, ಆದರೆ ಪರಿಮಾಣದಲ್ಲಿ ತುಂಬಿಸಲಾಗುತ್ತದೆ. ಪರಿಗಣನೆಯಲ್ಲಿರುವ ಪ್ರಕರಣದಲ್ಲಿನ ಪ್ರಮಾಣವು ಆಡ್ಸರ್ಬ್ ಅಲ್ಲ. ಸಂಭಾವ್ಯ, ಮತ್ತು ರಾಸಾಯನಿಕ ಚಿಹ್ನೆಯವರೆಗೆ. ಹೀರಿಕೊಳ್ಳುವ ಸಂಭಾವ್ಯತೆಯನ್ನು ರಾಸಾಯನಿಕ ಮಟ್ಟದಿಂದ ಅಳೆಯಲಾಗುತ್ತದೆ. ಅದೇ ತಾಪಮಾನದಲ್ಲಿ ಸಾಮಾನ್ಯ ದ್ರವದ ಸಾಮರ್ಥ್ಯ. ಆಡ್ಸರ್ಬೆಂಟ್ ರಂಧ್ರಗಳ ಸಂಪೂರ್ಣ ಗುಂಪನ್ನು ಮೂರು ವರ್ಗಗಳಾಗಿ ವಿಂಗಡಿಸಲಾಗಿದೆ: ಮೈಕ್ರೊಪೋರ್ಗಳು ( ಆರ್ 0.6 nm), ಮೆಸೊಪೋರ್ಗಳು (0.6 nm-20 nm) ಮತ್ತು ಮ್ಯಾಕ್ರೋಪೋರ್ಗಳು ( ಆರ್ 20 nm). ಹೊರಹೀರುವಿಕೆಮೈಕ್ರೋಪೋರ್ಗಳಲ್ಲಿ TOZM ಯೋಜನೆಯ ಪ್ರಕಾರ ಸಂಭವಿಸುತ್ತದೆ, ಅಂದರೆ. ಪರಿಮಾಣಾತ್ಮಕವಾಗಿ, ಮೆಸೊಪೋರ್ಗಳಲ್ಲಿ - ಲೇಯರ್-ಬೈ-ಲೇಯರ್ ಭರ್ತಿ ಮಾಡುವ ಕಾರ್ಯವಿಧಾನದ ಪ್ರಕಾರ, ಕ್ಯಾಪಿಲ್ಲರಿ ಘನೀಕರಣದಿಂದ ಪೂರ್ಣಗೊಂಡಿದೆ. ಹೀರಿಕೊಳ್ಳುವ ಸಮಯದಲ್ಲಿ ಮ್ಯಾಕ್ರೋಪೋರ್ಗಳು. ಸಮತೋಲನದಲ್ಲಿ ಯಾವುದೇ ಪಾತ್ರವನ್ನು ವಹಿಸಬೇಡಿ.
ರಾಸಾಯನಿಕ ಮೌಲ್ಯಗಳ ಪ್ರಕಾರ ರಂಧ್ರದ ಪರಿಮಾಣಗಳ ವಿತರಣೆಯ ಕಲ್ಪನೆಯನ್ನು ಪರಿಚಯಿಸಿದ ನಂತರ. ಅವುಗಳಲ್ಲಿರುವ ಸಾಮರ್ಥ್ಯವನ್ನು ಹೀರಿಕೊಳ್ಳುತ್ತದೆ, ಎಂ.ಎಂ. ಡುಬಿನಿನ್ ಮತ್ತು ಎಲ್.ವಿ. ರಾದುಶ್ಕೆವಿಚ್ ಅವರು TOZM ನ ಹೊರಹೀರುವಿಕೆ ಐಸೊಥರ್ಮ್ಗೆ ಸಮೀಕರಣವನ್ನು ಪಡೆದರು, ಇದನ್ನು ಸಾಮಾನ್ಯವಾಗಿ ಕೆಳಗಿನವುಗಳಲ್ಲಿ ಬರೆಯಲಾಗುತ್ತದೆ. ರೂಪ:

ಎಲ್ಲಿ ಪೆಮತ್ತು 0-ಪ್ಯಾರಾಮೀಟರ್ಗಳು ( a 0 = aನಲ್ಲಿ p = ps). ತಾಪಮಾನ ಅವಲಂಬನೆ ಎ 0:
ಎಲ್ಲಿ = -(da 0 / dT); a 0 0 = ಒಂದು 0 T= T 0 ನಲ್ಲಿ. ಆಯ್ಕೆಗಳು ಪಮತ್ತು ಇತಾಪಮಾನದಿಂದ ಪ್ರಾಯೋಗಿಕವಾಗಿ ಸ್ವತಂತ್ರವಾಗಿದೆ. ಹೆಚ್ಚಿನ ಸಂದರ್ಭಗಳಲ್ಲಿ ಪ= 2. ಆರಂಭಿಕ ಬಿಸಿಯಾದಾಗ ಪ್ರಕರಣಗಳಿಗೆ ಮಾತ್ರ ಹೊರಹೀರುವಿಕೆಬಹು ದೊಡ್ಡ n > 2.ಐಸೋಥರ್ಮ್ಗಳನ್ನು ಮರು ಲೆಕ್ಕಾಚಾರ ಮಾಡಲು ಹೊರಹೀರುವಿಕೆಒಂದು ಹೊರಹೀರುವಿಕೆಯಿಂದ ಇನ್ನೊಂದಕ್ಕೆ ಅದು ಸರಿಸುಮಾರು ಎಂದು ಊಹಿಸಲಾಗಿದೆ E 1 /E 2 P 1 /P=ಮತ್ತು ಒಂದು 01 /a 02 V 1 /V 2, ಅಲ್ಲಿ P i- ಪ್ಯಾರಾಚೋರ್, V i -ಹೀರಿಕೊಳ್ಳುವ ಮೋಲಾರ್ ಪರಿಮಾಣ ಹೊರಹೀರುವಿಕೆ
ಪ್ರತಿ ಮೈಕ್ರೋಪೋರಸ್ ಆಡ್ಸರ್ಬೆಂಟ್ ಅನ್ನು TOZM ನಿಂದ ಎರಡು ನಿಯತಾಂಕಗಳಿಂದ ನಿರೂಪಿಸಲಾಗಿದೆ: W-ಸೂಕ್ಷ್ಮ ರಂಧ್ರದ ಪರಿಮಾಣ ( W 0 = = a 0 V 0) ಮತ್ತು ಇ 0 -ಲಕ್ಷಣ. ಶಕ್ತಿ; W 0ಮತ್ತು E 0 ಅನ್ನು ಪ್ರಮಾಣಿತ ಆಡ್ಸರ್ಬೆಂಟ್ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ, ಸಾಮಾನ್ಯವಾಗಿ ಬೆಂಜೀನ್.
ನೈಜ ಆಡ್ಸರ್ಬೆಂಟ್ನಲ್ಲಿ ವಿಭಿನ್ನ ಗಾತ್ರದ ರಂಧ್ರಗಳಿವೆ ಎಂಬ ಕಲ್ಪನೆಯನ್ನು ಬಳಸುವುದು ಮತ್ತು ಮೌಲ್ಯಗಳ ವಿತರಣೆಯನ್ನು ಪರಿಚಯಿಸುವುದು ಇ ಎಸ್ಎಫ್. ಸ್ಟೆಕ್ಲೆಗೆ ಸಮಾನವಾದ ಪ್ರಸರಣವು ಡುಬಿನಿನ್-ಸ್ಟೆಕ್ಲೆ ಸಮೀಕರಣ ಎಂಬ ಸಮೀಕರಣದ (23) ಸಾಮಾನ್ಯೀಕರಣವನ್ನು ಪ್ರಸ್ತಾಪಿಸಿತು:

ಎಲ್ಲಿ ಬಿ 0 -ನಿರಂತರವಾಗಿ ಸಂಬಂಧಿಸಿದೆ ಇಸಮೀಕರಣದಲ್ಲಿ (23), ಮತ್ತು y= ![]() . ಏಕೆಂದರೆ ಆಡ್ಸರ್ಬ್ಟ್ಗಳಲ್ಲಿ. ಹೆಚ್ಚಿನ ತಂತ್ರಜ್ಞಾನ ಮೈಕ್ರೊಪೊರಸ್ ಆಡ್ಸರ್ಬೆಂಟ್ಗಳು (ಸಕ್ರಿಯ ಕಾರ್ಬನ್ಗಳು, ಜಿಯೋಲೈಟ್ಗಳು, ಫೈನ್-ಪೋರಸ್ ಕ್ಸೆರೊಜೆಲ್ಗಳು) ವ್ಯಾಪಕವಾಗಿ ಹರಡಿವೆ; TOZM ಅನ್ನು ಭೌತಿಕ ಮತ್ತು ರಾಸಾಯನಿಕ ಅನ್ವಯಿಕೆಗಳಲ್ಲಿ ಮಾತ್ರವಲ್ಲದೆ ಬಳಸಲಾಗುತ್ತದೆ. ಸಂಶೋಧನೆ, ಆದರೆ ಎಂಜಿನಿಯರಿಂಗ್ ಲೆಕ್ಕಾಚಾರದಲ್ಲಿ.
. ಏಕೆಂದರೆ ಆಡ್ಸರ್ಬ್ಟ್ಗಳಲ್ಲಿ. ಹೆಚ್ಚಿನ ತಂತ್ರಜ್ಞಾನ ಮೈಕ್ರೊಪೊರಸ್ ಆಡ್ಸರ್ಬೆಂಟ್ಗಳು (ಸಕ್ರಿಯ ಕಾರ್ಬನ್ಗಳು, ಜಿಯೋಲೈಟ್ಗಳು, ಫೈನ್-ಪೋರಸ್ ಕ್ಸೆರೊಜೆಲ್ಗಳು) ವ್ಯಾಪಕವಾಗಿ ಹರಡಿವೆ; TOZM ಅನ್ನು ಭೌತಿಕ ಮತ್ತು ರಾಸಾಯನಿಕ ಅನ್ವಯಿಕೆಗಳಲ್ಲಿ ಮಾತ್ರವಲ್ಲದೆ ಬಳಸಲಾಗುತ್ತದೆ. ಸಂಶೋಧನೆ, ಆದರೆ ಎಂಜಿನಿಯರಿಂಗ್ ಲೆಕ್ಕಾಚಾರದಲ್ಲಿ.
ಅನಿಲ ಮತ್ತು ದ್ರವ ಮಿಶ್ರಣಗಳ ಹೊರಹೀರುವಿಕೆ. ಪ್ರಾಯೋಗಿಕವಾಗಿ, ನಾವು ಯಾವಾಗಲೂ ವೈಯಕ್ತಿಕ ಆಡ್ಸರ್ಬೆಂಟ್ನೊಂದಿಗೆ ವ್ಯವಹರಿಸುವುದಿಲ್ಲ, ಆದರೆ ಅನಿಲಗಳು ಅಥವಾ ದ್ರವ ದ್ರಾವಣಗಳ ಮಿಶ್ರಣದೊಂದಿಗೆ. ಆದ್ದರಿಂದ, ಸಿದ್ಧಾಂತದ ಸಾಮಾನ್ಯೀಕರಣದ ಅಗತ್ಯವಿದೆ ಹೊರಹೀರುವಿಕೆಮಲ್ಟಿಕಾಂಪೊನೆಂಟ್ ಅಡ್ಸಾರ್ಪ್ಟಿವ್ ಸಂದರ್ಭದಲ್ಲಿ ಹೊರಹೀರುವಿಕೆತಾತ್ವಿಕವಾಗಿ, ನೀವು ಯಾವುದೇ ಮಾದರಿಯಿಂದ ಪ್ರಾರಂಭಿಸಬಹುದು ಹೊರಹೀರುವಿಕೆಮತ್ತು ಅದನ್ನು ಈ ಪ್ರಕರಣಕ್ಕೆ ವಿಸ್ತರಿಸಿ. ನಲ್ಲಿ ಹೊರಹೀರುವಿಕೆಅನಿಲ ಮಿಶ್ರಣ, ಇದು ಸಮೀಕರಣಗಳನ್ನು ಹೆಚ್ಚು ಸಂಕೀರ್ಣಗೊಳಿಸುವುದರ ಮೂಲಕ ಮಾತ್ರವಲ್ಲದೆ ಅವುಗಳಿಗೆ ಸೇರ್ಪಡೆಗಳನ್ನು ಪರಿಚಯಿಸುವ ಮೂಲಕವೂ ಸಾಧಿಸಲಾಗುತ್ತದೆ. ಪ್ರಾಯೋಗಿಕ ಪ್ಯಾರಾಮೀಟರ್ಗಳಿಗೆ ಸಂಬಂಧಿಸಿದ ಅಥವಾ ಪರಸ್ಪರ ಕ್ರಿಯೆಯೊಂದಿಗೆ. ಭಿನ್ನವಾದ ಅಣುಗಳು ಅಥವಾ, ಸಾಮಾನ್ಯವಾಗಿ, ಗುಣಾಂಕದ ಮೇಲೆ ಕೆಲವು ವಸ್ತುಗಳ ಪ್ರಭಾವದೊಂದಿಗೆ. ಇತರರ ಚಟುವಟಿಕೆ. ಲ್ಯಾಂಗ್ಮುಯಿರ್ ಮಾದರಿಯು ನಮಗೆ ಸಮೋಷ್ಣ ಸಮೀಕರಣವನ್ನು ಪಡೆಯಲು ಅನುಮತಿಸುತ್ತದೆ ಹೊರಹೀರುವಿಕೆನಿಯತಾಂಕಗಳಿಲ್ಲದ ಮಿಶ್ರಣಗಳನ್ನು ಸಮೀಕರಣಗಳಲ್ಲಿ ಸೇರಿಸಲಾಗಿಲ್ಲ ಹೊರಹೀರುವಿಕೆವೈಯಕ್ತಿಕ ವಸ್ತುಗಳು ಇದನ್ನು ಮಾಡಲು, ಮಿಶ್ರಣದಿಂದ kth ಘಟಕವನ್ನು ಹೀರಿಕೊಳ್ಳುವ ಸಮಯದಲ್ಲಿ ಗಣನೆಗೆ ತೆಗೆದುಕೊಳ್ಳುವುದು ಸಾಕು iಆಡ್ಸರ್ಬ್ಟ್ಗಳ ಭಾಗಗಳು. ಕೇಂದ್ರಗಳು m.b. ಇತರ ಅಣುಗಳಿಂದ ಆಕ್ರಮಿಸಲ್ಪಟ್ಟಿದೆ. ಅದಕ್ಕಾಗಿಯೇ:
ಯಾವಾಗ ಹೊರಹೀರುವಿಕೆದ್ರವ ದ್ರಾವಣಗಳು, ಅವುಗಳ ಸಾಂದ್ರತೆಯನ್ನು ಲೆಕ್ಕಿಸದೆಯೇ, ಆಡ್ಸರ್ಬೆಂಟ್ನ ಸಂಪೂರ್ಣ ಮೇಲ್ಮೈ ತುಂಬಿರುತ್ತದೆ ಹೊರಹೀರುವಿಕೆಪರಿಣಾಮವಾಗಿ ಹೊರಹೀರುವಿಕೆ kth ಘಟಕದ ಅಣುಗಳು ಉಳಿದ ಘಟಕಗಳ ನಿರ್ದಿಷ್ಟ ಸಂಖ್ಯೆಯ ಅಣುಗಳ ಸ್ಥಳಾಂತರದೊಂದಿಗೆ ಇರುತ್ತದೆ, ಅಂದರೆ. ಹೊರಹೀರುವಿಕೆಸ್ವಭಾವತಃ ಸ್ಪರ್ಧಾತ್ಮಕವಾಗಿದೆ.
ಆಣ್ವಿಕ ಮತ್ತು ಅಯಾನಿಕ್ ಇವೆ ಹೊರಹೀರುವಿಕೆಪರಿಹಾರಗಳು. ಮೊದಲನೆಯದು ಯಾವಾಗ ಸಂಭವಿಸುತ್ತದೆ ಹೊರಹೀರುವಿಕೆಎಲೆಕ್ಟ್ರೋಲೈಟ್ ಅಲ್ಲದ ಪರಿಹಾರಗಳು, ವಿದ್ಯುದ್ವಿಚ್ಛೇದ್ಯಗಳ ಎರಡನೇ ಪರಿಹಾರ. ಆಣ್ವಿಕ ಹೊರಹೀರುವಿಕೆ, ನಿಯಮದಂತೆ, ವ್ಯಕ್ತಪಡಿಸಲಾಗುತ್ತದೆ ಅತಿಯಾದ ಪ್ರಮಾಣಗಳು. ಸ್ಪರ್ಧಾತ್ಮಕ ಸ್ವಭಾವ ಹೊರಹೀರುವಿಕೆಮೌಲ್ಯವನ್ನು ನಿರ್ಧರಿಸುತ್ತದೆ ಎಎಂ.ಬಿ. ಧನಾತ್ಮಕ ಮತ್ತು ಋಣಾತ್ಮಕ ಎರಡೂ. ವ್ಯಕ್ತಪಡಿಸುತ್ತಿದ್ದಾರೆ ಹೊರಹೀರುವಿಕೆ i-ಆ ಘಟಕವು x ದ್ರಾವಣದಲ್ಲಿ ಅದರ ಮೋಲ್ ಭಾಗದ ಕಾರ್ಯವಾಗಿದೆ i-, ನಮ್ಮಲ್ಲಿ ಜಿ i= O ನಲ್ಲಿ x i= 0 ಮತ್ತು x i = 1 (ಸಂಭವನೀಯ ಬದಲಾವಣೆಆಡ್ಸರ್ಬ್ಟ್ಗಳಲ್ಲಿನ ವಸ್ತುವಿನ ಪರಿಮಾಣ. ಪದರವನ್ನು ನಿರ್ಲಕ್ಷಿಸಲಾಗಿದೆ). ಆದ್ದರಿಂದ ಐಸೊಥರ್ಮ್ ಹೊರಹೀರುವಿಕೆಒಂದು ಅಥವಾ ಹೆಚ್ಚಿನದನ್ನು ಹೊಂದಿದೆ ವಿಪರೀತ.
ಐಸೊಥರ್ಮ್ ಸಮೀಕರಣ ಹೊರಹೀರುವಿಕೆವಿದ್ಯುದ್ವಿಚ್ಛೇದ್ಯಗಳಿಲ್ಲದ ಬೈನರಿ ಪರಿಹಾರಗಳು, ವಿಶ್ವಾಸಾರ್ಹವಾಗಿ ಥರ್ಮೋಡೈನಾಮಿಕ್ ಆಗಿ, ರೂಪವನ್ನು ಹೊಂದಿದೆ:

ಅಲ್ಲಿ ಸಬ್ಸ್ಕ್ರಿಪ್ಟ್ s ಆಡ್ಸರ್ಬ್ ಅನ್ನು ಸೂಚಿಸುತ್ತದೆ. ಹಂತ, - ( ಡಿಎನ್ ಎಸ್ 2 / ಡಿಎನ್ ಎಸ್ 1) ಮೊದಲನೆಯ ಒಂದು ಮೋಲ್ನಿಂದ ಎರಡನೇ ಘಟಕದ ಎಷ್ಟು ಮೋಲ್ಗಳನ್ನು ಸ್ಥಳಾಂತರಿಸಲಾಗಿದೆ ಎಂಬುದನ್ನು ತೋರಿಸುತ್ತದೆ; ರಾಸಾಯನಿಕದ ಪದಗಳ (ಪ್ರಮಾಣಿತ ಭಾಗಗಳು) ನಡುವಿನ ವ್ಯತ್ಯಾಸ. ಸಾಮರ್ಥ್ಯ, ತಾಪಮಾನವನ್ನು ಮಾತ್ರ ಅವಲಂಬಿಸಿರುತ್ತದೆ.
ಮುಖ್ಯ ಇದನ್ನು ಮತ್ತು ಹಲವಾರು ಇತರ ಐಸೊಥರ್ಮ್ ಸಮೀಕರಣಗಳನ್ನು ಬಳಸುವ ಸಮಸ್ಯೆ ಹೊರಹೀರುವಿಕೆ- ಗುಣಾಂಕದ ಅವಲಂಬನೆಯ ಸ್ಪಷ್ಟೀಕರಣ. ಹೊರಹೀರುವಿಕೆಯಲ್ಲಿ ಘಟಕಗಳ ಚಟುವಟಿಕೆ. ಅದರ ಸಂಯೋಜನೆಯಿಂದ ಪದರ ಹೊರಹೀರುವಿಕೆಬಳಸುವಾಗ ಪ್ರಮುಖ ಪ್ರಶ್ನೆ ಹೊರಹೀರುವಿಕೆಪದಾರ್ಥಗಳ ಪ್ರತ್ಯೇಕತೆ ಅಥವಾ ಶುದ್ಧೀಕರಣಕ್ಕಾಗಿ - ಕೊಟ್ಟಿರುವ ಘಟಕ ಪರಿಹಾರಕ್ಕೆ ಸಂಬಂಧಿಸಿದಂತೆ ಆಯ್ದ ಆಡ್ಸರ್ಬೆಂಟ್ ಆಯ್ಕೆ ಹೊರಹೀರುವಿಕೆ
ಅಯಾನಿಕ್ ಹೊರಹೀರುವಿಕೆ, ನಿಯಮದಂತೆ, ಸಮಾನವಾಗಿಲ್ಲ ಹೊರಹೀರುವಿಕೆವಿದ್ಯುದ್ವಿಚ್ಛೇದ್ಯ ದ್ರಾವಣದಿಂದ ಮೇಲ್ಮೈಯಲ್ಲಿ ಪ್ರಧಾನಾಂಶಗಳನ್ನು ಹೀರಿಕೊಳ್ಳಲಾಗುತ್ತದೆ. ಕ್ಯಾಟಯಾನುಗಳು ಅಥವಾ ಅಯಾನುಗಳು. ವಿದ್ಯುತ್ ಗೆ ಧನ್ಯವಾದಗಳು (ಕೂಲಂಬ್) ಮೇಲ್ಮೈ ರೂಪಗಳ ಮೇಲೆ ಬಲಗಳು ವಿದ್ಯುತ್ ಡಬಲ್ ಲೇಯರ್.
ಆಡ್ಸರ್ಬೆಂಟ್ ಅಯಾನುಗಳು ಅಥವಾ ಮೇಲ್ಮೈ ಕಾರ್ಯಗಳನ್ನು ಹೊಂದಿದ್ದರೆ. ನಿರ್ದಿಷ್ಟ ದ್ರಾವಕದಲ್ಲಿ ಅಯಾನೀಕರಣದ ಸಾಮರ್ಥ್ಯವಿರುವ ಗುಂಪುಗಳು, ನಂತರ ಆಡ್ಸರ್ಬೆಂಟ್ ಮತ್ತು ಎಲೆಕ್ಟ್ರೋಲೈಟ್ ದ್ರಾವಣದ ನಡುವೆ ಅಯಾನು ವಿನಿಮಯ ಸಂಭವಿಸುತ್ತದೆ. ಈ ಸಂದರ್ಭದಲ್ಲಿ ಆಡ್ಸರ್ಬೆಂಟ್ ಅನ್ನು ಕರೆಯಲಾಗುತ್ತದೆ. ಅಯಾನೈಟ್.
ಹೊರಹೀರುವಿಕೆ ಚಲನಶಾಸ್ತ್ರ
ಹೊರಹೀರುವಿಕೆ, ಯಾವುದೇ ನೈಜ ಪ್ರಕ್ರಿಯೆಯಂತೆ, ಸಮಯಕ್ಕೆ ಸಂಭವಿಸುತ್ತದೆ. ಆದ್ದರಿಂದ ಸಂಪೂರ್ಣ ಸಿದ್ಧಾಂತ ಹೊರಹೀರುವಿಕೆಚಲನಶಾಸ್ತ್ರದ ವಿಭಾಗವನ್ನು ಹೊಂದಿರಬೇಕು ಹೊರಹೀರುವಿಕೆಪ್ರಾಥಮಿಕ ಕಾಯಿದೆ ಹೊರಹೀರುವಿಕೆಬಹುತೇಕ ತಕ್ಷಣವೇ ಕೈಗೊಳ್ಳಲಾಗುತ್ತದೆ (ಕೆಮಿಸೋರ್ಪ್ಷನ್ ಹೊರತುಪಡಿಸಿ). ಆದ್ದರಿಂದ, ಸಮಯದ ಅವಲಂಬನೆಗಳು ಹೊರಹೀರುವಿಕೆಮುಖ್ಯವಾಗಿ ನಿರ್ಧರಿಸಲಾಗುತ್ತದೆ ಪ್ರಸರಣ ಕಾರ್ಯವಿಧಾನದಿಂದ, ಅಂದರೆ, ಸೈಟ್ಗೆ ಆಡ್ಸರ್ಬೆಂಟ್ ಪೂರೈಕೆ ಹೊರಹೀರುವಿಕೆಒಂದು ವೇಳೆ ಹೊರಹೀರುವಿಕೆತೆರೆದ ಮೇಲ್ಮೈಯಲ್ಲಿ ತಕ್ಷಣವೇ ಅಲ್ಲ, ಅಂತಹ ಪ್ರಕ್ರಿಯೆಯು ಬಾಹ್ಯ ಪ್ರಸರಣ ಪ್ರದೇಶದಲ್ಲಿ ಸಂಭವಿಸುತ್ತದೆ; ಇದಲ್ಲದೆ, ಪ್ರಸರಣದ ನಿಯಮಗಳು ನಿರ್ದಿಷ್ಟವಾಗಿಲ್ಲ ಹೊರಹೀರುವಿಕೆಸರಂಧ್ರ ಆಡ್ಸರ್ಬೆಂಟ್ಗಳ ಸಂದರ್ಭದಲ್ಲಿ, ಬಾಹ್ಯ ಜೊತೆಗೆ ಪ್ರಸರಣ, ಆಂತರಿಕವು ಪ್ರಮುಖ ಪಾತ್ರವನ್ನು ವಹಿಸಲು ಪ್ರಾರಂಭಿಸುತ್ತದೆ. ಪ್ರಸರಣ, ಅಂದರೆ. ಅವುಗಳಲ್ಲಿನ ಸಾಂದ್ರತೆಯ ಗ್ರೇಡಿಯಂಟ್ ಉಪಸ್ಥಿತಿಯಲ್ಲಿ ಆಡ್ಸರ್ಬೆಂಟ್ನ ರಂಧ್ರಗಳಲ್ಲಿ ಆಡ್ಸರ್ಬೆಂಟ್ನ ವರ್ಗಾವಣೆ. ಅಂತಹ ವರ್ಗಾವಣೆಯ ಕಾರ್ಯವಿಧಾನವು ಆಡ್ಸರ್ಬೆಂಟ್ ಮತ್ತು ರಂಧ್ರದ ಗಾತ್ರದ ಸಾಂದ್ರತೆಯ ಮೇಲೆ ಅವಲಂಬಿತವಾಗಿರುತ್ತದೆ.
ಆಣ್ವಿಕ, ಕ್ನುಡ್ಸೆನ್ ಮತ್ತು ಮೇಲ್ಮೈ (ವೋಲ್ಮರ್) ಪ್ರಸರಣ ಇವೆ. ಮುಕ್ತ ಉದ್ದದ ವೇಳೆ ಆಣ್ವಿಕ ಪ್ರಸರಣ ಸಂಭವಿಸುತ್ತದೆ. ರಂಧ್ರಗಳಲ್ಲಿನ ಅಣುಗಳ ಮಾರ್ಗವು ರಂಧ್ರದ ಗಾತ್ರಕ್ಕಿಂತ ಕಡಿಮೆಯಿರುತ್ತದೆ, ಕ್ನುಡ್ಸೆನ್ - ಈ ಉದ್ದವು ರಂಧ್ರದ ಗಾತ್ರವನ್ನು ಮೀರಿದರೆ. ಮೇಲ್ಮೈ ಪ್ರಸರಣದೊಂದಿಗೆ, ಅಣುಗಳು ಬೃಹತ್ ಹಂತವನ್ನು ಪ್ರವೇಶಿಸದೆ ಆಡ್ಸರ್ಬೆಂಟ್ನ ಮೇಲ್ಮೈಯಲ್ಲಿ ಚಲಿಸುತ್ತವೆ. ಆದಾಗ್ಯೂ, ಗುಣಾಂಕ ಮೌಲ್ಯಗಳು. ವಿಭಿನ್ನ ಪ್ರಸರಣ ಕಾರ್ಯವಿಧಾನಗಳಿಗೆ ಪ್ರಸರಣವು ಒಂದೇ ಆಗಿರುವುದಿಲ್ಲ. ಬಹುವಚನದಲ್ಲಿ ಸಂದರ್ಭಗಳಲ್ಲಿ, ನಿಖರವಾಗಿ ಪ್ರಸರಣ ಹೇಗೆ ಸಂಭವಿಸುತ್ತದೆ ಎಂಬುದನ್ನು ಪ್ರಾಯೋಗಿಕವಾಗಿ ಸ್ಥಾಪಿಸಲು ಸಾಧ್ಯವಿಲ್ಲ, ಮತ್ತು ಆದ್ದರಿಂದ ಕರೆಯಲ್ಪಡುವ. ಪರಿಣಾಮಕಾರಿ ಗುಣಾಂಕ ಪ್ರಸರಣ, ಒಟ್ಟಾರೆಯಾಗಿ ಪ್ರಕ್ರಿಯೆಯನ್ನು ವಿವರಿಸುತ್ತದೆ.
ಮುಖ್ಯ ಪ್ರಯೋಗ ಮಾಡೋಣ ಚಲನಶಾಸ್ತ್ರದ ಬಗ್ಗೆ ವಸ್ತು ಹೊರಹೀರುವಿಕೆಕರೆಯಲ್ಪಡುವಂತೆ ಕಾರ್ಯನಿರ್ವಹಿಸುತ್ತದೆ ಚಲನಶೀಲ ಕರ್ವ್, ಅಂದರೆ. ಕಾರ್ಯ = a/a ಸಮಾನ = f(t) ಅಲ್ಲಿ-ಸಂಬಂಧಿ ಹೊರಹೀರುವಿಕೆ, ಪ್ರಸ್ತುತ ಹೊರಹೀರುವಿಕೆ ಮೌಲ್ಯದ ಅನುಪಾತಕ್ಕೆ ಸಮನಾಗಿರುತ್ತದೆ ಎಗೆ ಎಸಮಯದಲ್ಲಿ ಅದರ ಮೌಲ್ಯಕ್ಕೆ ಸಮಾನವಾಗಿರುತ್ತದೆ ಟಿ.ಚಲನಶಾಸ್ತ್ರವನ್ನು ಅರ್ಥೈಸಲು ಸರಳವಾದ ಸಂದರ್ಭದಲ್ಲಿ ಕರ್ವ್, ಆಡ್ಸರ್ಬೆಂಟ್ ಧಾನ್ಯವು ಪರಿಮಾಣದಲ್ಲಿ ಸಂಪೂರ್ಣವಾಗಿ ಏಕರೂಪದ ಸರಂಧ್ರ ರಚನೆಯನ್ನು ಹೊಂದಿದೆ ಎಂದು ಊಹಿಸಲಾಗಿದೆ (ಈ ಮಾದರಿಯನ್ನು ಅರೆ-ಸಮರೂಪದ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ). ಅರ್ಥ. ಅರೆ-ಸಮರೂಪದ ಮಾದರಿಯ ಸುಧಾರಣೆಯೆಂದರೆ ಪ್ರತಿ ಧಾನ್ಯವು ದೊಡ್ಡ ಮತ್ತು ಸೂಕ್ಷ್ಮ ರಂಧ್ರಗಳನ್ನು ಹೊಂದಿರುವ ಪ್ರದೇಶಗಳನ್ನು ಹೊಂದಿರುತ್ತದೆ. ಅಂತಹ ಧಾನ್ಯದಲ್ಲಿನ ಪ್ರಸರಣವನ್ನು ಎರಡು ವಿಭಿನ್ನ ಅಂಶಗಳಿಂದ ವಿವರಿಸಲಾಗಿದೆ. ಗುಣಾಂಕಗಳು.
ತೆರೆದ ಮೇಲ್ಮೈಯ ಸಂದರ್ಭದಲ್ಲಿ, ಲ್ಯಾಂಗ್ಮುಯಿರ್ ಮಾದರಿಯನ್ನು ಅಳವಡಿಸಿಕೊಂಡರೆ, ಚಲನಶಾಸ್ತ್ರವನ್ನು ಪಡೆಯುವುದು ಸುಲಭ. ಸಮೀಕರಣ ಹೊರಹೀರುವಿಕೆಸಮತೋಲನದ ವಿಧಾನದ ದರವು ವೇಗದಲ್ಲಿನ ವ್ಯತ್ಯಾಸವಾಗಿದೆ ಹೊರಹೀರುವಿಕೆಮತ್ತು ನಿರ್ಜಲೀಕರಣ. ಚಲನಶಾಸ್ತ್ರದಲ್ಲಿ ಎಂದಿನಂತೆ, ಪ್ರಕ್ರಿಯೆಗಳ ದರಗಳು ಪ್ರತಿಕ್ರಿಯಿಸುವ ಪದಾರ್ಥಗಳ ಸಾಂದ್ರತೆಗೆ ಅನುಗುಣವಾಗಿರುತ್ತವೆ ಎಂದು ಊಹಿಸಿ, ನಾವು ಹೊಂದಿದ್ದೇವೆ:
ಇಲ್ಲಿ k adc ಮತ್ತು k des ಅನುಕ್ರಮವಾಗಿ ದರ ಸ್ಥಿರಾಂಕಗಳಾಗಿವೆ. ಹೊರಹೀರುವಿಕೆಮತ್ತು ನಿರ್ಜಲೀಕರಣ. ಅನಿಲ ಹಂತದಲ್ಲಿ ಒತ್ತಡವು ಸ್ಥಿರವಾಗಿರುತ್ತದೆ ಎಂದು ಊಹಿಸಲಾಗಿದೆ. ನಿಂದ ಈ ಸಮೀಕರಣವನ್ನು ಸಂಯೋಜಿಸುವಾಗ ಟಿಯಾವುದೇ ಮೌಲ್ಯಕ್ಕೆ = 0 ಟಿನಾವು ಪಡೆಯುತ್ತೇವೆ:
ಆದ್ದರಿಂದ, f ಗಾಗಿ ನಾವು ಹೊಂದಿದ್ದೇವೆ: = ಸಮಾನ. ಆದ್ದರಿಂದ, ನಾವು ಅಂತಿಮವಾಗಿ ಹೊಂದಿದ್ದೇವೆ:
ಅಲ್ಲಿ k = k ಜಾಹೀರಾತುಗಳು + k des.
ವೇಗದ ಮೇಲೆ ತಾಪಮಾನದ ಪರಿಣಾಮ ಹೊರಹೀರುವಿಕೆಅರ್ಹೆನಿಯಸ್ ಸಮೀಕರಣವನ್ನು ಹೋಲುವ ಸಮೀಕರಣದಿಂದ ವ್ಯಕ್ತಪಡಿಸಲಾಗಿದೆ ಹೊರಹೀರುವಿಕೆತಾಪಮಾನ ಹೆಚ್ಚಾದಂತೆ, ಕ್ಯಾಡ್ಸ್ ಘಾತೀಯವಾಗಿ ಹೆಚ್ಚಾಗುತ್ತದೆ. ಏಕೆಂದರೆ ಆಡ್ಸರ್ಬೆಂಟ್ನ ರಂಧ್ರಗಳಲ್ಲಿನ ಪ್ರಸರಣವು ಸಕ್ರಿಯಗೊಳಿಸುವಿಕೆಯನ್ನು ಮೀರುವುದರೊಂದಿಗೆ ಸಂಬಂಧಿಸಿದೆ. ಅಡೆತಡೆಗಳು, kads ಮತ್ತು kdes ಗಳ ತಾಪಮಾನ ಅವಲಂಬನೆಗಳು ಒಂದೇ ಆಗಿರುವುದಿಲ್ಲ.
ಪ್ರಸರಣ ದರಗಳ ಜ್ಞಾನವು ಸಿದ್ಧಾಂತಕ್ಕೆ ಮಾತ್ರವಲ್ಲ ಹೊರಹೀರುವಿಕೆ, ಆದರೆ ಕೈಗಾರಿಕಾ ಲೆಕ್ಕಾಚಾರಕ್ಕಾಗಿ ಹೀರಿಕೊಳ್ಳುತ್ತದೆ. ಕಾರ್ಯವಿಧಾನಗಳು. ಈ ಸಂದರ್ಭದಲ್ಲಿ, ಅವರು ಸಾಮಾನ್ಯವಾಗಿ ಪ್ರತ್ಯೇಕ ಆಡ್ಸರ್ಬೆಂಟ್ ಧಾನ್ಯಗಳೊಂದಿಗೆ ವ್ಯವಹರಿಸುವುದಿಲ್ಲ, ಆದರೆ ಅವುಗಳ ಪದರಗಳೊಂದಿಗೆ. ಪದರದಲ್ಲಿನ ಪ್ರಕ್ರಿಯೆಯ ಚಲನಶಾಸ್ತ್ರವು ಬಹಳ ಸಂಕೀರ್ಣ ಅವಲಂಬನೆಗಳಿಂದ ವ್ಯಕ್ತವಾಗುತ್ತದೆ. ನಿರ್ದಿಷ್ಟ ಸಮಯದಲ್ಲಿ ಪದರದ ಪ್ರತಿ ಹಂತದಲ್ಲಿ, ಮೌಲ್ಯ ಹೊರಹೀರುವಿಕೆಐಸೊಥರ್ಮ್ ಸಮೀಕರಣದ ರೂಪದಿಂದ ಮಾತ್ರ ನಿರ್ಧರಿಸಲಾಗುತ್ತದೆ ಹೊರಹೀರುವಿಕೆಮತ್ತು ಪ್ರಕ್ರಿಯೆಯ ಚಲನಶಾಸ್ತ್ರದ ನಿಯಮಗಳು, ಆದರೆ ಏರೋ- ಅಥವಾ ಹೈಡ್ರೊಡೈನಾಮಿಕ್. ಧಾನ್ಯಗಳ ಸುತ್ತ ಅನಿಲ ಅಥವಾ ದ್ರವ ಹರಿವಿನ ಪರಿಸ್ಥಿತಿಗಳು. ಏಕ ಧಾನ್ಯದಲ್ಲಿನ ಚಲನಶಾಸ್ತ್ರಕ್ಕೆ ವ್ಯತಿರಿಕ್ತವಾಗಿ ಆಡ್ಸರ್ಬೆಂಟ್ ಪದರದಲ್ಲಿನ ಪ್ರಕ್ರಿಯೆಯ ಚಲನಶಾಸ್ತ್ರವನ್ನು ಕರೆಯಲಾಗುತ್ತದೆ. ಡೈನಾಮಿಕ್ಸ್ ಹೊರಹೀರುವಿಕೆ, ಸಾಮಾನ್ಯ ಯೋಜನೆಸಮಸ್ಯೆಗಳ ಪರಿಹಾರವು ಈ ಕೆಳಗಿನಂತಿರುತ್ತದೆ: ವಿಭಿನ್ನತೆಯ ವ್ಯವಸ್ಥೆಯನ್ನು ಸಂಕಲಿಸಲಾಗಿದೆ. ಭಾಗಶಃ ಭೇದಾತ್ಮಕ ಸಮೀಕರಣಗಳು, ಪದರದ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಗಣನೆಗೆ ತೆಗೆದುಕೊಂಡು, ಐಸೊಥರ್ಮ್ ಹೊರಹೀರುವಿಕೆ, ಪ್ರಸರಣ ಗುಣಲಕ್ಷಣಗಳು (ಪ್ರಸರಣ ಗುಣಾಂಕ, ಪದರದ ಉದ್ದಕ್ಕೂ ಮತ್ತು ಧಾನ್ಯಗಳ ಒಳಗೆ ಸಾಮೂಹಿಕ ವರ್ಗಾವಣೆಯ ವಿಧಗಳು), ಏರೋ- ಮತ್ತು ಹೈಡ್ರೊಡೈನಾಮಿಕ್. ವೈಶಿಷ್ಟ್ಯಗಳ ಸ್ಟ್ರೀಮ್ ಹೊರಹೀರುವಿಕೆಆರಂಭಿಕ ಮತ್ತು ಗಡಿ ಪರಿಸ್ಥಿತಿಗಳನ್ನು ನಿರ್ದಿಷ್ಟಪಡಿಸಲಾಗಿದೆ. ಈ ಸಮೀಕರಣಗಳ ವ್ಯವಸ್ಥೆಯ ಪರಿಹಾರವು ತಾತ್ವಿಕವಾಗಿ, ಮೌಲ್ಯಗಳಿಗೆ ಕಾರಣವಾಗುತ್ತದೆ ಹೊರಹೀರುವಿಕೆಒಂದು ನಿರ್ದಿಷ್ಟ ಹಂತದಲ್ಲಿ ಪದರದ ನಿರ್ದಿಷ್ಟ ಹಂತದಲ್ಲಿ. ನಿಯಮದಂತೆ, ವಿಶ್ಲೇಷಣಾತ್ಮಕ ಸರಳವಾದ ಪ್ರಕರಣಗಳಿಗೆ ಮಾತ್ರ ಪರಿಹಾರವನ್ನು ಪಡೆಯಬಹುದು, ಆದ್ದರಿಂದ ಈ ಸಮಸ್ಯೆಯನ್ನು ಕಂಪ್ಯೂಟರ್ ಬಳಸಿ ಸಂಖ್ಯಾತ್ಮಕವಾಗಿ ಪರಿಹರಿಸಲಾಗುತ್ತದೆ.
ಡೈನಾಮಿಕ್ಸ್ನ ಪ್ರಾಯೋಗಿಕ ಅಧ್ಯಯನದಲ್ಲಿ ಹೊರಹೀರುವಿಕೆನಿರ್ದಿಷ್ಟ ಗುಣಲಕ್ಷಣಗಳೊಂದಿಗೆ ಅನಿಲ ಅಥವಾ ದ್ರವ ಸ್ಟ್ರೀಮ್ ಹೊರಹೀರುವ ಪದರದ ಮೂಲಕ ಹಾದುಹೋಗುತ್ತದೆ ಮತ್ತು ಹೊರಹೋಗುವ ಸ್ಟ್ರೀಮ್ನ ಸಂಯೋಜನೆಯನ್ನು ಸಮಯದ ಕಾರ್ಯವಾಗಿ ಅಧ್ಯಯನ ಮಾಡಲಾಗುತ್ತದೆ. ಎಂದು ಕರೆಯಲ್ಪಡುವ ಪದರದ ಹಿಂದೆ ಹೀರಿಕೊಳ್ಳುವ ವಸ್ತುವಿನ ನೋಟ. ಪ್ರಗತಿ, ಮತ್ತು ಪ್ರಗತಿಯ ಮುಂಚಿನ ಸಮಯವು ರಕ್ಷಣಾತ್ಮಕ ಕ್ರಿಯೆಯ ಸಮಯವಾಗಿದೆ. ಸಮಯಕ್ಕೆ ಪದರದ ಹಿಂದೆ ನಿರ್ದಿಷ್ಟ ಘಟಕದ ಸಾಂದ್ರತೆಯ ಅವಲಂಬನೆಯನ್ನು ಕರೆಯಲಾಗುತ್ತದೆ. ಔಟ್ಪುಟ್ ಕರ್ವ್. ಈ ವಕ್ರಾಕೃತಿಗಳು ಆಧಾರವಾಗಿ ಕಾರ್ಯನಿರ್ವಹಿಸುತ್ತವೆ. ಪ್ರಯೋಗ ಮಾಡೋಣ ಡೈನಾಮಿಕ್ಸ್ ಮಾದರಿಗಳನ್ನು ನಿರ್ಣಯಿಸಲು ಅನುಮತಿಸುವ ವಸ್ತು ಹೊರಹೀರುವಿಕೆ
ಹೊರಹೀರುವಿಕೆ ಪ್ರಕ್ರಿಯೆಗಳ ಯಂತ್ರಾಂಶ ವಿನ್ಯಾಸ
ಹಲವು ತಂತ್ರಜ್ಞಾನಗಳಿವೆ. ಹೀರಿಕೊಳ್ಳುವ ವಿಧಾನಗಳು. ಕಾರ್ಯವಿಧಾನಗಳು. ವ್ಯಾಪಕ ಆವರ್ತಕ (ಆವರ್ತಕ) ಆಡ್ಸರ್ಬೆಂಟ್ನ ಸ್ಥಿರ ಪದರದೊಂದಿಗೆ ಅನುಸ್ಥಾಪನೆಗಳು, ಮೂಲಭೂತ. ಇದರ ನೋಡ್ ಒಂದು ಅಥವಾ ಹಲವಾರು. ಹರಳಿನ ಆಡ್ಸರ್ಬೆಂಟ್ನಿಂದ ತುಂಬಿದ ಟೊಳ್ಳಾದ ಕಾಲಮ್ಗಳ ರೂಪದಲ್ಲಿ ಮಾಡಿದ ಆಡ್ಸರ್ಬರ್ಗಳು. ಹೀರಿಕೊಳ್ಳುವ ಘಟಕಗಳನ್ನು ಹೊಂದಿರುವ ಅನಿಲ (ಅಥವಾ ದ್ರವ) ಸ್ಟ್ರೀಮ್ ಅನ್ನು ಹೀರಿಕೊಳ್ಳುವವರೆಗೆ ಹೀರಿಕೊಳ್ಳುವ ಪದರದ ಮೂಲಕ ಹಾದುಹೋಗುತ್ತದೆ. ಹೊರಹೀರುವಿಕೆಇದರ ನಂತರ, ಆಡ್ಸರ್ಬರ್ನಲ್ಲಿನ ಆಡ್ಸರ್ಬೆಂಟ್ ಅನ್ನು ಪುನರುತ್ಪಾದಿಸಲಾಗುತ್ತದೆ, ಮತ್ತು ಅನಿಲ ಹರಿವು ಮತ್ತೊಂದು ಆಡ್ಸರ್ಬರ್ಗೆ ನಿರ್ದೇಶಿಸಲ್ಪಡುತ್ತದೆ. ಆಡ್ಸರ್ಬೆಂಟ್ನ ಪುನರುತ್ಪಾದನೆಯು ಹಲವಾರು ಹಂತಗಳನ್ನು ಒಳಗೊಂಡಿದೆ, ಅದರಲ್ಲಿ ಮುಖ್ಯವಾದವು ನಿರ್ಜಲೀಕರಣವಾಗಿದೆ, ಅಂದರೆ. ಆಡ್ಸರ್ಬೆಂಟ್ನಿಂದ ಹಿಂದೆ ಹೀರಿಕೊಳ್ಳಲ್ಪಟ್ಟ ವಸ್ತುವಿನ ಬಿಡುಗಡೆ ಹೊರಹೀರುವಿಕೆನಿರ್ಜಲೀಕರಣವನ್ನು ತಾಪನ, ಅನಿಲ ಹಂತದ ಖಿನ್ನತೆ, ಸ್ಥಳಾಂತರ (ಉದಾ, ಬಿಸಿ ಉಗಿ) ಅಥವಾ ಈ ವಿಧಾನಗಳ ಸಂಯೋಜನೆಯಿಂದ ನಡೆಸಲಾಗುತ್ತದೆ. ಏಕೆಂದರೆ ಬಾರಿ ಹೊರಹೀರುವಿಕೆಮತ್ತು ಪುನರುತ್ಪಾದನೆಗಳು ಹೊಂದಿಕೆಯಾಗುವುದಿಲ್ಲ, ಅಂತಹ ಹಲವಾರು ಏಕಕಾಲದಲ್ಲಿ ಕಾರ್ಯನಿರ್ವಹಿಸುವ ಮತ್ತು ಪುನರುತ್ಪಾದಿತ ಆಡ್ಸರ್ಬರ್ಗಳನ್ನು ಆಯ್ಕೆ ಮಾಡಿ ಇದರಿಂದ ಒಟ್ಟಾರೆ ಪ್ರಕ್ರಿಯೆಯು ನಿರಂತರವಾಗಿ ಮುಂದುವರಿಯುತ್ತದೆ.
ತಾಂತ್ರಿಕ ಪ್ರಕಾರ ಮತ್ತು ಆರ್ಥಿಕ ಪುನರುತ್ಪಾದನೆಯ ಕಾರಣಗಳಿಗಾಗಿ, ಪುನರುತ್ಪಾದನೆ ಪೂರ್ಣಗೊಂಡಿಲ್ಲ ಹೊರಹೀರುವಿಕೆಆದ್ದರಿಂದ, ಆಡ್ಸರ್ಬೆಂಟ್ನ ಕೆಲಸದ ಸಾಮರ್ಥ್ಯವು ನಿರ್ದಿಷ್ಟ ಪರಿಸ್ಥಿತಿಗಳಲ್ಲಿ ಸಾಧಿಸಿದ ಗರಿಷ್ಠ ನಡುವಿನ ವ್ಯತ್ಯಾಸಕ್ಕೆ ಸಮಾನವಾಗಿರುತ್ತದೆ ಹೊರಹೀರುವಿಕೆಮತ್ತು ಪುನರುತ್ಪಾದನೆಯ ನಂತರ ಆಡ್ಸರ್ಬೆಂಟ್ನಲ್ಲಿ ಉಳಿದಿರುವ ಆಡ್ಸೋರ್ಬೇಟ್ ಪ್ರಮಾಣ. ಪರಿಣಾಮವಾಗಿ, ಐಸೋಥರ್ಮ್ಗಳು ಹೊರಹೀರುವಿಕೆ, ಆಡ್ಸರ್ಬರ್ನಲ್ಲಿನ ಪ್ರಕ್ರಿಯೆಗೆ ಅನುಗುಣವಾಗಿ, ತುಂಬಾ ಕಡಿದಾದ ಇರಬಾರದು.
ವಿವರಿಸಿದ ಯೋಜನೆಯಲ್ಲಿ, ಎರಡು ಆಯ್ಕೆಗಳು ಸಾಧ್ಯ: 1) ಉದ್ದೇಶಿತ ಉತ್ಪನ್ನವು ಅನಿಲದ ಹರಿವಿನಿಂದ ಸಂಪೂರ್ಣವಾಗಿ ಹೊರಹೀರುತ್ತದೆ, ಮತ್ತು ನಂತರ ಅದನ್ನು ನಿರ್ಜಲೀಕರಣದಲ್ಲಿ ಒಳಗೊಂಡಿರುತ್ತದೆ, ಅಲ್ಲಿಂದ ಅದನ್ನು ಒಂದು ರೀತಿಯಲ್ಲಿ ಅಥವಾ ಇನ್ನೊಂದು ರೀತಿಯಲ್ಲಿ ಹೊರತೆಗೆಯಲಾಗುತ್ತದೆ; 2) ಉದ್ದೇಶಿತ ಉತ್ಪನ್ನವು ಅನಿಲ ಮಿಶ್ರಣದ ಇತರ ಘಟಕಗಳಿಗಿಂತ ಕೆಟ್ಟದಾಗಿ ಹೀರಿಕೊಳ್ಳುತ್ತದೆ ಮತ್ತು ನಂತರ ಅದು ನಿರ್ಗಮನ ಅನಿಲ ಸ್ಟ್ರೀಮ್ನಲ್ಲಿ ಒಳಗೊಂಡಿರುತ್ತದೆ. ಮೊದಲ ಆಯ್ಕೆಯ ಪ್ರಕಾರ, ಉದಾಹರಣೆಗೆ, ಚೇತರಿಕೆ ಘಟಕಗಳು ವಿಸ್ಕೋಸ್ ಉತ್ಪಾದನೆಯಲ್ಲಿ ಕೆಲಸ ಮಾಡುತ್ತವೆ, ಸಿಎಸ್ 2 ಅನ್ನು ನಿಷ್ಕಾಸ ಅನಿಲಗಳಿಂದ ಸಂಗ್ರಹಿಸಿ ಅವುಗಳನ್ನು ಚಕ್ರಕ್ಕೆ ಹಿಂದಿರುಗಿಸುತ್ತದೆ. ಅಂತಹ ಅನುಸ್ಥಾಪನೆಗಳ ಉತ್ಪಾದಕತೆಯು ಗಂಟೆಗೆ ನೂರಾರು ಸಾವಿರ m3 ಶುದ್ಧೀಕರಿಸಿದ ಅನಿಲವನ್ನು ತಲುಪುತ್ತದೆ; ತುಂಬಾ ತೆಳುವಾದ ಸೂಕ್ಷ್ಮ ರಂಧ್ರಗಳನ್ನು ಹೊಂದಿರುವ ಆಡ್ಸರ್ಬೆಂಟ್-ಸಕ್ರಿಯ ಇಂಗಾಲ, ಅಂದರೆ. ಕಲ್ಲಿದ್ದಲು ಇದರಲ್ಲಿ ಸ್ಥಿರವಾಗಿರುತ್ತದೆ ಇ TOZM ಪ್ರಕಾರ (ಮೇಲೆ ನೋಡಿ) 20-25 kJ/mol ಆಗಿದೆ. ಇದೇ ಅರ್ಥ ಇ 0 ತುಂಬಾ ಕಡಿದಾದ ಐಸೊಥರ್ಮ್ಗೆ ಅನುರೂಪವಾಗಿದೆ, ಇದು ಉತ್ತಮ ಪುನರುತ್ಪಾದನೆಯ ಪರಿಸ್ಥಿತಿಗಳನ್ನು ಒದಗಿಸುತ್ತದೆ. ಅಂತಹ ಕಲ್ಲಿದ್ದಲುಗಳನ್ನು ಕರೆಯಲಾಗುತ್ತದೆ ಚೇತರಿಸಿಕೊಳ್ಳುವ. ನಿರ್ಜಲೀಕರಣವನ್ನು ಬಿಸಿನೀರಿನ ಆವಿಯಿಂದ ನಡೆಸಲಾಗುತ್ತದೆ. ಶಕ್ತಿಯನ್ನು ಉಳಿಸಲು, ಶೀತ ಮತ್ತು ಬಿಸಿ ಅನಿಲ ಹೊಳೆಗಳನ್ನು ಶಾಖ ವಿನಿಮಯಕಾರಕಗಳ ಮೂಲಕ ರವಾನಿಸಲಾಗುತ್ತದೆ.
ಅನಿಲಗಳು ಮತ್ತು ದ್ರವಗಳನ್ನು ಒಣಗಿಸುವುದು ಬಹಳ ಮುಖ್ಯ, ಉದಾ. ಪೆಟ್ರೋಲಿಯಂ ಅನಿಲಗಳುಅವುಗಳ ಸಂಸ್ಕರಣೆ ಅಥವಾ ನೈಸರ್ಗಿಕ ಮೊದಲು. ಸಾರಿಗೆ ಮೊದಲು ಅನಿಲಗಳು; ಆಡ್ಸರ್ಬೆಂಟ್ಗಳು - ಸಿಲಿಕಾ ಜೆಲ್ ಅಥವಾ ಜಿಯೋಲೈಟ್ಗಳು. ನಿರ್ಜಲೀಕರಣವನ್ನು ಬಿಸಿ ಮಾಡುವ ಮೂಲಕ ನಡೆಸಲಾಗುತ್ತದೆ. ಜಿಯೋಲೈಟ್ನ ನಿರ್ಜಲೀಕರಣವು ಹೆಚ್ಚಿನ ಶಕ್ತಿಯ ಬಳಕೆಗೆ ಸಂಬಂಧಿಸಿರುವುದರಿಂದ, ಸಂಯೋಜಿತ ಆಡ್ಸರ್ಬೆಂಟ್ ಅನ್ನು ಬಳಸಲಾಗುತ್ತದೆ: ಮೂಲಭೂತ. ತೇವಾಂಶದ ದ್ರವ್ಯರಾಶಿಯನ್ನು ಸುಲಭವಾಗಿ ಪುನರುತ್ಪಾದಿಸುವ ಸಿಲಿಕಾ ಜೆಲ್ ಮತ್ತು ಜಿಯೋಲೈಟ್ನಿಂದ ಆಳವಾದ ಒಣಗಿಸುವಿಕೆಯಿಂದ ಹೀರಿಕೊಳ್ಳಲಾಗುತ್ತದೆ.
ಉಷ್ಣ ಪುನರುತ್ಪಾದನೆಯೊಂದಿಗೆ, ಪೂರ್ಣ ಚಕ್ರವು ಒಳಗೊಂಡಿದೆ ಹೊರಹೀರುವಿಕೆ, ಆಡ್ಸರ್ಬೆಂಟ್ ಅನ್ನು ಬಿಸಿಮಾಡುವುದು, ಅದರ ನಿರ್ಜಲೀಕರಣ ಮತ್ತು ತಂಪಾಗಿಸುವಿಕೆ. ದೊಡ್ಡ ಸಂಖ್ಯೆಹಂತಗಳು ಪ್ರಕ್ರಿಯೆಯ ಕಡಿಮೆ ತೀವ್ರತೆ ಮತ್ತು ಹೆಚ್ಚಿನ ಶಕ್ತಿಯ ತೀವ್ರತೆಯನ್ನು ನಿರ್ಧರಿಸುತ್ತದೆ ಹೊರಹೀರುವಿಕೆಆದ್ದರಿಂದ, ಕರೆಯಲ್ಪಡುವ. ಸಣ್ಣ ಚಕ್ರದ ಸಸ್ಯಗಳು, ಸಂಪೂರ್ಣ ಚಕ್ರವು ಹಲವಾರು ತೆಗೆದುಕೊಳ್ಳುತ್ತದೆ. ನಿಮಿಷಗಳು. ಅವುಗಳಲ್ಲಿ, ಅರ್ಥದ ಅಡಿಯಲ್ಲಿ ಆಡ್ಸರ್ಬರ್ಗೆ ಅನಿಲವನ್ನು ಸರಬರಾಜು ಮಾಡಲಾಗುತ್ತದೆ. ಒತ್ತಡ, ನಂತರ ಬಿಡುಗಡೆಯಾಗುತ್ತದೆ ಮತ್ತು ನಿರ್ಜಲೀಕರಣ ಸಂಭವಿಸುತ್ತದೆ. ಇಡೀ ಪ್ರಕ್ರಿಯೆಯು ಬಹುತೇಕ ಐಸೊಥರ್ಮಲ್ ಆಗಿದೆ (ಐಸೊಥರ್ಮಾಲಿಟಿಯಿಂದ ವಿಚಲನವು ಶಾಖದ ಬಿಡುಗಡೆಯಿಂದ ಮಾತ್ರ ಉಂಟಾಗುತ್ತದೆ ಹೊರಹೀರುವಿಕೆಮತ್ತು ನಿರ್ಜಲೀಕರಣದ ಸಮಯದಲ್ಲಿ ಶಾಖ ಹೀರಿಕೊಳ್ಳುವಿಕೆ). ಸೈಕಲ್ ಹಂತಗಳು: ಹೊರಹೀರುವಿಕೆ, ಒತ್ತಡ ಬಿಡುಗಡೆ, ನಿರ್ಜಲೀಕರಣ, ಒತ್ತಡ ಏರಿಕೆ. ಆಮ್ಲಜನಕ-ಪುಷ್ಟೀಕರಿಸಿದ ಗಾಳಿಯನ್ನು ಉತ್ಪಾದಿಸಲು ಜಿಯೋಲೈಟ್ನೊಂದಿಗೆ ಅನುಸ್ಥಾಪನೆಗಳು ಒಂದು ಉದಾಹರಣೆಯಾಗಿದೆ.
ಆಡ್ಸರ್ಬೆಂಟ್ನ ಚಲಿಸುವ ಪದರವನ್ನು ಹೊಂದಿರುವ ಅನುಸ್ಥಾಪನೆಗಳಲ್ಲಿ (ಹೈಪರ್ಸರ್ಬರ್ಸ್ ಎಂದು ಕರೆಯಲ್ಪಡುವಲ್ಲಿ), ಎರಡನೆಯದು ಗುರುತ್ವಾಕರ್ಷಣೆಯ ಪ್ರಭಾವದ ಅಡಿಯಲ್ಲಿ ನಿಧಾನವಾಗಿ ಕಡಿಮೆಯಾಗುತ್ತದೆ ಮತ್ತು ಕೆಳಗಿನಿಂದ ತೆಗೆದುಹಾಕಲಾಗುತ್ತದೆ. ಆಡ್ಸರ್ಬರ್ನ ಭಾಗಗಳು ಮತ್ತು ಕರೆಯಲ್ಪಡುವಲ್ಲಿ ಕೊನೆಗೊಳ್ಳುತ್ತದೆ. ಏರ್ಲಿಫ್ಟ್, ಇದು ಆಡ್ಸರ್ಬೆಂಟ್ಗೆ ಸಮಾನಾಂತರವಾಗಿರುವ ಲಂಬ ಪೈಪ್ ಆಗಿದೆ. ಕಾಲಮ್. ಗಾಳಿಯ ಹರಿವು ಈ ಪೈಪ್ ಮೂಲಕ ಕೆಳಗಿನಿಂದ ಮೇಲಕ್ಕೆ ಚಲಿಸುತ್ತದೆ, ಇದು ಆಡ್ಸರ್ಬೆಂಟ್ ಧಾನ್ಯಗಳನ್ನು ಮೇಲಕ್ಕೆ ಎತ್ತುತ್ತದೆ. ಕಾಲಮ್ನ ಭಾಗ. ಸಂಸ್ಕರಿಸಿದ ಅನಿಲ ಹರಿವು ಆಡ್ಸರ್ಬರ್ನ ಮಧ್ಯ ಭಾಗವನ್ನು ಪ್ರವೇಶಿಸುತ್ತದೆ ಮತ್ತು ಆಡ್ಸರ್ಬೆಂಟ್ಗೆ ವಿರುದ್ಧವಾಗಿ ಮೇಲ್ಮುಖವಾಗಿ ಚಲಿಸುತ್ತದೆ. ಕಾಲಮ್ನ ಮೇಲ್ಭಾಗದಲ್ಲಿ ನಿರಂತರವಿದೆ ಹೊರಹೀರುವಿಕೆ, ಕೆಳಭಾಗದಲ್ಲಿ - ಆಡ್ಸರ್ಬೆಂಟ್ನ ಪುನರುತ್ಪಾದನೆ (ಇದನ್ನೂ ನೋಡಿ ಹೊರಹೀರುವಿಕೆ ಶುದ್ಧೀಕರಣ).
ಆಡ್ಸರ್ಬೆಂಟ್ನ ದ್ರವೀಕೃತ ("ಕುದಿಯುವ") ಹಾಸಿಗೆಯೊಂದಿಗಿನ ಅನುಸ್ಥಾಪನೆಗಳಲ್ಲಿ, ಕೆಳಗಿನಿಂದ ಆಡ್ಸರ್ಬರ್ಗೆ ಪ್ರವೇಶಿಸುವ ಅನಿಲ ಹರಿವು ಆಡ್ಸರ್ಬೆಂಟ್ ಅನ್ನು ಅಮಾನತುಗೊಳಿಸುವಿಕೆಗೆ ತರುತ್ತದೆ. ಅದೇ ಸಮಯದಲ್ಲಿ, ಆಡ್ಸರ್ಬೆಂಟ್ ಮತ್ತು ಅನಿಲದ ನಡುವಿನ ಸಾಮೂಹಿಕ ವರ್ಗಾವಣೆಯ ದಕ್ಷತೆಯು ತೀವ್ರವಾಗಿ ಹೆಚ್ಚಾಗುತ್ತದೆ ಮತ್ತು ಅವಧಿ ಹೊರಹೀರುವಿಕೆಮತ್ತು ನಿರ್ಜಲೀಕರಣ. ಅಂತಹ ಅನುಸ್ಥಾಪನೆಗಳು ಹೆಚ್ಚಿನ ಉತ್ಪಾದಕತೆಯನ್ನು ಹೊಂದಿವೆ. ತುಪ್ಪಳಕ್ಕೆ ಹೆಚ್ಚಿನ ಅವಶ್ಯಕತೆಗಳಿಂದ ಅವುಗಳ ವ್ಯಾಪಕ ವಿತರಣೆಯು ಅಡ್ಡಿಯಾಗುತ್ತದೆ. ಆಡ್ಸರ್ಬೆಂಟ್ ಧಾನ್ಯಗಳ ಶಕ್ತಿ (ಸಾಕಷ್ಟು ಶಕ್ತಿಯು ಅದರ ಸವೆತ ಮತ್ತು ಉಪಕರಣದಿಂದ ತೆಗೆದುಹಾಕುವಿಕೆಯಿಂದಾಗಿ ಆಡ್ಸರ್ಬೆಂಟ್ನ ಗಮನಾರ್ಹ ನಷ್ಟವನ್ನು ಉಂಟುಮಾಡುತ್ತದೆ).
ಮುಖ್ಯ ಆಡ್ಸರ್ಬೆಂಟ್ಗಳ ಅವಶ್ಯಕತೆಗಳು: ಹೆಚ್ಚಿನ ಆಡ್ಸರ್ಬ್. ಸಾಮರ್ಥ್ಯ, ಅಂದರೆ. ಅವುಗಳು ಹೆಚ್ಚಿನ ಬಡಿತದೊಂದಿಗೆ ಚದುರಿದ ದೇಹಗಳಾಗಿರಬೇಕು. ಮೇಲ್ಮೈ ಅಥವಾ ದೊಡ್ಡ ರಂಧ್ರದ ಪರಿಮಾಣದೊಂದಿಗೆ; ರಾಸಾಯನಿಕ ಮೇಲ್ಮೈಯ ಸ್ವರೂಪವು ಪರಿಣಾಮಕಾರಿಯಾಗಿರಬೇಕು ಹೊರಹೀರುವಿಕೆನಿರ್ದಿಷ್ಟ ಪರಿಸ್ಥಿತಿಗಳಲ್ಲಿ ಡೇಟಾ; ರಾಸಾಯನಿಕ ಮತ್ತು ಉಷ್ಣ ಬಾಳಿಕೆ, ಪುನರುತ್ಪಾದನೆ, ಪ್ರವೇಶಿಸುವಿಕೆ. ಗರಿಷ್ಠ ಸಕ್ರಿಯ ಇಂಗಾಲಗಳು, ಕೆಲವು ಆಕ್ಸೈಡ್ಗಳ ಜೆರೊಜೆಲ್ಗಳು (ಸಿಲಿಕಾ ಜೆಲ್ಗಳು, ಅಲ್ಯೂಮಿನಿಯಂ ಜೆಲ್ಗಳು, ಇತ್ಯಾದಿ), ಜಿಯೋಲೈಟ್ಗಳು ವ್ಯಾಪಕವಾಗಿ ಹರಡಿವೆ; ನಾನ್-ಪೋರಸ್ ಆಡ್ಸರ್ಬೆಂಟ್ಸ್-ಟೆಕ್ನ್ ನಿಂದ. ಕಾರ್ಬನ್ (ಮಸಿ) ಮತ್ತು ಹೆಚ್ಚು ಚದುರಿದ SiO 2 (ಏರೋಸಿಲ್, "ಬಿಳಿ ಮಸಿ").
ಹೊರಹೀರುವಿಕೆ ತಂತ್ರಜ್ಞಾನದ ಅನ್ವಯದ ಪ್ರದೇಶಗಳು
ಗೋಚರತೆಯ ಮೇಲೆ ಹೊರಹೀರುವಿಕೆಅನೇಕರಿಂದ ಸ್ಥಾಪಿಸಲ್ಪಟ್ಟಿದೆ ಹಾನಿಕಾರಕ ಕಲ್ಮಶಗಳಿಂದ ಗಾಳಿಯನ್ನು ಶುದ್ಧೀಕರಿಸುವ ವಿಧಾನಗಳು (ನೋಡಿ. ಅನಿಲ ಶುದ್ಧೀಕರಣ),ನೀರು (ನೋಡಿ ನೀರಿನ ಚಿಕಿತ್ಸೆ),ಹಾಗೆಯೇ ಸಕ್ಕರೆ ಉತ್ಪಾದನೆಗೆ ಸಕ್ಕರೆ ಪಾಕಗಳು, ಹಣ್ಣಿನ ರಸಗಳು ಮತ್ತು ಆಹಾರದಲ್ಲಿನ ಇತರ ದ್ರವಗಳು. ಉದ್ಯಮ, ತ್ಯಾಜ್ಯ ನಯಗೊಳಿಸುವ ತೈಲಗಳು. ಘನ ಆಡ್ಸರ್ಬೆಂಟ್ಗಳನ್ನು ಬಳಸಿಕೊಂಡು ಅನಿಲಗಳು ಮತ್ತು ದ್ರವಗಳಿಂದ ಹಾನಿಕಾರಕ ಕಲ್ಮಶವಾಗಿ ತೇವಾಂಶವನ್ನು ತೆಗೆದುಹಾಕುವುದು ಹೊರಹೀರುವಿಕೆಯ ಪ್ರಮುಖ ಶಾಖೆಗಳಲ್ಲಿ ಒಂದಾಗಿದೆ. ತಂತ್ರಗಳು (ಇದನ್ನೂ ನೋಡಿ ಅನಿಲ ಒಣಗಿಸುವಿಕೆ).
ಆಡ್ಸರ್ಬ್ಟ್ಗಳ ಮೇಲೆ. ಪದಾರ್ಥಗಳ ಮಿಶ್ರಣಗಳ ಉತ್ತಮವಾದ ಬೇರ್ಪಡಿಕೆ ಮತ್ತು ಸಂಕೀರ್ಣ ಮಿಶ್ರಣಗಳಿಂದ ಕೆಲವು ಘಟಕಗಳ ಪ್ರತ್ಯೇಕತೆಯ ಆಧಾರದ ಮೇಲೆ ಪ್ರಕ್ರಿಯೆಗಳು. ಸರ್ಫ್ಯಾಕ್ಟಂಟ್ಗಳ ಉತ್ಪಾದನೆಗೆ ಸಾಮಾನ್ಯ ಹೈಡ್ರೋಕಾರ್ಬನ್ಗಳನ್ನು ಪಡೆಯುವ ಸಲುವಾಗಿ ಆಲ್ಕೇನ್ ಐಸೋಮರ್ಗಳನ್ನು ಬೇರ್ಪಡಿಸುವುದು, ಮೋಟಾರು ಇಂಧನಗಳ ಉತ್ಪಾದನೆಯಲ್ಲಿ ತೈಲಗಳನ್ನು ಬೇರ್ಪಡಿಸುವುದು ಉದಾಹರಣೆಗಳಾಗಿವೆ. ಫಾರ್ ಅನಿಲ ಮಿಶ್ರಣಗಳುಹೀರಿಕೊಳ್ಳುತ್ತದೆ. ಆಮ್ಲಜನಕದಿಂದ ಸಮೃದ್ಧವಾಗಿರುವ ಗಾಳಿಯನ್ನು ಪಡೆಯಲು ಬೇರ್ಪಡಿಸುವ ವಿಧಾನಗಳನ್ನು ಬಳಸಲಾಗುತ್ತದೆ (ಬಹುತೇಕ ಶುದ್ಧ O 2 ವರೆಗೆ); ಬಹುವಚನದಲ್ಲಿ ಸಂದರ್ಭಗಳಲ್ಲಿ, ಈ ವಿಧಾನಗಳು ಸರಿಪಡಿಸುವಿಕೆಯೊಂದಿಗೆ ಯಶಸ್ವಿಯಾಗಿ ಸ್ಪರ್ಧಿಸುತ್ತವೆ (ನೋಡಿ. ವಾಯು ಬೇರ್ಪಡಿಕೆ).
ಆಡ್ಸರ್ಬ್ಗಳ ಅನ್ವಯದ ವೇಗವಾಗಿ ಅಭಿವೃದ್ಧಿ ಹೊಂದುತ್ತಿರುವ ಪ್ರದೇಶ. ವೈದ್ಯಕೀಯ ತಂತ್ರಜ್ಞಾನ, ಅಲ್ಲಿ ಅದು ಹೊರತೆಗೆಯಲು ಕಾರ್ಯನಿರ್ವಹಿಸುತ್ತದೆ ಹಾನಿಕಾರಕ ಪದಾರ್ಥಗಳುರಕ್ತದಿಂದ (ಹೆಮೊಸಾರ್ಪ್ಶನ್ ವಿಧಾನ), ಇತ್ಯಾದಿ. ಫಿಸಿಯೋಲ್. ದ್ರವಗಳು. ಸಂತಾನಹೀನತೆಗೆ ಹೆಚ್ಚಿನ ಅವಶ್ಯಕತೆಗಳು ಸೂಕ್ತವಾದ ಆಡ್ಸರ್ಬೆಂಟ್ಗಳನ್ನು ಆಯ್ಕೆಮಾಡಲು ಬಹಳ ಕಷ್ಟಕರವಾದ ಕೆಲಸವನ್ನು ಒಡ್ಡುತ್ತವೆ. ಇವುಗಳಲ್ಲಿ ವಿಶೇಷವಾಗಿ ಸಿದ್ಧಪಡಿಸಲಾದ ಸಕ್ರಿಯ ಇಂಗಾಲಗಳು ಸೇರಿವೆ.
ಬೆಳಗಿದ.:ಬ್ರೂನರ್ ಎಸ್., ಅನಿಲಗಳು ಮತ್ತು ಆವಿಗಳ ಹೊರಹೀರುವಿಕೆ, ಟ್ರಾನ್ಸ್. ಇಂಗ್ಲಿಷ್ನಿಂದ, ಸಂಪುಟ 1, M., 1948; ಡಿ ಬೋಯರ್ I, ಹೊರಹೀರುವಿಕೆಯ ಡೈನಾಮಿಕ್ ಪ್ರಕೃತಿ, ಟ್ರಾನ್ಸ್. ಇಂಗ್ಲಿಷ್ನಿಂದ, M., 1962; ಹೊರಹೀರುವಿಕೆ ಮತ್ತು ಸರಂಧ್ರತೆ, ಸಂ. M. M. ಡುಬಿನಿನಾ [ಇತ್ಯಾದಿ.], M., 1976; ಕೆಲೀವ್ ಎನ್.ವಿ., ಫಂಡಮೆಂಟಲ್ಸ್ ಆಫ್ ಅಡ್ಸರ್ಪ್ಶನ್ ಟೆಕ್ನಾಲಜಿ, 2ನೇ ಆವೃತ್ತಿ, ಎಂ., 1984; ಯಂಗ್ D.M., ಕ್ರೋವೆಲ್ A.D., ಅನಿಲಗಳ ಭೌತಿಕ ಹೊರಹೀರುವಿಕೆ, L., 1962. ಎಂ.ಎಂ.ಡುಬಿನಿನ್, ವಿ.ವಿ. ಸಿಯರ್ಪಿನ್ಸ್ಕಿ.
ಲೇಖನದ ಶೀರ್ಷಿಕೆಯಲ್ಲಿ ಮೊದಲ ಅಕ್ಷರವನ್ನು ಆಯ್ಕೆಮಾಡಿ:
ಹೀರಿಕೊಳ್ಳುವಿಕೆಯು ಇಂಟರ್ಫೇಸ್ನಲ್ಲಿ ನಡೆಯುತ್ತದೆ. ಆದ್ದರಿಂದ, ಮೇಲ್ಮೈ ವಿದ್ಯಮಾನಗಳ ಥರ್ಮೋಡೈನಾಮಿಕ್ ವಿವರಣೆಯನ್ನು ಪರಿಗಣಿಸುವುದು ಸಮಂಜಸವಾಗಿದೆ ವಿಶೇಷ ಪ್ರಕರಣವೈವಿಧ್ಯಮಯ ವ್ಯವಸ್ಥೆಗಳ ಥರ್ಮೋಡೈನಾಮಿಕ್ಸ್.
ಅಕ್ಕಿ. 3.4. ಗಿಬ್ಸ್ ಹೀರಿಕೊಳ್ಳುವಿಕೆ: 1- ಎರಡು-ಹಂತದ ಹೋಲಿಕೆ ವ್ಯವಸ್ಥೆ, 2- ಏಕರೂಪವಲ್ಲದ ಪ್ರದೇಶದೊಂದಿಗೆ ನೈಜ ಎರಡು-ಹಂತದ ವ್ಯವಸ್ಥೆ
ಭಿನ್ನಜಾತಿಯ ವ್ಯವಸ್ಥೆಗಳ ಥರ್ಮೋಡೈನಾಮಿಕ್ಸ್ನಲ್ಲಿ ಇದನ್ನು ಬಳಸಲಾಗುತ್ತದೆ ಸಂಕಲನ ತತ್ವಅದು ಈ ಕೆಳಗಿನಂತಿದೆ: ವೈವಿಧ್ಯಮಯ ವ್ಯವಸ್ಥೆಯ ಎಲ್ಲಾ ವ್ಯಾಪಕ ಗುಣಲಕ್ಷಣಗಳು ಹಂತಗಳು ಸಂಪರ್ಕಕ್ಕೆ ಬರುವ ಮೊದಲು ಹೊಂದಿದ್ದ ಅನುಗುಣವಾದ ವ್ಯಾಪಕ ಗುಣಲಕ್ಷಣಗಳ ಮೊತ್ತಕ್ಕೆ ಸಮಾನವಾಗಿರುತ್ತದೆ.ನಾವು ಹಂತಗಳನ್ನು α ಮತ್ತು β ಮೂಲಕ ಸೂಚಿಸೋಣ (ಚಿತ್ರ 4). ನಂತರ ಒಂದು ಆದರ್ಶ ವ್ಯವಸ್ಥೆಗಾಗಿ, ಇಂಟರ್ಫೇಸ್ ಬಳಿಯ ಹಂತಗಳ ಗುಣಲಕ್ಷಣಗಳು ಅವುಗಳ ಬೃಹತ್ ಗುಣಲಕ್ಷಣಗಳೊಂದಿಗೆ ಹೊಂದಿಕೆಯಾಗುತ್ತವೆ, ಈ ಕೆಳಗಿನ ಸಂಬಂಧಗಳು ಆಂತರಿಕ ಶಕ್ತಿಯ U, ಪರಿಮಾಣ V, ದ್ರವ್ಯರಾಶಿ (ಮೋಲ್ಗಳ ಸಂಖ್ಯೆ) n, ಎಂಟ್ರೊಪಿ S ಗೆ ಸಮತೋಲನವನ್ನು ಸ್ಥಾಪಿಸಿದ ನಂತರ ಮಾನ್ಯವಾಗಿರುತ್ತವೆ. ವೈವಿಧ್ಯಮಯ ವ್ಯವಸ್ಥೆ:
U = U α + U β, V = V α + V β, n = n α + n β, S = S α + S β
ಎರಡೂ ಹಂತಗಳಲ್ಲಿನ ತಾಪಮಾನ ಮತ್ತು ಒತ್ತಡವು ಒಂದೇ ಆಗಿರುತ್ತದೆ ಎಂದು ಇದು ಊಹಿಸುತ್ತದೆ.
ನೈಜ ಭಿನ್ನಜಾತಿಯ ವ್ಯವಸ್ಥೆಗಳಿಗೆ, ಎರಡು ಹಂತಗಳ ಗಡಿಯಲ್ಲಿರುವ ಪರಿವರ್ತನೆಯ ಪ್ರದೇಶವು ವ್ಯವಸ್ಥೆಯ ವ್ಯಾಪಕ ಗುಣಲಕ್ಷಣಗಳಿಗೆ ಹೆಚ್ಚುವರಿ ಕೊಡುಗೆಯನ್ನು ನೀಡುತ್ತದೆ. ಮೇಲ್ಮೈ ವಿದ್ಯಮಾನಗಳು ಸಂಭವಿಸಿದಲ್ಲಿ, ನಿಜವಾದ ವೈವಿಧ್ಯಮಯ ವ್ಯವಸ್ಥೆಯ ವ್ಯಾಪಕ ಗುಣಲಕ್ಷಣಗಳು ಮತ್ತು ಮೇಲ್ಮೈ ವಿದ್ಯಮಾನಗಳು ಇಲ್ಲದಿರುವ ಮಾದರಿ ವ್ಯವಸ್ಥೆಯ ವ್ಯಾಪಕ ಗುಣಲಕ್ಷಣಗಳ ನಡುವಿನ ವ್ಯತ್ಯಾಸವನ್ನು ಒಬ್ಬರು ಗಣನೆಗೆ ತೆಗೆದುಕೊಳ್ಳಬೇಕು. ಅಂತಹ ವ್ಯವಸ್ಥೆಯನ್ನು ಹೋಲಿಕೆ ವ್ಯವಸ್ಥೆ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಹೋಲಿಕೆ ವ್ಯವಸ್ಥೆಯು ಅದೇ ತೀವ್ರವಾದ ನಿಯತಾಂಕಗಳನ್ನು ಹೊಂದಿದೆ (T, P, C i ...) ಮತ್ತು ಅದೇ ಪರಿಮಾಣ V ನೈಜ ಸಿಸ್ಟಮ್ (Fig. 4).
ಥರ್ಮೋಡೈನಾಮಿಕ್ ದೃಷ್ಟಿಕೋನದಿಂದ, ಹೊರಹೀರುವಿಕೆ ಮೌಲ್ಯ G ಯನ್ನು ಮೋಲ್ ಅಥವಾ ಗ್ರಾಂಗಳಲ್ಲಿ ವ್ಯಕ್ತಪಡಿಸಿದ ವಸ್ತುವಿನ ಹೆಚ್ಚುವರಿ ಪ್ರಮಾಣ ಎಂದು ಅರ್ಥೈಸಲಾಗುತ್ತದೆ, ಇದು ಇಂಟರ್ಫೇಸ್ ಪ್ರದೇಶ ಅಥವಾ ಮೇಲ್ಮೈ ಪ್ರದೇಶಕ್ಕೆ ಸಂಬಂಧಿಸಿದ ಉಲ್ಲೇಖ ವ್ಯವಸ್ಥೆಗೆ ಹೋಲಿಸಿದರೆ ನಿಜವಾದ ವೈವಿಧ್ಯಮಯ ವ್ಯವಸ್ಥೆಯು ಹೊಂದಿದೆ. ಆಡ್ಸರ್ಬೆಂಟ್ A. ಹೋಲಿಕೆ ವ್ಯವಸ್ಥೆಯು ಒಂದೇ ರೀತಿಯ ತೀವ್ರವಾದ ನಿಯತಾಂಕಗಳನ್ನು (T, P, C i), ಮತ್ತು ಅದೇ ಪರಿಮಾಣವನ್ನು (V = V α + V β) ನೈಜ ವ್ಯವಸ್ಥೆಯಂತೆಯೇ (ಚಿತ್ರ 4) ಹೊಂದಿದೆ ಎಂದು ಊಹಿಸಲಾಗಿದೆ. .
Г = (n - n α - n β)/A = n s /A 3.11
ನೈಜ ವ್ಯವಸ್ಥೆಯ ಪರಿವರ್ತನೆಯ ಪ್ರದೇಶದ ಹೆಚ್ಚುವರಿ ಥರ್ಮೋಡೈನಾಮಿಕ್ ಕಾರ್ಯಗಳನ್ನು (ನಾವು ಅವುಗಳನ್ನು ಸೂಚ್ಯಂಕ s ಮೂಲಕ ಸೂಚಿಸುತ್ತೇವೆ) ಹೀಗೆ ಬರೆಯಬಹುದು
U s = U - U α - U β , n s = n - n α - n β , S s = S - S α - S βಇತ್ಯಾದಿ
ಹೊರಹೀರುವಿಕೆಯ ಪ್ರಾಯೋಗಿಕ ಮಾಪನಗಳು ಯಾವಾಗಲೂ ಹೊರಹೀರುವಿಕೆಯನ್ನು ನಿಖರವಾಗಿ ಒಂದು ಘಟಕದ ಹೆಚ್ಚುವರಿಯಾಗಿ ನೀಡುತ್ತದೆ ನಿಜವಾದ ವ್ಯವಸ್ಥೆಆಯ್ಕೆಮಾಡಿದ ಹೋಲಿಕೆ ವ್ಯವಸ್ಥೆಗೆ ಹೋಲಿಸಿದರೆ. ಉದಾಹರಣೆಗೆ, ಘನ ಆಡ್ಸರ್ಬೆಂಟ್ನಲ್ಲಿ ಅನಿಲದ ಹೊರಹೀರುವಿಕೆ ಅಥವಾ ಘನ ಹಂತದಲ್ಲಿ ಘಟಕಗಳ ಹೊರಹೀರುವಿಕೆ, ಹೊರಹೀರುವಿಕೆ ಮೌಲ್ಯಗಳನ್ನು ಕಂಡುಹಿಡಿಯಲು, α ಮತ್ತು β ಹಂತಗಳ ಸಂಪರ್ಕದ ನಂತರ ಆಡ್ಸೋರ್ಬೇಟ್ನ ಆರಂಭಿಕ ಸಾಂದ್ರತೆಯ ಬದಲಾವಣೆಯನ್ನು ನಿರ್ಧರಿಸಿ.
n i s = V(C i o - C i),
ಎಲ್ಲಿ ಸಿ ಐ ಓ- i-th ಘಟಕದ ಆರಂಭಿಕ ಸಾಂದ್ರತೆ, ಸಿ ಐ- ಸಂಪರ್ಕಿಸುವ ಹಂತಗಳ ನಡುವೆ ಸಮತೋಲನವನ್ನು ಸ್ಥಾಪಿಸಿದ ನಂತರ i-th ಘಟಕದ ಸಾಂದ್ರತೆ. ಸಂಪುಟ ಎಂದು ನಂಬಲಾಗಿದೆ ವಿಬದಲಾಗುವುದಿಲ್ಲ. ಆದಾಗ್ಯೂ, ಏಕಾಗ್ರತೆ iನೇ ಘಟಕ ಸಿ ಐ, ಪ್ರಾಯೋಗಿಕವಾಗಿ ಪಡೆದ, ಪರಿಮಾಣದಲ್ಲಿ ನಿರ್ಧರಿಸಲಾಗುತ್ತದೆ ವಿ'ಪರಿವರ್ತನಾ ಪದರದ ಅಸಮಂಜಸ ಪ್ರದೇಶದ ಪರಿಮಾಣವನ್ನು ಗಣನೆಗೆ ತೆಗೆದುಕೊಳ್ಳದೆ ಇಂಟರ್ಫೇಸ್ ಮೇಲೆ ವಿ αಏಕಾಗ್ರತೆ ಇರುವ ಇಂಟರ್ಫೇಸ್ನಲ್ಲಿ C i α. ಹೀಗಾಗಿ, ನೈಜ ವ್ಯವಸ್ಥೆಯಲ್ಲಿ ಅಸಮಂಜಸ ಪ್ರದೇಶದ ಅಸ್ತಿತ್ವದಿಂದಾಗಿ, ವ್ಯವಸ್ಥೆಯ ಒಟ್ಟು ಪರಿಮಾಣವನ್ನು ಹೀಗೆ ಪ್ರತಿನಿಧಿಸಬಹುದು V = V' + Vα. ಎಲ್ಲಾ ಪ್ರಮಾಣ i-ನೇ ಘಟಕ ಸಿ ಐ ಓಈ ಎರಡು ಸಂಪುಟಗಳ ನಡುವೆ ವಿತರಿಸಲಾಗುವುದು:
V C i o = V' C i + V α C i α,
ಮತ್ತು ಘಟಕದ ಮೋಲ್ಗಳ ಸಂಖ್ಯೆ i, ಇಂಟರ್ಫೇಸ್ನಲ್ಲಿ ಹೀರಿಕೊಳ್ಳಲಾಗುತ್ತದೆ, ಇದು ಸಮಾನವಾಗಿರುತ್ತದೆ
n i s = (V'C i + V α C i α) - (V' + V α) C i = V α (C i α - C i) 3.12
ಆ. ಪ್ರಾಯೋಗಿಕವಾಗಿ ನಿರ್ಧರಿಸಲಾದ ಹೊರಹೀರುವಿಕೆಯು ಹಂತದ ಇಂಟರ್ಫೇಸ್ನಿಂದ ದೂರದಲ್ಲಿರುವ ಅದೇ ಪರಿಮಾಣದಲ್ಲಿನ ಈ ಘಟಕದ ಪ್ರಮಾಣಕ್ಕೆ ಹೋಲಿಸಿದರೆ V α ಪರಿಮಾಣದಲ್ಲಿನ i-th ಘಟಕದ ಅಧಿಕವಾಗಿದೆ. ಈ ರೀತಿಯ ಹೊರಹೀರುವಿಕೆಯನ್ನು ಗಿಬ್ಸ್ ಹೀರಿಕೊಳ್ಳುವಿಕೆ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. .
V α C i αಎಂದು ಕರೆದರು ಪೂರ್ಣ ವಿಷಯ ನಾನು-ಹೊರಹೀರುವಿಕೆ ಪದರದಲ್ಲಿ ನೇ ಘಟಕ. ಅತ್ಯಂತ ಕಡಿಮೆ ಸಾಂದ್ರತೆಯ ಪ್ರದೇಶದಲ್ಲಿ ಸಿ ಐಪರಿಮಾಣದಲ್ಲಿ ವಿ'ತಿದ್ದುಪಡಿ V α C iಸಮೀಕರಣವನ್ನು (3.2) ನಿರ್ಲಕ್ಷಿಸಬಹುದು ಮತ್ತು ಅಳತೆ ಮಾಡಿದ ಮೌಲ್ಯವನ್ನು ಪರಿಗಣಿಸಬಹುದು V α C i αಪೂರ್ಣ ವಿಷಯ ನಾನು-ಹೊರಹೀರುವಿಕೆ ಪದರದಲ್ಲಿ th ಘಟಕ, ಉದಾಹರಣೆಗೆ, ಕಡಿಮೆ ಒತ್ತಡದಲ್ಲಿ ಘನ ಆಡ್ಸರ್ಬೆಂಟ್ ಮೇಲೆ ಅನಿಲ ಹೊರಹೀರುವಿಕೆಯ ಸಮಯದಲ್ಲಿ.
ಪ್ರಸ್ತುತ ಪುಟ: 6 (ಪುಸ್ತಕವು ಒಟ್ಟು 19 ಪುಟಗಳನ್ನು ಹೊಂದಿದೆ) [ಲಭ್ಯವಿರುವ ಓದುವ ಮಾರ್ಗ: 13 ಪುಟಗಳು]
ಫಾಂಟ್:
100% +
34. ಹೀರಿಕೊಳ್ಳುವ ಶಕ್ತಿಗಳ ಸ್ವರೂಪ
ಕರೆಯಲ್ಪಡುವ ಸಮಯದಲ್ಲಿ ಆಡ್ಸರ್ಬೆಂಟ್ನ ಮೇಲ್ಮೈಯೊಂದಿಗೆ ಆಡ್ಸರ್ಬೆಂಟ್ ಅಣುಗಳ ನಡುವಿನ ಪರಸ್ಪರ ಕ್ರಿಯೆ. ಭೌತಿಕ ಹೊರಹೀರುವಿಕೆ ವಿವಿಧ ಕಾರಣಗಳಿಂದಾಗಿರಬಹುದು. ನಂತರ ಧ್ರುವೀಯವಲ್ಲದ ಆಡ್ಸರ್ಬೆಂಟ್ನ ಒಂದು ಪರಮಾಣುವಿನೊಂದಿಗೆ ಒಂದು ಆಡ್ಸರ್ಬೆಂಟ್ ಅಣುವಿನ ಪರಸ್ಪರ ಕ್ರಿಯೆಯನ್ನು ನಿರ್ಧರಿಸುವ ಸಂಭಾವ್ಯತೆಯನ್ನು ಈ ಕೆಳಗಿನಂತೆ ವ್ಯಕ್ತಪಡಿಸಬಹುದು:
θ = −Cr 6 +Br 12 ,
ಇಲ್ಲಿ r ಎಂಬುದು ಕಣಗಳ ಕೇಂದ್ರಗಳ ನಡುವಿನ ಅಂತರವಾಗಿದೆ; ಸಿ - ಪ್ರಸರಣ ಆಕರ್ಷಣೆ ಸ್ಥಿರ; ಬಿ ಸ್ಥಿರಾಂಕವಾಗಿದ್ದು ಅದು ವಿಕರ್ಷಣ ಶಕ್ತಿಗಳ ಶಕ್ತಿಯನ್ನು ನಿರೂಪಿಸುತ್ತದೆ.
ತುಲನಾತ್ಮಕವಾಗಿ ದೂರದ ಅಂತರದಲ್ಲಿ ಆಕರ್ಷಣೆಯ ಶಕ್ತಿಗಳು ಮೇಲುಗೈ ಸಾಧಿಸಬೇಕು ಮತ್ತು ಹತ್ತಿರದ ದೂರದಲ್ಲಿ ವಿಕರ್ಷಣೆಯ ಶಕ್ತಿಗಳು ಮೇಲುಗೈ ಸಾಧಿಸಬೇಕು ಎಂಬುದು ಸ್ಪಷ್ಟವಾಗಿದೆ. ಅಲ್ಲದೆ, ಕೆಲವು ದೂರದಲ್ಲಿ ಈ ಶಕ್ತಿಗಳು ಸಮಾನವಾಗಿರಬೇಕು, ಅದು ಕನಿಷ್ಠಕ್ಕೆ ಅನುಗುಣವಾಗಿರುತ್ತದೆ ಉಚಿತ ಶಕ್ತಿ. ಆದರೆ ಹೊರಹೀರುವಿಕೆಯ ಸಮಯದಲ್ಲಿ, ಪ್ರಸರಣ ಶಕ್ತಿಗಳು ಪ್ರತಿ ಧ್ರುವೀಯವಲ್ಲದ ಕಣಗಳ ನಡುವೆ ಏಕಕಾಲದಲ್ಲಿ ಕಾರ್ಯನಿರ್ವಹಿಸುತ್ತವೆ ಎಂಬುದನ್ನು ಗಮನಿಸುವುದು ಮುಖ್ಯವಾಗಿದೆ.
ಕಣಗಳ ಪರಸ್ಪರ ಕ್ರಿಯೆಯ ಶಕ್ತಿಯು ದೂರದೊಂದಿಗೆ ತ್ವರಿತವಾಗಿ ಕಡಿಮೆಯಾಗುವುದರಿಂದ, ಹೊರಹೀರುವಿಕೆ ಶಕ್ತಿಗಳ ಸಾಮರ್ಥ್ಯವನ್ನು ನಿರ್ಧರಿಸಲು ಆಡ್ಸರ್ಬೆಂಟ್ನ ಹತ್ತಿರದ ಪರಮಾಣುಗಳ ಮೇಲೆ ಸಂಕಲನವನ್ನು ಕೈಗೊಳ್ಳಲು ಸಾಕು. ಸಂಕೀರ್ಣವಾದ ಧ್ರುವೀಯ ಅಣುಗಳ ಹೊರಹೀರುವಿಕೆಯ ಸಮಯದಲ್ಲಿ, ಸಂಭಾವ್ಯ ಶಕ್ತಿಯನ್ನು ಅಣು ಘಟಕಗಳ ಎಲ್ಲಾ ಸಂಭಾವ್ಯ ಹೊರಹೀರುವಿಕೆ ಶಕ್ತಿಗಳ ಮೊತ್ತವಾಗಿ ಅಂದಾಜು ಮಾಡಬಹುದು.
ಆಡ್ಸರ್ಬೆಂಟ್ ಅಯಾನುಗಳನ್ನು ಹೊಂದಿದ್ದರೆ, ಈಗಾಗಲೇ ತಿಳಿದಿರುವ ಪ್ರಸರಣ ಶಕ್ತಿಗಳ ಕ್ರಿಯೆಯು ದ್ವಿಧ್ರುವಿಗಳ ಆಕರ್ಷಣೆಯ ಅನುಗಮನದ ಶಕ್ತಿಗಳ ಕ್ರಿಯೆಯಿಂದ ಪೂರಕವಾಗಬಹುದು, ಅದು ವಿದ್ಯುತ್ ಕ್ಷೇತ್ರದಿಂದ ಆಡ್ಸರ್ಬೆಂಟ್ನ ಅಣುಗಳಲ್ಲಿ ಪ್ರಚೋದಿಸಲ್ಪಡುತ್ತದೆ, ಅದು ಪ್ರತಿಯಾಗಿ, ಆಡ್ಸರ್ಬೆಂಟ್ ಲ್ಯಾಟಿಸ್ನ ಅಯಾನುಗಳಿಂದ ರಚಿಸಲಾಗಿದೆ.
ಅಂತಹ ಪರಸ್ಪರ ಕ್ರಿಯೆಯೊಂದಿಗೆ, ಹೊರಹೀರುವಿಕೆಯ ಪರಸ್ಪರ ಕ್ರಿಯೆಯಲ್ಲಿನ ಅನುಗಮನದ ಶಕ್ತಿಗಳ ಪಾಲು ಆಡ್ಸರ್ಬೆಂಟ್ ಅಣುವಿನ ಧ್ರುವೀಕರಣಕ್ಕೆ ಮತ್ತು ಈ ಆಡ್ಸರ್ಬೆಂಟ್ ಮೇಲ್ಮೈಯಲ್ಲಿ ಕ್ಷೇತ್ರದ ಬಲದ ವರ್ಗಕ್ಕೆ ಅನುಗುಣವಾಗಿರಬಹುದು.
ಆಡ್ಸರ್ಬೆಂಟ್ನ ಧ್ರುವೀಯ ಅಣುಗಳ ಹೊರಹೀರುವಿಕೆ ಧ್ರುವೀಯ ಆಡ್ಸರ್ಬೆಂಟ್ನಲ್ಲಿ ಸಂಭವಿಸಿದರೆ, ಈ ಸಂದರ್ಭದಲ್ಲಿ ದ್ವಿಧ್ರುವಿಗಳು ಆಡ್ಸರ್ಬೆಂಟ್ನ ಪರಮಾಣುಗಳನ್ನು ಧ್ರುವೀಕರಿಸುತ್ತವೆ, ಅಂದರೆ, ಅವುಗಳು ಅವುಗಳಲ್ಲಿ ವಿದ್ಯುತ್ ಕ್ಷಣಗಳನ್ನು ಪ್ರೇರೇಪಿಸುತ್ತವೆ. ಈ ಪ್ರಭಾವದಿಂದಾಗಿ, ಪ್ರಸರಣದ ಪರಸ್ಪರ ಕ್ರಿಯೆಗೆ ಅನುಗಮನದ ಪರಸ್ಪರ ಕ್ರಿಯೆಯನ್ನು ಸೇರಿಸಲಾಗುತ್ತದೆ.
ಅನುಗಮನದ ಪರಸ್ಪರ ಕ್ರಿಯೆಯು ಸಾಮಾನ್ಯವಾಗಿ ಚಿಕ್ಕದಾಗಿದೆ ಮತ್ತು ಆಡ್ಸರ್ಬೆಂಟ್ ಅಣುವಿನ ದ್ವಿಧ್ರುವಿ ಮತ್ತು ಆಡ್ಸರ್ಬೆಂಟ್ನ ಧ್ರುವೀಯತೆಯನ್ನು ಅವಲಂಬಿಸಿ, ದೊಡ್ಡ ಮೌಲ್ಯಗಳನ್ನು ತಲುಪಬಹುದು. ಮೇಲ್ಮೈಯಲ್ಲಿ ಅಯಾನುಗಳು ಅಥವಾ ದ್ವಿಧ್ರುವಿಗಳನ್ನು ಹೊಂದಿರುವ ಆಡ್ಸರ್ಬೆಂಟ್ನಲ್ಲಿ ಅಣುಗಳು ಹೀರಿಕೊಳ್ಳಲ್ಪಟ್ಟರೆ, ಕರೆಯಲ್ಪಡುವ ಆಡ್ಸರ್ಬೆಂಟ್ನ ಸ್ಥಾಯೀವಿದ್ಯುತ್ತಿನ ಕ್ಷೇತ್ರದೊಂದಿಗೆ ಆಡ್ಸರ್ಬೆಂಟ್ನ ಅಯಾನುಗಳು ಅಥವಾ ದ್ವಿಧ್ರುವಿಗಳ ಪರಸ್ಪರ ಕ್ರಿಯೆ.
ಈ ಸಂದರ್ಭದಲ್ಲಿ, ಆಡ್ಸರ್ಬೆಂಟ್ನ ಅಣುಗಳು ಆಡ್ಸರ್ಬೆಂಟ್ ಕ್ಷೇತ್ರದಲ್ಲಿ ಸಹ ಆಧಾರಿತವಾಗಬಹುದು ಮತ್ತು ಓರಿಯೆಂಟೇಶನಲ್ ಕೂಲಂಬ್ ಪರಸ್ಪರ ಕ್ರಿಯೆಯು ಸಂಭವಿಸುತ್ತದೆ. ಅನುಗಮನದ ಮತ್ತು ಓರಿಯೆಂಟೇಶನಲ್ ಪರಸ್ಪರ ಕ್ರಿಯೆಗಳ ಶಕ್ತಿಯು ಪ್ರಸರಣ ಸಂವಹನಗಳ ಶಕ್ತಿಗಿಂತ ಕಡಿಮೆಯಿರುತ್ತದೆ ಮತ್ತು ಆದ್ದರಿಂದ ಇಂಟರ್ಮೋಲಿಕ್ಯುಲರ್ ಆಕರ್ಷಣೆಯ ಶಕ್ತಿಯನ್ನು ಪ್ರಸರಣ ಆಕರ್ಷಣೆಯ ಶಕ್ತಿಯಿಂದ ನಿರ್ಧರಿಸಲಾಗುತ್ತದೆ ಎಂದು ಒಪ್ಪಿಕೊಳ್ಳಲಾಗಿದೆ.
ಹೈಡ್ರೋಜನ್ ಬಂಧದ ರಚನೆಯಿಂದಲೂ ಹೊರಹೀರುವಿಕೆ ಉಂಟಾಗುತ್ತದೆ. ಮೇಲ್ಮೈಯಲ್ಲಿ ನೀರು, ಆಲ್ಕೋಹಾಲ್ಗಳು, ಅಮೋನಿಯಾ ಮತ್ತು ಅಮೈನ್ಗಳಂತಹ ಅಣುಗಳ ಹೈಡ್ರಾಕ್ಸಿಲ್ ಗುಂಪುಗಳನ್ನು ಒಳಗೊಂಡಿರುವ ಆಡ್ಸರ್ಬೆಂಟ್ಗಳ ಮೇಲೆ ಹೊರಹೀರುವಿಕೆಯ ಸಮಯದಲ್ಲಿ ಈ ರೀತಿಯ ಬಂಧವು ಸಂಭವಿಸಬಹುದು. ಹೈಡ್ರೋಜನ್ ಬಂಧವು ರೂಪುಗೊಂಡಾಗ, ಆಡ್ಸರ್ಬೆಂಟ್ ಮತ್ತು ಆಡ್ಸರ್ಬೆಂಟ್ ನಡುವಿನ ಪರಸ್ಪರ ಕ್ರಿಯೆಯ ಶಕ್ತಿಯು ಸಾಕಷ್ಟು ದೊಡ್ಡದಾಗಿರುತ್ತದೆ ಮತ್ತು ಅಂತಹ ಹೊರಹೀರುವಿಕೆಯ ಸಮಯದಲ್ಲಿ ಬಿಡುಗಡೆಯಾಗುವ ಶಾಖವು ಅಣುಗಳ ಆಕಾರ ಮತ್ತು ಗಾತ್ರದಲ್ಲಿ ಹೋಲುವ ವಸ್ತುಗಳ ಹೊರಹೀರುವಿಕೆಯ ಶಾಖಕ್ಕಿಂತ ಗಮನಾರ್ಹವಾಗಿ ಹೆಚ್ಚಾಗಿರುತ್ತದೆ. , ಆದರೆ ಹೈಡ್ರೋಜನ್ ಬಂಧವನ್ನು ರೂಪಿಸಬೇಡಿ.
ಆಡ್ಸರ್ಬೆಂಟ್-ಆಡ್ಸರ್ಬೆಂಟ್ ಇಂಟರ್ಫೇಸ್ನಲ್ಲಿ ಮೇಲ್ಮೈ ಪದರದ ಥರ್ಮೋಡೈನಾಮಿಕ್ ವಿವರಣೆ, ಅದರ ರಚನೆ, ವಿವಿಧ ರೀತಿಯ ಶಕ್ತಿಗಳ ಸ್ವರೂಪ ಮತ್ತು ಪ್ರಕ್ರಿಯೆಯ ಡೈನಾಮಿಕ್ಸ್ ಅನ್ನು ತಿಳಿದುಕೊಳ್ಳುವುದರಿಂದ, ಹೆಚ್ಚು ಸಂಕೀರ್ಣವಾದ ಹೊರಹೀರುವಿಕೆಯ ಅಧ್ಯಯನಕ್ಕೆ ಮುಂದುವರಿಯಬಹುದು ಎಂಬುದನ್ನು ಗಮನಿಸುವುದು ಮುಖ್ಯ. ಕಾರ್ಯವಿಧಾನಗಳು.
35. ಇಂಟರ್ಫೇಶಿಯಲ್ ಟೆನ್ಷನ್ ಅನ್ನು ಕಡಿಮೆ ಮಾಡುವ ವಸ್ತುಗಳ ಇಂಟರ್ಫೇಸ್ನಲ್ಲಿ ಸ್ವಾಭಾವಿಕ ಸಾಂದ್ರತೆಯಾಗಿ ಹೊರಹೀರುವಿಕೆ
ಸರ್ಫ್ಯಾಕ್ಟಂಟ್ಗಳನ್ನು ಎರಡು ದೊಡ್ಡ ಗುಂಪುಗಳಾಗಿ ವಿಂಗಡಿಸಲಾಗಿದೆ: ಸಕ್ರಿಯ ಮತ್ತು ನಿಷ್ಕ್ರಿಯಪದಾರ್ಥಗಳು.
ಸರ್ಫ್ಯಾಕ್ಟಂಟ್ಗಳು ಮೇಲ್ಮೈ ಪದರದಲ್ಲಿ ಸಂಗ್ರಹಗೊಳ್ಳಲು ಸಾಧ್ಯವಾಗುತ್ತದೆ, ಮತ್ತು ಧನಾತ್ಮಕ ಹೊರಹೀರುವಿಕೆ ಸಂಭವಿಸುತ್ತದೆ ಜಿ > 0.
ಈ ರೀತಿಯ ವಸ್ತುಗಳು ಮೇಲ್ಮೈ ಒತ್ತಡವನ್ನು ಹೊಂದಿರಬೇಕು, ಅದು ದ್ರಾವಕದ ಮೇಲ್ಮೈ ಒತ್ತಡಕ್ಕಿಂತ ಕಡಿಮೆಯಿರಬೇಕು, ಇಲ್ಲದಿದ್ದರೆ ಮೇಲ್ಮೈ ಪದರದಲ್ಲಿ ವಸ್ತುವಿನ ಸಂಗ್ರಹವು ಪ್ರತಿಕೂಲವಾಗಿರುತ್ತದೆ ಮತ್ತು ತುಲನಾತ್ಮಕವಾಗಿ ಕಡಿಮೆ ಕರಗುವಿಕೆಯನ್ನು ಹೊಂದಿರಬೇಕು. ಸಾಕಷ್ಟು ಉತ್ತಮ ಕರಗುವಿಕೆಯೊಂದಿಗೆ, ಸರ್ಫ್ಯಾಕ್ಟಂಟ್ ಅಣುಗಳು ಮೇಲ್ಮೈಯನ್ನು ದ್ರಾವಣದಲ್ಲಿ ಆಳವಾಗಿ ಬಿಡುತ್ತವೆ. ಆದ್ದರಿಂದ, ಸರ್ಫ್ಯಾಕ್ಟಂಟ್ಗಳನ್ನು ಆದ್ಯತೆಯಾಗಿ ದ್ರವದ ಬಹುಭಾಗದಿಂದ ಮೇಲ್ಮೈಗೆ ತಳ್ಳಲಾಗುತ್ತದೆ.
ಆದರೆ ಈ ಪದಾರ್ಥಗಳ ಅಣುಗಳಲ್ಲಿನ ದ್ರಾವಣದ ಗಡಿಯಲ್ಲಿರುವ ಪದಾರ್ಥಗಳ ಸಂಗ್ರಹದೊಂದಿಗೆ, ಪರಸ್ಪರ ದುರ್ಬಲವಾಗಿ ಸಂವಹನ ನಡೆಸುತ್ತದೆ, ಮೇಲ್ಮೈ ಪದರದಲ್ಲಿನ ಇಂಟರ್ಮೋಲಿಕ್ಯುಲರ್ ಪರಸ್ಪರ ಕ್ರಿಯೆಯು ಕಡಿಮೆಯಾಗುತ್ತದೆ ಮತ್ತು ಮೇಲ್ಮೈ ಒತ್ತಡವು ಕುಸಿಯುತ್ತದೆ.
ಸರ್ಫ್ಯಾಕ್ಟಂಟ್ಗಳುನೀರಿನ ಪದರಕ್ಕೆ ಸಂಬಂಧಿಸಿದಂತೆ ಅನೇಕ ರೀತಿಯ ಸಾವಯವ ಸಂಯುಕ್ತಗಳು, ಸಾಕಷ್ಟು ದೊಡ್ಡ ಹೈಡ್ರೋಕಾರ್ಬನ್ ರಾಡಿಕಲ್ ಹೊಂದಿರುವ ಕೊಬ್ಬಿನಾಮ್ಲಗಳು, ಈ ಆಮ್ಲಗಳ ಲವಣಗಳು (ಸಾಬೂನುಗಳು), ಸಲ್ಫೋನಿಕ್ ಆಮ್ಲಗಳು ಮತ್ತು ಅವುಗಳ ಲವಣಗಳು, ಹಾಗೆಯೇ ವಿವಿಧ ರೀತಿಯಆಲ್ಕೋಹಾಲ್ಗಳು ಮತ್ತು ಅಮೈನ್ಗಳು. ವಿಶಿಷ್ಟ ಲಕ್ಷಣಹೆಚ್ಚಿನ ಅಣುಗಳು ಅವುಗಳ ಡಿಫಿಲಿಸಿಟಿ: ಅಣುವು ಧ್ರುವೀಯ ಗುಂಪಿನ ಎರಡು ಭಾಗಗಳನ್ನು ಮತ್ತು ಧ್ರುವೀಯವಲ್ಲದ ಹೈಡ್ರೋಕಾರ್ಬನ್ ರಾಡಿಕಲ್ ಅನ್ನು ಹೊಂದಿರುತ್ತದೆ. ಗಮನಾರ್ಹ ದ್ವಿಧ್ರುವಿ ಕ್ಷಣವನ್ನು ಹೊಂದಿರುವ ಮತ್ತು ಧ್ರುವೀಯ ಗುಂಪನ್ನು ಚೆನ್ನಾಗಿ ತೇವಗೊಳಿಸುವುದರಿಂದ ಜಲೀಯ ಪರಿಸರಕ್ಕೆ ಸರ್ಫ್ಯಾಕ್ಟಂಟ್ನ ಸಂಬಂಧವನ್ನು ನಿರ್ಧರಿಸಬಹುದು. ಆದರೆ ಹೈಡ್ರೋಕಾರ್ಬನ್ ರಾಡಿಕಲ್ ಈ ಸಂಯುಕ್ತಗಳ ಕರಗುವಿಕೆಯನ್ನು ಕಡಿಮೆ ಮಾಡಲು ಕಾರಣವಾಗಿದೆ.
ಮೇಲ್ಮೈ-ನಿಷ್ಕ್ರಿಯ ಸರ್ಫ್ಯಾಕ್ಟಂಟ್ಗಳು- ಈ ರೀತಿಯ ವಸ್ತುಗಳು, ದ್ರವದ ಮೇಲ್ಮೈಯನ್ನು ಅದರ ಪರಿಮಾಣಕ್ಕೆ ಬಿಡಲು ಒಲವು ತೋರುತ್ತವೆ, ಇದರ ಪರಿಣಾಮವಾಗಿ, ಕರೆಯಲ್ಪಡುವ. ಋಣಾತ್ಮಕ ಹೊರಹೀರುವಿಕೆ ಜಿ < 0. Поверностно-инактивные вещества также обладают значительным поверхностным натяжением, значительно большим, чем натяжение у растворителя (иначе эти вещества способны самопроизвольно накапливаться в поверхностном слое), также обладают высокой растворимостью, что способствует их стремлению уйти с поверхности жидкости в объем. Взаимодействие между молекулами поверхностно-инактивного вещества и растворителя всегда больше, чем взаимодействие между самими молекулами растворителя, поэтому они и стремятся перейти в объем раствора. ಮೇಲ್ಮೈ-ನಿಷ್ಕ್ರಿಯ ವಸ್ತುಗಳುನೀರಿಗೆ ಸಂಬಂಧಿಸಿದಂತೆ ಅನೇಕ ಅಜೈವಿಕ ವಿದ್ಯುದ್ವಿಚ್ಛೇದ್ಯಗಳಿವೆ: ಆಮ್ಲಗಳು, ಕ್ಷಾರಗಳು, ಲವಣಗಳು. ಮೇಲ್ಮೈ-ನಿಷ್ಕ್ರಿಯ ವಸ್ತುಗಳ ಅಣುಗಳು ಹೈಡ್ರೋಫೋಬಿಕ್ ಭಾಗವನ್ನು ಹೊಂದಿರುವುದಿಲ್ಲ ಮತ್ತು ಹೆಚ್ಚು ಹೈಡ್ರೀಕರಿಸುವ ಅಯಾನುಗಳಾಗಿ ನೀರಿನಲ್ಲಿ ಕೊಳೆಯಬಹುದು.
ಉದಾಹರಣೆಗಳುಮೇಲ್ಮೈ-ನಿಷ್ಕ್ರಿಯ ವಸ್ತುಗಳು ಸಹ ಕೆಲವು ಸಾವಯವ ಸಂಯುಕ್ತಗಳಾಗಿವೆ, ಇದರಲ್ಲಿ ಅಣುವಿನ ಧ್ರುವೇತರ ಭಾಗವು ಇರುವುದಿಲ್ಲ ಅಥವಾ ತುಂಬಾ ಚಿಕ್ಕದಾಗಿದೆ. ಈ ವಸ್ತುಗಳು ಫಾರ್ಮಿಕ್ ಮತ್ತು ಅಮಿನೊಅಸೆಟಿಕ್ ಆಮ್ಲಗಳನ್ನು ಒಳಗೊಂಡಿವೆ.
ಜಲೀಯವಲ್ಲದ ದ್ರಾವಕಗಳಲ್ಲಿ, ಅಜೈವಿಕ ವಿದ್ಯುದ್ವಿಚ್ಛೇದ್ಯಗಳು ಮೇಲ್ಮೈ ಒತ್ತಡವನ್ನು ಹೆಚ್ಚಿಸುವ ಸಾಮರ್ಥ್ಯವನ್ನು ಹೊಂದಿರುತ್ತವೆ ಮತ್ತು ಇದು ದ್ರಾವಕದ ಮೇಲೆ ಅವಲಂಬಿತವಾಗಿರುತ್ತದೆ.
ಉದಾಹರಣೆಗೆ, ಸೋಡಿಯಂ ಅಯೋಡೈಡ್ ಅನ್ನು ಮೆಥನಾಲ್ಗೆ ಪರಿಚಯಿಸಿದಾಗ, ಮೇಲ್ಮೈ ಒತ್ತಡವು ಬಹಳವಾಗಿ ಹೆಚ್ಚಾಗುತ್ತದೆ; ಎಥೆನಾಲ್ಗಾಗಿ, ಮೇಲ್ಮೈ ಒತ್ತಡವು ಸರಿಸುಮಾರು 2 ಪಟ್ಟು ಹೆಚ್ಚಾಗಿರುತ್ತದೆ. ವಸ್ತುಗಳ ಮೇಲ್ಮೈ ಚಟುವಟಿಕೆಯು ವಸ್ತುವಿನ ಸ್ವರೂಪವನ್ನು ಮಾತ್ರವಲ್ಲದೆ ದ್ರಾವಕದ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಅವಲಂಬಿಸಿರುತ್ತದೆ. ಯಾವುದೇ ದ್ರಾವಕವು ಹೆಚ್ಚಿನ ಮೇಲ್ಮೈ ಒತ್ತಡವನ್ನು ಹೊಂದಿದ್ದರೆ, ಆ ದ್ರಾವಕವು ಗಮನಾರ್ಹವಾದ ಮೇಲ್ಮೈ ಚಟುವಟಿಕೆಯನ್ನು ಪ್ರದರ್ಶಿಸುತ್ತದೆ.
36. ಹೊರಹೀರುವಿಕೆ ಸಿದ್ಧಾಂತಗಳು
"ಘನ-ಅನಿಲ" ಅಥವಾ "ಘನ-ಪರಿಹಾರ" ಇಂಟರ್ಫೇಸ್ನಲ್ಲಿ ಕೆಲವು ವಿಧದ ಹೊರಹೀರುವಿಕೆಯನ್ನು ವಿವರಿಸುವ ಅತ್ಯಂತ ಸಾಮಾನ್ಯವಾದ ಹೊರಹೀರುವಿಕೆ ಸಿದ್ಧಾಂತಗಳನ್ನು ನಾವು ಪರಿಗಣಿಸೋಣ.
I. ಲ್ಯಾಂಗ್ಮುಯಿರ್ನಿಂದ ಮೊನೊಮಾಲಿಕ್ಯುಲರ್ ಅಡ್ಸಾರ್ಪ್ಶನ್ ಸಿದ್ಧಾಂತ.
1. ಹೊರಹೀರುವಿಕೆ ಸ್ಥಳೀಯವಾಗಿದೆ ಮತ್ತು ರಾಸಾಯನಿಕ ಪದಗಳಿಗಿಂತ ಹತ್ತಿರವಿರುವ ಶಕ್ತಿಗಳಿಂದ ಉಂಟಾಗುತ್ತದೆ.
2. ಹೊರಹೀರುವಿಕೆ ಸಕ್ರಿಯ ಕೇಂದ್ರಗಳಲ್ಲಿ ಮಾತ್ರ ಸಂಭವಿಸುತ್ತದೆ - ಆಡ್ಸರ್ಬೆಂಟ್ನ ಮೇಲ್ಮೈಯಲ್ಲಿ ಮುಂಚಾಚಿರುವಿಕೆಗಳು ಅಥವಾ ಖಿನ್ನತೆಗಳು, ಉಚಿತ ವೇಲೆನ್ಸ್ಗಳ ಉಪಸ್ಥಿತಿಯಿಂದ ನಿರೂಪಿಸಲ್ಪಟ್ಟಿದೆ. ಸಕ್ರಿಯ ಕೇಂದ್ರಗಳನ್ನು ಸ್ವತಂತ್ರ ಮತ್ತು ಒಂದೇ ಎಂದು ಪರಿಗಣಿಸಲಾಗುತ್ತದೆ.
3. ಪ್ರತಿಯೊಂದು ಸಕ್ರಿಯ ಕೇಂದ್ರವು ಕೇವಲ ಒಂದು ಆಡ್ಸೋರ್ಬೇಟ್ ಅಣುವಿನೊಂದಿಗೆ ಸಂವಹನ ನಡೆಸಲು ಸಾಧ್ಯವಾಗುತ್ತದೆ; ಹೊರಹೀರುವ ಅಣುಗಳ ಒಂದು ಪದರ ಮಾತ್ರ ಮೇಲ್ಮೈಯಲ್ಲಿ ರೂಪುಗೊಳ್ಳುತ್ತದೆ.
4. ಹೊರಹೀರುವಿಕೆ ಪ್ರಕ್ರಿಯೆಯು ಹಿಂತಿರುಗಿಸಬಹುದಾದ ಮತ್ತು ಸಮತೋಲನವಾಗಿದೆ; ಆಡ್ಸೋರ್ಬ್ಡ್ ಅಣುವನ್ನು ಸಕ್ರಿಯ ಸೈಟ್ನಿಂದ ಸ್ವಲ್ಪ ಸಮಯದವರೆಗೆ ಉಳಿಸಿಕೊಳ್ಳಲಾಗುತ್ತದೆ, ನಂತರ ಅದನ್ನು ನಿರ್ಲಕ್ಷಿಸಲಾಗುತ್ತದೆ; ಸ್ವಲ್ಪ ಸಮಯದ ನಂತರ, ಡೈನಾಮಿಕ್ ಸಮತೋಲನವನ್ನು ಸ್ಥಾಪಿಸಲಾಗಿದೆ.
ಗರಿಷ್ಠ ಸಂಭವನೀಯ ಹೊರಹೀರುವಿಕೆ ಮೌಲ್ಯ ಜಿಎಲ್ಲಾ ಸಕ್ರಿಯ ಕೇಂದ್ರಗಳು ಆಡ್ಸೋರ್ಬೇಟ್ ಅಣುಗಳಿಂದ ಆಕ್ರಮಿಸಲ್ಪಟ್ಟಿದ್ದರೆ o ಅನ್ನು ಸಾಧಿಸಲಾಗುತ್ತದೆ. ಹೊರಹೀರುವಿಕೆಯ ಪ್ರಮಾಣಕ್ಕೆ ಸಂಬಂಧಿಸಿದ ಮೊನೊಮಾಲಿಕ್ಯುಲರ್ ಆಡ್ಸರ್ಪ್ಶನ್ ಐಸೋಥರ್ಮ್ ಸಮೀಕರಣ ಜಿಆಡ್ಸೋರ್ಬೇಟ್ ಸಾಂದ್ರತೆಯೊಂದಿಗೆ ಇದರೊಂದಿಗೆ, ರೂಪವನ್ನು ಹೊಂದಿದೆ:
ಎಲ್ಲಿ ಬಿ- ನಿರ್ದಿಷ್ಟ "ಆಡ್ಸರ್ಬೆಂಟ್ - ಆಡ್ಸೋರ್ಬೇಟ್" ಜೋಡಿಗೆ ಸ್ಥಿರವಾದ ಮೌಲ್ಯ (ನಿರ್ಜಲೀಕರಣ ಮತ್ತು ಹೊರಹೀರುವಿಕೆಯ ದರ ಸ್ಥಿರಾಂಕಗಳ ಅನುಪಾತ), ಸಂಖ್ಯಾತ್ಮಕವಾಗಿ ಅರ್ಧದಷ್ಟು ಸಕ್ರಿಯ ಕೇಂದ್ರಗಳು ಆಕ್ರಮಿಸಿಕೊಂಡಿರುವ ಆಡ್ಸೋರ್ಬೇಟ್ ಸಾಂದ್ರತೆಗೆ ಸಮಾನವಾಗಿರುತ್ತದೆ.

ಲ್ಯಾಂಗ್ಮುಯಿರ್ ಆಡ್ಸೋರ್ಪ್ಶನ್ ಐಸೋಥರ್ಮ್ ಗ್ರಾಫ್ ಅನ್ನು ಚಿತ್ರ 2 ರಲ್ಲಿ ತೋರಿಸಲಾಗಿದೆ ಬಿಬಿಂದುವಿನಲ್ಲಿ ಹೀರಿಕೊಳ್ಳುವ ಐಸೊಥರ್ಮ್ಗೆ ಸ್ಪರ್ಶಕವನ್ನು ಎಳೆಯುವ ಮೂಲಕ ಚಿತ್ರಾತ್ಮಕವಾಗಿ ನಿರ್ಧರಿಸಿ ಇದರೊಂದಿಗೆ= 0. ಸಮೀಕರಣದಲ್ಲಿ ಅನಿಲ ಹೀರಿಕೊಳ್ಳುವ ಪ್ರಕ್ರಿಯೆಯನ್ನು ವಿವರಿಸುವಾಗ, ಸಾಂದ್ರತೆಯನ್ನು ಭಾಗಶಃ ಒತ್ತಡದ ಪ್ರಮಾಣಾನುಗುಣ ಮೌಲ್ಯದಿಂದ ಬದಲಾಯಿಸಬಹುದು. ಮೊನೊಮಾಲಿಕ್ಯುಲರ್ ಹೊರಹೀರುವಿಕೆಯ ಸಿದ್ಧಾಂತ I. ಲ್ಯಾಂಗ್ಮುಯಿರ್ ಆಡ್ಸೋರ್ಬೇಟ್ನ ಕಡಿಮೆ ಒತ್ತಡದಲ್ಲಿ (ಸಾಂದ್ರತೆಗಳು) ಅನಿಲಗಳು ಮತ್ತು ಕರಗಿದ ಪದಾರ್ಥಗಳ ಹೊರಹೀರುವಿಕೆಯ ಪ್ರಕ್ರಿಯೆಗಳನ್ನು ವಿವರಿಸಲು ಅನ್ವಯಿಸುತ್ತದೆ.
ಪಾಲಿಯಾನಿಯ ಪಾಲಿಮೋಲಿಕ್ಯುಲರ್ ಅಡ್ಸಾರ್ಪ್ಶನ್ ಸಿದ್ಧಾಂತ s-ಆಕಾರದ ಹೊರಹೀರುವಿಕೆ ಐಸೋಥರ್ಮ್ಗಳನ್ನು ವಿವರಿಸುತ್ತದೆ, ಅದರ ಆಕಾರವು ಆಡ್ಸೋರ್ಬ್ಡ್ ಅಣುಗಳ ಆಡ್ಸೋರ್ಬೇಟ್ನೊಂದಿಗೆ ಸಂಭವನೀಯ ಪರಸ್ಪರ ಕ್ರಿಯೆಯನ್ನು ಸೂಚಿಸುತ್ತದೆ.
1. ಹೊರಹೀರುವಿಕೆ ಭೌತಿಕ ಶಕ್ತಿಗಳಿಂದ ಉಂಟಾಗುತ್ತದೆ.
2. ಆಡ್ಸರ್ಬೆಂಟ್ನ ಮೇಲ್ಮೈ ಏಕರೂಪವಾಗಿದೆ, ಯಾವುದೇ ಸಕ್ರಿಯ ಕೇಂದ್ರಗಳಿಲ್ಲ; ಹೊರಹೀರುವಿಕೆ ಬಲಗಳು ಆಡ್ಸರ್ಬೆಂಟ್ನ ಮೇಲ್ಮೈ ಬಳಿ ನಿರಂತರ ಬಲ ಕ್ಷೇತ್ರವನ್ನು ರೂಪಿಸುತ್ತವೆ.
3. ಹೊರಹೀರುವಿಕೆ ಪಡೆಗಳು ಆಡ್ಸೋರ್ಬೇಟ್ ಅಣುವಿನ ಗಾತ್ರಕ್ಕಿಂತ ಹೆಚ್ಚಿನ ದೂರದಲ್ಲಿ ಕಾರ್ಯನಿರ್ವಹಿಸುತ್ತವೆ, ಅಂದರೆ, ಹೊರಹೀರುವಿಕೆಯ ಮೇಲ್ಮೈಯಲ್ಲಿ ಒಂದು ನಿರ್ದಿಷ್ಟ ಹೀರಿಕೊಳ್ಳುವ ಪರಿಮಾಣವಿದೆ, ಇದು ಹೊರಹೀರುವಿಕೆಯ ಸಮಯದಲ್ಲಿ ಆಡ್ಸೋರ್ಬೇಟ್ ಅಣುಗಳಿಂದ ತುಂಬಿರುತ್ತದೆ.
4. ಆಡ್ಸರ್ಬೆಂಟ್ನ ಮೇಲ್ಮೈಯಿಂದ ಆಡ್ಸರ್ಬೇಟ್ ಅಣುವಿನ ಆಕರ್ಷಣೆಯು ಹೊರಹೀರುವಿಕೆಯ ಪರಿಮಾಣದಲ್ಲಿನ ಇತರ ಅಣುಗಳ ಉಪಸ್ಥಿತಿಯನ್ನು ಅವಲಂಬಿಸಿರುವುದಿಲ್ಲ, ಇದರ ಪರಿಣಾಮವಾಗಿ ಪಾಲಿಮೋಲಿಕ್ಯುಲರ್ ಹೊರಹೀರುವಿಕೆ ಸಾಧ್ಯ.
5. ಹೊರಹೀರುವಿಕೆ ಪಡೆಗಳು ತಾಪಮಾನದ ಮೇಲೆ ಅವಲಂಬಿತವಾಗಿಲ್ಲ ಮತ್ತು ಆದ್ದರಿಂದ, ಹೀರಿಕೊಳ್ಳುವ ಪರಿಮಾಣವು ತಾಪಮಾನದಲ್ಲಿನ ಬದಲಾವಣೆಯೊಂದಿಗೆ ಬದಲಾಗುವುದಿಲ್ಲ.
ಫ್ರೆಂಡ್ಲಿಚ್ ಸಮೀಕರಣ.ಆಡ್ಸರ್ಬೆಂಟ್ನ ಮೇಲ್ಮೈ ವೈವಿಧ್ಯಮಯವಾಗಿದೆ, ಹೀರಿಕೊಳ್ಳುವ ಕಣಗಳ ನಡುವೆ ಪರಸ್ಪರ ಕ್ರಿಯೆಯು ಸಂಭವಿಸುತ್ತದೆ ಮತ್ತು ಸಕ್ರಿಯ ಕೇಂದ್ರಗಳು ಪರಸ್ಪರ ಸಂಪೂರ್ಣವಾಗಿ ಸ್ವತಂತ್ರವಾಗಿರುವುದಿಲ್ಲ. G. ಫ್ರೆಂಡ್ಲಿಚ್ ಹೊರಹೀರುವ ಅನಿಲದ ಮೋಲ್ಗಳ ಸಂಖ್ಯೆ ಅಥವಾ ಆಡ್ಸರ್ಬೆಂಟ್ನ ಪ್ರತಿ ಯೂನಿಟ್ ದ್ರವ್ಯರಾಶಿಗೆ ಕರಗಿದ ವಸ್ತು (ನಿರ್ದಿಷ್ಟ ಹೀರಿಕೊಳ್ಳುವಿಕೆ ಎಂದು ಕರೆಯಲ್ಪಡುವ) X/ಮೀ), ಆಡ್ಸರ್ಬೆಂಟ್ನ ಸಮತೋಲನದ ಒತ್ತಡಕ್ಕೆ (ಅನಿಲಕ್ಕೆ) ಅಥವಾ ಸಮತೋಲನದ ಸಾಂದ್ರತೆಗೆ (ದ್ರಾವಣದಿಂದ ಹೀರಿಕೊಳ್ಳುವ ವಸ್ತುಗಳಿಗೆ) ಅನುಪಾತದಲ್ಲಿರಬೇಕು, ನಿರ್ದಿಷ್ಟ ಶಕ್ತಿಗೆ ಏರಿಸಲಾಗುತ್ತದೆ, ಇದು ಯಾವಾಗಲೂ ಏಕತೆಗಿಂತ ಕಡಿಮೆಯಿರುತ್ತದೆ:
X / ಮೀ = aPಎನ್ ; X / ಮೀ = ಎಸಿಎನ್.
ಘಾತಕಗಳು ಎನ್ಮತ್ತು ಅನುಪಾತದ ಅಂಶ ಎಪ್ರಾಯೋಗಿಕವಾಗಿ ನಿರ್ಧರಿಸಲಾಗುತ್ತದೆ.
37. ಹೊರಹೀರುವಿಕೆ ಪ್ರಕ್ರಿಯೆಯ ಥರ್ಮೋಡೈನಾಮಿಕ್ಸ್. ಗಿಬ್ಸ್ ಹೊರಹೀರುವಿಕೆ ಸಮೀಕರಣ
"ಪರಿಹಾರ-ಅನಿಲ" ಇಂಟರ್ಫೇಸ್ನಲ್ಲಿ ಹೊರಹೀರುವಿಕೆಯ ವಿದ್ಯಮಾನವನ್ನು ಅಧ್ಯಯನ ಮಾಡಲು, ಮೇಲ್ಮೈಯಲ್ಲಿನ ಪದರದಲ್ಲಿ ಹೊರಹೀರುವ ವಸ್ತುವಿನ ಹೆಚ್ಚುವರಿ ನಡುವಿನ ಸಂಪರ್ಕವನ್ನು ಸ್ಥಾಪಿಸುವುದು ಅವಶ್ಯಕ ( ಜಿ), ದ್ರಾವಣದಲ್ಲಿ ಸರ್ಫ್ಯಾಕ್ಟಂಟ್ ಸಾಂದ್ರತೆ ( ಜೊತೆಗೆ) ಮತ್ತು ಮೇಲ್ಮೈ ಒತ್ತಡ ( σ ) "ಪರಿಹಾರ - ಅನಿಲ" ಹಂತದ ಗಡಿಯಲ್ಲಿ. ಥರ್ಮೋಡೈನಾಮಿಕ್ ದೃಷ್ಟಿಕೋನದಿಂದ ವಿದ್ಯಮಾನಗಳನ್ನು ಪರಿಗಣಿಸುವುದು ಮತ್ತು ಕರಗಿದ ವಸ್ತುವಿನ ಹೊರಹೀರುವಿಕೆಯನ್ನು ಮೇಲ್ಮೈಯ ಮುಕ್ತ ಶಕ್ತಿ ಅಥವಾ ಅದರ ಮೇಲ್ಮೈ ಒತ್ತಡದಲ್ಲಿನ ಬದಲಾವಣೆಗೆ ಸಂಬಂಧಿಸುವುದು ಹೆಚ್ಚು ಸೂಕ್ತವಾಗಿದೆ. ಈ ಸಂಪರ್ಕವನ್ನು ಮಾಡಲಾಗಿದೆ W. ಗಿಬ್ಸ್ವಿ 1876, ಇದನ್ನು ಹೆಸರಿಸಲಾಯಿತು "ಗಿಬ್ಸ್ ಹೊರಹೀರುವಿಕೆ ಸಮೀಕರಣ":
ಜಿ = – ಜೊತೆಗೆ / RT X dσ/ಡಿಸಿ.
ನೀವು ಇನ್ನೂ ಊಹಿಸಬಹುದು ಗಿಬ್ಸ್ ಸಮೀಕರಣ,ಥರ್ಮೋಡೈನಾಮಿಕ್ಸ್ ಅನ್ನು ಆಧರಿಸಿ, ಐಸೊಬಾರಿಕ್-ಐಸೋಥರ್ಮಲ್ ಸಂಭಾವ್ಯತೆಯನ್ನು ಬಳಸಿ ಜಿ, ರಾಸಾಯನಿಕ ವಿಭವಗಳು μ 1ಮತ್ತು μ2,ಮತ್ತು ಸಹ ಬಳಸುವುದು ಎನ್ 1 ಮತ್ತು ಎನ್ 2 ಘಟಕಗಳ ಮೋಲ್ಗಳ ಸಂಖ್ಯೆ. ಎಂಟ್ರೊಪಿಯನ್ನು ಗಣನೆಗೆ ತೆಗೆದುಕೊಂಡು ಅದನ್ನು ವಿಶ್ಲೇಷಿಸಿದ ನಂತರ ಎಸ್, ಪರಿಮಾಣ ವಿಮತ್ತು ಒತ್ತಡ ಪ, ನಾವು ಈ ಕೆಳಗಿನ ಸಮೀಕರಣವನ್ನು ಬರೆಯಬಹುದು:
dG=- SDT+ವಿಡಿಪಿ+σds+ μ 1 ಡಿಎನ್ 1 + μ 2 ಡಿಎನ್ 2.
ನಾವು ಅದನ್ನು ಶೂನ್ಯಕ್ಕೆ ಸಮೀಕರಿಸೋಣ ಮತ್ತು ಸ್ಥಿರ ತಾಪಮಾನ ಮತ್ತು ಒತ್ತಡವನ್ನು ಗಣನೆಗೆ ತೆಗೆದುಕೊಂಡು, ಅದು ರೂಪದ ಸಮೀಕರಣಕ್ಕೆ ಸರಳಗೊಳಿಸುತ್ತದೆ:
SD σ + ಎನ್ 1 ಡಿ μ 1 + ಎನ್ 2 ಡಿ μ 1 = 0.
ದುರ್ಬಲ ದ್ರಾವಣಗಳಿಗೆ ಎರಡನೇ ಘಟಕದ ರಾಸಾಯನಿಕ ಸಾಮರ್ಥ್ಯವನ್ನು ಈ ಕೆಳಗಿನಂತೆ ವ್ಯಕ್ತಪಡಿಸಲಾಗುತ್ತದೆ ಎಂಬ ಅಂಶವನ್ನು ಗಣನೆಗೆ ತೆಗೆದುಕೊಂಡು:
μ 2 = μ 2 0 +RTಎಲ್ಎನ್ ಸಿ,
ಮತ್ತು ತಾಪಮಾನವು ಸ್ಥಿರವಾಗಿರುತ್ತದೆ ಎಂದು ನೀಡಲಾಗಿದೆ
dμ 2 =RTdnc,
ಈ ಸಮೀಕರಣವನ್ನು ಬದಲಿಸುವುದು
![]()
ನಾವು ಬಯಸಿದ ಗಿಬ್ಸ್ ಹೊರಹೀರುವಿಕೆ ಸಮೀಕರಣವನ್ನು ಪಡೆಯುತ್ತೇವೆ. ಸಮೀಕರಣದ ಆಧಾರದ ಮೇಲೆ, ಮೇಲ್ಮೈ ಒತ್ತಡದ ವೇಳೆ ಇದನ್ನು ಕಾಣಬಹುದು σ ಏಕಾಗ್ರತೆಯೊಂದಿಗೆ ಹೆಚ್ಚಾಗುತ್ತದೆ ಜೊತೆಗೆ, ನಂತರ ಮೇಲ್ಮೈ ಪದರದ ಮೇಲೆ ದ್ರಾವಣದ ಸಾಂದ್ರತೆಯು ದ್ರಾವಣದ ಬಹುಭಾಗಕ್ಕಿಂತ ಕಡಿಮೆಯಿರುತ್ತದೆ (ಋಣಾತ್ಮಕ ಹೊರಹೀರುವಿಕೆ ಎಂದು ಕರೆಯಲ್ಪಡುವ), ಮತ್ತು ಮೇಲ್ಮೈ ಒತ್ತಡ σ ಹೆಚ್ಚುತ್ತಿರುವ ಏಕಾಗ್ರತೆಯೊಂದಿಗೆ ಕಡಿಮೆಯಾಗುತ್ತದೆ ಜೊತೆಗೆ, ನಂತರ ಪದರದಲ್ಲಿನ ಸಾಂದ್ರತೆಯು ಪರಿಮಾಣಕ್ಕಿಂತ ಹೆಚ್ಚಾಗಿರುತ್ತದೆ (ಧನಾತ್ಮಕ ಹೊರಹೀರುವಿಕೆ), ಮತ್ತು, ಅಂತಿಮವಾಗಿ, ವೇಳೆ σ ಅವಲಂಬಿಸಿಲ್ಲ ಜೊತೆಗೆ, ನಂತರ ಮೇಲ್ಮೈಯಲ್ಲಿ ಮತ್ತು ಪರಿಮಾಣದಲ್ಲಿ ಪದರದಲ್ಲಿ ವಸ್ತುವಿನ ಸಾಂದ್ರತೆಯು ಒಂದೇ ಆಗಿರುತ್ತದೆ. ಥರ್ಮೋಡೈನಾಮಿಕ್ಸ್ ಬಳಸಿ ಗಿಬ್ಸ್ ಸಮೀಕರಣವನ್ನು ಪಡೆಯಲಾಗಿದೆ. ಪ್ರಾಯೋಗಿಕವಾಗಿ, ಈ ಸಮೀಕರಣವನ್ನು ಪರಿಶೀಲಿಸುವುದು ಕಷ್ಟ, ಇದು ಪದರದ ಮೇಲ್ಮೈಯಲ್ಲಿ ಕರಗಿದ ವಸ್ತುವಿನ ಸಾಂದ್ರತೆಯನ್ನು ನಿರ್ಧರಿಸುವ ಕಷ್ಟದ ಕಾರಣ. ಅನುಭವಿ ಮಾರ್ಗ B. ಮೆಕ್ಬೆನ್ ಸಾಧನವನ್ನು ಬಳಸಿಕೊಂಡು ದ್ರಾವಣದ ಮೇಲ್ಮೈಯಿಂದ ದ್ರವದ ತೆಳುವಾದ ಪದರವನ್ನು ಕತ್ತರಿಸಲಾಗಿದೆ ಎಂದು ಕಂಡುಹಿಡಿದಿದೆ. ಗಿಬ್ಸ್ ಸಮೀಕರಣದ ಎಲ್ಲಾ ನಿಯತಾಂಕಗಳ ಹೆಚ್ಚಿನ ನಿರ್ಣಯವು ಪ್ರಾಯೋಗಿಕವಾಗಿ ಕಂಡುಬರುವ ಹೊರಹೀರುವಿಕೆ ಮೌಲ್ಯಗಳು, ಪ್ರಾಯೋಗಿಕ ದೋಷದೊಳಗೆ, ಗಿಬ್ಸ್ ಸಮೀಕರಣವನ್ನು ಬಳಸಿಕೊಂಡು ಲೆಕ್ಕಾಚಾರ ಮಾಡಿದ ಮೌಲ್ಯಗಳೊಂದಿಗೆ ಹೊಂದಿಕೆಯಾಗುತ್ತದೆ ಎಂದು ತೋರಿಸಿದೆ. ಯಾವುದೇ ದ್ರವದ ಮೇಲ್ಮೈಯ ಏಕರೂಪತೆ ಮತ್ತು ಮೃದುತ್ವದಿಂದಾಗಿ, ಅದರ ಮೇಲ್ಮೈಯಲ್ಲಿ ಹೊರಹೀರುವಿಕೆಯನ್ನು ಅಧ್ಯಯನ ಮಾಡುವಾಗ ಸಕ್ರಿಯ ಕೇಂದ್ರಗಳ ಸಾಮಾನ್ಯ ಪರಿಕಲ್ಪನೆಗಳು ಸಂಪೂರ್ಣವಾಗಿ ಅನ್ವಯಿಸುವುದಿಲ್ಲ. ನಿರ್ಣಾಯಕ ತಾಪಮಾನದಲ್ಲಿ, ಪಕ್ಕದ ಹಂತಗಳ ನಡುವಿನ ವ್ಯತ್ಯಾಸವು ಕಣ್ಮರೆಯಾಗುತ್ತದೆ ಮತ್ತು ಮೇಲ್ಮೈ ಒತ್ತಡವು ನಿಯಮದಂತೆ ಶೂನ್ಯಕ್ಕೆ ಸಮಾನವಾಗಿರುತ್ತದೆ. ಅನಿಲಗಳು ಮತ್ತು ಆವಿಗಳ ಹೊರಹೀರುವಿಕೆ ಅಂತಹ ವಿಶಾಲವಾದ ಪ್ರಾಯೋಗಿಕ ಅನ್ವಯವನ್ನು ಹೊಂದಿದೆ, ಸಾಹಿತ್ಯದಲ್ಲಿ, ವಿಶೇಷವಾಗಿ ತಾಂತ್ರಿಕ ಸಾಹಿತ್ಯದಲ್ಲಿ, ಈ ಪರಿಕಲ್ಪನೆಯನ್ನು ಕಾಣಬಹುದು, ಇದು ಘನವಸ್ತುಗಳ ಮೇಲ್ಮೈಯಲ್ಲಿನ ಪ್ರಕ್ರಿಯೆಗಳಿಗೆ ಸಂಬಂಧಿಸಿದಂತೆ ಮಾತ್ರ ಅನ್ವಯಿಸುತ್ತದೆ.
ಪರಿಗಣಿಸಲಾದ ಗಿಬ್ಸ್ ಸಮೀಕರಣದಂತಹ ಹೊರಹೀರುವಿಕೆಯ ಸಾಮಾನ್ಯ ನಿಯಮಗಳಂತೆ ಈ ಪರಿಕಲ್ಪನೆಯು ಎಲ್ಲಾ ಹಂತದ ಗಡಿಗಳಿಗೆ ಅನ್ವಯಿಸುತ್ತದೆ. ಗಿಬ್ಸ್ ಸಮೀಕರಣ ಮತ್ತು ಅದರಿಂದ ಅನುಸರಿಸುವ ಎಲ್ಲಾ ನಿಬಂಧನೆಗಳನ್ನು ಬಳಸಿ, Γ ನ ಮೌಲ್ಯವನ್ನು ನಿರ್ಧರಿಸಿದ ನಂತರ, ಹೊರಹೀರುವಿಕೆ ಐಸೊಥರ್ಮ್ ಅನ್ನು ನಿರ್ಮಿಸಲು ಸಾಧ್ಯವಿದೆ.
38. ಮೈಕ್ರೋಪೋರಸ್ ವಸ್ತುಗಳ ಮೇಲೆ ಹೊರಹೀರುವಿಕೆಯ ವೈಶಿಷ್ಟ್ಯಗಳು. ಪಾಲಿಯಾನಿಯ ಸಂಭಾವ್ಯ ಸಿದ್ಧಾಂತ. ಹೀರಿಕೊಳ್ಳುವ ಸಾಮರ್ಥ್ಯ
ಪಾಲಿಯಾನಿಯ ಸಿದ್ಧಾಂತಸ್ಥಳೀಯವಲ್ಲದ ಭೌತಿಕ ಹೊರಹೀರುವಿಕೆಯನ್ನು ಪರಿಗಣಿಸುತ್ತದೆ, ಇದು ಆಡ್ಸರ್ಬೆಂಟ್ ಮತ್ತು ಆಡ್ಸೋರ್ಬೇಟ್ ನಡುವಿನ ವ್ಯಾನ್ ಡೆರ್ ವಾಲ್ಸ್ ಬಲಗಳಿಂದ ನೇರವಾಗಿ ಉಂಟಾಗುತ್ತದೆ (ಇದನ್ನು ಮೊದಲ ಸ್ಥಾನವೆಂದು ಪರಿಗಣಿಸಬಹುದು). ಈ ಸಿದ್ಧಾಂತದ ಎರಡನೇ ಸ್ಥಾನವು ಆಡ್ಸರ್ಬೆಂಟ್ನ ಬಲ (ಅಥವಾ ಸಂಭಾವ್ಯ) ಕ್ಷೇತ್ರದ ಕಲ್ಪನೆಯಾಗಿದೆ, ಇದು ಮೇಲ್ಮೈಯಿಂದ ಸಾಕಷ್ಟು ದೂರದಲ್ಲಿ ವಿಸ್ತರಿಸುತ್ತದೆ; ಈ ಕ್ಷೇತ್ರದಲ್ಲಿ ಕಾಣಿಸಿಕೊಳ್ಳುವ ಹೊರಹೀರುವಿಕೆ ಪದರವು ಬಹು ಅಣುವಾಗಿದೆ. ನಾವು ಅನಿಲಗಳ ಹೊರಹೀರುವಿಕೆಯನ್ನು ಪರಿಗಣಿಸಿದರೆ, ಈ ಪದರದ ಸಾಂದ್ರತೆಯು ಮೇಲ್ಮೈಯಿಂದ ಒಂದು ನಿರ್ದಿಷ್ಟ ಸಾಮಾನ್ಯ ಉದ್ದಕ್ಕೂ ಕಡಿಮೆಯಾಗುತ್ತದೆ. ನಾವು ಆವಿ ಹೊರಹೀರುವಿಕೆಯನ್ನು ಪರಿಗಣಿಸಿದರೆ, ಒಂದು ನಿರ್ದಿಷ್ಟ ದಪ್ಪದ ದ್ರವ ಪದರವು ಮೇಲ್ಮೈಯಲ್ಲಿ ರೂಪುಗೊಳ್ಳುತ್ತದೆ. ಪಾಲಿಯಾನಿಯ ಸಿದ್ಧಾಂತದಲ್ಲಿನ ಕ್ಷೇತ್ರವನ್ನು ಸಮಬಲ ಮೇಲ್ಮೈಗಳ ಸರಣಿ ಎಂದು ಪರಿಗಣಿಸಲಾಗುತ್ತದೆ, ಪ್ರತಿ ಮೇಲ್ಮೈಯು ನಿರ್ದಿಷ್ಟ ಸಂಭಾವ್ಯ ಮೌಲ್ಯಕ್ಕೆ ಅನುರೂಪವಾಗಿದೆ ε , ಮತ್ತು ಪ್ರತಿ ನಂತರದ ಮೇಲ್ಮೈಯು ಹಿಂದಿನದಕ್ಕಿಂತ ಚಿಕ್ಕದಾಗಿರುತ್ತದೆ. ಬಾಹ್ಯಾಕಾಶದಲ್ಲಿ ಅಂತಹ ಪ್ರತಿಯೊಂದು ಮೇಲ್ಮೈ ಒಂದು ನಿರ್ದಿಷ್ಟ ಪರಿಮಾಣದ ಪದರಗಳನ್ನು ಕತ್ತರಿಸುತ್ತದೆ, ಎಂದು ಗೊತ್ತುಪಡಿಸಲಾಗಿದೆ v i. ಐಸೋಥರ್ಮ್ನ ಸಾಮಾನ್ಯ ನಿರ್ದೇಶಾಂಕಗಳಿಂದ ಪರಿವರ್ತನೆಯನ್ನು ಕಂಡುಹಿಡಿಯುವುದು ಪಾಲಿಯಾನಿ ಸಿದ್ಧಾಂತದ ಕಾರ್ಯವಾಗಿದೆ ( x,p) ಕ್ಷೇತ್ರ ನಿಯತಾಂಕಗಳಿಗೆ εiಮತ್ತು v i, ಈ ಮೂಲಭೂತ ನಿಯತಾಂಕಗಳ ನಡುವಿನ ಸಂಪರ್ಕದ ಮತ್ತಷ್ಟು ಸ್ಥಾಪನೆಯೊಂದಿಗೆ. ಪಾಲಿಯಾನಿ ಹೇಳಿದ ಸಮಸ್ಯೆಯ ಮೊದಲ ಭಾಗವು ಸಾಕಷ್ಟು ಸಂಕೀರ್ಣವಾಗಿದೆ, ಮತ್ತು ಅನೇಕ ಸಂದರ್ಭಗಳಲ್ಲಿ ನಿರ್ದಿಷ್ಟ ಪರಿಹಾರಗಳನ್ನು ಹೊಂದಲು ಸಾಧ್ಯವಿಲ್ಲ, ಆದರೆ ಆವಿ ಹೊರಹೀರುವಿಕೆಯ ಸಂದರ್ಭದಲ್ಲಿ, ಸಮಸ್ಯೆಯ ಈ ಭಾಗವನ್ನು ಮೊದಲ ಅಂದಾಜಿನಲ್ಲಿ ಸರಳವಾಗಿ ಪರಿಹರಿಸಲಾಗುತ್ತದೆ. ದ್ರವ ಹೊರಹೀರುವಿಕೆ ಪದರಕ್ಕಾಗಿ, ಪರಿಮಾಣದ ತುಂಬಿದ ಭಾಗವು ಇದಕ್ಕೆ ಸಮಾನವಾಗಿರುತ್ತದೆ:
v i = x(M/d),
ಎಲ್ಲಿ ಡಿ- ದ್ರವ ಸ್ಥಿತಿಯಲ್ಲಿ ವಸ್ತುವಿನ ಸಾಂದ್ರತೆ.
ಅವರ ಸಿದ್ಧಾಂತದಲ್ಲಿ, M. ಪಾಲಿಯಾನಿ ಅವರು ಕರೆಯಲ್ಪಡುವ ಅನುಪಸ್ಥಿತಿಯ ಬಗ್ಗೆ ಮತ್ತೊಂದು ನಿಬಂಧನೆಯನ್ನು ಪರಿಚಯಿಸುತ್ತಾರೆ. ಹೊರಹೀರುವಿಕೆಯ ಸಮಯದಲ್ಲಿ ಕ್ಷೇತ್ರ ಸ್ಕ್ರೀನಿಂಗ್, ಮೌಲ್ಯ ε ಈ ಸಿದ್ಧಾಂತದಲ್ಲಿ, ನಿರ್ದಿಷ್ಟ ಬಿಂದು ಮತ್ತು ಘನ ಮೇಲ್ಮೈ ನಡುವೆ ಕೆಲವು ಆಡ್ಸೋರ್ಬೇಟ್ ಅಣುಗಳು ಅಸ್ತಿತ್ವದಲ್ಲಿವೆಯೇ ಅಥವಾ ಎಲ್ಲಾ ಜಾಗವು ಮುಕ್ತವಾಗಿದೆಯೇ ಎಂಬುದನ್ನು ಲೆಕ್ಕಿಸದೆಯೇ ಬಾಹ್ಯಾಕಾಶವು ಸ್ಥಿರ ಮೌಲ್ಯವಾಗಿದೆ (ಗುರುತ್ವಾಕರ್ಷಣೆಯ ಸಂಭಾವ್ಯತೆಯಂತಹದ್ದು). ಪಾಲಿಯಾನಿ ಪರಿಕಲ್ಪನೆಯನ್ನು ಪರಿಚಯಿಸಿದರು ಹೀರಿಕೊಳ್ಳುವ ಸಾಮರ್ಥ್ಯ ε , ಇದು ಸಮತೋಲನ ಒತ್ತಡದಿಂದ ವರ್ಗಾವಣೆ ಮಾಡುವಾಗ ಉಗಿ ಸಂಕೋಚನದ ಐಸೊಥರ್ಮಲ್ ಕೆಲಸವನ್ನು ಪ್ರತಿನಿಧಿಸುತ್ತದೆ ಆರ್ಸ್ಯಾಚುರೇಟೆಡ್ ಆವಿಯ ಒತ್ತಡದೊಂದಿಗೆ ಮೇಲ್ಮೈ ಪದರದ ಪ್ರದೇಶಕ್ಕೆ ಮೇಲ್ಮೈಯಿಂದ ದೂರವಿರುವ ಬೃಹತ್ ಹಂತದಲ್ಲಿ ಪು 0ನಂತರ ಸಂಭಾವ್ಯತೆಯನ್ನು ನಿರ್ಧರಿಸುವ ಅಭಿವ್ಯಕ್ತಿ ಈ ರೀತಿ ಕಾಣುತ್ತದೆ:
ε = RTಎಲ್ಎನ್ ಆರ್ 0 / ಆರ್.
ಈ ಸಮೀಕರಣವನ್ನು ಬಳಸಿಕೊಂಡು, ನೀವು ನಿರ್ದೇಶಾಂಕಗಳು x, p ನಿಂದ ನಿರ್ದೇಶಾಂಕಗಳಿಗೆ ಹೋಗಬಹುದು ε ಮತ್ತು vಮತ್ತು ವಕ್ರರೇಖೆಯನ್ನು ಪಡೆದುಕೊಳ್ಳಿ, ಇದನ್ನು "ವಿಶಿಷ್ಟ" ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಪಡೆದ ಐಸೋಥರ್ಮ್ಗಳ ಪ್ರಾಯೋಗಿಕ ದತ್ತಾಂಶದಿಂದ ನಿರ್ಮಿಸಲಾದ ಅಂತಹ ವಕ್ರಾಕೃತಿಗಳು ಈ ಕೆಳಗಿನ ಆಸ್ತಿಯನ್ನು ಹೊಂದಿವೆ ಎಂದು ಪಾಲಿಯಾನಿ ತನ್ನ ಪ್ರಯೋಗಗಳಲ್ಲಿ ಕಂಡುಹಿಡಿದನು: ಅವು ಟಿಗೆ ಸಂಬಂಧಿಸಿದಂತೆ ಬದಲಾಗುವುದಿಲ್ಲ ಅಥವಾ ಬೇರೆ ರೀತಿಯಲ್ಲಿ ಹೇಳುವುದಾದರೆ, ಈ ಪ್ರಕಾರದ ಎಲ್ಲಾ ವಕ್ರಾಕೃತಿಗಳು ಒಂದು ವಕ್ರರೇಖೆಯಲ್ಲಿ ಹೊಂದಿಕೊಳ್ಳುತ್ತವೆ. ε −ε .
M. ಪಾಲಿಯಾನಿ ಈ ಸ್ಥಾನವನ್ನು ಒಂದು ನಿಲುವು ಎಂದು ಒಪ್ಪಿಕೊಂಡರು, ಅಂದರೆ:
ಪಾಲಿಯಾನಿಯ ನಿರ್ದಿಷ್ಟ ಆಸ್ತಿಯು ದೊಡ್ಡದಾಗಿದೆ ಪ್ರಾಯೋಗಿಕ ಮಹತ್ವ, ಇದು ಒಂದು ಪ್ರಾಯೋಗಿಕ ಹೊರಹೀರುವಿಕೆ ಐಸೊಥರ್ಮ್ನಿಂದ ಐಸೋಥರ್ಮ್ಗಳ ಕುಟುಂಬವನ್ನು ನಿರ್ಮಿಸಬಹುದು.
Polanyi ಸಿದ್ಧಾಂತವು ಐಸೊಥರ್ಮ್ ಅಥವಾ ಪೊಟೆನ್ಷಿಯಲ್-ವಾಲ್ಯೂಮ್ ಫಂಕ್ಷನ್ಗೆ ವಿಶ್ಲೇಷಣಾತ್ಮಕ ಅಭಿವ್ಯಕ್ತಿಯನ್ನು ಒದಗಿಸುವುದಿಲ್ಲ, ಆದರೆ ಕನಿಷ್ಠ ಒಂದು ಐಸೊಥರ್ಮ್ ತಿಳಿದಿದ್ದರೆ ಯಾವುದೇ ನಿರ್ದಿಷ್ಟ ತಾಪಮಾನಕ್ಕೆ ನಿರ್ದೇಶಾಂಕವನ್ನು ಲೆಕ್ಕಾಚಾರ ಮಾಡಲು ಇದು ಅನುಮತಿಸುತ್ತದೆ. ಈ ಫಲಿತಾಂಶವು ಬಹಳ ಮುಖ್ಯವಾಗಿದೆ ತಾಂತ್ರಿಕ ಲೆಕ್ಕಾಚಾರಗಳು, ಏಕೆಂದರೆ ಅದೇ ಆಡ್ಸರ್ಬೆಂಟ್ನಲ್ಲಿರುವ ಒಂದೇ ರೀತಿಯ ಅನಿಲಗಳಿಗೆ, ಹೊರಹೀರುವಿಕೆಯ ವಕ್ರಾಕೃತಿಗಳು ಪರಸ್ಪರ ಹತ್ತಿರದಲ್ಲಿರಬಹುದು ಮತ್ತು ಅನೇಕ ಸಂದರ್ಭಗಳಲ್ಲಿ ಸಂಯೋಜಿಸಬಹುದು.
39. ಗುಣಲಕ್ಷಣ ಹೊರಹೀರುವಿಕೆ ಕರ್ವ್. ತಾಪಮಾನ ವ್ಯತ್ಯಾಸ ಮತ್ತು ವಿಶಿಷ್ಟ ವಕ್ರಾಕೃತಿಗಳ ಸಂಬಂಧ
ಆಡ್ಸರ್ಬೆಂಟ್ನ ಮೇಲ್ಮೈಯಲ್ಲಿ ಉದ್ಭವಿಸುವ ಬಲ ಕ್ಷೇತ್ರವು ಗುರುತ್ವಾಕರ್ಷಣೆಯ ಕ್ಷೇತ್ರವನ್ನು ಹೋಲುವ ಹಲವು ವಿಧಗಳಲ್ಲಿರಬಹುದು. ಹೊರಹೀರುವಿಕೆ ಕ್ಷೇತ್ರದಲ್ಲಿ, ಒಬ್ಬರು ಸಂಭಾವ್ಯ ಮೇಲ್ಮೈಗಳನ್ನು ಕಲ್ಪಿಸಿಕೊಳ್ಳಬಹುದು, ಅಂದರೆ, ಅದೇ ಹೊರಹೀರುವಿಕೆ ಸಂಭಾವ್ಯತೆಯಿಂದ ನಿರೂಪಿಸಲ್ಪಟ್ಟ ಮೇಲ್ಮೈಗಳು. ಹೊರಹೀರುವಿಕೆ ಸಾಮರ್ಥ್ಯದ ಪರಿಕಲ್ಪನೆಯ ಅಡಿಯಲ್ಲಿ θ ಕ್ಷೇತ್ರದ ಒಂದು ನಿರ್ದಿಷ್ಟ ಬಿಂದುವಿನಿಂದ ಒಂದು ನಿರ್ದಿಷ್ಟ ಅನಿಲ ಹಂತಕ್ಕೆ 1 ಮೋಲ್ ಆಡ್ಸರ್ಬೆಂಟ್ ಅನ್ನು ಚಲಿಸುವಾಗ ಹೊರಹೀರುವಿಕೆ ಶಕ್ತಿಗಳ ವಿರುದ್ಧ ಮಾಡಿದ ಕೆಲಸಕ್ಕಿಂತ ಹೆಚ್ಚೇನೂ ಅಲ್ಲ ಎಂದು ತಿಳಿಯಬೇಕು. ಗರಿಷ್ಠ ಹೊರಹೀರುವಿಕೆ ಸಾಮರ್ಥ್ಯವು "ಆಡ್ಸರ್ಬೆಂಟ್ - ಆಡ್ಸರ್ಪ್ಶನ್ ವಾಲ್ಯೂಮ್" ಗಡಿಯಲ್ಲಿ ಅಸ್ತಿತ್ವದಲ್ಲಿರುತ್ತದೆ. ಆದರೆ "ಪರಿಮಾಣ - ಅನಿಲ ಹಂತ" ಗಡಿಯಲ್ಲಿ (ಇಲ್ಲಿ ಹೊರಹೀರುವಿಕೆ ಶಕ್ತಿಗಳ ಕ್ರಿಯೆಯು ಕೊನೆಗೊಳ್ಳುತ್ತದೆ), ಹೊರಹೀರುವಿಕೆಯ ಸಾಮರ್ಥ್ಯವು ಶೂನ್ಯಕ್ಕೆ ಸಮನಾಗಿರಬೇಕು. ಹೊರಹೀರುವಿಕೆಯ ಪರಿಮಾಣದಲ್ಲಿನ ಬದಲಾವಣೆಯೊಂದಿಗೆ ಹೊರಹೀರುವಿಕೆಯ ಸಾಮರ್ಥ್ಯದಲ್ಲಿನ ಬದಲಾವಣೆಯನ್ನು ವಕ್ರಾಕೃತಿಗಳ ರೂಪದಲ್ಲಿ ಪ್ರತಿನಿಧಿಸಬಹುದು. ಇದನ್ನು ಮೊಟ್ಟಮೊದಲ ಬಾರಿಗೆ ಮಾಡಿದ್ದು ಎಂ.ಪೋಲಿಯಾನಿ. ಈ ರೀತಿಯ ವಕ್ರಾಕೃತಿಗಳು ತಾಪಮಾನದ ಮೇಲೆ ಅವಲಂಬಿತವಾಗಿಲ್ಲ ಮತ್ತು ಪ್ರತಿ ನಿರ್ದಿಷ್ಟ ಆಡ್ಸರ್ಬೆಂಟ್ನ ವಿಶಿಷ್ಟ ಲಕ್ಷಣವಾಗಿರಬಹುದು; ಈ ರೀತಿಯ ವಕ್ರಾಕೃತಿಗಳನ್ನು ಸಾಮಾನ್ಯವಾಗಿ ವಿಶಿಷ್ಟ ಹೀರಿಕೊಳ್ಳುವ ವಕ್ರಾಕೃತಿಗಳು ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಪಾಲಿಮೋಲಿಕ್ಯುಲರ್ ಹೊರಹೀರುವಿಕೆಯ ಸಿದ್ಧಾಂತವು ರಾಜ್ಯದ ಅನಿಲ ಸಮೀಕರಣವು ಹೊರಹೀರುವಿಕೆಯ ಪರಿಮಾಣಕ್ಕೆ ಅನ್ವಯಿಸುತ್ತದೆ ಎಂದು ಊಹಿಸುತ್ತದೆ. ಪರಿಣಾಮವಾಗಿ, ವಿಭಿನ್ನ ತಾಪಮಾನಗಳಿಗೆ ಪರಿಮಾಣದ ಮೇಲೆ ಆಡ್ಸರ್ಬೆಂಟ್ನ ಸಾಂದ್ರತೆಯ ಅವಲಂಬನೆಯನ್ನು ನಿರೂಪಿಸುವ ಐಸೊಥರ್ಮ್ಗಳು ಪರಿಮಾಣದ ಮೇಲಿನ ಒತ್ತಡದ ಅವಲಂಬನೆಯ ಐಸೊಥರ್ಮ್ಗಳನ್ನು ಹೋಲುತ್ತವೆ. ಕಡಿಮೆ ತಾಪಮಾನದಲ್ಲಿ, ಮೇಲ್ಮೈ ಹೀರಿಕೊಳ್ಳುವ ಶಕ್ತಿಗಳು ಆವಿಯನ್ನು ಒಂದು ನಿರ್ದಿಷ್ಟ ಸಾಂದ್ರತೆಯ ದ್ರವವಾಗಿ ಸಾಂದ್ರೀಕರಿಸಲು ಕಾರಣವಾಗಬಹುದು. ನಿರ್ಣಾಯಕಕ್ಕಿಂತ ಕಡಿಮೆ ತಾಪಮಾನದಲ್ಲಿ, ಘನೀಕರಣದ ಸಮಯದಲ್ಲಿ, ಸಂಪೂರ್ಣ ಹೊರಹೀರುವಿಕೆಯ ಪರಿಮಾಣವು ದ್ರವದಿಂದ ತುಂಬಿರುತ್ತದೆ. ಈ ಸಂದರ್ಭದಲ್ಲಿ, ಹೊರಹೀರುವಿಕೆ ವಕ್ರರೇಖೆಯು ಅಬ್ಸಿಸ್ಸಾ ಅಕ್ಷಕ್ಕೆ ಬಹುತೇಕ ಸಮಾನಾಂತರವಾಗಿ ಚಲಿಸುತ್ತದೆ, ಇದು ದ್ರವದ ಕಡಿಮೆ ಸಂಕುಚಿತತೆಗೆ ಸಂಬಂಧಿಸಿದೆ. ನಂತರ "ವಾಲ್ಯೂಮ್ - ಗ್ಯಾಸ್ ಫೇಸ್" ಗಡಿಯಲ್ಲಿನ ಹೊರಹೀರುವಿಕೆ ಕರ್ವ್ ತೀವ್ರವಾಗಿ ಇಳಿಯುತ್ತದೆ ಮತ್ತು ಅದರ ಪ್ರಕಾರ, ಆಡ್ಸರ್ಬೆಂಟ್ ಸಾಂದ್ರತೆಯು ಅನಿಲ ಹಂತದ ನಿರ್ದಿಷ್ಟ ಸಾಂದ್ರತೆಯನ್ನು ತಲುಪುತ್ತದೆ. ನಿರ್ಣಾಯಕ ತಾಪಮಾನಕ್ಕಿಂತ ಹೆಚ್ಚಿನ ತಾಪಮಾನದಲ್ಲಿ, ಹೊರಹೀರುವಿಕೆಯು ಆದರ್ಶ ಅನಿಲದಂತೆ ವರ್ತಿಸಬಹುದು ಮತ್ತು ಗ್ರಾಫ್ ಅನ್ನು ಆದರ್ಶ ಅನಿಲ ಐಸೊಥರ್ಮ್ ಆಗಿ ವ್ಯಕ್ತಪಡಿಸಲಾಗುತ್ತದೆ. pV = RT. ಅಂತಹ ಪರಿಸ್ಥಿತಿಗಳಲ್ಲಿ, ಹೊರಹೀರುವ ಅನಿಲವು ಆಡ್ಸರ್ಬೆಂಟ್ನ ಮೇಲ್ಮೈಯಲ್ಲಿ ಗರಿಷ್ಠ ಸಾಂದ್ರತೆಯನ್ನು ಹೊಂದಿರುತ್ತದೆ ಮತ್ತು ಅನಿಲ ಹಂತದ ತಕ್ಷಣದ ಸಮೀಪದಲ್ಲಿ ಕನಿಷ್ಠ ಸಾಂದ್ರತೆಯನ್ನು ಹೊಂದಿರುತ್ತದೆ. ಇದಲ್ಲದೆ, ಈ ಸಂದರ್ಭದಲ್ಲಿ, ಹೀರಿಕೊಳ್ಳುವ ಪದರದಲ್ಲಿ ಹೀರಿಕೊಳ್ಳುವ ಸಾಂದ್ರತೆಯು ದ್ರವದ ಸಾಂದ್ರತೆಯನ್ನು ಎಲ್ಲಿಯೂ ತಲುಪುವುದಿಲ್ಲ ಎಂದು ಗಮನಿಸುವುದು ಮುಖ್ಯ. ಮತ್ತು ತಾಪಮಾನವು ನಿರ್ಣಾಯಕಕ್ಕೆ ತುಂಬಾ ಹತ್ತಿರದಲ್ಲಿದ್ದರೆ, ಪರಿಮಾಣದ ಮೇಲೆ ಸಾಂದ್ರತೆಯ ಅವಲಂಬನೆಯು ಐಸೊಥರ್ಮ್ಗೆ ಹತ್ತಿರವಿರುವ ವಕ್ರರೇಖೆಯಿಂದ ವ್ಯಕ್ತವಾಗುತ್ತದೆ, ಇದನ್ನು ವಿವರಿಸಲಾಗಿದೆ. ವ್ಯಾನ್ ಡೆರ್ ವಾಲ್ಸ್ ಸಮೀಕರಣ.ಈ ಪರಿಸ್ಥಿತಿಯಲ್ಲಿ, ಹೊರಹೀರುವ ವಸ್ತುವಿನ ಭಾಗವು ದ್ರವ ಸ್ಥಿತಿಯಲ್ಲಿ ಆಡ್ಸರ್ಬ್ಡ್ ಪರಿಮಾಣದಲ್ಲಿರುತ್ತದೆ ಮತ್ತು ಹೊರಹೀರುವ ವಸ್ತುವಿನ ಭಾಗವು ಅನಿಲ ಸ್ಥಿತಿಯಲ್ಲಿರುತ್ತದೆ. ನಂತರ ದ್ರವದಿಂದ ಅನಿಲಕ್ಕೆ ಪರಿವರ್ತನೆಗೆ ಅನುಗುಣವಾದ ವಿಭಾಗದಲ್ಲಿ ವಕ್ರರೇಖೆಯು ಹೆಚ್ಚು ತೀವ್ರವಾಗಿ ಕಡಿಮೆಯಾಗುತ್ತದೆ. ನೀವು ಆಡ್ಸಾರ್ಪ್ಟಿವ್ಗಳಲ್ಲಿ ಒಂದರ ಪ್ರಾಯೋಗಿಕ ಹೊರಹೀರುವಿಕೆ ಐಸೊಥರ್ಮ್ನಿಂದ ವಿಶಿಷ್ಟವಾದ ವಕ್ರರೇಖೆಯನ್ನು ನಿರ್ಮಿಸಿದರೆ ಮತ್ತು ಇತರ ಕೆಲವು ಆಡ್ಸಾರ್ಪ್ಟಿವ್ಗಳಿಗೆ ಅನುಗುಣವಾದ ಸಂಬಂಧ ಗುಣಾಂಕಗಳನ್ನು ತಿಳಿದಿದ್ದರೆ, ನೀವು ಹೊರಹೀರುವಿಕೆ ಐಸೊಥರ್ಮ್ ಅನ್ನು ಕಂಡುಹಿಡಿಯಬಹುದು ಮತ್ತು ಅದನ್ನು ಮತ್ತೊಂದು ಆಡ್ಸಾರ್ಪ್ಟಿವ್ಗಾಗಿ ನಿರ್ಮಿಸಬಹುದು. ಹೊರಹೀರುವಿಕೆಯ ಸಂಭಾವ್ಯ ಸಿದ್ಧಾಂತವು ಒಂದು ಆವಿಯ ಹೊರಹೀರುವಿಕೆಯ ಐಸೊಥರ್ಮ್ನಿಂದ ಪಡೆದ ವಿಶಿಷ್ಟ ವಕ್ರರೇಖೆಯನ್ನು ಬಳಸಿಕೊಂಡು ಒಂದೇ ಆಡ್ಸರ್ಬೆಂಟ್ನಲ್ಲಿ ವಿಭಿನ್ನ ಆವಿಗಳ ವಿಭಿನ್ನ ಹೀರಿಕೊಳ್ಳುವ ಐಸೊಥೆರ್ಮ್ಗಳನ್ನು ಲೆಕ್ಕಾಚಾರ ಮಾಡಲು ಸಾಧ್ಯವಾಗಿಸುತ್ತದೆ, ಏಕೆಂದರೆ ಹೊರಹೀರುವಿಕೆಯ ಸಾಮರ್ಥ್ಯದ ಅನುಪಾತವು ಹೊರಹೀರುವಿಕೆಯ ಪರಿಮಾಣಗಳನ್ನು ಅವಲಂಬಿಸಿರುವುದಿಲ್ಲ. .
ಬಾಂಧವ್ಯ(ಲ್ಯಾಟಿನ್ ಅಫಿನಿಸ್ ನಿಂದ - "ಸಂಬಂಧಿತ") - ಅಫಿನಿಟಿ ಕ್ರೊಮ್ಯಾಟೋಗ್ರಫಿ. ಪ್ರೋಟೀನುಗಳನ್ನು ಶುದ್ಧೀಕರಿಸುವ ಮತ್ತು ಬೇರ್ಪಡಿಸುವ ವಿಧಾನವು ಜಡ ವಾಹಕಕ್ಕೆ (ಅಫಿನಿಟಿ ಕ್ರೊಮ್ಯಾಟೋಗ್ರಫಿ) ಕೋವೆಲೆಂಟ್ ಆಗಿ ಬಂಧಿಸಲ್ಪಟ್ಟಿರುವ ಲಿಗಂಡ್ನೊಂದಿಗೆ ಅವುಗಳ ಆಯ್ದ ಪರಸ್ಪರ ಕ್ರಿಯೆಯನ್ನು ಆಧರಿಸಿದೆ. ರಿಸೆಪ್ಟರ್ಗೆ ವಿಷಕಾರಿಯ ಸಂಬಂಧವನ್ನು ಅಳೆಯುವುದು ಮೂಲಭೂತವಾಗಿ ಕಾವು ಮಾಧ್ಯಮಕ್ಕೆ ಸೇರಿಸಲಾದ ವಸ್ತುವಿನ ಪ್ರಮಾಣ ಮತ್ತು ಪರಸ್ಪರ ಕ್ರಿಯೆಯ ಪರಿಣಾಮವಾಗಿ ರೂಪುಗೊಂಡ ವಿಷಕಾರಿ-ಗ್ರಾಹಕ ಸಂಕೀರ್ಣದ ನಡುವಿನ ಸಂಬಂಧದ ಪ್ರಾಯೋಗಿಕ ಅಧ್ಯಯನವಾಗಿದೆ.
ಹೊರಹೀರುವಿಕೆ ಪ್ರಕ್ರಿಯೆಗಳ ಥರ್ಮೋಡೈನಾಮಿಕ್ಸ್.
| ಪ್ಯಾರಾಮೀಟರ್ ಹೆಸರು | ಅರ್ಥ |
| ಲೇಖನ ವಿಷಯ: | ಹೊರಹೀರುವಿಕೆ ಪ್ರಕ್ರಿಯೆಗಳ ಥರ್ಮೋಡೈನಾಮಿಕ್ಸ್. |
| ರೂಬ್ರಿಕ್ (ವಿಷಯಾಧಾರಿತ ವರ್ಗ) | ಶಿಕ್ಷಣ |
ಹೊರಹೀರುವಿಕೆ ಪ್ರಕ್ರಿಯೆಗಳ ವರ್ಗೀಕರಣದ ಮೂಲ ವ್ಯಾಖ್ಯಾನಗಳು ಮತ್ತು ವಿಧಾನಗಳು.
ಹೊರಹೀರುವಿಕೆ ಮೇಲ್ಮೈ ಶಕ್ತಿಯಲ್ಲಿ ಸ್ವಾಭಾವಿಕ ಇಳಿಕೆಯಿಂದಾಗಿ ಸಂಭವಿಸುವ ವಿದ್ಯಮಾನಗಳನ್ನು ಸೂಚಿಸುತ್ತದೆ.
ಹೊರಹೀರುವಿಕೆ- ಮೇಲ್ಮೈ ಪದರ ಮತ್ತು ಏಕರೂಪದ ಹಂತದ ಪರಿಮಾಣದ ನಡುವಿನ ವೈವಿಧ್ಯಮಯ ವ್ಯವಸ್ಥೆಯ ಘಟಕಗಳ ಸ್ವಯಂಪ್ರೇರಿತ ರಿವರ್ಸಿಬಲ್ ಅಥವಾ ಬದಲಾಯಿಸಲಾಗದ ಪುನರ್ವಿತರಣೆ ಪ್ರಕ್ರಿಯೆ.
ಮಲ್ಟಿಕಾಂಪೊನೆಂಟ್ ವ್ಯವಸ್ಥೆಗಳಲ್ಲಿ, ಇಂಟರ್ಫೇಶಿಯಲ್ ಟೆನ್ಷನ್ ಅನ್ನು ಹೆಚ್ಚು ಬಲವಾಗಿ ಕಡಿಮೆ ಮಾಡುವ ಘಟಕವನ್ನು ಮೇಲ್ಮೈ ಪದರಕ್ಕೆ ವರ್ಗಾಯಿಸಲಾಗುತ್ತದೆ. ಒಂದು-ಘಟಕ ವ್ಯವಸ್ಥೆಗಳಲ್ಲಿ, ಮೇಲ್ಮೈ ಪದರದ ರಚನೆಯ ಸಮಯದಲ್ಲಿ, ಅದರ ರಚನೆಯಲ್ಲಿ ಬದಲಾವಣೆ ಸಂಭವಿಸುತ್ತದೆ (ಪರಮಾಣುಗಳು ಮತ್ತು ಅಣುಗಳ ಒಂದು ನಿರ್ದಿಷ್ಟ ದೃಷ್ಟಿಕೋನ, ಧ್ರುವೀಕರಣ), ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ ಸ್ವಯಂ ಹೀರಿಕೊಳ್ಳುವಿಕೆ.
ಹೊರಹೀರುವಿಕೆಯ ಪರಸ್ಪರ ಕ್ರಿಯೆಗಳನ್ನು ಸ್ಥಳೀಕರಿಸಿದ ದಟ್ಟವಾದ ಹಂತವನ್ನು ಕರೆಯಲಾಗುತ್ತದೆ ಹೀರಿಕೊಳ್ಳುವ. ಏಕರೂಪದ ಹಂತ ಮತ್ತು ಮೇಲ್ಮೈ ಪದರದ ಪರಿಮಾಣದ ನಡುವೆ ಮರುಹಂಚಿಕೆ ಮಾಡಲಾದ ವಸ್ತುವನ್ನು ʼʼ ಎಂಬ ಪದದಿಂದ ಗೊತ್ತುಪಡಿಸಲಾಗಿದೆ ಹೀರಿಕೊಳ್ಳುತ್ತವೆʼʼ.
ಕೆಲವು ಸಂದರ್ಭಗಳಲ್ಲಿ, ಹೀರಿಕೊಳ್ಳುವ ಪ್ರಕ್ರಿಯೆಯು ಹಿಂತಿರುಗಿಸಬಹುದಾಗಿದೆ. ಈ ಸಂದರ್ಭದಲ್ಲಿ, ಕೆಲವು ಪರಿಸ್ಥಿತಿಗಳಲ್ಲಿ, ಆಣ್ವಿಕ ಚಲನ ವಿದ್ಯಮಾನಗಳ ಪರಿಣಾಮವಾಗಿ ಹೊರಹೀರುವ ಅಣುಗಳ ಭಾಗವು ಮೇಲ್ಮೈ ಪದರದಿಂದ ಬೃಹತ್ ಹಂತಕ್ಕೆ ಚಲಿಸಬಹುದು. ಹೊರಹೀರುವಿಕೆಯ ಹಿಮ್ಮುಖ ಪ್ರಕ್ರಿಯೆಯನ್ನು ಕರೆಯಲಾಗುತ್ತದೆ ನಿರ್ಜಲೀಕರಣ.
ಹೊರಹೀರುವಿಕೆ ಪ್ರಕ್ರಿಯೆಗಳನ್ನು ವರ್ಗೀಕರಿಸುವ ವಿಧಾನಗಳು.
ಪರಸ್ಪರ ಕ್ರಿಯೆಯ ಹಂತಗಳ ಒಟ್ಟುಗೂಡಿಸುವಿಕೆಯ ಸ್ಥಿತಿಗೆ ಅನುಗುಣವಾಗಿ ಹೊರಹೀರುವಿಕೆ ಪ್ರಕ್ರಿಯೆಗಳ ವರ್ಗೀಕರಣ.ಪಕ್ಕದ ಹಂತಗಳ ಒಟ್ಟು ಸ್ಥಿತಿಯ ಅವಲಂಬನೆಯನ್ನು ಗಣನೆಗೆ ತೆಗೆದುಕೊಂಡು, ಕೆಳಗಿನ ರೀತಿಯ ಹೊರಹೀರುವಿಕೆ ಪ್ರಕ್ರಿಯೆಗಳನ್ನು ಪ್ರತ್ಯೇಕಿಸಲಾಗಿದೆ:
ಘನ ಆಡ್ಸರ್ಬೆಂಟ್ಗಳ ಮೇಲೆ ಅನಿಲಗಳ ಹೊರಹೀರುವಿಕೆ;
"ಘನ-ದ್ರವ" ಮತ್ತು "ದ್ರವ-ದ್ರವ" ಇಂಟರ್ಫೇಸ್ಗಳಲ್ಲಿ ಕರಗಿದ ಪದಾರ್ಥಗಳ ಹೊರಹೀರುವಿಕೆ;
ದ್ರವ-ಅನಿಲ ಇಂಟರ್ಫೇಸ್ನಲ್ಲಿ ಸರ್ಫ್ಯಾಕ್ಟಂಟ್ಗಳ ಹೊರಹೀರುವಿಕೆ.
ಆಡ್ಸರ್ಬೆಂಟ್ ಮತ್ತು ಆಡ್ಸೋರ್ಬೇಟ್ ನಡುವಿನ ಪರಸ್ಪರ ಕ್ರಿಯೆಯ ಕಾರ್ಯವಿಧಾನದ ಪ್ರಕಾರ ಹೊರಹೀರುವಿಕೆ ಪ್ರಕ್ರಿಯೆಗಳ ವರ್ಗೀಕರಣ.ಹೊರಹೀರುವಿಕೆಯನ್ನು ಆಡ್ಸರ್ಬೆಂಟ್ನ ಸಕ್ರಿಯ ಕೇಂದ್ರಗಳೊಂದಿಗೆ ಆಡ್ಸೋರ್ಬೇಟ್ ಅಣುಗಳ ಪರಸ್ಪರ ಕ್ರಿಯೆ ಎಂದು ಪರಿಗಣಿಸಬಹುದು. ಅವುಗಳ ಪರಸ್ಪರ ಕ್ರಿಯೆಯ ಕಾರ್ಯವಿಧಾನದ ಪ್ರಕಾರ, ಕೆಳಗಿನ ರೀತಿಯ ಹೊರಹೀರುವಿಕೆಯನ್ನು ವಿಂಗಡಿಸಲಾಗಿದೆ:
1) ಭೌತಿಕ (ಆಣ್ವಿಕ) ಹೊರಹೀರುವಿಕೆ- ಆಡ್ಸೋರ್ಬೇಟ್ ಮತ್ತು ಆಡ್ಸರ್ಬೆಂಟ್ ಅಣುಗಳ ನಡುವಿನ ಪರಸ್ಪರ ಕ್ರಿಯೆಯನ್ನು ವ್ಯಾನ್ ಡೆರ್ ವಾಲ್ಸ್ ಬಲಗಳು, ಹೈಡ್ರೋಜನ್ ಬಂಧಗಳಿಂದ (ಇಲ್ಲದೆ) ನಡೆಸಲಾಗುತ್ತದೆ ರಾಸಾಯನಿಕ ಪ್ರತಿಕ್ರಿಯೆಗಳು);
2) ರಾಸಾಯನಿಕ ಹೊರಹೀರುವಿಕೆ (ರಾಸಾಯನಿಕ ಹೀರಿಕೊಳ್ಳುವಿಕೆ)- ಆಡ್ಸರ್ಬೆಂಟ್ನ ಸಕ್ರಿಯ ಕೇಂದ್ರಗಳಿಗೆ ಆಡ್ಸರ್ಬೇಟ್ ಅಣುಗಳ ಲಗತ್ತಿಸುವಿಕೆಯು ವಿವಿಧ ರೀತಿಯ ರಾಸಾಯನಿಕ ಪ್ರತಿಕ್ರಿಯೆಗಳ ಪರಿಣಾಮವಾಗಿ ಸಂಭವಿಸುತ್ತದೆ (ಅಯಾನು ವಿನಿಮಯ ಪ್ರತಿಕ್ರಿಯೆಗಳನ್ನು ಹೊರತುಪಡಿಸಿ);
3) ಅಯಾನು ವಿನಿಮಯ ಹೊರಹೀರುವಿಕೆ (ಅಯಾನು ವಿನಿಮಯ) - ಅಯಾನು ವಿನಿಮಯ ಪ್ರತಿಕ್ರಿಯೆಗಳ ಕಾರ್ಯವಿಧಾನದ ಪ್ರಕಾರ ದ್ರಾವಣ ಮತ್ತು ಘನ ಹಂತದ (ಅಯಾನು ವಿನಿಮಯಕಾರಕ) ನಡುವಿನ ಆಡ್ಸೋರ್ಬೇಟ್ ವಸ್ತುವಿನ ಪುನರ್ವಿತರಣೆ.
ಹೊರಹೀರುವಿಕೆ ಪ್ರಕ್ರಿಯೆಗಳನ್ನು ಪರಿಮಾಣಾತ್ಮಕವಾಗಿ ವಿವರಿಸಲು, ಎರಡು ಪ್ರಮಾಣಗಳನ್ನು ಬಳಸಲಾಗುತ್ತದೆ.
1) ಸಂಪೂರ್ಣ ಹೊರಹೀರುವಿಕೆ– ಪ್ರತಿ ಯೂನಿಟ್ ಮೇಲ್ಮೈ ವಿಸ್ತೀರ್ಣ ಅಥವಾ ಆಡ್ಸರ್ಬೆಂಟ್ನ ದ್ರವ್ಯರಾಶಿಯ ಪ್ರಮಾಣ (ಮೋಲ್) ಅಥವಾ ದ್ರವ್ಯರಾಶಿ (ಕೆಜಿ). ಹುದ್ದೆ - ಎ; ಆಯಾಮ: mol/m2, mol/kg, kg/m2, kg/kᴦ.
2) ಗಿಬ್ಸ್ (ಹೆಚ್ಚುವರಿ) ಹೊರಹೀರುವಿಕೆ- ಏಕರೂಪದ ಹಂತದ ಪರಿಮಾಣದಲ್ಲಿ ಅದರ ಪ್ರಮಾಣಕ್ಕೆ ಹೋಲಿಸಿದರೆ ನಿರ್ದಿಷ್ಟ ದಪ್ಪದ ಮೇಲ್ಮೈ ಪದರದಲ್ಲಿ ಆಡ್ಸೋರ್ಬೇಟ್ ವಸ್ತುವಿನ ಹೆಚ್ಚುವರಿ, ಪ್ರತಿ ಯೂನಿಟ್ ಮೇಲ್ಮೈ ವಿಸ್ತೀರ್ಣ ಅಥವಾ ಆಡ್ಸರ್ಬೆಂಟ್ ದ್ರವ್ಯರಾಶಿ. ಹುದ್ದೆ - ಜಿ; ಆಯಾಮ: mol/m 2, mol/kᴦ.
ಸಂಪೂರ್ಣ ಮತ್ತು ಹೆಚ್ಚುವರಿ ಹೊರಹೀರುವಿಕೆಯ ನಡುವಿನ ಸಂಬಂಧವನ್ನು ಸಮೀಕರಣವನ್ನು ಬಳಸಿಕೊಂಡು ವಿವರಿಸಬಹುದು:
Г = А – с * h (3.1)
ಇಲ್ಲಿ c ಎಂಬುದು ಹಂತದ ಪರಿಮಾಣದಲ್ಲಿ ವಸ್ತುವಿನ ಸಮತೋಲನ ಸಾಂದ್ರತೆಯಾಗಿದೆ, mol/m3;
h ಎಂಬುದು ಮೇಲ್ಮೈ ಪದರದ ದಪ್ಪವಾಗಿದ್ದು, ಸಾಂಪ್ರದಾಯಿಕವಾಗಿ 10 -9 ಮೀ ಎಂದು ಊಹಿಸಲಾಗಿದೆ.
ಮಲ್ಟಿಕಾಂಪೊನೆಂಟ್ ವೈವಿಧ್ಯಮಯ ವ್ಯವಸ್ಥೆಗಳಲ್ಲಿ, ಏಕರೂಪದ ಹಂತ ಮತ್ತು ಮೇಲ್ಮೈ ಪದರದ ಪರಿಮಾಣದ ನಡುವೆ ಒಂದು ಅಥವಾ ಇನ್ನೊಂದು ಘಟಕವನ್ನು ಪುನರ್ವಿತರಣೆ ಮಾಡಿದಾಗ, ಮೇಲ್ಮೈಯ ಹೆಚ್ಚುವರಿ ಆಂತರಿಕ ಶಕ್ತಿಯ ಸಮೀಕರಣವು ಮಾನ್ಯವಾಗಿರುತ್ತದೆ:
U = T * S + s * s + Sm i * n i (3.2)
ಸಮೀಕರಣದ ಎಲ್ಲಾ ಪದಗಳನ್ನು ಇಂಟರ್ಫೇಸ್ ಮೇಲ್ಮೈಯ ಯುನಿಟ್ ಪ್ರದೇಶಕ್ಕೆ ಕಡಿಮೆ ಮಾಡಿ, ನಾವು ಪಡೆಯುತ್ತೇವೆ:
U s = T * S s + s + Sm i * Г i (3.3)
ಇಲ್ಲಿ Г i = n i / s ಎಂಬುದು ಮೇಲ್ಮೈ ಪದರದಲ್ಲಿನ i-th ಘಟಕದ ಹೆಚ್ಚುವರಿ, ಅಂದರೆ, ಗಿಬ್ಸ್ ಹೀರಿಕೊಳ್ಳುವಿಕೆ.
ಒಂದು-ಘಟಕ ವ್ಯವಸ್ಥೆಗೆ, ಸಮೀಕರಣ (3.3) ರೂಪವನ್ನು ತೆಗೆದುಕೊಳ್ಳುತ್ತದೆ:
G s = s + m * G (3.4)
ಅಲ್ಲಿ G s = U s - T * S s - ಮೇಲ್ಮೈಯ ಗಿಬ್ಸ್ ಶಕ್ತಿ ಅಥವಾ ಯುನಿಟ್ ಮೇಲ್ಮೈ ಪ್ರದೇಶವನ್ನು ರಚಿಸುವ ಕೆಲಸ;
m * G - ಮೇಲ್ಮೈ ಪದರದಲ್ಲಿ ಹೀರಿಕೊಳ್ಳುವ ವಸ್ತುವಿನ ವಸ್ತುವಿನ ಸಂಕೋಚನ.
ಸಮೀಕರಣದ (3.4) ಆಧಾರದ ಮೇಲೆ, ಹೊರಹೀರುವಿಕೆಯ ಸಮಯದಲ್ಲಿ, ಇಂಟರ್ಫೇಸ್ ಮೇಲ್ಮೈಯನ್ನು ರಚಿಸುವ ಕೆಲಸವು ಮೇಲ್ಮೈ ರಚನೆಯ ಕೆಲಸವನ್ನು ಒಳಗೊಂಡಿರುತ್ತದೆ (ಆಡ್ಸೋರ್ಬೇಟ್ ಹಂತದ ಪರಿಮಾಣದಲ್ಲಿ ಒಗ್ಗೂಡಿಸುವ ಬಂಧಗಳನ್ನು ಮುರಿಯುವುದು) ಮತ್ತು ಮೇಲ್ಮೈ ಪದರದಲ್ಲಿ ವಸ್ತುವಿನ ಸಂಕೋಚನವನ್ನು ಒಳಗೊಂಡಿರುತ್ತದೆ ಎಂದು ನಾವು ತೀರ್ಮಾನಿಸಬಹುದು.
ಆಡ್ಸರ್ಬೆಂಟ್ ಮತ್ತು ಆಡ್ಸೋರ್ಬೇಟ್ ನಡುವಿನ ಡೈನಾಮಿಕ್ ಸಮತೋಲನದ ಸ್ಥಿತಿಯಲ್ಲಿ, ವೈವಿಧ್ಯಮಯ ವ್ಯವಸ್ಥೆಯ ಗಿಬ್ಸ್ ಶಕ್ತಿಯ ಬದಲಾವಣೆ ΔG = 0, ಹೊರಹೀರುವಿಕೆ ಪ್ರಕ್ರಿಯೆಯ ಥರ್ಮೋಡೈನಾಮಿಕ್ಸ್ ಎಂಬ ಸಮೀಕರಣದಿಂದ ವಿವರಿಸಲಾಗಿದೆ ಗಿಬ್ಸ್ ಮೂಲಭೂತ ಹೊರಹೀರುವಿಕೆ ಸಮೀಕರಣ:
Ds = SГ i * dm i (3.5)
ಈ ಸಮೀಕರಣವು ಸಾರ್ವತ್ರಿಕವಾಗಿದೆ, ಏಕೆಂದರೆ ಇದು ಎಲ್ಲಾ ವಿಧದ ಹೊರಹೀರುವಿಕೆ ಪ್ರಕ್ರಿಯೆಗಳಿಗೆ ಮಾನ್ಯವಾಗಿದೆ
ಗಿಬ್ಸ್ ಹೊರಹೀರುವಿಕೆ ಸಮೀಕರಣದ ವಿಶೇಷ ಪ್ರಕರಣಗಳು.
1) ಪರಿಹಾರಗಳಿಂದ ಹೊರಹೀರುವಿಕೆ.
"ದ್ರವ - ಘನ ಆಡ್ಸರ್ಬೆಂಟ್" ಮತ್ತು "ದ್ರವ - ಅನಿಲ" ಇಂಟರ್ಫೇಸ್ಗಳಲ್ಲಿ ಹೊರಹೀರುವಿಕೆಯ ಸಮಯದಲ್ಲಿ ಸಿಸ್ಟಮ್ನ ಐಥ್ ಘಟಕದ ರಾಸಾಯನಿಕ ಸಾಮರ್ಥ್ಯಕ್ಕಾಗಿ, ಈ ಕೆಳಗಿನ ಸಮೀಕರಣಗಳು ಮಾನ್ಯವಾಗಿರುತ್ತವೆ:
m i = m i 0 + R*T*ln a i (3.6)
dm i = R*T* d ln a i (3.7)
ಇಲ್ಲಿ m i 0 ಎಂಬುದು ವ್ಯವಸ್ಥೆಯ i-th ಘಟಕದ ರಾಸಾಯನಿಕ ವಿಭವವಾಗಿದೆ ಪ್ರಮಾಣಿತ ಪರಿಸ್ಥಿತಿಗಳು;
a i ಪ್ರಮಾಣಿತ ಪರಿಸ್ಥಿತಿಗಳಲ್ಲಿ ವ್ಯವಸ್ಥೆಯ i-th ಘಟಕದ ಚಟುವಟಿಕೆಯಾಗಿದೆ.
ಇದರ ಆಧಾರದ ಮೇಲೆ, ಗಿಬ್ಸ್ ಹೊರಹೀರುವಿಕೆ ಸಮೀಕರಣವು ರೂಪವನ್ನು ಪಡೆಯುತ್ತದೆ:
Г i = - a i / R*T * (ds / da i) (3.8)
ವಿದ್ಯುದ್ವಿಚ್ಛೇದ್ಯಗಳಲ್ಲದ ಪರಿಹಾರಗಳಿಗಾಗಿ ನಾವು i = c i ತೆಗೆದುಕೊಳ್ಳುತ್ತೇವೆ, ನಂತರ:
Г i = - с / R*T * (ds / dс) (3.9)
ಎಲೆಕ್ಟ್ರೋಲೈಟ್ ಪರಿಹಾರಗಳಿಗಾಗಿ:
Г i = - с ± n / R*T * (ds / dс ± n) (3.10)
ಇಲ್ಲಿ с ± ಎಂಬುದು ದ್ರಾವಣದ ಸರಾಸರಿ ಅಯಾನಿಕ್ ಸಾಂದ್ರತೆಯಾಗಿದೆ;
n ಎಂಬುದು ಸ್ಟೊಚಿಯೊಮೆಟ್ರಿಕ್ ಗುಣಾಂಕವಾಗಿದೆ.
2) ಅನಿಲ ಹಂತದಿಂದ ವಸ್ತುಗಳ ಹೊರಹೀರುವಿಕೆ.
ಮೆಂಡಲೀವ್-ಕ್ಲೇಪೆರಾನ್ ಸಮೀಕರಣಕ್ಕೆ ಅನುಗುಣವಾಗಿ:
Р = с * R*T (3.11)
ಈ ನಿಟ್ಟಿನಲ್ಲಿ, ಘನ ಆಡ್ಸರ್ಬೆಂಟ್ಗಳ ಮೇಲೆ ಅನಿಲಗಳ ಹೊರಹೀರುವಿಕೆಗೆ ಗಿಬ್ಸ್ ಸಮೀಕರಣವನ್ನು ಈ ಕೆಳಗಿನ ರೂಪದಲ್ಲಿ ಬರೆಯಲಾಗಿದೆ:
Г i = - Р / R*T * (ds / dР) (3.12)
ಪ್ರಾಯೋಗಿಕವಾಗಿ, ಗಿಬ್ಸ್ ಹೊರಹೀರುವಿಕೆ ಸಮೀಕರಣವು ಮೇಲ್ಮೈ ಒತ್ತಡವನ್ನು ನಿರ್ಧರಿಸುವ ಇಂಟರ್ಫೇಶಿಯಲ್ ಪದರದಲ್ಲಿನ ವಸ್ತುಗಳ ಹೊರಹೀರುವಿಕೆಯ ಪ್ರಮಾಣವನ್ನು ಲೆಕ್ಕಾಚಾರ ಮಾಡಲು ದ್ರವ ಸಾಂದ್ರತೆ ಅಥವಾ ಸಮತೋಲನ ಅನಿಲ ಒತ್ತಡದ ವಿವಿಧ ಮೌಲ್ಯಗಳಲ್ಲಿ ಮೇಲ್ಮೈ ಒತ್ತಡದ ಮಾಪನಗಳ ಆಧಾರದ ಮೇಲೆ ಅನುಮತಿಸುತ್ತದೆ.
ಹೊರಹೀರುವಿಕೆ ಪ್ರಕ್ರಿಯೆಗಳ ಥರ್ಮೋಡೈನಾಮಿಕ್ಸ್. - ಪರಿಕಲ್ಪನೆ ಮತ್ತು ಪ್ರಕಾರಗಳು. ವರ್ಗೀಕರಣ ಮತ್ತು ವರ್ಗದ ವೈಶಿಷ್ಟ್ಯಗಳು "ಹೀರಿಕೊಳ್ಳುವ ಪ್ರಕ್ರಿಯೆಗಳ ಥರ್ಮೋಡೈನಾಮಿಕ್ಸ್." 2017, 2018.
ಎರಡು ಪರಮಾಣುಗಳ ನಡುವಿನ ಪರಸ್ಪರ ಕ್ರಿಯೆಯ ಸಂದರ್ಭದಲ್ಲಿ:
ಯು - ಪರಸ್ಪರ ಶಕ್ತಿ;
U = U PRIOR. + ಯು ಹಿಂತಿರುಗಿ
 - ಲೆನಾರ್ಡ್-ಜೋನ್ಸ್ ಸಮೀಕರಣ
, c, b, m = const
- ಲೆನಾರ್ಡ್-ಜೋನ್ಸ್ ಸಮೀಕರಣ
, c, b, m = const
ಘನ ಮೇಲ್ಮೈಯೊಂದಿಗೆ ಪರಮಾಣುಗಳ ಪರಸ್ಪರ ಕ್ರಿಯೆಯ ಸಂದರ್ಭಗಳಲ್ಲಿ, ಎಲ್ಲಾ ಸಂವಹನಗಳನ್ನು ಒಟ್ಟುಗೂಡಿಸುವುದು ಅವಶ್ಯಕ.
x - ಮೇಲ್ಮೈಗೆ ದೂರ
ಆರ್ - ಆಕರ್ಷಕ ಶಕ್ತಿಗಳ ಕ್ರಿಯೆಯ ತ್ರಿಜ್ಯ
ಡಿವಿ - ಪರಿಮಾಣ
n - ಮೇಲ್ಮೈ ಅಣುಗಳ ಸಂಖ್ಯೆ
ಯು ಎಡಿಎಸ್. - ಹೊರಹೀರುವಿಕೆ ಪರಸ್ಪರ ಕ್ರಿಯೆಯ ಶಕ್ತಿ



ಹೊರಹೀರುವಿಕೆಯ ಸಂದರ್ಭದಲ್ಲಿ, ಆಕರ್ಷಣೆಯು ಹೆಚ್ಚಾಗುತ್ತದೆ. ಮತ್ತು ನಾನ್ಪೋಲಾರ್-ಪೋಲಾರ್ ಪರಸ್ಪರ ಕ್ರಿಯೆಯ ಸಂದರ್ಭದಲ್ಲಿ, ಹೊರಹೀರುವಿಕೆಯನ್ನು ಪ್ರಧಾನವಾಗಿ ಹಿನ್ಸರಿತಗಳಲ್ಲಿ ಸ್ಥಳೀಕರಿಸಲಾಗುತ್ತದೆ.
ಸ್ಥಾಯೀವಿದ್ಯುತ್ತಿನ ಪರಸ್ಪರ ಕ್ರಿಯೆ.
ಪೋಲಾರ್ ಆಡ್ಸರ್ಬೆಂಟ್ - ಧ್ರುವೀಯವಲ್ಲದ ಆಡ್ಸೋರ್ಬೇಟ್
ನಾನ್-ಪೋಲಾರ್ ಆಡ್ಸರ್ಬೆಂಟ್ - ಪೋಲಾರ್ ಆಡ್ಸೋರ್ಬೇಟ್
ಧ್ರುವ ಆಡ್ಸರ್ಬೆಂಟ್ - ಧ್ರುವ ಆಡ್ಸೋರ್ಬೇಟ್.
ಎಂ  ಆಡ್ಸೋರ್ಬೇಟ್ ಅಣುವನ್ನು ದ್ವಿಧ್ರುವಿಯಾಗಿ ಪ್ರತಿನಿಧಿಸಲಾಗುತ್ತದೆ, ಮತ್ತು ಆಡ್ಸರ್ಬೆಂಟ್ ಅನ್ನು ವಾಹಕವಾಗಿ ಪ್ರತಿನಿಧಿಸಲಾಗುತ್ತದೆ, ಇದರಲ್ಲಿ ಆಡ್ಸೋರ್ಬೇಟ್ ಅಣುವು ದ್ವಿಧ್ರುವಿ ಕನ್ನಡಿಯನ್ನು ನೀಡಿದ ಒಂದಕ್ಕೆ ಸಂಬಂಧಿಸಿದಂತೆ ಸಮ್ಮಿತೀಯವಾಗಿ ಪ್ರೇರೇಪಿಸುತ್ತದೆ.
ಆಡ್ಸೋರ್ಬೇಟ್ ಅಣುವನ್ನು ದ್ವಿಧ್ರುವಿಯಾಗಿ ಪ್ರತಿನಿಧಿಸಲಾಗುತ್ತದೆ, ಮತ್ತು ಆಡ್ಸರ್ಬೆಂಟ್ ಅನ್ನು ವಾಹಕವಾಗಿ ಪ್ರತಿನಿಧಿಸಲಾಗುತ್ತದೆ, ಇದರಲ್ಲಿ ಆಡ್ಸೋರ್ಬೇಟ್ ಅಣುವು ದ್ವಿಧ್ರುವಿ ಕನ್ನಡಿಯನ್ನು ನೀಡಿದ ಒಂದಕ್ಕೆ ಸಂಬಂಧಿಸಿದಂತೆ ಸಮ್ಮಿತೀಯವಾಗಿ ಪ್ರೇರೇಪಿಸುತ್ತದೆ.
X - ಮಧ್ಯದ ಅಂತರ
ಸಂವಹನ ಮಾಡುವಾಗ, ಸಂಭಾವ್ಯತೆಯು ಉದ್ಭವಿಸುತ್ತದೆ:
 ,
,
 - ದ್ವಿಧ್ರುವಿ ಕ್ಷಣ.
- ದ್ವಿಧ್ರುವಿ ಕ್ಷಣ.
ಸಂಭಾವ್ಯತೆಯು ಗರಿಷ್ಠ ಮೌಲ್ಯವನ್ನು ತೆಗೆದುಕೊಳ್ಳುತ್ತದೆ, ಅಂದರೆ. ದ್ವಿಧ್ರುವಿಗಳು ಮೇಲ್ಮೈಗೆ ಲಂಬವಾಗಿ ಓರಿಯಂಟ್ ಆಗುತ್ತವೆ.
ತಾಪಮಾನದಲ್ಲಿನ ಹೆಚ್ಚಳವು ಬ್ರೌನಿಯನ್ ಚಲನೆಯ ಬೆಳವಣಿಗೆಯನ್ನು ಉತ್ತೇಜಿಸುತ್ತದೆಯಾದ್ದರಿಂದ, ಇದು ಹೊರಹೀರುವಿಕೆ ಪ್ರಕ್ರಿಯೆಯ ಪ್ರತಿಬಂಧಕ್ಕೆ ಕಾರಣವಾಗುತ್ತದೆ.
ಸ್ಥಾಯೀವಿದ್ಯುತ್ತಿನ ಪರಸ್ಪರ ಕ್ರಿಯೆಯ ಸಂದರ್ಭದಲ್ಲಿ, ಆಡ್ಸೋರ್ಬೇಟ್ ಅನ್ನು ಪ್ರಧಾನವಾಗಿ ಮುಂಚಾಚಿರುವಿಕೆಗಳ ಮೇಲೆ ಸ್ಥಳೀಕರಿಸಲಾಗುತ್ತದೆ.
ಮೂಲಭೂತ ಹೊರಹೀರುವಿಕೆ ಸಮೀಕರಣ.
ಹೊರಹೀರುವಿಕೆಯ ಸಂದರ್ಭದಲ್ಲಿ, ಘಟಕದ ಪುನರ್ವಿತರಣೆ ಸಂಭವಿಸುತ್ತದೆ, ಅಂದರೆ ರಾಸಾಯನಿಕ ಸಂಭಾವ್ಯ ಬದಲಾವಣೆಗಳು. ಹೊರಹೀರುವಿಕೆ ಪ್ರಕ್ರಿಯೆಯನ್ನು ಮೇಲ್ಮೈ ಶಕ್ತಿಯನ್ನು ರಾಸಾಯನಿಕ ಶಕ್ತಿಯಾಗಿ ಪರಿವರ್ತಿಸುವುದು ಎಂದು ಪರಿಗಣಿಸಬಹುದು.
ಪದರದ ಪರಿಮಾಣ = 0, ನಂತರ ಥರ್ಮೋಡೈನಾಮಿಕ್ಸ್ನ I ಮತ್ತು II ನಿಯಮಗಳ ಸಾಮಾನ್ಯ ಸಮೀಕರಣ:
T = const; (1) = (2) => 

ಎರಡು-ಘಟಕ ವ್ಯವಸ್ಥೆಗಾಗಿ:
,
 ,
,
 =>
=>
=>
 - ಗಿಬ್ಸ್ ಹೊರಹೀರುವಿಕೆ ಸಮೀಕರಣ
.
- ಗಿಬ್ಸ್ ಹೊರಹೀರುವಿಕೆ ಸಮೀಕರಣ
.
ಟಿವಿ ಹೊರಹೀರುವಿಕೆಯ ಸಂದರ್ಭದಲ್ಲಿ. ದೇಹ - ಅನಿಲ:, 
 ,
,

 - ಐಸೋಥರ್ಮ್
- ಐಸೋಥರ್ಮ್
 - ಐಸೊಬಾರ್
- ಐಸೊಬಾರ್
 - ಐಸೊಪಿಕ್ನಲ್
- ಐಸೊಪಿಕ್ನಲ್
 - ಐಸೊಸ್ಟೆರ್
- ಐಸೊಸ್ಟೆರ್
ಐಸೊಥರ್ಮ್, ಐಸೊಪಿಕ್ನೆ, ಐಸೊಸ್ಟೆರ್ ಪರಸ್ಪರ ಸಂಬಂಧಿಸಿವೆ.
ಏಕೆಂದರೆ ಹೊರಹೀರುವಿಕೆ ಕಾರ್ಯ 



ಹೆನ್ರಿ ಐಸೊಥರ್ಮ್ ಲ್ಯಾಂಗ್ಮುಯಿರ್ ಐಸೊಥರ್ಮ್



ಥರ್ಮೋಡೈನಾಮಿಕ್ಸ್. ಹೊರಹೀರುವಿಕೆ.
ಮಂದಗೊಳಿಸಿದ ವಸ್ತುವಿಗೆ:
 ,
,
 ,
,
 - ಗಿಬ್ಸ್ ಶಕ್ತಿಯಲ್ಲಿ ಅವಿಭಾಜ್ಯ ಬದಲಾವಣೆ
.
- ಗಿಬ್ಸ್ ಶಕ್ತಿಯಲ್ಲಿ ಅವಿಭಾಜ್ಯ ಬದಲಾವಣೆ
.

ಪಿ - ಬಾಗಿದ ಮೇಲ್ಮೈ ಮೇಲೆ ಒತ್ತಡ, Р S - ಸಮತಟ್ಟಾದ ಮೇಲ್ಮೈ ಮೇಲೆ ಒತ್ತಡ
 - ಹೀರಿಕೊಳ್ಳುವ ಸಾಮರ್ಥ್ಯ
- ಹೀರಿಕೊಳ್ಳುವ ಸಾಮರ್ಥ್ಯ
ಎಂಟ್ರಾಪಿಯಲ್ಲಿ ಭೇದಾತ್ಮಕ ಬದಲಾವಣೆ 
 , Г = const
, Г = const
- ಡಿಫರೆನ್ಷಿಯಲ್ ಎಂಟ್ರೊಪಿ ಬದಲಾವಣೆ
- ಹೊರಹೀರುವಿಕೆಯ ವಿಭಿನ್ನ ಎಂಥಾಲ್ಪಿ
 - ಹೊರಹೀರುವಿಕೆಯ ಐಸೊಸ್ಟೆರಿಕ್ ಶಾಖ
- ಹೊರಹೀರುವಿಕೆಯ ಐಸೊಸ್ಟೆರಿಕ್ ಶಾಖ
 - ಘನೀಕರಣದ ಶಾಖ
- ಘನೀಕರಣದ ಶಾಖ
 - ಹೊರಹೀರುವಿಕೆಯ ನಿವ್ವಳ ಶಾಖ
- ಹೊರಹೀರುವಿಕೆಯ ನಿವ್ವಳ ಶಾಖ

 ,
,




Qa - ಹೊರಹೀರುವಿಕೆಯ ಅವಿಭಾಜ್ಯ ಶಾಖ, 
Qra - ಹೊರಹೀರುವಿಕೆಯ ಸಮಗ್ರ ನಿವ್ವಳ ಶಾಖ,

ಹೆನ್ರಿಯ ಸಮೀಕರಣ
ಹೊರಹೀರುವಿಕೆಯ ಅಧ್ಯಯನವು ಮೇಲ್ಮೈಯ ವೈವಿಧ್ಯತೆಯಿಂದ ಜಟಿಲವಾಗಿದೆ, ಆದ್ದರಿಂದ ಏಕರೂಪದ ಮೇಲ್ಮೈಗಳಿಗೆ ಸರಳವಾದ ಕಾನೂನುಗಳನ್ನು ಪಡೆಯಲಾಗುತ್ತದೆ.
ಘನ ಮೇಲ್ಮೈಯೊಂದಿಗೆ ಅನಿಲಗಳ ಪರಸ್ಪರ ಕ್ರಿಯೆಯನ್ನು ಪರಿಗಣಿಸೋಣ, ಪರಿಮಾಣದಲ್ಲಿನ ಸಮತೋಲನ ಸ್ಥಿತಿಯಿಂದ ಮೇಲ್ಮೈಯಲ್ಲಿ ಸಮತೋಲನ ಸ್ಥಿತಿಗೆ ಅನಿಲ ಪರಿವರ್ತನೆಯಾಗುತ್ತದೆ. ಈ ಪ್ರಕರಣವು ಗುರುತ್ವಾಕರ್ಷಣೆಯ ಕ್ಷೇತ್ರದಲ್ಲಿ ಅನಿಲಗಳ ಸಮತೋಲನಕ್ಕೆ ಹೋಲುತ್ತದೆ.
 ,
,
 ,
=>
,
=> -ಹೆನ್ರಿಯ ಸಮೀಕರಣ
-ಹೆನ್ರಿಯ ಸಮೀಕರಣ
 - ವಿತರಣಾ ಗುಣಾಂಕ
- ವಿತರಣಾ ಗುಣಾಂಕ
ಹೊರಹೀರುವಿಕೆ ಪ್ರಕ್ರಿಯೆಯಲ್ಲಿ, ರಾಸಾಯನಿಕ ವಿಭವಗಳಲ್ಲಿ ಬದಲಾವಣೆ ಸಂಭವಿಸುತ್ತದೆ.
ಬೃಹತ್ ಹಂತಕ್ಕೆ: 
ಮೇಲ್ಮೈಯಲ್ಲಿ ಅನಿಲಕ್ಕಾಗಿ: 
ಸಮತೋಲನ ಸ್ಥಿತಿಯಲ್ಲಿ  , ಅಂದರೆ
, ಅಂದರೆ

ಹೆನ್ರಿಯ ಸಮೀಕರಣದಲ್ಲಿ ಸ್ಥಿರತೆಯು ಏಕಾಗ್ರತೆಯನ್ನು ಅವಲಂಬಿಸಿರುವುದಿಲ್ಲ
ಹೆನ್ರಿಯ ಸಮೀಕರಣವು ಕಡಿಮೆ ಒತ್ತಡ ಮತ್ತು ಸಾಂದ್ರತೆಯ ಪ್ರದೇಶದಲ್ಲಿ ಮಾನ್ಯವಾಗಿದೆ. ಏಕಾಗ್ರತೆ ಹೆಚ್ಚಾದಂತೆ, ಹೆನ್ರಿಯ ನಿಯಮದಿಂದ 2 ವಿಧದ ವಿಚಲನಗಳು ಸಾಧ್ಯ:
1 - ಧನಾತ್ಮಕ ವಿಚಲನಗಳು, ಡಿ ಕಡಿಮೆಯಾಗುತ್ತದೆ, ಎ ಕಡಿಮೆಯಾಗುತ್ತದೆ
2 - ಋಣಾತ್ಮಕ ವಿಚಲನಗಳು, ಡಿ - ಹೆಚ್ಚಾಗುತ್ತದೆ, ಎ - ಹೆಚ್ಚಾಗುತ್ತದೆ.
ವಿಚಲನದ ಪ್ರಕಾರವು ಒಂದು ಅಥವಾ ಇನ್ನೊಂದು ವಿಧದ ಆಡ್ಸರ್ಬೆಂಟ್-ಆಡ್ಸೋರ್ಬೇಟ್ ಪರಸ್ಪರ ಕ್ರಿಯೆಯ ಪ್ರಾಬಲ್ಯದಿಂದ ನಿರ್ಧರಿಸಲ್ಪಡುತ್ತದೆ.
ಬಲವಾದ ಅಂಟಿಕೊಳ್ಳುವ ಪರಸ್ಪರ ಕ್ರಿಯೆಯೊಂದಿಗೆ, ಚಟುವಟಿಕೆಯ ಗುಣಾಂಕಗಳು ಹೆಚ್ಚಾಗುತ್ತವೆ - ಧನಾತ್ಮಕ ವಿಚಲನ. ಸಂಯೋಜಿತ ಸಂವಹನಗಳ ಸಂದರ್ಭದಲ್ಲಿ, ನಕಾರಾತ್ಮಕ ವಿಚಲನಗಳನ್ನು ಗಮನಿಸಬಹುದು.
ಮೊನೊಮಾಲಿಕ್ಯುಲರ್ ಹೊರಹೀರುವಿಕೆ.
ಲ್ಯಾಂಗ್ಮುಯಿರ್ ಐಸೋಥರ್ಮ್.
ಹೆನ್ರಿಯ ಸಿದ್ಧಾಂತದಲ್ಲಿ ಸರಳವಾದ ಮಾದರಿಗಳನ್ನು ಪಡೆಯಲಾಗಿದೆ. ಲ್ಯಾಂಗ್ಮುಯಿರ್ ಒಂದು ಸಿದ್ಧಾಂತವನ್ನು ಪ್ರಸ್ತಾಪಿಸಿದರು, ಅದರ ಪ್ರಕಾರ ಹೊರಹೀರುವಿಕೆಯನ್ನು ಅರೆ-ರಾಸಾಯನಿಕ ಕ್ರಿಯೆ ಎಂದು ಪರಿಗಣಿಸಲಾಗುತ್ತದೆ. ಇದರಲ್ಲಿ:
ಮೇಲ್ಮೈ ಶಕ್ತಿಯುತವಾಗಿ ಏಕರೂಪವಾಗಿದೆ.
ಹೊರಹೀರುವಿಕೆಯನ್ನು ಸ್ಥಳೀಕರಿಸಲಾಗಿದೆ, ಪ್ರತಿ ಹೊರಹೀರುವಿಕೆ ಕೇಂದ್ರವು ಒಂದು ಆಡ್ಸೋರ್ಬೇಟ್ ಅಣುವಿನೊಂದಿಗೆ ಸಂವಹನ ನಡೆಸುತ್ತದೆ.
ಆಡ್ಸೋರ್ಬೇಟ್ ಅಣುಗಳು ಪರಸ್ಪರ ಸಂವಹನ ನಡೆಸುವುದಿಲ್ಲ.
ಏಕಪದರದ ಹೊರಹೀರುವಿಕೆ.

 - ಮೇಲ್ಮೈ,
- ಮೇಲ್ಮೈ,  - ಹೀರಿಕೊಳ್ಳುವ,
- ಹೀರಿಕೊಳ್ಳುವ,  - ಹೊರಹೀರುವಿಕೆ ಸಂಕೀರ್ಣ.
- ಹೊರಹೀರುವಿಕೆ ಸಂಕೀರ್ಣ.
 , ನಂತರ ಹೊರಹೀರುವಿಕೆ ಸೈಟ್ಗಳ ಸಾಂದ್ರತೆ:
, ನಂತರ ಹೊರಹೀರುವಿಕೆ ಸೈಟ್ಗಳ ಸಾಂದ್ರತೆ:  ,
, - ಸೀಮಿತಗೊಳಿಸುವ ಹೊರಹೀರುವಿಕೆ.
- ಸೀಮಿತಗೊಳಿಸುವ ಹೊರಹೀರುವಿಕೆ.
 , ನಂತರ ಪ್ರತಿಕ್ರಿಯೆ ಸ್ಥಿರವಾಗಿರುತ್ತದೆ:
, ನಂತರ ಪ್ರತಿಕ್ರಿಯೆ ಸ್ಥಿರವಾಗಿರುತ್ತದೆ: 

 - ಲ್ಯಾಂಗ್ಮುಯಿರ್ ಸಮೀಕರಣ.
- ಲ್ಯಾಂಗ್ಮುಯಿರ್ ಸಮೀಕರಣ.
ಏಕಾಗ್ರತೆಯ ಮೇಲೆ ಹೊರಹೀರುವಿಕೆಯ ಅವಲಂಬನೆ
1 )
)
 ,
,

2) ಹೆಚ್ಚಿನ ಸಾಂದ್ರತೆಯ ಪ್ರದೇಶ
 - ಸೀಮಿತಗೊಳಿಸುವ ಹೊರಹೀರುವಿಕೆ, ಮೊನೊಮಾಲಿಕ್ಯುಲರ್ ಪದರದ ರಚನೆ
- ಸೀಮಿತಗೊಳಿಸುವ ಹೊರಹೀರುವಿಕೆ, ಮೊನೊಮಾಲಿಕ್ಯುಲರ್ ಪದರದ ರಚನೆ
ಗಿಬ್ಸ್ ಶಕ್ತಿಗಾಗಿ: .
g ಎಂಬುದು ಎಂಟ್ರೊಪಿ ಅಂಶವಾಗಿದೆ.
ಹೆನ್ರಿ ಐಸೊಥರ್ಮ್ನ ಸಂದರ್ಭದಲ್ಲಿ, ಗಿಬ್ಸ್ ಶಕ್ತಿಯು ಆಡ್ಸೋರ್ಬೇಟ್ ಅನ್ನು ಬೃಹತ್ ಪ್ರಮಾಣಿತ ಸ್ಥಿತಿಯಿಂದ ಮೇಲ್ಮೈಯಲ್ಲಿ ಪ್ರಮಾಣಿತ ಸ್ಥಿತಿಗೆ ಪರಿವರ್ತಿಸುವುದನ್ನು ನಿರೂಪಿಸುತ್ತದೆ. ಲ್ಯಾಂಗ್ಮುಯಿರ್ ಐಸೊಥರ್ಮ್ನ ಸಂದರ್ಭದಲ್ಲಿ  ಆಡ್ಸರ್ಬೆಂಟ್ ಮತ್ತು ಆಡ್ಸೋರ್ಬೇಟ್ ನಡುವಿನ ಸಂಬಂಧದ ಮಟ್ಟವನ್ನು ನಿರೂಪಿಸುತ್ತದೆ.
ಆಡ್ಸರ್ಬೆಂಟ್ ಮತ್ತು ಆಡ್ಸೋರ್ಬೇಟ್ ನಡುವಿನ ಸಂಬಂಧದ ಮಟ್ಟವನ್ನು ನಿರೂಪಿಸುತ್ತದೆ.
 ವ್ಯಾನ್ಟ್ ಹಾಫ್ ಐಸೊಬಾರ್ ನಿಂದ ಕಂಡುಬಂದಿದೆ.
ವ್ಯಾನ್ಟ್ ಹಾಫ್ ಐಸೊಬಾರ್ ನಿಂದ ಕಂಡುಬಂದಿದೆ.

 , ನಂತರ
, ನಂತರ  , ಆದ್ದರಿಂದ
, ಆದ್ದರಿಂದ  .
.

 - ಮೇಲ್ಮೈ ತುಂಬುವಿಕೆಯ ಮಟ್ಟ.
- ಮೇಲ್ಮೈ ತುಂಬುವಿಕೆಯ ಮಟ್ಟ.




 - ಉಚಿತ ಆಸನಗಳ ಸಂಖ್ಯೆ,
- ಉಚಿತ ಆಸನಗಳ ಸಂಖ್ಯೆ,  - ಆಕ್ರಮಿತ ಸ್ಥಳಗಳ ಸಂಖ್ಯೆ.
- ಆಕ್ರಮಿತ ಸ್ಥಳಗಳ ಸಂಖ್ಯೆ.
 ,
,

ಆ. ಹೆಚ್ಚಿನ ಸಾಂದ್ರತೆಯ ಪ್ರದೇಶದಲ್ಲಿ, ಉಚಿತ ಸೈಟ್ಗಳ ಸಂಖ್ಯೆಯು ಆಡ್ಸೋರ್ಬೇಟ್ ಪ್ರಮಾಣಕ್ಕೆ ವಿಲೋಮ ಅನುಪಾತದಲ್ಲಿರುತ್ತದೆ.
ಏಕರೂಪದ ಮೇಲ್ಮೈಯಲ್ಲಿ ಅನಿಲಗಳ ಮಿಶ್ರಣದ ಹೊರಹೀರುವಿಕೆ.
ಈ ಸಂದರ್ಭದಲ್ಲಿ, ಹೀರಿಕೊಳ್ಳುವ ಪ್ರಕ್ರಿಯೆಯನ್ನು ಎರಡು ಸಮಾನಾಂತರ ಪ್ರತಿಕ್ರಿಯೆಗಳಾಗಿ ಪರಿಗಣಿಸಲಾಗುತ್ತದೆ.
 (1)
(1)

 (2)
(2)


ಏಕರೂಪದ ಮೇಲ್ಮೈಯಲ್ಲಿ ಅನಿಲಗಳ ಮಿಶ್ರಣದ ಹೊರಹೀರುವಿಕೆ.
ಏಕರೂಪವಲ್ಲದ ಮೇಲ್ಮೈಯ ಸಂದರ್ಭದಲ್ಲಿ, ಒಬ್ಬನು ತನ್ನನ್ನು ಸರಾಸರಿ ತುಂಬುವಿಕೆಗೆ ಮಿತಿಗೊಳಿಸಲು ಸಾಧ್ಯವಿಲ್ಲ.
ಸ್ಪರ್ಧೆಯ ಪರಿಣಾಮವಾಗಿ, ವಿವಿಧ ರೀತಿಯ ಪ್ರದೇಶಗಳಲ್ಲಿ ವಿಭಿನ್ನ ಆಡ್ಸೋರ್ಬೇಟ್ಗಳ ಸ್ಥಳೀಕರಣ ಸಾಧ್ಯ.
ಈ ಸಂದರ್ಭದಲ್ಲಿ ಸಂಬಂಧ  .
.
 ,
,
 - ಆಡ್ಸೋರ್ಬೇಟ್ನ ಸ್ಯಾಚುರೇಟೆಡ್ ಆವಿಯ ಒತ್ತಡ.
- ಆಡ್ಸೋರ್ಬೇಟ್ನ ಸ್ಯಾಚುರೇಟೆಡ್ ಆವಿಯ ಒತ್ತಡ.
 ,
,
 - ಹೊರಹೀರುವಿಕೆಯ ಶಾಖ.
- ಹೊರಹೀರುವಿಕೆಯ ಶಾಖ.
“+” - ಸಿಂಬೇಟ್ ಅವಲಂಬನೆ, “-” - ಆಂಟಿಬೇಟ್ ಅವಲಂಬನೆ, “N” - ಯಾವುದೇ ಪರಸ್ಪರ ಸಂಬಂಧವಿಲ್ಲ.
"+" - ಅದೇ ಕಾರ್ಯವಿಧಾನದ ಪ್ರಕಾರ ಹೊರಹೀರುವಿಕೆ ಮುಂದುವರಿಯುತ್ತದೆ. ಹೆಚ್ಚು ಶಕ್ತಿಯುತವಾಗಿ ಅನುಕೂಲಕರವಾದ ಪ್ರದೇಶಗಳಲ್ಲಿ, ಮೇಲ್ಮೈಗೆ ಹೆಚ್ಚಿನ ಸಂಬಂಧವನ್ನು ಹೊಂದಿರುವ ಅನಿಲವು ಪ್ರಧಾನವಾಗಿ ಹೀರಿಕೊಳ್ಳುತ್ತದೆ.
“-” - ಹೊರಹೀರುವಿಕೆ ವಿವಿಧ ಕಾರ್ಯವಿಧಾನಗಳ ಮೂಲಕ ಸಂಭವಿಸುತ್ತದೆ ಮತ್ತು ನಿರ್ದಿಷ್ಟ ಸಮಯದವರೆಗೆ ಮೇಲ್ಮೈಗೆ ಯಾವುದೇ ಸ್ಪರ್ಧೆಯಿಲ್ಲ.
ಕಡಿಮೆ ಮೌಲ್ಯಗಳಲ್ಲಿ ಅನಿಲಗಳ ಭೌತಿಕ ಹೊರಹೀರುವಿಕೆಯ ಸಮಯದಲ್ಲಿ ಮೊನೊಮಾಲಿಕ್ಯುಲರ್ ಹೊರಹೀರಿಕೆಯನ್ನು ಪ್ರಧಾನವಾಗಿ ಅರಿತುಕೊಳ್ಳಲಾಗುತ್ತದೆ ಪ, ಹಾಗೆಯೇ ದ್ರವ / ಅನಿಲ ಇಂಟರ್ಫೇಸ್ನಲ್ಲಿ.
ಪಾಲಿಮಾಲಿಕ್ಯುಲರ್ ಹೊರಹೀರುವಿಕೆ.
BET ಸಿದ್ಧಾಂತ(ಬ್ರೂನೌರ್, ಎಮ್ಮೆಟ್, ಟೆಲ್ಲರ್).
ಒಂದು ಏಕಪದರದ ರಚನೆಯು ಮೇಲ್ಮೈ ಶಕ್ತಿಯನ್ನು ಸರಿದೂಗಿಸಲು ಸಾಕಾಗುವುದಿಲ್ಲವಾದರೆ, ಹೊರಹೀರುವಿಕೆ ಬಹು ಅಣುವಾಗಿದೆ ಮತ್ತು ಮೇಲ್ಮೈ ಬಲಗಳ ಕ್ರಿಯೆಯ ಅಡಿಯಲ್ಲಿ ಬಲವಂತದ ಘನೀಕರಣದ ಪರಿಣಾಮವಾಗಿ ಪರಿಗಣಿಸಬಹುದು.
ಮುಖ್ಯ ಅಂಶಗಳು:
ಆಡ್ಸೋರ್ಬೇಟ್ ಅಣುವು ಆಕ್ರಮಿತ ಸೈಟ್ಗೆ ಹೊಡೆದಾಗ, ಬಹು ಸೆಟ್ ರಚನೆಯಾಗುತ್ತದೆ.
ನಾವು ಹತ್ತಿರವಾಗುತ್ತಿದ್ದಂತೆ ಪಗೆ ಪ ರುಉಚಿತ ಹೊರಹೀರುವಿಕೆ ಸೈಟ್ಗಳ ಸಂಖ್ಯೆ ಕಡಿಮೆಯಾಗುತ್ತದೆ. ಆರಂಭದಲ್ಲಿ, ಸಿಂಗಲ್ಸ್, ಡಬಲ್ಸ್ ಇತ್ಯಾದಿಗಳು ಆಕ್ರಮಿಸಿಕೊಂಡಿರುವ ಸ್ಥಳಗಳ ಸಂಖ್ಯೆಯು ಹೆಚ್ಚಾಗುತ್ತದೆ ಮತ್ತು ನಂತರ ಕಡಿಮೆಯಾಗುತ್ತದೆ. ಸೆಟ್ಗಳಲ್ಲಿ.
ನಲ್ಲಿ ಪ =ಪ ರು ಹೊರಹೀರುವಿಕೆ ಘನೀಕರಣವಾಗಿ ಬದಲಾಗುತ್ತದೆ.
ಯಾವುದೇ ಸಮತಲ ಸಂವಹನಗಳಿಲ್ಲ.
ಮೊದಲ ಪದರಕ್ಕಾಗಿ, ಲ್ಯಾಂಗ್ಮುಯಿರ್ ಐಸೊಥರ್ಮ್ ಅನ್ನು ಪೂರೈಸಲಾಗಿದೆ.
ಮೇಲ್ಮೈಯನ್ನು ಹೊರಹೀರುವಿಕೆ ತಾಣಗಳ ಒಂದು ಸೆಟ್ ಎಂದು ಪರಿಗಣಿಸಲಾಗುತ್ತದೆ. ಡೈನಾಮಿಕ್ ಸಮತೋಲನದ ಸ್ಥಿತಿಯು ಮಾನ್ಯವಾಗಿದೆ: ಮುಕ್ತ ಸ್ಥಳಗಳಲ್ಲಿ ಘನೀಕರಣದ ದರವು ಆಕ್ರಮಿತ ಸ್ಥಳಗಳಿಂದ ಆವಿಯಾಗುವ ದರಕ್ಕೆ ಸಮಾನವಾಗಿರುತ್ತದೆ.
a ಎಂಬುದು ಘನೀಕರಣ ಗುಣಾಂಕವಾಗಿದೆ (ಮೇಲ್ಮೈಯಲ್ಲಿ ಘನೀಕರಿಸಿದ ಅಣುಗಳ ಭಾಗ);
 ,
,
Zm - ಗರಿಷ್ಠ ಸಂಖ್ಯೆಯ ಉಚಿತ ಸೀಟುಗಳು.
 - ಮೇಲ್ಮೈಗೆ ಲಂಬವಾಗಿರುವ ದಿಕ್ಕಿನಲ್ಲಿ ಪರಮಾಣು ಕಂಪನಗಳ ಆವರ್ತನ.
- ಮೇಲ್ಮೈಗೆ ಲಂಬವಾಗಿರುವ ದಿಕ್ಕಿನಲ್ಲಿ ಪರಮಾಣು ಕಂಪನಗಳ ಆವರ್ತನ.
ಮೊದಲ ಪದರಕ್ಕೆ, ಡೈನಾಮಿಕ್ ಸಮತೋಲನ ಪರಿಸ್ಥಿತಿಗಳು:



 , ನಂತರ
, ನಂತರ
 - ಲ್ಯಾಂಗ್ಮುಯಿರ್ ಸಮೀಕರಣ.
- ಲ್ಯಾಂಗ್ಮುಯಿರ್ ಸಮೀಕರಣ.
ಎರಡನೇ ಪದರಕ್ಕೆ ಇದು ನಿಜವಾಗಲಿದೆ: 
i-th ಪದರಕ್ಕಾಗಿ: 
ಸರಳತೆಗಾಗಿ, ಮೊದಲನೆಯದನ್ನು ಹೊರತುಪಡಿಸಿ ಎಲ್ಲಾ ಪದರಗಳಿಗೆ a ಮತ್ತು ν ಒಂದೇ ಆಗಿರುತ್ತದೆ ಎಂದು ಊಹಿಸಲಾಗಿದೆ. ಮೊದಲನೆಯದನ್ನು ಹೊರತುಪಡಿಸಿ ಎಲ್ಲಾ ಪದರಗಳಿಗೆ, ಹೊರಹೀರುವಿಕೆಯ ಶಾಖವು ಸ್ಥಿರವಾಗಿರುತ್ತದೆ. ಕೊನೆಯ ಪದರಕ್ಕೆ, ಹೊರಹೀರುವಿಕೆಯ ಶಾಖವು ಘನೀಕರಣದ ಶಾಖಕ್ಕೆ ಸಮಾನವಾಗಿರುತ್ತದೆ. ಪರಿಣಾಮವಾಗಿ, ಸಮೀಕರಣವನ್ನು ಪಡೆಯಲಾಯಿತು
 (*)
(*)
ಸಿ- ನಿರಂತರ,
BET ಸಿದ್ಧಾಂತದ ಸಂದರ್ಭದಲ್ಲಿ, ಸ್ಥಿರ ಇದರೊಂದಿಗೆಶುದ್ಧ ಹೊರಹೀರುವಿಕೆಯ ಗಿಬ್ಸ್ ಶಕ್ತಿಯನ್ನು ನಿರೂಪಿಸುತ್ತದೆ. ಸಮೀಕರಣವು ಕೇವಲ ಒಂದು ಸ್ಥಿರತೆಯನ್ನು ಹೊಂದಿರುತ್ತದೆ, ಮತ್ತು ಆಡ್ಸರ್ಬೆಂಟ್ನ ನಿರ್ದಿಷ್ಟ ಮೇಲ್ಮೈ ಪ್ರದೇಶವನ್ನು ನಿರ್ಧರಿಸಲು ಈ ಸಮೀಕರಣವು ಬಹಳ ಮುಖ್ಯವಾಗಿದೆ.
ಹೊರಹೀರುವಿಕೆಯ ಪರಿಣಾಮವಾಗಿ ಶಾಖ ಬಿಡುಗಡೆಯಾಗುವುದರಿಂದ, ನಿರ್ದಿಷ್ಟ ಮೇಲ್ಮೈ ಪ್ರದೇಶಗಳನ್ನು ಕಡಿಮೆ ತಾಪಮಾನದಲ್ಲಿ ನಿರ್ಧರಿಸಲಾಗುತ್ತದೆ.
 ????????????
????????????


ಸಿದ್ಧಾಂತದ ಮುಖ್ಯ ನ್ಯೂನತೆ- ಲಂಬವಾದವುಗಳ ಪರವಾಗಿ ಸಮತಲ ಪರಸ್ಪರ ಕ್ರಿಯೆಗಳ ನಿರ್ಲಕ್ಷ್ಯ.
ಸಮೀಕರಣವು ವ್ಯಾಪ್ತಿಯಲ್ಲಿದೆ  0.05 ರಿಂದ 0.3 ರವರೆಗೆ.
0.05 ರಿಂದ 0.3 ರವರೆಗೆ.
ಎಲ್ಲಿ  <
0,05 – существенное влияние оказывает
неоднородность поверхности.
<
0,05 – существенное влияние оказывает
неоднородность поверхности.
 > 0.3 - ಆಡ್ಸೋರ್ಬೇಟ್ - ಆಡ್ಸೋರ್ಬೇಟ್ ಪರಸ್ಪರ ಪರಿಣಾಮ ಬೀರುತ್ತದೆ.
> 0.3 - ಆಡ್ಸೋರ್ಬೇಟ್ - ಆಡ್ಸೋರ್ಬೇಟ್ ಪರಸ್ಪರ ಪರಿಣಾಮ ಬೀರುತ್ತದೆ.
ಆಡ್ಸೋರ್ಬೇಟ್-ಆಡ್ಸೋರ್ಬೇಟ್ ಪರಸ್ಪರ ಕ್ರಿಯೆಗಳಿಗೆ ಲೆಕ್ಕಪತ್ರ ನಿರ್ವಹಣೆ.
ಕವಲೊಡೆದ ಅಣುಗಳು ಅಥವಾ ಅಣುಗಳು ಧ್ರುವೀಯವಲ್ಲದ ಮೇಲ್ಮೈಯಲ್ಲಿ ಹೀರಿಕೊಳ್ಳಲ್ಪಟ್ಟಾಗ ಪರಸ್ಪರ ಕ್ರಿಯೆಗಳು ಸಂಭವಿಸುತ್ತವೆ. ಸಹವರ್ತಿಗಳನ್ನು ರೂಪಿಸುವ ಸಾಮರ್ಥ್ಯ. ಈ ಸಂದರ್ಭದಲ್ಲಿ, ಹೊರಹೀರುವಿಕೆ ಐಸೋಥರ್ಮ್ಗಳ ಆಕಾರವು ಬದಲಾಗುತ್ತದೆ.
ಎ  ಆಡ್ಸರ್ಬೆಂಟ್ ಧ್ರುವೀಯವಾಗಿಲ್ಲ.
ಆಡ್ಸರ್ಬೆಂಟ್ ಧ್ರುವೀಯವಾಗಿಲ್ಲ.
ಗ್ರಾಫ್ 1 ದುರ್ಬಲ ಆಡ್ಸೋರ್ಬೇಟ್-ಆಡ್ಸೋರ್ಬೇಟ್ ಸಂವಹನಗಳು ಮತ್ತು ಬಲವಾದ ಆಡ್ಸೋರ್ಬೇಟ್-ಆಡ್ಸರ್ಬೆಂಟ್ ಪರಸ್ಪರ ಕ್ರಿಯೆಗಳಿಗೆ ಅನುರೂಪವಾಗಿದೆ.
ಗ್ರಾಫ್ 2 ಬಲವಾದ ಆಡ್ಸೋರ್ಬೇಟ್-ಆಡ್ಸೋರ್ಬೇಟ್ ಮತ್ತು ಬಲವಾದ ಆಡ್ಸೋರ್ಬೇಟ್-ಆಡ್ಸರ್ಬೆಂಟ್ ಸಂವಹನಗಳಿಗೆ ಅನುರೂಪವಾಗಿದೆ.
ಗ್ರಾಫ್ 3 ಬಲವಾದ ಆಡ್ಸೋರ್ಬೇಟ್-ಆಡ್ಸೋರ್ಬೇಟ್ ಸಂವಹನ ಮತ್ತು ದುರ್ಬಲ ಆಡ್ಸೋರ್ಬೇಟ್-ಆಡ್ಸರ್ಬೆಂಟ್ ಪರಸ್ಪರ ಕ್ರಿಯೆಗೆ ಅನುರೂಪವಾಗಿದೆ.
 ,
,

ಆಡ್ಸೋರ್ಬೇಟ್ ಅಣುಗಳ ನಡುವಿನ ಪರಸ್ಪರ ಕ್ರಿಯೆಯ ಸಂದರ್ಭದಲ್ಲಿ, ಚಟುವಟಿಕೆಯ ಗುಣಾಂಕಗಳಲ್ಲಿನ ಬದಲಾವಣೆಗಳನ್ನು ಗಣನೆಗೆ ತೆಗೆದುಕೊಳ್ಳುವುದು ಅವಶ್ಯಕ. ಮತ್ತು ಈ ಸಮೀಕರಣವನ್ನು ಹೀಗೆ ಬರೆಯಲಾಗಿದೆ:
 - ಫ್ರುಂಕಿನ್, ಫೌಲರ್, ಗುಗೆನ್ಹೈಮ್ ಸಮೀಕರಣ.
- ಫ್ರುಂಕಿನ್, ಫೌಲರ್, ಗುಗೆನ್ಹೈಮ್ ಸಮೀಕರಣ.
ಕೆ- ನಿರಂತರ ಆಕರ್ಷಣೆ.
ಪಾಲಿಯಾನಿಯ ಸಂಭಾವ್ಯ ಸಿದ್ಧಾಂತ.
ಈ ಸಿದ್ಧಾಂತವು ಯಾವುದೇ ರೀತಿಯ ಹೊರಹೀರುವಿಕೆ ಐಸೊಥರ್ಮ್ ಅನ್ನು ಪಡೆಯುವುದಿಲ್ಲ, ಆದರೆ ವಿಭಿನ್ನ ತಾಪಮಾನದಲ್ಲಿ ಐಸೊಥೆರ್ಮ್ಗಳನ್ನು ಲೆಕ್ಕಾಚಾರ ಮಾಡಲು ಸಾಧ್ಯವಾಗಿಸುತ್ತದೆ.
ಹೊರಹೀರುವಿಕೆ- ಇದು ಹೊರಹೀರುವಿಕೆಯ ಸಾಮರ್ಥ್ಯದ ಕ್ರಿಯೆಯ ಕಾರಣದಿಂದ ಹೊರಹೀರುವಿಕೆಯ ಮೇಲ್ಮೈಗೆ ಆಡ್ಸೋರ್ಬೇಟ್ನ ಆಕರ್ಷಣೆಯ ಪರಿಣಾಮವಾಗಿದೆ, ಇದು ಇತರ ಅಣುಗಳ ಉಪಸ್ಥಿತಿಯನ್ನು ಅವಲಂಬಿಸಿರುವುದಿಲ್ಲ ಮತ್ತು ಮೇಲ್ಮೈ ಮತ್ತು ಆಡ್ಸೋರ್ಬೇಟ್ ಅಣುವಿನ ನಡುವಿನ ಅಂತರವನ್ನು ಅವಲಂಬಿಸಿರುತ್ತದೆ.
 ,
,
 - ಹೀರಿಕೊಳ್ಳುವ ಸಾಮರ್ಥ್ಯ.
- ಹೀರಿಕೊಳ್ಳುವ ಸಾಮರ್ಥ್ಯ.
ಮೇಲ್ಮೈ ಏಕರೂಪವಲ್ಲದ ಕಾರಣ, ದೂರವನ್ನು ಹೊರಹೀರುವಿಕೆಯ ಪರಿಮಾಣದಿಂದ ಬದಲಾಯಿಸಲಾಗುತ್ತದೆ  .ಹೀರಿಕೊಳ್ಳುವ ಪರಿಮಾಣಮೇಲ್ಮೈ ಮತ್ತು ನಿರ್ದಿಷ್ಟ ಮೌಲ್ಯಕ್ಕೆ ಅನುಗುಣವಾದ ಬಿಂದುವಿನ ನಡುವೆ ಸುತ್ತುವರಿದ ಪರಿಮಾಣವಾಗಿದೆ
.ಹೀರಿಕೊಳ್ಳುವ ಪರಿಮಾಣಮೇಲ್ಮೈ ಮತ್ತು ನಿರ್ದಿಷ್ಟ ಮೌಲ್ಯಕ್ಕೆ ಅನುಗುಣವಾದ ಬಿಂದುವಿನ ನಡುವೆ ಸುತ್ತುವರಿದ ಪರಿಮಾಣವಾಗಿದೆ  .
.
ಹೀರಿಕೊಳ್ಳುವ ಸಾಮರ್ಥ್ಯಆಡ್ಸೋರ್ಬೇಟ್ನ 1 ಮೋಲ್ ಅನ್ನು ಹೊರಹೀರುವಿಕೆ ಪರಿಮಾಣದ ನಿರ್ದಿಷ್ಟ ಬಿಂದುವಿಗೆ ವರ್ಗಾಯಿಸುವ ಕೆಲಸವಾಗಿದೆ ಆಡ್ಸರ್ಬೆಂಟ್ನೊಂದಿಗೆ ಸಮತೋಲನದಲ್ಲಿ ಆವಿಯ ಹಂತಕ್ಕೆ).

ವಿಶಿಷ್ಟ ವಕ್ರರೇಖೆ
 - ಹೀರಿಕೊಳ್ಳುವ ಸಾಮರ್ಥ್ಯ,
- ಹೀರಿಕೊಳ್ಳುವ ಸಾಮರ್ಥ್ಯ, 
ನಿರ್ದಿಷ್ಟ ಆಡ್ಸರ್ಬೆಂಟ್ ಮತ್ತು ವಿವಿಧ ಆಡ್ಸೋರ್ಬೇಟ್ಗಳಿಗೆ, ಈ ಕೆಳಗಿನವುಗಳು ನಿಜ: 
ವಿವಿಧ ರೀತಿಯ ಆಡ್ಸೋರ್ಬೇಟ್ಗಳಿಗೆ  ,
,
ಎಲ್ಲಿ  ಸಾಪೇಕ್ಷ ಒತ್ತಡದಲ್ಲಿ ಹೊರಹೀರುವಿಕೆ ಐಸೋಥರ್ಮ್ಗಳ ಸಂಭಾವ್ಯತೆಗಳು
ಸಾಪೇಕ್ಷ ಒತ್ತಡದಲ್ಲಿ ಹೊರಹೀರುವಿಕೆ ಐಸೋಥರ್ಮ್ಗಳ ಸಂಭಾವ್ಯತೆಗಳು  ಆಡ್ಸೋರ್ಬೇಟ್ 1 ಮತ್ತು ಆಡ್ಸೋರ್ಬೇಟ್ 2. ಈ ಅನುಪಾತವು ಸ್ಥಿರ ಮೌಲ್ಯವಾಗಿದೆ.
ಆಡ್ಸೋರ್ಬೇಟ್ 1 ಮತ್ತು ಆಡ್ಸೋರ್ಬೇಟ್ 2. ಈ ಅನುಪಾತವು ಸ್ಥಿರ ಮೌಲ್ಯವಾಗಿದೆ.
 - ಸಂಬಂಧ ಗುಣಾಂಕ
- ಸಂಬಂಧ ಗುಣಾಂಕ
ಕ್ಯಾಪಿಲ್ಲರಿ ಘನೀಕರಣದ ಸಿದ್ಧಾಂತ.
ಹೊರಹೀರುವಿಕೆ ಪ್ರಕ್ರಿಯೆಯ ಕೋರ್ಸ್ ಹೆಚ್ಚಾಗಿ ಸರಂಧ್ರ ದೇಹದ ರಚನೆಯನ್ನು ಅವಲಂಬಿಸಿರುತ್ತದೆ.
|
ಮೈಕ್ರೋಪೋರಸ್ | |
|
ಪರಿವರ್ತನೆಯ ಸರಂಧ್ರ | |
|
ಮ್ಯಾಕ್ರೋಪೊರಸ್ |
ಮೈಕ್ರೊಪೊರಸ್ ಸೋರ್ಬೆಂಟ್ಗಳ ಸಂದರ್ಭದಲ್ಲಿ, ಹೊರಹೀರುವಿಕೆ ಬಲಗಳ ಕ್ಷೇತ್ರಗಳು ಅತಿಕ್ರಮಿಸುತ್ತವೆ. ಮ್ಯಾಕ್ರೋಪೊರಸ್ ಸೋರ್ಬೆಂಟ್ಗಳ ಸಂದರ್ಭದಲ್ಲಿ, ರಂಧ್ರಗಳು ಸಾರಿಗೆ ಚಾನಲ್ಗಳಾಗಿ ಕಾರ್ಯನಿರ್ವಹಿಸುತ್ತವೆ. ಸಂಕ್ರಮಣ ಸರಂಧ್ರ ಕಾಯಗಳಲ್ಲಿ ಘನೀಕರಣ ಪ್ರಕ್ರಿಯೆಗಳು ಅತ್ಯಂತ ಮಹತ್ವದ್ದಾಗಿವೆ. ಕ್ಯಾಪಿಲ್ಲರಿ ಘನೀಕರಣವು ಕೆಲವು ಮೌಲ್ಯಗಳಲ್ಲಿ ಪ್ರಾರಂಭವಾಗುತ್ತದೆ ಪಮತ್ತು  , ಮೇಲ್ಮೈ ಶಕ್ತಿಯ ಭಾಗವನ್ನು ಈಗಾಗಲೇ ಸರಿದೂಗಿಸಿದಾಗ. ಅಗತ್ಯವಾದ ಸ್ಥಿತಿಯೆಂದರೆ ಮೇಲ್ಮೈ ಸ್ವಯಂ ತೇವವಾಗಿರಬೇಕು. ಪ್ರಕ್ರಿಯೆಯನ್ನು ವಿವರಿಸಲಾಗಿದೆ ಥಾಂಪ್ಸನ್-ಕೆಲ್ವಿನ್ ಸಮೀಕರಣ.
, ಮೇಲ್ಮೈ ಶಕ್ತಿಯ ಭಾಗವನ್ನು ಈಗಾಗಲೇ ಸರಿದೂಗಿಸಿದಾಗ. ಅಗತ್ಯವಾದ ಸ್ಥಿತಿಯೆಂದರೆ ಮೇಲ್ಮೈ ಸ್ವಯಂ ತೇವವಾಗಿರಬೇಕು. ಪ್ರಕ್ರಿಯೆಯನ್ನು ವಿವರಿಸಲಾಗಿದೆ ಥಾಂಪ್ಸನ್-ಕೆಲ್ವಿನ್ ಸಮೀಕರಣ.

 - ಆರ್ದ್ರತೆಯ ಸಂದರ್ಭದಲ್ಲಿ, ವಕ್ರತೆಯ ಕೇಂದ್ರವು ಅನಿಲ ಹಂತದಲ್ಲಿದೆ.
- ಆರ್ದ್ರತೆಯ ಸಂದರ್ಭದಲ್ಲಿ, ವಕ್ರತೆಯ ಕೇಂದ್ರವು ಅನಿಲ ಹಂತದಲ್ಲಿದೆ.
ಕ್ಯಾಪಿಲ್ಲರಿ ಘನೀಕರಣದ ಸಂದರ್ಭದಲ್ಲಿ, ಹೊರಹೀರುವಿಕೆ ಐಸೊಥರ್ಮ್ ಹಿಸ್ಟರೆಟಿಕ್ ರೂಪವನ್ನು ಹೊಂದಿರುತ್ತದೆ. ಕೆಳಗಿನ ಶಾಖೆಯು ಹೊರಹೀರುವಿಕೆ ಪ್ರಕ್ರಿಯೆಗೆ ಅನುರೂಪವಾಗಿದೆ, ಮತ್ತು ಮೇಲಿನ ಶಾಖೆಯು ನಿರ್ಜಲೀಕರಣ ಪ್ರಕ್ರಿಯೆಗೆ ಅನುರೂಪವಾಗಿದೆ.
ಎಲ್ಲಾ ರೀತಿಯ ರಂಧ್ರಗಳನ್ನು ಮೂರು ವಿಧಗಳಾಗಿ ಕಡಿಮೆ ಮಾಡಬಹುದು:
|
ಶಂಕುವಿನಾಕಾರದ |
ಒಂದು ಮುಚ್ಚಿದ ತುದಿಯೊಂದಿಗೆ ಸಿಲಿಂಡರಾಕಾರದ |
ಎರಡು ತೆರೆದ ತುದಿಗಳೊಂದಿಗೆ ಸಿಲಿಂಡರಾಕಾರದ |
|
ಪ್ರಕ್ರಿಯೆ ತುಂಬುವಿಕೆಯನ್ನು ರಂಧ್ರದ ಕೆಳಗಿನಿಂದ ಕೈಗೊಳ್ಳಲಾಗುತ್ತದೆ. ಹೊರಹೀರುವಿಕೆ ಐಸೊಥರ್ಮ್ ಮತ್ತು ಈ ಸಂದರ್ಭದಲ್ಲಿ ಡಿಸಾರ್ಪ್ಶನ್ ಐಸೊಥರ್ಮ್ ಹೊಂದಿಕೆಯಾಗುತ್ತದೆ, ಏಕೆಂದರೆ ಹೊರಹೀರುವಿಕೆ ಪ್ರಕ್ರಿಯೆಯು ಗೋಳದಿಂದ ಪ್ರಾರಂಭವಾಗುತ್ತದೆ ಮತ್ತು ಕೆಲವು ಗೋಳಗಳ ಕಣ್ಮರೆಯೊಂದಿಗೆ ನಿರ್ಜಲೀಕರಣ ಪ್ರಕ್ರಿಯೆಯು ಪ್ರಾರಂಭವಾಗುತ್ತದೆ.
↓ |
ಯಾವುದೇ ಹಿಸ್ಟರೆಸಿಸ್ ಇಲ್ಲ. ಫಾರ್ವರ್ಡ್ ಮತ್ತು ರಿವರ್ಸ್ ಸ್ಟ್ರೋಕ್ ಅನ್ನು ಸಮೀಕರಣದಿಂದ ವಿವರಿಸಲಾಗಿದೆ:
|
ಎಲ್ಲಿಯೂ ಕೆಳಭಾಗವಿಲ್ಲ, ರಂಧ್ರದ ತುಂಬುವಿಕೆಯು ಸಿಲಿಂಡರ್ನ ಗೋಡೆಗಳ ಉದ್ದಕ್ಕೂ ಹೋಗುತ್ತದೆ.
ಸಿಲಿಂಡರ್: ಐಸೋಥರ್ಮ್ ಹಿಸ್ಟರೆಟಿಕ್ ನೋಟವನ್ನು ಹೊಂದಿರುತ್ತದೆ.
↓ |
IN  ಒದ್ದೆಯಾಗುವ ಪರಿಸ್ಥಿತಿಗಳಲ್ಲಿ, ಕಡಿಮೆ ಒತ್ತಡದಲ್ಲಿ ಘನೀಕರಣವು ಸಂಭವಿಸುತ್ತದೆ, ಇದು ಶಕ್ತಿಯುತವಾಗಿ ಅನುಕೂಲಕರವಾಗಿರುತ್ತದೆ. ನಿರ್ಜಲೀಕರಣ ಶಾಖೆಯಿಂದ, ರಂಧ್ರದ ಗಾತ್ರದ ವಿತರಣಾ ವಕ್ರಾಕೃತಿಗಳನ್ನು ಪಡೆಯಲಾಗುತ್ತದೆ.
ಒದ್ದೆಯಾಗುವ ಪರಿಸ್ಥಿತಿಗಳಲ್ಲಿ, ಕಡಿಮೆ ಒತ್ತಡದಲ್ಲಿ ಘನೀಕರಣವು ಸಂಭವಿಸುತ್ತದೆ, ಇದು ಶಕ್ತಿಯುತವಾಗಿ ಅನುಕೂಲಕರವಾಗಿರುತ್ತದೆ. ನಿರ್ಜಲೀಕರಣ ಶಾಖೆಯಿಂದ, ರಂಧ್ರದ ಗಾತ್ರದ ವಿತರಣಾ ವಕ್ರಾಕೃತಿಗಳನ್ನು ಪಡೆಯಲಾಗುತ್ತದೆ.
ಅವಿಭಾಜ್ಯ ಕರ್ವ್ನ ಇನ್ಫ್ಲೆಕ್ಷನ್ ಪಾಯಿಂಟ್ಗೆ ಸಂಬಂಧಿಸಿದಂತೆ ಭೇದಾತ್ಮಕ ವಕ್ರರೇಖೆಯ ಗರಿಷ್ಠವನ್ನು ಎಡಕ್ಕೆ ವರ್ಗಾಯಿಸಲಾಗುತ್ತದೆ. ಸಣ್ಣ ರಂಧ್ರಗಳ ಒಟ್ಟು ಪರಿಮಾಣವು ಚಿಕ್ಕದಾಗಿದೆ, ಆದರೆ ದೊಡ್ಡ ಮೇಲ್ಮೈ ಪ್ರದೇಶಗಳನ್ನು ಹೊಂದಿದೆ. ಹೆಚ್ಚುತ್ತಿರುವ ರಂಧ್ರದ ಗಾತ್ರದೊಂದಿಗೆ, ಅವುಗಳ ಪರಿಮಾಣವು ಹೆಚ್ಚಾಗುತ್ತದೆ  , ಮತ್ತು ಪ್ರದೇಶವು ಹಾಗೆ
, ಮತ್ತು ಪ್ರದೇಶವು ಹಾಗೆ  , ಈ ಕಾರಣದಿಂದಾಗಿ, ಡಿಫರೆನ್ಷಿಯಲ್ ಕರ್ವ್ನ ಗರಿಷ್ಠ ಬದಲಾವಣೆಯನ್ನು ಗಮನಿಸಲಾಗಿದೆ.
, ಈ ಕಾರಣದಿಂದಾಗಿ, ಡಿಫರೆನ್ಷಿಯಲ್ ಕರ್ವ್ನ ಗರಿಷ್ಠ ಬದಲಾವಣೆಯನ್ನು ಗಮನಿಸಲಾಗಿದೆ.
ಘನ-ದ್ರವ ಇಂಟರ್ಫೇಸ್ನಲ್ಲಿ ಹೀರಿಕೊಳ್ಳುವಿಕೆ.
ಘನ-ಅನಿಲ ಇಂಟರ್ಫೇಸ್ನಲ್ಲಿ ಹೊರಹೀರುವಿಕೆಯ ಸಂದರ್ಭದಲ್ಲಿ, ನಾವು ಒಂದು ಘಟಕವನ್ನು ನಿರ್ಲಕ್ಷಿಸಿದ್ದೇವೆ. ಘನ-ದ್ರವ ಇಂಟರ್ಫೇಸ್ನಲ್ಲಿ ಹೊರಹೀರುವಿಕೆಯ ಸಂದರ್ಭದಲ್ಲಿ, ಆಡ್ಸರ್ಬೇಟ್ ಆಡ್ಸರ್ಬೆಂಟ್ನ ಮೇಲ್ಮೈಯಿಂದ ದ್ರಾವಕ ಅಣುಗಳನ್ನು ಸ್ಥಳಾಂತರಿಸುತ್ತದೆ.
 ,
,
ಸಮೀಕರಣ ಸರಿಯಾಗಿದೆ:

 ,
,
N 1, N 2 - ದ್ರಾವಕ ಮತ್ತು ಘಟಕದ ಮೋಲ್ ಭಿನ್ನರಾಶಿಗಳು, N 1 + N 2 = 1, ನಂತರ
 ,
=>
,
=>
 , ನಂತರ ಘನ-ದ್ರವ ಇಂಟರ್ಫೇಸ್ಗೆ ಹೊರಹೀರುವಿಕೆ ಸಮೀಕರಣವಾಗಿದೆ.
, ನಂತರ ಘನ-ದ್ರವ ಇಂಟರ್ಫೇಸ್ಗೆ ಹೊರಹೀರುವಿಕೆ ಸಮೀಕರಣವಾಗಿದೆ.
ಹೊರಹೀರುವಿಕೆ (ಜಿ) > 0 ನಲ್ಲಿ  <
0
<
0
ಮೌಲ್ಯಗಳು ಇದ್ದರೆ  ಘಟಕ ಮತ್ತು ದ್ರಾವಕವು ವಿಭಿನ್ನವಾಗಿದೆ, ಈ ಸಂದರ್ಭದಲ್ಲಿ ಅವಲಂಬನೆ ಜಿನಿಂದ ಎನ್ಮೌಲ್ಯದಲ್ಲಿ ತೀವ್ರತೆಯನ್ನು ಹೊಂದಿದೆ ಎನ್
~ 0,5.
ಘಟಕ ಮತ್ತು ದ್ರಾವಕವು ವಿಭಿನ್ನವಾಗಿದೆ, ಈ ಸಂದರ್ಭದಲ್ಲಿ ಅವಲಂಬನೆ ಜಿನಿಂದ ಎನ್ಮೌಲ್ಯದಲ್ಲಿ ತೀವ್ರತೆಯನ್ನು ಹೊಂದಿದೆ ಎನ್
~ 0,5.
ಇ  ಒಂದು ವೇಳೆ
ಒಂದು ವೇಳೆ  ನಿಕಟ ಮೌಲ್ಯಗಳನ್ನು ಹೊಂದಿವೆ, ಈ ಸಂದರ್ಭದಲ್ಲಿ ಹೊರಹೀರುವಿಕೆಯ ಚಿಹ್ನೆಯು ಬದಲಾಗಬಹುದು. ಚಟ ಜಿನಿಂದ ಎನ್ x-ಅಕ್ಷವನ್ನು ದಾಟುತ್ತದೆ
ನಿಕಟ ಮೌಲ್ಯಗಳನ್ನು ಹೊಂದಿವೆ, ಈ ಸಂದರ್ಭದಲ್ಲಿ ಹೊರಹೀರುವಿಕೆಯ ಚಿಹ್ನೆಯು ಬದಲಾಗಬಹುದು. ಚಟ ಜಿನಿಂದ ಎನ್ x-ಅಕ್ಷವನ್ನು ದಾಟುತ್ತದೆ
ಫಂಕ್ಷನ್ ಛೇದಕ ಜಿ(ಎನ್) abscissa ಅಕ್ಷದೊಂದಿಗೆ ಕರೆಯಲಾಗುತ್ತದೆ ಹೊರಹೀರುವಿಕೆ ಅಜಿಯೋಟ್ರೋಪ್. ಕೊಟ್ಟಿರುವ ಆಡ್ಸರ್ಬೆಂಟ್ನಲ್ಲಿ ಎರಡು ಘಟಕಗಳನ್ನು ಬೇರ್ಪಡಿಸಲಾಗುವುದಿಲ್ಲ ಎಂದರ್ಥ.
ವಿನಿಮಯ ಸ್ಥಿರಾಂಕದೊಂದಿಗೆ ಹೊರಹೀರುವಿಕೆ ಸಮೋಷ್ಣತೆಯ ಸಮೀಕರಣ.
ಘನ-ದ್ರವ ಇಂಟರ್ಫೇಸ್ನಲ್ಲಿ ಹೀರಿಕೊಳ್ಳುವಿಕೆಯ ಸಮಯದಲ್ಲಿ, ಆಡ್ಸರ್ಬೆಂಟ್ನ ಮೇಲ್ಮೈ ಮತ್ತು ದ್ರಾವಣದ ಪರಿಮಾಣದ ನಡುವೆ ಘಟಕಗಳ ನಿರಂತರ ಪುನರ್ವಿತರಣೆ ಸಂಭವಿಸುತ್ತದೆ.
 - ಘಟಕಗಳು (- - ಮೇಲ್ಮೈಯನ್ನು ಉಲ್ಲೇಖಿಸಿ)
- ಘಟಕಗಳು (- - ಮೇಲ್ಮೈಯನ್ನು ಉಲ್ಲೇಖಿಸಿ)

 ,
,
 ,
, .
.
 ,
,


ದ್ರವ-ಅನಿಲ ಇಂಟರ್ಫೇಸ್ನಲ್ಲಿ ಹೀರಿಕೊಳ್ಳುವಿಕೆ
ಆರ್  ದ್ರವ-ಅನಿಲ ಇಂಟರ್ಫೇಸ್ ದಾಟಿದಂತೆ ಸಾಂದ್ರತೆಯ ಪ್ರೊಫೈಲ್ನಲ್ಲಿನ ಬದಲಾವಣೆಯನ್ನು ನಾವು ಪರಿಗಣಿಸೋಣ. ಘಟಕ 2 ಬಾಷ್ಪಶೀಲವಾಗಿರಲಿ.
ದ್ರವ-ಅನಿಲ ಇಂಟರ್ಫೇಸ್ ದಾಟಿದಂತೆ ಸಾಂದ್ರತೆಯ ಪ್ರೊಫೈಲ್ನಲ್ಲಿನ ಬದಲಾವಣೆಯನ್ನು ನಾವು ಪರಿಗಣಿಸೋಣ. ಘಟಕ 2 ಬಾಷ್ಪಶೀಲವಾಗಿರಲಿ.
Cs - ಮೇಲ್ಮೈ ಪದರದಲ್ಲಿ ಸಾಂದ್ರತೆ.
ಹೆಚ್ಚುವರಿ ಹೊರಹೀರುವಿಕೆಯ ವ್ಯಾಖ್ಯಾನವನ್ನು ಆಧರಿಸಿದೆ

ಘಟಕವು ಬಾಷ್ಪಶೀಲವಾಗಿಲ್ಲದಿದ್ದರೆ, ಹೊರಹೀರುವಿಕೆ ಮೌಲ್ಯವನ್ನು ಈ ಕೆಳಗಿನಂತೆ ಬರೆಯಲಾಗುತ್ತದೆ:
ಪ  ರಿ
ರಿ 

ಸಮೀಕರಣದಲ್ಲಿ.  ವಸ್ತುವಿನ ಸ್ವರೂಪವನ್ನು ಅದರ ಉತ್ಪನ್ನದಿಂದ ವಿವರಿಸಲಾಗಿದೆ
ವಸ್ತುವಿನ ಸ್ವರೂಪವನ್ನು ಅದರ ಉತ್ಪನ್ನದಿಂದ ವಿವರಿಸಲಾಗಿದೆ  .
.
ಮೇಲ್ಮೈ ಒತ್ತಡದ ಐಸೊಥರ್ಮ್ ರೂಪ 1 ಅಥವಾ 2 ಆಗಿರಬಹುದು:
1 - ಸರ್ಫ್ಯಾಕ್ಟಂಟ್ಗಳು
2 - ಸರ್ಫ್ಯಾಕ್ಟಂಟ್ಗಳು
ಮೇಲ್ಮೈ ಚಟುವಟಿಕೆ g ಎನ್ನುವುದು ವ್ಯವಸ್ಥೆಯಲ್ಲಿ ಮೇಲ್ಮೈ ಒತ್ತಡವನ್ನು ಕಡಿಮೆ ಮಾಡುವ ವಸ್ತುಗಳ ಸಾಮರ್ಥ್ಯವಾಗಿದೆ.

 - ಮೇಲ್ಮೈ ಪದರದ ದಪ್ಪ
- ಮೇಲ್ಮೈ ಪದರದ ದಪ್ಪ
ಸಿ ರು- ಮೇಲ್ಮೈ ಪದರದಲ್ಲಿ ಘಟಕದ ಸಾಂದ್ರತೆ
ಇದರೊಂದಿಗೆ- ಪರಿಮಾಣದ ಸಾಂದ್ರತೆ
ಏಕರೂಪದ ಸರಣಿಗೆ ಒಂದು ನಿಯಮವಿದೆ:
 - ಟ್ರಾಬೊ ಡುಕ್ಲೋಸ್ ನಿಯಮ
- ಟ್ರಾಬೊ ಡುಕ್ಲೋಸ್ ನಿಯಮ
ಏಕರೂಪದ ಸರಣಿಗಾಗಿ, ಹೊರಹೀರುವಿಕೆ ಐಸೊಥರ್ಮ್ ಈ ರೀತಿ ಕಾಣುತ್ತದೆ:
A ಬದಲಿಗೆ ನಾವು G ಅನ್ನು ಬರೆಯುತ್ತೇವೆ, ಏಕೆಂದರೆ ಮೇಲ್ಮೈ ಪದರದಲ್ಲಿ ಹೊರಹೀರುವಿಕೆ ಅಧಿಕವಾಗಿರುತ್ತದೆ.
ಮೇಲ್ಮೈ ಒತ್ತಡದ ಐಸೋಥರ್ಮ್:

 - ಶುದ್ಧ ದ್ರಾವಕದ ಮೇಲ್ಮೈ ಒತ್ತಡ.
- ಶುದ್ಧ ದ್ರಾವಕದ ಮೇಲ್ಮೈ ಒತ್ತಡ.
 - ಮೂಲಭೂತ ಹೊರಹೀರುವಿಕೆ ಸಮೀಕರಣ;
- ಮೂಲಭೂತ ಹೊರಹೀರುವಿಕೆ ಸಮೀಕರಣ;
 - ಲ್ಯಾಂಗ್ಮುಯಿರ್ ಸಮೀಕರಣ.
- ಲ್ಯಾಂಗ್ಮುಯಿರ್ ಸಮೀಕರಣ.
ಅವುಗಳನ್ನು ಒಟ್ಟಿಗೆ ಪರಿಹರಿಸೋಣ:

- ಶಿಶ್ಕೋವ್ಸ್ಕಿ ಸಮೀಕರಣ.
ಬಿ- ಏಕರೂಪದ ಸರಣಿಗೆ ಸ್ಥಿರ.
ಎ- ಒಂದು ಹೋಮೋಲಾಗ್ನಿಂದ ಇನ್ನೊಂದಕ್ಕೆ ಚಲಿಸುವಾಗ 3-3.5 ಪಟ್ಟು ಹೆಚ್ಚಾಗುತ್ತದೆ 
![]()
1 - ಕಡಿಮೆ ಸಾಂದ್ರತೆಯ ಪ್ರದೇಶ
![]()
2 - ಸರಾಸರಿ ಸಾಂದ್ರತೆ
3 - ಮೊನೊಮಾಲಿಕ್ಯುಲರ್ ಪದರ
ಸರ್ಫ್ಯಾಕ್ಟಂಟ್ಗಳು ಡಿಫಿಲಿಕ್ ಅಣುಗಳಾಗಿವೆ, ಅಂದರೆ. ಧ್ರುವೀಯ ಗುಂಪು ಮತ್ತು ಧ್ರುವೀಯವಲ್ಲದ ಹೈಡ್ರೋಕಾರ್ಬನ್ ರಾಡಿಕಲ್ ಅನ್ನು ಒಳಗೊಂಡಿರುತ್ತದೆ.
o ಅಣುವಿನ ಧ್ರುವೀಯ ಭಾಗವಾಗಿದೆ.
| - ಅಣುವಿನ ಧ್ರುವೀಯವಲ್ಲದ ಭಾಗ.
ಧ್ರುವೀಯ ದ್ರಾವಕದಲ್ಲಿ, ಅಣುವಿನ ಧ್ರುವೀಯ ಭಾಗವು ದ್ರಾವಕವನ್ನು ಎದುರಿಸುವ ರೀತಿಯಲ್ಲಿ ಸರ್ಫ್ಯಾಕ್ಟಂಟ್ ಅಣುಗಳು ಆಧಾರಿತವಾಗಿರುತ್ತವೆ, ಆದರೆ ಧ್ರುವೇತರ ಭಾಗವನ್ನು ಅನಿಲ ಹಂತಕ್ಕೆ ತಳ್ಳಲಾಗುತ್ತದೆ.
ಶಿಶ್ಕೋವ್ಸ್ಕಿಯ ಸಮೀಕರಣದಲ್ಲಿ  , ಇದು ಹೋಮೋಲಾಜಿಕಲ್ ಸರಣಿಗೆ ಸ್ಥಿರವಾಗಿರುತ್ತದೆ.
, ಇದು ಹೋಮೋಲಾಜಿಕಲ್ ಸರಣಿಗೆ ಸ್ಥಿರವಾಗಿರುತ್ತದೆ.
ಸರ್ಫ್ಯಾಕ್ಟಂಟ್ ಪರಿಣಾಮವು ಕಾಣಿಸಿಕೊಳ್ಳಲು ಪ್ರಾರಂಭಿಸುತ್ತದೆ ಎನ್>5. ಮೊನೊಮಾಲಿಕ್ಯುಲರ್ ಪದರದ ಸಾಂದ್ರತೆಗಿಂತ ಹೆಚ್ಚಿನ ಸಾಂದ್ರತೆಗಳಲ್ಲಿ, ಸರ್ಫ್ಯಾಕ್ಟಂಟ್ ದ್ರಾವಣಗಳಲ್ಲಿ ಮೈಕಲೈಸೇಶನ್ ಸಂಭವಿಸುತ್ತದೆ.
ಮೈಕೆಲ್- ಆಂಫಿಫಿಲಿಕ್ ಸರ್ಫ್ಯಾಕ್ಟಂಟ್ ಅಣುಗಳ ಒಟ್ಟು ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ, ಹೈಡ್ರೋಕಾರ್ಬನ್ ರಾಡಿಕಲ್ಗಳು ಕೋರ್ ಅನ್ನು ರೂಪಿಸುತ್ತವೆ ಮತ್ತು ಧ್ರುವೀಯ ಗುಂಪುಗಳನ್ನು ಜಲೀಯ ಹಂತವಾಗಿ ಪರಿವರ್ತಿಸಲಾಗುತ್ತದೆ.
ಮೈಕೆಲ್ ದ್ರವ್ಯರಾಶಿ - ಮೈಕೆಲ್ ದ್ರವ್ಯರಾಶಿ.
ಎಚ್  ಅಣುಗಳ ಸಂಖ್ಯೆ - ಒಟ್ಟುಗೂಡಿಸುವ ಸಂಖ್ಯೆ.
ಅಣುಗಳ ಸಂಖ್ಯೆ - ಒಟ್ಟುಗೂಡಿಸುವ ಸಂಖ್ಯೆ.
ಗೋಳಾಕಾರದ ಮೈಕೆಲ್ಗಳು
ಮೈಕಲೈಸೇಶನ್ ಸಂದರ್ಭದಲ್ಲಿ, ದ್ರಾವಣದಲ್ಲಿ ಸಮತೋಲನವನ್ನು ಸ್ಥಾಪಿಸಲಾಗಿದೆ
CMC - ಮೈಕೆಲ್ ರಚನೆಯ ನಿರ್ಣಾಯಕ ಸಾಂದ್ರತೆ.
ನಾವು ಮೈಕೆಲ್ ಅನ್ನು ಪ್ರತ್ಯೇಕ ಹಂತವೆಂದು ಪರಿಗಣಿಸುವುದರಿಂದ:
ಹೋಮೋಲಾಜಿಕಲ್ ಸರಣಿಗೆ ಪ್ರಾಯೋಗಿಕ ಸಮೀಕರಣವಿದೆ:
ಎ- ಕ್ರಿಯಾತ್ಮಕ ಗುಂಪಿನ ವಿಸರ್ಜನೆಯ ಶಕ್ತಿ.
ಬಿ - ಹೊರಹೀರುವಿಕೆ ಸಾಮರ್ಥ್ಯದ ಹೆಚ್ಚಳ, ಪ್ರತಿ ಮಿಥಿಲೀನ್ ಘಟಕಕ್ಕೆ ಹೊರಹೀರುವಿಕೆ ಕೆಲಸ.
- ಹೊರಹೀರುವಿಕೆ ಸಾಮರ್ಥ್ಯದ ಹೆಚ್ಚಳ, ಪ್ರತಿ ಮಿಥಿಲೀನ್ ಘಟಕಕ್ಕೆ ಹೊರಹೀರುವಿಕೆ ಕೆಲಸ.
ಮೈಕೆಲ್ಗಳಲ್ಲಿ ಹೈಡ್ರೋಕಾರ್ಬನ್ ಕೋರ್ ಇರುವಿಕೆಯು ನೀರಿನಲ್ಲಿ ಕರಗದ ಸಂಯುಕ್ತಗಳನ್ನು ಸರ್ಫ್ಯಾಕ್ಟಂಟ್ಗಳ ಜಲೀಯ ದ್ರಾವಣಗಳಲ್ಲಿ ಕರಗಿಸಲು ಅವಕಾಶವನ್ನು ಸೃಷ್ಟಿಸುತ್ತದೆ; ಈ ವಿದ್ಯಮಾನವನ್ನು ಸಾಲ್ಯುಬಿಲೈಸೇಶನ್ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ (ಏನು ಕರಗುತ್ತದೆ ಎಂಬುದು ಕರಗುತ್ತದೆ, ಸರ್ಫ್ಯಾಕ್ಟಂಟ್ ಸಾಲ್ಯುಬಿಲೈಸರ್ ಆಗಿದೆ).
ಮಣ್ಣು ಸಂಪೂರ್ಣವಾಗಿ ಧ್ರುವೀಯವಲ್ಲದಿರಬಹುದು, ಧ್ರುವೀಯ ಮತ್ತು ಧ್ರುವೇತರ ಭಾಗಗಳನ್ನು ಹೊಂದಿರಬಹುದು ಮತ್ತು ಸರ್ಫ್ಯಾಕ್ಟಂಟ್ ಅಣುವಿನಂತೆ ಆಧಾರಿತವಾಗಿರುತ್ತದೆ.
ಯಾವುದೇ ಸಂದರ್ಭದಲ್ಲಿ, ಕರಗುವಿಕೆಯ ಸಮಯದಲ್ಲಿ ಮೈಕೆಲ್ಲರ್ ದ್ರವ್ಯರಾಶಿ ಮತ್ತು ಒಟ್ಟುಗೂಡಿಸುವಿಕೆಯ ಸಂಖ್ಯೆಯಲ್ಲಿನ ಹೆಚ್ಚಳವು ಕರಗುವ ಸೇರ್ಪಡೆಯಿಂದಾಗಿ ಮಾತ್ರವಲ್ಲದೆ ಸಮತೋಲನ ಸ್ಥಿತಿಯನ್ನು ಕಾಪಾಡಿಕೊಳ್ಳಲು ಅಗತ್ಯವಾದ ಸರ್ಫ್ಯಾಕ್ಟಂಟ್ ಅಣುಗಳ ಸಂಖ್ಯೆಯಲ್ಲಿನ ಹೆಚ್ಚಳದ ಕಾರಣದಿಂದಾಗಿ.
ಕರಗುವಿಕೆ ಹೆಚ್ಚು ಪರಿಣಾಮಕಾರಿಯಾಗಿರುತ್ತದೆ, ಕರಗುವಿಕೆಯ ಆಣ್ವಿಕ ತೂಕ ಕಡಿಮೆಯಾಗಿದೆ.

 ~ 72 mN\m.
~ 72 mN\m.
 ~ 33 mN\m.
~ 33 mN\m.
ಸರ್ಫ್ಯಾಕ್ಟಂಟ್ಗಳ ಪರಿಣಾಮಕಾರಿತ್ವವು CMC ಮೌಲ್ಯವನ್ನು ಅವಲಂಬಿಸಿರುತ್ತದೆ.
2D ಮೇಲ್ಮೈ ಪದರದ ಒತ್ತಡ

→ -ಮೇಲ್ಮೈ ಒತ್ತಡ ಶಕ್ತಿಗಳು.
- ಎರಡು ಆಯಾಮದ ಒತ್ತಡ.
ಮೇಲ್ಮೈ ಪದರವು ಒಂದು ಸರ್ಫ್ಯಾಕ್ಟಂಟ್ ದ್ರಾವಣ ಮತ್ತು ಶುದ್ಧ ದ್ರಾವಕದ ಮೇಲ್ಮೈ ಒತ್ತಡದಲ್ಲಿನ ವ್ಯತ್ಯಾಸಕ್ಕೆ ಸಮಾನವಾದ ಬಲವಾಗಿದೆ, ಇದನ್ನು ಶುದ್ಧ ಮೇಲ್ಮೈಗೆ ನಿರ್ದೇಶಿಸಲಾಗುತ್ತದೆ.
ಪರಿಹಾರ ಮತ್ತು ಮೇಲ್ಮೈ ಪದರದ ನಡುವೆ ಸಮತೋಲನವನ್ನು ಸ್ಥಾಪಿಸಲಾಗಿದೆ



ನಲ್ಲಿ  ಅಲ್ಲಿ ಒಂದು ಪ್ರದೇಶವಿದೆ
ಅಲ್ಲಿ ಒಂದು ಪ್ರದೇಶವಿದೆ  ಏಕಾಗ್ರತೆಯ ಮೇಲೆ ರೇಖಾತ್ಮಕವಾಗಿ ಅವಲಂಬಿತವಾಗಿದೆ.
ಏಕಾಗ್ರತೆಯ ಮೇಲೆ ರೇಖಾತ್ಮಕವಾಗಿ ಅವಲಂಬಿತವಾಗಿದೆ.
ಜಿ [mol/m2].
 - ವಸ್ತುವಿನ ಒಂದು ಮೋಲ್ ಆಕ್ರಮಿಸಿಕೊಂಡಿರುವ ಪ್ರದೇಶ
- ವಸ್ತುವಿನ ಒಂದು ಮೋಲ್ ಆಕ್ರಮಿಸಿಕೊಂಡಿರುವ ಪ್ರದೇಶ
ನಂತರ ಎರಡು ಆಯಾಮದ ಒತ್ತಡದ ಐಸೋಥರ್ಮ್ ರೂಪವನ್ನು ಹೊಂದಿರುತ್ತದೆ 
 - ಎರಡು ಆಯಾಮದ ಒತ್ತಡದ ಐಸೋಥರ್ಮ್.
- ಎರಡು ಆಯಾಮದ ಒತ್ತಡದ ಐಸೋಥರ್ಮ್.
ಚಟ  ಎಸ್ ಎಂ ನಿಂದ:
ಎಸ್ ಎಂ ನಿಂದ:

ನಲ್ಲಿ  - ಎರಡು ಆಯಾಮದ ಒತ್ತಡ ತೀವ್ರವಾಗಿ ಹೆಚ್ಚಾಗುತ್ತದೆ. ನಲ್ಲಿ
- ಎರಡು ಆಯಾಮದ ಒತ್ತಡ ತೀವ್ರವಾಗಿ ಹೆಚ್ಚಾಗುತ್ತದೆ. ನಲ್ಲಿ  ಎರಡು ಆಯಾಮಗಳು ವಿರೂಪಗೊಂಡಿವೆ, ಇದು ಹಠಾತ್ ಬೆಳವಣಿಗೆಗೆ ಕಾರಣವಾಗುತ್ತದೆ
ಎರಡು ಆಯಾಮಗಳು ವಿರೂಪಗೊಂಡಿವೆ, ಇದು ಹಠಾತ್ ಬೆಳವಣಿಗೆಗೆ ಕಾರಣವಾಗುತ್ತದೆ  .
.
ಎರಡೂ ಬದಿಗಳಲ್ಲಿ ಒಂದೇ ಹಂತಗಳಿಂದ ಸುತ್ತುವರಿದ ಚಲನಚಿತ್ರವನ್ನು ಡಬಲ್-ಸೈಡೆಡ್ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಅಂತಹ ಚಲನಚಿತ್ರಗಳಲ್ಲಿ, ತಾಯಿ ಮದ್ಯದ ನಿರಂತರ ಚಲನೆಯನ್ನು ಗಮನಿಸಬಹುದು.
5 nm ಗಿಂತ ಕಡಿಮೆ ದಪ್ಪವಿರುವ ಚಲನಚಿತ್ರಗಳನ್ನು ಕಪ್ಪು ಚಿತ್ರಗಳು ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ.

ಹೊರಹೀರುವಿಕೆ ಪದರಗಳು ಎರಡು ಗುಣಲಕ್ಷಣಗಳನ್ನು ಹೊಂದಿರಬೇಕು: ಸ್ನಿಗ್ಧತೆ ಮತ್ತು ಸುಲಭ ಚಲನಶೀಲತೆ, ದ್ರವತೆ ಮತ್ತು ಸ್ಥಿತಿಸ್ಥಾಪಕತ್ವ.
ಮರಂಗೋನಿ ಪರಿಣಾಮವು ಸ್ವಯಂ-ಗುಣಪಡಿಸುತ್ತದೆ.
ಗಿಬ್ಸ್ ತ್ರಿಕೋನ,  - ಅತಿಯಾದ ಒತ್ತಡ.
- ಅತಿಯಾದ ಒತ್ತಡ.
ಚಲನಚಿತ್ರವು ವಿಸ್ತರಿಸಿದೆ ಮತ್ತು ದ್ರವದ ಭಾಗವು ಉಳಿದಿದೆ ಎಂಬ ಅಂಶದಿಂದಾಗಿ, ಸರ್ಫ್ಯಾಕ್ಟಂಟ್ಗಳು ಮುಕ್ತ ಜಾಗಕ್ಕೆ ಧಾವಿಸುತ್ತವೆ. ಗಿಬ್ಸ್ ತ್ರಿಕೋನ.
ದೇಹಗಳ ಹೊರಹೀರುವಿಕೆ ಶಕ್ತಿಯ ಪರಿಣಾಮ.
ಚಿತ್ರದ ಮೇಲ್ಮೈಯಲ್ಲಿ ಯಾವಾಗಲೂ ಹೊರಹೀರುವಿಕೆ ಪದರವಿರುತ್ತದೆ, ಇದಕ್ಕಾಗಿ ನಂತರ
ಲ್ಯಾಂಗ್ಮುಯಿರ್ ಸಮೀಕರಣ:


 ಎರಡು ಆಯಾಮದ ಒತ್ತಡಕ್ಕೆ
ಎರಡು ಆಯಾಮದ ಒತ್ತಡಕ್ಕೆ
 - ಶಿಶ್ಕೋವ್ಸ್ಕಿ ಸಮೀಕರಣದ ಅನಲಾಗ್
- ಶಿಶ್ಕೋವ್ಸ್ಕಿ ಸಮೀಕರಣದ ಅನಲಾಗ್
ಎಲೆಕ್ಟ್ರೋಕಿನೆಟಿಕ್ ವಿದ್ಯಮಾನಗಳು. ಎಲೆಕ್ಟ್ರಿಕ್ ಡಬಲ್ ಲೇಯರ್ (EDL).
ಗೆಲೆಮ್ಹೋಲ್ಟ್ಜ್ ಮಾದರಿ. ಗೌಯ್-ಚಾಪ್ಮನ್ ಸಿದ್ಧಾಂತ.
1808 ವಿಮಾನ

ಯು – ಆಕಾರದ ಟ್ಯೂಬ್, ಅದರಲ್ಲಿ 2 ವಿದ್ಯುದ್ವಾರಗಳನ್ನು ಮುಳುಗಿಸಿ. ಸಂವಹನ ಹಡಗುಗಳ ನಿಯಮವನ್ನು ಉಲ್ಲಂಘಿಸಲಾಗಿದೆ ಮತ್ತು ಟ್ಯೂಬ್ನಲ್ಲಿ ದ್ರವದ ಮಟ್ಟದಲ್ಲಿ ಬದಲಾವಣೆ ಸಂಭವಿಸುತ್ತದೆ - ಎಲೆಕ್ಟ್ರೋಕಿನೆಟಿಕ್ ವಿದ್ಯಮಾನಗಳು.
ಚಲನ ವಿದ್ಯಮಾನಗಳು:
ಎಲೆಕ್ಟ್ರೋಫೋರೆಸಿಸ್
ಎಲೆಕ್ಟ್ರೋಸ್ಮಾಸಿಸ್
ಹರಿವು (ಹರಿವು) ಸಾಮರ್ಥ್ಯ
ಸೆಡಿಮೆಂಟೇಶನ್ ಸಂಭಾವ್ಯ
ಸಂಭಾವ್ಯ ವ್ಯತ್ಯಾಸವನ್ನು ಅನ್ವಯಿಸಿದಾಗ 1 ಮತ್ತು 2 ಉದ್ಭವಿಸುತ್ತದೆ; 3 ಮತ್ತು 4, ಕೊಲೊಯ್ಡಲ್ ಕಣಗಳ ಗುದ್ದುವಿಕೆ ಮತ್ತು ಸೆಡಿಮೆಂಟೇಶನ್ ಸಂಭಾವ್ಯ ವ್ಯತ್ಯಾಸದ ನೋಟವನ್ನು ಉಂಟುಮಾಡುತ್ತದೆ.
ಎಲೆಕ್ಟ್ರೋಸ್ಮಾಸಿಸ್ ವಿದ್ಯುತ್ ಪ್ರವಾಹದ ಪ್ರಭಾವದ ಅಡಿಯಲ್ಲಿ ಸ್ಥಿರವಾದ ಚದುರಿದ ಹಂತಕ್ಕೆ ಸಂಬಂಧಿಸಿದಂತೆ ಪ್ರಸರಣ ಮಾಧ್ಯಮದ ಚಲನೆಯಾಗಿದೆ.
ಎಲೆಕ್ಟ್ರೋಫೋರೆಸಿಸ್ - ಇದು ವಿದ್ಯುತ್ ಪ್ರವಾಹದ ಪ್ರಭಾವದ ಅಡಿಯಲ್ಲಿ ಸ್ಥಾಯಿ ಪ್ರಸರಣ ಮಾಧ್ಯಮಕ್ಕೆ ಸಂಬಂಧಿಸಿದಂತೆ ಚದುರಿದ ಹಂತದ ಕಣಗಳ ಚಲನೆಯಾಗಿದೆ.
ಪ  ಎಲೆಕ್ಟ್ರೋಕಿನೆಟಿಕ್ ವಿದ್ಯಮಾನಗಳ ಸಂಭವಕ್ಕೆ ಕಾರಣವೆಂದರೆ ಶುಲ್ಕಗಳ ಪ್ರಾದೇಶಿಕ ಪ್ರತ್ಯೇಕತೆ ಮತ್ತು ಎರಡು ವಿದ್ಯುತ್ ಪದರದ ನೋಟ.
ಎಲೆಕ್ಟ್ರೋಕಿನೆಟಿಕ್ ವಿದ್ಯಮಾನಗಳ ಸಂಭವಕ್ಕೆ ಕಾರಣವೆಂದರೆ ಶುಲ್ಕಗಳ ಪ್ರಾದೇಶಿಕ ಪ್ರತ್ಯೇಕತೆ ಮತ್ತು ಎರಡು ವಿದ್ಯುತ್ ಪದರದ ನೋಟ.
ವಿದ್ಯುತ್ ಡಬಲ್ ಲೇಯರ್ ಫ್ಲಾಟ್ ಕೆಪಾಸಿಟರ್ ಆಗಿದೆ, ಒಂದು ಪ್ಲೇಟ್ ಸಂಭಾವ್ಯ-ನಿರ್ಧರಿಸುವ ಅಯಾನುಗಳಿಂದ ರೂಪುಗೊಳ್ಳುತ್ತದೆ, ಇನ್ನೊಂದು ಕೌಂಟರ್-ಅಯಾನುಗಳಿಂದ. ಸಂಭಾವ್ಯ-ನಿರ್ಧರಿಸುವ ಸಹ-ಅಯಾನುಗಳನ್ನು ದ್ರಾವಣದ ಪರಿಮಾಣಕ್ಕೆ ತಳ್ಳುವ ರೀತಿಯಲ್ಲಿಯೇ ಅಯಾನುಗಳು ಕಲುಷಿತಗೊಳ್ಳುತ್ತವೆ. ಫಲಕಗಳ ನಡುವಿನ ಅಂತರ  . ವಿಭವವು ರೇಖೀಯವಾಗಿ ಇಳಿಯುತ್ತದೆ, ಸಂಭಾವ್ಯ ವ್ಯತ್ಯಾಸ
. ವಿಭವವು ರೇಖೀಯವಾಗಿ ಇಳಿಯುತ್ತದೆ, ಸಂಭಾವ್ಯ ವ್ಯತ್ಯಾಸ  .
.
ಬಾಹ್ಯ ಸಂಭಾವ್ಯ ವ್ಯತ್ಯಾಸವು ಬರಿಯ ಮಾಡ್ಯುಲಸ್ನ ನೋಟವನ್ನು ಉಂಟುಮಾಡುತ್ತದೆ  ಘನ ದೇಹದ ಮೇಲ್ಮೈಯಲ್ಲಿ ಕಾರ್ಯನಿರ್ವಹಿಸುವ ಪ್ರತಿ ಯುನಿಟ್ ಪ್ರದೇಶಕ್ಕೆ ಒಂದು ಜೋಡಿ ಪಡೆಗಳು.
ಘನ ದೇಹದ ಮೇಲ್ಮೈಯಲ್ಲಿ ಕಾರ್ಯನಿರ್ವಹಿಸುವ ಪ್ರತಿ ಯುನಿಟ್ ಪ್ರದೇಶಕ್ಕೆ ಒಂದು ಜೋಡಿ ಪಡೆಗಳು.

ಸಮತೋಲನದಲ್ಲಿ, ಬರಿಯ ಮಾಡ್ಯುಲಸ್ ಸ್ನಿಗ್ಧತೆಯ ಘರ್ಷಣೆ ಮಾಡ್ಯುಲಸ್ಗೆ ಸಮಾನವಾಗಿರುತ್ತದೆ (  ).
).

ನಮ್ಮ ಪರಿಸ್ಥಿತಿಗಳಲ್ಲಿ  ,
,

 - ಗೆಲೆಮ್ಹೋಲ್ಟ್ಜ್-ಸ್ಮಾಲುಕೋವ್ಸ್ಕಿ ಸಮೀಕರಣ
- ಗೆಲೆಮ್ಹೋಲ್ಟ್ಜ್-ಸ್ಮಾಲುಕೋವ್ಸ್ಕಿ ಸಮೀಕರಣ
 - ಹಂತದ ಸ್ಥಳಾಂತರದ ರೇಖೀಯ ವೇಗ.
- ಹಂತದ ಸ್ಥಳಾಂತರದ ರೇಖೀಯ ವೇಗ.
ಇ- ವಿದ್ಯುತ್ ಕ್ಷೇತ್ರದ ಶಕ್ತಿ.
 - ಫಲಕಗಳ ನಡುವಿನ ಸಂಭಾವ್ಯ ವ್ಯತ್ಯಾಸ
- ಫಲಕಗಳ ನಡುವಿನ ಸಂಭಾವ್ಯ ವ್ಯತ್ಯಾಸ
 - ಎಲೆಕ್ಟ್ರೋಫೋರೆಟಿಕ್ ಮೊಬಿಲಿಟಿ [m 2 /(V*s)].
- ಎಲೆಕ್ಟ್ರೋಫೋರೆಟಿಕ್ ಮೊಬಿಲಿಟಿ [m 2 /(V*s)].
ಹೆಲೆಮ್ಹೋಲ್ಟ್ಜ್ ಮಾದರಿಯು ಅಣುಗಳ ಉಷ್ಣ ಚಲನೆಯನ್ನು ಗಣನೆಗೆ ತೆಗೆದುಕೊಳ್ಳುವುದಿಲ್ಲ. ವಾಸ್ತವದಲ್ಲಿ, ಡಬಲ್ ಲೇಯರ್ನಲ್ಲಿ ಅಯಾನುಗಳ ವಿತರಣೆಯು ಹೆಚ್ಚು ಸಂಕೀರ್ಣವಾಗಿದೆ.
ಗುಯಿ ಮತ್ತು ಚಾಪ್ಮನ್ DES ನ ಕೆಳಗಿನ ಕಾರಣಗಳನ್ನು ಗುರುತಿಸಿದ್ದಾರೆ:
ಸಮತೋಲನವನ್ನು ಸ್ಥಾಪಿಸಿದಾಗ ಅಯಾನು ಒಂದು ಹಂತದಿಂದ ಇನ್ನೊಂದಕ್ಕೆ ಪರಿವರ್ತನೆ.
ಘನ ಹಂತದ ವಸ್ತುವಿನ ಅಯಾನೀಕರಣ.
ಪ್ರಸರಣ ಮಾಧ್ಯಮದಲ್ಲಿ ಇರುವ ಅಯಾನುಗಳೊಂದಿಗೆ ಮೇಲ್ಮೈಯನ್ನು ಪೂರ್ಣಗೊಳಿಸುವುದು.
ಬಾಹ್ಯ ಪ್ರಸ್ತುತ ಮೂಲದಿಂದ ಧ್ರುವೀಕರಣ.
ವಿದ್ಯುತ್ ಡಬಲ್ ಲೇಯರ್ ಅಸ್ಪಷ್ಟ ಅಥವಾ ಪ್ರಸರಣ ರಚನೆಯನ್ನು ಹೊಂದಿದೆ. ಅಯಾನುಗಳು ಪ್ರಸರಣ ಪದರದ ಉದ್ದಕ್ಕೂ ಸಮವಾಗಿ ವಿತರಿಸಲ್ಪಡುತ್ತವೆ.
ಪ್ರಸರಣ ಪದರವು ಕೌಂಟರ್ನಾನ್ಗಳನ್ನು ಹೊಂದಿರುತ್ತದೆ; ಪದರದ ಉದ್ದವನ್ನು ಅವುಗಳ ಚಲನ ಶಕ್ತಿಯಿಂದ ನಿರ್ಧರಿಸಲಾಗುತ್ತದೆ. ಸಂಪೂರ್ಣ ಶೂನ್ಯವನ್ನು ಸಮೀಪಿಸುತ್ತಿರುವ ತಾಪಮಾನದಲ್ಲಿ, ಪ್ರತಿ-ಅಯಾನುಗಳು ಸಂಭಾವ್ಯ-ನಿರ್ಧರಿಸುವ ಅಯಾನುಗಳಿಗೆ ಸಾಧ್ಯವಾದಷ್ಟು ಹತ್ತಿರದಲ್ಲಿವೆ.
ದನ್ಯಾ ಅವರ ಸಿದ್ಧಾಂತವು ಎರಡು ಸಮೀಕರಣಗಳನ್ನು ಆಧರಿಸಿದೆ:
ಬೋಲ್ಟ್ಜ್ಮನ್ ಸಮೀಕರಣ

 - ಸ್ಥಾಯೀವಿದ್ಯುತ್ತಿನ ಪರಸ್ಪರ ಕ್ರಿಯೆಯ ಶಕ್ತಿಗಳ ವಿರುದ್ಧ ಕೆಲಸ ಮಾಡಿ.
- ಸ್ಥಾಯೀವಿದ್ಯುತ್ತಿನ ಪರಸ್ಪರ ಕ್ರಿಯೆಯ ಶಕ್ತಿಗಳ ವಿರುದ್ಧ ಕೆಲಸ ಮಾಡಿ.
 - ವಾಲ್ಯೂಮೆಟ್ರಿಕ್ ಚಾರ್ಜ್ ಸಾಂದ್ರತೆ.
- ವಾಲ್ಯೂಮೆಟ್ರಿಕ್ ಚಾರ್ಜ್ ಸಾಂದ್ರತೆ.

ವಿಷದ ಸಮೀಕರಣ 
EDL ನ ದಪ್ಪವು ಕಣದ ಗಾತ್ರಕ್ಕಿಂತ ಚಿಕ್ಕದಾಗಿದೆ ಮತ್ತು ಸಮತಟ್ಟಾದ EDL ಗೆ ನಿರ್ದೇಶಾಂಕಗಳಿಗೆ ಸಂಬಂಧಿಸಿದಂತೆ ಉತ್ಪನ್ನವಾಗಿದೆ  ಮತ್ತು
ಮತ್ತು  ರದ್ದುಪಡಿಸಲಾಗಿದೆ.
ರದ್ದುಪಡಿಸಲಾಗಿದೆ. 
y ನಲ್ಲಿ e y ಗೆ<<1 функцию можно разложить в ряд Маклорена:

ನಾವು ಸರಣಿಯ ಎರಡು ಪದಗಳಿಗೆ ನಮ್ಮನ್ನು ಮಿತಿಗೊಳಿಸೋಣ, ನಂತರ:


 - DEL ದಪ್ಪವು DEL ಸಾಮರ್ಥ್ಯವು ಕಡಿಮೆಯಾಗುವ ದೂರವಾಗಿದೆ ಇಒಮ್ಮೆ.
- DEL ದಪ್ಪವು DEL ಸಾಮರ್ಥ್ಯವು ಕಡಿಮೆಯಾಗುವ ದೂರವಾಗಿದೆ ಇಒಮ್ಮೆ.
ಕಡಿಮೆ ತಾಪಮಾನ, ಕಡಿಮೆ  . T→0 ನಲ್ಲಿ - ಫ್ಲಾಟ್ DEL. ಹೆಚ್ಚಿನ ಏಕಾಗ್ರತೆ, ಹೆಚ್ಚು ನಾನು, ಕಡಿಮೆ
. T→0 ನಲ್ಲಿ - ಫ್ಲಾಟ್ DEL. ಹೆಚ್ಚಿನ ಏಕಾಗ್ರತೆ, ಹೆಚ್ಚು ನಾನು, ಕಡಿಮೆ  .
.





 "-" ಎಂದರೆ ದೂರದೊಂದಿಗೆ ಸಾಮರ್ಥ್ಯವು ಕಡಿಮೆಯಾಗುತ್ತದೆ. =>
"-" ಎಂದರೆ ದೂರದೊಂದಿಗೆ ಸಾಮರ್ಥ್ಯವು ಕಡಿಮೆಯಾಗುತ್ತದೆ. =>
=>

 ,
,
 - ಸಾಮರ್ಥ್ಯವು ಘಾತೀಯವಾಗಿ ಕಡಿಮೆಯಾಗುತ್ತದೆ.
- ಸಾಮರ್ಥ್ಯವು ಘಾತೀಯವಾಗಿ ಕಡಿಮೆಯಾಗುತ್ತದೆ.
ಮೇಲ್ಮೈ ಚಾರ್ಜ್ ಸಾಂದ್ರತೆಯ ಸಂಭಾವ್ಯತೆ: 
ಮೇಲ್ಮೈ ಚಾರ್ಜ್ ಎನ್ನುವುದು ವಿರುದ್ಧ ಚಿಹ್ನೆಯೊಂದಿಗೆ ವಾಲ್ಯೂಮ್ ಚಾರ್ಜ್ ಆಗಿದೆ, ದೂರದಲ್ಲಿ ಸಂಯೋಜಿಸಲಾಗಿದೆ.




=>


ವಿಭವವು 2.7 ಪಟ್ಟು ಕಡಿಮೆಯಾದರೆ - 
ಡಬಲ್ ಲೇಯರ್ ಸಾಮರ್ಥ್ಯ 
ಸಿದ್ಧಾಂತದ ಅನನುಕೂಲವೆಂದರೆ ಹೆಲೆಮ್ಹೋಲ್ಟ್ಜ್ ಪದರದ ಉಪಸ್ಥಿತಿಯನ್ನು ಗಣನೆಗೆ ತೆಗೆದುಕೊಳ್ಳುವುದಿಲ್ಲ, ಅಂದರೆ. ಗಣನೆಗೆ ತೆಗೆದುಕೊಳ್ಳುವುದಿಲ್ಲ  , ಆದ್ದರಿಂದ ಮುಖ್ಯ ನಿಯತಾಂಕಗಳನ್ನು ನಿರ್ಧರಿಸುವಲ್ಲಿ ದೋಷಗಳು. ವಿದ್ಯುತ್ ಡಬಲ್ ಪದರದ ದಪ್ಪದ ಮೇಲೆ ವಿಭಿನ್ನ ಸ್ವಭಾವದ ಅಯಾನುಗಳ ಪ್ರಭಾವವನ್ನು ಸಹ ಇದು ವಿವರಿಸುವುದಿಲ್ಲ.
, ಆದ್ದರಿಂದ ಮುಖ್ಯ ನಿಯತಾಂಕಗಳನ್ನು ನಿರ್ಧರಿಸುವಲ್ಲಿ ದೋಷಗಳು. ವಿದ್ಯುತ್ ಡಬಲ್ ಪದರದ ದಪ್ಪದ ಮೇಲೆ ವಿಭಿನ್ನ ಸ್ವಭಾವದ ಅಯಾನುಗಳ ಪ್ರಭಾವವನ್ನು ಸಹ ಇದು ವಿವರಿಸುವುದಿಲ್ಲ.
ಸ್ಟರ್ನ್ ಸಿದ್ಧಾಂತ. ಕೊಲೊಯ್ಡಲ್ ಮೈಕೆಲ್ನ ರಚನೆ.
ವಿದ್ಯುತ್ ಡಬಲ್ ಲೇಯರ್ ಎರಡು ಭಾಗಗಳನ್ನು ಒಳಗೊಂಡಿದೆ: ದಟ್ಟವಾದ ಮತ್ತು ಪ್ರಸರಣ. ನಿರ್ದಿಷ್ಟವಾಗಿ ಹೊರಹೀರುವ ಅಯಾನುಗಳೊಂದಿಗೆ ಸಂಭಾವ್ಯ-ರೂಪಿಸುವ ಅಯಾನುಗಳ ಪರಸ್ಪರ ಕ್ರಿಯೆಯ ಪರಿಣಾಮವಾಗಿ ದಟ್ಟವಾದ ಪದರವು ರೂಪುಗೊಳ್ಳುತ್ತದೆ. ಈ ಅಯಾನುಗಳು ನಿಯಮದಂತೆ, ಭಾಗಶಃ ಅಥವಾ ಸಂಪೂರ್ಣವಾಗಿ ನಿರ್ಜಲೀಕರಣಗೊಳ್ಳುತ್ತವೆ ಮತ್ತು ಸಂಭಾವ್ಯ-ನಿರ್ಧರಿಸುವ ಅಯಾನುಗಳಿಗೆ ಒಂದೇ ಅಥವಾ ವಿರುದ್ಧವಾದ ಚಾರ್ಜ್ ಅನ್ನು ಹೊಂದಿರಬಹುದು. ಇದು ಸ್ಥಾಯೀವಿದ್ಯುತ್ತಿನ ಪರಸ್ಪರ ಕ್ರಿಯೆಯ ಶಕ್ತಿಯ ಅನುಪಾತವನ್ನು ಅವಲಂಬಿಸಿರುತ್ತದೆ  ಮತ್ತು ನಿರ್ದಿಷ್ಟ ಹೀರಿಕೊಳ್ಳುವ ಸಾಮರ್ಥ್ಯ
ಮತ್ತು ನಿರ್ದಿಷ್ಟ ಹೀರಿಕೊಳ್ಳುವ ಸಾಮರ್ಥ್ಯ  . ದಟ್ಟವಾದ ಪದರದ ಅಯಾನುಗಳನ್ನು ನಿವಾರಿಸಲಾಗಿದೆ. ಅಯಾನುಗಳ ಇತರ ಭಾಗವು ಪ್ರಸರಣ ಪದರದಲ್ಲಿದೆ; ಈ ಅಯಾನುಗಳು ಮುಕ್ತವಾಗಿರುತ್ತವೆ ಮತ್ತು ದ್ರಾವಣಕ್ಕೆ ಆಳವಾಗಿ ಚಲಿಸಬಹುದು, ಅಂದರೆ. ಹೆಚ್ಚಿನ ಸಾಂದ್ರತೆಯ ಪ್ರದೇಶದಿಂದ ಕಡಿಮೆ ಸಾಂದ್ರತೆಯ ಪ್ರದೇಶಕ್ಕೆ. ಒಟ್ಟು ಚಾರ್ಜ್ ಸಾಂದ್ರತೆಯು ಎರಡು ಭಾಗಗಳನ್ನು ಒಳಗೊಂಡಿದೆ.
. ದಟ್ಟವಾದ ಪದರದ ಅಯಾನುಗಳನ್ನು ನಿವಾರಿಸಲಾಗಿದೆ. ಅಯಾನುಗಳ ಇತರ ಭಾಗವು ಪ್ರಸರಣ ಪದರದಲ್ಲಿದೆ; ಈ ಅಯಾನುಗಳು ಮುಕ್ತವಾಗಿರುತ್ತವೆ ಮತ್ತು ದ್ರಾವಣಕ್ಕೆ ಆಳವಾಗಿ ಚಲಿಸಬಹುದು, ಅಂದರೆ. ಹೆಚ್ಚಿನ ಸಾಂದ್ರತೆಯ ಪ್ರದೇಶದಿಂದ ಕಡಿಮೆ ಸಾಂದ್ರತೆಯ ಪ್ರದೇಶಕ್ಕೆ. ಒಟ್ಟು ಚಾರ್ಜ್ ಸಾಂದ್ರತೆಯು ಎರಡು ಭಾಗಗಳನ್ನು ಒಳಗೊಂಡಿದೆ.

 -ಹೆಲ್ಮ್ಹೋಲ್ಟ್ಜ್ ಪದರದ ಚಾರ್ಜ್
-ಹೆಲ್ಮ್ಹೋಲ್ಟ್ಜ್ ಪದರದ ಚಾರ್ಜ್
 -ಡಿಫ್ಯೂಸ್ ಲೇಯರ್ ಚಾರ್ಜ್
-ಡಿಫ್ಯೂಸ್ ಲೇಯರ್ ಚಾರ್ಜ್
ಮೇಲ್ಮೈಯು ಒಂದು ನಿರ್ದಿಷ್ಟ ಸಂಖ್ಯೆಯ ಹೊರಹೀರುವಿಕೆ ಕೇಂದ್ರಗಳನ್ನು ಹೊಂದಿದೆ, ಪ್ರತಿಯೊಂದೂ ಒಂದು ಪ್ರತಿರೂಪದೊಂದಿಗೆ ಸಂವಹನ ನಡೆಸುತ್ತದೆ. ಅಂತಹ ಅರೆ-ರಾಸಾಯನಿಕ ಕ್ರಿಯೆಯ ಸ್ಥಿರಾಂಕವು ಇದಕ್ಕೆ ಸಮಾನವಾಗಿರುತ್ತದೆ:

 , ಎಲ್ಲಿ
, ಎಲ್ಲಿ  - ದ್ರಾವಣದಲ್ಲಿ ಪ್ರತಿರೂಪಗಳ ಮೋಲ್ ಭಾಗ
- ದ್ರಾವಣದಲ್ಲಿ ಪ್ರತಿರೂಪಗಳ ಮೋಲ್ ಭಾಗ
ಹೆಲ್ಮ್ಹೋಲ್ಟ್ಜ್ ವಿತರಣೆ
ಸಾಮರ್ಥ್ಯವು ರೇಖೀಯವಾಗಿ ಕಡಿಮೆಯಾಗುತ್ತದೆ
ಗೌಯ್ ಸಂಭಾವ್ಯ ವಿತರಣೆ. ದಟ್ಟವಾದ ಪದರವಿಲ್ಲ, ಸಂಭಾವ್ಯತೆಯು ಮೌಲ್ಯದಿಂದ ಘಾತೀಯವಾಗಿ ಕಡಿಮೆಯಾಗುತ್ತದೆ 
ಸ್ಟರ್ನ್ ವಿತರಣೆ.
ಆರಂಭದಲ್ಲಿ, ಸಂಭಾವ್ಯ ಇಳಿಕೆಯು ರೇಖೀಯವಾಗಿರುತ್ತದೆ ಮತ್ತು ನಂತರ ಘಾತೀಯವಾಗಿರುತ್ತದೆ.
ಎಲೆಕ್ಟ್ರೋಫೋರೆಸಿಸ್ನ ಸಂದರ್ಭದಲ್ಲಿ ವಿದ್ಯುತ್ ಕ್ಷೇತ್ರವನ್ನು ಅನ್ವಯಿಸಿದಾಗ, ಅದು ನೇರವಾಗಿ ಚಲಿಸುವ ಘನ ಹಂತದ ಕಣವಲ್ಲ, ಆದರೆ ಅದರ ಸುತ್ತಲಿನ ಅಯಾನುಗಳ ಪದರವನ್ನು ಹೊಂದಿರುವ ಘನ ಹಂತದ ಕಣವಾಗಿದೆ. ಡಿಇಎಸ್ ಚದುರಿದ ಹಂತದ ಕಣದ ಆಕಾರವನ್ನು ಪುನರಾವರ್ತಿಸುತ್ತದೆ. ಸಂಭಾವ್ಯತೆಯನ್ನು ಅನ್ವಯಿಸಿದಾಗ, ಪ್ರಸರಣ ಪದರದ ಭಾಗವು ಹರಿದುಹೋಗುತ್ತದೆ. ಬ್ರೇಕ್ ಲೈನ್ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ ಸ್ಲೈಡಿಂಗ್ ಗಡಿ.
ಪ್ರಸರಣ ಪದರದ ಭಾಗವನ್ನು ಬೇರ್ಪಡಿಸುವ ಪರಿಣಾಮವಾಗಿ ಸ್ಲಿಪ್ ಗಡಿಯಲ್ಲಿ ಉದ್ಭವಿಸುವ ಸಂಭಾವ್ಯತೆಯನ್ನು ಕರೆಯಲಾಗುತ್ತದೆ ಎಲೆಕ್ಟ್ರೋಕಿನೆಟಿಕ್ ಸಂಭಾವ್ಯ(ಝೀಟಾ ಸಂಭಾವ್ಯ  ).
).
ಸುತ್ತುವರಿದ ಕೌಂಟರ್ಯಾನ್ಗಳ ಪದರ ಮತ್ತು ಎರಡು ವಿದ್ಯುತ್ ಪದರವನ್ನು ಹೊಂದಿರುವ ಚದುರಿದ ಹಂತದ ಕಣವನ್ನು ಕರೆಯಲಾಗುತ್ತದೆ ಮೈಕೆಲ್.
ಕೊಲೊಯ್ಡಲ್ ಮೈಕೆಲ್ಗಳನ್ನು ಬರೆಯುವ ನಿಯಮಗಳು:


1-1 ಚಾರ್ಜಿಂಗ್ ಎಲೆಕ್ಟ್ರೋಲೈಟ್
ಟಿ - ಚದುರಿದ ಹಂತದ ಕಣ.
AA ಎಂಬುದು ದಟ್ಟವಾದ ಮತ್ತು ಪ್ರಸರಣ ಭಾಗಗಳ ನಡುವಿನ ಗಡಿಯಾಗಿದೆ.
ಬಿಬಿ - ಸ್ಲೈಡಿಂಗ್ ಗಡಿ.
ಸ್ಲೈಡಿಂಗ್ ಗಡಿರೇಖೆಯು AA ರೇಖೆಯೊಂದಿಗೆ ಹೊಂದಿಕೆಯಾಗಬಹುದು ಅಥವಾ ಇಲ್ಲದಿರಬಹುದು.
ಝೀಟಾ ವಿಭವವು ಶೂನ್ಯವಾಗಿರುವ pH ಮೌಲ್ಯವನ್ನು ಕರೆಯಲಾಗುತ್ತದೆ ಐಸೊಎಲೆಕ್ಟ್ರಿಕ್ ಪಾಯಿಂಟ್.
CaCl 2 + Na 2 SO 4 → CaSO 4 ↓ + 2NaCl
1. ಹೆಚ್ಚುವರಿ CaCl 2
CaCl 2 ↔ Ca 2+ + 2Cl -
(CaSO 4 m∙nCa 2+ 2( n - x)Cl - ) 2 X + X Cl - - ಮೈಕೆಲ್ ಸಂಕೇತ.
CaSO 4 ಮೀ - ಒಟ್ಟು.
CaSO 4 m∙nCa 2+ - ಕೋರ್.
CaSO 4 m∙nCa 2+ 2( n - x)Cl - - ಕಣ.
2. ಹೆಚ್ಚುವರಿ Na 2 SO 4
Na 2 SO 4 ↔2Na + + SO 4 2-
(CaSO 4 m∙nSO 4 2- 2(n-x)Na + ) 2x- 2xNa + - ಮೈಕೆಲ್
CaSO 4 ಮೀ - ಒಟ್ಟು.
CaSO 4 m∙nSO 4 2 + - ಕೋರ್.
CaSO 4 m∙nSO 4 2- 2(n-x)Na + - ಕಣ
ಗೆಲೆಮ್ಹೋಲ್ಟ್ಜ್-ಸ್ಮೊಲುಚೋವ್ಸ್ಕಿ ಸಮೀಕರಣ

 - ಗಡಿ ಸ್ಥಳಾಂತರದ ರೇಖೀಯ ವೇಗ (ಎಲೆಕ್ಟ್ರೋಸ್ಮಾಸಿಸ್ನಲ್ಲಿ).
- ಗಡಿ ಸ್ಥಳಾಂತರದ ರೇಖೀಯ ವೇಗ (ಎಲೆಕ್ಟ್ರೋಸ್ಮಾಸಿಸ್ನಲ್ಲಿ).
 - ಕೆಪಾಸಿಟರ್ ಪ್ಲೇಟ್ಗಳಾದ್ಯಂತ ಸಂಭಾವ್ಯ ವ್ಯತ್ಯಾಸ (ಎಲೆಕ್ಟ್ರೋಸ್ಮಾಸಿಸ್ನಲ್ಲಿ).
- ಕೆಪಾಸಿಟರ್ ಪ್ಲೇಟ್ಗಳಾದ್ಯಂತ ಸಂಭಾವ್ಯ ವ್ಯತ್ಯಾಸ (ಎಲೆಕ್ಟ್ರೋಸ್ಮಾಸಿಸ್ನಲ್ಲಿ).


 - ಪರಿಹಾರದ ಪರಿಮಾಣದ ಹರಿವಿನ ಪ್ರಮಾಣ, ಎಸ್- ಚದರ ಅಡ್ಡ ವಿಭಾಗಜೀವಕೋಶಗಳು.
- ಪರಿಹಾರದ ಪರಿಮಾಣದ ಹರಿವಿನ ಪ್ರಮಾಣ, ಎಸ್- ಚದರ ಅಡ್ಡ ವಿಭಾಗಜೀವಕೋಶಗಳು.

ಇ- ವಿದ್ಯುತ್ ಕ್ಷೇತ್ರದ ಶಕ್ತಿ.


 (ಎಲೆಕ್ಟ್ರೋಸ್ಮಾಸಿಸ್ಗಾಗಿ).
(ಎಲೆಕ್ಟ್ರೋಸ್ಮಾಸಿಸ್ಗಾಗಿ).
ಹರಿವಿನ ಸಾಮರ್ಥ್ಯಕ್ಕಾಗಿ:

 - ಸಂಭಾವ್ಯ
- ಸಂಭಾವ್ಯ
 - ಪೊರೆಯ ಮೇಲೆ ಒತ್ತಡ
- ಪೊರೆಯ ಮೇಲೆ ಒತ್ತಡ
ನಿಯಮದಂತೆ, ಎಲೆಕ್ಟ್ರೋಫೋರೆಟಿಕ್ ಚಲನಶೀಲತೆ ಮತ್ತು ಎಲೆಕ್ಟ್ರೋಸ್ಮೋಟಿಕ್ ಮೊಬಿಲಿಟಿಗಳ ಮೌಲ್ಯಗಳು ಲೆಕ್ಕಹಾಕಿದ ಪದಗಳಿಗಿಂತ ಕಡಿಮೆ. ಇದು ಈ ಕಾರಣದಿಂದಾಗಿ ಸಂಭವಿಸುತ್ತದೆ:
ವಿಶ್ರಾಂತಿ ಪರಿಣಾಮ (ಚೆದುರಿದ ಹಂತದ ಕಣವು ಚಲಿಸಿದಾಗ, ಅಯಾನಿಕ್ ವಾತಾವರಣದ ಸಮ್ಮಿತಿಯು ಮುರಿದುಹೋಗುತ್ತದೆ).
ಎಲೆಕ್ಟ್ರೋಫೋರೆಟಿಕ್ ಪ್ರತಿಬಂಧ (ಪ್ರತಿರೋಧಗಳ ಚಲನೆಯ ಪರಿಣಾಮವಾಗಿ ಹೆಚ್ಚುವರಿ ಘರ್ಷಣೆಯ ಸಂಭವ).
ವಿದ್ಯುತ್ ವಾಹಕ ಕಣಗಳ ಸಂದರ್ಭದಲ್ಲಿ ಪ್ರಸ್ತುತ ರೇಖೆಗಳ ವಿರೂಪ.
ಮೇಲ್ಮೈ ಒತ್ತಡ ಮತ್ತು ಸಂಭಾವ್ಯತೆಯ ನಡುವಿನ ಸಂಬಂಧ. ಲಿಪ್ಮನ್ ಸಮೀಕರಣ.
EDL ನ ರಚನೆಯು ಅದರ ಮೇಲ್ಮೈ ಶಕ್ತಿಯನ್ನು ಕಡಿಮೆ ಮಾಡುವ ವ್ಯವಸ್ಥೆಯ ಬಯಕೆಯಿಂದಾಗಿ ಸ್ವಯಂಪ್ರೇರಿತವಾಗಿ ಸಂಭವಿಸುತ್ತದೆ. ಸ್ಥಿರ ಪರಿಸ್ಥಿತಿಗಳಲ್ಲಿ ಟಿಮತ್ತು ಪಥರ್ಮೋಡೈನಾಮಿಕ್ಸ್ನ ಮೊದಲ ಮತ್ತು ಎರಡನೆಯ ನಿಯಮಗಳ ಸಾಮಾನ್ಯೀಕರಿಸಿದ ಸಮೀಕರಣವು ಈ ರೀತಿ ಕಾಣುತ್ತದೆ:
 (2)
(2)
(3), (1)=(3) =>
=>

 - 1 ನೇ ಲಿಪ್ಮನ್ ಸಮೀಕರಣ.
- 1 ನೇ ಲಿಪ್ಮನ್ ಸಮೀಕರಣ.
 - ಮೇಲ್ಮೈ ಚಾರ್ಜ್ ಸಾಂದ್ರತೆ.
- ಮೇಲ್ಮೈ ಚಾರ್ಜ್ ಸಾಂದ್ರತೆ.
 - ಡಿಫರೆನ್ಷಿಯಲ್ ಕೆಪಾಸಿಟನ್ಸ್.
- ಡಿಫರೆನ್ಷಿಯಲ್ ಕೆಪಾಸಿಟನ್ಸ್.
 - 2 ನೇ ಲಿಪ್ಮನ್ ಸಮೀಕರಣ.
- 2 ನೇ ಲಿಪ್ಮನ್ ಸಮೀಕರಣ.
ಇದರೊಂದಿಗೆ- ಸಾಮರ್ಥ್ಯ.
1 ನೇ ಲಿಪ್ಮನ್ ಸಮೀಕರಣ ಮತ್ತು ಮೂಲಭೂತ ಹೀರಿಕೊಳ್ಳುವ ಸಮೀಕರಣವನ್ನು ಪರಿಹರಿಸೋಣ:
 ,
,


 , ನಂತರ
, ನಂತರ
 - ನೆರ್ನ್ಸ್ಟ್ ಸಮೀಕರಣ
- ನೆರ್ನ್ಸ್ಟ್ ಸಮೀಕರಣ
 ,
,
 ,
,




 - ಎಲೆಕ್ಟ್ರೋಕ್ಯಾಪಿಲ್ಲರಿ ಕರ್ವ್ (ಇಸಿಸಿ) ಸಮೀಕರಣ.
- ಎಲೆಕ್ಟ್ರೋಕ್ಯಾಪಿಲ್ಲರಿ ಕರ್ವ್ (ಇಸಿಸಿ) ಸಮೀಕರಣ.
IN  :
: , ಆದರೆ
, ಆದರೆ 
ಕ್ಯಾಟಯಾನಿಕ್ ಸರ್ಫ್ಯಾಕ್ಟಂಟ್ಗಳು (CPAS) EKC ಯ ಕ್ಯಾಥೋಡಿಕ್ ಶಾಖೆಯನ್ನು ಕಡಿಮೆ ಮಾಡುತ್ತದೆ.
ಅಯಾನಿಕ್ ಸರ್ಫ್ಯಾಕ್ಟಂಟ್ಗಳು (APS) EKC ಯ ಆನೋಡಿಕ್ ಶಾಖೆಯನ್ನು ಕಡಿಮೆ ಮಾಡುತ್ತದೆ.
ಅಯಾನಿಕ್ ಸರ್ಫ್ಯಾಕ್ಟಂಟ್ಗಳು (ಎನ್ಎಸ್ಎಎಸ್) ಇಸಿಸಿಯ ಮಧ್ಯ ಭಾಗವನ್ನು ಕಡಿಮೆ ಮಾಡುತ್ತದೆ.
ಚದುರಿದ ವ್ಯವಸ್ಥೆಗಳ ಸ್ಥಿರತೆ. ಅಸಮಂಜಸ ಒತ್ತಡ.
ಚದುರಿದ ವ್ಯವಸ್ಥೆಗಳನ್ನು ವಿಂಗಡಿಸಬಹುದು:
ಥರ್ಮೋಡೈನಮಿಕ್ ಅಸ್ಥಿರವಾಗಿರುವ ವ್ಯವಸ್ಥೆಗಳು ಮೆಟಾಸ್ಟೇಬಲ್ ಸ್ಥಿತಿಗೆ ಪರಿವರ್ತನೆಯ ಕಾರಣದಿಂದಾಗಿ ಚಲನಶಾಸ್ತ್ರೀಯವಾಗಿ ಸ್ಥಿರವಾಗಿರುತ್ತದೆ.
ಎರಡು ರೀತಿಯ ಸ್ಥಿರತೆಗಳಿವೆ:
ಸೆಡಿಮೆಂಟೇಶನ್ ಸ್ಥಿರತೆ (ಗುರುತ್ವಾಕರ್ಷಣೆಗೆ ಸಂಬಂಧಿಸಿದಂತೆ).
ಒಟ್ಟುಗೂಡಿಸುವ ಸ್ಥಿರತೆ. (ಅಂಟಿಕೊಳ್ಳುವುದಕ್ಕೆ ಸಂಬಂಧಿಸಿದಂತೆ)
ಹೆಪ್ಪುಗಟ್ಟುವಿಕೆಕಣದ ಅಂಟಿಕೊಳ್ಳುವಿಕೆಯ ಪ್ರಕ್ರಿಯೆಯಾಗಿದ್ದು, ಒಟ್ಟುಗೂಡಿಸುವಿಕೆಯ ಸ್ಥಿರತೆಯ ನಷ್ಟಕ್ಕೆ ಕಾರಣವಾಗುತ್ತದೆ. ತಾಪಮಾನ ಬದಲಾವಣೆಗಳು, pH, ಸ್ಫೂರ್ತಿದಾಯಕ ಮತ್ತು ಅಲ್ಟ್ರಾಸೌಂಡ್ನಿಂದ ಹೆಪ್ಪುಗಟ್ಟುವಿಕೆ ಉಂಟಾಗಬಹುದು.
ಹೆಪ್ಪುಗಟ್ಟುವಿಕೆಯನ್ನು ಪ್ರತ್ಯೇಕಿಸಿ:
ಹಿಂತಿರುಗಿಸಬಹುದಾದ.
ಬದಲಾಯಿಸಲಾಗದ.
ವಿದ್ಯುದ್ವಿಚ್ಛೇದ್ಯಗಳ ಪರಿಚಯದೊಂದಿಗೆ ಹೆಪ್ಪುಗಟ್ಟುವಿಕೆ ಸಂಭವಿಸುತ್ತದೆ.
ಹೆಪ್ಪುಗಟ್ಟುವಿಕೆ ನಿಯಮಗಳು:

ಚಲನಚಿತ್ರ- ಇದು ಎರಡು ಇಂಟರ್ಫೇಶಿಯಲ್ ಮೇಲ್ಮೈಗಳ ನಡುವೆ ಇರುವ ವ್ಯವಸ್ಥೆಯ ಭಾಗವಾಗಿದೆ.
ಅಸಮಂಜಸ ಒತ್ತಡಸಮೀಪಿಸುತ್ತಿರುವ ಮೇಲ್ಮೈ ಪದರಗಳ ಪರಸ್ಪರ ಕ್ರಿಯೆಯ ಪರಿಣಾಮವಾಗಿ ಫಿಲ್ಮ್ ದಪ್ಪವು ತೀವ್ರವಾಗಿ ಕಡಿಮೆಯಾದಾಗ ಸಂಭವಿಸುತ್ತದೆ.

“-” - ಫಿಲ್ಮ್ ದಪ್ಪವು ಕಡಿಮೆಯಾದಂತೆ, ವಿಘಟನೆಯ ಒತ್ತಡವು ಹೆಚ್ಚಾಗುತ್ತದೆ.
P 0 ಎಂಬುದು ಬೃಹತ್ ಹಂತದಲ್ಲಿ ಒತ್ತಡವಾಗಿದೆ, ಇದು ಇಂಟರ್ಲೇಯರ್ನ ಮುಂದುವರಿಕೆಯಾಗಿದೆ.
ಪಿ 1 - ಚಿತ್ರದಲ್ಲಿ ಒತ್ತಡ.
ಸ್ಥಿರತೆಯ ಸಿದ್ಧಾಂತ. DLFO (ಡೆರಿಯಾಜಿನ್, ಲ್ಯಾಂಡೌ, ಫೇರ್ವೇ, ಓವರ್ಬೆಕ್).
DLFO ಸಿದ್ಧಾಂತದ ಪ್ರಕಾರ, ಡಿಸ್ಜೋಯಿಂಗ್ ಒತ್ತಡವು ಎರಡು ಅಂಶಗಳನ್ನು ಹೊಂದಿದೆ:
ಸ್ಥಾಯೀವಿದ್ಯುತ್ತಿನಪಿ ಇ (ಧನಾತ್ಮಕ, ಇದು ಸ್ಥಾಯೀವಿದ್ಯುತ್ತಿನ ವಿಕರ್ಷಣೆಯ ಶಕ್ತಿಗಳಿಂದಾಗಿ). ಹೆಚ್ಚುತ್ತಿರುವ ಫಿಲ್ಮ್ ದಪ್ಪದೊಂದಿಗೆ ಗಿಬ್ಸ್ ಶಕ್ತಿಯಲ್ಲಿನ ಇಳಿಕೆಗೆ ಅನುರೂಪವಾಗಿದೆ.
ಆಣ್ವಿಕಪಿ ಎಂ (ಋಣಾತ್ಮಕ, ಆಕರ್ಷಕ ಶಕ್ತಿಗಳ ಕ್ರಿಯೆಯಿಂದಾಗಿ). ಇದು ರಾಸಾಯನಿಕ ಮೇಲ್ಮೈ ಬಲಗಳ ಕಾರಣದಿಂದಾಗಿ ಫಿಲ್ಮ್ ಸಂಕೋಚನದಿಂದ ಉಂಟಾಗುತ್ತದೆ, ಶಕ್ತಿಗಳ ಕ್ರಿಯೆಯ ತ್ರಿಜ್ಯವು ಸುಮಾರು 400 kJ/mol ಶಕ್ತಿಯೊಂದಿಗೆ ಹತ್ತನೇ nm ಆಗಿದೆ.
ಒಟ್ಟು ಪರಸ್ಪರ ಶಕ್ತಿ:

 - ವ್ಯವಸ್ಥೆಯು ಒಟ್ಟಾರೆಯಾಗಿ ಸ್ಥಿರವಾಗಿದೆ
- ವ್ಯವಸ್ಥೆಯು ಒಟ್ಟಾರೆಯಾಗಿ ಸ್ಥಿರವಾಗಿದೆ
 - ಅಸ್ಥಿರ ವ್ಯವಸ್ಥೆ
- ಅಸ್ಥಿರ ವ್ಯವಸ್ಥೆ
ಪ  ಧನಾತ್ಮಕ ಅಂಶ.
ಧನಾತ್ಮಕ ಅಂಶ.
ತೆಳುವಾದ ಫಿಲ್ಮ್ಗಳ ಸಂಕೋಚನದ ಸಮಯದಲ್ಲಿ ಸಂಭಾವ್ಯ ಶಕ್ತಿಯ ಹೆಚ್ಚಳದಿಂದಾಗಿ ಹೆಚ್ಚಳವಾಗಿದೆ. ದಪ್ಪ ಫಿಲ್ಮ್ಗಳಿಗೆ, ಹೆಚ್ಚುವರಿ ಅಯಾನು ಶಕ್ತಿಯನ್ನು ಸರಿದೂಗಿಸಲಾಗುತ್ತದೆ ಮತ್ತು ಪ್ರಸರಣ ಮಾಧ್ಯಮದ ಬಹುಪಾಲು ಶಕ್ತಿಯ ಪರಸ್ಪರ ಕ್ರಿಯೆಗೆ ಸಮಾನವಾಗಿರುತ್ತದೆ.
ಒಂದು ವೇಳೆ  (
( - ಫಿಲ್ಮ್ ದಪ್ಪ,
- ಫಿಲ್ಮ್ ದಪ್ಪ,  - ಅಯಾನು ತ್ರಿಜ್ಯ) ಫಿಲ್ಮ್ ತೆಳುವಾಗುವುದರಿಂದ ಅದರಲ್ಲಿ ಕನಿಷ್ಠ ಮೇಲ್ಮೈ ಶಕ್ತಿಯೊಂದಿಗೆ ಅಣುಗಳು ಮತ್ತು ಅಯಾನುಗಳ ಕಣ್ಮರೆ ಮತ್ತು ಕಡಿತಕ್ಕೆ ಕಾರಣವಾಗುತ್ತದೆ. ನೆರೆಯ ಕಣಗಳ ಸಂಖ್ಯೆಯು ಕಡಿಮೆಯಾಗುತ್ತದೆ, ಇದರ ಪರಿಣಾಮವಾಗಿ ಚಿತ್ರದಲ್ಲಿ ಉಳಿದಿರುವ ಕಣಗಳ ಸಂಭಾವ್ಯ ಶಕ್ತಿಯು ಹೆಚ್ಚಾಗುತ್ತದೆ.
- ಅಯಾನು ತ್ರಿಜ್ಯ) ಫಿಲ್ಮ್ ತೆಳುವಾಗುವುದರಿಂದ ಅದರಲ್ಲಿ ಕನಿಷ್ಠ ಮೇಲ್ಮೈ ಶಕ್ತಿಯೊಂದಿಗೆ ಅಣುಗಳು ಮತ್ತು ಅಯಾನುಗಳ ಕಣ್ಮರೆ ಮತ್ತು ಕಡಿತಕ್ಕೆ ಕಾರಣವಾಗುತ್ತದೆ. ನೆರೆಯ ಕಣಗಳ ಸಂಖ್ಯೆಯು ಕಡಿಮೆಯಾಗುತ್ತದೆ, ಇದರ ಪರಿಣಾಮವಾಗಿ ಚಿತ್ರದಲ್ಲಿ ಉಳಿದಿರುವ ಕಣಗಳ ಸಂಭಾವ್ಯ ಶಕ್ತಿಯು ಹೆಚ್ಚಾಗುತ್ತದೆ.


DLVO ಸಿದ್ಧಾಂತವು ಕಣಗಳ ಪರಸ್ಪರ ಕ್ರಿಯೆಯನ್ನು ಫಲಕಗಳ ಪರಸ್ಪರ ಕ್ರಿಯೆ ಎಂದು ಪರಿಗಣಿಸುತ್ತದೆ.

ಕಣಗಳು ಸಂವಹನ ಮಾಡುವುದಿಲ್ಲ



 - ಲ್ಯಾಪ್ಲೇಸ್ ಸಮೀಕರಣ,
- ಲ್ಯಾಪ್ಲೇಸ್ ಸಮೀಕರಣ,  ,
,


ದುರ್ಬಲವಾಗಿ ಚಾರ್ಜ್ ಮಾಡಿದ ಮೇಲ್ಮೈಗಳಿಗೆ
ಹೆಚ್ಚು ಚಾರ್ಜ್ ಮಾಡಿದ ಮೇಲ್ಮೈಗಳಿಗೆ:

ಆಣ್ವಿಕ ಘಟಕವು ಎರಡು ಪರಮಾಣುಗಳ ಪರಸ್ಪರ ಕ್ರಿಯೆಯಾಗಿದೆ:
 ~
~
ಮೇಲ್ಮೈಯೊಂದಿಗೆ ಪರಮಾಣುವಿನ ಪರಸ್ಪರ ಕ್ರಿಯೆ:

ಎರಡು ದಾಖಲೆಗಳನ್ನು ತೆಗೆದುಕೊಳ್ಳೋಣ:
ಡಿ  ಆಣ್ವಿಕ ಘಟಕವನ್ನು ಪಡೆಯಲು, ಬಲ ಮತ್ತು ಎಡ ಫಲಕಗಳ ಪರಮಾಣುಗಳ ಎಲ್ಲಾ ಪರಸ್ಪರ ಶಕ್ತಿಗಳನ್ನು ಒಟ್ಟುಗೂಡಿಸುವುದು ಅವಶ್ಯಕ.
ಆಣ್ವಿಕ ಘಟಕವನ್ನು ಪಡೆಯಲು, ಬಲ ಮತ್ತು ಎಡ ಫಲಕಗಳ ಪರಮಾಣುಗಳ ಎಲ್ಲಾ ಪರಸ್ಪರ ಶಕ್ತಿಗಳನ್ನು ಒಟ್ಟುಗೂಡಿಸುವುದು ಅವಶ್ಯಕ.
ಎಲ್ಲಿ  - ಹ್ಯಾಮೇಕರ್ ಸ್ಥಿರ (ಸಂವಾದಿಸುವ ದೇಹಗಳ ಸ್ವರೂಪವನ್ನು ಗಣನೆಗೆ ತೆಗೆದುಕೊಳ್ಳುತ್ತದೆ).
- ಹ್ಯಾಮೇಕರ್ ಸ್ಥಿರ (ಸಂವಾದಿಸುವ ದೇಹಗಳ ಸ್ವರೂಪವನ್ನು ಗಣನೆಗೆ ತೆಗೆದುಕೊಳ್ಳುತ್ತದೆ).
ಅದು. ಸಂಭಾವ್ಯ ವಕ್ರಾಕೃತಿಗಳನ್ನು ಬಳಸಿಕೊಂಡು ವ್ಯವಸ್ಥೆಯಲ್ಲಿನ ಕಣಗಳ ಪರಸ್ಪರ ಕ್ರಿಯೆಯ ಶಕ್ತಿಯನ್ನು ವ್ಯಕ್ತಪಡಿಸಬಹುದು.
I - ಪ್ರಾಥಮಿಕ ಸಂಭಾವ್ಯ ಕನಿಷ್ಠ. ಇದು ಬದಲಾಯಿಸಲಾಗದ ಹೆಪ್ಪುಗಟ್ಟುವಿಕೆಯ ವಲಯವಾಗಿದೆ, ಆಕರ್ಷಣೆಯ ಶಕ್ತಿಗಳು ಮೇಲುಗೈ ಸಾಧಿಸುತ್ತವೆ.
II - ಸಮಗ್ರ ಸ್ಥಿರತೆಯ ವಲಯ, ವಿಕರ್ಷಣ ಶಕ್ತಿಗಳು ಮೇಲುಗೈ ಸಾಧಿಸುತ್ತವೆ.
III - ದ್ವಿತೀಯ ಸಂಭಾವ್ಯ ಕನಿಷ್ಠ (ಅಥವಾ ಫ್ಲೋಕ್ಯುಲೇಷನ್ ವಲಯ). ಚದುರಿದ ಹಂತದ ಕಣಗಳ ನಡುವೆ ಎಲೆಕ್ಟ್ರೋಲೈಟ್ ಪದರವಿದೆ, ಮತ್ತು ಕಣಗಳನ್ನು ಬೇರ್ಪಡಿಸಬಹುದು ಮತ್ತು ಒಟ್ಟುಗೂಡಿಸುವಿಕೆಯ ಸ್ಥಿರತೆಯ ವಲಯಕ್ಕೆ ವರ್ಗಾಯಿಸಬಹುದು.

ಕರ್ವ್ 1 - ವ್ಯವಸ್ಥೆಯು ಒಟ್ಟಾರೆಯಾಗಿ ಸ್ಥಿರವಾಗಿರುತ್ತದೆ.
ಕರ್ವ್ 2 - ವಲಯ I ರಲ್ಲಿ ಸ್ಥಿರವಾಗಿರುತ್ತದೆ, ವಲಯ II ರಲ್ಲಿ ಅಸ್ಥಿರವಾಗಿರುತ್ತದೆ.
ಕರ್ವ್ 3 - ವ್ಯವಸ್ಥೆಯಲ್ಲಿ ಹೆಪ್ಪುಗಟ್ಟುವಿಕೆ ಸಂಭವಿಸಿದೆ.
ಕರ್ವ್ 4 - ಪಾಯಿಂಟ್ 4 ನಲ್ಲಿ ಒಟ್ಟು ಪರಸ್ಪರ ಶಕ್ತಿ U=0,  , ಈ ವಿಪರೀತ ಬಿಂದುವು ಕ್ಷಿಪ್ರ ಹೆಪ್ಪುಗಟ್ಟುವಿಕೆಯ ಆರಂಭಕ್ಕೆ ಅನುರೂಪವಾಗಿದೆ.
, ಈ ವಿಪರೀತ ಬಿಂದುವು ಕ್ಷಿಪ್ರ ಹೆಪ್ಪುಗಟ್ಟುವಿಕೆಯ ಆರಂಭಕ್ಕೆ ಅನುರೂಪವಾಗಿದೆ.
ಎರಡು ಪ್ರಕರಣಗಳಿವೆ:
1. ಸ್ವಲ್ಪ ಚಾರ್ಜ್ ಮಾಡಿದ ಮೇಲ್ಮೈಗಳು:
U = U E + U M = 0
 (1)
(1)
2)

 (2)
(2)



 - ಇದು ಹೆಪ್ಪುಗಟ್ಟುವಿಕೆ ಪ್ರಕ್ರಿಯೆಯ ಪ್ರಾರಂಭಕ್ಕೆ ಅನುಗುಣವಾದ ಪದರದ ದಪ್ಪವಾಗಿದೆ.
- ಇದು ಹೆಪ್ಪುಗಟ್ಟುವಿಕೆ ಪ್ರಕ್ರಿಯೆಯ ಪ್ರಾರಂಭಕ್ಕೆ ಅನುಗುಣವಾದ ಪದರದ ದಪ್ಪವಾಗಿದೆ.






 - ದುರ್ಬಲವಾಗಿ ಚಾರ್ಜ್ ಮಾಡಿದ ಮೇಲ್ಮೈಗಳಿಗೆ
- ದುರ್ಬಲವಾಗಿ ಚಾರ್ಜ್ ಮಾಡಿದ ಮೇಲ್ಮೈಗಳಿಗೆ
 ನಂತರ
ನಂತರ 
2. ಹೆಚ್ಚು ಚಾರ್ಜ್ ಮಾಡಿದ ಮೇಲ್ಮೈಗಳಿಗೆ:
 (1)
(1)
2)

 (2)
(2)


 (3)
(3)
 ,
,
ಚೌಕವನ್ನು ನೋಡೋಣ (3)

ಹೆಪ್ಪುಗಟ್ಟುವಿಕೆ:
ನಿರ್ದಿಷ್ಟ ಹೊರಹೀರುವಿಕೆಯಲ್ಲಿ, ಅಯಾನುಗಳನ್ನು ಸೂಪರ್-ಸಮಾನ ಪ್ರಮಾಣದಲ್ಲಿ ಹೀರಿಕೊಳ್ಳಬಹುದು, ಅಂದರೆ ಮೇಲ್ಮೈ ತನ್ನ ಚಾರ್ಜ್ ಅನ್ನು ಬದಲಾಯಿಸಬಹುದು. ಮೇಲ್ಮೈಯನ್ನು ರೀಚಾರ್ಜ್ ಮಾಡಲಾಗಿದೆ.
ನಿರ್ದಿಷ್ಟ ಹೊರಹೀರುವಿಕೆಯ ಸಂದರ್ಭದಲ್ಲಿ, ವಿರುದ್ಧ ಚಿಹ್ನೆಗಳ ಅಯಾನುಗಳನ್ನು ಮಾತ್ರ ಹೀರಿಕೊಳ್ಳಬಹುದು, ಆದರೆ ಅದೇ ಚಿಹ್ನೆಯಿಂದ ಕೂಡ ಮಾಡಬಹುದು.
ಮೇಲ್ಮೈಯಂತೆಯೇ ಅದೇ ಚಿಹ್ನೆಯ ಅಯಾನುಗಳು ಹೊರಹೀರಿದರೆ, ಮೇಲ್ಮೈ ಪದರದಲ್ಲಿ ಸಂಭಾವ್ಯತೆಯ ಕುಸಿತವು ಇರುವುದಿಲ್ಲ, ಆದರೆ ಅದರಲ್ಲಿ ಹೆಚ್ಚಳವಾಗುತ್ತದೆ.

ನ್ಯೂಟ್ರಾಲೈಸೇಶನ್ ಹೆಪ್ಪುಗಟ್ಟುವಿಕೆ (ದುರ್ಬಲವಾಗಿ ಚಾರ್ಜ್ ಮಾಡಲಾದ ಕಣಗಳ ಭಾಗವಹಿಸುವಿಕೆಯೊಂದಿಗೆ ಸಂಭವಿಸುತ್ತದೆ ಮತ್ತು ಎಲೆಕ್ಟ್ರೋಲೈಟ್-ಕೋಗ್ಯುಲೇಟರ್ನ ಚಾರ್ಜ್ನ ಮೇಲೆ ಮಾತ್ರವಲ್ಲದೆ ದಟ್ಟವಾದ ಮತ್ತು ಪ್ರಸರಣ ಪದರಗಳ ಗಡಿಯಲ್ಲಿರುವ ಸಂಭಾವ್ಯತೆಯ ಮೇಲೆ ಅವಲಂಬಿತವಾಗಿರುತ್ತದೆ).
ಸ್ಮೋಲುಚೌಸ್ಕಿಯ ಕ್ಷಿಪ್ರ ಹೆಪ್ಪುಗಟ್ಟುವಿಕೆಯ ಸಿದ್ಧಾಂತ.

ಎಲೆಕ್ಟ್ರೋಲೈಟ್ ಸಾಂದ್ರತೆಯ ಮೇಲೆ ಹೆಪ್ಪುಗಟ್ಟುವಿಕೆ ದರದ ಅವಲಂಬನೆ.
ನಾನು - ಹೆಪ್ಪುಗಟ್ಟುವಿಕೆಯ ಪ್ರಮಾಣ ಕಡಿಮೆಯಾಗಿದೆ,
II - ಹೆಪ್ಪುಗಟ್ಟುವಿಕೆಯ ಪ್ರಮಾಣವು ಎಲೆಕ್ಟ್ರೋಲೈಟ್ ಸಾಂದ್ರತೆಗೆ ಬಹುತೇಕ ಅನುಪಾತದಲ್ಲಿರುತ್ತದೆ.
III - ಕ್ಷಿಪ್ರ ಹೆಪ್ಪುಗಟ್ಟುವಿಕೆಯ ಪ್ರದೇಶ, ವೇಗವು ಪ್ರಾಯೋಗಿಕವಾಗಿ ಏಕಾಗ್ರತೆಯಿಂದ ಸ್ವತಂತ್ರವಾಗಿರುತ್ತದೆ.
ಮೂಲ ನಿಬಂಧನೆಗಳು:
ಆರಂಭಿಕ ಸೋಲ್ ಮೊನೊಡಿಸ್ಪರ್ಸ್ ಆಗಿದೆ, ಇದೇ ಕಣಗಳು ಗೋಳಾಕಾರದ ಆಕಾರವನ್ನು ಹೊಂದಿರುತ್ತವೆ.
ಎಲ್ಲಾ ಕಣಗಳ ಘರ್ಷಣೆಗಳು ಪರಿಣಾಮಕಾರಿ.
ಎರಡು ಪ್ರಾಥಮಿಕ ಕಣಗಳು ಘರ್ಷಿಸಿದಾಗ, ದ್ವಿತೀಯಕ ಕಣವು ರೂಪುಗೊಳ್ಳುತ್ತದೆ. ದ್ವಿತೀಯ + ಪ್ರಾಥಮಿಕ = ತೃತೀಯ. ಪ್ರಾಥಮಿಕ, ದ್ವಿತೀಯ, ತೃತೀಯ - ಬಹುಸಂಖ್ಯೆ.
ರಾಸಾಯನಿಕ ಚಲನಶಾಸ್ತ್ರದ ವಿಷಯದಲ್ಲಿ, ಹೆಪ್ಪುಗಟ್ಟುವಿಕೆಯ ಪ್ರಕ್ರಿಯೆಯನ್ನು ಸಮೀಕರಣದಿಂದ ವಿವರಿಸಬಹುದು:
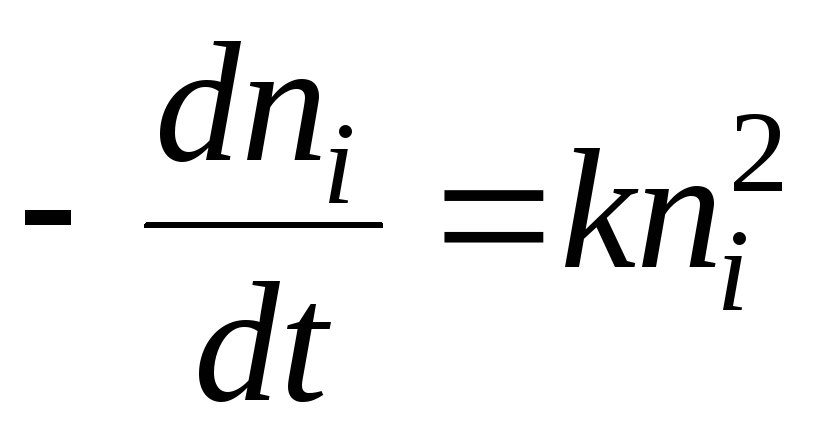
ಪರಿಹಾರವು ಸಮೀಕರಣವಾಗಿರುತ್ತದೆ: 
 - ಅರ್ಧ ಹೆಪ್ಪುಗಟ್ಟುವಿಕೆ ಸಮಯ. ಸೋಲ್ ಕಣಗಳ ಸಂಖ್ಯೆಯು 2 ಪಟ್ಟು ಕಡಿಮೆಯಾಗುವ ಸಮಯ ಇದು.
- ಅರ್ಧ ಹೆಪ್ಪುಗಟ್ಟುವಿಕೆ ಸಮಯ. ಸೋಲ್ ಕಣಗಳ ಸಂಖ್ಯೆಯು 2 ಪಟ್ಟು ಕಡಿಮೆಯಾಗುವ ಸಮಯ ಇದು.

 ,
,
 ,
,
 ,
,


ಗುಣಾಕಾರವು ಹೆಚ್ಚಾದಂತೆ, ಹೆಪ್ಪುಗಟ್ಟುವಿಕೆಯ ವಕ್ರಾಕೃತಿಗಳ ಗರಿಷ್ಠವು ದೊಡ್ಡ ಮೌಲ್ಯಗಳ ಕಡೆಗೆ ಬದಲಾಗುತ್ತದೆ  .
.
ನ್ಯೂನತೆಗಳು:
ಮೊನೊಡಿಸ್ಪರ್ಸಿಟಿಯ ಊಹೆ.
ಎಲ್ಲಾ ಘರ್ಷಣೆಗಳ ಪರಿಣಾಮಕಾರಿತ್ವದ ಬಗ್ಗೆ ಊಹೆ.




 - ಗೋಳ,
- ಗೋಳ, ,
,





