التغييرات في الوظائف الديناميكية الحرارية أثناء الامتزاز. الديناميكا الحرارية لعمليات الامتزاز. تصميم الأجهزة لعمليات الامتزاز
الامتزاز(من الإعلان اللاتيني - on، at و سوربيو - امتصاص)، تغيير (عادة زيادة) في تركيز المادة بالقرب من واجهة الطور ("الامتصاص على السطح"). سبب الامتزاز- عدم تشبع الروابط بين الجزيئات بالقرب من السطح، أي. وجود الامتزاز ميدان القوة. يُطلق على الجسم الذي يخلق مثل هذا المجال اسم الممتز، وتسمى المادة التي يمكن امتزاز جزيئاتها باسم الممتز، والمادة التي تم امتزازها بالفعل تسمى الممتز. عملية عكسية الامتزاز، ويسمى الامتزاز.
طبيعة مجال الامتزاز مختلفة. إذا كان الامتزاز مرتبطًا بسندات فان دير فالس، إذن الامتزازتسمى المادية. إذا كانت هذه روابط التكافؤ، أي. الامتزازيحدث مع تشكيل السطح مركبات كيميائية، الذي - التي الامتزازتسمى كيميائية، أو الامتزاز الكيميائي. الميزات الهامة الامتزاز الكيميائيالمعروضات: اللارجعة، والتأثيرات الحرارية العالية (مئات كيلوجول/مول)، والطابع المنشط. هناك العديد من الأنواع المتوسطة الامتزازبين الفيزيائية والكيميائية الامتزاز. على سبيل المثال، الامتزازالناتجة عن تكوين الروابط الهيدروجينية. من الممكن أيضا أنواع مختلفةبدني الامتزاز. الحدث الأكثر شيوعًا هو حدوث قوى التجاذب بين الجزيئات المشتتة، نظرًا لأنها تكون ثابتة تقريبًا بالنسبة للمواد الممتزة ذات السطح من أي طبيعة كيميائية (غير محددة الامتزاز). بدني الامتزازقد يكون سببها القوى الكهروستاتيكية (التفاعلات بين الأيونات أو ثنائيات القطب أو الرباعية)؛ حيث الامتزازتحدده الطبيعة الكيميائية للجزيئات الممتزة (ما يسمى بالجزيئات المحددة). الامتزاز). تلعب هندسة الواجهة أيضًا دورًا مهمًا. إذا كان السطح مسطحًا، فهو كذلك الامتزازسطح مفتوح، في حالة السطح المنحني قليلاً أو بقوة - حول الامتزازفي المسام من الممتزات.
نظريا الامتزازالتمييز بين الإحصائيات (نظام الممتزات في حالة توازن ديناميكي حراري) والحركية (لا يوجد توازن).
احصائيات الامتزاز
الديناميكا الحرارية للامتصاص
.أساسيات الديناميكا الحرارية الامتزازتم إنشاؤها بواسطة J. Gibbs في السبعينيات. القرن التاسع عشر وفقًا لجيبس، في نظام ثنائي الطور متوازن بالقرب من واجهة الطور، يوجد بعض التغيير في القيم المحلية لجميع الخصائص الشاملة (باستثناء الحجم). إلا أن الأطوار تعتبر متجانسة حتى يفصل بينها سطح هندسي معين. ولذلك فإن قيمة أي خاصية واسعة النطاق للنظام ككل لا تساوي مجموع قيم هذه الخاصية في المراحل المتجانسة و. ويعزى الفرق إلى الطور السطحي ثنائي الأبعاد المرتبط بالسطح الفاصل. لأن المرحلة السطحية ليس لها سمك الخامس 0=+ و=-، حيث الخامس-مقدار.
تتيح لنا الأفكار المقدمة تقليل المعادلة الديناميكية الحرارية الأساسية إلى الشكل:
حيث G هي طاقة جيبس الحرة، وS هي الإنتروبيا، وهي التوتر السطحي، وs هي منطقة الواجهة، وn أنا- الإمكانات الكيميائية المقابلة وعدد الشامات أنا- ذلك المكون. يشير المؤشر إلى قيمة الخاصية المقابلة في المرحلة السطحية. يتيح لك تحويل Legendre تعديل المعادلة (1) للظروف متساوية الحرارة:
الكمية تسمى جيبس الامتزازويشار إليه بالرمز G (معبر عنه بـ mol/cm2). لنظام مكون من مكونين:
يمكن اختيار موضع السطح الفاصل بشكل تعسفي. وعلى وجه الخصوص، فإن اختيار هذا الموضع يمكن أن يفي بالشرط Г 1 =0. ويسمى هذا السطح متساوي الجزيئات. لذلك تم تقديم التعيين Г 2 = Г 2 (1). وهذا يعني معادلة امتزاز جيبس الأساسية:
إذا كانت المادة الممتزة غير قابلة للذوبان تماماً في إحدى الطورين، =const، والانتقال من المعادلة (2) إلى المعادلة (3) لا يتطلب الشرط Г 1 =0. هكذا يا جيبس الامتزازهو الفائض في مكون معين في نظام حقيقي ثنائي الطور مقارنة بنظام تكون فيه كلا المرحلتين متجانستين تمامًا حتى السطح الفاصل. بالإضافة إلى كميات جيبس الزائدة الامتزازتلعب دورًا كبيرًا في نظريتها الامتزازيُفهم على أنه المحتوى الكامل للمكون أنافي الفضاء دبليو، حيث تتجلى قوى الامتزاز. الإشارة إلى المحتويات الكاملة بواسطة أوعلى افتراض أن المكون أناغير قابل للذوبان تمامًا في إحدى المراحل السائبة، لدينا:
أين سي أنا-تركيز أنا-من هذا المكون في المرحلة السائبة. في صغير ج أنا:
الامتزازيمكن أن تحدث في أي واجهة بين أي مرحلتين، ولا سيما في واجهة مائع-سائل (غاز سائل، سائل-سائل) أو واجهة صلبة-سائل (غاز صلب، صلب-سائل). في أنظمة الموائع والموائع، يمكن قياس a كدالة ويمكن تحديد G 2 (1) تجريبيًا باستخدام المعادلة (3). وفي الحالة الثانية، يتم قياس تحديد G 2 (1) بأي طريقة n أنا 0، و تركيز المكون الأول في هذه المجلدات. ومن هنا نحسب G أنا(١) . تسمى هذه الطريقة الحجمية (أو الحجمية). باستخدام طريقة الوزن (الوزنية)، يتم تحديد كمية أنا-هذا المكون في الواجهة.
ايزوثرم الامتزاز
.في نظام الامتزاز التوازن، المعلمات التي تحدد التوازن هي أالضغوط الجزئية ر(أو مع أنا) ودرجة الحرارة ت. وترتبط فيما بينها بما يسمى بالمعادلة الحرارية:
في الامتزازالامتزاز الفردي ( أنا=1) تأخذ هذه المعادلة الشكل:
ثلاث حالات خاصة المعادلة الحرارية(متى ت، صأو أ- الثوابت) تلعب دورا خاصا في النظرية الامتزاز:
أ=- معادلة الأيزوثرم الامتزاز,
ت =- معادلة الأيزوبار الامتزاز,
ص-- معادلة الأيزوستر الامتزاز.
يتم تحديد النوع المحدد من الوظائف من خلال خصائص النظام قيد النظر. فإذا كان أحدهما مثلا معروفا بأي قيمة ت = const، فمن الواضح أن الاثنين الآخرين أصبحا معروفين أيضًا. وفي هذه الحالة، ليس من الضروري معرفة النوع التحليلي للتبعيات. ويمكن تحديدها تجريبيا كمجموعة من القيم أ، صو ت.
نظريا الامتزازعادة ما يتم تحديد مسألة شكل الوظيفة أ=(ع) ز، أي حول معادلة الأيزوثرم الامتزاز. وترجع هذه المشكلة إلى التأثيرات الحرارية المصاحبة الامتزاز. عند حساب التغيرات في قيم الوظائف الديناميكية الحرارية الرئيسية في حالة التحول الاسم المميزمولات المادة المازة من الطور السائب إلى الطور السطحي في نظام التوازن عند ع =هناك حالتان محتملتان: في الحالة الأولى، يؤخذ في الاعتبار فقط تحويل المادة الممتزة إلى مادة ممتزة، حيث أن المادة الممتزة عند الامتزازدون تغيير من الناحية الديناميكية الحرارية، ودورها هو أن تكون بمثابة مصدر لحقل الامتزاز؛ وفي الحالة الثانية، يؤخذ في الاعتبار أيضًا التغير في المادة المازة.
وبما أن النظام في حالة توازن، فإن الإمكانات الكيميائية للمادة الممتزة والمادة الممتصة هي نفسها؛ انتروبيا المادة الممتزة بسبب انخفاض حركة الجزيئات معها الامتزازأقل إنتروبيا من الممتزات. لذلك، مع الممتزات الخاملة، يكون المحتوى الحراري دائمًا سلبيًا، أي. الامتزازطارد للحرارة. مع الأخذ بعين الاعتبار التغير في إنتروبيا المادة المازة قد يغير هذا الاستنتاج. على سبيل المثال، عندما يتم امتصاص المواد التي يتضخم فيها البوليمر بواسطة البوليمرات، فإن إنتروبيا هذه الأخيرة (بسبب زيادة حركة الجزيئات الكبيرة) يمكن أن تزيد بدرجة كبيرة بحيث الامتزازيصبح ماصًا للحرارة. في ما يلي، تتناول المقالة الطاردة للحرارة فقط الامتزاز.
هناك درجات حرارة متكاملة وتفاضلية ومتساوية ومتوسطة الامتزاز. حرارة متكاملة سيساوي فقدان المحتوى الحراري (في الخامس= const - طاقة داخلية ثابتة) عند التغيير الامتزازمن أ 1قبل 2(في حالة معينة قد يكون 1 = 0): س= -(ح2 - ح1). ترتبط هذه القيمة عادة بكتلة المادة المازة ويتم التعبير عنها بوحدة J/kg.
الحرارة التفاضلية س(J/mol) يساوي فقدان المحتوى الحراري درهمعندما يتغير أعلى دا. يتم التعبير عنها من خلال الموقف ف = - (دها / دا). من الواضح أن
الحرارة المتساوية q st تساوي:
أين هو الفرق بين الحجوم المولية للمكثف والممتزج. يمكن أن يظهر ذلك  للغاز المثالي الممتز:
للغاز المثالي الممتز:
معنى المقدمة qsiهو أن تحديده لا يتطلب بيانات السعرات الحرارية (مثل سو س) ويمكن حسابها باستخدام المعادلة (9) بناء على نتائج القياس الامتزاز. يتم أيضًا تقديم حرارة متوسطة س(جول/مول):
مع النمو أمعامل سيزيد دائما، أ سقد تنخفض أو تزيد أو تبقى دون تغيير. مع النمو أمع سطح غير موحد الامتزازيحدث في المناطق الأقل نشاطًا بشكل متزايد، مما يؤدي إلى الانخفاض س. إلا أن ذلك يقلل من متوسط المسافات بين الجزيئات الممتزة، ونتيجة لذلك تزداد قوى التجاذب بينها، و سيزيد. العلاقة بين التأثيرين المذكورين تحدد مسار الاعتماد ف = و (أ). لكبيرة جداً أتبدأ القوى البغيضة في السيطرة على هذا المجال سيتناقص دائمًا مع النمو أ.
بالنسبة للتغطيات السطحية الصغيرة جدًا، يتم استخدام معادلة الأيسوثرم الامتزازله شكل معادلة هنري:
حيث KH هو معامل هنري. في الواقع، في صغيرة جدا أطبقة الامتزاز تشبه الغاز المثالي ثنائي الأبعاد، وبالتالي فإن معادلة حالته لها الشكل: = ريت،حيث الضغط ثنائي الأبعاد، هو المساحة التي يشغلها مول واحد من المادة. ومن هنا ومع مراعاة أن =- وباستخدام المعادلة (3) نحصل على المعادلة (12). معادلة هنري تتطلب ذلك سكان ثابتا. عند الحشوات الكبيرة، تتوقف هذه المعادلة عن الصمود. لذلك، اقترح G. Freundlich (1906) وصف متساوي الحرارة الامتزازالمعادلة التجريبية التالية (معادلة فروندليتش):
أين كو ن- ثوابت. غالبًا ما تستخدم هذه المعادلة كصيغة استيفاء، على الرغم من أنها صغيرة رلا تتحول إلى المعادلة (12) بل لكبيرة جداً ريؤدي إلى زيادة غير محدودة تتعارض مع الخبرة أ.
نظرية الأيزوثرم الصارمة الامتزازتم إنشاؤه بواسطة I. Langmuir (1914-18). وتستند النظرية على ما يلي. النموذج: 1) سطح المادة المازة عبارة عن مجموعة من المراكز النشطة المتطابقة بقوة والتي يتم امتصاص الجزيئات الممتزة عليها (موضعية) ؛ 2) يتم امتصاص جزيء واحد فقط في مركز واحد، أي. في الامتزازيتم تشكيل مادة ماصة واحدة فقط. طبقة (أحادي الطبقة)؛ 3) الامتزازفي هذا المركز لا يؤثر الامتزازعلى مراكز أخرى، أي التفاعل. يمكن إهمال الجزيئات الممتزة.
يسمى نموذج لانجميور أحادي الجزيئي الموضعي الامتزازعلى سطح متجانس. معادلة الأيزوثرم الامتزاز، الموافق لهذا النموذج، م.ب. تم الحصول عليها باستخدام فك. الطرق (الحركية الجزيئية، الديناميكية الحرارية، الديناميكية الحرارية الإحصائية). نعم الممتزات. يمكن التعبير عن التوازن على النحو التالي. مخطط:
جزيء مجاني الممتزات. في الغاز + الممتزات. مركز المرحلة المعقدة (مركز مزدحم)
يتناسب تركيز الجزيئات في الغاز مع p، وهو تركيز المادة الحرة. حجم المراكز ( أ ر - أ)،أين و ت -العدد الكلي للمراكز، عدد المراكز المشغولة، تركيز الامتزاز. حجم المجمعات الامتزازوبالتالي فإن ثابت التوازن هو: ك ع = ص(أ ر -أ)/ الامتزازومن هنا نحصل على معادلة لانجميور:
أين ب-ت. مُسَمًّى الممتزات. معامل متساوي ك ص -1 .في منطقة الضغوط المنخفضة جدا ب " 1 و أ = (أ م ب) ص،وهو ما يتوافق مع معادلة هنري، حيث ك ح= أ م ب.في منطقة الضغوط العالية جدا ب 1 و أأ ر؛حيث الامتزازلم يعد يعتمد على الضغط. توازن ثابت ب -1يرتبط بالقيمة القياسية لجهد التفاعل متساوي الضغط:
يتطلب نموذج لانجميور هذا التفاضل الحرارة والانتروبيا الامتزازلا يعتمد على درجة ملء السطح.
المعادلة (14) هي تعبير صارم يتوافق مع نموذج لانجميور، ولكن نادرا ما يكون له ما يبرره تجريبيا، حيث أن النموذج نفسه مثالي الامتزازعقيدة الامتزازمنذ العشرينات القرن ال 20 في الوسائل. تم بناء الدرجة على أساس إضعاف أو استبعاد واحد أو آخر من افتراضات لانجميور الامتزاز
اقترح لانجموير بالفعل طريقة للوصف الامتزازعلى سطح غير منتظم (أي بافتراض أن المراكز ليست كلها متماثلة). ومن خلال دمج المراكز المتطابقة في مجموعات، وبافتراض أن المعادلة (14) تنطبق على كل مجموعة، يمكننا افتراض ذلك الامتزازعلى السطح بأكمله يتم التعبير عنه بمجموع شروط المعادلة (14):
على افتراض أن عدد الممتزات. مراكز م.ب. موصوفة بوظيفة توزيع مستمرة وفقًا للقيم الحرة. الطاقة، حصل Ya.B.Zeldovich من الصيغة (16) للدالة الأسية على معادلة من النوع (13).
الامتزازعلى الأسطح غير المتجانسة - فصل كبير من النظرية الامتزازالرئيسية حل مشكلة معادلة متكاملة:
أين و(ص) - ما يسمى تجريبي متساوي الحرارة الامتزاز- وظيفة أو أخرى لتوزيع عدد المراكز حسب القيم الحرة. طاقة،( ب، ع)-الأيسوثرم المحلي الامتزاز، والذي عادةً ما يُنظر إليه على أنه تساوي درجة حرارة لانجميور الامتزاز
لقد جرت محاولات عديدة لرفض افتراض لانجميور الثاني. الامتزازوعلى هذا المسار ظهرت نظرية الجزيئات المتعددة الامتزاز، اقترحها S. Brunauer، P. Emmett و E. Teller (نظرية BET). تفترض النظرية أنه عند درجات حرارة أقل من درجة الحرارة الحرجة، يتم امتصاص كل جزيء في الطبقة الأولى (حرارة الامتزاز تشي،) هو مركز الجزيئات التي تشكل الطبقة الثانية، الخ. ومن رأى أن الحرارة الامتزازفي جميع الطبقات ماعدا الأولى تساوي حرارة التكثف، وهذا النموذج يؤدي إلى المعادلة:
أين ج =إكسب [(ف 1 -)/رت]. المعادلة (18) في الإحداثيات أ، ص / ع قيتوافق مع منحنى على شكل S. في الإحداثيات ص / ع ق،
متساوي الحرارة الامتزازوفقا للمعادلة (18) يجب أن تكون خطية. إن ميل هذا الخط المستقيم (عادةً في حدود 0.05 ص / ع ث 0.30) والقطعة المقطوعة به على المحور الإحداثي تعطي القيم على التوالي. فيو مع.يرجع الانتشار الواسع لنظرية BET إلى حقيقة أن مؤلفيها يؤمنون بها في الواقع الامتزازغير مترجمة، وتحديد الثابت فيليس مع عدد الممتزات المنفصلة. المراكز، ومع عدد الجزيئات الممتزة في الطبقة الأولى ذات التعبئة الأكثر كثافة (في ر= ملاحظة).ولذلك، وبطرح فكرة المساحة التي يشغلها جزيء واحد في هذه الطبقة، نقبل:
أين س-كثف مساحة السطح الامتزازكقاعدة عامة، لهذا الغرض يتم قياس الأيسوثرم الامتزازالنيتروجين ونفترض أن لجزيئه = 0.162 نانومتر2. يتم إجراء عملية حسابية مماثلة في كثير من الأحيان سوفقا لنموذج لانجميور غير صحيح، لأن من الواضح أن هذه الطريقة تنطبق فقط على غير المترجمة الامتزاز
في نظرية متعدد الجزيئات الامتزازتم تقديم مساهمة كبيرة من قبل J. de Boer، الذي أظهر تجريبيًا أن اعتماد متوسط عدد الطبقات (فوق الطبقة الأولى) على جميع الأسطح المتشابهة في الخواص الكيميائية. الطبيعة، من ص / ع قيتم التعبير عنها بمنحنى عالمي (ما يسمى بمنحنى t). وهذا يجعل من الممكن أيضًا تقدير المساحة السطحية للمواد الماصة.
وقد بذلت محاولات لمراعاة التفاعل في نموذج لانجميور. بين الامتزاز. جزيئات. وهكذا، فإن T. Hill وJ. de Boer، معتبرا أن معادلة حالة الممتزc. الطبقة التناظرية ثنائية الأبعاد لمعادلة فان دير فالس، حصلنا على ما يلي. معادلة الأيزوثرم الامتزاز:
حيث= أ/أ ر، أوالثوابت ب لمعادلة فان دير فالس الامتزاز R. فاولر وE. غوغنهايم، مع مراعاة التفاعل. كثف. الجزيئات، استنتجنا المعادلة:
حيث هو ثابت مرتبط بالتفاعل الزوجي للجزيئات.
هناك آلية أخرى تؤدي إلى التكامل. الامتزازالممتزات أقل من قيمتها الحرجة. درجات الحرارة على الممتزات المسامية عند قيم عالية نسبيا ع / ع ق .هذا هو التكثيف الشعري. إذا تشكل هلالة مقعرة من المادة الممتزة في المسام، فإن التكثيف يبدأ فيها عند p/p s وفقًا لمعادلة كلفن:
أين هو التوتر السطحي للمادة الممتزة V -لهالحجم المولي، نصف قطر R لانحناء الغضروف المفصلي الامتزازيؤدي التكثيف الشعري إلى ارتفاع حاد في الأيسوثرم الامتزازفي هذه الحالة، ما يسمى. الممتزات. التباطؤ، أي. عدم تطابق الامتزاز والامتزاز. فروع متساوية الحرارة. كقاعدة عامة، يرجع ذلك إلى حقيقة أن شكل الغضروف المفصلي متى الامتزازوالامتزاز لا يتزامنان.
يستخدم التكثيف الشعري لتحديد حجم المسام من الممتزات الامتزازحسب المعادلة (22) لكل قيمة ص / ع قحساب نصف قطر انحناء الغضروف المفصلي الامتزازمنه مع مراعاة سمك الممتزات. الطبقة (على سبيل المثال، على طول منحنى t)، وشكل المنطقة الانتقالية من الطبقة إلى الغضروف المفصلي والاعتماد على الانحناء عند r صغير جدًا , أوجد الحجم الخطي (نصف القطر الفعال r ef) للمسام المملوءة عند نقطة معينة ع / ع ق .يتم تحديد حجم هذه المسام من خلال الزيادة الامتزازعند نقطة الأيسوثرم هذه. باستخدام البيانات التي تم الحصول عليها، يتم إنشاء منحنى توزيع حجم المسام على أنصاف أقطارها. الطريقة قابلة للتطبيق عند r ef 1.5 نانومتر. عادة يتم إجراء الحساب باستخدام الامتزاز. فروع الأيسوثرم، ولكن أكثر صرامة الحديثة. تتطلب النظرية مراعاة كلا الفرعين لبناء المنحنى.
النظرية المحتملة للامتزاز ونظرية الملء الحجمي للمسام الصغيرة.نموذج الامتزاز، والتي تختلف بشكل أساسي عن لانجموير، تم اقتراحها في عام 1914 من قبل م. بولياكي. وفقا لهذا النموذج، هناك مادة ماصة محتملة بالقرب من سطح المادة المازة. مجال القوة الذي يتناقص مع المسافة من السطح. ونتيجة لذلك، فإن ضغط المادة المازة، يساوي p بعيدًا عن السطح، يزداد بالقرب منه وعلى مسافة معينة يصل إلى القيمة ps، التي يتكثف عندها الممتز. حجم الطبقة بين الواجهة والجيوم. مكان النقاط حيث ع = p s، مليئة بالسائل، والتي يتم تعيين القيم الفيزيائية العادية لها. خصائص السائل السائب. متساوي الحرارة عكسها العمل ه الامتزاز. القوى التي تحددها المعادلة = RTlnp/p s، تسمى. الممتزات. المحتملة، والمفهوم كله هو نظرية محتملة الامتزازلحجم معين الخامسالممتزات. من المحتمل أن تكون الطبقة مستقلة عن درجة الحرارة (بسبب استقلال قوى التشتت عن درجة الحرارة). هذا الثبات في درجة الحرارة يجعل من الممكن إعادة الحساب الامتزازمن درجة حرارة إلى أخرى، على الرغم من معادلات الأيسوثرم الامتزازولم يكن من الممكن الاستدلال على أساس النظرية المقدمة. لقد تم استخدام نموذج بولياني على نطاق واسع وبنجاح من قبل الكثيرين. من قبل المؤلفين، فإنه يحتوي على حكمين ضعيفين للغاية: 1) افتراض أن أفضل الممتزات. الفيلم له قيم مادية عادية. خصائص السائل السائب (لم يتم تأكيد هذا الافتراض بالتجارب)؛ 2) ثبات درجة الحرارة للوظيفة =و(الخامس)،تم تأكيد النظرية الأساسية تقريبًا من خلال التجربة فقط بالنسبة للممتزات المسامية الدقيقة جدًا.
وباستخدام النظرية المحتملة، قال م.م. اقترح دوبينين وطور نظرية الحشو الحجمي للمسام الدقيقة (VFM). لقد تم افتراض أن هذه النظرية تنطبق فقط على الممتزات الصغيرة المسامية. إن خصوصية هذه المواد الماصة، التي يبلغ حجم المسام الخطية فيها r1 نانومتر، هي أن الحجم الكامل لمسامها "مملوء" بالمواد الماصة. مجال. لذلك متى الامتزازيتم ملؤها ليس طبقة تلو الأخرى، ولكن حجميا. الكمية في الحالة قيد النظر ليست ممتزة. الإمكانات، وحتى العلامة الكيميائية. إمكانات الامتزاز، تقاس من المستوى الكيميائي. إمكانية وجود سائل عادي عند نفس درجة الحرارة. تنقسم المجموعة الكاملة من المسام الممتزة إلى ثلاث فئات: المسام الصغيرة ( ص 0.6 نانومتر)، المسام المتوسطة (0.6 نانومتر - 20 نانومتر) والمسام الكبيرة ( ص 20 نانومتر). الامتزازفي المسام الصغيرة يحدث وفقًا لمخطط TOZM، أي. حجميًا، في المسام المتوسطة - وفقًا لآلية ملء طبقة بطبقة، مكتملة بالتكثيف الشعري. المسام الكبيرة أثناء الامتزاز. لا تلعب أي دور في التوازن.
بعد أن قدم فكرة توزيع أحجام المسام حسب القيم الكيميائية. يمتص الإمكانات فيهم، م.م. Dubinin و L. V. حصل Radushkevich على معادلة الأيسوثرم الامتزاز لـ TOZM، والتي عادة ما تكون مكتوبة على النحو التالي. استمارة:

أين ص، إيو0 -معلمات ( أ 0 = أفي ع =ملاحظة). اعتماد درجات الحرارة أ 0:
حيث= -(دا 0 /دت)؛ أ 0 0 = 0عند T= T 0. خيارات صو هعمليا مستقلة عن درجة الحرارة. في معظم الحالات ص= 2. فقط في الحالات التي تكون فيها درجات الحرارة الأولية الامتزازكبيرة جدًا ن > 2.لإعادة حساب متساوي الحرارة الامتزازمن مادة امتزازية إلى أخرى يُفترض تقريبًا ذلك ه 1 /ه 2 ف 1 /ف=وأن 01 /a 02 V 1 /V 2 حيث P أنا- باراكور، السادس -الحجم المولي من الامتزاز الامتزاز
تتميز كل مادة ماصة صغيرة الحجم بـ TOZM بمعلمتين: ث-حجم المسام الصغيرة ( ث 0 = = أ 0 فولت 0) وE 0 -مميزة. طاقة؛ ث 0وE0 يشار إليها على أنها مادة ماصة قياسية، وعادة ما تكون البنزين.
استخدام فكرة وجود مسام بأحجام مختلفة في المادة الممتزة الحقيقية، وإدخال توزيع القيم هالتشتت يساوي F. اقترح ستيكلي تعميم المعادلة (23)، تسمى معادلة دوبينين-ستيكلي:

أين ب 0 -ثابت مرتبط هفي المعادلة (23)، و ص= ![]() . لأن في الممتزات. التكنولوجيا الأكثر أصبحت المواد الماصة الدقيقة (الكربون النشط، الزيوليت، المواد الهلامية الجافة المسامية الدقيقة) منتشرة على نطاق واسع، ويستخدم TOZM ليس فقط في التطبيقات الفيزيائية والكيميائية. البحث، ولكن أيضًا في الحسابات الهندسية.
. لأن في الممتزات. التكنولوجيا الأكثر أصبحت المواد الماصة الدقيقة (الكربون النشط، الزيوليت، المواد الهلامية الجافة المسامية الدقيقة) منتشرة على نطاق واسع، ويستخدم TOZM ليس فقط في التطبيقات الفيزيائية والكيميائية. البحث، ولكن أيضًا في الحسابات الهندسية.
امتزاز مخاليط الغاز والسائل. من الناحية العملية، نحن لا نتعامل دائمًا مع مادة ماصة فردية، بل مع خليط من الغازات أو المحاليل السائلة. ولذلك، مطلوب تعميم النظرية الامتزازفي حالة الامتزاز متعدد المكونات الامتزازمن حيث المبدأ، يمكنك أن تبدأ من أي نموذج الامتزازوتوسيع نطاقه إلى هذه الحالة. في الامتزازخليط الغاز، ويتحقق ذلك ليس فقط عن طريق تعقيد المعادلات بشكل كبير، ولكن أيضًا عن طريق إدخال إضافات إليها. تجريبي المعلمات المتعلقة أو مع التفاعل. جزيئات متباينة أو، بشكل عام، مع تأثير مواد معينة على المعامل. نشاط الآخرين. فقط نموذج لانجميور هو الذي يسمح لنا بالحصول على معادلة الأيسوثرم الامتزازمخاليط بدون معلمات غير مدرجة في المعادلات الامتزازالأصناف الفردية للقيام بذلك، يكفي أن نأخذ في الاعتبار أنه أثناء امتصاص المكون K من الخليط أنامكونات جزء من الممتزات. مراكز م.ب. تشغلها جزيئات أخرى. لهذا السبب:
متى الامتزازالمحاليل السائلة، بغض النظر عن تركيزها، يتم ملء سطح المادة المازة بالكامل الامتزازبالتالي الامتزازتكون جزيئات المكون k مصحوبة بإزاحة عدد معين من جزيئات المكونات المتبقية، أي. الامتزازتتسم بالتنافسية بطبيعتها.
هناك الجزيئية والأيونية الامتزازحلول. الأول يحدث عندما الامتزازمحاليل غير الإلكتروليتات، المحلول الثاني للإلكتروليتات. جزيئي الامتزازكقاعدة عامة، يتم التعبير عنها كميات زائدة. طبيعة تنافسية الامتزازيحدد أن القيمة أم.ب. سواء الإيجابية والسلبية. تعبير الامتزاز أنا-من هذا المكون كدالة لكسر الخلد الخاص به في المحلول x أنا- لدينا ذلك G أنا= يا في س أنا= 0 و س أنا = 1 (التغيير المحتملحجم المادة في الممتزات. الطبقة مهملة). لذلك الأيسوثرم الامتزازلديه واحد أو أكثر التطرف.
معادلة الأيزوثرم الامتزازالمحاليل الثنائية للكهارل، والتي تم إثباتها بشكل موثوق بالديناميكا الحرارية، لها الشكل:

حيث يشير الحرف المنخفض إلى الممتز. مرحلة، - ( د ق 2 / د ق 1) يوضح عدد مولات المكون الثاني التي تم إزاحتها بواسطة مول واحد من الأول؛ الفرق بين المصطلحين (الأجزاء القياسية) للمادة الكيميائية. المحتملة، اعتمادا فقط على درجة الحرارة.
أساسي مشكلة استخدام هذا وعدد من معادلات الأيسوثرم الأخرى الامتزاز- توضيح اعتماد المعامل. نشاط المكونات في الامتزاز. طبقة من تركيبته الامتزازالسؤال الأهم عند الاستخدام الامتزازلفصل أو تنقية المواد - اختيار مادة ماصة انتقائية فيما يتعلق بمحلول مكون معين الامتزاز
أيوني الامتزاز، كقاعدة عامة، ليست متكافئة الامتزازيتم امتصاص المواد السائدة على السطح من محلول الإلكتروليت. الكاتيونات أو الأنيونات. بفضل الكهرباء قوى (كولوم) تتشكل على السطح طبقة كهربائية مزدوجة.
إذا كانت المادة المازة تحتوي على أيونات أو وظائف سطحية. المجموعات القادرة على التأين في مذيب معين، ثم يحدث التبادل الأيوني بين المادة المازة ومحلول الإلكتروليت. يسمى الممتز في هذه الحالة. أيوني.
حركية الامتزاز
الامتزاز، مثل أي عملية حقيقية، تحدث في الوقت المناسب. وبالتالي النظرية الكاملة الامتزازيجب أن يحتوي على قسم عن الحركية الامتزازالقانون الابتدائي الامتزازيتم تنفيذه على الفور تقريبًا (الاستثناء هو الامتصاص الكيميائي). ولذلك، التبعيات الوقت الامتزازيتم تحديدها بشكل رئيسي من خلال آلية الانتشار، أي توريد المادة المازة إلى الموقع الامتزازلو الامتزازعلى سطح مفتوح ليست لحظية، وتحدث مثل هذه العملية في منطقة الانتشار الخارجي؛ وعلاوة على ذلك، فإن قوانين الانتشار ليست محددة ل الامتزازفي حالة الممتزات المسامية، بالإضافة إلى الخارجية الانتشار، يبدأ الجزء الداخلي في لعب دور مهم. الانتشار، أي نقل المادة المازة في مسام المادة المازة في ظل وجود تدرج تركيز فيها. قد تعتمد آلية هذا النقل على تركيز المادة المازة وحجم المسام.
هناك انتشار جزيئي ونودسن وسطحي (فولمر). يحدث الانتشار الجزيئي إذا كان الطول الحر. مسار الجزيئات في المسام يكون أقل من حجم المسام، كنودسن – إذا كان هذا الطول يتجاوز حجم المسام. مع الانتشار السطحي، تتحرك الجزيئات على طول سطح المادة المازة دون الدخول في المرحلة السائبة. ومع ذلك، فإن قيم المعامل. الانتشار ليس هو نفسه بالنسبة لآليات الانتشار المختلفة. بصيغة الجمع في بعض الحالات، لا يمكن تحديد تجريبيا كيف يحدث الانتشار بالضبط، وبالتالي ما يسمى. معامل فعال الانتشار، ووصف العملية ككل.
أساسي دعونا نجرب مواد عن الحركية الامتزازبمثابة ما يسمى الحركية منحنى، أي الدالة = أ/أ يساوي = و (ر) حيث النسبية الامتزاز، أي ما يعادل نسبة قيمة الامتزاز الحالية أل أمساوية لقيمته في ذلك الوقت ر.لتفسير الحركية في أبسط الحالات، من المفترض أن الحبوب الممتزة لها بنية مسامية متجانسة تمامًا في الحجم (يسمى هذا النموذج شبه متجانس). وسائل. أحد التحسينات في النموذج شبه المتجانس هو فكرة أن كل حبة تحتوي على مناطق ذات مسام أكبر وأدق. يتم وصف الانتشار في مثل هذه الحبوب بعاملين مختلفين. معاملات.
في حالة السطح المفتوح، باعتماد نموذج لانجميور، من السهل الحصول على الحركية. المعادلة الامتزازمعدل الاقتراب من التوازن هو الفرق في السرعة الامتزازوالامتزاز. بافتراض، كما جرت العادة في علم الحركة، أن معدلات العمليات تتناسب مع تراكيز المواد المتفاعلة، نحصل على:
حيث k adc و k des هما ثوابت المعدل، على التوالي. الامتزازوالامتزاز. من المفترض أن يكون الضغط في الطور الغازي ثابتًا. عند دمج هذه المعادلة من ر= 0 إلى أي قيمة رنحن نحصل:
وبالتالي، بالنسبة لـ f لدينا: = متساوٍ. ولذلك، لدينا في النهاية:
حيث k = k الإعلانات + k des.
تأثير درجة الحرارة على السرعة الامتزازيتم التعبير عنها بمعادلة مشابهة لمعادلة أرهينيوس الامتزازمع ارتفاع درجة الحرارة، يزيد kads بشكل كبير. لأن يرتبط الانتشار في مسام المادة المازة بالتغلب على التنشيط. الحواجز، والاعتماد على درجة الحرارة من kads وkdes ليست هي نفسها.
معرفة معدلات الانتشار مهمة ليس فقط من الناحية النظرية الامتزاز، ولكن أيضًا لحساب الصناعة الممتزات. العمليات. في هذه الحالة، عادة لا يتعاملون مع الحبوب الممتزة الفردية، ولكن مع طبقاتها. يتم التعبير عن حركية العملية في الطبقة من خلال تبعيات معقدة للغاية. في كل نقطة من الطبقة في وقت معين، القيمة الامتزازيتم تحديده ليس فقط من خلال شكل معادلة الأيسوثرم الامتزازوقوانين حركية العملية، وأيضًا القوانين الهوائية أو الهيدروديناميكية. ظروف تدفق الغاز أو السائل حول الحبوب. تسمى حركية العملية في الطبقة الممتزة، على عكس حركية الحبوب المنفصلة. ديناميات الامتزاز, المخطط العامحل مشاكلها كالتالي: يتم تجميع نظام التفاضلات. المعادلات التفاضلية الجزئية مع مراعاة خصائص الطبقة الأيسوثرم الامتزاز، خصائص الانتشار (معامل الانتشار، أنواع نقل الكتلة في جميع أنحاء الطبقة وداخل الحبوب)، الهوائية والهيدروديناميكية. تيار الميزات الامتزازيتم تحديد الشروط الأولية والحدية. يؤدي حل نظام المعادلات هذا، من حيث المبدأ، إلى قيم الامتزازعند نقطة زمنية معينة عند نقطة معينة في الطبقة. كقاعدة عامة، تحليلية ولا يمكن الحصول على الحل إلا لأبسط الحالات، لذلك يتم حل هذه المشكلة عدديا باستخدام الكمبيوتر.
في دراسة تجريبية للديناميكيات الامتزازيتم تمرير تيار غاز أو سائل ذو خصائص معينة عبر الطبقة الممتزة ويتم دراسة تكوين التيار الخارج كدالة للوقت. ظهور المادة الممتصة خلف طبقة ما يسمى. الاختراق، والوقت الذي يسبق الاختراق هو وقت الإجراءات الوقائية. يسمى اعتماد تركيز مكون معين خلف الطبقة على الوقت. منحنى الإخراج هذه المنحنيات بمثابة الأساس. دعونا نجرب المواد التي تسمح للمرء بالحكم على أنماط الديناميكيات الامتزاز
تصميم الأجهزة لعمليات الامتزاز
هناك العديد من التقنيات. طرق الامتزاز. العمليات. دوري واسع الانتشار (دورية) تركيبات ذات طبقة ثابتة من المادة المازة الأساسية. العقدة التي تكون واحدة أو عدة. الممتزات مصنوعة على شكل أعمدة مجوفة مملوءة بمادة ماصة حبيبية. يتم تمرير تيار غاز (أو سائل) يحتوي على مكونات ممتزة عبر طبقة ماصة حتى يتم اختراقها الامتزازبعد ذلك، يتم تجديد المادة الممتزة الموجودة في جهاز الامتزاز، ويتم توجيه تدفق الغاز إلى جهاز امتزاز آخر. يتضمن تجديد المادة المازة عددًا من المراحل، أهمها الامتزاز، أي الامتزاز. تحرير المادة الممتصة مسبقًا من المادة المازة الامتزازيتم تنفيذ الامتزاز عن طريق التسخين، أو خفض ضغط الطور الغازي، أو الإزاحة (على سبيل المثال، البخار الساخن)، أو مزيج من هذه الطرق. لأن الأوقات الامتزازوإذا لم تتزامن عمليات التجديد، حدد هذا العدد من أدوات الامتزاز العاملة والمتجددة في وقت واحد بحيث تستمر العملية الشاملة بشكل مستمر.
بحسب التقنية واقتصادية لأسباب التجديد، لم يكتمل التجديد الامتزازلذلك، فإن قدرة عمل المادة المازة تساوي الفرق بين الحد الأقصى الذي تم تحقيقه في ظل ظروف معينة الامتزازوكمية المادة الممتزة المتبقية في المادة المازة بعد التجديد. ونتيجة لذلك، فإن الأيسوثروم الامتزاز، المقابلة للعملية في الممتز، لا ينبغي أن تكون شديدة الانحدار.
في المخطط الموصوف، هناك خياران ممكنان: 1) يتم امتصاص المنتج المستهدف من تدفق الغاز بشكل كامل تقريبًا، ثم يتم احتواؤه في المادة الممتصة، حيث يتم استخراجه بطريقة أو بأخرى؛ 2) يتم امتصاص المنتج المستهدف بشكل أسوأ من المكونات الأخرى لخليط الغاز، ثم يتم احتواؤه في تيار الغاز الخارج. وفقا للخيار الأول، على سبيل المثال، تعمل وحدات الاسترداد في إنتاج الفسكوز، حيث تجمع CS 2 من غازات العادم وتعيدها إلى الدورة. تصل إنتاجية هذه المنشآت إلى مئات الآلاف من الأمتار المكعبة من الغاز المنقى في الساعة؛ الكربون النشط الممتز الذي لا يحتوي على مسام دقيقة للغاية، أي. الفحم الذي فيه ثابت هوفقًا لـ TOZM (انظر أعلاه) هو 20-25 كيلوجول/مول. هذا هو المعنى ه 0 يتوافق مع درجة حرارة متساوية ليست شديدة الانحدار، مما يوفر ظروف تجديد جيدة. تسمى هذه الفحم متعافي. يتم الامتزاز ببخار الماء الساخن. لتوفير الطاقة، يتم تمرير تيارات الغاز الباردة والساخنة من خلال المبادلات الحرارية.
يعد تجفيف الغازات والسوائل أمرًا مهمًا جدًا، على سبيل المثال. الغازات البتروليةقبل معالجتها أو الطبيعية. الغازات قبل النقل الممتزات - هلام السيليكا أو الزيوليت. يتم الامتزاز عن طريق التسخين. نظرًا لأن امتزاز الزيوليت يرتبط بارتفاع استهلاك الطاقة، يتم استخدام مادة ماصة مدمجة: أساسية. يتم امتصاص كتلة الرطوبة عن طريق هلام السيليكا المتجدد بسهولة، والتجفيف العميق بواسطة الزيوليت.
مع التجديد الحراري، تشمل الدورة الكاملة الامتزازتسخين المادة المازة وامتزازها وتبريدها. رقم ضخمتحدد المراحل الكثافة المنخفضة وكثافة الطاقة العالية للعملية الامتزازولذلك فإن ما يسمى. محطات الدورة القصيرة، والتي تستغرق الدورة بأكملها عدة. دقائق. فيها، يتم توفير الغاز إلى الممتز تحت المعنى. الضغط، والذي يتم تحريره بعد ذلك ويحدث الامتزاز. العملية برمتها متساوية الحرارة تقريبًا (الانحراف عن درجة الحرارة المتساوية يحدث فقط عن طريق إطلاق الحرارة الامتزازوامتصاص الحرارة أثناء الامتزاز). مراحل الدورة: الامتزاز، إطلاق الضغط، الامتزاز، ارتفاع الضغط. ومن الأمثلة على ذلك المنشآت التي تستخدم الزيوليت لإنتاج الهواء الغني بالأكسجين.
في المنشآت ذات الطبقة المتحركة من الممتزات (في ما يسمى بفرط الامتصاص)، تنخفض هذه الأخيرة ببطء تحت تأثير الجاذبية ويتم إزالتها من الأسفل. أجزاء من الممتز وينتهي بما يسمى. الجسر الجوي، وهو عبارة عن أنبوب عمودي موازٍ للمادة المازة. عمود. ويتحرك تدفق الهواء عبر هذا الأنبوب من الأسفل إلى الأعلى، مما يؤدي إلى رفع الحبوب الممتزة إلى الأعلى. جزء من العمود. يدخل تدفق الغاز المعالج إلى الجزء الأوسط من الممتز ويتحرك للأعلى بتيار معاكس للممتز. في الجزء العلوي من العمود هناك مستمر الامتزاز، في الأسفل - تجديد الممتزات (انظر أيضًا تنقية الامتزاز).
في المنشآت التي تحتوي على طبقة ممتزة مميعة ("غلي")، فإن تدفق الغاز الذي يدخل إلى الممتز من الأسفل يؤدي إلى تعليق المادة المازة. وفي الوقت نفسه، تزداد بشكل حاد كفاءة نقل الكتلة بين الممتزات والغاز ومدة الامتزازوالامتزاز. هذه المنشآت لديها إنتاجية عالية. يتم إعاقة توزيعها على نطاق واسع بسبب المتطلبات العالية للفراء. قوة الحبوب الممتزة (القوة غير الكافية تسبب خسارة كبيرة في المادة المازة بسبب تآكلها وإزالتها من الجهاز).
أساسي متطلبات الممتزات: مكثفات عالية. القدرة، أي. يجب أن تكون أجسادًا متفرقة بإيقاع عالٍ. السطح أو مع حجم المسام الكبيرة. الكيمياء. يجب أن توفر طبيعة السطح فعالية الامتزازالبيانات الواردة في ظروف معينة؛ الكيمياء. والحرارية المتانة، والتجديد، وسهولة الوصول إليها. الأعلى. أصبحت الكربون المنشط، والجيلات الجافة لبعض الأكاسيد (هلام السيليكا، والمواد الهلامية المصنوعة من الألومنيوم، وما إلى ذلك)، والزيوليتات منتشرة على نطاق واسع؛ من تقنية الممتزات غير المسامية. الكربون (السخام) وSiO 2 المشتت للغاية (الهباء الجوي، "السخام الأبيض").
مجالات تطبيق تكنولوجيا الامتزاز
على المظهر الامتزازأسسها الكثيرون طرق تنقية الهواء من الشوائب الضارة (انظر. تنقية الغاز)،الماء (انظر معالجة المياه)،وكذلك شراب السكر لإنتاج السكر وعصائر الفاكهة والسوائل الأخرى في الطعام. صناعة زيوت التشحيم النفايات. تعد إزالة الرطوبة كشوائب ضارة من الغازات والسوائل باستخدام الممتزات الصلبة أحد الفروع المهمة للامتزاز. التقنيات (انظر أيضًا تجفيف الغاز).
على الممتزات. العمليات التي تعتمد على الفصل الدقيق لمخاليط المواد وعزل مكونات معينة من المخاليط المعقدة. ومن الأمثلة على ذلك فصل أيزومرات الألكان من أجل الحصول على الهيدروكربونات العادية لإنتاج المواد الخافضة للتوتر السطحي، وفصل الزيوت في إنتاج وقود المحركات. ل مخاليط الغازالممتزات. يتم استخدام طرق الفصل للحصول على الهواء المخصب بالأكسجين (حتى O 2 النقي تقريبًا) ؛ بصيغة الجمع في بعض الحالات، تتنافس هذه الأساليب بنجاح مع التصحيح (انظر. فصل الهواء).
مجال سريع التطور لتطبيق الممتزات. التقنية الطبية حيث تفيد في استخلاصها مواد مؤذيةمن الدم (طريقة امتصاص الدم)، إلخ. السوائل. تشكل المتطلبات العالية للعقم مهمة صعبة للغاية لاختيار الممتزات المناسبة. وتشمل هذه الكربون المنشط المعد خصيصًا.
أشعل.:بروناور س.، امتزاز الغازات والأبخرة، العابرة. من الإنجليزية، المجلد الأول، م، 1948؛ دي بوير الأول، الطبيعة الديناميكية للامتزاز، العابرة. من الإنجليزية، م.، 1962؛ الامتزاز والمسامية، أد. M. M. Dubinina [إلخ]، M.، 1976؛ كيلييف إن في، أساسيات تكنولوجيا الامتزاز، الطبعة الثانية، م، 1984؛ Young D.M., Crowell A.D.، الامتزاز الفيزيائي للغازات، L.، 1962. إم إم دوبينين، ف.ف. سيربينسكي.
اختر الحرف الأول في عنوان المقال:
الامتزاز يحدث في الواجهة. لذلك، فمن المعقول النظر في الوصف الديناميكي الحراري للظواهر السطحية حالة خاصةالديناميكا الحرارية للأنظمة غير المتجانسة.
أرز. 3.4. امتزاز جيبس: 1- نظام مقارنة ثنائي الطور، 2- نظام ثنائي الطور حقيقي مع منطقة غير موحدة
في الديناميكا الحرارية للأنظمة غير المتجانسة يتم استخدامه مبدأ الجمعوهو على النحو التالي: جميع الخصائص الشاملة لنظام غير متجانس تساوي مجموع الخصائص الشاملة المقابلة التي كانت ستمتلكها المراحل قبل أن تتلامس.دعونا نشير إلى المرحلتين بـ α و β (الشكل 4). ثم بالنسبة لنظام مثالي، بحيث تتزامن خصائص المراحل القريبة من الواجهة مع خصائصها المجمعة، فإن العلاقات التالية صالحة للطاقة الداخلية U، الحجم V، الكتلة (عدد الشامات) n، الإنتروبيا S بعد تحقيق التوازن في نظام غير متجانس:
U = U α + U β , V = V α + V β , n = n α + n β , S = S α + S β
وهذا يفترض أن درجة الحرارة والضغط في كلا المرحلتين هي نفسها.
بالنسبة للأنظمة غير المتجانسة الحقيقية، فإن المنطقة الانتقالية عند حدود المرحلتين تقدم مساهمة إضافية في الخصائص الشاملة للنظام. في حالة حدوث ظواهر سطحية، ينبغي للمرء أن يأخذ في الاعتبار الفرق بين الخصائص الشاملة لنظام غير متجانس حقيقي والخصائص الشاملة لنظام نموذجي تغيب فيه الظواهر السطحية. ويسمى هذا النظام بنظام المقارنة. يحتوي نظام المقارنة على نفس المعلمات المكثفة (T، P، C i ...) ونفس الحجم V مثل النظام الحقيقي (الشكل 4).
من وجهة نظر الديناميكا الحرارية، تُفهم قيمة الامتزاز G على أنها الكمية الزائدة من المادة n s، معبرًا عنها بالمول أو الجرام، والتي يمتلكها نظام غير متجانس حقيقي مقارنةً بالنظام المرجعي، المتعلق بمساحة السطح البيني أو بمساحة السطح من الممتز A. من المفترض أن نظام المقارنة له نفس المعلمات المكثفة (T، P، C i)، ونفس الحجم (V = V α + V β) مثل النظام الحقيقي (الشكل 4) .
Г = (n - n α - n β)/A = n s /A 3.11
يمكن كتابة الوظائف الديناميكية الحرارية الزائدة للمنطقة الانتقالية لنظام حقيقي (نشير إليها بالمؤشرات) كـ
U s = U - U α - U β , n s = n - n α - n β , S s = S - S α - S βإلخ.
دائمًا ما تعطي القياسات التجريبية للامتزاز الامتزاز على وجه التحديد كزيادة في أحد المكونات النظام الحقيقيمقارنة بنظام المقارنة المختار. على سبيل المثال، عند امتزاز الغاز على مادة ماصة صلبة أو عند امتزاز المكونات على مرحلة صلبة، للعثور على قيم الامتزاز، حدد التغير في التركيزات الأولية للمادة الممتزة بعد ملامسة المرحلتين α و β
ن أنا الصورة = V(C i o - C i)،
أين ج أنا س- التركيز الأولي للمكون الأول، ج ط– تركيز المكون i بعد تحقيق التوازن بين مراحل الاتصال. ويعتقد أن الحجم الخامسلم يتغير. ومع ذلك، فإن التركيز أناالمكون ج ط، التي تم الحصول عليها تجريبيا، يتم تحديدها في الحجم الخامس'أعلى واجهة الطور دون مراعاة حجم المنطقة غير المتجانسة للطبقة الانتقالية الخامس ألفافي الواجهة حيث يكون التركيز ج ط α. وبالتالي، ونظرًا لوجود منطقة غير منتظمة في نظام حقيقي، يمكن تمثيل الحجم الإجمالي للنظام على النحو التالي: V = V' + V α. كل الكمية أنا-المكون ج أنا سسيتم توزيعها بين هذين المجلدين:
V C i o = V’ C i + V α C i α ,
وعدد مولات المكون أنا، الممتز على الواجهة، سيكون مساوياً لـ
n i s = (V’C i + V α C i α) – (V’ + V α)C i = V α (C i α – C i) 3.12
أولئك. الامتزاز المحدد تجريبيًا هو زيادة المكون الأول في الحجم V α مقارنة بكمية هذا المكون في نفس الحجم بعيدًا عن واجهة الطور. ويسمى هذا النوع من الامتزاز "امتزاز جيبس". .
الخامس α ج أنا αمُسَمًّى المحتوى الكامل أنا-المكون الرابع في طبقة الامتزاز. في المنطقة بتركيزات منخفضة للغاية ج طفي حجم الخامس'تعديل الخامس α ج طويمكن إهمال المعادلة (3.2) ويمكن أخذ القيمة المقاسة في الاعتبار الخامس α ج أنا αالمحتوى الكامل أنا-المكون الرابع في طبقة الامتزاز، على سبيل المثال، أثناء امتزاز الغاز على مادة ماصة صلبة عند ضغوط منخفضة.
الصفحة الحالية: 6 (يحتوي الكتاب على 19 صفحة إجمالاً) [مقطع القراءة المتاح: 13 صفحة]
الخط:
100% +
34. طبيعة قوى الامتزاز
التفاعل بين الجزيئات الممتزة مع سطح المادة المازة أثناء ما يسمى. الامتزاز الجسدي يمكن أن يكون نتيجة لأسباب مختلفة. ومن ثم يمكن التعبير عن الإمكانات التي تحدد تفاعل جزيء واحد ممتز مع ذرة واحدة من مادة ماصة غير قطبية على النحو التالي:
θ = −سجل تجاري 6 +ر 12 ,
حيث r هي المسافة بين مراكز الجزيئات؛ ج - ثابت جذب التشتت؛ B هو الثابت الذي يميز طاقة القوى التنافرية.
ومن الواضح تمامًا أنه على المسافات البعيدة نسبيًا يجب أن تسود قوى الجذب، وعلى المسافات القريبة يجب أن تسود قوى التنافر. أيضا، على مسافات معينة، يجب أن تكون هذه القوى متساوية، والتي سوف تتوافق مع الحد الأدنى طاقة حرة. ولكن من المهم أن نلاحظ أنه أثناء عملية الامتزاز، تعمل قوى التشتت في وقت واحد بين كل جسيم غير قطبي.
وبما أن طاقة تفاعل الجزيئات يمكن أن تنخفض بسرعة مع المسافة، لتحديد إمكانات قوى الامتزاز، يكفي إجراء الجمع على أقرب ذرات المادة الممتزة. من المهم أنه أثناء امتزاز الجزيئات المعقدة غير القطبية، يمكن حساب الطاقة الكامنة تقريبًا كمجموع كل طاقات الامتزاز المحتملة لوحدات الجزيء.
إذا كانت المادة الممتزة تتكون من أيونات، فيمكن استكمال عمل قوى التشتت المعروفة بالفعل بعمل قوى الجذب الحثية لثنائيات الأقطاب التي يتم تحفيزها في جزيئات المادة المازة بواسطة المجال الكهربائي، والذي بدوره يكون تم إنشاؤها بواسطة أيونات الشبكة الممتزة.
مع مثل هذا التفاعل، يمكن أن تكون حصة القوى الحثية في تفاعل الامتزاز متناسبة مع قابلية استقطاب الجزيء الممتز ومربع شدة المجال على هذا السطح الممتز.
إذا حدث امتزاز الجزيئات القطبية من المادة المازة على مادة ماصة قطبية، فإن ثنائيات الأقطاب في هذه الحالة تستقطب ذرات المادة المازة، أي يبدو أنها تحفز لحظات كهربائية فيها. وبسبب هذا التأثير يضاف التفاعل الاستقرائي إلى تفاعل التشتت.
عادة ما يكون التفاعل الاستقرائي نفسه صغيرًا، ويمكن أن يصل إلى قيم كبيرة اعتمادًا على ثنائي القطب للجزيء الممتز وقابلية الاستقطاب للمادة المازة. إذا تم امتزاز الجزيئات على مادة ماصة تحتوي على أيونات أو ثنائيات أقطاب على السطح، فإن هذا ما يسمى. تفاعل الأيونات أو ثنائيات أقطاب المادة المازة مع المجال الكهروستاتيكي للمادة المازة نفسها.
في هذه الحالة، يمكن حتى توجيه جزيئات المادة المازة في مجال المادة المازة، ويحدث تفاعل كولوم الاتجاهي. ويحدث عادة أن طاقات التفاعلات الحثية والاتجاهية أقل من طاقة التفاعلات المشتتة، ولذلك فمن المقبول أن يتم تحديد طاقة الجذب بين الجزيئات بواسطة طاقة الجذب المشتت.
يمكن أيضًا أن يحدث الامتزاز بسبب تكوين رابطة هيدروجينية. يمكن أن يحدث رابط من هذا النوع أثناء الامتزاز على المواد الماصة التي تحتوي على مجموعات الهيدروكسيل من الجزيئات مثل الماء والكحول والأمونيا والأمونيا على السطح. عندما تتشكل رابطة هيدروجينية، يمكن أن تكون طاقة التفاعل بين المادة الممتزة والممتزة كبيرة جدًا، وتكون الحرارة المنبعثة أثناء هذا الامتزاز أكبر بكثير من حرارة امتزاز المواد المتشابهة في شكل وحجم الجزيئات ولكنها لا تشكل رابطة هيدروجينية.
من المهم أن نلاحظ أنه من خلال معرفة الوصف الديناميكي الحراري للطبقة السطحية عند السطح البيني الممتز، وبنيتها، وطبيعة أنواع القوى المختلفة، وديناميكيات العملية، يمكن للمرء المضي قدمًا في دراسة الامتزاز الأكثر تعقيدًا العمليات.
35. الامتزاز كتركيز تلقائي عند واجهة المواد التي تقلل التوتر السطحي
تنقسم المواد الخافضة للتوتر السطحي إلى مجموعتين كبيرتين: نشط وغير نشطمواد.
المواد الخافضة للتوتر السطحي قادرة على التراكم في الطبقة السطحية، ويحدث امتصاص إيجابي ز > 0.
يجب أن يكون لهذه الأنواع من المواد توتر سطحي، والذي بدوره يجب أن يكون أقل من التوتر السطحي للمذيب، وإلا فإن تراكم المادة في الطبقة السطحية سيكون غير مناسب، ويجب أن تكون ذوبانه منخفضة نسبيًا. مع ذوبان جيد بما فيه الكفاية، تميل جزيئات الفاعل بالسطح إلى الانتقال من السطح إلى أعماق المحلول. وبالتالي، سيتم دفع المواد الخافضة للتوتر السطحي بشكل تفضيلي من الجزء الأكبر من السائل إلى السطح.
ولكن مع تراكم المواد عند حدود المحلول في جزيئات هذه المواد والتي تتفاعل بشكل ضعيف مع بعضها البعض، فإن التفاعل بين الجزيئات في الطبقة السطحية سينخفض، وينخفض التوتر السطحي.
السطحيبالنسبة للطبقة المائية هناك أنواع كثيرة من المركبات العضوية، والأحماض الدهنية مع جذري هيدروكربوني كبير بما فيه الكفاية، وأملاح هذه الأحماض (الصابون)، وأحماض السلفونيك وأملاحها، وكذلك أنواع مختلفةالكحوليات والأمينات. ميزة مميزةتتميز معظم الجزيئات بثنائيتها: يتكون الجزيء من جزأين من مجموعة قطبية وجذر هيدروكربوني غير قطبي. يمكن للمجموعة القطبية التي تتمتع بعزم ثنائي القطب كبير وتكون عالية الترطيب أن تحدد مدى تقارب المادة الخافضة للتوتر السطحي للبيئة المائية. لكن الجذر الهيدروكربوني هو السبب الذي يقلل من ذوبان هذه المركبات.
المواد الخافضة للتوتر السطحي غير النشطة- تميل هذه الأنواع من المواد إلى ترك سطح السائل في حجمه، مما يؤدي إلى ما يسمى. الامتزاز السلبي ز < 0. Поверностно-инактивные вещества также обладают значительным поверхностным натяжением, значительно большим, чем натяжение у растворителя (иначе эти вещества способны самопроизвольно накапливаться в поверхностном слое), также обладают высокой растворимостью, что способствует их стремлению уйти с поверхности жидкости в объем. Взаимодействие между молекулами поверхностно-инактивного вещества и растворителя всегда больше, чем взаимодействие между самими молекулами растворителя, поэтому они и стремятся перейти в объем раствора. المواد غير النشطة السطحيةفيما يتعلق بالمياه هناك العديد من الشوارد غير العضوية: الأحماض والقلويات والأملاح. لا تحتوي جزيئات الفاعل بالسطح على جزء كاره للماء ويمكن أن تتحلل في الماء إلى أيونات عالية الترطيب.
أمثلةالمواد الخافضة للتوتر السطحي هي أيضًا بعض المركبات العضوية التي يكون فيها الجزء غير القطبي من الجزيء غائبًا أو صغيرًا جدًا. وتشمل هذه المواد الأحماض الفورميك والأمينية.
في المذيبات غير المائية، يمكن للإلكتروليتات غير العضوية أيضًا أن تزيد من التوتر السطحي، اعتمادًا على المذيب.
على سبيل المثال، عندما يتم إدخال يوديد الصوديوم في الميثانول، يزداد التوتر السطحي بشكل كبير؛ بالنسبة للإيثانول، يكون التوتر السطحي أكبر مرتين تقريبًا. يمكن أن يعتمد النشاط السطحي للمواد ليس فقط على طبيعة المادة، ولكن أيضًا على خصائص المذيب. إذا كان لأي مذيب توتر سطحي مرتفع، فيمكن لذلك المذاب أن يُظهر نشاطًا سطحيًا كبيرًا.
36. نظريات الامتزاز
دعونا نفكر في نظريات الامتزاز الأكثر شيوعًا التي تصف أنواعًا معينة من الامتزاز عند واجهة "الغاز الصلب" أو "المحلول الصلب".
نظرية الامتزاز الأحادي الجزيئي بقلم آي لانجميور.
1. الامتزاز موضعي ويحدث بسبب قوى قريبة من القوى الكيميائية.
2. يحدث الامتزاز فقط في المراكز النشطة - نتوءات أو انخفاضات على سطح المادة المازة، تتميز بوجود تكافؤ حر. وتعتبر المراكز النشطة مستقلة ومتماثلة.
3. كل مركز نشط قادر على التفاعل مع جزيء ممتز واحد فقط؛ يمكن أن تتشكل طبقة واحدة فقط من الجزيئات الممتزة على السطح.
4. عملية الامتزاز قابلة للعكس والتوازن. يتم الاحتفاظ بالجزيء الممتز بواسطة الموقع النشط لبعض الوقت، وبعد ذلك يتم امتصاصه؛ بعد مرور بعض الوقت، يتم إنشاء التوازن الديناميكي.
أقصى قيمة امتزاز ممكنة زيتم تحقيق o بشرط أن تكون جميع المراكز النشطة مشغولة بجزيئات ممتزة. معادلة الأيزوثرم لامتزاز أحادي الجزيء تتعلق بحجم الامتزاز زمع تركيز كثف مع، له النموذج:
أين ب- قيمة ثابتة لزوج "ممتز - ممتز" معين (نسبة ثوابت معدل الامتزاز والامتزاز)، تساوي عدديًا تركيز المادة الممتزة التي يشغلها نصف المراكز النشطة.

يظهر الرسم البياني لامتزاز لانجميور في الشكل 2. الثابت بتحديد بيانيا عن طريق رسم مماس لأيسوثرم الامتزاز عند هذه النقطة مع= 0. عند وصف عملية امتزاز الغاز في المعادلة، يمكن استبدال التركيز بقيمة متناسبة للضغط الجزئي. نظرية الامتزاز أحادي الجزيء آي لانجموير ينطبق على وصف عمليات امتزاز الغازات والمواد المذابة عند ضغوط منخفضة (تركيزات) من المادة الممتزة.
نظرية بولياني في الامتزاز متعدد الجزيئاتيصف متساوي حرارة الامتزاز على شكل حرف s، والذي يشير شكله إلى التفاعل المحتمل للجزيئات الممتزة مع المادة الممتزة.
1. يحدث الامتزاز بسبب القوى الفيزيائية.
2. سطح المادة المازة متجانس، ولا توجد مراكز نشطة. تشكل قوى الامتزاز مجال قوة مستمرًا بالقرب من سطح المادة المازة.
3. تعمل قوى الامتزاز على مسافة أكبر من حجم الجزيء الممتز، أي أن هناك حجم امتزاز معين على سطح المادة المازة، والذي يمتلئ بجزيئات الامتزاز أثناء الامتزاز.
4. لا يعتمد جذب جزيء الممتز على سطح المادة المازة على وجود جزيئات أخرى في حجم الامتزاز، ونتيجة لذلك يكون الامتزاز متعدد الجزيئات ممكنًا.
5. قوى الامتزاز لا تعتمد على درجة الحرارة، وبالتالي فإن حجم الامتزاز لا يتغير مع تغير درجة الحرارة.
معادلة فروندليتش.سطح المادة الممتزة غير متجانس، ويحدث تفاعل بين الجزيئات الممتزة، والمراكز النشطة ليست مستقلة تمامًا عن بعضها البعض. جي فروندليتش اقترح أن عدد مولات الغاز الممتز أو المادة المذابة لكل وحدة كتلة من المادة المازة (ما يسمى بالامتزاز النوعي) X/م) ، يجب أن يكون متناسبًا مع ضغط التوازن (للغاز) أو تركيز التوازن (للمواد الممتزة من المحلول) للمادة المازة، مرفوعًا إلى قوة معينة، والتي تكون دائمًا أقل من الوحدة:
س / م = أ.بن؛ س / م = مكيف الهواءن.
الدعاة نوعامل التناسب أيتم تحديدها تجريبيا.
37. الديناميكا الحرارية لعملية الامتزاز. معادلة الامتزاز جيبس
لدراسة ظاهرة الامتزاز عند واجهة "المحلول-الغاز" لا بد من إقامة علاقة بين فائض المادة الممتزة في الطبقة الموجودة على السطح ( ز) ، تركيز الفاعل بالسطح في المحلول ( مع) والتوتر السطحي ( σ ) عند حدود مرحلة "الحل - الغاز". من الأفضل النظر في الظواهر من وجهة نظر ديناميكية حرارية وربط امتزاز المادة المذابة بالتغير في الطاقة الحرة للسطح أو التوتر السطحي لها. تم إجراء هذا الاتصال دبليو جيبسالخامس 1876، والذي كان اسمه "معادلة الامتزاز جيبس":
ز = – مع / ر.تس دσ/العاصمة.
لا يزال بإمكانك أن تتخيل معادلة جيبس,على أساس الديناميكا الحرارية، وذلك باستخدام إمكانات متساوي الضغط زالإمكانات الكيميائية μ 1و μ2,واستخدام أيضا ن 1 و ن 2 عدد مولات المكونات. بعد تحليلها مع الأخذ بعين الاعتبار الإنتروبيا س، مقدار الخامسوالضغط ص، يمكننا كتابة المعادلة التالية:
دي جي=– المعاملة الخاصة والتفضيلية+فدب+σds+ μ 1 د 1 + μ 2 د 2.
دعونا نساويها بالصفر، ومع الأخذ بعين الاعتبار ثبات درجة الحرارة والضغط، يتم تبسيطها إلى معادلة بالشكل:
SD σ + ن 1 د μ 1 + ن 2 د μ 1 = 0.
مع الأخذ في الاعتبار حقيقة أنه بالنسبة للحلول المخففة يتم التعبير عن الإمكانات الكيميائية للمكون الثاني على النحو التالي:
μ 2 = μ 2 0 +ر.ت ln ج,
وبما أن درجة الحرارة ثابتة
ديميكرو 2 =رتدنك،
استبدال هذه المعادلة في
![]()
نحصل على معادلة امتزاز جيبس المطلوبة. استنادا إلى المعادلة، يمكن ملاحظة أنه إذا كان التوتر السطحي σ يزداد مع التركيز مع، فإن تركيز المذاب على الطبقة السطحية يكون أقل منه في الجزء الأكبر من المحلول (ما يسمى بالامتزاز السلبي)، وإذا كان التوتر السطحي σ يتناقص مع زيادة التركيز مع، فإن التركيز في الطبقة يكون أكبر منه في الحجم (الامتزاز الإيجابي)، وأخيرا، إذا σ لا يعتمد على معفإن تركيز المادة في الطبقة الموجودة على السطح وفي الحجم يكون هو نفسه. تم اشتقاق معادلة جيبس باستخدام الديناميكا الحرارية. ومن الناحية العملية يصعب التحقق من هذه المعادلة، وذلك بسبب صعوبة تحديد تركيز المادة المذابة في سطح الطبقة. طريقة مجربة ب. ماكبن ووجد أنه تم قطع طبقة رقيقة جدًا من السائل عن سطح المحلول باستخدام الجهاز. وأظهر التحديد الإضافي لجميع معاملات معادلة جيبس أن قيم الامتزاز الموجودة تجريبيا، ضمن الخطأ التجريبي، تزامنت مع القيم المحسوبة باستخدام معادلة جيبس. نظرا لتجانس ونعومة سطح أي سائل، فإن المفاهيم المعتادة للمراكز النشطة غير قابلة للتطبيق تماما عند دراسة الامتزاز على سطحه. عند درجة حرارة حرجة، يختفي الفرق بين المراحل المجاورة، ويصبح التوتر السطحي، كقاعدة عامة، مساوياً للصفر. لامتصاص الغازات والأبخرة تطبيق عملي واسع لدرجة أنه في الأدبيات، وخاصة في الأدبيات التقنية، يمكن للمرء أن يجد هذا المفهوم، والذي يتم تطبيقه فقط فيما يتعلق بالعمليات التي تتم على سطح المواد الصلبة.
هذا المفهوم، مثل معظم قوانين الامتزاز العامة، مثل معادلة جيبس، ينطبق على جميع حدود الطور. باستخدام معادلة جيبس وجميع الأحكام التي تتبعها، بعد تحديد قيمة Γ، من الممكن بناء متساوي درجة حرارة الامتزاز.
38. مميزات الامتزاز على المواد الدقيقة المسامية. نظرية بولياني المحتملة. إمكانية الامتزاز
نظرية بوليانييأخذ في الاعتبار الامتزاز المادي غير الموضعي، والذي يحدث مباشرة بسبب قوى فان دير فالس بين الممتز والممتص (وهذا يمكن اعتباره الموضع الأول). الموقف الثاني لهذه النظرية هو فكرة وجود مجال قوة (أو جهد) للمادة الممتزة يمتد على مسافة كبيرة من السطح؛ طبقة الامتزاز التي تظهر في هذا المجال هي طبقة متعددة الجزيئات. إذا أخذنا في الاعتبار امتصاص الغازات، فإن كثافة هذه الطبقة تتناقص على طول مستوى طبيعي معين من السطح. إذا أخذنا في الاعتبار امتصاص البخار، فسيتم تشكيل طبقة سائلة بسماكة معينة على السطح. يعتبر المجال في نظرية بولياني عبارة عن سلسلة من السطوح متساوية الجهد، كل سطح يقابل قيمة جهد معينة ε وسيكون كل سطح لاحق أصغر من السطح السابق. كل سطح من هذا القبيل في الفضاء يقطع طبقات من حجم معين، يسمى السادس. مهمة نظرية بولياني هي إيجاد الانتقال من الإحداثيات المعتادة للأيسوثرم ( س، ص) إلى معلمات الحقل ε طو السادس، مع مزيد من إنشاء العلاقة بين هذه المعلمات الأساسية. الجزء الأول من المشكلة، الذي طرحه بولياني، معقد للغاية، وفي كثير من الحالات لا يمكن أن يكون له حلول محددة، ولكن بالنسبة لحالة امتزاز البخار، يتم حل هذا الجزء من المشكلة في تقدير تقريبي أولي بكل بساطة. بالنسبة لطبقة الامتزاز السائل، فإن الجزء المملوء من الحجم سيكون مساويًا لـ:
ت أنا = س(م/د),
أين د– كثافة المادة في الحالة السائلة .
في نظريته، يقدم M. Polyany حكما آخر حول غياب ما يسمى. الفحص الميداني أثناء الامتزاز، القيمة ε في هذه النظرية، الفضاء هو قيمة ثابتة (شيء مثل إمكانات الجاذبية) بغض النظر عما إذا كانت بعض الجزيئات الممتزة موجودة بين نقطة معينة وسطح صلب أو ما إذا كان كل الفضاء حرًا. يقدم بولياني هذا المفهوم إمكانات الامتزاز ε والذي يمثل العمل متساوي الحرارة لضغط البخار عند نقله من ضغط التوازن رفي الطور السائب بعيدًا عن السطح إلى منطقة الطبقة السطحية ذات ضغط البخار المشبع ص 0عندها سيبدو التعبير لتحديد الإمكانات كما يلي:
ε = ر.ت ln ر 0 / ر.
باستخدام هذه المعادلة، يمكنك الانتقال من الإحداثيات x، p إلى الإحداثيات ε و الخامسوالحصول على منحنى يسمى "المميزة". اكتشف بولياني في تجاربه أن مثل هذه المنحنيات، التي تم إنشاؤها من البيانات التجريبية لتساوي الحرارة التي تم الحصول عليها، لها الخاصية التالية: أنها ثابتة بالنسبة إلى T، أو بمعنى آخر، يمكن لجميع المنحنيات من هذا النوع أن تتناسب مع منحنى واحد ε −ε .
قبل M. Polyany هذا الموقف باعتباره مسلمة، أي:
الخاصية المحددة لبولياني ضخمة أهمية عمليةيمكن بناء عائلة من متساوي الحرارة من متساوي حرارة الامتزاز التجريبي.
لا تقدم نظرية بولاني تعبيرًا تحليليًا عن الأيسوثرم أو دالة الحجم المحتمل، ولكنها تسمح للشخص بحساب الإحداثيات لأي درجة حرارة معينة إذا كان الأيسوثرم واحدًا على الأقل معروفًا. هذه النتيجة مهمة جدا ل الحسابات التكنولوجيةلأنه بالنسبة للغازات المتشابهة على نفس المادة المازة فإن منحنيات الامتزاز قد تكون قريبة من بعضها البعض ويمكن دمجها في كثير من الحالات.
39. منحنى الامتزاز المميز. ثبات درجة الحرارة وتقارب المنحنيات المميزة
يمكن أن يكون مجال القوة الذي ينشأ على سطح المادة المازة مشابهًا في كثير من النواحي لمجال الجاذبية. في مجال الامتزاز، يمكن للمرء أن يتخيل الأسطح المحتملة، أي الأسطح التي تتميز بنفس إمكانات الامتزاز. تحت مفهوم إمكانية الامتزاز θ يجب أن يُفهم على أنه ليس أكثر من الشغل المبذول ضد قوى الامتزاز عند نقل 1 مول من المادة المازة من نقطة معينة في الحقل إلى مرحلة غازية معينة. سيكون الحد الأقصى لإمكانية الامتزاز موجودًا عند حدود "حجم الامتزاز - الامتزاز". ولكن عند حدود "الحجم - الطور الغازي" (هذا هو المكان الذي ينتهي فيه عمل قوى الامتزاز)، يجب أن تكون إمكانات الامتزاز مساوية للصفر. يمكن تمثيل التغير في احتمالية الامتزاز مع التغير في حجم الامتزاز في شكل منحنيات. وقد تم ذلك لأول مرة بواسطة م. بولياني. لا تعتمد هذه الأنواع من المنحنيات على درجة الحرارة ويمكن أن تكون مميزة لكل مادة ماصة محددة؛ وتسمى هذه الأنواع من المنحنيات عادةً منحنيات الامتزاز المميزة. تفترض نظرية الامتزاز متعدد الجزيئات أن معادلة الحالة الغازية قابلة للتطبيق على حجم الامتزاز. وبالتالي، فإن متساوي الحرارة الذي يميز اعتماد كثافة المادة المازة على الحجم في درجات حرارة مختلفة يشبه متساوي الحرارة في اعتماد الضغط على الحجم. عند درجات الحرارة المنخفضة، يمكن لقوى الامتزاز السطحي أن تتسبب في تكثيف البخار إلى سائل ذي كثافة معينة. عند درجات حرارة أقل من الحرجة، أثناء التكثيف، سيتم ملء حجم الامتزاز بالكامل بالسائل. في هذه الحالة، سيكون منحنى الامتزاز موازيًا تقريبًا لمحور الإحداثي السيني، والذي يرتبط بانضغاطية السائل المنخفضة. ثم ينخفض منحنى الامتزاز عند حدود "الحجم - الطور الغازي" بشكل حاد، وبالتالي تصل كثافة المادة المازة إلى كثافة معينة من الطور الغازي. عند درجات حرارة أعلى من درجة الحرارة الحرجة، يمكن أن تتصرف المادة الممتصة مثل الغاز المثالي، وسيتم التعبير عن الرسم البياني على شكل متساوي الحرارة للغاز المثالي، بشرط أن الكهروضوئية = ر.ت. في مثل هذه الظروف، سيكون للغاز الممتز أقصى كثافة على سطح المادة المازة وكثافة دنيا في المنطقة المجاورة مباشرة للطور الغازي. علاوة على ذلك، في هذه الحالة، من المهم ملاحظة أن كثافة المادة المازة في طبقة الامتزاز لا تصل إلى كثافة السائل نفسه. وإذا كانت درجة الحرارة قريبة جدًا من الدرجة الحرجة، فسيتم التعبير عن اعتماد الكثافة على الحجم من خلال منحنى قريب في المظهر من الأيسوثرم، الذي تم وصفه معادلة فان دير فالس.في هذه الحالة، جزء من المادة الممتزة سيكون في الحجم الممتز في الحالة السائلة، وجزء من المادة الممتزة سيكون في الحالة الغازية. ثم سينخفض المنحنى بشكل حاد في القسم الذي يتوافق مع التحول من السائل إلى الغاز. إذا قمت بإنشاء منحنى مميز من تساوي درجة حرارة الامتزاز التجريبي لأحد المواد الممتزة، ومعرفة معاملات التقارب المقابلة لبعض المواد الممتزة الأخرى، فيمكنك العثور على تساوي درجة حرارة الامتزاز وبناءه لمادة امتزاز أخرى. تتيح نظرية احتمالات الامتزاز حساب متساوي حرارة الامتزاز المختلفة لأبخرة مختلفة على نفس المادة المازة، باستخدام منحنى مميز يتم الحصول عليه من متساوي حرارة الامتزاز لبخار واحد، حيث أن نسبة جهد الامتزاز لا تعتمد على أحجام الامتزاز .
التقارب(من اللاتينية affinis - "ذات الصلة") - كروماتوجرافيا التقارب. تعتمد طريقة تنقية وفصل البروتينات على تفاعلها الانتقائي مع رابطة تساهمية مرتبطة بحامل خامل (تحليل كروماتوجرافي متقارب). يعد قياس ألفة مادة سامة لمستقبل ما بمثابة دراسة تجريبية للعلاقة بين كمية المادة المضافة إلى وسط الحضانة وكمية مركب مستقبل المادة السامة المتكون نتيجة للتفاعل.
الديناميكا الحرارية لعمليات الامتزاز.
| اسم المعلمة | معنى |
| موضوع المقال: | الديناميكا الحرارية لعمليات الامتزاز. |
| الموضوع (الفئة الموضوعية) | تعليم |
التعاريف الأساسية وطرق تصنيف عمليات الامتزاز.
يشير الامتزاز إلى الظواهر التي تحدث بسبب الانخفاض التلقائي في الطاقة السطحية.
الامتزاز- عملية إعادة التوزيع التلقائي العكسي أو غير القابل للانعكاس لمكونات النظام غير المتجانس بين الطبقة السطحية وحجم الطور المتجانس.
في الأنظمة متعددة المكونات، يفضل نقل المكون الذي يقلل بقوة أكبر من التوتر السطحي إلى الطبقة السطحية. في الأنظمة ذات المكون الواحد، أثناء تكوين الطبقة السطحية، يحدث تغيير في بنيتها (اتجاه معين للذرات والجزيئات، الاستقطاب)، يسمى الامتزاز التلقائي.
تسمى المرحلة الأكثر كثافة التي يتم فيها توطين تفاعلات الامتزاز الممتزات. يتم تحديد المادة المعاد توزيعها بين حجم الطور المتجانس والطبقة السطحية بالمصطلح ʼʼ كثفʼʼ.
في بعض الحالات، تكون عملية الامتزاز قابلة للعكس. في هذه الحالة، في ظل ظروف معينة، يمكن لجزء من الجزيئات الممتزة نتيجة للظواهر الحركية الجزيئية أن ينتقل من الطبقة السطحية إلى المرحلة السائبة. وتسمى عملية الامتزاز العكسية الامتزاز.
طرق تصنيف عمليات الامتزاز.
تصنيف عمليات الامتزاز حسب حالة تجميع المراحل المتفاعلة.مع الأخذ في الاعتبار الاعتماد على الحالة الإجمالية للمراحل المجاورة، يتم تمييز الأنواع التالية من عمليات الامتزاز:
امتزاز الغازات على الممتزات الصلبة.
امتزاز المواد المذابة في السطوح البينية "الصلبة السائلة" و"السائلة السائلة"؛
امتزاز المواد الخافضة للتوتر السطحي في واجهة الغاز السائل.
تصنيف عمليات الامتزاز حسب آلية التفاعل بين المادة الممتزة والمادة الممتزة.يمكن اعتبار الامتزاز بمثابة تفاعل الجزيئات الممتزة مع المراكز النشطة للمادة المازة. حسب آلية تفاعلها تنقسم أنواع الامتصاص التالية:
1) الامتزاز الجسدي (الجزيئي).– يتم التفاعل بين جزيئات المادة الممتزة والممتزة بسبب قوى فان دير فالس والروابط الهيدروجينية (بدون التفاعلات الكيميائية);
2) الامتزاز الكيميائي (الامتصاص الكيميائي)– يحدث ارتباط الجزيئات الممتزة بالمراكز النشطة للمادة المازة نتيجة للتفاعلات الكيميائية بأنواعها المختلفة (باستثناء تفاعلات التبادل الأيوني)؛
3) الامتزاز بالتبادل الأيوني (التبادل الأيوني) – إعادة توزيع المادة الممتزة بين المحلول والطور الصلب (المبادل الأيوني) وفق آلية تفاعلات التبادل الأيوني.
لوصف عمليات الامتزاز كميا، يتم استخدام كميتين.
1) الامتزاز المطلق- الكمية (مول) أو الكتلة (كجم) من المادة الممتزة لكل وحدة مساحة سطحية أو كتلة المادة المازة. التعيين - أ؛ البعد: مول/م2، مول/كجم، كجم/م2، كجم/kᴦ.
2) امتصاص جيبس (الزائد).- زيادة المادة الممتزة في الطبقة السطحية بسماكة معينة مقارنة بكميتها في حجم الطور المتجانس، لكل وحدة مساحة سطحية أو كتلة المادة المازة. التعيين - ز؛ البعد: مول/م2، مول/كᴦ.
يمكن توضيح العلاقة بين الامتزاز المطلق والزائد باستخدام المعادلة:
Г = А – с*h (3.1)
حيث c هو تركيز التوازن للمادة في حجم الطور، مول/م3؛
h هو سمك الطبقة السطحية، ويفترض تقليديًا أن يكون 10 -9 م.
في الأنظمة غير المتجانسة متعددة المكونات، عندما يتم إعادة توزيع مكون أو آخر بين حجم الطور المتجانس والطبقة السطحية، تكون معادلة الطاقة الداخلية الزائدة للسطح صالحة:
U = T * S + s * s + Sm i * n i (3.2)
بتقليل جميع شروط المعادلة إلى وحدة مساحة سطح الطور البيني، نحصل على:
U s = T * S s + s + Sm i * Г i (3.3)
حيث Г i = n i / s هو فائض المكون i في الطبقة السطحية، أي امتصاص جيبس.
بالنسبة لنظام مكون واحد، فإن المعادلة (3.3) سوف تأخذ الشكل:
ز ق = ق + م * ز (3.4)
حيث G s = U s - T * S s – طاقة جيبس للسطح أو عمل إنشاء وحدة مساحة السطح؛
م * ز – ضغط المادة الممتزة في الطبقة السطحية.
بناءً على المعادلة (3.4) يمكن أن نستنتج أنه أثناء الامتزاز، يتكون عمل إنشاء سطح الطور البيني من عمل تكوين السطح (كسر الروابط المتماسكة في حجم الطور الممتص) وضغط المادة في الطبقة السطحية.
في حالة التوازن الديناميكي بين المادة الممتزة والمادة الممتزة، فإن التغير في طاقة جيبس للنظام غير المتجانس ΔG = 0، يتم وصف الديناميكا الحرارية لعملية الامتزاز بالمعادلة التي تسمى معادلة جيبس الأساسية للامتزاز:
Ds = SГ i * dm i (3.5)
هذه المعادلة عالمية، فهي صالحة لجميع أنواع عمليات الامتزاز
حالات خاصة لمعادلة امتزاز جيبس.
1) الامتزاز من المحاليل.
بالنسبة للإمكانات الكيميائية للمكون التاسع للنظام أثناء الامتزاز عند الواجهات البينية "السائل - الممتز الصلب" و"السائل - الغاز"، فإن المعادلات التالية صالحة:
م i = م i 0 + R*T*ln a i (3.6)
dm i = R*T* d ln a i (3.7)
حيث m i 0 هي الإمكانات الكيميائية للمكون i في النظام عند الشروط القياسية;
a i هو نشاط المكون i في النظام في ظل الظروف القياسية.
وبناء على ذلك فإن معادلة الامتزاز جيبس تأخذ الشكل التالي:
Г i = - a i / R*T * (ds / da i) (3.8)
بالنسبة لمحاليل غير الإلكتروليتات نأخذ a i = c i، ثم:
Г أنا = - с / R*T * (دس / دس) (3.9)
لمحاليل المنحل بالكهرباء:
Г i = - с ± n / R*T * (ds / dс ± n) (3.10)
حيث с ± هو متوسط التركيز الأيوني للمحلول؛
n هو معامل العناصر المتكافئة.
2) امتزاز المواد من الطور الغازي.
وفقًا لمعادلة مندليف-كلابيرون:
ص = س * ر*ت (3.11)
وفي هذا الصدد، تتم كتابة معادلة جيبس لامتصاص الغازات على الممتزات الصلبة بالشكل التالي:
Г i = - Р / R*T * (ds / dР) (3.12)
من الناحية العملية، تسمح معادلة الامتزاز جيبس، بناءً على قياسات التوتر السطحي عند قيم مختلفة لتركيز السائل أو ضغط الغاز المتوازن، بحساب كمية امتزاز المواد في الطبقة البينية التي يتم تحديد التوتر السطحي لها.
الديناميكا الحرارية لعمليات الامتزاز. - المفهوم والأنواع. تصنيف وميزات فئة "الديناميكا الحرارية لعمليات الامتزاز". 2017، 2018.
في حالة التفاعل بين ذرتين:
U - طاقة التفاعل؛
U = U قبل. + ش العودة
 - معادلة لينارد-جونز
، ج، ب، م = ثابت
- معادلة لينارد-جونز
، ج، ب، م = ثابت
في حالات تفاعل الذرات مع سطح صلب، من الضروري تلخيص كل التفاعلات.
س - المسافة إلى السطح
ص - نصف قطر عمل القوى الجذابة
العنف المنزلي - الحجم
ن – عدد جزيئات السطح
إعلانات يو. – طاقة التفاعل الامتزاز



وفي حالة الامتزاز تزداد الجاذبية. وفي حالة التفاعل غير القطبي وغير القطبي، يتمركز الامتزاز في الغالب في فترات الاستراحة.
التفاعل الكهروستاتيكي.
الممتز القطبي – الممتز غير القطبي
الممتزات غير القطبية – الممتزات القطبية
الممتزات القطبية – الممتزات القطبية.
م  يتم تمثيل الجزيء الممتز على أنه ثنائي القطب، ويتم تمثيل الممتز كموصل حيث يقوم الجزيء الممتز بتحفيز مرآة ثنائية القطب بشكل متماثل فيما يتعلق بالمرآة المعطاة.
يتم تمثيل الجزيء الممتز على أنه ثنائي القطب، ويتم تمثيل الممتز كموصل حيث يقوم الجزيء الممتز بتحفيز مرآة ثنائية القطب بشكل متماثل فيما يتعلق بالمرآة المعطاة.
X - المسافة إلى المنتصف
عند التفاعل، تنشأ الإمكانات:
 ,
,
 - عزم ثنائي الاقطاب.
- عزم ثنائي الاقطاب.
تميل الإمكانات إلى الحصول على القيمة القصوى، أي. تميل ثنائيات القطب إلى توجيه نفسها بشكل عمودي على السطح.
وبما أن الزيادة في درجة الحرارة تشجع نمو الحركة البراونية، فإنها تؤدي إلى تثبيط عملية الامتزاز.
في حالة التفاعل الكهروستاتيكي، يتم توطين الممتزات في الغالب على النتوءات.
معادلة الامتزاز الأساسية.
وفي حالة الامتزاز، تحدث إعادة توزيع للمكون، مما يعني تغير الإمكانات الكيميائية. يمكن اعتبار عملية الامتزاز بمثابة انتقال الطاقة السطحية إلى طاقة كيميائية.
حجم الطبقة = 0، ثم المعادلة المعممة لقانوني الديناميكا الحرارية I و II:
T = ثابت؛ (1) = (2) => 

لنظام مكون من مكونين:
,
 ,
,
 =>
=>
=>
 - معادلة الامتزاز جيبس
.
- معادلة الامتزاز جيبس
.
لحالة الامتزاز التلفزيوني. الجسم - الغاز : , 
 ,
,

 - متساوي الحرارة
- متساوي الحرارة
 - إيزوبار
- إيزوبار
 - إيزوبيكنال
- إيزوبيكنال
 - إيزوستير
- إيزوستير
الأيسوثرم، الأيزوبيكني، الإيزوستير ترتبط ببعضها البعض.
لأن وظيفة الامتزاز 



هنري ايزوثرم لانجميور ايزوثرم



الديناميكا الحرارية. الامتزاز.
بالنسبة للمادة المكثفة:
 ,
,
 ,
,
 - التغير المتكامل في طاقة جيبس
.
- التغير المتكامل في طاقة جيبس
.

P - الضغط على سطح منحني، Р S - الضغط على سطح مستو
 - إمكانية الامتزاز
- إمكانية الامتزاز
التغيير التفاضلي في الإنترابيا 
 , Г = ثابت
, Г = ثابت
- تغير الانتروبيا التفاضلية
- المحتوى الحراري التفاضلي للامتصاص
 - حرارة الامتزاز متساوية
- حرارة الامتزاز متساوية
 - حرارة التكثيف
- حرارة التكثيف
 - صافي حرارة الامتزاز
- صافي حرارة الامتزاز

 ,
,




Qa - الحرارة المتكاملة للامتزاز، 
قرا – صافي الحرارة المتكاملة للامتزاز،

معادلة هنري
إن دراسة الامتزاز معقدة بسبب عدم تجانس السطح، لذلك يتم الحصول على أبسط القوانين للأسطح المتجانسة.
دعونا ننظر في تفاعل الغازات مع سطح صلب، عندما ينتقل الغاز من حالة التوازن في الحجم إلى حالة التوازن على السطح. هذه الحالة مشابهة لتوازن الغازات في مجال الجاذبية.
 ,
,
 ,
=>
,
=> -معادلة هنري
-معادلة هنري
 - معامل التوزيع
- معامل التوزيع
أثناء عملية الامتزاز، يحدث تغيير في الإمكانات الكيميائية.
بالنسبة للمرحلة السائبة: 
بالنسبة للغاز على السطح: 
في حالة توازن  ، أي.
، أي.

في معادلة هنري لا يعتمد الثابت على التركيز
معادلة هنري صالحة في منطقة الضغوط المنخفضة والتركيزات. مع زيادة التركيز، من الممكن حدوث نوعين من الانحرافات عن قانون هنري:
1 – الانحرافات الإيجابية، D النقصان، A النقصان
2 – الانحرافات السلبية، د – الزيادات، أ – الزيادات.
يتم تحديد نوع الانحراف من خلال غلبة نوع أو آخر من تفاعل الممتزات.
مع تفاعل لاصق قوي، تزيد معاملات النشاط - وهو انحراف إيجابي. وفي حالة التفاعلات المتماسكة لوحظت انحرافات سلبية.
الامتزاز الأحادي الجزيئي.
لانجميور متساوي الحرارة.
تم الحصول على أبسط الأنماط في نظرية هنري. اقترح لانجموير نظرية تعتبر بموجبها الامتزاز بمثابة تفاعل شبه كيميائي. حيث:
السطح متجانس بقوة.
الامتزاز موضعي، حيث يتفاعل كل مركز امتزاز مع جزيء واحد ممتز.
لا تتفاعل الجزيئات الممتزة مع بعضها البعض.
امتزاز أحادي الطبقة.

 - سطح،
- سطح،  - كثف،
- كثف،  - مجمع الامتزاز.
- مجمع الامتزاز.
 ثم تركيز مواقع الامتزاز:
ثم تركيز مواقع الامتزاز:  ,
, - الحد من الامتزاز.
- الحد من الامتزاز.
 ، فإن ثابت التفاعل هو:
، فإن ثابت التفاعل هو: 

 - معادلة لانجميور.
- معادلة لانجميور.
اعتماد الامتزاز على التركيز
1 )
)
 ,
,

2) منطقة التركيزات العالية
 - الحد من الامتزاز، وتشكيل طبقة أحادية الجزيئية
- الحد من الامتزاز، وتشكيل طبقة أحادية الجزيئية
لطاقة جيبس: .
g هو عامل الانتروبيا.
في حالة تساوي حرارة هنري، تميز طاقة جيبس انتقال المادة الممتزة من الحالة القياسية في الكتلة إلى الحالة القياسية على السطح. في حالة ايزوثيرم لانجميور  يميز درجة التقارب بين الممتزات وكثف.
يميز درجة التقارب بين الممتزات وكثف.
 وجدت من فان هوف إيزوبار.
وجدت من فان هوف إيزوبار.

 ، ثم
، ثم  ، من هنا
، من هنا  .
.

 - درجة ملء السطح.
- درجة ملء السطح.




 - عدد المقاعد المجانية،
- عدد المقاعد المجانية،  - عدد الأماكن المشغولة.
- عدد الأماكن المشغولة.
 ,
,

أولئك. وفي المنطقة ذات التركيزات العالية، يتناسب عدد المواقع الحرة عكسيا مع كمية المادة الممتزة.
امتزاز خليط من الغازات على سطح متجانس.
وفي هذه الحالة تعتبر عملية الامتزاز بمثابة تفاعلين متوازيين.
 (1)
(1)

 (2)
(2)


امتزاز خليط من الغازات على سطح غير منتظم.
في حالة السطح غير الموحد، لا يمكن للمرء أن يقتصر على الحشوات المتوسطة.
نتيجة للمنافسة، من الممكن توطين الممتزات المختلفة في مناطق ذات أنواع مختلفة.
في هذه الحالة العلاقة  .
.
 ,
,
 - ضغط البخار المشبع للمادة الممتزة.
- ضغط البخار المشبع للمادة الممتزة.
 ,
,
 - حرارة الامتزاز.
- حرارة الامتزاز.
"+" - الاعتماد التعاطفي، "-" - الاعتماد المضاد، "N" - لا يوجد ارتباط.
"+" - تتم عملية الامتزاز بنفس الآلية. في المناطق الأكثر ملاءمة للطاقة، يتم امتصاص الغاز ذو الألفة العالية للسطح في الغالب.
"-" - يحدث الامتزاز من خلال آليات مختلفة وحتى وقت معين لا توجد منافسة على السطح.
يتم تحقيق الامتزاز الأحادي الجزيئي في الغالب أثناء الامتزاز الفيزيائي للغازات بقيم منخفضة صوكذلك في واجهة السائل/الغاز.
الامتزاز المتعدد الجزيئات.
نظرية الرهان(بروناور، إيميت، تيلر).
في الحالة التي لا يكون فيها تكوين طبقة أحادية كافيًا للتعويض عن الطاقة السطحية، يكون الامتزاز متعدد الجزيئات ويمكن اعتباره نتيجة للتكثيف القسري تحت تأثير القوى السطحية.
النقاط الرئيسية:
عندما يضرب جزيء ممتز موقعًا مشغولًا، يتم تشكيل مجموعة متعددة.
كلما اقتربنا صل ص سيتناقص عدد مواقع الامتزاز المجانية. في البداية، يزيد عدد الأماكن التي يشغلها الفردي والزوجي وما إلى ذلك ثم يتناقص. في مجموعات.
في ص =ص س يتحول الامتزاز إلى التكثيف.
لا توجد تفاعلات أفقية.
بالنسبة للطبقة الأولى، يتم استيفاء ايزوثيرم لانجموير.
يعتبر السطح بمثابة مجموعة من مواقع الامتزاز. شرط التوازن الديناميكي صحيح: معدل التكثيف في الأماكن الحرة يساوي معدل التبخر من الأماكن المشغولة.
أ هو معامل التكثيف (جزء من الجزيئات المكثفة على السطح)؛
 ,
,
Zm – الحد الأقصى لعدد المقاعد المجانية.
 - تردد الاهتزازات الذرية في الاتجاه العمودي على السطح.
- تردد الاهتزازات الذرية في الاتجاه العمودي على السطح.
بالنسبة للطبقة الأولى، شروط التوازن الديناميكي:



 ، ثم
، ثم
 - معادلة لانجميور.
- معادلة لانجميور.
بالنسبة للطبقة الثانية سيكون صحيحا: 
بالنسبة للطبقة i: 
من أجل التبسيط، يُفترض أن a وv متماثلان بالنسبة لجميع الطبقات باستثناء الطبقة الأولى. بالنسبة لجميع الطبقات ما عدا الأولى، تكون حرارة الامتزاز ثابتة. بالنسبة للطبقة الأخيرة، فإن حرارة الامتزاز تساوي حرارة التكثيف. ونتيجة لذلك تم الحصول على المعادلة
 (*)
(*)
ج- ثابت،
في حالة نظرية BET، فإن الثابت معيميز طاقة جيبس للامتزاز النقي. تحتوي المعادلة على ثابت واحد فقط، وهذه المعادلة أيضًا مهمة جدًا لتحديد مساحة السطح المحددة للمادة المازة.
وبما أن الحرارة يتم إطلاقها نتيجة للامتزاز، يتم تحديد مساحات سطحية محددة عند درجات حرارة منخفضة.
 ????????????
????????????


العيب الرئيسي للنظرية- إهمال التفاعلات الأفقية لصالح التفاعلات الرأسية.
المعادلة تبقى في المدى  من 0.05 إلى 0.3.
من 0.05 إلى 0.3.
أين  <
0,05 – существенное влияние оказывает
неоднородность поверхности.
<
0,05 – существенное влияние оказывает
неоднородность поверхности.
 > 0.3 – يتأثر التفاعل الممتز – الممتز.
> 0.3 – يتأثر التفاعل الممتز – الممتز.
المحاسبة عن التفاعلات الممتزة.
تحدث التفاعلات عندما يتم امتصاص الجزيئات أو الجزيئات المتفرعة على سطح غير قطبي. القدرة على تكوين شركاء. في هذه الحالة، يتغير شكل متساوي الحرارة الامتزاز.
أ  الممتزات ليست قطبية.
الممتزات ليست قطبية.
يتوافق الرسم البياني 1 مع التفاعلات الممتزة الضعيفة والتفاعلات الممتزة القوية.
يتوافق الرسم البياني 2 مع التفاعلات الممتزة القوية والتفاعلات الممتزة القوية.
يتوافق الرسم البياني 3 مع التفاعل القوي الممتز والتفاعل الضعيف الممتز.
 ,
,

في حالة التفاعل بين الجزيئات الممتزة، فمن الضروري أن تأخذ في الاعتبار التغيرات في معاملات النشاط. ويتم كتابة هذه المعادلة على النحو التالي:
 - معادلة فرونكين، فاولر، غوغنهايم.
- معادلة فرونكين، فاولر، غوغنهايم.
ك- ثابت الجذب .
نظرية بولياني المحتملة.
لا تستمد هذه النظرية أي نوع من متساوي درجة حرارة الامتزاز، ولكنها تجعل من الممكن حساب متساوي الحرارة عند درجات حرارة مختلفة.
الامتزاز- وهذا نتيجة انجذاب المادة الممتزة إلى سطح المادة المازة بفعل جهد الامتزاز الذي لا يعتمد على وجود جزيئات أخرى ويعتمد على المسافة بين السطح والجزيء الممتز.
 ,
,
 - إمكانية الامتزاز.
- إمكانية الامتزاز.
وبما أن السطح غير منتظم، يتم استبدال المسافة بحجم الامتزاز  .حجم الامتزازهو الحجم المحصور بين السطح والنقطة المقابلة لقيمة معينة
.حجم الامتزازهو الحجم المحصور بين السطح والنقطة المقابلة لقيمة معينة  .
.
إمكانية الامتزازهو عمل نقل 1 مول من المادة الممتزة خارج حجم امتزاز معين إلى نقطة معينة من حجم الامتزاز (أو عمل نقل 1 مول من البخار المشبع لمادة ماصة تكون في حالة توازن مع سائل ممتز في غياب المادة الممتزة إلى مرحلة بخار في حالة توازن مع المادة المازة).

منحنى مميز
 - إمكانية الامتزاز،
- إمكانية الامتزاز، 
بالنسبة لمادة ماصة معينة وممتزات مختلفة، يكون ما يلي صحيحًا: 
لأنواع مختلفة من الممتزات  ,
,
أين  إمكانات متساوي الحرارة الامتزاز عند الضغوط النسبية
إمكانات متساوي الحرارة الامتزاز عند الضغوط النسبية  للامتصاص 1 وللامتصاص 2. هذه النسبة هي قيمة ثابتة.
للامتصاص 1 وللامتصاص 2. هذه النسبة هي قيمة ثابتة.
 - معامل التقارب
- معامل التقارب
نظرية التكثيف الشعري.
يعتمد مسار عملية الامتزاز إلى حد كبير على بنية الجسم المسامي.
|
صغيرة الحجم | |
|
مسامية انتقالية | |
|
كبير المسام |
في حالة المواد الماصة الصغيرة التي يسهل اختراقها، تتداخل مجالات قوى الامتزاز. في حالة المواد الماصة كبيرة المسام، تعمل المسام كقنوات نقل. تعتبر عمليات التكثيف أكثر أهمية في الأجسام المسامية الانتقالية. يبدأ التكثيف الشعري عند قيم معينة صو  عندما يتم بالفعل تعويض جزء من الطاقة السطحية. الشرط الضروري هو أن السطح يجب أن يكون رطبًا ذاتيًا. تم وصف العملية معادلة طومسون-كلفن.
عندما يتم بالفعل تعويض جزء من الطاقة السطحية. الشرط الضروري هو أن السطح يجب أن يكون رطبًا ذاتيًا. تم وصف العملية معادلة طومسون-كلفن.

 - في حالة التبول يكون مركز الانحناء في الطور الغازي.
- في حالة التبول يكون مركز الانحناء في الطور الغازي.
في حالة التكثيف الشعري، فإن الأيسوثرم الامتزاز له شكل هستيري. الفرع السفلي يتوافق مع عملية الامتزاز، والفرع العلوي يتوافق مع عملية الامتزاز.
يمكن اختزال جميع أنواع المسام إلى ثلاثة أنواع:
|
مخروطي |
أسطوانية ذات نهاية واحدة مغلقة |
أسطوانية ذات طرفين مفتوحين |
|
تتم عملية التعبئة من أسفل المسام. يتطابق ايزوثرم الامتزاز وايزوثرم الامتزاز في هذه الحالة، حيث أن عملية الامتزاز تبدأ من كرة وتبدأ عملية الامتزاز أيضًا باختفاء بعض المجالات.
↓ |
لا يوجد تباطؤ. يتم وصف السكتة الدماغية الأمامية والخلفية بالمعادلة:
|
لا يوجد قاع في أي مكان، وسوف يمتد ملء المسام على طول جدران الاسطوانة.
اسطوانة: سيكون للأيسوثرم مظهر هستيري.
↓ |
في  في ظل ظروف الترطيب، يحدث التكثيف عند ضغوط منخفضة، وهو أمر مناسب للطاقة. من فرع الامتزاز، يتم الحصول على منحنيات توزيع حجم المسام.
في ظل ظروف الترطيب، يحدث التكثيف عند ضغوط منخفضة، وهو أمر مناسب للطاقة. من فرع الامتزاز، يتم الحصول على منحنيات توزيع حجم المسام.
يتم إزاحة الحد الأقصى للمنحنى التفاضلي إلى اليسار بالنسبة إلى نقطة انعطاف المنحنى التكاملي. الحجم الإجمالي للمسام الصغيرة صغير، ولكن له مساحات سطحية كبيرة. ومع زيادة حجم المسام، يزداد حجمها  ، والمنطقة مثل
، والمنطقة مثل  ونتيجة لذلك، لوحظ تحول في الحد الأقصى للمنحنى التفاضلي.
ونتيجة لذلك، لوحظ تحول في الحد الأقصى للمنحنى التفاضلي.
الامتزاز في الواجهة الصلبة والسائلة.
وفي حالة الامتزاز عند السطح البيني للغاز الصلب، أهملنا مكونًا واحدًا. في حالة الامتزاز عند السطح البيني للصلب والسائل، تعمل المادة الممتزة على إزاحة جزيئات المذيب من سطح المادة المازة.
 ,
,
المعادلة صحيحة:

 ,
,
N 1, N 2 - الكسور المولية للمذيب والمكون، N 1 + N 2 = 1، إذن
 ,
=>
,
=>
 ، إذن هي معادلة الامتزاز للواجهة الصلبة والسائلة.
، إذن هي معادلة الامتزاز للواجهة الصلبة والسائلة.
الامتزاز (ز) > 0 عند  <
0
<
0
إذا كانت القيم  بالنسبة للمكون والمذيب مختلفان تمامًا، وفي هذه الحالة يكون الاعتماد زمن نلديه الحد الأقصى في القيمة ن
~ 0,5.
بالنسبة للمكون والمذيب مختلفان تمامًا، وفي هذه الحالة يكون الاعتماد زمن نلديه الحد الأقصى في القيمة ن
~ 0,5.
ه  لو
لو  لها قيم قريبة، في هذه الحالة قد تتغير علامة الامتزاز. مدمن زمن نيعبر المحور x
لها قيم قريبة، في هذه الحالة قد تتغير علامة الامتزاز. مدمن زمن نيعبر المحور x
نقطة تقاطع الدالة ز(ن) مع المحور السيني يسمى الأزيوتروب الامتزاز. وهذا يعني أنه لا يمكن فصل المكونين على مادة ماصة معينة.
معادلة تساوي درجة حرارة الامتزاز مع ثابت التبادل.
أثناء الامتزاز في الواجهة الصلبة والسائلة، تحدث إعادة توزيع ثابتة للمكونات بين سطح المادة الممتزة وحجم المحلول.
 - المكونات (- - الرجوع إلى السطح)
- المكونات (- - الرجوع إلى السطح)

 ,
,
 ,
, .
.
 ,
,


الامتزاز في واجهة الغاز السائل
ر  دعونا نفكر في التغيير في ملف تعريف التركيز عند عبور واجهة الغاز السائل. دع المكون 2 يكون متقلبًا.
دعونا نفكر في التغيير في ملف تعريف التركيز عند عبور واجهة الغاز السائل. دع المكون 2 يكون متقلبًا.
Cs - التركيز في الطبقة السطحية.
بناء على تعريف الامتزاز الزائد

إذا كان المكون غير متطاير، فسيتم كتابة قيمة الامتزاز على النحو التالي:
ص  ري
ري 

في مكافئ.  يتم وصف طبيعة المادة من خلال مشتقاتها
يتم وصف طبيعة المادة من خلال مشتقاتها  .
.
يمكن أن يكون متساوي حرارة التوتر السطحي بالشكل 1 أو 2:
1- المواد الخافضة للتوتر السطحي
2- المواد الخافضة للتوتر السطحي
النشاط السطحي g هو قدرة المواد على تقليل التوتر السطحي في النظام.

 - سماكة الطبقة السطحية
- سماكة الطبقة السطحية
ج س- تركيز المكون في الطبقة السطحية
مع- تركيز الحجم
بالنسبة لسلسلة متماثلة هناك قاعدة:
 - حكم تراوبو دوكلوس
- حكم تراوبو دوكلوس
بالنسبة للمتسلسلة المتجانسة، يكون تساوي درجة حرارة الامتزاز كما يلي:
بدلاً من A نكتب G، لأن الامتزاز مفرط في الطبقة السطحية.
التوتر السطحي متساوي الحرارة:

 - التوتر السطحي للمذيب النقي .
- التوتر السطحي للمذيب النقي .
 - معادلة الامتزاز الأساسية؛
- معادلة الامتزاز الأساسية؛
 - معادلة لانجميور.
- معادلة لانجميور.
دعونا نحلها معا:

- معادلة شيشكوفسكي.
ب- ثابت للسلسلة المتماثلة.
أ- عند الانتقال من متماثل إلى آخر يزيد بمقدار 3-3.5 مرات 
![]()
1- منطقة التركيزات المنخفضة
![]()
2- تركيز متوسط
3 - طبقة أحادية الجزيئية
المواد الخافضة للتوتر السطحي هي جزيئات ثنائية المحبة، أي. تشمل مجموعة قطبية وجذر هيدروكربوني غير قطبي.
o هو الجزء القطبي من الجزيء.
| - الجزء غير القطبي من الجزيء.
في المذيب القطبي، يتم توجيه جزيئات الفاعل بالسطح بطريقة بحيث يواجه الجزء القطبي من الجزيء المذيب، ويتم دفع الجزء غير القطبي إلى الطور الغازي.
في معادلة شيشكوفسكي  ، فهو ثابت بالنسبة للسلسلة المتماثلة.
، فهو ثابت بالنسبة للسلسلة المتماثلة.
يبدأ تأثير الفاعل بالسطح في الظهور ن>5. عند التركيزات الأعلى من تركيز الطبقة الأحادية الجزيئية، تحدث عملية الميسيلات في المحاليل الخافضة للتوتر السطحي.
ميشيل- يسمى مجموع جزيئات الفاعل بالسطح الأمفيفيلية، التي تشكل جذورها الهيدروكربونية قلبًا، وتتحول المجموعات القطبية إلى الطور المائي.
كتلة مذيلة – كتلة مذيلة.
ح  عدد الجزيئات - عدد التجميع.
عدد الجزيئات - عدد التجميع.
المذيلات الكروية
في حالة الميكيلة، يتم إنشاء التوازن في الحل
CMC - التركيز الحرج لتشكيل المذيلة.
وبما أننا نعتبر المذيلة مرحلة منفصلة:
بالنسبة للسلسلة المتماثلة هناك معادلة تجريبية:
أ- طاقة انحلال المجموعة الوظيفية.
ب - زيادة إمكانية الامتزاز، وعمل الامتزاز لكل وحدة الميثيلين.
- زيادة إمكانية الامتزاز، وعمل الامتزاز لكل وحدة الميثيلين.
إن وجود نواة هيدروكربونية في المذيلات يخلق الفرصة للمركبات غير القابلة للذوبان في الماء لتذوب في المحاليل المائية للمواد الخافضة للتوتر السطحي؛ وتسمى هذه الظاهرة الذوبان (ما يذوب هو الذوبان، والفاعل بالسطح هو المذيب).
قد يكون الطين غير قطبي تمامًا، وقد يحتوي على أجزاء قطبية وغير قطبية، وسيكون موجهًا مثل جزيء الفاعل بالسطح.
على أية حال، أثناء الذوبان هناك زيادة في كتلة المذيلة وعدد التجميع ليس فقط بسبب إدراج الذوبان، ولكن أيضًا بسبب زيادة عدد جزيئات الفاعل بالسطح اللازمة للحفاظ على حالة التوازن.
تكون عملية الذوبان أكثر فعالية، فكلما انخفض الوزن الجزيئي للمركب القابل للذوبان.

 ~ 72 ملي نيوتن\م.
~ 72 ملي نيوتن\م.
 ~ 33 ملي نيوتن\م.
~ 33 ملي نيوتن\م.
تعتمد فعالية المواد الخافضة للتوتر السطحي على قيمة CMC.
ضغط الطبقة السطحية ثنائي الأبعاد

→ -قوى التوتر السطحي.
- الضغط ثنائي الأبعاد.
الطبقة السطحية عبارة عن قوة تساوي الفرق في التوتر السطحي لمحلول الفاعل بالسطح والمذيب النقي، الموجهة نحو سطح نظيف.
يتم إنشاء التوازن بين المحلول والطبقة السطحية



في  هناك منطقة حيث
هناك منطقة حيث  يعتمد خطيا على التركيز.
يعتمد خطيا على التركيز.
ز [مول/م2].
 -المساحة التي يشغلها مول واحد من المادة
-المساحة التي يشغلها مول واحد من المادة
ومن ثم سيكون لتساوي درجة حرارة الضغط ثنائي الأبعاد الشكل 
 - متساوي الضغط ثنائي الأبعاد.
- متساوي الضغط ثنائي الأبعاد.
مدمن  من س م:
من س م:

في  - يزداد الضغط ثنائي الأبعاد بشكل حاد. في
- يزداد الضغط ثنائي الأبعاد بشكل حاد. في  ثنائي الأبعاد مشوه، مما يسبب النمو المفاجئ
ثنائي الأبعاد مشوه، مما يسبب النمو المفاجئ  .
.
يسمى الفيلم المحدود بمراحل متماثلة من كلا الجانبين بأنه مزدوج الجوانب. في مثل هذه الأفلام، يتم ملاحظة الحركة المستمرة للسائل الأم.
تسمى الأفلام التي يقل سمكها عن 5 نانومتر بالأفلام السوداء.

يجب أن تتمتع طبقات الامتزاز بخاصيتين: اللزوجة وسهولة الحركة، والسيولة والمرونة.
تأثير مارانجوني هو الشفاء الذاتي.
مثلث جيبس,  - الضغط الزائد.
- الضغط الزائد.
امتد الفيلم وبسبب ترك جزء من السائل، تندفع المواد الخافضة للتوتر السطحي إلى المساحة الحرة. مثلث جيبس.
تأثير قوة الامتزاز للأجسام.
توجد دائمًا طبقة امتصاص على سطح الفيلم، والتي يتم استخدامها بعد ذلك
معادلة لانجميور:


 إلى ضغط ثنائي الأبعاد
إلى ضغط ثنائي الأبعاد
 - نظير لمعادلة شيشكوفسكي
- نظير لمعادلة شيشكوفسكي
الظواهر الحركية الكهربائية. طبقة كهربائية مزدوجة (EDL).
نموذج جيليمهولتز. نظرية جوي تشابمان.
رحلة 1808

ش – أنبوب على شكل، تزج 2 أقطاب كهربائية فيه. ينتهك قانون توصيل الأوعية ويحدث تغيير في مستوى السائل في الأنبوب - الظواهر الحركية الكهربائية.
الظواهر الحركية:
الكهربائي
التناضح الكهربائي
التدفق (التدفق) المحتمل
إمكانية الترسيب
ينشأ 1 و 2 عند تطبيق فرق الجهد؛ 3 و 4، يؤدي تثقيب وترسيب الجسيمات الغروية إلى ظهور فرق الجهد.
التناضح الكهربائي هي حركة وسط التشتت بالنسبة إلى الطور المشتت الثابت تحت تأثير تيار كهربائي.
الكهربائي - هذه هي حركة جسيمات الطور المشتتة بالنسبة إلى وسط تشتت ثابت تحت تأثير تيار كهربائي.
ص  سبب حدوث الظواهر الحركية الكهربائية هو الفصل المكاني للشحنات وظهور طبقة كهربائية مزدوجة.
سبب حدوث الظواهر الحركية الكهربائية هو الفصل المكاني للشحنات وظهور طبقة كهربائية مزدوجة.
الطبقة الكهربائية المزدوجة عبارة عن مكثف مسطح، تتكون إحدى الصفائح من الأيونات المحددة للجهد، والأخرى من الأيونات المضادة. تتلوث الأيونات بنفس الطريقة التي يتم بها دفع الأيونات المشتركة المحددة للجهد إلى حجم المحلول. المسافة بين اللوحات  . تنخفض الإمكانات خطيًا، أي فرق الجهد
. تنخفض الإمكانات خطيًا، أي فرق الجهد  .
.
يؤدي فرق الجهد الخارجي إلى ظهور معامل القص  هو زوج من القوى لكل وحدة مساحة تؤثر على طول سطح الجسم الصلب.
هو زوج من القوى لكل وحدة مساحة تؤثر على طول سطح الجسم الصلب.

في حالة التوازن، يكون معامل القص مساوياً لمعامل الاحتكاك اللزج (  ).
).

في أحوالنا  ,
,

 - معادلة جيليمهولتز-سمالوكوسكي
- معادلة جيليمهولتز-سمالوكوسكي
 - السرعة الخطية لإزاحة الطور.
- السرعة الخطية لإزاحة الطور.
ه– شدة المجال الكهربائي .
 - فرق الجهد بين الصفائح
- فرق الجهد بين الصفائح
 - التنقل الكهربي [م2 /(V*s)].
- التنقل الكهربي [م2 /(V*s)].
لا يأخذ نموذج هيلمهولتز في الاعتبار الحركة الحرارية للجزيئات. في الواقع، توزيع الأيونات في الطبقة المزدوجة أكثر تعقيدًا.
حدد غوي وتشابمان الأسباب التالية لـ DES:
انتقال الأيون من مرحلة إلى أخرى عند حدوث التوازن.
تأين مادة الطور الصلب.
استكمال السطح بالأيونات الموجودة في وسط التشتت.
الاستقطاب من مصدر تيار خارجي.
الطبقة الكهربائية المزدوجة لها بنية غامضة أو منتشرة. تميل الأيونات إلى التوزيع بالتساوي في جميع أنحاء الطبقة المنتشرة.
تتكون الطبقة المنتشرة من عدادات، ويتم تحديد طول الطبقة من خلال طاقتها الحركية. عند درجات حرارة تقترب من الصفر المطلق، تكون الأيونات المضادة قريبة قدر الإمكان من الأيونات المحددة للجهد.
تعتمد نظرية دانيا على معادلتين:
معادلة بولتزمان

 - العمل ضد قوى التفاعل الكهروستاتيكي.
- العمل ضد قوى التفاعل الكهروستاتيكي.
 - كثافة الشحنة الحجمية.
- كثافة الشحنة الحجمية.

معادلة بواسون 
بما أن سمك EDL أصغر بكثير من حجم الجسيمات وبالنسبة لـ EDL المسطح فإن المشتق بالنسبة للإحداثيات  و
و  تم إلغاؤه.
تم إلغاؤه. 
ل ه ذ في ذ<<1 функцию можно разложить в ряд Маклорена:

فلنقتصر على حدين من المتسلسلة إذن:


 - سمك DEL هو المسافة التي يتناقص فيها جهد DEL همرة واحدة.
- سمك DEL هو المسافة التي يتناقص فيها جهد DEL همرة واحدة.
كلما انخفضت درجة الحرارة، كلما قلت  . عند T → 0 – DEL المسطح. كلما زاد التركيز، كلما قلت
. عند T → 0 – DEL المسطح. كلما زاد التركيز، كلما قلت  .
.





 "-" تعني أن الجهد يتناقص مع المسافة. =>
"-" تعني أن الجهد يتناقص مع المسافة. =>
=>

 ,
,
 - تتناقص الإمكانات بشكل كبير.
- تتناقص الإمكانات بشكل كبير.
إمكانية كثافة الشحنة السطحية: 
الشحنة السطحية هي شحنة حجمية ذات علامة معاكسة ومتكاملة عبر المسافة.




=>


حيث تنخفض الإمكانات بمقدار 2.7 مرة - 
سعة طبقة مزدوجة 
عيب النظرية هو أن وجود طبقة هيلمهولتز لا يؤخذ في الاعتبار، أي. لا يأخذ بعين الاعتبار  ومن هنا جاءت الأخطاء في تحديد المعلمات الرئيسية. كما أنه لا يفسر تأثير الأيونات ذات الطبيعة المختلفة على سمك الطبقة الكهربائية المزدوجة.
ومن هنا جاءت الأخطاء في تحديد المعلمات الرئيسية. كما أنه لا يفسر تأثير الأيونات ذات الطبيعة المختلفة على سمك الطبقة الكهربائية المزدوجة.
نظرية ستيرن. هيكل المذيلة الغروية.
تتكون الطبقة الكهربائية المزدوجة من جزأين: كثيف ومنتشر. تتشكل طبقة كثيفة نتيجة لتفاعل الأيونات المحتملة التكوين مع الأيونات الممتزة على وجه التحديد. هذه الأيونات، كقاعدة عامة، تكون مجففة جزئيًا أو كليًا ويمكن أن يكون لها نفس الشحنة أو معاكسة للأيونات المحددة للجهد. ذلك يعتمد على نسبة طاقة التفاعل الكهروستاتيكية  وإمكانية امتصاص محددة
وإمكانية امتصاص محددة  . يتم إصلاح أيونات الطبقة الكثيفة. أما الجزء الآخر من الأيونات فيقع في الطبقة المنتشرة، وهذه الأيونات حرة ويمكن أن تتحرك بشكل أعمق في المحلول، أي في المحلول. من منطقة ذات تركيز أعلى إلى منطقة ذات تركيز أقل. تتكون كثافة الشحنة الإجمالية من جزأين.
. يتم إصلاح أيونات الطبقة الكثيفة. أما الجزء الآخر من الأيونات فيقع في الطبقة المنتشرة، وهذه الأيونات حرة ويمكن أن تتحرك بشكل أعمق في المحلول، أي في المحلول. من منطقة ذات تركيز أعلى إلى منطقة ذات تركيز أقل. تتكون كثافة الشحنة الإجمالية من جزأين.

 - شحنة طبقة هلمهولتز
- شحنة طبقة هلمهولتز
 -شحنة طبقة منتشرة
-شحنة طبقة منتشرة
يحتوي السطح على عدد معين من مراكز الامتزاز، يتفاعل كل منها مع مضاد واحد. ثابت هذا التفاعل شبه الكيميائي يساوي:

 ، أين
، أين  - الكسر المولي للأضداد في المحلول
- الكسر المولي للأضداد في المحلول
توزيع هيلمهولتز
تتناقص الإمكانات خطيًا
التوزيع المحتمل Gouy. لا توجد طبقة كثيفة، وتتناقص الإمكانات بشكل كبير من القيمة 
توزيع صارم.
في البداية، يكون الانخفاض المحتمل خطيًا ثم أسيًا.
عندما يتم تطبيق مجال كهربائي في حالة الرحلان الكهربائي، فإن جسيم الطور الصلب ليس هو الذي يتحرك بشكل مباشر، بل جسيم الطور الصلب مع طبقة من الأيونات المحيطة به. يكرر DES شكل جسيم الطور المشتت. عندما يتم تطبيق الإمكانات، يتم تمزيق جزء من الطبقة المنتشرة. يسمى خط الاستراحة الحدود المنزلقة.
يُطلق على الإمكانات الناشئة عند الحدود المنزلقة نتيجة لفصل جزء من الطبقة المنتشرة الإمكانات الحركية الكهربائية(إمكانات زيتا  ).
).
يسمى جسيم الطور المشتت مع طبقة محيطة من الأضداد وطبقة كهربائية مزدوجة مذيلة.
قواعد لكتابة المذيلات الغروية:


1-1 شحن بالكهرباء
T – جسيم الطور المشتت.
AA هو الحد الفاصل بين الأجزاء الكثيفة والمنتشرة.
BB – الحدود المنزلقة.
قد يتطابق أو لا يتطابق الحد المنزلق مع الخط AA.
تسمى قيمة الرقم الهيدروجيني التي يكون عندها جهد زيتا صفراً نقطة تساوي الجهد الكهربي.
CaCl 2 + Na 2 SO 4 → CaSO 4 ↓ + 2NaCl
1. فائض CaCl 2
CaCl 2 ↔ Ca 2+ + 2Cl -
(CaSO 4 m∙nCa 2+ 2( ن - س)الكلور - ) 2 س + س Cl - - تدوين مذيل.
CaSO 4 م – الركام.
CaSO 4 m∙nCa 2+ – النواة.
CaSO 4 m∙nCa 2+ 2( ن - س)Cl - - جسيم.
2. فائض الصوديوم 2 SO 4
نا 2 SO 4 ↔2Na + + SO 4 2-
(CaSO 4 m∙nSO 4 2- 2(n-x)Na + ) 2x- 2xNa + - مذيل
CaSO 4 م – الركام.
CaSO 4 m∙nSO 4 2 + – نواة.
CaSO 4 m∙nSO 4 2- 2(n-x)Na + - جسيم
معادلة جيليمهولتز-سمولوتشوسكي

 - السرعة الخطية للإزاحة الحدودية (في التناضح الكهربائي).
- السرعة الخطية للإزاحة الحدودية (في التناضح الكهربائي).
 - فرق الجهد عبر لوحات المكثف (في التناضح الكهربائي).
- فرق الجهد عبر لوحات المكثف (في التناضح الكهربائي).


 - معدل التدفق الحجمي للحل، س- مربع المقطع العرضيالخلايا.
- معدل التدفق الحجمي للحل، س- مربع المقطع العرضيالخلايا.

ه– شدة المجال الكهربائي .


 (للتناضح الكهربائي).
(للتناضح الكهربائي).
لإمكانات التدفق:

 - محتمل
- محتمل
 - الضغط على الغشاء
- الضغط على الغشاء
وكقاعدة عامة، فإن قيم التنقلات الكهربي والتنقلات الكهروضوئية أقل من تلك المحسوبة. يحدث هذا بسبب:
تأثير الاسترخاء (عندما يتحرك جسيم طور مشتت، ينكسر تماثل الغلاف الجوي الأيوني).
التثبيط الكهربي (حدوث احتكاك إضافي نتيجة حركة الأضداد).
تشويه خطوط التيار في حالة الجزيئات الموصلة للكهرباء.
العلاقة بين التوتر السطحي والإمكانات. معادلة ليبمان.
يحدث تكوين EDL تلقائيًا بسبب رغبة النظام في تقليل طاقته السطحية. في ظروف ثابتة تو صتبدو المعادلة المعممة للقانونين الأول والثاني للديناميكا الحرارية كما يلي:
 (2)
(2)
(3), (1)=(3) =>
=>

 - معادلة ليبمان الأولى.
- معادلة ليبمان الأولى.
 - كثافة الشحنة السطحية.
- كثافة الشحنة السطحية.
 - السعة التفاضلية.
- السعة التفاضلية.
 - معادلة ليبمان الثانية.
- معادلة ليبمان الثانية.
مع- سعة.
دعونا نحل معادلة ليبمان الأولى ومعادلة الامتزاز الأساسية:
 ,
,


 ، ثم
، ثم
 - معادلة نرنست
- معادلة نرنست
 ,
,
 ,
,




 - معادلة المنحنى الشعري الكهربائي (ECC).
- معادلة المنحنى الشعري الكهربائي (ECC).
في  :
: ، لكن
، لكن 
تعمل المواد الخافضة للتوتر السطحي الكاتيونية (CPAS) على تقليل الفرع الكاثودي لـ EKC.
تعمل المواد الخافضة للتوتر السطحي الأنيونية (APS) على تقليل الفرع الأنودي لـ EKC.
تعمل المواد الخافضة للتوتر السطحي غير الأيونية (NSAS) على تقليل الجزء الأوسط من ECC.
استقرار الأنظمة المتفرقة. الضغط المنفصل.
يمكن تقسيم الأنظمة المتفرقة إلى:
الأنظمة غير المستقرة من الناحية الديناميكية الحرارية يمكن أن تكون مستقرة حركيًا بسبب الانتقال إلى حالة شبه مستقرة.
هناك نوعان من الاستقرار:
استقرار الترسيب (نسبة إلى الجاذبية).
الاستقرار الجمعي. (بالنسبة للالتصاق)
تجلط الدمهي عملية التصاق الجسيمات، مما يؤدي إلى فقدان الاستقرار التجميعي. يمكن أن يحدث التخثر بسبب التغيرات في درجات الحرارة، ودرجة الحموضة، والتحريك، والموجات فوق الصوتية.
يتميز التخثر:
تفريغ.
لا رجعة فيه.
يحدث التخثر مع إدخال الشوارد.
قواعد التخثر:

فيلم- هذا هو جزء النظام الموجود بين سطحين بينيين.
الضغط المنفصليحدث عندما ينخفض سمك الفيلم بشكل حاد نتيجة لتفاعل الطبقات السطحية المقتربة.

"-" - مع انخفاض سمك الفيلم، يزداد ضغط الانفصال.
P 0 هو الضغط في المرحلة السائبة، وهو استمرار للطبقة البينية.
ف1 – الضغط في الفيلم .
نظرية الاستقرار. DLFO (ديرياجين، لانداو، فيرواي، أوفربيك).
وفقًا لنظرية DLFO، يتكون ضغط الانفصال من عنصرين:
كهرباء P E (إيجابي، ويرجع ذلك إلى قوى التنافر الكهروستاتيكية). يتوافق مع انخفاض طاقة جيبس مع زيادة سمك الفيلم.
جزيئي P M (سلبي بسبب عمل قوى الجذب). وهو ناتج عن ضغط الفيلم بسبب قوى السطح الكيميائية، ونصف قطر عمل القوى هو أعشار نانومتر مع طاقة تبلغ حوالي 400 كيلوجول / مول.
إجمالي طاقة التفاعل:

 - النظام مستقر بشكل جماعي
- النظام مستقر بشكل جماعي
 - نظام غير مستقر
- نظام غير مستقر
ص  عنصر إيجابي.
عنصر إيجابي.
ترجع الزيادة إلى زيادة الطاقة الكامنة عند ضغط الأغشية الرقيقة. بالنسبة للأفلام ذات السماكة الكبيرة، يتم تعويض الطاقة الأيونية الزائدة وتساوي تفاعل الطاقة في حجم وسط التشتت.
لو  (
( - سمك الفيلم،
- سمك الفيلم،  - نصف القطر الأيوني) يؤدي ترقق الفيلم إلى اختفاء وتقليل الجزيئات والأيونات مع الحد الأدنى من الطاقة السطحية فيه. يتناقص عدد الجزيئات المجاورة، ونتيجة لذلك تزداد الطاقة الكامنة للجزيئات المتبقية في الفيلم.
- نصف القطر الأيوني) يؤدي ترقق الفيلم إلى اختفاء وتقليل الجزيئات والأيونات مع الحد الأدنى من الطاقة السطحية فيه. يتناقص عدد الجزيئات المجاورة، ونتيجة لذلك تزداد الطاقة الكامنة للجزيئات المتبقية في الفيلم.


تعتبر نظرية DLVO تفاعل الجزيئات بمثابة تفاعل الصفائح.

الجزيئات لا تتفاعل



 - معادلة لابلاس،
- معادلة لابلاس،  ,
,


للأسطح ضعيفة الشحن
للأسطح المشحونة للغاية:

المكون الجزيئي هو تفاعل ذرتين:
 ~
~
تفاعل الذرة مع السطح:

لنأخذ سجلين:
د  للحصول على المكون الجزيئي، من الضروري جمع كل طاقات التفاعل لذرات الصفائح اليمنى واليسرى.
للحصول على المكون الجزيئي، من الضروري جمع كل طاقات التفاعل لذرات الصفائح اليمنى واليسرى.
أين  - ثابت هامكر (يراعي طبيعة الأجسام المتفاعلة).
- ثابت هامكر (يراعي طبيعة الأجسام المتفاعلة).
الذي - التي. يمكن التعبير عن طاقة تفاعل الجزيئات في النظام باستخدام منحنيات الجهد.
I - الحد الأدنى المحتمل الأساسي. هذه منطقة تخثر لا رجعة فيه، وقوى الجذب تسود.
II - منطقة الاستقرار التجميعي، وتسود القوى التنافرية.
III – الحد الأدنى المحتمل الثانوي (أو منطقة التلبد). توجد طبقة إلكتروليت بين جزيئات الطور المشتت، ويمكن فصل الجزيئات ونقلها إلى منطقة استقرار التجميع.

المنحنى 1 - النظام مستقر بشكل جماعي.
المنحنى 2 – مستقر في المنطقة الأولى، وغير مستقر في المنطقة الثانية.
المنحنى 3 - حدث تخثر في النظام.
المنحنى 4 - عند النقطة 4 إجمالي طاقة التفاعل U=0،  ، هذه النقطة القصوى تتوافق مع بداية التخثر السريع.
، هذه النقطة القصوى تتوافق مع بداية التخثر السريع.
هناك حالتان:
1. الأسطح المشحونة قليلاً:
U = U E + U M = 0
 (1)
(1)
2)

 (2)
(2)



 - هذا هو سمك الطبقة المقابلة لبداية عملية التخثر.
- هذا هو سمك الطبقة المقابلة لبداية عملية التخثر.






 - للأسطح ضعيفة الشحن
- للأسطح ضعيفة الشحن
 ثم
ثم 
2. للأسطح المشحونة للغاية:
 (1)
(1)
2)

 (2)
(2)


 (3)
(3)
 ,
,
دعونا مربع (3)

تجلط الدم:
في عملية الامتزاز المحددة، يمكن امتصاص الأيونات بكميات فائقة التكافؤ بحيث يمكن للسطح أن يغير شحنته. يتم إعادة شحن السطح.
في حالة الامتزاز النوعي، لا يمكن امتصاص الأيونات ذات العلامات المعاكسة فحسب، بل أيضًا من نفس العلامة.
إذا تم امتصاص الأيونات التي لها نفس علامة السطح، فلن يكون هناك انخفاض في الإمكانات في الطبقة السطحية، بل زيادة فيها.

تخثر التعادل (يحدث بمشاركة جزيئات ضعيفة الشحنة ويعتمد ليس فقط على شحنة مُخثر المنحل بالكهرباء، ولكن أيضًا على الإمكانات عند حدود الطبقات الكثيفة والمنتشرة).
نظرية سمولوشوفسكي للتخثر السريع.

اعتماد معدل التخثر على تركيز المنحل بالكهرباء.
I - معدل تخثر الدم منخفض،
II – يتناسب معدل التخثر تقريبًا مع تركيز الإلكتروليت.
III – منطقة التخثر السريع، وسرعتها مستقلة عمليا عن التركيز.
الأحكام الأساسية:
يكون المحلول الأولي أحادي التشتت، والجزيئات المماثلة لها شكل كروي.
جميع تصادمات الجسيمات فعالة.
عندما يصطدم جسيمان أوليان، يتكون جسيم ثانوي. ثانوي + ابتدائي = ثالثي. الابتدائي والثانوي والثالث – التعدد.
من حيث الحركية الكيميائية، يمكن وصف عملية التخثر بالمعادلة:
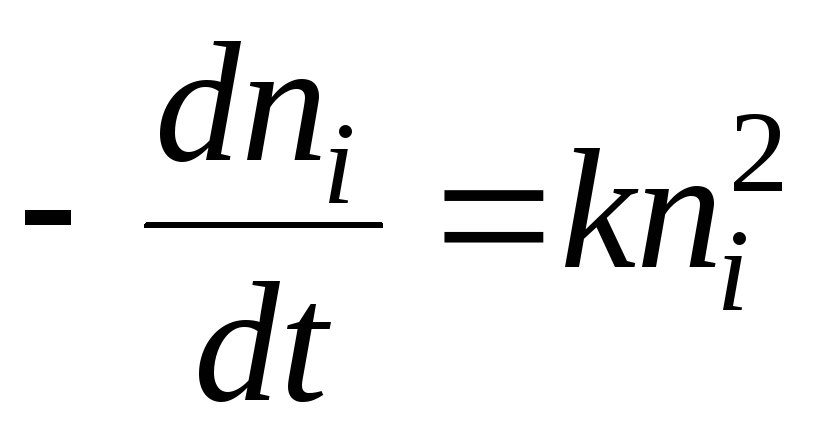
الحل سيكون المعادلة : 
 - نصف زمن التخثر. هذا هو الوقت الذي ينخفض فيه عدد جزيئات المحلول مرتين.
- نصف زمن التخثر. هذا هو الوقت الذي ينخفض فيه عدد جزيئات المحلول مرتين.

 ,
,
 ,
,
 ,
,


ومع زيادة التعدد، يتحول الحد الأقصى لمنحنيات التخثر نحو قيم أكبر  .
.
عيوب:
افتراض التشتت الأحادي.
الافتراض حول فعالية جميع الاصطدامات.




 - جسم كروي،
- جسم كروي، ,
,





