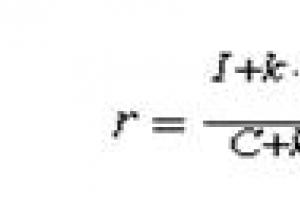Քրոմատագրության զարգացում. Հեղուկ քրոմատագրության զարգացման պատմություն. Քրոմատոգրաֆիա պինդ ստացիոնար փուլում
Անցած դարի բազմաթիվ բացահայտումներ պայմանավորված են ռուս գիտնական Միխայիլ Ցվետով և նրա քրոմատոգրաֆիկ վերլուծության մեթոդով։ Մեծ թվով ականավոր հետազոտողներ նրան պարտական են իրենց հաջողություններով և բազմաթիվ Նոբելյան մրցանակներով:
«...Առանց Մայքլ Ցվետայի աշխատանքի, մենք՝ բոլոր «պիգմենտներներս», անելիք չէինք ունենա...»,- այս կարծիքին է հայտնի անգլիացի գիտնականներից մեկը։
Միխայիլ Սեմենովիչ Ցվետ (1872–1919) - իտալուհու և ռուս մտավորականի որդի։ Նա ծնվել է Իտալիայում՝ Թուրինից ոչ հեռու գտնվող Աստի քաղաքում։ 1891 թվականին Միխայիլն ավարտել է Ժնևի գիմնազիան և ընդունվել Ժնևի համալսարանի ֆիզիկամաթեմատիկական ֆակուլտետը։ 1896 թվականի հոկտեմբերին «Բջջային ֆիզիոլոգիայի հետազոտություն. նյութեր պրոտոպլազմայի, պլազմային թաղանթների և քլորոպլաստների շարժման իմացության համար» ատենախոսությունը ներկայացնելուց հետո Ցվետը ստանում է բնական գիտությունների դոկտորի դիպլոմ։ Նույն թվականի դեկտեմբերին նա ժամանում է Սանկտ Պետերբուրգ։
Միխայիլը չգիտեր, որ Ժնեւի համալսարանի դիպլոմը Ռուսաստանում ճանաչված չէ։ Հետևաբար, նա պետք է աշխատեր հայտնի բուսաբան Անդրեյ Սերգեևիչ Ֆամինցինի մոտ, ով նույնպես ուսումնասիրում էր քլորոֆիլը, կարելի է ասել, թռչնի աջ կողմում։ Սանկտ Պետերբուրգում Ցվետը հանդիպեց այլ նշանավոր բուսաբանների և բույսերի ֆիզիոլոգների՝ Ի.Պ. Բորոդին, Մ.Ս. Վորոնինը, Ա.Ն. Բեկետովը։ Դա ինքնատիպ, մտածող մտածողների և հմուտ փորձարարների փայլուն հասարակություն էր: Ցվետը շարունակեց իր հետազոտությունները քլորոպլաստների վերաբերյալ՝ միաժամանակ պատրաստվելով նոր մագիստրոսական քննություններին և ատենախոսության պաշտպանությանը։ Քննությունները հանձնել է 1899 թվականին, իսկ մագիստրոսական թեզը պաշտպանել է Կազանի համալսարանում 1901 թվականի սեպտեմբերի 23-ին։
1901 թվականի նոյեմբերից Ցվետը աշխատում է որպես ասիստենտ Վարշավայի համալսարանի բույսերի անատոմիայի և ֆիզիոլոգիայի ամբիոնում։ Բնագետների և բժիշկների XI համագումարում Միխայիլ Սեմենովիչը հանդես եկավ «Քլորոֆիլի ֆիզիոլոգիական ուսումնասիրության մեթոդներ և առաջադրանքներ» զեկույցով, որտեղ նա առաջին անգամ զեկուցեց ադսորբցիոն քրոմատոգրաֆիայի մեթոդի մասին:
Միխայիլ Սեմենովիչը երկար ժամանակ լուծել է կանաչ տերևային պիգմենտների տարանջատման խնդիրը, և դրանք շատ նման են հատկություններով։ Բացի այդ, տերեւները պարունակում են այլ, շատ վառ, գունանյութեր՝ կարոտինոիդներ։ Հենց կարոտինոիդների շնորհիվ են աշնանը հայտնվում դեղին, նարնջագույն, մանուշակագույն տերևները։ Այնուամենայնիվ, քանի դեռ քլորոֆիլները չեն ոչնչացվել, գրեթե անհնար էր դրանք առանձնացնել կարոտինոիդներից։
Ինչպես նշել է Յու.Գ. Չիրկովը, «ըստ երևույթին, Գույնի հայտնաբերումը արձագանք էր դրանց տարանջատման մեթոդներին, որոնք այն ժամանակ կոպիտ և մահացու էին պիգմենտների համար: Ահա մեթոդներից մեկը.
Նախ արդյունահանվել է քլորոֆիլի ալկոհոլային մզվածք, այնուհետև այն երեք ժամ եռացրել՝ լուծույթին ուժեղ ալկալի (կաուստիկ կալիում) ավելացնելով։ Արդյունքում քլորոֆիլը քայքայվում է իր բաղկացուցիչ մասերի՝ կանաչ և դեղին պիգմենտների։
Բայց չէ՞ որ այս խմիչքի պատրաստման գործընթացում (գրեթե ալքիմիական մանիպուլյացիաներ) բնական քլորոֆիլը կարող էր ոչնչացվել։ Եվ այդ ժամանակ հետազոտողը պետք է գործ ունենա պիգմենտների կտորների և նույնիսկ դրանց քիմիական փոխակերպման արտադրանքի հետ:
Ինչպես է տեղի ունեցել մեծ հայտնագործությունը, գրում է S.E. Շնոլ.- Նա վերցրեց ապակե խողովակ, լցրեց կավիճի փոշի և վերին շերտի վրա լցրեց տերեւների մի քիչ ալկոհոլային մզվածք, մզվածքը դարչնագույն-կանաչավուն էր, իսկ կավիճ սյունակի վերին շերտը դարձավ նույն գույնը։ Եվ այնուհետև Մ.Ս.-ն սկսեց կաթիլ առ կաթիլ կաթիլ վերևից կաթիլներ լցնել լուծիչի մեկ այլ մասի պիգմենտները կավիճի հատիկներից, որոնք շարժվեցին խողովակով, որտեղ կավիճի թարմ հատիկները կլանեցին պիգմենտները և, իր հերթին, դրանք տվեցին. լուծիչի նոր մասեր: շարժական լուծիչով ներծծված տարբեր պիգմենտներ տարբեր արագությամբ շարժվեցին կավիճ սյունակի երկայնքով և կավիճ սյունակում ձևավորեցին մաքուր նյութերի միատեսակ գունավոր շերտեր: Դա գեղեցիկ էր: Վառ կանաչ գոտի, ժապավենը մի փոքր ավելի դեղին, քան կանաչը: - սրանք երկու տեսակի քլորոֆիլներ են և կարոտինոիդների վառ դեղին-նարնջագույն գոտի: MS-ն այս նկարն անվանել է քրոմատոգրամ»:
«Գույնը ցույց տվեց,- գրում է Չիրկովը,- որ երբ հեղուկի մեջ լուծարված բուսական պիգմենտները անցնում են անգույն ծակոտկեն սորբենտի շերտով, առանձին գունանյութեր դասավորվում են գունավոր գոտիների տեսքով. յուրաքանչյուր պիգմենտ ունի իր գույնը կամ առնվազն երանգ Սորբենտ փոշի (կարող է լինել կավիճ, շաքարի փոշի...) ներծծում է (մակերեսորեն ներծծում. լատիներեն adsorbere նշանակում է «կուլ») անհավասար ուժով տարբեր պիգմենտներ. հետաձգվել է ավելի մոտ: Գույնը կոչվում է քրոմատոգրամ, իսկ մեթոդը` քրոմատոգրաֆիա:
Այսպիսով, անհաղթահարելի թվացող խնդիր լուծվեց. Մեթոդը պարզվեց, որ հնարամտորեն պարզ է. Այն նման չէ նախկինում օգտագործված ծանր, ռեակտիվ ինտենսիվ բարդ ընթացակարգերին:
Թերևս այս պարզությունն էր պատճառը, որ նրա ժամանակակիցներից շատերը կամ չընդունեցին այս զարմանալի հայտնագործությունը, կամ, առավել տխուր, կտրուկ ըմբոստացան դրա հեղինակի դեմ։
Բայց ժամանակը ամեն ինչ իր տեղը դրեց։ Գունավոր հայտնագործված քրոմատագրություն քլորոֆիլի հետազոտության համար: Նա սկզբում մեկուսացրեց մի նյութ, որը նա անվանեց քլորոֆիլ ալֆա և քլորոֆիլ բետա: Պարզվեց, որ այն հարմար է ոչ միայն պիգմենտների, այլև անգույն, անգույն խառնուրդների՝ սպիտակուցների, ածխաջրերի ուսումնասիրության համար։ Քսաներորդ դարի վաթսունական թվականներին մի քանի հազար ուսումնասիրություններ արդեն նվիրված էին քրոմատագրությանը։ Քրոմատոգրաֆիան դարձել է ունիվերսալ մեթոդ։
«... Նյութերի քրոմատոգրաֆիկ տարանջատման սկզբունքը, որը հայտնաբերեց Մ. Ցվետը, ընկած է քրոմատոգրաֆիկ վերլուծության բազմաթիվ տարբեր մեթոդների հիմքում: Առանց դրա կիրառման, 20-րդ դարի գիտության և տեխնիկայի ձեռքբերումների մեծ մասը հնարավոր չէր լինի ...
Այս ամենի հիմքում մեկ ընդհանուր գաղափար է. Նա պարզ է: Սա, ըստ էության, երկրաչափական առաջընթացի գաղափարն է: Թող լինեն երկու նյութեր, որոնք շատ նման են իրենց բոլոր հատկություններին: Ո՛չ տեղումները, ո՛չ արդյունահանումը, ո՛չ կլանումը չեն կարող դրանք նկատելի չափով բաժանել։ Թող մեկ նյութ ներծծվի մակերեսի վրա, օրինակ՝ կալցիումի կարբոնատ (այսինքն՝ 1 տոկոսից պակաս):
Այսինքն՝ դրա պարունակությունը ադսորբենտի վրա կլինի մյուսի պարունակության 0,99-ը։ Եկեք ադսորբենտը մշակենք որոշ լուծիչով, որպեսզի տեղի ունենան երկու նյութերի կլանումը (կտրումը) և կլանումը (լվացումը), և երկուսն էլ ներծծողից անցնեն լուծիչ, և ստացված լուծույթը տեղափոխենք ադսորբենտի թարմ մասը: Այնուհետև առաջին նյութի հարաբերակցությունը ներծծող նյութի մակերևույթի վրա կրկին հավասար կլինի երկրորդի պարունակության 0,99-ին, այսինքն՝ ներծծվում է սկզբնական քանակի 0,99 x 0,99 = 0,98 մաս: Եվս մեկ անգամ մենք նորից կիրականացնենք էլյուցիան և կլանումը. այժմ առաջին նյութի համամասնությունը կկազմի երկրորդի պարունակության 0,98 x 0,99 \u003d 0,97: Որպեսզի ադսորբենտի հաջորդ մասի վրա առաջին նյութի պարունակությունը կազմի երկրորդի պարունակության միայն 1 տոկոսը, անհրաժեշտ կլինի մոտ 200 անգամ կրկնել ներծծում-էլյուցիոն ցիկլը...
Առանձին նյութերի բազմակի վերաադսորբցիայի գաղափարը կարող է փոփոխվել չխառնվող լուծիչների համակարգում նյութերի խառնուրդի բազմակի վերաբաշխման: Սա բաժանման քրոմատոգրաֆիայի հիմքն է։ Նույն գաղափարն է ընկած ժամանակակից էլեկտրոֆորեզի մեթոդների հիմքում, երբ նյութերի խառնուրդը տարբեր արագությամբ շարժվում է էլեկտրական դաշտում տարբեր կլանիչների վրայով։
Ուղարկել ձեր լավ աշխատանքը գիտելիքների բազայում պարզ է: Օգտագործեք ստորև բերված ձևը
Ուսանողները, ասպիրանտները, երիտասարդ գիտնականները, ովքեր օգտագործում են գիտելիքների բազան իրենց ուսումնառության և աշխատանքի մեջ, շատ շնորհակալ կլինեն ձեզ:
Տեղադրվել է http://www.allbest.ru
1. Քրոմատոգրաֆիայի հայտնաբերման և զարգացման պատմություն
2. Հիմնական դրույթներ
3. Անալիզի քրոմատոգրաֆիկ մեթոդների դասակարգում
4. Ադսորբցիոն քրոմատոգրաֆիա: Բարակ շերտով քրոմատոգրաֆիա
4.1 Փորձարարական տեխնիկա բարակ շերտով քրոմատագրության մեջ
5. Գազային քրոմատոգրաֆիա
5.1 Գազի կլանման քրոմատոգրաֆիա
5.2 Գազային-հեղուկ քրոմատոգրաֆիա
6. Բաժանման քրոմատոգրաֆիա: Թղթային քրոմատոգրաֆիա
7. Նստվածքի քրոմատագրություն
7.1 Նստվածքի քրոմատագրման մեթոդների դասակարգումն ըստ փորձարարական տեխնիկայի
7.2 Նստվածքի քրոմատագրություն թղթի վրա
8. Իոնափոխանակման քրոմատոգրաֆիա
Եզրակացություն
Մատենագիտություն
1. ՊԱՏՄՈՒԹՅՈՒՆԲԱՑԱՀԱՅՏՈՒՄՆԵՐ ԵՎ ՔՐՈՄԱՏՈԳՐԱՖԻԱՅԻ ԶԱՐԳԱՑՈՒՄ
Քրոմատագրության հայտնագործողը ռուս գիտնական, բուսաբան և ֆիզիկաքիմիկոս Միխայիլ Սեմյոնովիչ Ցվետն էր։
Քրոմատոգրաֆիայի բացահայտումը սկսվում է այն ժամանակներից, երբ Ցվետը ավարտեց իր մագիստրոսական թեզը Սանկտ Պետերբուրգում (1900 - 1902 թթ.) և աշխատանքի առաջին շրջանը Վարշավայում (1902 - 1903 թթ.): Հետազոտելով բույսերի պիգմենտները՝ Ցվետը պիգմենտների խառնուրդի լուծույթը, որը շատ քիչ էր տարբերվում գույնով, անցկացրեց ներծծող կալցիումի կարբոնատով լցված խողովակի միջով, այնուհետև լվացեց կլանիչը մաքուր լուծիչով: Խառնուրդի առանձին բաղադրիչներն առանձնացրել են և ձևավորել գունավոր շերտեր: Ժամանակակից տերմինաբանության համաձայն՝ Ցվետը հայտնաբերել է քրոմատոգրաֆիայի զարգացող տարբերակը (մշակող հեղուկ ադսորբցիոն քրոմատագրություն)։ Քրոմատագրության տարբերակի մշակման վերաբերյալ հետազոտության հիմնական արդյունքները Ցվետը շարադրել է «Քրոմոֆիլները բույսերի և կենդանիների աշխարհում» (1910) գրքում, որն իր դոկտորական ատենախոսությունն է։ քրոմատոգրաֆիա գազի նստվածքային իոնափոխանակություն
Ցվետը լայնորեն կիրառեց քրոմատոգրաֆիկ մեթոդը ոչ միայն խառնուրդը առանձնացնելու և դրա բազմաբաղադրիչ բնույթը հաստատելու, այլև քանակական վերլուծության համար, այդ նպատակով նա կոտրեց ապակե սյունը և ներծծող սյունը շերտերի կտրեց: Ցվետը մշակել է հեղուկ քրոմատագրման ապարատ, առաջինն է իրականացրել քրոմատոգրաֆիկ պրոցեսները նվազեցված ճնշման (պոմպային դուրս) և որոշ ավելորդ ճնշման պայմաններում և մշակել է առաջարկություններ արդյունավետ սյուների պատրաստման համար։ Բացի այդ, նա ներկայացրեց նոր մեթոդի բազմաթիվ հիմնական հասկացություններ և տերմիններ, ինչպիսիք են «քրոմատոգրաֆիա», «զարգացում», «տեղաշարժ», «քրոմատոգրամ» և այլն:
Քրոմատոգրաֆիան սկզբում օգտագործվում էր շատ հազվադեպ, մոտ 20 տարվա լատենտ ժամանակաշրջանով, որի ընթացքում հայտնվեցին մեթոդի տարբեր կիրառությունների վերաբերյալ միայն շատ փոքր թվով զեկույցներ: Եվ միայն 1931 թվականին Ռ.Կունը (Գերմանիա) Ա.Վինտերշտեյնը (Գերմանիա) և Է.Լեդերերը (Ֆրանսիա), ովքեր աշխատում էին Հայդելբերգի կայսր Վիլհելմի բժշկական հետազոտությունների ինստիտուտի քիմիական լաբորատորիայում (ղեկավար՝ Ռ. Կուն): մեկուսացնել a- և b-կարոտինը հում կարոտինից և դրանով իսկ ցույց տալ Գույնի հայտնաբերման արժեքը:
Քրոմատոգրաֆիայի զարգացման կարևոր փուլը խորհրդային գիտնականներ Ն.Ա. Իզմայիլովը և Մ.Ս. Շրայբերի բարակ շերտով քրոմատագրման մեթոդը (1938), որը թույլ է տալիս վերլուծել նյութի հետքի քանակով։
Հաջորդ կարևոր քայլը Ա. Մարտինի և Ռ. Սինգի (Անգլիա) կողմից հեղուկ բաժանման քրոմատոգրաֆիայի տարբերակի հայտնաբերումն էր՝ օգտագործելով ամինաթթուների ացետիլ ածանցյալների տարանջատման օրինակը ջրով հագեցած սիլիկա գելով լցված սյունակի վրա՝ օգտագործելով քլորոֆորմը: լուծիչ (1940): Միաժամանակ նշվել է, որ որպես շարժական փուլ կարող է օգտագործվել ոչ միայն հեղուկ, այլ նաև գազ։ Մի քանի տարի անց այս գիտնականներն առաջարկեցին ամինաթթուների ածանցյալների տարանջատումն իրականացնել ջրով խոնավացած թղթի վրա՝ բութանոլով որպես շարժական փուլ: Նրանք նաև ներդրեցին առաջին երկչափ տարանջատման համակարգը: Մարտինը և Սինգը ստացել են Նոբելյան մրցանակ քիմիայի բնագավառում բաժանման քրոմատագրության հայտնագործության համար։ (1952): Այնուհետև, Մարտինը և Ա. Ջեյմսը իրականացրել են գազային բաժանման քրոմատագրության տարբերակ՝ խառնուրդները բաժանելով սիլիկոնային DS-550 և ստեարաթթվի խառը սորբենտի վրա (1952 - 1953 թթ.): Այդ ժամանակվանից ամենաինտենսիվ զարգացում է ստացել գազային քրոմատագրության մեթոդը։
Գազային քրոմատագրության տարբերակներից մեկը քրոմատագրությունն է, որի դեպքում գազերի խառնուրդի տարանջատումը բարելավելու համար շարժական փուլի՝ գազի շարժման հետ միաժամանակ սորբենտը և անջատվող խառնուրդը ենթարկվում են շարժվող ջերմաստիճանի։ երկարությամբ որոշակի գրադիենտ ունեցող դաշտ (A.A. Zhukhovitsky et al., 1951):
Քրոմատոգրաֆիկ մեթոդի մշակման գործում նշանակալի ներդրում է ունեցել Գ.Շվաբը (Գերմանիա), ով եղել է իոնափոխանակման քրոմատագրության հիմնադիրը (1937 - 1940 թթ.)։ Այն հետագայում զարգացավ խորհրդային գիտնականներ Է.Ն. Գապոն եւ Թ.Բ. Գապոնը, ով իրականացրել է լուծույթում իոնների խառնուրդի քրոմատոգրաֆիկ տարանջատումը (Ֆ. քիչ լուծվող նստվածքների (նստվածքային քրոմատոգրաֆիա, 1948):
Իոնափոխանակման քրոմատոգրաֆիայի զարգացման ժամանակակից փուլը սկսվեց 1975 թվականին Գ.Սմոլի, Թ.Սթիվենսի և Վ.Բաումանի (ԱՄՆ) աշխատանքից հետո, որտեղ նրանք առաջարկեցին նոր վերլուծական մեթոդ, որը կոչվում է իոնային քրոմատագրություն (բարձր-տարբերակ: կատարողական իոնափոխանակման քրոմատոգրաֆիա հաղորդունակության հայտնաբերմամբ):
Բացառիկ նշանակություն ունեցավ Մ.Գոլեյի (ԱՄՆ) կողմից քրոմատոգրաֆիայի մազանոթ տարբերակի ստեղծումը (1956թ.), որտեղ մազանոթ խողովակի ներքին պատերին կիրառվում է սորբենտ, որը հնարավորություն է տալիս վերլուծել բազմաբաղադրիչ խառնուրդների միկրոքանակները։
60-ականների վերջին։ Հեղուկ քրոմատագրության նկատմամբ հետաքրքրությունը կտրուկ աճել է։ Ծնվել է բարձր արդյունավետության հեղուկ քրոմատոգրաֆիա (HPLC): Դրան նպաստել են բարձր զգայուն դետեկտորների, նոր ընտրովի պոլիմերային սորբենտների և նոր սարքավորումների ստեղծումը, որը հնարավորություն է տալիս աշխատել բարձր ճնշման տակ: Ներկայումս HPLC-ն առաջատար դիրք է զբաղեցնում քրոմատոգրաֆիայի այլ մեթոդների շարքում և իրականացվում է Հայաստանում տարբեր տարբերակներ.
2. ՀԻՄՆԱԿԱՆ ԴՐՈՒՅԹՆԵՐ
Քրոմատոգրաֆիան նյութերի տարանջատման և որոշման մեթոդ է, որը հիմնված է բաղադրիչների բաշխման վրա երկու փուլերի միջև՝ շարժական և ստացիոնար: Ստացիոնար (ստացիոնար) փուլը պինդ ծակոտկեն նյութ է (հաճախ կոչվում է սորբենտ) կամ պինդ նյութի վրա դրված հեղուկ թաղանթ։ Շարժական փուլը հեղուկ կամ գազ է, որը հոսում է ստացիոնար փուլով, երբեմն ճնշման տակ: Վերլուծված խառնուրդի բաղադրիչները (սորբատները) շարժական փուլի հետ միասին շարժվում են ստացիոնար փուլով: Այն սովորաբար տեղադրվում է ապակե կամ մետաղական խողովակի մեջ, որը կոչվում է սյունակ: Կախված սորբենտի մակերեսի հետ փոխազդեցության ուժից (կլանման կամ որևէ այլ մեխանիզմի շնորհիվ), բաղադրիչները կշարժվեն սյունակի երկայնքով տարբեր արագություններով: Որոշ բաղադրիչներ կմնան վերին շերտսորբենտը, մյուսները՝ փոքր չափով փոխազդելով սորբենտի հետ, կհայտնվեն սյունակի ստորին հատվածում, իսկ ոմանք նույնիսկ կլքեն սյունը շարժական փուլի հետ միասին (այդպիսի բաղադրիչները կոչվում են չպահպանված, և դրանց պահպանման ժամանակը որոշում է «մեռած» ժամանակ» սյունակի): Այսպիսով, բաղադրիչների բարդ խառնուրդները արագ բաժանվում են: Պետք է ընդգծել քրոմատոգրաֆիկ մեթոդների հետևյալ առավելությունները.
1. Տարանջատումն իր բնույթով դինամիկ է, և տարանջատված բաղադրիչների սորբցիա-դեզորբցիայի ակտերը կրկնվում են բազմիցս։ Դրանով է պայմանավորված քրոմատոգրաֆիկ տարանջատման զգալիորեն ավելի բարձր արդյունավետությունը սորբման և արդյունահանման ստատիկ մեթոդների համեմատ:
2. Տարանջատելիս օգտագործվում են սորբատների և ստացիոնար փուլի փոխազդեցության տարբեր տեսակներ՝ զուտ ֆիզիկականից մինչև քիմիզորբցիա։ Սա հնարավորություն է տալիս ընտրողաբար առանձնացնել նյութերի լայն տեսականի։
3. Առանձնացման ենթակա նյութերին կարող են պարտադրվել տարբեր լրացուցիչ դաշտեր (գրավիտացիոն, էլեկտրական, մագնիսական և այլն), որոնք, փոխելով տարանջատման պայմանները, ընդլայնում են քրոմատագրման հնարավորությունները։
4. Քրոմատոգրաֆիան հիբրիդային մեթոդ է, որը միավորում է մի քանի բաղադրիչների միաժամանակյա տարանջատումն ու որոշումը։
5. Քրոմատոգրաֆիան թույլ է տալիս լուծել ինչպես անալիտիկ խնդիրներ (տարանջատում, նույնականացում, որոշում), այնպես էլ նախապատրաստական (մաքրում, մեկուսացում, կենտրոնացում): Այս խնդիրների լուծումը կարելի է համատեղել՝ դրանք կատարելով «online» ռեժիմում:
6. Բազմաթիվ մեթոդներ դասակարգվում են ըստ փուլերի ագրեգացման վիճակի, տարանջատման մեխանիզմի և տարանջատման տեխնիկայի: Քրոմատոգրաֆիկ մեթոդները տարբերվում են նաև այն ձևով, թե ինչպես է տարանջատման գործընթացն իրականացվում ճակատային, տեղաշարժի և էլուենտի:
3. ԱՆԼԻԶԻ ՔՐՈՄԱՏՈԳՐԱՖԻԿԱԿԱՆ ՄԵԹՈԴՆԵՐԻ ԴԱՍԱԿԱՐԳՈՒՄԸ.
Քրոմատոգրաֆիկ մեթոդների դասակարգումը հիմնված է սկզբունքների վրա, որոնք հաշվի են առնում տարանջատման գործընթացի հետևյալ տարբեր առանձնահատկությունները.
* օգտագործվող քրոմատոգրաֆիկ համակարգի փուլերի ագրեգացման վիճակի տարբերություններ.
* տարանջատված նյութերի փոխազդեցության բնույթի տարբերություններ ստացիոնար փուլի հետ.
* Քրոմատոգրաֆիկ տարանջատման գործընթացի կատարման փորձնական տարբերություններ:
Աղյուսակներ 1–3-ը ցույց են տալիս հայտնի քրոմատոգրաֆիկ մեթոդների դասակարգման հիմնական տարբերակները:
Քանի որ տարբեր քրոմատոգրաֆիկ համակարգերի փուլերի հետ բաժանվող միացությունների փոխազդեցության բնույթը կարող է շատ տարբեր լինել, գրեթե չկան առարկաներ, որոնց տարանջատման համար հնարավոր չլինի գտնել հարմար անշարժ փուլ (պինդ կամ հեղուկ) և շարժական լուծիչների համակարգեր: Քրոմատագրության հիմնական տարբերակների կիրառման ոլորտները՝ կախված ուսումնասիրվող միացությունների մոլեկուլային քաշից, բերված են Աղյուսակում: 4.
4. ADSORPTION CHROMATOGRAPHY. ԲԱՐԱԿ ՇԵՐՏԱՅԻՆ ՔՐՈՄԱՏՈԳՐԱՖԻԱ
Ադսորբցիոն քրոմատոգրաֆիայի ամենատարածված մեթոդներից մեկը բարակ շերտի քրոմատոգրաֆիան (TLC) է՝ հարթ քրոմատոգրաֆիայի մի տեսակ, որում ադսորբենտն օգտագործվում է ափսեի վրա բարակ շերտի տեսքով:
TLC մեթոդի սկզբունքը և հիմնական հասկացությունները: Մաքուր հարթ մակերեսի վրա (ապակուց, մետաղից, պլաստմասից ափսե) այս կամ այն կերպ կիրառվում է սորբենտի բարակ շերտ, որն առավել հաճախ ամրացվում է ափսեի մակերեսին։ Ափսեի չափերը կարող են տարբեր լինել (երկարությունը և լայնությունը՝ 5-ից 50 սմ, չնայած դա անհրաժեշտ չէ): Ափսեի մակերեսին զգուշորեն, որպեսզի չվնասեք սորբենտ շերտը, նշեք (օրինակ՝ մատիտով) մեկնարկային գիծը (ափսեի ներքևի եզրից 2–3 սմ հեռավորության վրա) և ավարտի գիծը։ լուծիչից։
A և B բաղադրիչների տարանջատման սխեման TLC-ով
Նմուշը կիրառվում է ափսեի սկզբնական գծի վրա (միկրոներարկիչով, մազանոթով) - փոքր քանակությամբ հեղուկ, որը պարունակում է առանձնացվելիք նյութերի խառնուրդ, օրինակ՝ երկու A և B նյութեր համապատասխան լուծիչում: Լուծիչը թույլատրվում է գոլորշիացնել, որից հետո թիթեղը ընկղմվում է քրոմատոգրաֆիկ խցիկում PF-ի հեղուկ փուլի մեջ, որը լուծիչ է կամ լուծիչների խառնուրդ, որը հատուկ ընտրված է այս դեպքի համար: Մազանոթային ուժերի ազդեցությամբ PF-ն ինքնաբերաբար շարժվում է NF-ի երկայնքով մեկնարկային գծից մինչև լուծիչի ճակատային գիծ՝ իր հետ տանելով նմուշի A և B բաղադրիչները, որոնք շարժվում են տարբեր արագություններով: Քննարկվող դեպքում A բաղադրիչի հարաբերակցությունը NP-ի համար ավելի քիչ է, քան B բաղադրիչի նույն փուլի մերձեցումը, հետևաբար բաղադրիչ A-ն ավելի արագ է շարժվում, քան B բաղադրիչը: Այն բանից հետո, երբ շարժական փուլը (լուծիչը) հասնում է լուծիչների ճակատային գծին t ժամանակում: , քրոմատոգրաֆիան ընդհատվում է, թիթեղը հանվում է քրոմատոգրաֆիկ խցիկից և չորանում օդում և որոշում A և B նյութերի բծերի դիրքը թիթեղի մակերեսին։ Բծերը (գոտիները) սովորաբար ունենում են օվալաձև կամ կլոր ձև: Քննարկվող դեպքում A բաղադրիչի կետը մեկնարկային գծից տեղափոխվել է հեռավորություն լ Ա , բաղադրիչ B կետ - հեռավորության վրա լ IN, և լուծիչը ճանապարհ է անցել Լ.
Երբեմն, տարանջատվող նյութերի նմուշի կիրառման հետ միաժամանակ, սկզբնական գծի վրա կիրառվում են ստանդարտ նյութի փոքր քանակություններ, ինչպես նաև վկայող նյութեր (նրանք, որոնք ենթադրաբար պարունակվում են վերլուծված նմուշում):
Համակարգում առանձնացվելիք բաղադրիչները բնութագրելու համար ներկայացվում է շարժունակության գործակիցը Rf (կամ Rf գործակիցը).
Ռ զ=V 1 /Վ Ե= (լ 1 /t)/ (L/t)=l 1 /Լ ,
Որտեղ Վ 1 = լ 1 / տԵվ Վ Ե= Լ/ տ - ըստ շարժման արագության ես- րդ բաղադրիչ և լուծիչ E; լ 1 ԵվԼ - անցած ճանապարհը ես- m բաղադրիչը և լուծիչը, համապատասխանաբար, t-ն այն ժամանակն է, որն անհրաժեշտ է լուծիչը սկզբնական գծից լուծիչի ճակատային գիծ տեղափոխելու համար: Հեռավորություններ լ 1 հաշվել սկզբնական գծից մինչև համապատասխան բաղադրիչի կետի կենտրոն:
Սովորաբար շարժունակության գործակիցը գտնվում է միջակայքում Ռ զ =0 - 1. Օպտիմալ արժեքը 0,3-0,7 է:Քրոմատագրման պայմաններն ընտրված են այնպես, որ R f-ի արժեքը տարբերվի զրոյից և մեկից:
Շարժունակության գործակիցը սորբենտ-սորբատային համակարգի կարևոր հատկանիշն է։ Վերարտադրելի և խիստ կայուն քրոմատոգրաֆիկ պայմանների համար Ռ զ = հաստատ.
Rf շարժունակության գործակիցը կախված է մի շարք գործոններից՝ լուծիչի բնույթից և որակից, նրա մաքրությունից; սորբենտի բնույթն ու որակը (բարակ շերտ), դրա հատիկավորման միատեսակությունը, շերտի հաստությունը. սորբենտային ակտիվություն (դրա մեջ խոնավության պարունակություն); փորձարարական տեխնիկա (նմուշի կշիռներ, լուծիչների գործարկման L երկարություններ); փորձարարի հմտությունը և այլն: Գործնականում այս բոլոր պարամետրերի վերարտադրման կայունությունը երբեմն դժվար է: Գործընթացի պայմանների ազդեցությունը հարթելու համար ներդրվում է հարաբերական շարժունակության գործակիցը Rs.
Rs=l/l սբ=Ռ զ/Ռ զ( սբ ) ,
Որտեղ Ռ զ = լ/ Լ; Ռ զ (փ)= լ սբ/ Լ; լ սմ - հեռավորությունը մեկնարկային գծից մինչև ստանդարտ կետի կենտրոն:
Հարաբերական շարժունակության Rs գործակիցը նյութի շարժունակության ավելի օբյեկտիվ բնութագիր է, քան շարժունակության R f գործակիցը:
Որպես ստանդարտ, հաճախ ընտրվում է մի նյութ, որի համար տվյալ պայմաններում R f? 0.5. Ըստ քիմիական բնույթի՝ ստանդարտն ընտրվում է առանձնացվելիք նյութերին մոտ։ Ստանդարտի կիրառմամբ Rs-ի արժեքը սովորաբար գտնվում է Rs=0.1--10 միջակայքում, օպտիմալ սահմանները մոտ 0.5--2 են:
Առանձնացված բաղադրիչների առավել հուսալի նույնականացման համար օգտագործվում են «վկաներ»՝ ռեֆերենս նյութեր, որոնց առկայությունը ակնկալվում է վերլուծված նմուշում։ Եթե R f = R f (վկայական), որտեղ R f և R f (վկայական) համապատասխանաբար այս բաղադրիչի և վկայի շարժունակության գործակիցներն են, ապա ավելի հավանական է ենթադրել, որ վկա նյութը առկա է քրոմատագրվող խառնուրդում: .
Այս պայմաններում երկու A և B բաղադրիչների տարանջատումը բնութագրելու համար ներկայացվում է R (A / B) տարանջատման աստիճանը (չափանիշը).
R (A / B) \u003d D լ(=2D լ ,
որտեղ Դ լ- A և B բաղադրիչների բծերի կենտրոնների միջև հեռավորությունը. a(A) և a(B)-ը համապատասխանաբար քրոմատոգրամի վրա A և B կետերի տրամագծերն են:
Որքան մեծ է R-ի արժեքը (A/B), այնքան ավելի հստակ են բաժանվում A և B բաղադրիչների բծերը քրոմատոգրամի վրա:
Երկու A և B նյութերի տարանջատման ընտրողականությունը գնահատելու համար օգտագործվում է տարանջատման գործակիցը A:
ա=լԲ / լԱ.
Եթե a=1,ապա A և B բաղադրիչներն առանձնացված չեն:
A և B բաղադրիչների R (A/B) անջատման աստիճանը որոշելու համար:
4.1 Փորձարարական տեխնիկա բարակ շերտի քրոմատագրության մեջ.
Ա) Նմուշ դիմում. Վերլուծված հեղուկ նմուշը կիրառվում է մեկնարկային գծի վրա՝ օգտագործելով մազանոթ, միկրոներարկիչ, միկրոպիպետ՝ զգուշորեն դիպչելով սորբենտային շերտին (սկզբնական գծի կետի տրամագիծը սովորաբար մեկից մի քանի միլիմետր է): Եթե սկզբնական գծի վրա կիրառվում են մի քանի նմուշներ, ապա սկզբնական գծի վրա նմուշների բծերի միջև հեռավորությունը չպետք է լինի 2 սմ-ից պակաս, հնարավորության դեպքում օգտագործեք խտացված լուծույթներ: Բծերը չորանում են օդով, այնուհետև քրոմատագրվում:
բ) Քրոմատոգրամայի զարգացում (քրոմատոգրաֆիա):Գործընթացն իրականացվում է փակ քրոմատոգրաֆիկ խցերում՝ հագեցած լուծիչի գոլորշիներով, որոնք օգտագործվում են որպես PF, օրինակ՝ վերևում կափարիչով ծածկված ապակե տարայի մեջ։
Կախված ՊՖ-ի շարժման ուղղությունից՝ կան բարձրանալ, իջնել Եվ հորիզոնական քրոմատոգրաֆիա.
Աճող քրոմատագրության տարբերակում օգտագործվում են միայն սորբենտի ֆիքսված շերտով թիթեղներ։ PF-ն լցվում է խցիկի ներքևի մասում (որպես վերջինս կարող է օգտագործվել համապատասխան չափի ապակե բաժակ, ապակե կափարիչով), քրոմատոգրաֆիկ ափսեը տեղադրվում է ուղղահայաց կամ թեք խցիկի մեջ, որպեսզի PF շերտը ներքևի մասում լինի: խցիկը թրջում է ափսեի հատակը (սկիզբային գծից ~ 1,5 - 2 սմ-ով ներքև): PF-ն շարժվում է մազանոթային ուժերի ներքևից վերև (հակառակ ձգողականության ուժի) համեմատաբար դանդաղ:
Ներքև քրոմատագրությունը նույնպես օգտագործում է միայն ֆիքսված մահճակալի թիթեղները: PF-ը սնվում է վերևից և շարժվում ներքև ափսեի սորբենտ շերտի երկայնքով: Ձգողության ուժը արագացնում է PF-ի շարժումը: Այս տարբերակն իրականացվում է PF-ի հետ դանդաղ շարժվող բաղադրիչներ պարունակող խառնուրդների վերլուծության մեջ:
Հորիզոնական քրոմատոգրաֆիայի տարբերակում թիթեղը տեղադրվում է հորիզոնական: Կարող են օգտագործվել ուղղանկյուն կամ կլոր ափսեներ: Կլոր թիթեղներ օգտագործելիս (հորիզոնական քրոմատագրության շրջանաձև տարբերակ) մեկնարկային գիծը նշանակվում է որպես համապատասխան շառավղով շրջան (~1,5-2 սմ), որի վրա կիրառվում են նմուշներ: Կլոր ափսեի կենտրոնում անցք է կտրված, որի մեջ մտցված է վիթիք՝ PF-ն մատակարարելու համար: Վերջինս սորբենտ շերտի երկայնքով շարժվում է շրջանագծի կենտրոնից դեպի ծայրամաս։ Քրոմատոգրաֆիան իրականացվում է փակ խցիկում՝ չորացուցիչ կամ Պետրի ափսեի մեջ։ Շրջանաձև տարբերակով կարելի է միաժամանակ վերլուծել մինչև մի քանի տասնյակ նմուշ։
TLC մեթոդները օգտագործում են միաչափ, երկչափ, բազմակի (կրկնվող), փուլային քրոմատագրություն:
Մեկ քրոմատագրմամբ անալիզը կատարվում է առանց PF շարժման ուղղությունը փոխելու։ Այս մեթոդը ամենատարածվածն է:
Երկչափ քրոմատոգրաֆիան սովորաբար օգտագործվում է բարդ խառնուրդները (սպիտակուցներ, ամինաթթուներ և այլն) վերլուծելու համար: Նախ, խառնուրդի նախնական տարանջատումը կատարվում է առաջին PF 1-ի միջոցով: Քրոմատոգրամի վրա բծերը ստացվում են ոչ թե առանձին նյութերից, այլ մի քանի չբաժանված բաղադրիչների խառնուրդներից։ Այնուհետև այս բծերի միջով գծվում է նոր մեկնարկային գիծ, թիթեղը շրջվում է 90° և նորից քրոմատագրվում, բայց երկրորդ PF 2-ով, փորձելով վերջապես առանձնացնել խառնուրդների բծերը առանձին բաղադրիչների բծերի:
Եթե ափսեը քառակուսի է, ապա նմուշը կիրառվում է այս քառակուսու անկյունագծի վրա՝ նրա ստորին անկյունի մոտ: Երբեմն երկչափ քրոմատոգրաֆիան իրականացվում է նույն PF-ով քառակուսի ափսեի վրա։
Երկչափ քրոմատագրության սկզբունքը պատկերող սխեմա.
ա - PF1-ով ստացված քրոմատոգրամ;
b - քրոմատոգրամ, որը ստացվել է PF2-ով
Բազմակի (կրկնվող) քրոմատոգրաֆիայում պրոցեսն իրականացվում է մի քանի անգամ հաջորդաբար նույն PF-ով (յուրաքանչյուր անգամ հաջորդ չորացումից հետո), մինչև ստացվի խառնուրդի բաղադրիչների բծերի ցանկալի տարանջատումը (սովորաբար ոչ ավելի, քան երեք անգամ):
Փուլային քրոմատոգրաֆիայի դեպքում պրոցեսն իրականացվում է նույն թիթեղով հաջորդաբար՝ ամեն անգամ օգտագործելով նոր PF, մինչև ձեռք բերվի բծերի հստակ տարանջատում:
V) Քրոմատոգրամի մեկնաբանություն. Եթե քրոմատոգրամի վրա բծերը գունավոր են, ապա թիթեղները չորացնելուց հետո որոշվում է մեկնարկային գծից մինչև յուրաքանչյուր կետի կենտրոն հեռավորությունը և հաշվարկվում են շարժունակության գործակիցները։ Եթե վերլուծված նմուշի բաղադրությունը ներառում է անգույն նյութեր, որոնք տալիս են անգույն, այսինքն. քրոմատոգրամի վրա տեսողականորեն չբացահայտվող բծերը, անհրաժեշտ է իրականացնել հայտնաբերում այս բծերը, որոնց համար քրոմատոգրամներ դրսևորել.
Ստորև նկարագրված են հայտնաբերման ամենատարածված մեթոդները:
Ճառագայթում ուլտրամանուշակագույն լույսով.Այն օգտագործվում է լյումինեսցենտային միացություններ հայտնաբերելու համար (բծերը փայլում են, երբ թիթեղը ենթարկվում է ուլտրամանուշակագույն լույսի) կամ ոչ լյումինեսցենտ նյութեր, բայց օգտագործելով սորբենտ լյումինեսցենտային ցուցիչով (սորբենտը փայլում է, բծերը չեն փայլում): Այս կերպ, օրինակ, հայտնաբերվում են ալկալոիդներ, հակաբիոտիկներ, վիտամիններ և այլ բուժիչ նյութեր։
Ջերմային բուժում.Քրոմատոգրաֆիայից հետո քրոմատագրումից հետո չորացրած թիթեղը խնամքով տաքացվում է (մինչև ~200°C), որպեսզի խուսափեն սորբենտի շերտի մգացումից (օրինակ, երբ բարակ սորբենտ շերտը պարունակում է օսլա): Այս դեպքում բծերը սովորաբար հայտնվում են շագանակագույն գոտիների տեսքով (օրգանական բաղադրիչների մասնակի ջերմոլիզի պատճառով)։
Քիմիական մշակում.Քրոմատոգրամները հաճախ մշակվում են՝ մշակելով դրանք ռեակտիվներով, որոնք գունավոր միացություններ են կազմում բաժանվող խառնուրդի բաղադրիչներով: Այդ նպատակով օգտագործվում են տարբեր ռեակտիվներ՝ յոդի, ամոնիակի, բրոմի, ծծմբի երկօքսիդի, ջրածնի սուլֆիդի գոլորշիներ, հատուկ պատրաստված լուծույթներ, որոնցով մշակվում են թիթեղները։ Օգտագործվում են ինչպես ունիվերսալ, այնպես էլ ընտրովի ռեակտիվներ («ունիվերսալ» հասկացությունը բավականին կամայական է):
Ունիվերսալ ռեակտիվները կարող են լինել, օրինակ, կենտրոնացված ծծմբական թթու(տաքացման ժամանակ նկատվում է օրգանական միացությունների բծերի մգացում), կալիումի պերմանգանատի թթվային ջրային լուծույթ (սորբենտի մանուշակագույն ֆոնի վրա նկատվում են շագանակագույն բծեր), տաքացման ժամանակ ֆոսֆոր-մոլիբդաթթվի լուծույթ (կապույտ բծեր են հայտնվում): դեղին ֆոն) և այլն:
Որպես ընտրովի, օրինակ, օգտագործվում է Դրագենդորֆի ռեագենտը. Ցիմերմանի ռեագենտ; պղնձի սուլֆատի ջրային ամոնիակի լուծույթ (10% CuSO 4-ի համար, 2% ամոնիակի համար); նինհիդրին C 9 H 4 O 3 H 2 O էթանոլի և քացախաթթվի խառնուրդ:
Dragendorff ռեագենտը հիմնային բիսմուտ նիտրատի BiONO 3, կալիումի յոդիդ KJ-ի և քացախաթթվի լուծույթ է ջրի մեջ: Օգտագործվում է ամինների, ալկալոիդների, ստերոիդների որոշման համար։
Zimmermann ռեագենտը պատրաստվում է դինիտրոբենզոլի 2% էթանոլային լուծույթը մշակելով KOH ալկալային լուծույթով, որից հետո խառնուրդը տաքացնելով ~70–100°C ջերմաստիճանում: Օգտագործվում է ստերոիդների հայտնաբերման համար:
Նինհիդրինի օգնությամբ հայտնաբերվում են ամինների, ամինաթթուների, սպիտակուցների և այլ միացությունների բծեր։
Կիրառվում են նաև բծերի հայտնաբերման որոշ այլ մեթոդներ։ Օրինակ, դրանց ռադիոակտիվությունը չափվում է, եթե առանձնացված բաղադրիչներից մի քանիսը ռադիոակտիվ են, կամ ներմուծվում են խառնուրդի առանձնացված բաղադրիչների մաս կազմող տարրերի ռադիոակտիվ իզոտոպների հատուկ հավելումներ:
Քրոմատոգրամի վրա բծերը հայտնաբերելուց հետո դրանք նույնացվում են, այսինքն. որոշեք, թե որ միացությունը համապատասխանում է որոշակի կետին. Դրա համար առավել հաճախ օգտագործվում են «վկաների» տեղեկատու կետերը։ Երբեմն բծերը նույնացվում են շարժունակության R f գործակիցների արժեքով, դրանք համեմատելով տվյալ պայմանների համար հայտնի R f արժեքների հետ: Այնուամենայնիվ, նման նույնականացումը R f-ի արժեքով հաճախ նախնական է:
Լյումինեսցենտային բծերի գույնը նույնպես օգտագործվում է նույնականացման նպատակով, քանի որ տարբեր միացություններ տարբեր ալիքների երկարություններով (տարբեր գույներով) լյումինեսցում են:
Բծերի քիմիական հայտնաբերման ժամանակ սելեկտիվ ռեակտիվները որոշակի բնույթի միացություններով գունավոր բծեր են տալիս, որը նույնպես օգտագործվում է նույնականացման նպատակով։
Օգտագործելով TLC մեթոդը, կարելի է ոչ միայն հայտնաբերել, այլև քանակականացնել բաղադրիչների պարունակությունը խառնուրդներում: Դրա համար կա՛մ բծերն իրենք են վերլուծվում քրոմատոգրամայի վրա, կա՛մ առանձնացված բաղադրիչները այս կամ այն կերպ դուրս են հանվում քրոմատոգրամից (արդյունահանում, էլյուացիա համապատասխան լուծիչներով):
Բծերը վերլուծելիս ենթադրվում է, որ կա որոշակի հարաբերություն բծի տարածքի և տվյալ նյութի պարունակության միջև (օրինակ՝ համամասնական կամ գծային կախվածության առկայություն), որը հաստատվում է տրամաչափման գրաֆիկի կառուցմամբ։ չափելով «վկաների» բծերի տարածքները՝ վերլուծված բաղադրիչի հայտնի բովանդակությամբ ստանդարտներ:
Երբեմն համեմատվում է բծերի գույնի ինտենսիվությունը՝ ենթադրելով, որ բծի գույնի ինտենսիվությունը համաչափ է տվյալ գունավոր բաղադրիչի քանակին։ Գույնի ինտենսիվությունը չափելու համար օգտագործվում են տարբեր մեթոդներ.
Քրոմատոգրամից առանձնացված բաղադրիչները հանելիս ստացվում է այս բաղադրիչը պարունակող լուծույթ։ Այնուհետև վերջինս որոշվում է այս կամ այն վերլուծական մեթոդով:
TLC-ով նյութի քանակական որոշման հարաբերական սխալը 5-10% է:
TLC-ն դեղագրքի մեթոդ է և լայնորեն կիրառվում է տարբեր դեղամիջոցների վերլուծության և որակի վերահսկման համար:
5. ԳԱԶԱՅԻՆ ՔՐՈՄԱՏՈԳՐԱՖԻԱ
Գազային քրոմատագրությունը (GC) որպես շարժական փուլ օգտագործում է իներտ գազ (ազոտ, հելիում, ջրածին), որը կոչվում է կրող գազ։ Նմուշը սնվում է գոլորշիների տեսքով, ստացիոնար փուլը կա՛մ պինդ նյութ է՝ սորբենտ (գազի կլանման քրոմատոգրաֆիա) կամ պինդ կրիչի վրա բարակ շերտով նստած բարձր եռացող հեղուկ (գազահեղուկ քրոմատագրություն)։ Դիտարկենք գազահեղուկ քրոմատագրության (GLC) տարբերակը: Kieselguhr (դիատոմիտ) օգտագործվում է որպես կրող՝ մի տեսակ հիդրացված սիլիկա գել, այն հաճախ մշակվում է ռեակտիվներով, որոնք Si-OH խմբերը վերածում են Si-O-Si (CH 3) 3 խմբերի, ինչը մեծացնում է կրիչի իներտությունը։ հարգանք լուծիչների նկատմամբ. Դրանք են, օրինակ, «Chromosorb W» և «Gazochrome Q» կրիչները: Բացի այդ, օգտագործվում են ապակե միկրոփուչիկներ, տեֆլոն և այլ նյութեր։
5.1 Գազո- ադսորբցիոն քրոմատոգրաֆիա
Գազի կլանման քրոմատոգրաֆիայի (GAC) մեթոդի առանձնահատկությունն այն է, որ որպես անշարժ փուլ օգտագործվում են բարձր հատուկ մակերեսով (10-1000 մ 2 գ-1) ադսորբենտները, և որոշվում է նյութերի բաշխումը ստացիոնար և շարժական փուլերի միջև: կլանման գործընթացով: Մոլեկուլների կլանումը գազային փուլից, այսինքն. կենտրոնացած է պինդ և գազային փուլերի միջերեսում, առաջանում է միջմոլեկուլային փոխազդեցությունների պատճառով (ցրվածություն, կողմնորոշում, ինդուկցիա), որոնք ունեն էլեկտրաստատիկ բնույթ։ Թերևս, ջրածնային կապի ձևավորումը և այս տեսակի փոխազդեցության ներդրումը պահպանված ծավալներին զգալիորեն նվազում է ջերմաստիճանի բարձրացման հետ:
Վերլուծական պրակտիկայի համար կարևոր է, որ հաստատուն ջերմաստիճանում ներծծվող նյութի քանակը С մակերևույթի վրա համաչափ լինի այս նյութի կոնցենտրացիային գազային փուլում С m.
Գ ս = կկ մ (1)
դրանք. այնպես, որ բաշխումը տեղի ունենա գծային կլանման իզոթերմի համաձայն (դեպի -- մշտական): Այս դեպքում յուրաքանչյուր բաղադրիչ շարժվում է սյունակի երկայնքով հաստատուն արագությամբ՝ անկախ դրա կոնցենտրացիայից: Նյութերի տարանջատումը պայմանավորված է նրանց շարժման տարբեր արագությամբ։ Ուստի ԳԱԿ-ում չափազանց կարևոր է ներծծող նյութի ընտրությունը, որի մակերեսը և բնույթը որոշում են ընտրողականությունը (տարանջատումը) տվյալ ջերմաստիճանում։
Ջերմաստիճանի բարձրացման հետ կլանման ջերմությունը նվազում է: DH/T, որից կախված է պահպանումը, և, համապատասխանաբար, տ Ռ . Սա օգտագործվում է վերլուծության պրակտիկայում: Եթե միացությունները առանձնացվեն, որոնք մեծապես տարբերվում են անկայունությամբ հաստատուն ջերմաստիճանում, ապա ցածր եռացող նյութերն արագ կլանում են, բարձր եռացող նյութերն ունեն ավելի երկար պահման ժամանակ, դրանց գագաթները քրոմատոգրամում ավելի ցածր և լայն կլինեն, և վերլուծությունը երկար ժամանակ է պահանջում: . Եթե, այնուամենայնիվ, քրոմատոգրաֆիայի ընթացքում սյունակի ջերմաստիճանը բարձրացվի հաստատուն արագությամբ (ջերմաստիճանի ծրագրավորում), ապա քրոմատոգրամի վրա լայնությամբ մոտ գագաթները հավասարաչափ կբաշխվեն:
Ակտիվ ածխածինները, սիլիցիումի գելերը, ծակոտկեն ապակին և ալյումինի օքսիդը հիմնականում օգտագործվում են որպես HAC-ի կլանիչներ: Ակտիվ ադսորբենտների մակերեսի անհամասեռությունը պատասխանատու է GAC մեթոդի հիմնական թերությունների և ուժեղ կլանված բևեռային մոլեկուլների որոշման անհնարինության համար: Այնուամենայնիվ, հնարավոր է վերլուծել բարձր բևեռային նյութերի խառնուրդները երկրաչափական և քիմիապես միատարր մակրածակոտային կլանիչների վրա: Վերջին տարիներին արտադրվել են քիչ թե շատ միատարր մակերեսով ադսորբենտներ, ինչպիսիք են ծակոտկեն պոլիմերները, մակրոծակոտկեն սիլիցիումի գելերը (սիլոքրոմ, փորասիլ, սֆերոսիլ), ծակոտկեն ապակիներ, ցեոլիտներ։
Գազի ադսորբցիոն քրոմատոգրաֆիայի ամենատարածված մեթոդը գազերի և ցածր եռացող ածխաջրածինների խառնուրդների վերլուծությունն է, որոնք չեն պարունակում ակտիվ ֆունկցիոնալ խմբեր: Նման մոլեկուլների ադսորբցիոն իզոթերմները մոտ են գծային։ Օրինակ՝ O 2 , N 2 , CO, CH 4 , CO 2 կավը բաժանելու համար հաջողությամբ օգտագործվում է։ Սյունակի ջերմաստիճանը ծրագրված է նվազեցնել վերլուծության ժամանակը` նվազեցնելով բարձր եռացող գազերի t R-ը: Մոլեկուլային մաղերի վրա՝ բարձր ծակոտկեն բնական կամ սինթետիկ բյուրեղային նյութեր, որոնց բոլոր ծակոտիները մոտավորապես նույն չափի են (0,4 - 1,5 նմ), ջրածնի իզոտոպները կարելի է առանձնացնել։ Պորապակ կոչվող սորբենտները օգտագործվում են մետաղների հիդրիդների (Ge, As, Sn, Sb) առանձնացնելու համար։ GAC մեթոդը ծակոտկեն պոլիմերային սորբենտներով կամ ածխածնային մոլեկուլային մաղերով սյուների վրա ամենաարագ և ամենահարմար միջոցն է ջրի որոշման անօրգանական և օրգանական նյութերում, ինչպիսիք են լուծիչները:
5.2 Գազո- հեղուկ քրոմատոգրաֆիա
Անալիտիկ պրակտիկայում ավելի հաճախ օգտագործվում է գազահեղուկ քրոմատագրման մեթոդը (GLC): Դա պայմանավորված է հեղուկ ստացիոնար փուլերի ծայրահեղ բազմազանությամբ, ինչը հեշտացնում է տվյալ վերլուծության համար ընտրովի փուլի ընտրությունը, գծային բաշխման իզոթերմով ավելի լայն կոնցենտրացիայի տիրույթում, ինչը թույլ է տալիս աշխատել մեծ նմուշների հետ և հեշտությամբ ստանալ վերարտադրվող սյուներ: արդյունավետության առումով։
Բաղադրիչների բաշխման մեխանիզմը կրիչի և անշարժ հեղուկի փուլի միջև հիմնված է դրանց լուծարման վրա հեղուկ փուլում: Ընտրողականությունը կախված է երկու գործոնից՝ անալիտի գոլորշու ճնշումից և հեղուկ փուլում նրա ակտիվության գործակիցից: Համաձայն Ռաուլի օրենքի՝ տարրալուծվելիս՝ նյութի գոլորշու ճնշումը լուծույթի վրա էջ ես ուղիղ համեմատական է իր ակտիվության գործակցի g մոլային բաժինին Ն եսՄաքուր նյութի լուծույթի և գոլորշու ճնշման մեջ R° եստվյալ ջերմաստիճանում.
p i = N i R ° I (2)
Քանի որ i-րդ բաղադրիչի կոնցենտրացիան հավասարակշռության գոլորշիների փուլում որոշվում է նրա մասնակի ճնշմամբ, կարող ենք ենթադրել, որ.
P i ~ c m , and N i ~ c s ապա
և ընտրողականության գործակիցը.
Այսպիսով, որքան ցածր է նյութի եռման կետը (որքան մեծ է P 0 i), այնքան ավելի թույլ է այն պահպանվում քրոմատոգրաֆիկ սյունակում։
Եթե նյութերի եռման կետերը նույնն են, ապա դրանք առանձնացնելու համար օգտագործվում են անշարժ հեղուկ փուլի հետ փոխազդեցության տարբերությունները. որքան ուժեղ է փոխազդեցությունը, այնքան ցածր է ակտիվության գործակիցը և այնքան մեծ է պահպանումը:
Ստացիոնար հեղուկ փուլեր . Սյունակի ընտրողականությունն ապահովելու համար կարևոր է ընտրել ճիշտ ստացիոնար հեղուկ փուլը: Այս փուլը պետք է լինի լավ լուծիչխառնուրդի բաղադրիչների համար (եթե լուծելիությունը ցածր է, բաղադրիչները շատ արագ հեռանում են սյունից), ոչ ցնդող (այնպես, որ այն չի գոլորշիանում սյունակի աշխատանքային ջերմաստիճանում), քիմիապես իներտ, պետք է ունենա ցածր մածուցիկություն ( հակառակ դեպքում դիֆուզիոն գործընթացը դանդաղում է) և, երբ կիրառվում է կրիչի վրա, ձևավորում է միատեսակ թաղանթ, որը ամուր կապված է նրա հետ: Այս նմուշի բաղադրիչների համար անշարժ փուլի բաժանարար հզորությունը պետք է լինի առավելագույնը:
Կան երեք տեսակի հեղուկ փուլեր՝ ոչ բևեռային (հագեցած ածխաջրածիններ և այլն), չափավոր բևեռային (էսթերներ, նիտրիլներ և այլն) և բևեռային (պոլիգլիկոլներ, հիդրօքսիլամիններ և այլն)։
Իմանալով անշարժ հեղուկ փուլի հատկությունները և տարանջատվող նյութերի բնույթը, օրինակ՝ դասը, կառուցվածքը, հնարավոր է արագ ընտրել ընտրովի հեղուկ փուլ, որը հարմար է տվյալ խառնուրդն առանձնացնելու համար։ Այս դեպքում պետք է հաշվի առնել, որ բաղադրիչների պահպանման ժամանակը ընդունելի կլինի վերլուծության համար, եթե ստացիոնար փուլի և վերլուծված նմուշի նյութի բևեռականությունները մոտ են: Մոտ բևեռականություն ունեցող լուծույթների դեպքում էլյուցիայի կարգը սովորաբար փոխկապակցված է եռման կետերի հետ, և եթե ջերմաստիճանի տարբերությունը բավականաչափ մեծ է, հնարավոր է ամբողջական տարանջատում: Տարբեր բևեռականության մոտ եռացող նյութերը առանձնացնելու համար օգտագործվում է անշարժ փուլ, որն ընտրողաբար պահպանում է մեկ կամ մի քանի բաղադրիչ՝ դիպոլ-դիպոլ փոխազդեցության պատճառով։ Քանի որ հեղուկ փուլի բևեռականությունը մեծանում է, բևեռային միացությունների պահպանման ժամանակը մեծանում է:
Հեղուկ փուլի միասնական կիրառման համար պինդ կրիչի վրա այն խառնվում է բարձր ցնդող լուծիչի հետ, ինչպիսին է եթերն է: Այս լուծույթին ավելացվում է պինդ կրիչ: Խառնուրդը տաքացվում է, լուծիչը գոլորշիանում է, հեղուկ փուլը մնում է հենարանի վրա։ Չոր կրիչը, որն այսպիսով պատված է ստացիոնար հեղուկ փուլով, լցվում է սյունակում՝ հոգալով խուսափելով դատարկությունների ձևավորումից: Միատեսակ փաթեթավորման համար սյունակի միջով անցնում է գազի շիթ, և միևնույն ժամանակ սյունը հպվում է փաթեթավորումը կնքելու համար: Այնուհետև, նախքան դետեկտորին միանալը, սյունը ջեռուցվում է մինչև 50 ° C ջերմաստիճանի բարձր ջերմաստիճան, որի դեպքում այն պետք է օգտագործվի: Այս դեպքում կարող են լինել հեղուկ փուլի կորուստներ, սակայն սյունակը մտնում է կայուն աշխատանքային ռեժիմ:
Անշարժ հեղուկ փուլերի կրիչներ. Անշարժ հեղուկի փուլը համասեռ բարակ թաղանթի տեսքով ցրելու համար պինդ կրիչները պետք է լինեն մեխանիկորեն ամուր՝ չափավոր հատուկ մակերեսով (20 մ 2/գ), փոքր և միատեսակ մասնիկների չափով, ինչպես նաև բավականաչափ իներտ լինեն՝ թույլ տալու համար կլանումը պինդ-գազային միջերես. փուլերընվազագույն էր: Ամենացածր կլանումը նկատվում է սիլանացված քրոմոսորբի, ապակե ուլունքների և ֆտորապակի (ֆտորածխածնային պոլիմեր) կրողների վրա: Բացի այդ, պինդ կրիչները չպետք է արձագանքեն ջերմաստիճանի բարձրացմանը և պետք է հեշտությամբ թրջվեն հեղուկ փուլով: Քելատների գազային քրոմատագրության մեջ որպես պինդ կրիչ առավել հաճախ օգտագործվում են սիլանացված սպիտակ դիատոմիտ կրիչներ, դիատոմիտ սիլիցիում կամ քիզելգուր։ Դիատոմային երկիրը միկրո-ամորֆ, ջուր պարունակող սիլիցիում է: Նման կրիչներն են քրոմոսորբ W, գազային քրոմ Q, քրոմատոն N և այլն: Բացի այդ, օգտագործվում են ապակե ուլունքներ և տեֆլոն:
Քիմիական կապով փուլեր. Հաճախ օգտագործվում են փոփոխված կրիչներ՝ կովալենտորեն կապված հեղուկ փուլին։ Այս դեպքում անշարժ հեղուկ փուլը ավելի ամուր է պահվում մակերեսի վրա նույնիսկ ամենաբարձր սյունակի ջերմաստիճանում: Օրինակ, դիատոմային հողակիրը մշակվում է քլորոսիլանով երկար շղթայի փոխարինողով, որն ունի որոշակի բևեռականություն: Քիմիական կապով անշարժ փուլն ավելի արդյունավետ է:
6. ԲԱՇԽՄԱՆ ՔՐՈՄԱՏՈԳՐԱՖԻԱ. ԹԱՂԹԻ ՔՐՈՄԱՏՈԳՐԱՖԻԱ (ԹԱՂԹԻ ՔՐՈՄԱՏՈԳՐԱՖԻԱ)
Բաժանման քրոմատոգրաֆիան հիմնված է բաժանված նյութի լուծելիության տարբերությունների օգտագործման վրա երկու շփվող չխառնվող հեղուկ փուլերում: Երկու փուլերը՝ PF և NF, հեղուկ փուլեր են: Երբ հեղուկ PF-ն շարժվում է հեղուկ NF-ի երկայնքով, քրոմատագրված նյութերը շարունակաբար վերաբաշխվում են երկու հեղուկ փուլերի միջև:
Բաժանման քրոմատոգրաֆիան է թղթե քրոմատոգրաֆիկա (կամ քրոմատագրություն թղթի վրա) իր սովորական տեսքով: Այս մեթոդով TLC-ում օգտագործվող սորբենտի բարակ շերտով թիթեղների փոխարեն օգտագործվում է հատուկ քրոմատոգրաֆիկ թուղթ, որի երկայնքով, ներծծելով այն, հեղուկ PF-ն քրոմատագրման ընթացքում շարժվում է սկզբնական գծից մինչև լուծիչի ավարտի գիծ:
Տարբերել նորմալ փուլ և հակադարձ փուլ թղթային քրոմատոգրաֆիա.
Տարբերակում նորմալ փուլ Թղթային քրոմատոգրաֆիայի հեղուկ NF-ն ջուր է, որը ներծծվում է մանրաթելերի վրա բարակ շերտի տեսքով և գտնվում է ծակոտիներում: հիդրոֆիլ թուղթ (ըստ կշռի մինչև 25%): Այս կապակցված ջուրն իր կառուցվածքով և ֆիզիկական վիճակով շատ է տարբերվում սովորական հեղուկ ջրից։ Նրանում լուծվում են առանձնացված խառնուրդների բաղադրիչները։
Թղթի վրայով շարժվող PF-ի դերը խաղում է մեկ այլ հեղուկ փուլ, օրինակ՝ օրգանական հեղուկ՝ թթուների և ջրի ավելացումով։ Քրոմատագրումից առաջ հեղուկ օրգանական PF-ն հագեցած է ջրով, որպեսզի PF-ն չլուծի հիդրոֆիլ քրոմատոգրաֆիական թղթի մանրաթելերի վրա ներծծված ջուրը:
Քրոմատոգրաֆիկ թուղթը արտադրվում է արդյունաբերության կողմից։ Այն պետք է համապատասխանի մի շարք պահանջների. այն պետք է պատրաստված լինի բարձրորակ թելքավոր բամբակի սորտերից, լինի միատեսակ խտությամբ և հաստությամբ, մանրաթելերի կողմնորոշման ուղղությամբ, քիմիապես մաքուր և իներտ NF-ի և տարանջատվող բաղադրիչների նկատմամբ:
Նորմալ փուլային տարբերակում որպես PF առավել հաճախ օգտագործվում են տարբեր լուծիչներից կազմված հեղուկ խառնուրդներ: Նման PF-ի դասական օրինակ է քացախաթթվի, n-բուտանոլի և ջրի խառնուրդը 1:4:5 ծավալային հարաբերակցությամբ: Օգտագործվում են նաև այնպիսի լուծիչներ, ինչպիսիք են էթիլացետատը, քլորոֆորմը, բենզոլը և այլն։
Տարբերակում հակադարձ փուլ Թղթային քրոմատագրության մեջ հեղուկ NF-ը օրգանական լուծիչ է, մինչդեռ հեղուկ PF-ն ջուր է, ջրային կամ ալկոհոլային լուծույթներ և թթուների խառնուրդներ սպիրտների հետ։ Գործընթացն իրականացվում է օգտագործելով հիդրոֆոբ քրոմատոգրաֆիկ թուղթ. Ստացվում է թուղթը նաֆթալինով, սիլիկոնային յուղերով, պարաֆինով և այլն մշակելով (ներծծելով): Ոչ բևեռային և ցածր բևեռային օրգանական լուծիչները ներծծվում են հիդրոֆոբ թղթի մանրաթելերի վրա և թափանցում նրա ծակոտիները՝ ձևավորելով հեղուկ NF-ի բարակ շերտ: Նման թղթի վրա ջուրը չի պահվում և այն չի թրջում։
Թղթային քրոմատագրման տեխնիկան ընդհանուր առմամբ նույնն է, ինչ TLC մեթոդով: Սովորաբար, վերլուծված լուծույթի մի կաթսա, որը պարունակում է առանձնացվելիք նյութերի խառնուրդ, կիրառվում է սկզբնական գծում գտնվող քրոմատոգրաֆիկ թղթի շերտի վրա: Լուծիչի գոլորշիացումից հետո սկզբնական գծի տակ գտնվող թուղթը ընկղմվում է PF-ի մեջ՝ թերթը դնելով ուղղահայաց (կախելով այն): Փակեք խցիկը կափարիչով և կատարեք քրոմատոգրաֆիա, մինչև PF-ն հասնի թղթի վրա նշված լուծիչի ճակատային գծին: Դրանից հետո գործընթացը ընդհատվում է, թուղթը չորանում է օդում, հայտնաբերվում են բծեր և հայտնաբերվում են խառնուրդի բաղադրիչները։
Թղթային քրոմատոգրաֆիան, ինչպես TLC մեթոդը, օգտագործվում է ինչպես որակական, այնպես էլ քանակական վերլուծության մեջ:
Խառնուրդի որոշակի բաղադրիչի պարունակությունը քանակականացնելու համար օգտագործվում են տարբեր մեթոդներ.
1) դրանք բխում են տեղում գտնվող նյութի քանակի և կետի տարածքի միջև որոշակի հարաբերությունների առկայությունից (համամասնական, գծային) (հաճախ նախապես կառուցվում է տրամաչափման գրաֆիկ).
2) կշռել կտրված տեղը նույն տարածքի նյութով և մաքուր թղթով, այնուհետև գտնել տարբերությամբ որոշվող նյութի զանգվածը.
3) հաշվի առնել բծի գույնի ինտենսիվության և դրանում առկա բծին գույն տվող որոշված բաղադրիչի պարունակության հարաբերությունը.
Որոշ դեպքերում բծերում պարունակվող նյութերը արդյունահանվում են որոշ լուծիչով, իսկ հետո քաղվածքը վերլուծվում։
Թղթային քրոմատոգրաֆիան դեղաբանական մեթոդ է, որն օգտագործվում է ինչպես անօրգանական, այնպես էլ օրգանական նյութեր պարունակող խառնուրդները առանձնացնելու համար։ Մեթոդը հասանելի է, հեշտ կատարվող, բայց ընդհանուր առմամբ այն զիջում է ավելի ժամանակակից TLC մեթոդին, որն օգտագործում է սորբենտի բարակ շերտ։
7. Նստվածքի քրոմատոգրաֆիա
Նստվածքային քրոմատոգրաֆիան հիմնականում օգտագործվում է խառնուրդներում անօրգանական իոնների տարանջատման և նույնականացման համար։
Մեթոդի էությունը. Նստվածքային քրոմատոգրաֆիան հիմնված է խառնուրդի տարանջատված բաղադրիչների նստեցման քիմիական ռեակցիաների օգտագործման վրա, որը NF-ի մի մասն է կազմում: Տարանջատումն իրականացվում է ստացված միացությունների անհավասար լուծելիության պատճառով, որոնք շարժական փուլով տեղափոխվում են տարբեր արագություններով՝ ՊՖ-ից ավելի քիչ լուծվող նյութեր են տեղափոխվում ավելի դանդաղ, քան ավելի լուծվողները։
Մեթոդի կիրառումը կարելի է ցույց տալ վերլուծված ջրային լուծույթում միաժամանակ պարունակվող հալոգենային իոնների՝ Cl-ի, բրոմիդի իոնների, Br-ի և յոդիդի իոնների բաժանման օրինակով: Դա անելու համար օգտագործեք քրոմատոգրաֆիկ սյունակ (որը ներքևում ծորակով ապակե խողովակ է), որը լցված է սորբենտով: Վերջինս բաղկացած է դրանց միջավայրից՝ ալյումինի օքսիդ Al 2 O 3 կամ սիլիցիում SiO 2 ներծծված արծաթի նիտրատի AgNO 3 լուծույթով (արծաթի նիտրատի պարունակությունը կազմում է սորբենտի կրիչի զանգվածի մոտ 10%-ը)։
Ջրային լուծույթը, որը պարունակում է տարանջատման ենթակա անիոնների խառնուրդ, անցնում է քրոմատոգրաֆիկ սյունակով: Այս անիոնները փոխազդում են Ag + արծաթի կատիոնների հետ՝ ձևավորելով արծաթի հալոգենիդների քիչ լուծվող նստվածքներ.
Ag + + I - > AgIv (դեղին)
Ag + + Br - > AgBrv (սերուցք)
Ag + + Cl - > AgClv (սպիտակ)
Արծաթի հալոգենիդների լուծելիությունը ջրի մեջ աճում է հետևյալ հաջորդականությամբ.
Agl (K ° \u003d 8.3 * 10 -17)< АgВг (К° = 5,3*10 -13) < AgCl (K°= 1,78*10 -10),
որտեղ սենյակային ջերմաստիճանում լուծելիության արտադրանքի արժեքները տրված են փակագծերում: Հետևաբար, սկզբում կառաջանա արծաթի յոդիդի դեղին նստվածք, քանի որ քրոմատոգրամի վրա ամենաքիչ լուծվողը կնկատվի դեղին (վերին) գոտի: Այնուհետև ձևավորվում է կրեմի գույնի արծաթե բրոմիդի նստվածքային գոտի (միջանկյալ գոտի): Վերջապես, ձևավորվում է արծաթի քլորիդի սպիտակ նստվածք՝ ստորին սպիտակ գոտի, որը մթնում է լույսի ներքո արծաթի քլորիդի ֆոտոքիմիական տարրալուծման հետևանքով նուրբ ցրված մետաղական արծաթի արտազատմամբ:
Արդյունքը առաջնային նստվածքային քրոմատոգրամա է:
Գոտիների ավելի հստակ տարանջատման համար առաջնային քրոմատոգրամը ստանալուց հետո սյունակի միջով անցնում է մաքուր լուծիչ, մինչև ստացվի երկրորդային նստվածքային քրոմատոգրամ՝ տեղումների գոտիների հստակ տարանջատմամբ։
Նկարագրված օրինակում նստեցնողը NF-ի մի մասն էր, և սյունակի միջով անցավ լուծույթ, որը պարունակում էր առանձնացվելիք իոնների խառնուրդ: Ընդհակառակը, հնարավոր է նստեցնող նյութի լուծույթն անցնել այն սյունով, որի NF-ում գտնվում են քրոմատագրման ենթակա իոնները։ Այս դեպքում, սակայն, ձեւավորվում են խառը գոտիներ։
Cl-, Br- և I- իոնների տարանջատման սխեման քրոմատոգրաֆիկ սյունակում նստվածքային քրոմատագրման միջոցով:
7.1 Նստվածքի քրոմատագրման մեթոդների դասակարգումն ըստ փորձարարական տեխնիկայի
Ես սովորաբար տարբերում եմ սյունաձևնստվածքային քրոմատագրություն, որն իրականացվում է քրոմատոգրաֆիկ սյունակներում, և հարթնստվածքային քրոմատոգրաֆիա՝ իրականացված թղթի վրա կամ սորբենտի բարակ շերտով։
Որպես սորբենտներ նստվածքային քրոմատագրության մեջ, օգտագործվում են իներտ կրիչների խառնուրդներ նստեցնող նյութով. սորբենտներ, որոնք կուտակում են իոնների (իոնափոխանակման խեժեր) կամ մոլեկուլների (ակտիվացված ածխածին) տեսքով. թուղթ՝ ներծծված նստվածքային լուծույթով:
Առավել հաճախ ընտրված կրիչներն են սիլիկատային գելը, օսլան, ալյումինի, կալցիումի, բարիումի սուլֆատի օքսիդները, իոնափոխանակման խեժերը և այլն։ Կրողն օգտագործվում է մանր ցրված վիճակում մոտ 0,02-0,10 մմ մասնիկի չափով:
Որպես նստեցնող նյութեր, օգտագործվում են այնպիսի ռեակտիվներ, որոնք քրոմատոգրաֆիկ իոնների հետ կազմում են քիչ լուծվող նստվածքներ, օրինակ՝ նատրիումի յոդիդ NaI, նատրիումի սուլֆիդ Na 2 S, արծաթի սուլֆատ Ag 2 SO 4, կալիումի ֆերոցիանիդ K 4, օքսիկինոլին, պիրիդին և այլն։
Սովորաբար նստվածքային սյունակային քրոմատագրության մեթոդը կիրառելիս մաքուր լուծիչը սյունակի միջով անցնելուց հետո ստացվում են հստակ առանձնացված գոտիներ, որոնցից յուրաքանչյուրը պարունակում է միայն մեկ բաղադրիչ (այն դեպքում, երբ նստվածքների լուծելիությունը տարբերվում է առնվազն երեք անգամ): . Մեթոդն ունի արդյունքների լավ վերարտադրելիություն:
Անգույն նստվածքների առաջացման դեպքում քրոմատոգրամը մշակվում է կա՛մ սյունակի միջով մշակող լուծույթ անցնելու միջոցով, որը գունավոր ռեակցիայի արտադրանք է տալիս նստվածքներով, կա՛մ անմիջապես մշակողին PF կամ NF ներմուծելով:
7.2 Նստվածքի քրոմատագրություն թղթի վրա
Եկեք դիտարկենք այս մեթոդի էությունը պղնձի կատիոնների խառնուրդ պարունակող ջրային լուծույթի վերլուծության օրինակով Cu 2+? երկաթ Fe 3+ և ալյումին Al 3+։
Թղթի թերթիկի կենտրոնում, որը ներծծված է նստեցնող նյութի՝ կալիումի ֆերոցիանիդի K 4 լուծույթով, վերլուծված ջրային լուծույթը կիրառվում է մազանոթով: Պղնձի իոնները Cu 2+ և երկաթի Fe 2+ փոխազդում են ֆերոցիանիդի իոնների հետ՝ ձևավորելով քիչ լուծվող նստվածքներ.
2Cu 2+ + 4- > Cu 2 (շագանակագույն)
4Fe 3+ + 3 4->Fe4 (կապույտ)
Քանի որ պղնձի (II) ֆերոցիանիդը ավելի քիչ լուծելի է, քան երկաթը (III) ֆերոցիանիդի, պղնձի (II) ֆերոցիանիդի նստվածքը սկզբում նստեցվում է՝ ձևավորելով կենտրոնական շագանակագույն գոտի։ Այնուհետև ձևավորվում է երկաթի (III) ֆերոցիանիդի կապույտ նստվածք՝ տալով կապույտ գոտի։ Ալյումինի իոնները գաղթում են դեպի ծայրամաս՝ տալով անգույն գոտի, քանի որ դրանք չեն առաջացնում գունավոր ալյումինի ֆերոցյանիդ։
Cu2+, Fe3+ և Al3+-ի տարանջատման սխեման նստվածքային քրոմատագրմամբ.
Այս կերպ ստացվում է առաջնային քրոմատոգրամա, որում տեղումների գոտիները մասամբ համընկնում են։
Այնուհետեւ ստացվում է երկրորդական քրոմատոգրամա։ Դրա համար համապատասխան լուծիչ (այս դեպքում՝ ամոնիակի ջրային լուծույթ) մազանոթով կիրառվում է առաջնային քրոմատոգրամի կենտրոն։ Լուծիչը ինքնաբերաբար շարժվում է թղթի կենտրոնից դեպի ծայրամաս՝ իր հետ տանելով նստվածքները, որոնք շարժվում են տարբեր արագություններով. ավելի լուծվող երկաթի ֆերոցիանիդի նստվածքի գոտին ավելի արագ է շարժվում, քան պակաս լուծվող պղնձի ֆերոցիանիդի նստվածքի գոտին։ Այս փուլում գոտիների շարժման արագությունների տարբերության պատճառով դրանք ավելի հստակ տարանջատված են։
Անգույն ծայրամասային գոտի կազմող ալյումինի իոնները բացելու համար ցուցադրվում է երկրորդական քրոմատոգրամը. Ստացեք արտաքին վարդագույն օղակը:
8. ԻՈՆՆԵՐԻ ՓՈԽԱՆԱԿՄԱՆ ՔՐՈՄԱՏՈԳՐԱՖԻԱ
Իոնափոխանակման քրոմատագրության մեջ խառնուրդի բաղադրիչների տարանջատումը կատարվում է սորբենտի իոնային խմբերի հետ իոնացնող նյութերի հետադարձելի փոխազդեցության շնորհիվ։ Սորբենտի էլեկտրական չեզոքության պահպանումն ապահովվում է մակերևույթին մոտ գտնվող իոնային փոխանակման ընդունակ հակաիոնների առկայությամբ: Ներդրված նմուշի իոնը, փոխազդելով սորբենտի ֆիքսված լիցքի հետ, փոխանակվում է հակաիոնի հետ։ Ֆիքսված լիցքի համար տարբեր կապեր ունեցող նյութերն առանձնացվում են անիոնափոխանակիչներով կամ կատիոնափոխանակիչներով: Անիոնափոխանակիչներն ունեն մակերեսի վրա դրական լիցքավորված խմբեր և անիոններ են սորբում շարժական փուլից: Կատիոնափոխանակիչները համապատասխանաբար պարունակում են կատիոնների հետ փոխազդող բացասական լիցքով խմբեր։
Որպես շարժական փուլ, օգտագործվում են թթուների, հիմքերի և լուծիչների աղերի ջրային լուծույթներ, ինչպիսիք են հեղուկ ամոնիակը, այսինքն. լուծողական համակարգեր, որոնք ունեն բարձր դիէլեկտրական հաստատուն և միացությունների իոնացման ուժեղ միտում: Սովորաբար նրանք աշխատում են բուֆերային լուծույթներով, որոնք թույլ են տալիս կարգավորել pH արժեքը:
Քրոմատոգրաֆիկ տարանջատման ժամանակ անալիտի իոնները մրցակցում են էլուենտում պարունակվող իոնների հետ՝ ձգտելով փոխազդել սորբենտի հակառակ լիցքավորված խմբերի հետ։ Սրանից հետևում է, որ իոնափոխանակման քրոմատոգրաֆիան կարող է օգտագործվել ցանկացած միացություն առանձնացնելու համար, որոնք կարող են ցանկացած ձևով իոնացվել։ Բորատ իոնի հետ հնարավոր է վերլուծել նույնիսկ չեզոք շաքարի մոլեկուլները իրենց բարդույթների տեսքով։
Իոնափոխանակման քրոմատոգրաֆիան անփոխարինելի է բարձր բևեռային նյութերի տարանջատման համար, որոնք հնարավոր չէ վերլուծել GLC-ով առանց ածանցյալների վերածելու: Այս միացությունները ներառում են ամինաթթուներ, պեպտիդներ, շաքարներ:
Իոնափոխանակման քրոմատոգրաֆիան լայնորեն կիրառվում է բժշկության, կենսաբանության, կենսաքիմիայի մեջ՝ վերահսկելու համար միջավայրըարյան և մեզի մեջ դեղերի և դրանց մետաբոլիտների, սննդային հումքի թունաքիմիկատների պարունակության վերլուծության, ինչպես նաև անօրգանական միացությունների, այդ թվում՝ ռադիոիզոտոպների, լանթանիդների, ակտինիդների տարանջատման համար: Կենսապոլիմերների (սպիտակուցներ, նուկլեինաթթուներ) վերլուծություն և այլն), որոնց համար սովորաբար ծախսվում են ժամեր կամ օրեր, իոնափոխանակման քրոմատոգրաֆիայի կիրառմամբ իրականացվում է 20-40 րոպեում՝ ավելի լավ տարանջատմամբ։ Կենսաբանության մեջ իոնափոխանակման քրոմատոգրաֆիայի օգտագործումը հնարավորություն է տվել նմուշները դիտարկել անմիջապես կենսաբանական միջավայրում՝ նվազեցնելով վերադասավորման կամ իզոմերացման հնարավորությունը, ինչը կարող է հանգեցնել վերջնական արդյունքի սխալ մեկնաբանության: Հետաքրքիր է օգտագործել այս մեթոդը կենսաբանական հեղուկների փոփոխությունները վերահսկելու համար: Սիլիկա գելի հիման վրա ծակոտկեն թույլ անիոնափոխանակիչների օգտագործումը հնարավորություն է տվել առանձնացնել պեպտիդները։ Իոնների փոխանակման մեխանիզմը կարող է ներկայացվել հետևյալ հավասարումների տեսքով.
անիոնների փոխանակման համար X - + R + Y - - Y - + R + X -
կատիոնների փոխանակման համար X + + R - Y + - Y + + R - X +
Առաջին դեպքում նմուշի իոն X-ը մրցում է շարժական փուլի Y-ի հետ՝ իոնափոխանակիչի R+ կենտրոնների համար, իսկ երկրորդ դեպքում X+ նմուշի կատիոնները մրցակցության մեջ են մտնում շարժական փուլային իոնների հետ։ Y + R - իոնային կենտրոնների համար:
Բնականաբար, նմուշային իոնները, որոնք թույլ են փոխազդում իոնափոխանակիչի հետ, թույլ կպահվեն սյունակի վրա այս մրցակցության ընթացքում և առաջինը կհեռացվեն դրանից, և, ընդհակառակը, ավելի ուժեղ պահված իոնները վերջինը կթափվեն սյունակից: Սովորաբար, ոչ իոնային բնույթի երկրորդական փոխազդեցությունները տեղի են ունենում մատրիցայի ոչ իոնային մասի հետ նմուշի կլանման կամ ջրածնային կապի կամ շարժական փուլում նմուշի սահմանափակ լուծելիության պատճառով:
Հատուկ նյութերի բաժանումը հիմնականում կախված է ամենահարմար սորբենտի և շարժական փուլի ընտրությունից: Որպես իոնափոխանակման քրոմատագրության անշարժ փուլեր, օգտագործվում են իոնափոխանակման խեժեր և սիլիցիումի գելեր՝ պատվաստված իոնոգեն խմբերով։
Պոլիստիրոլային իոնափոխանակիչ խեժերը HPLC-ի համար 10 մկմ կամ պակաս հատիկի չափով ունեն ընտրողականություն և կայունություն, սակայն դրանց ցանցային կառուցվածքը, որը բնութագրվում է ցանցային հանգույցների միջև 1,5 նմ հեռավորությամբ, ինչը շատ ավելի փոքր է, քան սիլիկա գելի ծակոտիների չափը: ադսորբցիոն քրոմատոգրաֆիան (10 նմ), դանդաղեցնում է զանգվածի փոխանցումը և, հետևաբար, զգալիորեն նվազեցնում է արդյունավետությունը: HPLC-ում օգտագործվող իոնափոխանակման խեժերը հիմնականում ստիրոլի և դիվինիլբենզոլի համապոլիմերներն են: Սովորաբար ավելացնում են վերջինիս 8-12%-ը։ Որքան մեծ է դիվինիլբենզոլի պարունակությունը, այնքան մեծ է պոլիմերի կոշտությունն ու ամրությունը, այնքան բարձր է տարողությունը և, որպես կանոն, ընտրողականությունը, և այնքան ցածր է այտուցը։
Նմանատիպ փաստաթղթեր
Քրոմատագրման գործընթացի ընդհանուր բնութագրերը. Բարակաշերտ քրոմատագրության ֆիզիկաքիմիական հիմքերը, անալիզի մեթոդների դասակարգումը. Քրոմատոգրաֆիայի տարբերակները ըստ փուլային վիճակների. Սննդի որակի վերահսկում TLC մեթոդով, սարքավորումներ.
կուրսային աշխատանք, ավելացվել է 27.12.2009թ
Երևույթներ, որոնք տեղի են ունենում քրոմատոգրաֆիայի ընթացքում. Բացատրության երկու մոտեցումներ են տեսական թիթեղների տեսությունը և կինետիկ տեսությունը: Գազային, հեղուկ, թղթային քրոմատոգրաֆիա: իոնների փոխանակման մեթոդ. Իոնափոխանակման քրոմատագրության կիրառությունները. Գելային քրոմատոգրաֆիա.
վերացական, ավելացվել է 24.01.2009թ
Պոլիմերային սորբենտների հայեցակարգը և կառուցվածքը, դրանց ստեղծման և զարգացման պատմությունը, դրանց նշանակությունը բաժանման քրոմատագրման գործընթացում: Պոլիմերային սորբենտների տեսակները, դրանց կիրառման հնարավորությունները չափերի բացառման քրոմատագրության մեջ. Կոշտ գելերի օգտագործման առանձնահատկությունները.
վերացական, ավելացվել է 01/07/2010 թ
Քրոմատոգրաֆիայի առաջացումը և զարգացումը. Քրոմատագրական մեթոդների դասակարգում. Քրոմատոգրաֆիա պինդ ստացիոնար փուլի վրա՝ գազ, հեղուկ (հեղուկ ադսորբցիա): Քրոմատոգրաֆիա հեղուկ ստացիոնար փուլի վրա՝ գազահեղուկ և գելային քրոմատագրություն։
վերացական, ավելացվել է 05/01/2009 թ
Քրոմատոգրաֆիայի մեթոդի էությունը, զարգացման պատմությունը և տեսակները. Քրոմատոգրաֆիայի, նյութերի խառնուրդների քրոմատոգրաֆիկ տարանջատման և վերլուծության սարքերի կամ կայանքների կիրառման ոլորտները: Գազային քրոմատոգրաֆի սխեման, նրա հիմնական համակարգերը և աշխատանքի սկզբունքը:
վերացական, ավելացվել է 25.09.2010թ
Հակադարձ գազային քրոմատոգրաֆիայի մեթոդի հիմունքները. Գազային քրոմատոգրաֆիան բարդ խառնուրդների որակական և քանակական վերլուծության ունիվերսալ մեթոդ է և առանձին բաղադրիչներ մաքուր ձևով ստանալու մեթոդ: Հակադարձ գազային քրոմատոգրաֆիայի կիրառում.
կուրսային աշխատանք, ավելացվել է 09.01.2010թ
Իոն-զույգ քրոմատագրության էությունը և բովանդակությունը, դրա օգտագործումը հեղուկ քրոմատագրության և արդյունահանման համար կենսաբանական հեղուկներից օրգանական փուլ դեղերի և դրանց մետաբոլիտների արդյունահանման համար: Իոն-զույգ քրոմատագրության տարբերակներ, տարբերակիչ հատկանիշներ.
վերացական, ավելացվել է 01/07/2010 թ
Գազային քրոմատոգրաֆիան ֆիզիկաքիմիական հետազոտության ամենախոստումնալից մեթոդներից է, որն այժմ արագ զարգանում է։ Քրոմատագրական մեթոդների դասակարգում. Գործընթացի տարբեր բնութագրական առանձնահատկություններ. Քրոմատոգրաֆիայի մեթոդների էությունը.
վերացական, ավելացվել է 25.01.2010 թ
Բարձր արդյունավետության հեղուկ քրոմատագրության (HPLC) էությունը որպես բարդ կեղտերի վերլուծության և տարանջատման մեթոդ: Սորբենտներ, կոորդինատիվ հագեցած քելատներ; Հակառակ փուլային քրոմատոգրաֆիայի պայմաններում լիգանդի կառուցվածքի ազդեցության օրինաչափությունները քելատների վարքագծի վրա:
վերացական, ավելացվել է 10.11.2011թ
Չափերի բացառման մեթոդի հայեցակարգը և գործընթացի հիմնական փուլերը, դրա հիմնարար առանձնահատկությունն ու շրջանակը, սորտերը և դրանց տարբերակիչ առանձնահատկությունները: Չափերի բացառման քրոմատոգրաֆիայի գործընթացում օգտագործվող սարքավորումների բնութագրերը.
սղագրություն
1 Պատմվածքհեղուկ քրոմատագրության զարգացում Քրոմատոգրաֆիան հայտնաբերել է Մ.Ս. Ցվետը 1903 թվականին հեղուկ-ադսորբցիոն սյունակի մեթոդի տեսքով։ Այս մեթոդում օգտագործվել են մկմ-ից ավելի հատիկի չափով ադսորբենտներ, լուծիչը (լուծիչը) ձգողականության պատճառով անցել է սյունակով, հոսքի դետեկտորներ չեն եղել: Տարանջատումն ընթացավ դանդաղ, մի քանի ժամվա ընթացքում, և այս ռեժիմում հեղուկ քրոմատոգրաֆիան չի կարող օգտագործվել վերլուծական նպատակներով: Տարիներին տարբեր երկրների մասնագետների ջանքերն ուղղված են եղել էքսպրես հեղուկ քրոմատոգրաֆիայի ստեղծմանը։ Պարզ էր, որ տարանջատման արագությունը բարձրացնելու համար անհրաժեշտ էր կրճատել արտաքին և ներքին դիֆուզիայի ուղիները։ Դրան կարելի է հասնել՝ նվազեցնելով ներծծող հատիկների տրամագիծը: Սյուները բարակ հատիկներով (5-10 մկմ) լցնելը ստեղծեց մուտքի բարձր ճնշում, որը պահանջում էր բարձր ճնշման պոմպերի օգտագործում։ Ահա թե ինչպես է ծնվել բարձր ճնշման հեղուկ քրոմատոգրաֆիան։ Նուրբ ֆրակցիայի ադսորբենտներին անցնելով, սյուների արդյունավետությունը մեծապես բարձրացավ, հետևաբար, ժամանակակից էքսպրես անալիտիկ հեղուկ քրոմատոգրաֆիան կոչվեց բարձր արդյունավետության հեղուկ քրոմատագրություն (HPLC): Ապահովված է կոշտ մանրահատիկ կլանիչների (5 կամ 10 միկրոն), բարձր ճնշման պոմպերի (ավելի քան 200 ատմ) և հոսքի դետեկտորների ստեղծումը։ բարձր կատարողական HPLC. Տարանջատման ժամանակներով այն ոչնչով չէր զիջում գազային քրոմատագրությանը, իսկ կիրառման ոլորտներով զգալիորեն գերազանցում էր նրան։ Ներկայումս HPLC-ն առաջատար դիրք է զբաղեցնում քրոմատագրման այլ մեթոդների շարքում՝ ինչպես արտադրված սարքավորումների ծավալով (տարեկան ավելի քան 2 միլիարդ դոլար արժողությամբ քրոմատոգրաֆներ), այնպես էլ հրապարակումների քանակով (տարեկան 5-6 հազար հրապարակում): . Ժամանակակից HPLC-ն իրականացվում է տարբեր տարբերակներով: Այս տարբերակները թույլ են տալիս տարանջատել մոլեկուլների տարբեր խառնուրդներ (ներառյալ բոլոր տեսակի իզոմերների խառնուրդները); սինթետիկ և կենսապոլիմերների մակրոմոլեկուլներ (ներառյալ վիրուսներ և մինչև մի քանի միլիոն զանգված ունեցող մոլեկուլներ); իոններ և կայուն ռադիկալներ: HPLC-ի դերը մեծ է նաև գիտության և արտադրության այնպիսի կենսական ոլորտներում, ինչպիսիք են կենսաբանությունը, կենսատեխնոլոգիան, սննդի արդյունաբերությունը, բժշկությունը, դեղագործությունը, դատաբժշկական փորձաքննությունը, շրջակա միջավայրի աղտոտվածության վերահսկումը և այլն: HPLC-ն գլխավոր դերերից է խաղացել մարդու գենոմի վերծանման գործում: , վերջին շրջանում տարիներ շարունակ հաջողությամբ լուծում է պրոտեոմիկայի խնդիրները։
2 HPLC տարբերակ օգտագործված վերջին տասնամյակում Ընտրանքներ Հակադարձ փուլ Նորմալ փուլ իոնային իոն-զույգ Իոնափոխանակիչ Բացառող գել-ֆիլտրում Լիգանդի փոխանակում Chiral Affinity Իմունային միցելյար հիդրոֆոբ Արծաթ հակադարձ փուլ Հեղուկ-հեղուկ արդյունահանում Donor-liquid Concurrent Concurrent Options Շարժվող մահճակալի բարձր ջերմաստիճանի թաղանթ HPLC-ի տեսություն Քրոմատոգրաֆիկ գործընթաց. պահպանում, զտում, տարանջատում Քրոմատոգրաֆիկ սյունը հասարակ կլանիչով լցված խողովակ է, որի միջով լուծիչը անընդհատ հոսում է: Ադսորբենտը (սորբենտ, սյունակ լցնող) սյունակում պահվում է զտիչներով, անշարժ է և հետևաբար կոչվում է անշարժ փուլ։ Սորբենտի նկատմամբ շարժվող լուծիչը կոչվում է շարժական փուլ (որոշ դեպքերում՝ էլուենտ)։ Սյունակի երկայնքով շարժվելիս նյութի մոլեկուլները (սորբատները) ցրվում են սորբենտի ծակոտիների ներսում և այս կամ այն տեսակի միջմոլեկուլային փոխազդեցությունների արդյունքում ներծծվում են ստացիոնար փուլի մակերեսին։ Ժամանակը, որի ընթացքում մոլեկուլները գտնվում են կլանված վիճակում, որոշվում է սորբատների միջմոլեկուլային փոխազդեցության ուժով սորբենտի հետ։ Շատ թույլ կլանման դեպքում մոլեկուլները գրեթե ամբողջ ժամանակն անցկացնում են ներսում
Շարժական փուլի լուծումը և, հետևաբար, շարժական փուլի արագությունից մի փոքր զիջող արագությամբ շարժվել սյունակի ներքև: Ընդհակառակը, շատ ուժեղ կլանման դեպքում մոլեկուլները գրեթե չեն հեռանում մակերեսից, և սյունակի երկայնքով դրանց շարժման արագությունը աննշան է: Քրոմատագրության տեսանկյունից ավելի մեծ հետաքրքրություն են ներկայացնում այնպիսի պայմանները, որոնց դեպքում կլանման ուժը միջանկյալ է, և սյունակի միջով սորբատների շարժման արագությունը 2-10 անգամ ցածր է շարժական փուլի շարժման արագությունից: Քրոմատագրության մեջ շարժական փուլի շարժման համեմատ մոլեկուլների դանդաղ շարժման ֆենոմենը կոչվում է պահպանում։ Եթե նյութերի կլանման հաստատունները տարբեր են, ապա սյունակի երկայնքով նրանց միջին արագությունը նույնպես տարբեր կլինի։ Այսպիսով, ձեռք է բերվում տարանջատման քրոմատագրության հիմնական նպատակը. Բնականաբար, գործնականում միայնակ մոլեկուլներ չեն ներմուծվում սյունակում: Եթե սյունակ են ներմուծվում տարբեր տեսակի առնվազն մի քանի մոլեկուլներ, ապա սորբատի մոլեկուլների շարժման միջին արագությունները դեռ տարբեր են։ Բացի այդ, յուրաքանչյուր տեսակի առանձին մոլեկուլների շարժման արագությունները այս կամ այն ուղղությամբ շեղվում են այս տեսակի միջին արժեքից: Սորբատի մոլեկուլները, որոնք սկզբում մտցվել են սյունակի մեջ ակնթարթային իմպուլսի տեսքով, թողնում են այն ավելի լայն գոտում: Նույնական մոլեկուլների շարժման արագությունների նման անհամապատասխանությունը քրոմատագրության մեջ կոչվում է քսում: Այս անցանկալի երեւույթը հանգեցնում է նրան, որ մի նյութի մոլեկուլների մեջ կարող են լինել նաև մյուսի մոլեկուլներ, որոնց արագությունը մոտ է առաջինի ամենաարագ մոլեկուլների արագությանը։ Արդյունքում, նյութերի գոտիները կարող են մասամբ համընկնել միմյանց հետ, և տարանջատումը կլինի թերի: Պահպանման և լղոզման գործընթացները քրոմատագրության տեսության առարկան են։ Որոշ հիմնական տերմիններ և սահմանումներ Քրոմատոգրամը կոր է, որը ցույց է տալիս շարժական փուլային հոսքով սյունակից դուրս եկող միացությունների կոնցենտրացիան՝ որպես բաժանման սկզբից սկսած ժամանակի ֆունկցիա:
4 Քրոմատոգրամը սովորաբար բաղկացած է ելակետից և գագաթներից: Քրոմատոգրաֆիկ սարքերում, որպես կանոն, շարժական փուլում նյութի կոնցենտրացիայի ուղղակի չափում չկա, այլ հատուկ դետեկտորային միավորի օգնությամբ ցանկացած ֆիզիկական մեծություն, որը ֆունկցիոնալորեն կապված է կոնցենտրացիայի հետ (էլեկտրահաղորդականություն, օպտիկական խտություն): և այլն) չափվում է։ Ելակետային գիծը համապատասխանում է այն ժամանակահատվածին, որի ընթացքում դետեկտորը գրանցում է միայն շարժական փուլի ազդանշանը: Պիկ կորը, որն իդեալականորեն մոտենում է Գաուսի բաշխման կորին, նկարագրում է սյունակի ելքի վրա կոնցենտրացիայի աստիճանական աճը և դրա հետագա նվազումը: Այն ժամանակը, երբ առավելագույն գագաթնակետը հայտնվում է քրոմատոգրամի վրա, կոչվում է պահպանման ժամանակ (t R): Մշտական աշխատանքային պայմաններում և քրոմատոգրաֆիկ համակարգի փուլերի բաղադրության պայմաններում պահման ժամանակը հաստատուն արժեք է տվյալ նյութի համար: Երբեմն քրոմատոգրամայի սկզբնական մասում գրանցվում է գագաթնակետ, որի բնույթը կապված է նմուշի ներարկման ժամանակ սյունակում կարճատև անհավասարակշռության հետ: Այս գագաթնակետը համապատասխանում է ոչ կլանվող նյութի պահպանման ժամանակին (t 0): Նյութերի երկու բաժանելի գագաթների համեմատական թերմոդինամիկական բնութագրումը տալիս է հարաբերական պահպանում կամ ընտրողականություն: Այս արժեքը ցույց է տալիս տվյալ քրոմատոգրաֆիկ համակարգի ունակությունը՝ առանձնացնել տվյալ զույգ նյութերը: Պահպանման ժամանակները և դրանցից ստացված բոլոր քանակությունները, ըստ էության, գործընթացի թերմոդինամիկական բնութագրերն են: Այնուամենայնիվ, արդյունքը որոշվում է ջերմադինամիկ և կինետիկ գործոնների համակցված ազդեցությամբ: Եթե տվյալ կազմի քրոմատոգրաֆիկ համակարգում ժամը
Տվյալ ջերմաստիճանում t R-ի արժեքները երկու նյութերի համար նույնն են (կամ =1.0), ապա սյունակի երկրաչափության ոչ մի փոփոխություն չի հանգեցնի այս զույգի բաժանմանը: Բայց, մյուս կողմից, t R-ի արժեքների տարբերությունը ինքնաբերաբար չի նշանակում, որ բաժանումը, և առավել ևս լավը, ձեռք կբերվի: Դա անելու համար օգտագործվող սյունը պետք է ունենա բավականաչափ բարձր կինետիկ բնութագրեր: Սորբում-դեզորբցման գործողությունները պետք է կատարվեն մեծ արագությամբ, որպեսզի իրագործվի տարանջատման պոտենցիալը, որը նշվում է t R-ի տարբերությամբ: Գործընթացի հիմնական կինետիկ բնութագիրը h բարձրությունն է, որը համարժեք է տեսական ափսեին (HETP): ) Այս արժեքը համապատասխանում է սորբենտային շերտի բարձրությանը, որի անցման ընթացքում ներծծում-դեզորբցման ակտը տեղի է ունենում միջինը մեկ անգամ։ Այն հիմնականում արտացոլում է օգտագործվող սորբենտի որակը, սյունակի լցման որակը և քրոմատագրման ռեժիմի ճիշտ ընտրությունը: Սյունակի որակը գնահատելու համար օգտագործվում է տեսական թիթեղների թվի փոխադարձությունը N։Տեսական թիթեղների թիվը սյունակի արդյունավետության չափանիշն է։ Քրոմատոգրաֆիկ գոտիների լղոզում Տարանջատվող խառնուրդը սյունակի մեջ մտցվում է նեղ զարկերակի տեսքով, և դրա ծավալը սյունակի ծավալի համեմատությամբ կարող է անտեսվել: Երբ տարանջատվող նյութերի մոլեկուլները շարժվում են շարժական փուլի հոսքի հետ, զարկերակն աստիճանաբար ընդլայնվում է, մինչդեռ նրանում առանձնացվելիք նյութերի կոնցենտրացիան նվազում է։ հիմնական պատճառըԱյս գործընթացում այն է, որ առանձին մոլեկուլների սյունակի երկայնքով շարժման արագությունը տարբերվում է այս միացությանը բնորոշ միջին արագությունից: Տարբեր տեսակի մոլեկուլների տարանջատման քրոմատոգրաֆիկ գործընթացի վերջնական օգտակար արդյունքի տեսանկյունից գոտիների տարածումը խիստ անցանկալի է առնվազն հետևյալ պատճառներով. Նախ, ինտենսիվ էրոզիան հանգեցնում է տարբեր միացությունների գոտիների մասնակի համընկնմանը և, հետևաբար, անհրաժեշտ է ավելի խիստ պահանջներ դնել համակարգի ընտրողականության նկատմամբ: Ավելին, եթե նույնիսկ այս կամ այն դեպքում հնարավոր է ապահովել ընտրողականության բարձրացում, ընդհանուր բաժանարար հզորությունը ցածր է: Կեղտոտման մեկ այլ բացասական հետևանք է սորբատի կոնցենտրացիայի նվազումը գոտու կենտրոնում, ինչը հանգեցնում է վերլուծության զգայունության նվազմանը: Էրոզիայի պրոցեսների ինտենսիվության չափանիշը տեսական թիթեղին համարժեք բարձրությունն է: h-ի արժեքը որոշվում է մի շարք կոնկրետ գործընթացներով: 1) շարժական փուլի հոսքի անհամասեռություն. Սյունակում սորբենտը ձևավորում է ալիքների համակարգ, որի միջոցով հոսում է շարժական փուլը: Որքան նուրբ են սորբենտ մասնիկները, այնքան ավելի մոտ են միմյանց շարժական փուլային մոլեկուլների ուղու երկարությունը, այնքան փոքր է սյունակի միջով անցնող մի գոտու մոլեկուլների ժամանակի տարբերությունը, և այնքան քիչ է գոտին լղոզվում:
6 2) Մոլեկուլային դիֆուզիոն շարժական և անշարժ փուլերում. Որքան մեծ է հոսքի արագությունը, այնքան քիչ մշուշում է այս պատճառով: 3) Զանգվածի փոխանցման արագությունը կլանման կամ իոնափոխանակման ժամանակն է: Որքան մեծ է հոսքի արագությունը, այնքան ավելի մեծ է մշուշումը այս պատճառով: Ակնհայտ է, որ h-ը նվազեցնելու համար անհրաժեշտ է օգտագործել ավելի փոքր տրամագծով սորբենտ մասնիկներ։ Ցավոք, այս ճանապարհը կարող է օգտագործվել միայն մինչև որոշակի սահմանաչափ, որը թելադրված է տեխնիկական նկատառումներով։ Սյունակում ճնշման անկումը կապված է գործընթացի այլ պարամետրերի հետ հետևյալ հարաբերակցությամբ. որտեղ r-ը հոսքի դիմադրության պարամետրն է, p-ն ճնշման անկումն է, U-ը հոսքի արագությունն է, L-ը սյունակի երկարությունն է, և d-ն՝ չափը: սորբենտ մասնիկներ. Ճնշման բարձրացման դեպքում սարքավորումների արժեքը և բարդությունը կտրուկ աճում են: Հետեւաբար, HPLC d p = 3-10 մկմ: Արդյունավետությունը բարձրացնելու համար նախընտրելի են ավելի քիչ մածուցիկ լուծիչներ, քանի որ դրանք ունեն ավելի բարձր դիֆուզիոն գործակից և ցածր սյունակի դիմադրություն: HPLC-ում մինչ այժմ քիչ թե շատ ավարտված է քրոմատոգրաֆիկ գոտիների քսելու տեսությունը։ Այս տեսության զարգացումը հնարավորություն տվեց գործնականում գիտակցել տեսականին մոտ սյուների արդյունավետությունը։ Այսպիսով, 3 մկմ-ից պակաս հատիկի տրամագծով սորբենտներ օգտագործելիս ստացվել է արդյունավետություն մինչև տեսական թիթեղներ սյունակի երկարության մեկ մետրի համար: Քրոմատագրիչների մեծ ուշադրություն է դարձվում տարանջատման ընտրողականության ուսումնասիրություններին։ HPLC-ում, ի տարբերություն գազային քրոմատագրության, ընտրողականությունը որոշվում է ինչպես սորբենտի, այնպես էլ էլուենտի բնույթով: Շարունակվում են աշխատանքները նյութ-լուծիչ փոխազդեցության ուսումնասիրման ուղղությամբ, որը փոխկապակցված է ազատ էներգիասորբցիա. HPLC տեսության թեժ թեմաներն են տարանջատման գործընթացի համակարգչային օպտիմիզացումը: Ինչպես նշվեց վերևում, քրոմատոգրաֆիստների հիմնական ջանքերը ներկայումս կենտրոնացած են տարանջատման ընտրողականության խնդիրների տեսական ուսումնասիրության վրա: Կան տասնյակ հրապարակումներ մոլեկուլների կառուցվածքի և դրանց պահպանման փոխհարաբերությունների ուսումնասիրության վերաբերյալ տարբեր քիմիական բնույթի սորբենտների և բազմաչափ քրոմատագրության մեջ։ Տարանջատման ընտրողականությունը բարելավելու համար, ինչպես գազային քրոմատոգրաֆիայում, այնպես էլ HPLC-ում, ստերիկ գործոնը լայնորեն օգտագործվում է, երբ իզոմերների ընտրովի տարանջատման համար օգտագործվում են ցիկլոդեքստրիններ, պսակային եթերներ և հեղուկ բյուրեղներ:
7 Օպտիկական իզոմերների տարանջատման տեսության ձեռքբերումները, ինչպես գազային, այնպես էլ հեղուկ քրոմատագրության մեջ, տպավորիչ են։ Արդյունքները ստացվում են հայտնաբերման մակարդակում՝ ցույց տալով օպտիկական իզոմերների տարանջատման հնարավորությունը երկու կետերում կոնտակտների վրա (ակիրալ ադսորբենտի մակերեսը կարող է ծառայել որպես շփման երրորդ կետ): Կրիտիկական պայմաններում պոլիմերային քրոմատագրության տեսության զարգացումը հաջողությամբ շարունակվում է։ Առաջընթաց է արձանագրվել քրոմատոգրաֆիկ պահպանման պարամետրերի և մոլեկուլների կենսաբանական և քիմիական ակտիվության միջև կապի հաստատման հարցում: Սա հատկապես խոստումնալից է դեղագործական արդյունաբերության համար, երբ փնտրում են նոր տեսակի դեղեր: Վերջին տարիներին աճում է հետաքրքրությունը HPLC-ում տարանջատման ողջ գործընթացի վրա ջերմաստիճանի ազդեցության խնդրի նկատմամբ: Առաջարկվել է բարձր ջերմաստիճանի HPLC, և այս մեթոդով ջերմաստիճանի ծրագրավորման սարքավորումները մշակվում են: Տարանջատման օպտիմիզացման աշխատանքները՝ միաժամանակ փոփոխելով էլուենտի ջերմաստիճանը և ուժը, խոստումնալից է թվում: Սյունակի երկայնքով կիրառվող էլեկտրական դաշտի ազդեցությունը կորտիկոստերոիդների պահպանման և էրոզիայի վրա ծակոտկեն ածխածնային ներծծող սյուների վրա, ինչպես նաև մագնիսական դաշտի ազդեցությունը պոլիտետրաֆտորէթիլենով պատված մագնիսական մասնիկներով լցված սյուների վրա պահելու վրա. ուսումնասիրված. Սորբենտներ HPLC-ի համար Սորբենտների լայն տեսականի մշակվել և արտադրվել է HPLC-ի համար: Ամբողջ աշխարհում մոտ 100 ֆիրմաներ արտադրում են ավելի քան 300 տեսակի սորբենտներ։ Այնուամենայնիվ, իրական տեսականին շատ ավելի նեղ է, քանի որ շատ ընկերությունների սորբենտները մակերեսի քիմիական բնույթով նույնական են և տարբերվում են միայն անուններով: Տարբեր սորբենտների վրա HPLC-ի տարբեր մեթոդների կիրառման հարաբերական տեսակարար կշիռը Քրոմատագրման մեթոդ/տեսակ Սորբենտ օգտագործողների տոկոսը հակադարձ փուլ 50.4 Սիլիկոնային գել պատվաստված խմբերով С С 8 15.9 Ֆենիլ 7.1 С 4 2.3 С 1 -С 2 1.1
8 Normal-phase 24.1 Silica gel պատվաստված խմբերով CN- 8.9 Silica gel 8.5 MN 2-4.7 Diol 2 Ion-փոխանակիչ և իոնային 14 Անիոններ 7.4 Կատիոններ 6.6 Բացառիկ 6.7 Ջրային 3.5 Ոչ-ջրային 3.5 Ոչ ջրային 2.111 Այլ Հիֆոբիկ. սովորաբար օգտագործվում են մաքուր սիլիցիումի գելեր և սիլիկատային գելեր՝ պատվաստված ոչ բևեռային և բևեռային խմբերով: Մշակվել և շարունակում են մշակվել ալյումինի, ցիրկոնիումի, տիտանի և այլն օքսիդների հիման վրա սորբենտներ, որոնց տեսակարար կշիռը HPLC-ում տարբեր սորբենտների կիրառման մասնաբաժինը հետևյալն է. , ցելյուլոզա և այլն) 20%, ծակոտկեն ածխածնի սորբենտներ, տիտանի օքսիդ, ցիրկոնիումի օքսիդ 4%, ալյումինի օքսիդ 1%։ Անալիտիկ պրակտիկայում առավել մեծ կիրառություն է գտնում հակափուլային քրոմատոգրաֆիան (ավելի քան 70%), օգտագործելով սիլիկագել պատվաստված С18 և С8 ալկիլ խմբերով: Չնայած լայն կիրառմանը, այս սորբենտներն ունեն մի շարք թերություններ, որոնցից հիմնականը անբավարար քիմիական կայունությունն է: pH-ում< 3 происходит гидролиз связи =Si О Si=, а при рн >10 սիլիկա գելի հիմքը լուծվում է, հատկապես բարձր ջերմաստիճանում: Այս սորբենտները ոչ ընտրովի են բևեռային միացությունների և իզոմերների տարանջատման հարցում: Հիմնական բնույթի նյութերը, որպես կանոն, արտանետվում են անհամաչափ գագաթների տեսքով՝ մնացորդային հիդրօքսիլ խմբերի հետ փոխազդեցության պատճառով։ Սիլիկա գելի նյութերի հատկությունները մեծապես կախված են սիլիկա գելի մաքրությունից, երկրաչափական և քիմիական բնույթից, ալկիլ խմբերի պատվաստման եղանակից և այլն: Վերջին տարիներին ակտիվորեն իրականացվել են հետազոտություններ՝ վերացնելու այդ թերությունները: Նախ և առաջ զգալիորեն բարելավվել է սկզբնական սիլիցիումի գելերի արտադրությունը, ինչը հնարավորություն է տվել վերարտադրելիորեն ստանալ աննշան պարունակությամբ գնդաձև մասնիկներ.
9 ծանր մետաղներ. Հիդրօքսիլային խմբերի ամբողջական կապը սիլիկա գելի մակերեսի վրա երբեք չի ստացվում: Հիդրօքսիլային մնացորդային խմբերը հանգեցնում են անցանկալի փոխազդեցությունների և փոքր բևեռային մոլեկուլներից կազմված միացությունների ոչ սիմետրիկ գագաթների: Մնացորդային սիլանոլների ազդեցությունը վերացնելու համար առաջարկվել է դրանք փակել (արգելափակել) ավելի մեծածավալ իզոպրոպիլային կամ իզոբուտիլային խմբերով։ Նման սորբենտի օրինակ է Zorbax Stable Bond-ը։ Bidentate փոխարինիչներ օգտագործվում են նաև, երբ երկու հարևան ալկիլային շղթաները կապված են սիլիցիումի ատոմների հետ 3-4 մեթիլեն խմբերի միջոցով: Այս «կամուրջը» փակում է մնացորդային հիդրօքսիլային խմբերը, և նման փուլերը կայուն են նույնիսկ բարձր pH-ի դեպքում:< 12 (Zorbax Extend-С18). Силикагели со средними размерами пор, 80, 100, 120 Å, применяют для разделения низкомолекулярных соединений, силикагели с порами 300 Å и более для разделения макробиомолекул. Как известно, поверхность белковой глобулы богата гидрофильными аминокислотами, но в то же время содержит немало (до половины от их общего содержания) гидрофобных остатков, нередко образующих скопления (" гроздья"). Такие гидрофобные зоны, развитые в большей или меньшей степени, представляют характерную особенность структуры каждого белка, на чем и основан метод гидрофобной хроматографии. Соответствующие сорбенты синтезируют, включая гидрофобные группировки в гидрофильную матрицу, например в поперечносшитую агарозу сефарозу. По такому принципу построены, в частности, октил- и фенилсефароза: При пропускании белкового раствора через фенилсефарозу гидрофобные участки поверхности белков образуют контакты с фенильнымн группами, вытесняя прилегающие к этим структурам молекулы воды. Число и прочность таких контактов весьма различны у разных белков. Повышению их прочности способствует сорбция белков из концентрированных растворов солей, например
10 ամոնիումի սուլֆատ: Ֆենիլսեֆարոզով սյունակի միջով հոսող լուծույթում աղի կոնցենտրացիայի սահուն նվազումը հանգեցնում է սպիտակուցների հաջորդական կլանմանը: Նմանատիպ գործում են մակրոծակոտկեն սիլիցիումին տարբեր երկարությունների հիդրոֆոբ ալկիլ ռադիկալներ ավելացնելով ստացված սորբենտները։ Դրանք, լինելով կոշտ, հատկապես հարմար են բարձր արդյունավետության հեղուկ քրոմատոգրաֆիայի (HPLC, անգլերեն HPLC) բարձր ճնշման տակ աշխատելու համար: Նրանք, որոնք պարունակում են երկար C18 ածխաջրածնային շղթաներ, քիչ օգտակար են սպիտակուցների տարանջատման համար՝ չափազանց ուժեղ, հաճախ անդառնալի կապի պատճառով, բայց կարող են օգտագործվել պեպտիդային քրոմատոգրաֆիայի համար: Լավագույն արդյունքները ձեռք են բերվում սպիտակուցների քրոմատագրման միջոցով սորբենտների վրա, որոնք պարունակում են ավելի կարճ C 4 -C 8 ածխաջրածնային շղթաներ: Հաճախ հիդրոֆոբ քրոմատոգրաֆիան զուգակցվում է այլ էֆեկտների հետ։ Օրինակ, ցիանոգենի բրոմիդով ակտիվացված Sepharose-ին տարբեր երկարությունների դիամինի ավելացումն առաջացնում է սորբենտներ, որոնք պարունակում են ջրածնային ածխաջրածնային շղթաներ երկու կատիոնային խմբերի հետ միասին: Հիդրոֆոբ սորբենտի և անիոնափոխանակիչի հատկությունների համադրումը մեկ քրոմատոգրաֆիկ նյութում հարստացնում է դրա հնարավորությունները: Հիդրոֆոբ սորբենտի վրա քրոմատագրման իրականացման վերը նկարագրված մեթոդը ամենևին էլ միակ հնարավոր չէ: Սպիտակուցների կլանման համար անհրաժեշտ չէ լուծույթի մեջ մտցնել աղի բարձր կոնցենտրացիաներ, իսկ լուծույթի համար կարող է օգտագործվել օրգանական լուծիչների ավելացում՝ pH-ի փոփոխություն։ Որոշ դեպքերում, երբ սպիտակուցների կապը հիմնված է հիդրոֆոբ և իոնային փոխազդեցությունների համակցության վրա, աղի լուծույթներով էլյուցիան լավ արդյունքներ է տալիս: Մենք նաև նշում ենք, որ հիդրոֆոբ քրոմատոգրաֆիայի նշանները հայտնաբերվում են նաև սպիտակուցների տարանջատման այլ մեթոդներում, հատկապես մերձավոր քրոմատոգրաֆիայում: Ամեն տարի ԱՄՆ-ի Պիտսբուրգի կոնֆերանսում և ցուցահանդեսում ներկայացվում են տասնյակ նոր HPLC սորբենտներ և դրանցից կարելի է դատել նոր ուղղություններն ու միտումները։ Ընկերությունները առաջարկում են սյուների լայն տեսականի՝ սյունակների երկարությունը տատանվում է 10-ից 250 մմ, իսկ ներքին տրամագիծը՝ 1-ից 50 մմ: Սարքավորումներ HPLC-ի համար Ժամանակակից հեղուկ քրոմատոգրաֆները հասանելի են երեք տարբերակով՝ բլոկ-մոդուլային, մոնոբլոկ և միջանկյալ (մոդուլային ձևավորում մեկ բլոկում): Մոդուլային սարքի կոնֆիգուրացիայի ընտրությունը որոշվում է վերլուծական առաջադրանքով: Մոդուլային համակարգը թույլ է տալիս արագ և հեշտությամբ հավաքել կոնկրետ համակարգ՝ նվազագույն ծախսերով: Ճկուն բլոկ-մոդուլային համակարգի հիման վրա հնարավոր է ստեղծել ինչպես պարզ, այնպես էլ բարդ սարքեր՝ շինանյութերով, որոնք հարմար են սովորական տեխնոլոգիական խնդիրներ լուծելու և բարդ հետազոտական չափումներ կատարելու համար:
11 Մոնոբլոկ համակարգը որոշ դեպքերում ձեռնտու է մասնագիտացված կոնկրետ առաջադրանքների դեպքում: Փոխարինվող բլոկներով ինտեգրված համակարգը նմանատիպ առավելություններ ունի: Ներկայումս կոմերցիոն եղանակով արտադրվում են հեղուկ քրոմատոգրաֆների հետևյալ տեսակները. ցածր ճնշում(բաց համակարգեր), բազմաչափ, on-line անալիզատորներ, բարձր ջերմաստիճանի շարունակական, հակահոսք, շարժվող մահճակալ, ամինաթթուների անալիզատորներ: Այս հեղուկ քրոմատոգրաֆները կարող են ներառել հայտնաբերման հետևյալ համակարգերը՝ փոփոխական ալիքի երկարություն, ֆիքսված ալիքի երկարություն (զտիչներով), սկանավորում, ֆոտոդիոդային զանգված, ռեֆրակտոմետրիկ, ֆլյուորեսցենտ, էլեկտրաքիմիական, հաղորդիչ, ամպերաչափ, լույսի ցրում, քիմլյումինեսցենտ, զանգվածային սպեկտրաչափական, միկրոակտիվ սպեկտրաչափ, սպեկտրոսկոպիկ, բոցի իոնացում և այլն: Մշակվում է միկրո և նանոսյուններով HPLC: Քրոմատոգրաֆի դասավորությունը. 1-պոմպ 2-նմուշի ներարկման միավոր 3-քրոմատոգրաֆիկ սյունակ 4-դետեկտոր 5-գրանցիչ 6-սյունակ թերմոստատ 7-էլյուենտի պատրաստման միավոր 8-ջրահեռացման կամ ֆրակցիոն կոլեկցիոներ
12 HPLC կիրառումներ HPLC մեթոդները դարձել են պաշտոնական մեթոդներ տարբեր երկրների դեղագրքերում, EPA-ում (ԱՄՆ շրջակա միջավայրի աղտոտվածության վերլուծության գործակալություն), ԳՕՍՏ-ներում և բազմաթիվ վնասակար միացությունների վերլուծության վերաբերյալ առաջարկություններում: HPLC մեթոդներով շրջակա միջավայրի աղտոտվածության մոնիտորինգի ժամանակ նավթամթերքները որոշվում են մակերեսային և խմելու ջրերում. թունաքիմիկատներ ջրի, հողի մեջ; ֆտալատներ ջրի մեջ; անուշաբույր ամիններ և պոլիմիջուկային անուշաբույր միացություններ սննդի և ջրի մեջ. ֆենոլ, քլորոֆենոլ և նիտրոֆենոլներ խմելու ջուր; նիտրոզամիններ սննդի մեջ; ծանր մետաղներ ջրի, հողի և սննդի մեջ; միկոտոքսիններ (աֆլատոքսիններ, զեարալենոն և այլն) սննդամթերքում և կերերում և շատ այլ աղտոտիչներ: Հիվանդությունների վաղ ախտորոշումը կենսաքիմիական մարկերների վերլուծությամբ HPLC-ն ավելի ու ավելի է օգտագործվում կենսաքիմիական մարկերների և մետաբոլիտների որոշման համար բնակչության զանգվածային բժշկական հետազոտության և վտանգավոր հիվանդությունների հայտնաբերման ժամանակ: Սովորաբար հիվանդությունների ախտորոշման համար բավական է որոշել միայն մարկերները, սակայն որոշ դեպքերում պահանջվում է որոշել բազմաթիվ բաղադրիչների մակարդակի նյութափոխանակության պրոֆիլը: Կենսաբանական մարկերները համեմատաբար փոքր մոլեկուլներ են՝ կատեխոլամիններ, ամինաթթուներ (հոմոցիստեին), ինդոլներ, նուկլեոզիդներ, պորֆիրիններ, շաքարներ, ստերոիդներ, հորմոններ, վիտամիններ, պտերիններ և լիպիդներ։ Որոշ դեպքերում օգտագործվում են նաև խոշոր մոլեկուլներ՝ ֆերմենտներ, սպիտակուցներ, նուկլեինաթթուներ։ Տարբեր հիվանդություններով հիվանդների ֆիզիոլոգիական հեղուկի կոնցենտրացիաների պրոֆիլը կարող է զգալիորեն տարբերվել պրոֆիլից առողջ մարդիկ. Այս ցուցանիշը պետք է որոշվի նաև ժառանգական նյութափոխանակության խանգարումներով հիվանդների մոտ։ Բացի այդ, պրոֆիլային անալիզներ են կատարվում ուռուցքաբանական, սրտանոթային, հոգեկան և նյարդաբանական հիվանդությունների, ինչպես նաև շաքարախտի և պորֆիրիազի դեպքում։ Մարմնի հեղուկի կոնցենտրացիայի պրոֆիլը որոշվում է որոշակի ախտանիշներով հիվանդների մոտ, սակայն դա հիվանդության ճշգրիտ ախտորոշում չի տալիս: Վերջերս ապացուցվեց, որ ՁԻԱՀ-ով հիվանդների պրոֆիլում հայտնվում են փոփոխված նուկլեոզիդներ: Օբյեկտների վերլուծության համար, ինչպիսիք են բարդ և բազմաբաղադրիչ կենսաբանական հեղուկները, հարմար է բարձր արդյունավետության հեղուկ քրոմատոգրաֆիան, որն ունի հստակ առավելություններ գազային քրոմատագրության նկատմամբ՝ բարձր ջերմաստիճանում բազմաթիվ կենսաբանական ակտիվ միացությունների անկայունության պատճառով: Բազմաթիվ մարկերների պարունակությունը կենսաբանական հեղուկներում գտնվում է g-ի մակարդակում, հետևաբար, դրանց որոշման համար անհրաժեշտ են բարձր զգայուն և ընտրողական դետեկտորներ, մասնավորապես՝ ամպերաչափական և լյումինեսցենտներ։ Ցանկալի է, որ անալիզները
13-ն ավարտվեց արագ, 5-20 րոպեի ընթացքում: Ներկայումս աշխարհի բժշկական կենտրոններում կենսաքիմիական մարկերների վերլուծությամբ արդեն հայտնաբերվում են ավելի քան 200 նյութափոխանակության հիվանդություններ։ Կենսաքիմիայի ուսումնասիրություններ և վերլուծություններ HPLC-ն առավել լայնորեն օգտագործվում է կենսաբանական միացությունների՝ սպիտակուցների, ֆերմենտների, շաքարների, լիպիդների, ամինաթթուների, պեպտիդների, վիտամինների և այլն տարանջատելու համար։ կտրուկ ավելացել են պեպտիդներն ու ամինաթթուները։ HPLC մեթոդը օգտագործվում է դեղամիջոց-թաղանթ և դեղ-սպիտակուց փոխազդեցության ուսումնասիրության և սպիտակուցի օքսիդացման աստիճանը գնահատելու համար: Քրոմատոգրաֆիկ պարամետրերի և կենսաբանական հատկությունների միջև հաստատված հարաբերությունը թույլ է տալիս ավելի գիտակցված որոնել նոր դեղամիջոցներ և այլ կենսաբանական ակտիվ միացություններ դեղագործական արտադրանքներում: HPLC-ն դեղերի մետաբոլիտների ուսումնասիրման, ալերգենների առանձնացման և մեկուսացման, ինչպես նաև ֆարմակոկինետիկ գործընթացների ուսումնասիրման կարևորագույն մեթոդներից մեկն է: Էնանտիոմերային բուժիչ նյութերի տարանջատումը յուրացվել է արդյունաբերական մասշտաբով։
2.2.29. ԲԱՐՁՐ ԱՐԴՅՈՒՆԱԿԱՆ ՀԵՂՈՒԿ ՔՐՈՄԱՏՈԳՐԱՖԻԱ Բարձր արդյունավետության հեղուկ քրոմատոգրաֆիան (HPLC) տարանջատման մեթոդ է, որը հիմնված է նյութերի դիֆերենցիալ բաշխման վրա երկու չխառնվող նյութերի միջև:
8. Հարցեր 1. Սահմանել քրոմատոգրաֆիան: 2. Քրոմատոգրաֆիայի ո՞ր հատկանիշներն են թույլ տալիս հասնել նմանատիպ հատկություններով նյութերի ավելի լավ տարանջատման՝ համեմատած տարանջատման այլ մեթոդների հետ։ 3. Ցուցակ
Դասախոսություն 6 Անալիզի քրոմատոգրաֆիկ մեթոդներ Դասախոսության պլան 1. Քրոմատագրության հասկացություններ և տերմիններ. 2. Անալիզի քրոմատոգրաֆիկ մեթոդների դասակարգում. Քրոմատոգրաֆիկ սարքավորումներ. 3. Քրոմատոգրաֆիայի տեսակները՝ գազային,
Մոսկվայի ֆիզիկատեխնիկական ինստիտուտ (Պետական համալսարան) Մոլեկուլային և կենսաբանական ֆիզիկայի ամբիոն Ֆիզիկական հետազոտության մեթոդներ Դասախոսություն 9 Հեղուկ քրոմատագրություն Մեթոդներ և տեխնոլոգիա.
Պրոֆեսոր Կոչետով Անատոլի Գլեբովիչ Ասիստենտ Լիանգ Օլգա Վիկտորովնա AST, ALT. Ռեյտման Ֆրենկելի և կինետիկ մեթոդի համաձայն Կենսաբանականի գյուտ կամ պատկերացում քիմիական ռեակցիակամ ֆիզիկական գործընթաց
ԴԱՍԱԽՈՍՈՒԹՅՈՒՆ 7 ՔՐՈՄԱՏՈԳՐԱՖԻԱՆ ՈՐՊԵՍ տարանջատման, նույնականացման և քանակական որոշման մեթոդ Հիմնական հասկացություններ և սահմանումներ Քրոմատոգրաֆիական մեթոդների տարբեր դասակարգումներ Քիմիորբցիոն քրոմատագրություն.
Քրոմատագրության հայտնաբերում (1903) ՄԻԽԱՅԼ ՍԵՄԵՆՈՎԻՉ ՑՎԵՏ (1872-1919) Քրոմատագրության զարգացման հիմնական փուլերը 1903 Քրոմատագրության հայտնաբերում (Ցվետ Մ.Ս.) 1938 Նիհար կամ հարթ քրոմատագրություն (I.
Անալիտիկ քիմիա 4-րդ կիսամյակ, Դասախոսություն 17. Մոդուլ 3. Քրոմատագրություն և անալիզի այլ մեթոդներ. Քրոմատոգրաֆիա. Մեթոդների սկզբունքը և դասակարգումը. 1. Քրոմատոգրաֆիկ տարանջատման սկզբունքը. Ստացիոնար և շարժական
ՌՈՒՍԱՍՏԱՆԻ ԿՐԹՈՒԹՅԱՆ ԵՎ ԳԻՏՈՒԹՅԱՆ ՆԱԽԱՐԱՐՈՒԹՅՈՒՆ ԱԶԳԱՅԻՆ ՀԵՏԱԶՈՏՈՒԹՅԱՆ ՏՈՄՍԿԻ ՊԵՏԱԿԱՆ ՀԱՄԱԼՍԱՐԱՆ ՔԻՄԻԱԿԱՆ ՖԱԿՈՒԼՏԵՏ Առարկաների ծանոթագրված աշխատանքային ծրագիր Անալիզի քրոմատոգրաֆիկ մեթոդներ Ուսումնասիրության ոլորտ
04.07 Մոսկվայի ֆիզիկատեխնիկական ինստիտուտի մոլեկուլային և կենսաբանական ֆիզիկայի ամբիոն Ֆիզիկական հետազոտության մեթոդներ Դասախոսություն 8 Քրոմատագրություն Դոլգոպրուդնի, ապրիլի 6, 07. Պլանավորել. Պատմություն առաջացման
Վ.Դ. ՇԱՑ Օ.Վ. SACHART ԲԱՐՁՐ ԱՐՏԱԴՐՈՒԹՅՈՒՆ ՀԵՂՈՒԿ ՔՐՈՄԱՏՈԳՐԱՖԻԱ Տեսության հիմունքներ. Մեթոդաբանությունը. Կիրառություն բժշկության քիմիայում. ՆԱԽԱԲԱՆ Ժամանակակից զարգացումՊահանջվում է քիմիական և կենսաբանական գիտություններ
ԿՐԹՈՒԹՅԱՆ ԴԱՇՆԱԿԱՆ ԳՈՐԾԱԿԱԼՈՒԹՅՈՒՆ Բարձրագույն մասնագիտական կրթության պետական ուսումնական հաստատություն «Ուրալի պետական համալսարան. Ա.Մ. Գորկի» IONTS «Էկոլոգիա և բնության կառավարում»
«Անալիտիկ քրոմատոգրաֆիկ մեթոդների ներածություն» առարկայի աշխատանքային ծրագրի ԱՆՈՏԱՑԻԱ նախապատրաստման ուղղությամբ 04.03.01 Քիմիա «Անալիտիկ քիմիա» թրեյնինգի պրոֆիլում 1. Առարկայի յուրացման նպատակները.
ՌՈՒՍԱՍՏԱՆԻ ԴԱՇՆՈՒԹՅԱՆ ԱՌՈՂՋԱՊԱՀՈՒԹՅԱՆ ՆԱԽԱՐԱՐՈՒԹՅԱՆ ԳԼԽԱՎՈՐ ԴԵՂԱԳՈՐԾԱԿԱՆ ԼԻԶՈՐՈՒՄ Բարձր արդյունավետության հեղուկ քրոմատոգրաֆիա OFS.1.2.1.2.0005.15 Արվեստի փոխարեն. GF XI Բարձր արդյունավետության հեղուկ քրոմատագրություն (հեղուկ
Լաբորատոր աշխատանք 7բ Հողերի գազային փուլի բաղադրության քրոմատագրական որոշում. Քրոմատոգրաֆիան (հունարեն chroma, genitive chromatos color, paint) տարանջատման և վերլուծության ֆիզիկաքիմիական մեթոդ է։
Մոսկվայի ֆիզիկատեխնիկական ինստիտուտ (Պետական համալսարան) Մոլեկուլային ֆիզիկայի ամբիոն Ֆիզիկական հետազոտության մեթոդներ Դասախոսություն Գազային քրոմատագրություն Տեսություն և սկզբունքներ Դոլգոպրուդնի, նոյեմբեր.
APP NOTE-19/2017LC Maestro HPLC հեղուկ քրոմատոգրաֆի վերլուծական հնարավորությունները ամպերոմետրիկ դետեկտորով արյան պլազմայում հոմոցիստեինի որոշման օրինակով Յաշին Ա. Յա. բ.գ.թ., առաջատար ինժեներ
Agilent AdvanceBio SEC SEC սյունակների առավելությունները կենսադեղագործական վերլուծության համար Տարբեր վաճառողների սյունակների համեմատություն՝ տվյալների որակը բարելավելու համար Տեխնիկական ակնարկ
ԲԵԼԱՌՈՒՍԻ ՊԵՏԱԿԱՆ ՀԱՄԱԼՍԱՐԱՆԻ ՔԻՄԻԱԿԱՆ ՖԱԿՈՒԼՏԵՏ ԱՆԼԻՏԻԿ ՔԻՄԻԱՅԻ ԲԱԺԻՆ
Agilent AdvanceBio SEC Չափի բացառման քրոմատոգրաֆիայի սյունակներ ագրեգացման վերլուծության համար. գործիքի համատեղելիության տեխնիկական ակնարկ Ներածություն Agilent AdvanceBio SEC սյունակները նոր ընտանիք են
Մոսկվայի ֆիզիկատեխնիկական ինստիտուտ (Պետական համալսարան)) Մոլեկուլային ֆիզիկայի ամբիոն Հետազոտության ֆիզիկական մեթոդներ Դասախոսություն 0 Գազային քրոմատագրություն Dolgoprudny, նոյեմբերի 5, 0g. Պլանավորել. Պատմություն
2 Վերլուծության մեթոդներ. 1. Քիմիական մեթոդներ. Քիմիական հավասարակշռությունը և դրա օգտագործումը վերլուծության մեջ: Թթու-բազային հավասարակշռություն. Թթուների և հիմքերի ուժը, դրանց փոփոխության օրինաչափությունները: Համմետի ֆունկցիան. հաշվարկ
Առողջապահության և սոցիալական զարգացման նախարարության ՄՈՍԿՎԱՅԻ ՊԵՏԱԿԱՆ ԲԺՇԿԱԿԱՆ ԵՎ ԱՏՈՄԱՏՈՄԱՏՈԼԻԱԿԱՆ ՀԱՄԱԼՍԱՐԱՆ Բարձրագույն մասնագիտական կրթության պետական բյուջետային ուսումնական հաստատություն.
Վ.Դ.ՇԱՑ, ՕՎ ՍԱԽԱՐՏՈՎԱ ԲԱՐՁՐ ԱՐԴՅՈՒՆԱԿԱՆ ՀԵՂՈՒԿ ՔՐՈՄԱՏՈԳՐԱՖԻԱ Տեսության հիմունքները. Մեթոդաբանությունը. Կիրառում Բժշկական քիմիայում ԼԱՏՎԻԱՅԻ ԽՍՀ ԻՆՍՏԻՏՈՒՏԻ ԳԻՏՈՒԹՅՈՒՆՆԵՐԻ ԱԿԱԴԵՄԻԱ.
Մոսկվայի ֆիզիկատեխնիկական ինստիտուտ (Պետական համալսարան) Մոլեկուլային և կենսաբանական ֆիզիկայի ամբիոն Ֆիզիկական հետազոտության մեթոդներ Դասախոսություն 8 Դետեկտորները քրոմատագրաֆիայում Հեղուկ քրոմատագրություն.
ՌՈՒՍԱՍՏԱՆԻ ԴԱՇՆՈՒԹՅԱՆ ԱՌՈՂՋԱՊԱՀՈՒԹՅԱՆ ՆԱԽԱՐԱՐՈՒԹՅԱՆ ԳԼԽԱՎՈՐ ԴԵՂԱԳՈՐԾԱԿԱՆ ԼԻԶՈՐՈՒՄ Էլեկտրոֆորեզ OFS.1.2.1.0021.15 Փոխարենը Art. SP XI, թողարկում 1 Էլեկտրոֆորեզի վերլուծության մեթոդ՝ հիմնված լիցքավորված մասնիկների ունակության վրա,
Մոսկվայի ֆիզիկատեխնիկական ինստիտուտի մոլեկուլային և կենսաբանական ֆիզիկայի ամբիոն Ֆիզիկական հետազոտության մեթոդներ Դասախոսություն 9 Գազային քրոմատագրություն Փորձարարական տեխնիկա և մեթոդներ Դոլգոպրուդնի, ապրիլի 3.
APP NOTE-18/2017LC Հեղուկ քրոմատոգրաֆ Maestro HPLC-ի անալիտիկ հնարավորությունները ամպերաչափական դետեկտորով արյան պլազմայում կատեխոլամինների որոշման օրինակով Yashin A. Ya. k. x. բ.գ.թ., առաջատար ինժեներ
Քրոմատագրությունը գործիքային վերլուծության կարևորագույն գործընթացներից մեկն է։ Առաջին հերթին, այն կարևոր դեր է խաղում գիտության այնպիսի ոլորտներում, ինչպիսիք են քիմիան, կենսաքիմիան և շրջակա միջավայրի վերլուծությունը փոքր չափերի որոշման գործում
Դաշնային պետական բյուջետային գիտության ինստիտուտ «Կիրովի անվան արյունաբանության և արյան փոխներարկման դաշնային գործակալության գիտահետազոտական ինստիտուտ» 3.3.2. Բժշկական իմունոկենսաբանական
Ածխաջրերի, սպիրտների և օրգանական թթուների հուսալի հայտնաբերում ցածր ճնշման քրոմատագրմամբ Agilent Hi-Plex սյունակներով լիգանդի փոխանակման HPLC Agilent Technologies Technologies Agilent Hi-Plex սյուների համար
Դաշնային պետական ունիտար ձեռնարկություն NPO RADON Moscow Կոնցենտրացիայի և տարանջատման մեթոդի մշակում և հաստատում և (IV) օգտագործելով արդյունահանման քրոմատագրություն Resin Ermakov A.I. Մոսկվա - 2013 1 Սորբման նյութ՝ ներծծված
Անալիզի ֆիզիկաքիմիական մեթոդներ Քրոմատոգրաֆիա Քրոմատագրության մեթոդը հիմնված է սորբցիոն երևույթի վրա Սորբումը գազերի, գոլորշիների և լուծված նյութերի կլանման գործընթացն է պինդ կամ հեղուկ սորբենտներով։
ՌՈՒՍԱՍՏԱՆԻ ԴԱՇՆՈՒԹՅԱՆ ԱՌՈՂՋԱՊԱՀՈՒԹՅԱՆ ՆԱԽԱՐԱՐՈՒԹՅԱՆ ԳԼԽԱՎՈՐ ԴԵՂԱԳՈՐԾԱԿԱՆ ԼԻԶՈՐՈՒՄ Գազային քրոմատոգրաֆիա OFS.1.2.1.2.0004.15 Հոդ. GF XI Գազային քրոմատոգրաֆիան ցնդող միացությունների տարանջատման մեթոդ է՝ հիմնված
Գազային քրոմատագրություն 1 Նյութի պահանջներ 1. Ցնդականություն 2. Ջերմային կայունություն (նյութը պետք է գոլորշիանա առանց տարրալուծման) 3. Իներտություն Գազային քրոմատոգրաֆի դասավորությունը 1 2 3 4 5 1. Գազի կրող բալոն
ՌՈՒՍԱՍՏԱՆԻ ԴԱՇՆՈՒԹՅԱՆ ԱՌՈՂՋԱՊԱՀՈՒԹՅԱՆ ՆԱԽԱՐԱՐՈՒԹՅԱՆ ԳԼԽԱՎՈՐ ԴԵՂԱԳՈՐԾԱԿԱՆ ԼԻԶՈՐՈՒՄԸ Նիհարշերտային քրոմատոգրաֆիա OFS.1.2.1.2.0003.15 Հոդ. SP XI, թողարկում 1 Քրոմատոգրաֆիկ գործընթաց, որը տեղի է ունենում շարժման ընթացքում
Մոսկվայի ֆիզիկատեխնիկական ինստիտուտ (Պետական համալսարան) Մոլեկուլային և կենսաբանական ֆիզիկայի ամբիոն Ֆիզիկական հետազոտության մեթոդներ Դասախոսություն 7 Գազային և հեղուկ քրոմատագրություն. Գործնական
141 Application of microcolumn HPLC for control of ionol in transformer oil Rudakov OB, Fan Vinh Thin Voronezh State University of Architecture and Civil Engineering, Voronezh Podolina Ye.A. Էլեկտրոստալսկին
46. ՔՐՈՄԱՏՈԳՐԱՖԻԿԱԿԱՆ ԲԱԺԱՆԱՑՄԱՆ ՄԵԹՈԴՆԵՐ Քրոմատոգրաֆիկ տարանջատման մեթոդները բազմաստիճան տարանջատման մեթոդներ են, որոնցում նմուշի բաղադրիչները բաշխվում են երկու փուլերի՝ անշարժ և շարժական: անշարժ
E.L.STYSKIN, L.B.ITSIKSON, E.V.BRAUDE Practical High-Performance Liquid Chromatography Evaluation տարբերակ Մոսկվա. 1986 ԲՈՎԱՆԴԱԿՈՒԹՅՈՒՆ Նախաբան... Ներածություն... ԳԼՈՒԽ 1. ՏԵՍՈՒԹՅԱՆ ՀԻՄՈՒՆՔՆԵՐԸ ԵՎ ՀԻՄՆԱԿԱՆ.
Մոսկվայի ֆիզիկատեխնիկական ինստիտուտ (Պետական համալսարան)) Մոլեկուլային ֆիզիկայի ամբիոն Ֆիզիկական հետազոտության մեթոդներ Դասախոսություն 9 Քրոմատագրություն. Ներածություն Dolgoprudny, 9 հոկտեմբերի 0գ. Պլանավորել.
ԿՐԹՈՒԹՅԱՆ ԴԱՇՆԱԿԱՆ ԳՈՐԾԱԿԱԼՈՒԹՅՈՒՆ Բարձրագույն մասնագիտական կրթության պետական ուսումնական հաստատություն «Ուրալի պետական համալսարան. Ա.Մ. Գորկի» IONTS «Էկոլոգիա և բնության կառավարում»
Առարկա. Մակերեւութային երեւույթների ֆիզիկաքիմ. Ադսորբցիա. Մակերեւութային երեւույթները դրսեւորվում են տարասեռ համակարգերում, այսինքն. համակարգեր, որտեղ առկա է ինտերֆեյս բաղադրիչների միջև: Մակերեւութային երեւույթներ
848 ՀԱՄԱՌՈՏ ԶԵԿՈՒՅՑՆԵՐ՝ հիմնված XII միջազգային գիտաժողովի նյութերի վրա «Իոնափոխանակման գործընթացների ֆիզիկական և քիմիական հիմքերը (IONITES-2010)» UDC 541 Շաքարների, ամինաթթուների որոշում բարձր արդյունավետ անիոնափոխանակման մեթոդով.
ԺԱՄԱՆԱԿԱԿԻՑ ՊԱՏՐԱՍՏԱԿԱՆ ՖԼԵՇ ՔՐՈՄԱՏՈԳՐԱՖԻԱ Մաս 2* Ա.Աբոլին, բ.գ.թ., «ԳալաՔեմ» [էլփոստը պաշտպանված է]Պ.-Ֆ. Icarus, Interchim (Ֆրանսիա) Շարունակում ենք հրապարակել նյութերի մասին ժամանակակից մեթոդներնախապատրաստական
ՌՈՒՍԱՍՏԱՆԻ ԴԱՇՆՈՒԹՅԱՆ ԿՐԹՈՒԹՅԱՆ ԵՎ ԳԻՏՈՒԹՅԱՆ ՆԱԽԱՐԱՐՈՒԹՅՈՒՆ ՄՈՍԿՎԱՅԻ ՖԻԶԻՏԵԽՆԻԿԱԿԱՆ ԻՆՍՏԻՏՈՒՏ (ՊԵՏԱԿԱՆ ՀԱՄԱԼՍԱՐԱՆ) Մոլեկուլային և կենսաբանական ֆիզիկայի ԲԱՐՁՐ ԱՐԴՅՈՒՆԱԿԱՆ Հեղուկի Քրոմատոգրաֆիայի բաժին.
Թաուրիդայի ազգային համալսարանի գիտական նշումները. V. I. Vernadsky Series «Կենսաբանություն, քիմիա» հատոր 17 (56): 2004. 1. S. 150-155. UDC 577.322: 537.632.5 ՈՐՈՇ ՀԻԴՐՈՖՈԲ ԼԻԳԱՆԴՆԵՐԻ ԱԶԴԵՑՈՒԹՅՈՒՆԸ ՍՊԵԿՏՐԱԼԻ ՎՐԱ
Ֆիզիկական պրոցեսները կենսաբանական թաղանթներում Հեղինակներ՝ А.А. Կյագովա, Ա.Յա. Պոտապենկո Ի. Կենսաբանական թաղանթների կառուցվածքը, գործառույթները, ֆիզիկական հատկությունները 1) Կառուցվածքը Ֆոսֆոլիպիդային երկշերտ Ֆոսֆոլիպիդների մոլեկուլները.
Ամինաթթուների էնանտիոմերների ածանցյալների տարանջատումը ամինացված β-ցիկլոդեքստրինի վրա ԲԱՐՁՐ ԱՐՏԱԴՐՈՒԹՅԱՆ ՀԵՂՈՒԿ ՔՐՈՄԱՏՈԳՐԱՖԻԱՅՈՎ I. A. Ananyeva, E. N. Shapovalova, S. A. Lopatin, O.
ԲԱՐՁՐ ԱՐՏԱԴՐՈՒԹՅԱՆ ՀԵՂՈՒԿ ՔՐՈՄԱՏՈԳՐԱՖ ՍՊԵԿՏՐՈՖԼՈՒՈՐԻՄԵՏՐԱԿԱՆ ԴԵՏԵԿՏՈՐՈՎ «FLUORAT-02-PANORAMA». Այն հեղուկ անալիզատոր է «FLUORAT -02-PANORAMA», որն օգտագործվում է որպես սպեկտրաֆտորաչափ
1. Բացատրական նշում 1.1. Պահանջներ ուսանողներին Ուսանողը պետք է ունենա հետևյալ նախնական կարողությունները. մաթեմատիկական և բնական գիտությունների հիմնական դրույթներ. տիրապետել անկախության հմտություններին
Բաց մամուլում հրապարակման ենթակա Հեղուկ քրոմատոգրաֆներ Agilent 1100, Agilent 100 ընդգրկված են Չափիչ գործիքների պետական ռեգիստրում գրանցման A6 սուտ փոխարենը թողարկվել է ըստ տեխնիկական փաստաթղթերի
ՂԱԶԱԽՍՏԱՆԻ ՀԱՆՐԱՊԵՏՈՒԹՅԱՆ ԿՐԹՈՒԹՅԱՆ ԵՎ ԳԻՏՈՒԹՅԱՆ ՆԱԽԱՐԱՐՈՒԹՅԱՆ ՍԵՄԵՅ ՔԱՂԱՔԻ ՇԱԿԱՐԻՄԻ ԱՆՎԱՆ ՊԵՏԱԿԱՆ ՀԱՄԱԼՍԱՐԱՆ QMS փաստաթուղթ Ձեր ընտրած բաղադրիչի 3-րդ մակարդակի UP KV UP KV Ուսումնական պլան Revision 1 from "08"
Կրթության դաշնային գործակալություն Բարձրագույն մասնագիտական կրթության պետական ուսումնական հաստատություն Վլադիմիր պետական համալսարան Վ.Գ. ԱՄԵԼԻՆԻ ՔՐՈՄԱՏՈԳՐԱՖԻԿԱԿԱՆ ՎԵՐԼՈՒԾՄԱՆ ՄԵԹՈԴՆԵՐ
Մեկ Crystal 09-312-6029RU Guidelines Նավթամթերքի բոլոր կողմերը: Տիպի սահմանում անուշաբույր ածխաջրածիններմիջին թորումներում. Բարձր արդյունավետության հեղուկ քրոմատոգրաֆիայի մեթոդ
Դասախոսություն 7. ՄԵՐԿԵՍՈՒԹՅԱՆ ԵՐԵՎՈՒՅԹՆԵՐ 1. Մակերեւութային լարվածություն 1.1. մակերեսային էներգիա. Մինչ այժմ մենք հաշվի չենք առել տարբեր լրատվամիջոցների միջև ինտերֆեյսի առկայությունը*։ Այնուամենայնիվ, նրա ներկայությունը կարող է լինել շատ
Ուսումնական ծրագիրը հիմնված է OSVO 1-31 05 01 2013 կրթական չափորոշչի և բուհերի G 31 153/ac ծրագրի վրա: 2013 ԿԱԶՄԱԿԵՐՊՈՂ՝ Վ.Ա.Վինարսկի, դոցենտ, քիմիական գիտությունների թեկնածու, դոց.
1 Մակրոմոլեկուլային միացություններ (Lysenko EA) Դասախոսություն 7. Մակրոմոլեկուլների ֆրակցիոնացում 2 1. Կոտորակացիայի հասկացություն. 2. Նախապատրաստական ֆրակցիոնացում. 3. Պղտորաչափական տիտրման մեթոդ. 4. Գել թափանցող
08, հատոր http://dx.doi.org/0.6787/nydha-68-878-08---07- ԳԻՏԱԿԱՆ ՄՈՏԵՑՈՒՄ ԴԵՂԻ ՄԵԳՈՍԻՆԻ ԵՎ ԴՐԱ ԲԱՂԴԻՐ ՄԻԱՑՈՒՅԹԻ ՍՏԱՆԴԱՐԴԱՑՄԱՆ ՈՒՍՈՒՄՆԱՍԻՐՈՒԹՅԱՆ ՄԵԳԱՖԵՐՈՆ Զիյաև Յա. .K., Khaitbaev A.A.
Agilent SureMass Տեխնիկական տեղեկատվության ամփոփում Աբստրակտ Ձեռնարկի վերլուծությունը կամ ծրագրաշարի գագաթնակետային տարանջատումը ավանդաբար օգտագործվում է ամբողջական սպեկտրի GC/MS քրոմատոգրամների վերլուծության մեջ՝ մեկուսացնելու նպատակով:
1. Ներածություն.
2. Քրոմատոգրաֆիայի առաջացումը և զարգացումը.
3. Քրոմատոգրաֆիկ մեթոդների դասակարգում.
4. Քրոմատոգրաֆիա պինդ ստացիոնար փուլի վրա.
ա) գազային (գազի կլանման) քրոմատոգրաֆիա.
բ) հեղուկ (հեղուկ adsorption) քրոմատոգրաֆիա.
5. Քրոմատագրություն հեղուկ ստացիոնար փուլի վրա.
ա) գազահեղուկ քրոմատոգրաֆիա;
բ) գելային քրոմատոգրաֆիա.
6. Եզրակացություն.
Ինչպես սպեկտրի ճառագայթները, այնպես էլ պիգմենտների խառնուրդի տարբեր բաղադրիչները կանոնավոր կերպով բաշխվում են կալցիումի կարբոնատի սյունակում՝ թույլ տալով դրանց որակական և քանակական որոշումը։ Այս եղանակով ստացված պատրաստուկը ես անվանում եմ քրոմատոգրամ, իսկ առաջարկվող մեթոդը՝ քրոմատոգրաֆիկ։
M. S. Tsvet, 1906 թ
Ներածություն
Նյութերի խառնուրդն առանձնացնելու և վերլուծելու անհրաժեշտությունը բախվում է ոչ միայն քիմիկոսին, այլև շատ այլ մասնագետների։
Առանձին քիմիական միացությունների և դրանց բարդ խառնուրդների առանձնացման, վերլուծության, կառուցվածքի և հատկությունների ուսումնասիրության քիմիական և ֆիզիկաքիմիական մեթոդների հզոր զինանոցում առաջատար տեղերից մեկը զբաղեցնում է քրոմատագրությունը։
Քրոմատոգրաֆիան ֆիզիկաքիմիական մեթոդ է գազերի, գոլորշիների, հեղուկների կամ լուծված նյութերի խառնուրդները բաժանելու և վերլուծելու և առանձին նյութերի ֆիզիկաքիմիական հատկությունների որոշման համար՝ հիմնված խառնուրդների առանձնացված բաղադրիչների բաշխման վրա երկու փուլերի միջև՝ շարժական և անշարժ: Ստացիոնար փուլը կազմող նյութերը կոչվում են սորբենտներ։ Ստացիոնար փուլը կարող է լինել պինդ կամ հեղուկ: Շարժական փուլը հեղուկ կամ գազային հոսք է, որը զտված է սորբենտային շերտով: Շարժական փուլը կատարում է լուծիչի և գազային կամ հեղուկ վիճակի տեղափոխվող նյութերի վերլուծված խառնուրդի կրիչի գործառույթները։
Գոյություն ունի սորբցիա երկու տեսակ՝ ադսորբցիա՝ նյութերի կլանումը պինդ մակերեսով և կլանում՝ գազերի և հեղուկների տարրալուծում հեղուկ լուծիչներում։
2. Քրոմատոգրաֆիայի առաջացումը և զարգացումը
Քրոմատագրության՝ որպես գիտական մեթոդի առաջացումը կապված է ռուս ականավոր գիտնական Միխայիլ Սեմենովիչ Ցվետի (1872 - 1919) անվան հետ, ով 1903-ին հայտնաբերեց քրոմատագրությունը բույսերի պիգմենտներում արևային էներգիայի փոխակերպման մեխանիզմի հետազոտության ընթացքում: Որպես քրոմատոգրաֆիկ մեթոդի ստեղծման տարեթիվ պետք է ընդունել այս տարի։
Մ.Ս. Գույնը անալիտների և շարժական փուլի լուծույթը փոխանցել է ապակե խողովակի ներծծող սյունակի միջով: Այս առումով նրա մեթոդը կոչվում էր սյունակային քրոմատոգրաֆիա։ 1938 թվականին Ն.Ա. Իզմայիլովը և Մ.Ս. Շրայբերն առաջարկել է փոփոխել Color մեթոդը և նյութերի խառնուրդի տարանջատումն իրականացնել ափսեի վրա, որը ծածկված է ներծծող նյութի բարակ շերտով։ Այսպես առաջացել է բարակ շերտային քրոմատագրությունը, որը հնարավորություն է տալիս անալիզ իրականացնել նյութի միկրո քանակով։
1947 թվականին Թ.Բ. Գապոն, Է.Ն. Գապոն եւ Ֆ.Մ. Շեմյակինն առաջինն էր, ով իրականացրեց լուծույթում իոնների խառնուրդի քրոմատոգրաֆիկ տարանջատումը՝ դա բացատրելով սորբենտ իոնների և լուծույթում պարունակվող իոնների միջև փոխանակման ռեակցիայի առկայությամբ։ Այսպիսով, բացվեց քրոմատագրության մեկ այլ ուղղություն՝ իոնափոխանակման քրոմատոգրաֆիան։ Ներկայումս իոնափոխանակման քրոմատոգրաֆիան քրոմատոգրաֆիկ մեթոդի կարևորագույն ուղղություններից է։
Է.Ն. եւ Գ.Բ. Գապոն 1948-ին իրականացրեց այն, ինչ Մ.Ս. Գունավորեք նյութերի խառնուրդի քրոմատոգրաֆիկ տարանջատման հնարավորության գաղափարը, որը հիմնված է քիչ լուծվող նստվածքների լուծելիության տարբերությունների վրա: Հայտնվել է նստվածքային քրոմատագրություն։
1957 թվականին Մ.Գոլին առաջարկել է մազանոթ խողովակի ներքին պատերին սորբենտ կիրառել՝ մազանոթային քրոմատոգրաֆիա։ Այս տարբերակը թույլ է տալիս վերլուծել բազմաբաղադրիչ խառնուրդների միկրոքանակները:
1960-ականներին հնարավոր դարձավ սինթեզել ինչպես իոնային, այնպես էլ չլիցքավորված գելեր՝ խիստ սահմանված ծակոտիների չափերով։ Սա հնարավորություն տվեց մշակել քրոմատոգրաֆիայի մի տարբերակ, որի էությունը նյութերի խառնուրդի առանձնացումն է՝ հիմնված գելի մեջ ներթափանցելու ունակության տարբերության վրա՝ գելային քրոմատագրություն։ Այս մեթոդը թույլ է տալիս տարանջատել տարբեր մոլեկուլային քաշ ունեցող նյութերի խառնուրդները։
Ներկայումս քրոմատոգրաֆիան զգալի զարգացում է ստացել։ Այսօր քրոմատոգրաֆիայի տարբեր մեթոդներ, հատկապես այլ ֆիզիկական և ֆիզիկաքիմիական մեթոդների հետ համատեղ, օգնում են գիտնականներին և ճարտարագետներին լուծել գիտական հետազոտությունների և տեխնոլոգիայի տարբեր, հաճախ շատ բարդ խնդիրներ:
3. Քրոմատոգրաֆիկ մեթոդների դասակարգում
Քրոմատոգրաֆիայի մեթոդի մոդիֆիկացիաների և տարբերակների բազմազանությունը պահանջում է դրանց համակարգում կամ դասակարգում:
Դասակարգումը կարող է հիմնված լինել տարբեր չափանիշների վրա, մասնավորապես.
1. փուլերի ագրեգացման վիճակ;
2. տարանջատման մեխանիզմ;
3. գործընթացի իրականացման եղանակը.
4. գործընթացի նպատակը.
Դասակարգումը ըստ փուլերի ագրեգացման վիճակի.
գազային (շարժական փուլ - գազ), գազահեղուկ (շարժական փուլ - գազ, ստացիոնար փուլ - հեղուկ), հեղուկ (շարժական փուլ - հեղուկ) քրոմատագրություն:
Դասակարգումն ըստ տարանջատման մեխանիզմի.
Ադսորբցիոն քրոմատոգրաֆիան հիմնված է վերլուծված խառնուրդի առանձին բաղադրիչների ընտրովի կլանման (կլանման) վրա՝ համապատասխան ադսորբենտների կողմից: Ադսորբցիոն քրոմատոգրաֆիան բաժանվում է հեղուկի (հեղուկ ադսորբցիոն քրոմատոգրաֆիա) և գազային (գազի ադսորբցիոն քրոմատոգրաֆիա)։
Իոնափոխանակման քրոմատոգրաֆիան հիմնված է իոնափոխանակման գործընթացների օգտագործման վրա, որոնք տեղի են ունենում շարժական կլանիչ իոնների և էլեկտրոլիտի իոնների միջև, երբ անալիտի լուծույթն անցնում է իոնափոխանակիչ նյութով (իոնափոխանակիչ) լցված սյունակի միջով: Իոնափոխանակիչները չլուծվող անօրգանական և օրգանական մակրոմոլեկուլային միացություններ են։ Որպես իոնափոխանակիչներ օգտագործվում են ալյումինի օքսիդ, պերմուտիտ, սուլֆոնացված ածուխ և մի շարք սինթետիկ օրգանական իոնափոխանակիչներ՝ իոնափոխանակող խեժեր։
Նստվածքային քրոմատոգրաֆիան հիմնված է նստվածքների տարբեր լուծելիության վրա, որոնք առաջանում են հատուկ ռեակտիվներով վերլուծված խառնուրդի բաղադրիչներից: Օրինակ, երբ Hg (II) և Pb-ի աղերի խառնուրդի լուծույթն անցնում է KI-ի լուծույթով նախապես ներծծված կրիչով սյունակի միջով, ձևավորվում է 2 գունավոր շերտ՝ վերինը՝ գունավոր նարնջագույն-կարմիր (HgI): 2), իսկ ստորինը՝ գունավոր դեղին (PbI 2):
Դասակարգումն ըստ գործընթացի իրականացման մեթոդի.
Սյունակային քրոմատոգրաֆիան քրոմատոգրաֆիայի մի տեսակ է, որում սյունն օգտագործվում է որպես անշարժ լուծիչի կրող։
Թղթային քրոմատոգրաֆիան քրոմատոգրաֆիայի մի տեսակ է, որտեղ սյունակի փոխարեն օգտագործվում են հանքային կեղտեր չպարունակող զտիչ թղթի շերտեր կամ թերթիկներ՝ որպես անշարժ լուծիչի կրող: Այս դեպքում փորձարկման լուծույթի մի կաթիլ, օրինակ, Fe (III) և Co (II) աղերի լուծույթների խառնուրդը կիրառվում է թղթե շերտի եզրին: Թուղթը կասեցվում է փակ խցիկում (նկ. 1)՝ դրա վրա կիրառվող փորձնական լուծույթի կաթիլով իջեցնելով դրա եզրը շարժական լուծիչով անոթի մեջ, օրինակ՝ n-բութիլ սպիրտ։ Շարժական լուծիչը, շարժվելով թղթի միջով, թրջում է այն։ Այս դեպքում վերլուծված խառնուրդում պարունակվող յուրաքանչյուր նյութ իր բնորոշ արագությամբ շարժվում է նույն ուղղությամբ, ինչ լուծիչը: Իոնների տարանջատման վերջում թուղթը չորացնում են, այնուհետև ցողում ռեագենտով, այս դեպքում՝ K 4 լուծույթով, որը բաժանվող նյութերի հետ ձևավորում է գունավոր միացություններ (կապույտ՝ երկաթի իոններով, կանաչ՝ կոբալտի իոններով։ ) Ստացված գոտիները գունավոր բծերի տեսքով հնարավորություն են տալիս հաստատել առանձին բաղադրիչների առկայությունը:
Թղթային քրոմատոգրաֆիան՝ զուգորդված օրգանական ռեակտիվների կիրառմամբ, թույլ է տալիս որակական վերլուծել կատիոնների և անիոնների բարդ խառնուրդները: Մի շարք նյութեր կարելի է հայտնաբերել մեկ քրոմատոգրամի վրա՝ օգտագործելով մեկ ռեագենտ, քանի որ յուրաքանչյուր նյութ բնութագրվում է ոչ միայն համապատասխան գունավորմամբ, այլև քրոմատոգրամի վրա որոշակի տեղակայմամբ։
Բարակ շերտով քրոմատոգրաֆիան իր տարանջատման մեխանիզմով նման է թղթային քրոմատոգրաֆիային: Դրանց միջև տարբերությունն այն է, որ թղթի թերթիկների փոխարեն տարանջատումն իրականացվում է սորբենտի բարակ շերտով պատված թիթեղների վրա՝ պատրաստված փոշու կավահողից, ցելյուլոզից, ցեոլիտից, սիլիկա գելից, դիատոմային հողից և այլն։ և պահպանելով անշարժ լուծիչը: Բարակ շերտով քրոմատոգրաֆիայի հիմնական առավելությունն ապարատի պարզությունն է, փորձի պարզությունն ու բարձր արագությունը, նյութերի խառնուրդի բաժանման բավարար հստակությունը և նյութի ուլտրամիկրոքանակությունները վերլուծելու հնարավորությունը։
Դասակարգումն ըստ քրոմատոգրաֆիական գործընթացի նպատակի.
Քրոմատագրությունը մեծ նշանակություն ունի որպես նյութերի խառնուրդների որակական և քանակական վերլուծության մեթոդ (վերլուծական քրոմատոգրաֆիա)։
Նախապատրաստական քրոմատոգրաֆիան քրոմատոգրաֆիայի մի տեսակ է, որտեղ նյութերի խառնուրդի տարանջատումն իրականացվում է նախապատրաստական նպատակներով, այսինքն. ստանալ քիչ թե շատ զգալի քանակությամբ նյութեր մաքուր տեսքով, կեղտից զերծ. Նախապատրաստական քրոմատոգրաֆիայի խնդիր կարող է լինել նաև միկրոկեղտաջրերի տեսքով պարունակվող նյութերի խառնուրդից կոնցենտրացիան և հետագա մեկուսացումը հիմնական նյութին:
Ոչ անալիտիկ քրոմատոգրաֆիան քրոմատագրության տեսակ է, որն օգտագործվում է որպես գիտական հետազոտության մեթոդ։ Այն օգտագործվում է ուսումնասիրելու համակարգերի հատկությունները, ինչպիսիք են լուծույթները, քիմիական գործընթացների կինետիկան, կատալիզատորների և կլանիչների հատկությունները:
Այսպիսով, քրոմատոգրաֆիան նյութերի խառնուրդների վերլուծության, մաքուր ձևով նյութեր ստանալու, ինչպես նաև համակարգերի հատկությունների ուսումնասիրման ունիվերսալ մեթոդ է։
4. Քրոմատոգրաֆիա պինդ ստացիոնար փուլի վրա
ա) Գազային (գազի-ադսորբցիոն) քրոմատագրություն
Գազային քրոմատագրությունը քրոմատոգրաֆիկ մեթոդ է, որի դեպքում շարժական փուլը գազ է: Գազային քրոմատոգրաֆիան ամենամեծ կիրառությունն է ստացել նյութերի և դրանց խառնուրդների տարանջատման, վերլուծության և ուսումնասիրության համար՝ առանց տարրալուծման անցնելով գոլորշու վիճակի։
Գազային քրոմատոգրաֆիայի տարբերակներից մեկը գազի ադսորբցիոն քրոմատոգրաֆիան է՝ մեթոդ, որտեղ ստացիոնար փուլը պինդ կլանիչ է:
Գազային քրոմատագրության մեջ որպես շարժական փուլ (փոխադրող գազ) օգտագործվում է իներտ գազ՝ հելիում, ազոտ, արգոն, շատ ավելի հազվադեպ՝ ջրածին և ածխածնի երկօքսիդ։ Երբեմն կրող գազը ցնդող հեղուկների գոլորշի է:
Գազային քրոմատագրման գործընթացը սովորաբար իրականացվում է հատուկ գործիքներով, որոնք կոչվում են գազային քրոմատոգրաֆներ (նկ. 3): Նրանցից յուրաքանչյուրն ունի կրող գազի հոսքի մատակարարման համակարգ, փորձնական խառնուրդի պատրաստման և ներարկման համակարգ, ջերմաստիճանի հսկողության համակարգով քրոմատոգրաֆիկ սյունակ, անալիզի համակարգ (դետեկտոր) և տարանջատման և վերլուծության արդյունքների գրանցման համակարգ (գրանցող):
Ջերմաստիճանը մեծ նշանակություն ունի գազի կլանման քրոմատագրության մեջ։ Նրա դերը, առաջին հերթին, գազ-պինդ համակարգում սորբցիոն հավասարակշռության փոփոխությունն է։ Խառնուրդի բաղադրիչների տարանջատման աստիճանը, սյունակի արդյունավետությունը և վերլուծության ընդհանուր արագությունը կախված են սյունակի ջերմաստիճանի ճիշտ ընտրությունից: Գոյություն ունի սյունակի որոշակի ջերմաստիճանային միջակայք, որում քրոմատոգրաֆիկ անալիզը օպտիմալ է: Սովորաբար, այս ջերմաստիճանի միջակայքը գտնվում է որոշվածի եռման կետին մոտ գտնվող տարածաշրջանում քիմիական միացություն. Երբ խառնուրդի բաղադրիչների եռման կետերը շատ տարբեր են միմյանցից, օգտագործվում է սյունակի ջերմաստիճանի ծրագրավորում։
Քրոմատոգրաֆիկ սյունակում տարանջատումը գազաքրոմատագրական վերլուծության ողջ գործընթացի ամենակարևոր, բայց նախնական գործողությունն է: Որպես կանոն, սյունակից դուրս եկող երկուական խառնուրդները (փոխադրող գազ - բաղադրիչ) մտնում են հայտնաբերող սարք։ Այստեղ բաղադրիչների կոնցենտրացիաների փոփոխությունները ժամանակի ընթացքում վերածվում են էլեկտրական ազդանշանի, որը գրանցվում է հատուկ համակարգի միջոցով կորի տեսքով, որը կոչվում է քրոմատոգրամ: Ամբողջ փորձի արդյունքները մեծապես կախված են դետեկտորի տեսակի և դրա դիզայնի ճիշտ ընտրությունից։ Դետեկտորների մի քանի դասակարգումներ կան. Կան դիֆերենցիալ և ինտեգրալ դետեկտորներ: Դիֆերենցիալ դետեկտորները ժամանակի ընթացքում գրանցում են բնութագրերից մեկի (կենտրոնացում կամ հոսք) ակնթարթային արժեքը: Ինտեգրալ դետեկտորներն ամփոփում են նյութի քանակությունը որոշակի ժամանակահատվածում: Օգտագործվում են նաև աշխատանքի, զգայունության և նշանակության տարբեր սկզբունքների դետեկտորներ՝ ջերմահաղորդչային, իոնացնող, սպեկտրոսկոպիկ, զանգվածային սպեկտրաչափական, կուլոմետրիկ և շատ ուրիշներ։
Գազի ադսորբցիոն քրոմատոգրաֆիայի կիրառում
Գազի կլանման քրոմատոգրաֆիան օգտագործվում է քիմիական և նավթաքիմիական արդյունաբերություններում՝ քիմիական և նավթաքիմիական սինթեզի արտադրանքները, նավթային ֆրակցիաների կազմը, որոշելու ռեագենտների մաքրությունը և հիմնական արտադրանքի պարունակությունը տեխնոլոգիական գործընթացների տարբեր փուլերում և այլն:
Մշտական գազերի և թեթև ածխաջրածինների, ներառյալ իզոմերների, գազային քրոմատագրման վերլուծությունը տևում է 5-6 րոպե: Նախկինում ավանդական գազի անալիզատորների վրա այս անալիզը տևում էր 5-6 ժամ: Այս ամենը հանգեցրեց նրան, որ գազային քրոմատագրությունը սկսեց լայնորեն կիրառվել ոչ միայն գիտահետազոտական ինստիտուտներում և վերահսկման և չափման լաբորատորիաներում, այլև դարձավ արդյունաբերական ձեռնարկությունների ինտեգրված ավտոմատացման համակարգերի մի մասը:
Այսօր գազային քրոմատոգրաֆիան օգտագործվում է նաև նավթի և գազի հանքավայրերի որոնման մեջ՝ հնարավորություն տալով որոշել հողերից վերցված օրգանական նյութերի պարունակությունը՝ նշելով նավթի և գազի հանքավայրերի մոտիկությունը։
Գազային քրոմատոգրաֆիան հաջողությամբ կիրառվում է դատաբժշկության մեջ, որտեղ այն օգտագործվում է արյան բծերի, բենզինի, յուղերի, թանկարժեք սննդամթերքի կեղծման և այլնի նմուշների ինքնությունը հաստատելու համար։ Շատ հաճախ գազային քրոմատոգրաֆիան օգտագործվում է ավտոմեքենայի վարորդների արյան մեջ ալկոհոլի պարունակությունը որոշելու համար։ Մատից մի քանի կաթիլ արյունը բավական է պարզելու համար, թե որքան, երբ և ինչպիսի ալկոհոլային խմիչք է նա խմել։
Գազային քրոմատագրությունը թույլ է տալիս մեզ արժեքավոր և եզակի տեղեկություններ ստանալ սննդամթերքի հոտերի բաղադրության մասին, ինչպիսիք են պանիրը, սուրճը, խավիարը, կոնյակը և այլն: Երբեմն գազաքրոմատոգրաֆիական անալիզի արդյունքում ստացված տեղեկատվությունը մեզ չի գոհացնում: Օրինակ, հազվադեպ չէ, որ պարենային ապրանքները պարունակում են չափից ավելի թունաքիմիկատներ կամ մրգահյութը պարունակում է տրիքլորէթիլեն, որը, հակառակ արգելքների, օգտագործվել է մրգերից կարոտինի արդյունահանման աստիճանը բարձրացնելու համար և այլն: Բայց հենց այս տեղեկությունն է պաշտպանում մարդու առողջությունը:
Այնուամենայնիվ, հազվադեպ չէ, որ մարդիկ պարզապես անտեսում են ստացված տեղեկատվությունը: Սա առաջին հերթին վերաբերում է ծխելուն։ Մանրամասն գազաքրոմատոգրաֆիկ անալիզը վաղուց հաստատել է, որ ծխախոտի և ծխախոտի ծուխը պարունակում է մինչև 250 տարբեր ածխաջրածիններ և դրանց ածանցյալներ, որոնցից մոտ 50-ն ունեն քաղցկեղածին ազդեցություն։ Այդ իսկ պատճառով թոքերի քաղցկեղը 10 անգամ ավելի հաճախ է հանդիպում ծխողների մոտ, սակայն դեռ միլիոնավոր մարդիկ շարունակում են թունավորել իրենց, իրենց գործընկերներին ու հարազատներին։
Բժշկության մեջ գազային քրոմատոգրաֆիան լայնորեն կիրառվում է բազմաթիվ դեղամիջոցների պարունակությունը որոշելու, ճարպաթթուների, խոլեստերինի, ստերոիդների մակարդակը որոշելու համար և այլն։ հիվանդի մարմնում. Նման վերլուծությունները չափազանց կարևոր տեղեկություններ են տալիս մարդու առողջության վիճակի, նրա հիվանդության ընթացքի, որոշակի դեղամիջոցների օգտագործման արդյունավետության մասին։
Գիտական հետազոտություններ մետալուրգիայի, մանրէաբանության, կենսաքիմիայի, բույսերի պաշտպանության միջոցների և նոր դեղամիջոցների մշակման, նոր պոլիմերների ստեղծման, Շինանյութերև մարդկային գործնական գործունեության շատ այլ շատ բազմազան ոլորտներում անհնար է պատկերացնել առանց այնպիսի հզոր վերլուծական մեթոդի, ինչպիսին գազային քրոմատագրությունն է:
Գազային քրոմատագրությունը հաջողությամբ կիրառվել է ջրի և օդում մարդու առողջության համար վտանգավոր բազմացիկլային արոմատիկ միացությունների պարունակությունը, լցակայանների օդում բենզինի մակարդակը, օդում ավտոմեքենաների արտանետվող գազերի բաղադրությունը և այլն:
Այս մեթոդը լայնորեն կիրառվում է որպես շրջակա միջավայրի մաքրության մոնիտորինգի հիմնական մեթոդներից մեկը։
Գազային քրոմատոգրաֆիան տեւում է կարևոր տեղմեր կյանքում՝ տրամադրելով մեզ հսկայական քանակությամբ տեղեկատվություն: Ազգային տնտեսության մեջ և հետազոտական կազմակերպություններում օգտագործվում են ավելի քան 20 հազար տարբեր գազային քրոմատոգրաֆներ, որոնք անփոխարինելի օգնականներշատերը լուծելիս դժվար առաջադրանքներորոնք ամեն օր բախվում են հետազոտողների և ինժեներների հետ:
բ) Հեղուկ (հեղուկ ադսորբցիոն) քրոմատագրություն
Հեղուկ քրոմատոգրաֆիան քրոմատոգրաֆիայի տարբերակների խումբ է, որտեղ շարժական փուլը հեղուկ է։
Հեղուկ քրոմատոգրաֆիայի տարբերակներից մեկը հեղուկ ադսորբցիոն քրոմատոգրաֆիան է՝ մեթոդ, որի դեպքում ստացիոնար փուլը պինդ կլանիչ է:
Թեև հեղուկ քրոմատոգրաֆիան հայտնաբերվեց գազային քրոմատագրությունից առաջ, այն մտավ բացառիկ ինտենսիվ զարգացման շրջան միայն 20-րդ դարի երկրորդ կեսին։ Ներկայումս քրոմատոգրաֆիական պրոցեսի տեսության զարգացվածության աստիճանով և գործիքավորման տեխնիկայով, արդյունավետությամբ և տարանջատման արագությամբ այն հազիվ թե զիջում է գազաքրոմատոգրաֆիկ տարանջատման մեթոդին։ Այնուամենայնիվ, քրոմատոգրաֆիայի այս երկու հիմնական տեսակներից յուրաքանչյուրն ունի իր նախընտրելի կիրառման տարածքը: Եթե գազային քրոմատոգրաֆիան հարմար է հիմնականում 500-600 մոլեկուլային քաշ ունեցող քիմիական նյութերի վերլուծության, տարանջատման և ուսումնասիրության համար, ապա հեղուկ քրոմատագրությունը կարող է օգտագործվել մի քանի հարյուրից մինչև մի քանի միլիոն մոլեկուլային քաշ ունեցող նյութերի համար, ներառյալ պոլիմերների չափազանց բարդ մակրոմոլեկուլները, սպիտակուցներ և նուկլեինաթթուներ. Այնուամենայնիվ, տարբեր քրոմատոգրաֆիկ մեթոդների հակադրությունն էապես զուրկ է ողջախոհություն, քանի որ քրոմատոգրաֆիկ մեթոդները հաջողությամբ լրացնում են միմյանց, և կոնկրետ ուսումնասիրության խնդիրը պետք է այլ կերպ մոտենա, այն է, թե որ քրոմատոգրաֆիկ մեթոդն է թույլ տալիս լուծել այն ավելի մեծ արագությամբ, տեղեկատվական բովանդակությամբ և ավելի ցածր գնով:
Ինչպես գազային քրոմատոգրաֆիայում, այնպես էլ ժամանակակից հեղուկ քրոմատագրաֆիան օգտագործում է դետեկտորներ, որոնք թույլ են տալիս շարունակաբար գրանցել անալիտի կոնցենտրացիան սյունակից հոսող հեղուկ հոսքում:
Չկա մեկ ունիվերսալ դետեկտոր հեղուկ քրոմատագրման համար: Հետեւաբար, յուրաքանչյուր կոնկրետ դեպքում պետք է ընտրել ամենահարմար դետեկտորը: Առավել տարածված են ուլտրամանուշակագույն, ռեֆրակտոմետրիկ, միկրոադսորբցիոն և տրանսպորտային բոցի իոնացման դետեկտորները։
Սպեկտրոմետրիկ դետեկտորներ. Այս տիպի դետեկտորները շատ զգայուն ընտրողական սարքեր են, որոնք հնարավորություն են տալիս որոշել նյութերի շատ փոքր կոնցենտրացիաները հեղուկ փուլային հոսքում: Նրանց ընթերցումները քիչ են կախված ջերմաստիճանի տատանումներից և շրջակա միջավայրի այլ պատահական փոփոխություններից: Սպեկտրոմետրիկ դետեկտորների կարևոր առանձնահատկություններից մեկը հեղուկ ադսորբցիոն քրոմատագրության մեջ օգտագործվող լուծիչների մեծ մասի թափանցիկությունն է աշխատանքային ալիքի երկարության տիրույթում:
Ամենից հաճախ կլանումն օգտագործվում է ուլտրամանուշակագույն, ավելի քիչ՝ IR շրջանում: Ուլտրամանուշակագույն ճառագայթման տարածքում օգտագործվում են սարքեր, որոնք գործում են լայն տիրույթում՝ 200 նմ-ից մինչև սպեկտրի տեսանելի հատվածը կամ որոշակի ալիքի երկարություններում, առավել հաճախ՝ 280 և 254 նմ: Որպես ճառագայթման աղբյուրներ օգտագործվում են ցածր ճնշման (254 նմ), միջին ճնշման (280 նմ) սնդիկի լամպեր և համապատասխան զտիչներ։
Microadsorption դետեկտորներ. Միկրադսորբցիոն դետեկտորների գործողությունը հիմնված է դետեկտորային բջիջը լցնող նյութի կլանման ժամանակ ջերմության արտազատման վրա: Սակայն չափվում է ոչ թե ջերմությունը, այլ ներծծվող նյութի ջերմաստիճանը, որին այն տաքացվում է կլանման արդյունքում։
Միկրադսորբցիոն դետեկտորը բավականին բարձր զգայուն գործիք է: Դրա զգայունությունը հիմնականում կախված է կլանման ջերմությունից:
Microadsorption դետեկտորները ունիվերսալ են, հարմար են ինչպես օրգանական, այնպես էլ անօրգանական նյութեր հայտնաբերելու համար: Սակայն դրանց վրա բավականաչափ հստակ քրոմատոգրամներ ստանալը դժվար է, հատկապես խառնուրդի բաղադրիչների թերի տարանջատման դեպքում։
5. Քրոմատոգրաֆիա հեղուկ ստացիոնար փուլի վրա
ա) գազահեղուկ քրոմատագրություն
Գազային-հեղուկ քրոմատոգրաֆիան գազային քրոմատոգրաֆիական մեթոդ է, որի դեպքում անշարժ փուլը ցածր ցնդող հեղուկ է, որը դրված է պինդ կրիչի վրա:
Այս տեսակի քրոմատոգրաֆիան օգտագործվում է հեղուկների գազերն ու գոլորշիները բաժանելու համար։
Գազային հեղուկի և գազի կլանման քրոմատոգրաֆիայի հիմնական տարբերությունն այն է, որ առաջին դեպքում մեթոդը հիմնված է լուծարման գործընթացի և գազի կամ գոլորշու հետագա գոլորշիացման վրա, որը պահվում է ամուր իներտ կրիչի կողմից պահվող հեղուկ թաղանթից. երկրորդ դեպքում տարանջատման գործընթացը հիմնված է պինդ նյութի՝ ներծծող նյութի մակերեսի վրա գազի կամ գոլորշու կլանման և հետագա կլանման վրա:
Քրոմատագրման գործընթացը սխեմատիկորեն կարող է ներկայացվել հետևյալ կերպ. Գազերի կամ ցնդող հեղուկների գոլորշիների խառնուրդը կրող գազի հոսքով ներարկվում է ֆիքսված իներտ կրիչով լցված սյունակի մեջ, որի վրա բաշխված է ոչ ցնդող հեղուկ (ստացիոնար փուլ): Հետազոտված գազերն ու գոլորշիները ներծծվում են այս հեղուկով: Այնուհետև առանձնացվելիք խառնուրդի բաղադրիչները ընտրողաբար դուրս են մղվում սյունակից որոշակի կարգով:
Գազային հեղուկ քրոմատագրության մեջ օգտագործվում են մի շարք դետեկտորներ, որոնք հատուկ արձագանքում են ցանկացած օրգանական նյութի կամ որոշակի ֆունկցիոնալ խմբի օրգանական նյութերի: Դրանք ներառում են իոնացման դետեկտորներ, էլեկտրոնների գրավման դետեկտորներ, թերմիոնիկ, սպեկտրոֆոտոմետրիկ և որոշ այլ դետեկտորներ:
Ֆլեյմի իոնացման դետեկտոր (FID): FID-ի աշխատանքը հիմնված է այն փաստի վրա, որ ջրածնային այրիչի բոց մտնող օրգանական նյութերը ենթարկվում են իոնացման, ինչի արդյունքում իոնացման հոսանք է առաջանում դետեկտորի խցիկում, որը նաև իոնացման խցիկ է, որի ուժը համաչափ է։ լիցքավորված մասնիկների քանակին:
FID-ը զգայուն է միայն օրգանական միացությունների նկատմամբ և զգայուն կամ շատ թույլ չէ գազերի նկատմամբ, ինչպիսիք են օդը, ծծումբը և ածխածնի օքսիդները, ջրածնի սուլֆիդը, ամոնիակը, ածխածնի դիսուլֆիդը, ջրի գոլորշին և մի շարք այլ անօրգանական միացություններ: Օդի նկատմամբ FID-ի անզգայունությունը թույլ է տալիս այն օգտագործել տարբեր օրգանական նյութերով օդի աղտոտվածությունը որոշելու համար:
FID-ի շահագործման մեջ օգտագործվում է 3 գազ՝ կրող գազ (հելիում կամ ազոտ), ջրածին և օդ։ Բոլոր 3 գազերը պետք է լինեն բարձր մաքրությամբ։
Արգոնի դետեկտոր. Արգոնի դետեկտորում իոնացումն առաջանում է անալիտի մոլեկուլների բախումից մետաստայուն արգոնի ատոմների հետ, որոնք ձևավորվել են ռադիոակտիվ B ճառագայթման ազդեցության արդյունքում:
Թերմիոնիկ դետեկտոր. Թերմիոնային դետեկտորի աշխատանքի սկզբունքն այն է, որ ալկալիական մետաղների աղերը, գոլորշիանալով այրիչի կրակի մեջ, ընտրողաբար արձագանքում են հալոգեններ կամ ֆոսֆոր պարունակող միացությունների հետ: Նման միացությունների բացակայության դեպքում դետեկտորի իոնացման խցիկում հաստատվում է ալկալիական մետաղների ատոմների հավասարակշռություն։ Ֆոսֆորի ատոմների առկայությունը ալկալիական մետաղների ատոմների հետ նրանց ռեակցիայի պատճառով խախտում է այս հավասարակշռությունը և խցում առաջացնում է իոնային հոսանքի առաջացում։
Քանի որ թերմիոնային դետեկտորն ունի ամենաբարձր զգայունությունը ֆոսֆոր պարունակող միացությունների նկատմամբ, այն կոչվում է ֆոսֆոր: Այս դետեկտորը հիմնականում օգտագործվում է ֆոսֆորօրգանական թունաքիմիկատների, միջատասպանների և մի շարք կենսաբանական ակտիվ միացությունների վերլուծության համար։
բ) գելային քրոմատոգրաֆիա
Գելային քրոմատոգրաֆիան (գելային ֆիլտրացիա) տարբեր մոլեկուլային քաշ ունեցող նյութերի խառնուրդների առանձնացման մեթոդ է՝ վերլուծված լուծույթը ֆիլտրելով խաչաձեւ բջջային գելերի միջոցով:
Նյութերի խառնուրդի բաժանումը տեղի է ունենում, եթե այդ նյութերի մոլեկուլների չափերը տարբեր են, իսկ գելային հատիկների ծակոտիների տրամագիծը հաստատուն է և կարող է անցնել միայն այն մոլեկուլները, որոնց չափերը փոքր են, քան անցքերի տրամագիծը: գել ծակոտիները. Վերլուծված խառնուրդի լուծույթը զտելիս ավելի փոքր մոլեկուլները, որոնք ներթափանցում են գելի ծակոտիները, պահվում են այս ծակոտիներում պարունակվող լուծիչում և շարժվում են գելային շերտի երկայնքով ավելի դանդաղ, քան մեծ մոլեկուլները, որոնք չեն կարողանում ներթափանցել ծակոտիները: Այսպիսով, գելային քրոմատոգրաֆիան հնարավորություն է տալիս առանձնացնել նյութերի խառնուրդ՝ կախված այդ նյութերի մասնիկների չափից և մոլեկուլային քաշից։ Տարանջատման այս մեթոդը բավականին պարզ է, արագ և, որ ամենակարևորն է, թույլ է տալիս նյութերի խառնուրդների տարանջատումը ավելի մեղմ պայմաններում, քան մյուս քրոմատոգրաֆիկ մեթոդները։
Եթե սյունակը լցնում եք գելային հատիկներով, ապա դրա մեջ լուծույթ լցնում տարբեր նյութերտարբեր մոլեկուլային կշիռներով, ապա երբ լուծումը շարժվի սյունակում գտնվող գելային շերտի երկայնքով, այս խառնուրդը կառանձնանա։
Փորձի սկզբնական շրջանը՝ վերլուծված խառնուրդի լուծույթի կիրառում սյունակում գտնվող գելային շերտի վրա: Երկրորդ փուլ - գելը չի կանխում փոքր մոլեկուլների տարածումը ծակոտիների մեջ, մինչդեռ խոշոր մոլեկուլները մնում են գելի հատիկները շրջապատող լուծույթում: Երբ գելի շերտը լվանում են մաքուր լուծիչով, խոշոր մոլեկուլները սկսում են շարժվել լուծիչի արագությանը մոտ արագությամբ, մինչդեռ փոքր մոլեկուլները պետք է նախ ցրվեն գելի ներքին ծակոտիներից դեպի հատիկների միջև ընկած ծավալը և, որպես արդյունքը պահվում և ավելի ուշ լվացվում է լուծիչով: Նյութերի խառնուրդն առանձնացվում է ըստ դրանց մոլեկուլային քաշի։ Նյութերը լվանում են սյունակից՝ ըստ մոլեկուլային քաշի նվազման:
Գելային քրոմատոգրաֆիայի կիրառում.
Գելային քրոմատագրության հիմնական նպատակը մակրոմոլեկուլային միացությունների խառնուրդների բաժանումն է և պոլիմերների մոլեկուլային քաշի բաշխման որոշումը։
Այնուամենայնիվ, գելային քրոմատոգրաֆիան հավասարապես օգտագործվում է միջին մոլեկուլային քաշի և նույնիսկ ցածր մոլեկուլային քաշի միացությունների նյութերի խառնուրդները առանձնացնելու համար: Այս դեպքում շատ կարևոր է, որ գելային քրոմատոգրաֆիան թույլ է տալիս առանձնացնել սենյակային ջերմաստիճանում, ինչը բարենպաստ համեմատվում է գազահեղուկ քրոմատոգրաֆիայի հետ, որը պահանջում է տաքացում՝ անալիտները գոլորշիների փուլ տեղափոխելու համար:
Նյութերի խառնուրդի տարանջատումը գելային քրոմատագրմամբ հնարավոր է նաև, երբ վերլուծված նյութերի մոլեկուլային կշիռները շատ մոտ են կամ նույնիսկ հավասար: Այս դեպքում օգտագործվում է լուծվող նյութերի փոխազդեցությունը գելի հետ։ Այս փոխազդեցությունը կարող է այնքան նշանակալի լինել, որ վերացնում է մոլեկուլների չափերի տարբերությունները: Եթե գելի հետ փոխազդեցության բնույթը տարբեր է տարբեր նյութերի համար, ապա այս տարբերությունը կարող է օգտագործվել հետաքրքրության խառնուրդը առանձնացնելու համար:
Օրինակ՝ գելային քրոմատոգրաֆիայի օգտագործումը վահանաձև գեղձի հիվանդությունների ախտորոշման համար։ Ախտորոշումը հաստատվում է վերլուծության ընթացքում որոշված յոդի քանակով։
Գելային քրոմատոգրաֆիայի կիրառման տրված օրինակները ցույց են տալիս դրա լայն հնարավորությունները վերլուծական խնդիրների լայն տեսականի լուծելու համար։
Եզրակացություն
Որպես մեզ շրջապատող աշխարհը հասկանալու գիտական մեթոդ՝ քրոմատոգրաֆիան մշտապես զարգանում և բարելավվում է: Այսօր այն այնքան հաճախ և այնքան լայնորեն օգտագործվում է գիտական հետազոտությունների, բժշկության, մոլեկուլային կենսաբանության, կենսաքիմիայի, տեխնոլոգիայի և ազգային տնտեսության մեջ, որ շատ դժվար է գտնել գիտելիքի այնպիսի ոլորտ, որտեղ քրոմատագրությունը չօգտագործվի:
Քրոմատոգրաֆիան՝ որպես հետազոտության մեթոդ՝ իր բացառիկ հնարավորություններով, հզոր գործոն է՝ հասկանալու և փոխակերպելու ավելի ու ավելի բարդ աշխարհը՝ մեր մոլորակի վրա մարդկանց համար ընդունելի կենսապայմաններ ստեղծելու շահերից:
ՄԱՏԵՆԱԳՐՈՒԹՅՈՒՆ
1. Այվազով Բ.Վ. Քրոմատոգրաֆիայի ներածություն. - M.: Vyssh.shk., 1983 - էջ. 8-18, 48-68, 88-233.
2. Կրեշկով Ա.Պ. Անալիտիկ քիմիայի հիմունքներ. Տեսական հիմք. Որակական վերլուծություն, գիրք առաջին, 4-րդ հրտ., վերանայված։ Մ., «Քիմիա», 1976 - էջ. 119-125 թթ.
3. Սակոդինսկի Կ.Ի., Օրեխով Բ.Ի. Քրոմատոգրաֆիան գիտության և տեխնիկայի մեջ. - Մ.: Գիտելիք, 1982 - էջ. 3-20, 28-38, 58-59.
Ներածություն
Բարձր արդյունավետության հեղուկ քրոմատոգրաֆիան (HPLC) նյութերի բարդ խառնուրդների առանձնացման արդյունավետ մեթոդներից մեկն է, որը լայնորեն կիրառվում է ինչպես անալիտիկ քիմիայում, այնպես էլ քիմիական տեխնոլոգիաներում։ Քրոմատոգրաֆիկ տարանջատման հիմքը խառնուրդի բաղադրիչների մասնակցությունն է, որոնք առանձնացված են վան դեր Վալսի փոխազդեցությունների բարդ համակարգում (հիմնականում միջմոլեկուլային) փուլային սահմաններում: Որպես վերլուծության մեթոդ՝ HPLC-ն մտնում է մեթոդների խմբի մեջ, որը, ելնելով ուսումնասիրվող օբյեկտների բարդությունից, ներառում է նախնական բարդ խառնուրդի նախնական տարանջատումը համեմատաբար պարզների։ Ստացված պարզ խառնուրդներն այնուհետև վերլուծվում են սովորական ֆիզիկաքիմիական մեթոդներով կամ քրոմատագրման համար մշակված հատուկ մեթոդներով:
Հեղուկ քրոմատագրության զարգացման պատմություն
Քրոմատոգրաֆիան հայտնաբերել է Մ.Ս. Ցվետը 1903 թվականին հեղուկ-ադսորբցիոն սյունակի մեթոդի տեսքով։ Այս մեթոդով օգտագործվել են 50–100 մկմ-ից ավելի հատիկի չափով ադսորբենտներ, լուծիչն ինքնահոսով անցել է սյունակի միջով, չկային հոսքի դետեկտորներ։ Տարանջատումն ընթացավ դանդաղ, մի քանի ժամվա ընթացքում, և այս ռեժիմում հեղուկ քրոմատոգրաֆիան չի կարող օգտագործվել վերլուծական նպատակներով: 1965-1970 թթ. տարբեր երկրների մասնագետների ջանքերն ուղղված են եղել էքսպրես հեղուկ քրոմատոգրաֆիայի ստեղծմանը։ Պարզ էր, որ տարանջատման արագությունը բարձրացնելու համար անհրաժեշտ էր կրճատել արտաքին և ներքին դիֆուզիայի ուղիները։ Դրան կարելի է հասնել՝ նվազեցնելով ներծծող հատիկների տրամագիծը: Սյուները բարակ հատիկներով (5-10 մկմ) լցնելը ստեղծեց մուտքի բարձր ճնշում, որը պահանջում էր բարձր ճնշման պոմպերի օգտագործում։ Ահա թե ինչպես է ծնվել բարձր ճնշման հեղուկ քրոմատոգրաֆիան։ Նուրբ ֆրակցիայի ադսորբենտներին անցնելու դեպքում սյուների արդյունավետությունը մեծապես բարձրացավ (մեկ միավորի երկարության համար հարյուր անգամ ավելի բարձր է, քան գազային քրոմատագրության սյունակների արդյունավետությունը), ուստի ժամանակակից էքսպրես անալիտիկ հեղուկ քրոմատոգրաֆիան կոչվեց բարձր արդյունավետության հեղուկ քրոմատագրություն (HPLC): ) Կոշտ մանրահատիկ ադսորբենտների մշակումը (5 կամ 10 մկմ), բարձր ճնշման պոմպերի (ավելի քան 200 ատմ) և հոսքի դետեկտորների ստեղծումը. այս ամենը ապահովեց HPLC-ի բարձր արդյունավետությունը: Տարանջատման ժամանակներով այն ոչնչով չէր զիջում գազային քրոմատագրությանը, իսկ կիրառման ոլորտներով զգալիորեն գերազանցում էր նրան։ Ժամանակի այս շրջանը սկսեց կոչվել հեղուկ քրոմատագրության երկրորդ ծնունդ՝ վերածնունդ, նրա վերածննդի շրջան։
Առաջին կոմերցիոն հեղուկ քրոմատոգրաֆներից մեկը DuPont Model 820-ն էր (1968): Դրան նախորդել է հեղուկ քրոմատոգրաֆիայի համար դետեկտորների շարքի մշակումը. հաղորդիչ դետեկտոր (1951), կլանման ջերմային դետեկտոր (1959), բեկման ցուցիչի դետեկտոր (1962), ուլտրամանուշակագույն դետեկտոր (1966), հեղուկ քրոմատոգրաֆ / զանգվածային սպեկտրոմետրի համակարգ (1973), դիոդային զանգվածի վրա դետեկտորի առաջին տարբերակը (1976)։
1969 թվականին Ի. Հալաշը և Ի. Սեբաստիանը առաջարկեցին սորբենտներ՝ քիմիապես պատվաստված ալկիլային շղթաներով («խոզանակի սորբենտներ») Si--O--C կապերով։ Այս հարաբերությունները անկայուն էին։ 1970 թվականին Ջ. Կիրկլենդը մշակել է սորբենտներ ավելի կայուն Si--O-Si կապերով: Հանուն արդարության պետք է նշել, որ նման մոդիֆիկացիա առաջարկվել է շատ ավելի վաղ (1959 թ.) Կ.Դ. Շչերբակովան և Ա.Վ. Կիսելևը։
Մեզ մոտ հեղուկ քրոմատոգրաֆները մշակվել են 1969--1972 թվականներին, դրանք են Ցվետ-1-69, Ցվետ-304 և ԽԳ-1301 մոդելները։