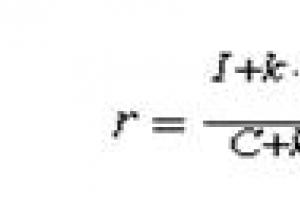حدد متوسط السعة الحرارية في نطاق درجة الحرارة. السعة الحرارية صحيحة ومتوسطة ومتساوية الضغط ومتساوية الضغط. إرشادات تحضير المختبر
السعة الحرارية هي نسبة كمية الحرارة المنقولة إلى النظام إلى زيادة درجة الحرارة الملحوظة في هذه الحالة (في حالة عدم وجود تفاعل كيميائي، انتقال مادة من حالة تجميع إلى أخرى وعند A "= 0.)
تُحسب السعة الحرارية عادةً لكل 1 جرام من الكتلة ، ثم تسمى محددة (J / g * K) ، أو لكل 1 مول (J / mol * K) ، ثم تسمى الضرس.
يميز متوسط وصحيحالسعة الحرارية.
وسطالسعة الحرارية هي السعة الحرارية في نطاق درجة الحرارة ، أي نسبة الحرارة الممنوحة للجسم إلى الزيادة في درجة حرارته بمقدار ΔТ
حقيقيالسعة الحرارية للجسم هي نسبة كمية الحرارة المتناهية الصغر التي يتلقاها الجسم إلى الزيادة المقابلة في درجة حرارته.
من السهل إنشاء اتصال بين السعة الحرارية المتوسطة والحقيقية:
استبدال قيم Q في التعبير عن متوسط السعة الحرارية ، لدينا:
![]()
تعتمد السعة الحرارية الحقيقية على طبيعة المادة ودرجة الحرارة والظروف التي يحدث فيها انتقال الحرارة إلى النظام.
لذلك ، إذا كان النظام محاطًا بحجم ثابت ، أي لـ متساوي الصدرالعملية لدينا:
إذا توسع النظام أو انكمش بينما ظل الضغط ثابتًا ، أي ل متساوى الضغطالعملية لدينا:
لكن ΔQ V = dU ، و ΔQ P = dH ، لذلك
C V = (∂U / T) v ، و C P = (∂H / T) ص
(إذا كان هناك متغير واحد أو أكثر ثابتًا بينما يتغير الآخرون ، فيُقال إن المشتقات جزئية فيما يتعلق بالمتغير المتغير).
كلا النسبتين صالحان لأي مواد وأي حالات تجميع. لإظهار العلاقة بين C V و C P ، من الضروري التمييز بين تعبير المحتوى الحراري H \ u003d U + pV /
بالنسبة لغاز مثالي pV = nRT
![]()
لخلد واحد أو
الفرق R هو عمل التمدد متساوي الضغط لـ 1 مول من غاز مثالي حيث ترتفع درجة الحرارة بمقدار وحدة واحدة.
بالنسبة للسوائل والمواد الصلبة ، بسبب تغير طفيف في الحجم عند التسخين ، С P = С V
اعتماد التأثير الحراري لتفاعل كيميائي على درجة الحرارة ، معادلات كيرشوف.
باستخدام قانون هيس ، يمكن للمرء حساب التأثير الحراري للتفاعل عند درجة حرارة (عادة 298 كلفن) حيث يتم قياس درجات الحرارة القياسية للتكوين أو الاحتراق لجميع المشاركين في التفاعل.
ولكن في كثير من الأحيان يكون من الضروري معرفة التأثير الحراري للتفاعل عند درجات حرارة مختلفة.
ضع في اعتبارك رد الفعل:
ν أ أ + ν ب ب = ν ج С + ν د د
دعونا نشير بواسطة H المحتوى الحراري للمشارك في التفاعل لكل 1 مول. يتم التعبير عن التغيير الكلي في المحتوى الحراري ΔΗ (T) للتفاعل بالمعادلة:
ΔΗ \ u003d (ν C H C + ν D H D) - (ν A H A + ν B H B) ؛ معاملات القياس المتكافئ va ، vb ، vc ، vd. x.r.
إذا استمر التفاعل عند ضغط ثابت ، فإن التغيير في المحتوى الحراري سيكون مساويًا للتأثير الحراري للتفاعل. وإذا اشتقنا هذه المعادلة بالنسبة لدرجة الحرارة ، نحصل على:
معادلات متساوية الضغط وعملية متساوية الصدور
![]() و
و ![]()
مُسَمًّى معادلات كيرشوف(في شكل تفاضلي). يسمحون نوعياتقييم اعتماد التأثير الحراري على درجة الحرارة.
يتم تحديد تأثير درجة الحرارة على التأثير الحراري من خلال علامة القيمة ΔС p (أو ΔС V)
في ∆С ص> 0القيمة ، أي مع زيادة درجة الحرارة يزيد التأثير الحراري
في ∆С ص< 0 أي ، مع زيادة درجة الحرارة ، ينخفض التأثير الحراري.
في ∆С p = 0- التأثير الحراري للتفاعل لا تعتمد على درجة الحرارة
أي ، كما يلي من هذا ، تحدد ΔС p العلامة الموجودة أمام ΔН.
السعة الحرارية هي القدرة على امتصاص قدر من الحرارة أثناء التسخين أو التخلص منها عند التبريد. السعة الحرارية للجسم هي نسبة كمية الحرارة المتناهية الصغر التي يتلقاها الجسم إلى الزيادة المقابلة في مؤشرات درجة الحرارة. تقاس القيمة بـ J / K. في الممارسة العملية ، يتم استخدام قيمة مختلفة قليلاً - السعة الحرارية المحددة.
تعريف
ماذا تعني السعة الحرارية المحددة؟ هذه كمية مرتبطة بكمية واحدة من مادة ما. وفقًا لذلك ، يمكن قياس كمية المادة بالأمتار المكعبة أو الكيلوجرامات أو حتى بالمولات. على ماذا تعتمد؟ في الفيزياء ، تعتمد السعة الحرارية بشكل مباشر على الوحدة الكمية التي تشير إليها ، مما يعني أنها تميز بين السعة الحرارية المولية والكتلة والحجمية. في صناعة البناء ، لن تقابل القياسات المولية ، ولكن مع الآخرين - طوال الوقت.
ما الذي يؤثر على السعة الحرارية المحددة؟

أنت تعرف ما هي السعة الحرارية ، لكن القيم التي تؤثر على المؤشر ليست واضحة بعد. تتأثر قيمة الحرارة النوعية بشكل مباشر بعدة مكونات: درجة حرارة المادة والضغط وخصائص الديناميكا الحرارية الأخرى.
مع ارتفاع درجة حرارة المنتج ، تزداد سعته الحرارية النوعية ، ومع ذلك ، تختلف بعض المواد في منحنى غير خطي تمامًا في هذا الاعتماد. على سبيل المثال ، مع زيادة مؤشرات درجة الحرارة من صفر إلى 37 درجة ، تبدأ السعة الحرارية النوعية للماء في الانخفاض ، وإذا كان الحد بين 37 ومائة درجة ، فإن المؤشر ، على العكس من ذلك ، سوف يزيد.
تجدر الإشارة إلى أن المعلمة تعتمد أيضًا على كيفية السماح بتغيير الخصائص الديناميكية الحرارية للمنتج (الضغط والحجم وما إلى ذلك). على سبيل المثال ، ستكون الحرارة النوعية عند ضغط ثابت وحجم ثابت مختلفة.
كيف تحسب المعلمة؟
هل أنت مهتم بما هي السعة الحرارية؟ صيغة الحساب كالتالي: C \ u003d Q / (m ΔT). ما هي هذه القيم؟ Q هي كمية الحرارة التي يتلقاها المنتج عند تسخينه (أو إطلاقه بواسطة المنتج أثناء التبريد). m كتلة المنتج ، و T هو الفرق بين درجة الحرارة الأولية ودرجة الحرارة النهائية للمنتج. يوجد أدناه جدول السعة الحرارية لبعض المواد.

ماذا يمكن أن يقال عن حساب السعة الحرارية؟
حساب السعة الحرارية ليس بالمهمة السهلة ، خاصة إذا تم استخدام الطرق الديناميكية الحرارية فقط ، فمن المستحيل القيام بذلك بشكل أكثر دقة. لذلك ، يستخدم الفيزيائيون طرق الفيزياء الإحصائية أو معرفة البنية المجهرية للمنتجات. كيف تحسب الغاز؟ يتم حساب السعة الحرارية للغاز من حساب متوسط طاقة الحركة الحرارية للجزيئات الفردية في المادة. يمكن أن تكون حركات الجزيئات من النوع الانتقالي والدوراني ، ويمكن أن توجد داخل الجزيء ذرة كاملة أو اهتزاز ذرات. تقول الإحصائيات الكلاسيكية أنه لكل درجة من درجات حرية الحركة الدورانية والتحويلية ، هناك قيمة مولارية ، تساوي R / 2 ، ولكل درجة اهتزازية من الحرية ، فإن القيمة تساوي R. وتسمى هذه القاعدة أيضًا بـ قانون التقسيم.
في هذه الحالة ، يختلف جزيء غاز أحادي الذرة بثلاث درجات انتقالية فقط من الحرية ، وبالتالي يجب أن تكون سعته الحرارية مساوية لـ 3R / 2 ، وهو ما يتوافق بشكل ممتاز مع التجربة. يحتوي كل جزيء غاز ثنائي الذرة على ثلاث درجات انتقالية ودرجتين دوران ودرجة اهتزازية واحدة ، مما يعني أن قانون التقسيم المتساوي سيكون 7R / 2 ، وقد أظهرت التجربة أن السعة الحرارية لخلد غاز ثنائي الذرة عند درجة حرارة عادية هي 5R / 2. لماذا كان هناك مثل هذا التناقض من الناحية النظرية؟ كل شيء يرجع إلى حقيقة أنه عند إنشاء السعة الحرارية ، سيكون من الضروري مراعاة التأثيرات الكمية المختلفة ، وبعبارة أخرى ، لاستخدام الإحصائيات الكمومية. كما ترون ، السعة الحرارية مفهوم معقد نوعًا ما.
تقول ميكانيكا الكم أن أي نظام من الجسيمات التي تتأرجح أو تدور ، بما في ذلك جزيء الغاز ، يمكن أن يكون لها قيم طاقة منفصلة معينة. إذا كانت طاقة الحركة الحرارية فيها نظام مثبتغير كافٍ لإثارة تذبذبات التردد المطلوب ، فإن هذه التذبذبات لا تساهم في السعة الحرارية للنظام.
في المواد الصلبة ، تكون الحركة الحرارية للذرات تذبذبًا ضعيفًا حول مواضع توازن معينة ، وهذا ينطبق على عقد الشبكة البلورية. تتمتع الذرة بثلاث درجات اهتزازية من الحرية ، ووفقًا للقانون ، السعة الحرارية المولية جسم صلبيساوي 3nR ، حيث n هو عدد الذرات الموجودة في الجزيء. من الناحية العملية ، هذه القيمة هي الحد الذي تميل إليه السعة الحرارية للجسم عند درجات حرارة عالية. تتحقق القيمة مع تغيرات درجة الحرارة العادية في العديد من العناصر ، وهذا ينطبق على المعادن ، وكذلك المركبات البسيطة. يتم أيضًا تحديد السعة الحرارية للرصاص والمواد الأخرى.
ماذا يمكن أن يقال عن درجات الحرارة المنخفضة؟

نحن نعلم بالفعل ما هي السعة الحرارية ، ولكن إذا تحدثنا عنها درجات الحرارة المنخفضةفكيف ستحسب القيمة إذن؟ إذا كنا نتحدث عن مؤشرات درجات الحرارة المنخفضة ، فإن السعة الحرارية لجسم صلب تتحول إلى أن تكون متناسبة تي 3 أو ما يسمى بقانون ديباي للسعة الحرارية. المعيار الرئيسي للتمييز بين درجات الحرارة المرتفعة والدرجات المنخفضة هو المقارنة المعتادة بينهما مع خاصية بارامتر لمادة معينة - يمكن أن تكون هذه الخاصية أو درجة حرارة ديباي q د. يتم تعيين القيمة المعروضة بواسطة طيف اهتزاز الذرات في المنتج وتعتمد بشكل كبير على التركيب البلوري.
في المعادن ، تساهم إلكترونات التوصيل مساهمة معينة في السعة الحرارية. يتم حساب هذا الجزء من السعة الحرارية باستخدام إحصائيات Fermi-Dirac التي تأخذ الإلكترونات في الاعتبار. السعة الحرارية الإلكترونية للمعدن ، والتي تتناسب مع السعة الحرارية المعتادة ، هي قيمة صغيرة نسبيًا ، وتساهم في السعة الحرارية للمعدن فقط عند درجات حرارة قريبة من الصفر المطلق. ثم تصبح السعة الحرارية للشبكة صغيرة جدًا ويمكن إهمالها.
السعة الحرارية الجماعية
السعة الحرارية النوعية للكتلة هي مقدار الحرارة المطلوب إحضاره إلى وحدة كتلة من مادة لتسخين المنتج لكل وحدة درجة حرارة. يُشار إلى هذه القيمة بالحرف C ويتم قياسها بالجول مقسومًا على كيلوغرام لكل كلفن - J / (كجم K). هذا هو كل ما يتعلق بالقدرة الحرارية للكتلة.
ما هي السعة الحرارية الحجمية؟

السعة الحرارية الحجمية هي كمية معينة من الحرارة التي يجب إحضارها إلى وحدة حجم الإنتاج من أجل تسخينها لكل وحدة درجة حرارة. يقاس بالجول مقسومًا على متر مكعبلكل كلفن أو J / (م كلفن). في العديد من الكتب المرجعية للبناء ، يتم أخذ السعة الحرارية النوعية للكتلة في العمل بعين الاعتبار.
التطبيق العملي للقدرة الحرارية في صناعة البناء
يتم استخدام العديد من المواد كثيفة الحرارة بشكل فعال في بناء الجدران المقاومة للحرارة. هذا مهم للغاية بالنسبة للمنازل التي تتميز بالتدفئة الدورية. على سبيل المثال ، الفرن. تعمل المنتجات والجدران كثيفة الحرارة المبنية منها على تجميع الحرارة بشكل مثالي وتخزينها أثناء فترات التسخين وإطلاق الحرارة تدريجيًا بعد إيقاف تشغيل النظام ، مما يتيح لك الحفاظ على درجة حرارة مقبولة طوال اليوم.
لذلك ، كلما تم تخزين المزيد من الحرارة في الهيكل ، ستكون درجة الحرارة في الغرف أكثر راحة واستقرارًا.
وتجدر الإشارة إلى أن الطوب العادي والخرسانة المستخدمة في بناء المساكن لها سعة حرارية أقل بكثير من البوليسترين الموسع. إذا أخذنا ecowool ، فإنه يستهلك حرارة أكثر بثلاث مرات من الخرسانة. وتجدر الإشارة إلى أنه في صيغة حساب السعة الحرارية ، ليس عبثًا وجود كتلة. نظرًا للكتلة الضخمة من الخرسانة أو الطوب ، بالمقارنة مع ecowool ، فإنه يسمح بتراكم كميات هائلة من الحرارة في الجدران الحجرية للهياكل وتخفيف جميع التقلبات اليومية في درجات الحرارة. فقط كتلة صغيرة من العزل في الكل منازل الإطارعلى الرغم من سعتها الحرارية الجيدة ، إلا أنها أضعف منطقة في جميع تقنيات الإطارات. لحل هذه المشكلة ، تم تركيب مراكم حرارة رائعة في جميع المنازل. ما هذا؟ هذه أجزاء هيكلية تتميز بكتلة كبيرة مع مؤشر سعة حرارية جيد إلى حد ما.
أمثلة على مراكم الحرارة في الحياة

ماذا يمكن أن يكون؟ على سبيل المثال ، بعض الداخلية جدران من الطوب، موقد كبير أو مدفأة ، قدد خرسانية.
يعتبر الأثاث في أي منزل أو شقة تراكمًا ممتازًا للحرارة ، لأن الخشب الرقائقي واللوح الخشبي والخشب يمكنه في الواقع تخزين الحرارة فقط لكل كيلوغرام من الوزن أكثر بثلاث مرات من الطوب سيئ السمعة.
هل هناك أي عيوب للتخزين الحراري؟ بطبيعة الحال ، فإن العيب الرئيسي لهذا النهج هو أن مجمع الحرارة يحتاج إلى التصميم في مرحلة إنشاء التخطيط. منزل الإطار. هذا يرجع إلى حقيقة أنه ثقيل جدًا ، وسيتعين أخذ ذلك في الاعتبار عند إنشاء الأساس ، ثم تخيل كيف سيتم دمج هذا الكائن في الداخل. تجدر الإشارة إلى أنه من الضروري مراعاة ليس فقط الكتلة ، بل سيكون من الضروري تقييم كلتا الخصائص في العمل: الكتلة والحرارة. على سبيل المثال ، إذا كنت تستخدم الذهب بوزن لا يُصدق يبلغ عشرين طنًا لكل متر مكعب كمخزن للحرارة ، فسيعمل المنتج كما يجب أن يكون أفضل بنسبة 23 بالمائة فقط من مكعب الخرسانة ، الذي يزن طنين ونصف طن.
ما هي المادة الأكثر ملاءمة لتخزين الحرارة؟

أفضل منتج للمراكم الحراري ليس الخرسانة والطوب على الإطلاق! يقوم النحاس والبرونز والحديد بعمل جيد في هذا الأمر ، لكنها ثقيلة جدًا. من الغريب أن أفضل مُجمّع حرارة هو الماء! يتمتع السائل بقدرة حرارية مذهلة ، وهي الأكبر بين المواد المتاحة لنا. فقط غازات الهيليوم (5190 جول / (كجم كلفن) والهيدروجين (14300 جول / (كجم كلفن)) لها سعة حرارية أكبر ، ولكن من الصعب تطبيقها عمليًا. إذا كنت ترغب في ذلك وتحتاج ، راجع جدول السعة الحرارية للمواد انت تحتاج.
السعة الحرارية، كمية الحرارة المستهلكة لتغيير درجة الحرارة بمقدار 1 درجة مئوية. وفقًا لتعريف أكثر صرامة ، السعة الحرارية - الديناميكا الحرارية. القيمة التي يحددها التعبير:
أين D Q - كمية الحرارة التي يتم توصيلها إلى النظام وتسبب في حدوث تغيير في t-ry بواسطة D T. نسبة الاختلافات المحدودة D Q / D T تسمى. متوسط السعة الحرارية ، نسبة القيم المتناهية الصغر d Q / dT- السعة الحرارية الحقيقية. نظرًا لأن d Q ليس تفاضلاً كليًا لوظيفة الحالة ، فإن السعة الحرارية تعتمد أيضًا على مسار الانتقال بين حالتي النظام. هناك سعة حرارية للنظام ككل (J / K) ، سعة حرارية محددة [J / (g K)] ، سعة حرارية مولارية [J / (mol K)]. في جميع الصيغ أدناه ، يتم استخدام السعات الحرارية المولية.
طرق تحديد السعة الحرارية للمواد الفردية.رئيسي تجريبي الطريقة هي قياس الكالوري. نظري يتم حساب السعة الحرارية الداخلية بواسطة طرق الديناميكا الحرارية الإحصائية ، ولكن هذا ممكن فقط للجزيئات البسيطة نسبيًا في حالة الغاز المثالي والبلورات ، وفي كلتا الحالتين ، يلزم إجراء تجربة لـ عملية حسابية. بيانات عن هيكل الجزر.
تجريبي تعتمد طرق تحديد السعة الحرارية في حالة الغاز المثالي على فكرة إضافة مساهمات مجموعات فردية من الذرات أو المواد الكيميائية. روابط. تم نشر جداول موسعة للمساهمات الذرية الجماعية لقيمة C p. بالنسبة للسوائل ، بالإضافة إلى طرق المجموعة المضافة ، تُستخدم الطرق بناءً على الحالات المقابلة في القانون ، وكذلك على استخدام الديناميكا الحرارية. دورات تسمح بالمرور إلى السعة الحرارية للسائل من السعة الحرارية للغاز المثالي من خلال مشتق درجة الحرارة من المحتوى الحراري للتبخير.
بالنسبة إلى p-ra ، فإن حساب السعة الحرارية كدالة مضافة للسعة الحرارية للمكونات غير صحيح بشكل عام ، لأن السعة الحرارية الزائدة للحل ، كقاعدة عامة ، مهمة. لتقييمها يتطلب إشراك الجزيئية الإحصائية. نظريات الحلول (انظر حلول غير المنحل بالكهرباء). تجريبيا ، يمكن تحديد السعة الحرارية الزائدة من اعتماد درجات الحرارةالمحتوى الحراري للخلط ، وبعد ذلك يمكن حساب С р р-ra.
تي السعة الحرارية النوعية من مغاير. أنظمة تمثل نيب. حالة صعبة للديناميكا الحرارية. تحليل. في مخطط الحالة ، تكون الحركة على طول منحنى توازن الطور مصحوبة بتغيير في كل من p و T. إذا تغيرت نقطة توازن الطور أثناء التسخين ، فهذا يعطي إضافة. المساهمة في السعة الحرارية ، وبالتالي فإن السعة الحرارية من غير المتجانسة. النظام لا يساوي مجموع السعات الحرارية لمراحلها المكونة ، ولكنه يتجاوزها. على مخطط المرحلة في الانتقال من homog. الدولة في مجال وجود مغاير. تشهد السعة الحرارية للنظام قفزة (انظر انتقالات الطور).
قيمة عمليةدراسات السعة الحرارية مهمة لحسابات الطاقة. أرصدة العمليات في الكيمياء. المفاعلات والأجهزة الكيميائية الأخرى. pro-va ، وكذلك لتحديد الأمثل. المبردات. تجربة. قياس السعة الحرارية لفترات مختلفة من tp - من منخفضة للغاية إلى عالية - هو الأساسي. طريقة لتحديد الديناميكا الحرارية. st-in-in. لحساب المحتوى الحراري والنتروبيا للجزيرة (في النطاق من 0 إلى T) ، يتم استخدام تكاملات السعة الحرارية:

تضاف الآثار المقابلة إلى شبه جزيرة القرم
يتم تقييم كمال العمليات الحرارية التي تحدث في أسطوانة محرك سيارة حقيقي من خلال مؤشرات المؤشر لدورته الفعلية ، بينما يتم تقييم كمال المحرك ككل ، مع مراعاة فقد الطاقة بسبب الاحتكاك ومحرك الآليات المساعدة ، يتم تقييمه من خلال مؤشراته الفعالة.
يُطلق على العمل الذي تقوم به الغازات في أسطوانات المحرك عمل المؤشر. يسمى عمل مؤشر الغازات في اسطوانة واحدة في دورة واحدة دورة العمل.
يمكن تحديده باستخدام مخطط مؤشر مبني وفقًا لبيانات الحساب الحراري للمحرك.
منطقة يحدها كفاف أ -c-z "-z-b-aمخطط المؤشر المحسوب أتي , سيمثل ، على نطاق مناسب ، عمل المؤشر النظري للغازات في اسطوانة واحدة لكل دورة. منطقة الرسم التخطيطي الحقيقي أ "-c" -c "-z" -b "-b" -r-a-a "سوف تتكون من حلقات علوية وسفلية. مربع أدالحلقة العلوية تميز العمل الإيجابي للغازات في كل دورة. لا تتطابق حدود هذه الحلقة مع الحدود المحسوبة بسبب تقدم الإشعال أو حقن الوقود (s "-s- s "-s") ،الاحتراق غير الفوري للوقود (مع "-z" -z "-c"و z "- z-z ""-z") والإصدار التجريبي (ب "-ب-ب" -ب ").
يتم أخذ التخفيض في مساحة الرسم البياني للحساب للأسباب الموضحة في الاعتبار باستخدام عامل اكتمال الرسم التخطيطي :
لمحركات السيارات تأخذ قيم عامل اكتمال الرسم البياني القيم 0,93...0,97.
مربع ان تميز الحلقة السفلية العمل السلبي المنفق على ضربات المضخة للمكبس لتبادل الغازات في الاسطوانة. وبالتالي ، فإن عمل المؤشر الفعلي للغازات في اسطوانة واحدة في دورة واحدة:
في الممارسة العملية ، يتم تحديد قيمة أداء المحرك لكل دورة من خلال متوسط الضغط المشار إليه باي،يساوي العمل المفيد للدورة ، المشار إليه بوحدة حجم عمل الأسطوانة
أين واي- عمل مفيد للدورة ، J (N · m) ؛ ف- حجم عمل الاسطوانة ، م 3.
متوسط ضغط المؤشر -هذا ضغط ثابت مشروط على المكبس أثناء ضربة واحدة للمكبس ، والتي تعمل بشكل مساوٍ لعمل الغازات للدورة بأكملها. يتم التعبير عن هذا الضغط على مقياس معين بالارتفاع باي مستطيل بمساحة أ = الجحيم - أن وقاعدة مساوية لطول الرسم البياني للمؤشر. قيمة بايفي ظل التشغيل العادي للمحرك ، تصل إلى 1.2 ميجا باسكال في محركات البنزين ، و 1.0 ميجا باسكال في محركات الديزل.
عمل مفيد، التي يتم إجراؤها بواسطة الغازات في أسطوانات المحرك لكل وحدة زمنية ، تسمى قوة المؤشر ويتم الإشارة إليها باي
.
مؤشر عمل الغازات في اسطوانة واحدة لدورة واحدة (نيوتن متر)
يميز بين السعة الحرارية المتوسطة والحقيقية. متوسط السعة الحرارية cn هو مقدار الحرارة المستهلكة عند تسخين وحدة غاز (1 كجم ، 1 م 3 ، 1 مول) بمقدار 1 كلفن من t1 إلى t2:
с = q / (t2-t1)
كلما كان الفرق في درجة الحرارة أصغر t2 - t1 ، كلما اقتربت قيمة متوسط السعة الحرارية من c الحقيقي. لذلك ، ستحدث السعة الحرارية الحقيقية عندما تقترب قيمة t2 - t1 من الصفر.
السعة الحرارية هي دالة لمعلمات الحالة - الضغط ودرجة الحرارة ، لذلك ، في الديناميكا الحرارية التقنية ، يتم تمييز السعات الحرارية الحقيقية والمتوسطة.
تعتمد السعة الحرارية للغاز المثالي فقط على درجة الحرارة ، وبحسب التعريف ، يمكن العثور عليها فقط في نطاق درجة الحرارة. ومع ذلك ، يمكن دائمًا افتراض أن هذا الفاصل الزمني صغير جدًا بالقرب من بعض قيم درجة الحرارة. ثم يمكننا القول أن السعة الحرارية يتم تحديدها عند درجة حرارة معينة. هذه السعة الحرارية تسمى حقيقي.
في الأدبيات المرجعية ، الاعتماد على السعات الحرارية الحقيقية مع صو معيتم إعطاء درجة الحرارة في شكل جداول وتبعيات تحليلية. عادةً ما يتم تمثيل الاعتماد التحليلي (على سبيل المثال ، للسعة الحرارية الجماعية) على أنه متعدد الحدود:
ثم كمية الحرارة التي يتم توفيرها في العملية في نطاق درجة الحرارة [ t1 ، t2] من خلال التكامل:
في دراسة العمليات الديناميكية الحرارية ، غالبًا ما يتم تحديد متوسط قيمة السعة الحرارية في نطاق درجة الحرارة. إنها نسبة كمية الحرارة التي يتم توفيرها في العملية س 12إلى فرق درجة الحرارة النهائي:
ثم ، إذا تم إعطاء اعتماد السعة الحرارية الحقيقية على درجة الحرارة ، وفقًا لـ (2):
غالبًا في الأدبيات المرجعية ، يتم إعطاء قيم متوسط السعات الحرارية مع صو معلنطاق درجة الحرارة من 0 قبل ر عن ج. مثل تلك الحقيقية ، يتم تقديمها في شكل جداول ووظائف:
عند استبدال قيمة درجة الحرارة رسيتم استخدام هذه الصيغة لإيجاد متوسط السعة الحرارية في نطاق درجة الحرارة [ 0.t]. لإيجاد متوسط السعة الحرارية في فترة عشوائية [ t1 ، t2] ، باستخدام الاعتماد (4) ، من الضروري إيجاد كمية الحرارة س 12المطبقة على النظام في نطاق درجة الحرارة هذا. بناءً على القاعدة المعروفة من الرياضيات ، يمكن تقسيم التكامل في المعادلة (2) إلى التكاملات التالية:
بعد ذلك ، يتم إيجاد القيمة المرغوبة لمتوسط السعة الحرارية بالصيغة (3).