Promjena termodinamičkih funkcija tijekom adsorpcije. Termodinamika adsorpcijskih procesa. Dizajn hardvera adsorpcijskih procesa
Adsorpcija(od latinskog ad - na, na i sorbeo - apsorbirati), promjena (obično povećanje) koncentracije tvari u blizini fazne granice ("apsorpcija na površini"). Uzrok adsorpcija- nezasićenost međumolekulskih veza blizu površine, tj. postojanje adsorpcije polje sile. Tijelo koje stvara takvo polje naziva se adsorbent, tvar čije se molekule mogu adsorbirati naziva se adsorbent, a tvar koja je već adsorbirana naziva se adsorbat. Obrnuti proces adsorpcija, naziva se desorpcija.
Priroda adsorpcijskog polja je drugačija. Ako je adsorpcija povezana s van der Waalsovim vezama, tada adsorpcija naziva fizičkim. Ako su to valentne veze, t.j. adsorpcija nastaje stvaranjem površine kemijski spojevi, To adsorpcija zove kemijski, odn kemisorpcija. Važne karakteristike kemisorpcija pokazuje: ireverzibilnost, visoke toplinske učinke (stotine kJ/mol), aktivirani karakter. Postoji mnogo međutipova adsorpcija između fizičke i kemijske adsorpcija. Na primjer, adsorpcija uzrokovana stvaranjem vodikovih veza. Također moguće različiti tipovi fizički adsorpcija. Najčešća pojava je pojava disperzijskih međumolekulskih privlačnih sila, zbog činjenice da su one približno konstantne za adsorbente s površinom bilo koje kemijske prirode (nespecifične adsorpcija). Fizički adsorpcija mogu biti uzrokovane elektrostatskim silama (interakcije između iona, dipola ili kvadrupola); pri čemu adsorpcija određena kemijskom prirodom molekula adsorbensa (tzv. specifičnih adsorpcija). Važnu ulogu igra i geometrija sučelja. ako je površina ravna, onda jest adsorpcija otvorena površina, u slučaju blago ili jako zakrivljene površine - oko adsorpcija u porama adsorbensa.
U teoriji adsorpcija razlikovati statiku (sustav adsorbent-adsorbat je u termodinamičkoj ravnoteži) i kinetiku (nema ravnoteže).
Adsorpcijska statika
Termodinamika adsorpcije
.Osnove termodinamike adsorpcija stvorio ih je J. Gibbs 70-ih godina. XIX stoljeće Prema Gibbsu, u ravnotežnom dvofaznom sustavu u blizini faznog sučelja postoji određena promjena u lokalnim vrijednostima svih ekstenzivnih svojstava (osim volumena). Međutim, faze se smatraju homogenima do određene geometrijske površine koja ih razdvaja. Stoga vrijednost bilo kojeg opsežnog svojstva za sustav kao cjelinu nije jednaka zbroju vrijednosti ovog svojstva u homogenim fazama i . Razlika se pripisuje dvodimenzionalnoj površinskoj fazi povezanoj s razdjelnom površinom. Jer površinska faza nema debljinu, dakle V 0=+ i =-, gdje je V- volumen.
Prikazane ideje omogućuju nam da temeljnu termodinamičku jednadžbu svedemo na oblik:
gdje je G Gibbsova slobodna energija, S entropija, međufazna napetost, s površina međupovršine, a n ja- odgovarajući kemijski potencijal i broj molova ja-ta komponenta. Indeks označava vrijednost odgovarajućeg svojstva u površinskoj fazi. Legendreova transformacija omogućuje izmjenu jednadžbe (1) za izotermne uvjete:
Količina se zove Gibbs adsorpcija i označava se simbolom G, (izraženo u mol/cm 2). Za dvokomponentni sustav:
Položaj razdjelne površine može se odabrati proizvoljno. Konkretno, izbor ovog položaja može zadovoljiti uvjet G 1 =0. Takva se površina naziva ekvimolekularna. Za njega se uvodi oznaka G 2 = G 2 (1). Ovo implicira osnovnu Gibbsovu jednadžbu adsorpcije:
Ako je adsorbent potpuno netopljiv u jednoj od dvije faze, =const, a prijelaz s jednadžbe (2) na jednadžbu (3) ne zahtijeva uvjet G 1 =0. Dakle, Gibbs adsorpcija je višak dane komponente u stvarnom dvofaznom sustavu u usporedbi sa sustavom u kojem bi obje faze bile strogo homogene sve do razdjelne površine. Osim Gibbsovih viška količina adsorpcija, igra važnu ulogu u njezinoj teoriji adsorpcija, shvaćeno kao puni sadržaj komponente ja u svemiru W, koji pokazuje adsorpcijske sile. Označavajući puni sadržaj kroz A a pod pretpostavkom da komponenta ja potpuno netopljiv u jednoj od velikih faza, imamo:
gdje c ja-koncentracija ja-ta komponenta u fazi mase. Kod malih c ja:
Adsorpcija može se pojaviti na bilo kojem sučelju između bilo koje dvije faze, posebno na sučelju tekućina-tekućina (tekućina-plin, tekućina-tekućina) ili čvrsto-tekućina (krutina-plin, krutina-tekućina). U sustavima fluid-fluid, a se može mjeriti kao funkcija, a G 2 (1) može se odrediti eksperimentalno pomoću jednadžbe (3). U drugom slučaju, za određivanje G 2 (1) mjeri se bilo kojom metodom n ja 0 , , i koncentracije i-te komponente u tim volumenima. Odavde izračunavamo G ja(1) . Ova se metoda naziva volumetrijskom (ili volumetrijskom). Težinskom (gravimetrijskom) metodom količina se neposredno utvrđuje ja-ta komponenta na sučelju.
Izoterma adsorpcije
.U ravnotežnom adsorpcijskom sustavu parametri koji određuju ravnotežu su a ja parcijalni pritisci R(ili sa ja) i temperaturu T. Oni su povezani takozvanom toplinskom jednadžbom:
Na adsorpcija pojedinačni adsorpcijski ( ja=1) ova jednadžba ima oblik:
Tri posebna slučaja toplinska jednadžba(Kada T, r ili a- konstante) imaju posebnu ulogu u teoriji adsorpcija:
a=- jednadžba izoterme adsorpcija,
T=- izobarna jednadžba adsorpcija,
R-- izosterna jednadžba adsorpcija.
Specifična vrsta funkcija određena je karakteristikama sustava koji se razmatra. Ako je jedan od njih npr. poznat po bilo kojoj vrijednosti T= const, onda, očito, druga dva također postaju poznata. U ovom slučaju nije potrebno znati analitički tip ovisnosti. Mogu se empirijski odrediti kao skup vrijednosti a, str I T.
U teoriji adsorpcija Obično se odlučuje o pitanju oblika funkcije A=(p) g, tj. o jednadžbi izoterme adsorpcija. Ovaj problem je zbog toplinskih učinaka koji prate adsorpcija. Pri izračunavanju promjena u vrijednostima glavnih termodinamičkih funkcija u slučaju prijelaza dn molova adsorbensa iz masene faze u površinsku fazu u ravnotežnom sustavu pri p = moguća su dva slučaja: u prvom se uzima u obzir samo pretvorba adsorbensa u adsorbat, budući da adsorbens na adsorpcija termodinamički nepromijenjen i uloga mu je da služi kao izvor adsorpcijskog polja; u drugom se uzima u obzir i promjena adsorbensa.
Budući da je sustav u ravnoteži, kemijski potencijali adsorbata i adsorpcije su isti; entropija adsorbata zbog smanjenja pokretljivosti molekula sa adsorpcija manja entropija adsorbensa. Stoga je kod inertnog adsorbensa entalpija uvijek negativna, tj. adsorpcija egzotermna. Uzimanje u obzir promjene u entropiji adsorbensa može promijeniti ovaj zaključak. Na primjer, kada se tvari u kojima polimer bubri apsorbiraju polimeri, entropija potonjih (zbog povećanja pokretljivosti makromolekula) može se toliko povećati da adsorpcija postaje endoterman. U nastavku se u članku razmatraju samo egzotermni adsorpcija.
Razlikuju se integralna, diferencijalna, izosterična i prosječna toplina adsorpcija. Integralna toplina Q jednako gubitku entalpije (at V= const – stalna unutarnja energija) pri promjeni adsorpcija iz a 1 prije a 2(u određenom slučaju to može biti 1 = 0): Q= -(H 2 - H 1). Ta se vrijednost obično odnosi na masu adsorbensa i izražava u J/kg.
Diferencijalna toplina q(J/mol) jednak je gubitku entalpije dH kada se mijenja A na da. Izražava se stavom q = - (dH/da). Očito je da
Izosterična toplina q st uzima se jednakom:
gdje je razlika između molarnih volumena adsorbata i adsorpcije. Može se pokazati da  za idealni adsorbent plina:
za idealni adsorbent plina:
Značenje uvoda qsi je da za njegovo određivanje nisu potrebni kalorimetrijski podaci (kao što je Q I q) i može se izračunati pomoću jednadžbe (9) na temelju rezultata mjerenja adsorpcija. Uvodi se i srednja toplina Q(J/mol):
S rastom A parametar Q uvijek raste, a q može se smanjiti, povećati ili ostati nepromijenjen. S rastom A s nejednolikom površinom adsorpcija javlja se u sve manje aktivnim područjima, što dovodi do smanjenja q. Međutim, to smanjuje prosječne udaljenosti između adsorbiranih molekula, zbog čega se privlačne sile među njima povećavaju, a q povećava se. Odnos između dva navedena učinka određuje tijek ovisnosti q=f(a). Za vrlo velike A na ovom području počinju prevladavati odbojne sile q uvijek opada s rastom a.
Za vrlo male površinske pokrivenosti, jednadžba izoterme adsorpcija ima oblik Henryjeve jednadžbe:
gdje je K H Henryjev koeficijent. Doista, za vrlo male A adsorpcijski sloj sličan je dvodimenzionalnom idealnom plinu, stoga njegova jednadžba stanja ima oblik: = RT, gdje je dvodimenzionalni tlak, površina koju zauzima jedan mol tvari. Dakle, uzimajući u obzir da je =- i koristeći jednadžbu (3), dobivamo jednadžbu (12). Henryjeva jednadžba to zahtijeva q bio konstantan. Za velika punjenja ova jednadžba prestaje vrijediti. Stoga je G. Freindlich (1906) predložio opisati izoterme adsorpcija sljedeća empirijska jednadžba (Freundlichova jednadžba):
Gdje k I n- konstante. Ova se jednadžba često koristi kao interpolacijska formula, iako za male R ne ulazi u jednadžbu (12), i to vrlo veliko R dovodi do neograničenog povećanja koje nije u skladu s iskustvom A.
Stroga teorija izoterme adsorpcija stvorio je I. Langmuir (1914-18). Teorija se temelji na sljedećem. model: 1) površina adsorbensa je skup energetski identičnih aktivnih centara na kojima su adsorbirane (lokalizirane) molekule adsorbensa; 2) samo jedna molekula je adsorbirana na jednom centru, tj. na adsorpcija nastaje samo jedan adsorbent. sloj (jednoslojni); 3) adsorpcija u ovom centru ne utječe adsorpcija na druge centre, tj. interakciju. adsorbirane molekule mogu se zanemariti.
Langmuirov model tzv lokalizirana monomolekularna adsorpcija na homogenu površinu. izotermna jednadžba adsorpcija, koji odgovara ovom modelu, m.b. dobiven korištenjem razgradnje. metode (molekularno-kinetičke, termodinamičke, statističko-termodinamičke). Da, adsorbti. ravnoteža se može izraziti na sljedeći način. shema:
Bez molekula Adsorbti. u plinu + adsorb. složeni fazni centar (prometno središte)
Koncentracija molekula u plinu proporcionalna je p, koncentraciji slobodnih. centar-veličina ( a t - a), Gdje i T - ukupan broj centara, a-broj okupiranih centara, koncentracija adsorpcije. kompleksi-veličina adsorpcija Stoga je konstanta ravnoteže: K p = p(a t - A)/ adsorpcija Odavde dobivamo Langmuirovu jednadžbu:
Gdje b-T. nazvao adsorpcija koeficijent, jednak K p -1. U području vrlo niskih tlakova bp " 1 i a = (a m b)p,što odgovara Henryjevoj jednadžbi, u kojoj K H= a m b. U području vrlo visokih tlakova br 1 i aa t; pri čemu adsorpcija više ne ovisi o pritisku. Konstanta ravnoteže b-1 odnosi se na standardnu vrijednost izobarnog reakcijskog potencijala:
Langmuirov model zahtijeva da diferencijal topline i entropije adsorpcija nije ovisio o stupnju ispunjenosti površine.
jednadžba (14) je strogi izraz koji odgovara Langmuirovom modelu, ali se rijetko eksperimentalno opravdava, jer je sam model idealiziran adsorpcija Doktrina o adsorpcija iz 20-ih godina 20. stoljeće u sredstvima. stupanj izgrađen na temelju slabljenja ili isključivanja jedne ili druge Langmuirove pretpostavke adsorpcija
Langmuir je već predložio način opisa adsorpcija na neuniformnoj površini (tj. pod pretpostavkom da nisu svi centri isti). Kombiniranjem identičnih centara u skupine i pretpostavkom da je jednadžba (14) primjenjiva na svaku skupinu, možemo pretpostaviti da adsorpcija na cijeloj površini izražava se zbrojem članova jednadžbe (14):
Uz pretpostavku da je broj adsorbta. centri mogu biti opisan kontinuiranom funkcijom raspodjele prema slobodnim vrijednostima. energije, Ya.B.Zeldovich dobio je iz formule (16) za eksponencijalnu funkciju jednadžbu tipa (13).
adsorpcija na nehomogenim površinama – veliko poglavlje teorije adsorpcija Njen glavni rješavanje problema integralna jednadžba:
Gdje f(str) - tzv. empirijski izoterma adsorpcija, - jedna ili druga funkcija raspodjele broja centara prema slobodnim vrijednostima. energija,( b, p)- lokalna izoterma adsorpcija, što se obično uzima kao Langmuirova izoterma adsorpcija
Učinjeni su mnogi pokušaji da se odbaci Langmuirova druga pretpostavka. adsorpcija Na tom putu, teorija polimolekul adsorpcija, koju su predložili S. Brunauer, P. Emmett i E. Teller (BET teorija). Teorija postulira da na temperaturama ispod kritične temperature svaka molekula adsorbirana u prvom sloju (adsorpcijska toplina q i,), središte je za molekule koje tvore drugi sloj, itd. Vjeruje se da toplina adsorpcija u svim slojevima osim u prvom, jednaka je toplini kondenzacije. Ovaj model dovodi do jednadžbe:
Gdje c = exp[(q 1 -)/RT]. jednadžba (18) u koordinatama a, p/p s odgovara krivulji u obliku slova S. U koordinatama p/p s,
izoterma adsorpcija prema jednadžbi (18) treba biti linearna. Nagib ove ravne crte (obično u rasponu od 0,05 p/p s 0,30) i segment odsječen njome na ordinatnoj osi daju vrijednosti. a t I S.Široka rasprostranjenost BET teorije posljedica je činjenice da njezini autori, zapravo, vjeruju adsorpcija nelokalizirani, identificirajte konstantu a t ne s brojem diskretnih adsorba. centara, te s brojem molekula adsorbata u prvom sloju s najgušćim pakiranjem (na R= p.s). Stoga, uvodeći ideju o površini koju zauzima jedna molekula u ovom sloju, prihvaćamo:
Gdje s- površina adsorbata adsorpcija U pravilu se u tu svrhu mjeri izoterma adsorpcija dušika i pretpostavimo da je za njegovu molekulu = 0,162 nm 2. Često se izvodi sličan izračun s prema Langmuirovu modelu nije točno, jer ova se metoda očito odnosi samo na nelokalizirane adsorpcija
U teoriju polimolekul adsorpcija Velik doprinos dao je J. de Boer koji je eksperimentalno pokazao da ovisnost prosječnog broja slojeva (iznad prvog) na svim površinama sličnih kemijskih svojstava. priroda, iz p/p s izražava se univerzalnom krivuljom (tzv. t-krivulja). Također omogućuje procjenu površina adsorbenata.
Pokušalo se uzeti u obzir u Langmuirovu modelu i interakciju. između adsorbir. molekule. Dakle, T. Hill i J. de Boer, smatrajući da jednadžba stanja adsorpcije. sloj dvodimenzionalni analog van der Waalsove jednadžbe, dobili smo sljedeće. izotermna jednadžba adsorpcija:
gdje= a/a t, a i b konstante van der Waalsove jednadžbe adsorpcija R. Fowler i E. Guggenheim, uzimajući u obzir interakciju. adsorber molekula, izveli smo jednadžbu:
gdje je konstanta povezana s parnom interakcijom molekula.
Postoji još jedan mehanizam koji vodi komplementarnosti. adsorpcija adsorptivima ispod njihove kritične vrijednosti. temperature na poroznim adsorbentima pri relativno visokim vrijednostima p/p s . Ovo je kapilarna kondenzacija. Ako se u pori stvorio konkavni meniskus adsorbata, onda u njemu počinje kondenzacija na p/p s Prema Kelvinovoj jednadžbi:
gdje je površinska napetost adsorbata, V -njegov molarni volumen, r-radijus zakrivljenosti meniska adsorpcija Kapilarna kondenzacija dovodi do naglog porasta izoterme adsorpcija U ovom slučaju se često (ali ne uvijek) promatra tzv. adsorpcija histereza, tj. adsorpcijska neusklađenost i desorpcija. izotermne grane. U pravilu, to je zbog činjenice da je oblik meniskusa na adsorpcija i desorpcija se ne poklapaju.
Kapilarna kondenzacija se koristi za određivanje veličine pora adsorbensa adsorpcija Prema jednadžbi (22) za svaku vrijednost p/p s izračunajte radijus zakrivljenosti meniskusa adsorpcija Iz njega, s obzirom na debljinu adsorpcije. sloj (na primjer, duž t-krivulje), oblik prijelaznog područja iz sloja u menisk i ovisnost o zakrivljenosti pri vrlo malim r , pronađite linearnu veličinu (efektivni radijus r ef) pora ispunjenih na određeno vrijeme p/p s . Volumen takvih pora određen je rastom adsorpcija u ovoj točki izoterme. Na temelju dobivenih podataka konstruirana je krivulja raspodjele volumena pora po njihovim polumjerima. Metoda je primjenjiva na r ef 1,5 nm. Obično se proračun provodi desorpcijom. grane izoterme, ali strože suvremene. teorija zahtijeva da se obje grane uzmu u obzir za konstrukciju krivulje.
Potencijalna teorija adsorpcije i teorija volumnog punjenja mikropora. Model adsorpcija, bitno drugačiji od Langmuirovog, predložio je 1914. M. Polyaki. Prema ovom modelu, postoji potencijalni adsorbent blizu površine adsorbensa. polje sile koje se smanjuje s udaljenošću od površine. Kao rezultat toga, tlak adsorbensa, jednak p daleko od površine, raste blizu nje i na nekoj udaljenosti doseže vrijednost ps, pri kojoj se adsorbens kondenzira. Volumen sloja između sučelja i geoma. mjesto točaka gdje p = p s, ispunjen tekućinom, kojoj su dodijeljene normalne fizičke vrijednosti. svojstva rasute tekućine. Reverzibilni izotermni rad e adsorpcija. sile određene jednadžbom = RTlnp/p s, tzv. adsorpcija potencijal, a cijeli koncept je potencijalna teorija adsorpcija Za zadani volumen V adsorpcija sloj je potencijalno neovisan o temperaturi (zbog neovisnosti disperzijskih sila o temperaturi). Ova temperaturna nepromjenjivost omogućuje ponovno izračunavanje adsorpcija s jedne temperature na drugu, iako jednadžbe izoterme adsorpcija Nije bilo moguće zaključiti na temelju iznesene teorije. Mnogi su naširoko i uspješno koristili model Polyani. od strane autora ipak je sadržavao dvije vrlo ranjive odredbe: 1) pretpostavku da najfiniji adsorbira. film ima normalne fizičke vrijednosti. svojstva rasute tekućine (ova pretpostavka nije potvrđena eksperimentima); 2) temperaturna nepromjenjivost funkcije =f(V), temeljna teorija približno je potvrđena eksperimentom samo za vrlo fine porozne adsorbente.
Koristeći teoriju potencijala, M.M. Dubinin je predložio i razvio teoriju volumetrijskog punjenja mikropora (VFM). Pretpostavlja se da je ova teorija primjenjiva samo na mikroporozne adsorbente. Osobitost takvih adsorbenata, kod kojih su linearne veličine pora r1 nm, je da je cijeli volumen njihovih pora "ispunjen" adsorbensima. polje. Stoga, kada adsorpcija Pune se ne sloj po sloj, već volumetrijski. Količina u slučaju koji se razmatra nije adsorbirana. potencijal, i do kemijskog predznaka. adsorbatni potencijal, mjeren s kemijske razine. potencijal normalne tekućine pri istoj temperaturi. Cijeli skup adsorbirajućih pora podijeljen je u tri klase: mikropore ( r 0,6 nm), mezopore (0,6 nm-20 nm) i makropore ( r 20 nm). adsorpcija u mikroporama se odvija po shemi TOZM, t.j. volumetrijski, u mezoporama - prema mehanizmu sloj-po-sloja punjenja, završenog kapilarnom kondenzacijom. Makropore tijekom adsorpcije. ne igraju nikakvu ulogu u ravnoteži.
Uvodeći ideju o raspodjeli volumena pora prema kemijskim vrijednostima. adsorbatni potencijal u njima, M.M. Dubinin i L.V. Radushkevich dobili su jednadžbu za adsorpcijsku izotermu TOZM-a, koja se obično piše u nastavku. oblik:

Gdje p, E i 0 -parametri ( a 0 = a na p = p.s). Ovisnost o temperaturi a 0:
gdje= -(da 0/dT); a 0 0 = a 0 pri T \u003d T 0. Mogućnosti P I E praktički neovisno o temperaturi. U većini slučajeva P= 2. Samo za slučajeve kada početne grije adsorpcija vrlo velika n > 2. Za ponovno izračunavanje izotermi adsorpcija s jednog na drugi adsorptiv približno se pretpostavlja da E 1 /E 2 P 1 /P= i da je a 01 /a 02 V 1 /V 2, gdje je P ja- padobran, Vi- molarni volumen adsorpcije adsorpcija
Svaki mikroporozni adsorbent karakterizira TOZM pomoću dva parametra: W- volumen mikropora ( W 0 = = a 0 V 0) i E 0 -karakteristika. energija; W 0 i E 0 se nazivaju standardnim adsorbensom, obično benzenom.
Koristeći ideju da u pravom adsorbensu postoje pore različitih veličina i uvođenje raspodjele vrijednosti E s disperzija jednaka F. Steckley je predložio generalizaciju jednadžbe (23), nazvanu Dubinin-Steckleyeva jednadžba:

Gdje B 0 - konstanta povezana sa E u jednadžbi (23), i y= ![]() . Jer u adsorbentima. tehnologija najviše Mikroporozni adsorbenti (aktivni ugljen, zeoliti, fino porozni kserogeli) postali su široko rasprostranjeni; TOZM se koristi ne samo u fizikalnim i kemijskim primjenama. istraživanja, ali i u inženjerskim proračunima.
. Jer u adsorbentima. tehnologija najviše Mikroporozni adsorbenti (aktivni ugljen, zeoliti, fino porozni kserogeli) postali su široko rasprostranjeni; TOZM se koristi ne samo u fizikalnim i kemijskim primjenama. istraživanja, ali i u inženjerskim proračunima.
Adsorpcija plinskih i tekućih smjesa. U praksi se uvijek ne radi o pojedinačnom adsorbensu, već o mješavini plinova ili tekućih otopina. Stoga je potrebna generalizacija teorije adsorpcija u slučaju višekomponentnog adsorptivnog sredstva adsorpcija U principu, možete početi od bilo kojeg modela adsorpcija i proširiti ga na ovaj slučaj. Na adsorpcija plinske smjese, to se postiže ne samo velikim kompliciranjem jednadžbi, već i uvođenjem dodataka u njih. empirijski parametri povezani s interakcijom ili s interakcijom. različitih molekula ili, općenito, s utjecajem određenih tvari na koeficijent. aktivnost drugih. Samo nam Langmuirov model omogućuje dobivanje jednadžbe izoterme adsorpcija smjese bez parametara koji nisu uključeni u jednadžbe za adsorpcija pojedinačne stavke Da biste to učinili, dovoljno je uzeti u obzir da tijekom adsorpcije k-te komponente iz smjese ja sastavni dio adsorbata. centri m.b. zauzimaju druge molekule. Zato:
Kada adsorpcija tekućim otopinama, bez obzira na njihovu koncentraciju, ispunjena je cijela površina adsorbensa adsorpcija Slijedom toga adsorpcija molekula k-te komponente prati istiskivanje određenog broja molekula preostalih komponenti, tj. adsorpcija je natjecateljske prirode.
Postoje molekularni i ionski adsorpcija rješenja. Prvi se javlja kada adsorpcija otopine neelektrolita, druga otopina elektrolita. Molekularni adsorpcija, u pravilu, izražava se prevelike količine. Natjecateljska priroda adsorpcija utvrđuje da vrijednost A m.b. i pozitivno i negativno. Izražavanje adsorpcija ja- te komponente kao funkcije njezinog molnog udjela u otopini x ja-, imamo tog G ja= O na x ja= 0 i x ja = 1 (moguća promjena volumen tvari u adsorbtima. sloj je zanemaren). Stoga izoterm adsorpcija ima jedan ili više krajnosti.
izotermna jednadžba adsorpcija binarnih otopina neelektrolita, pouzdano termodinamički potkrijepljenih, ima oblik:

gdje indeks s označava adsorb. faza, - ( dn s 2 / dn s 1) pokazuje koliko je molova druge komponente istisnuto jednim molom prve; razlika između članova (standardnih dijelova) kemikalije. potencijal, ovisno samo o temperaturi.
Osnovni, temeljni problem korištenja ove i niza drugih jednadžbi izoterme adsorpcija- pojašnjenje ovisnosti koeficijenta. aktivnost komponenata u adsorpciji. sloj iz svog sastava adsorpcija Najvažnije pitanje kod korištenja adsorpcija za odvajanje ili pročišćavanje tvari - odabir selektivnog adsorbensa u odnosu na zadanu otopinu komponente adsorpcija
ionski adsorpcija, u pravilu, nije ekvivalentan adsorpcija Pretežni se adsorbiraju na površini iz otopine elektrolita. kationi ili anioni. Zahvaljujući električnoj (Coulombove) sile na površini oblika električni dvostruki sloj.
Ako adsorbent sadrži ione ili površinske funkcije. skupine sposobne za ionizaciju u određenom otapalu, tada dolazi do ionske izmjene između adsorbensa i otopine elektrolita. Adsorbent se u ovom slučaju naziva. ionit.
Kinetika adsorpcije
adsorpcija, kao i svaki pravi proces, događa se u vremenu. Stoga kompletna teorija adsorpcija treba sadržavati odjeljak o kinetici adsorpcija Osnovni zakon adsorpcija provodi se gotovo trenutno (izuzetak je kemisorpcija). Dakle, vremenske ovisnosti adsorpcija određuju se u glavnom mehanizmom difuzije, tj. dovodom adsorbensa na mjesto adsorpcija Ako adsorpcija na otvorenoj površini nije trenutačan, takav se proces događa u području vanjske difuzije; Štoviše, zakoni difuzije nisu specifični za adsorpcija Kod poroznih adsorbenata osim vanjskih difuzije, unutarnji počinje igrati važnu ulogu. difuziju, tj. prijenos adsorbenta u porama adsorbensa u prisutnosti koncentracijskog gradijenta u njima. Mehanizam takvog prijenosa može ovisiti o koncentraciji adsorbensa i veličini pora.
Razlikuju se molekularna, Knudsenova i površinska (Volmerova) difuzija. Do molekularne difuzije dolazi ako je slobodna duljina. put molekula u porama manji je od veličine pora, Knudsen - ako ta duljina premašuje veličinu pora. S površinskom difuzijom, molekule se kreću duž površine adsorbensa bez ulaska u fazu mase. Međutim, vrijednosti koeficijenta. difuzija nije ista za različite mehanizme difuzije. U množini U slučajevima se ne može eksperimentalno ustanoviti kako točno dolazi do difuzije, pa stoga dolazi do tzv. efektivni koeficijent difuzija, opisujući proces u cjelini.
Osnovni, temeljni eksperimentirajmo gradivo o kinetici adsorpcija služi kao tzv kinetički krivulja, tj. funkcija = a/a jednako = f(t) gdje-relativni adsorpcija, jednak omjeru trenutne vrijednosti adsorpcije A Do a jednaka njegovoj vrijednosti u trenutku t. Za tumačenje kinetičke krivulje u najjednostavnijem slučaju, pretpostavlja se da zrno adsorbensa ima poroznu strukturu koja je potpuno homogena po volumenu (ovaj model se naziva kvazihomogenim). Sredstva. Poboljšanje kvazihomogenog modela je ideja da svako zrno sadrži regije s većim i finijim porama. Difuziju u takvom zrnu opisuju dva dec. koeficijenti.
U slučaju otvorene površine, usvajanjem Langmuirovog modela, lako je dobiti kinetiku. jednadžba adsorpcija Brzina približavanja ravnoteži je razlika u brzinama adsorpcija i desorpcija. Pretpostavljajući, kao i obično u kinetici, da su brzine procesa proporcionalne koncentracijama tvari koje reagiraju, imamo:
gdje su k adc i k des konstante brzine. adsorpcija i desorpcija. Pretpostavlja se da je tlak u plinovitoj fazi konstantan. Pri integraciji ove jednadžbe iz t= 0 na bilo koju vrijednost t dobivamo:
Dakle, za f imamo:= jednako. Dakle, konačno imamo:
gdje je k = k oglasa + k dec.
Utjecaj temperature na brzinu adsorpcija izražena jednadžbom sličnom Arrheniusovoj jednadžbi adsorpcija Kako temperatura raste, kads raste eksponencijalno. Jer difuzija u porama adsorbensa povezana je s prevladavanjem aktivacije. barijere, temperaturne ovisnosti kads i kdes nisu iste.
Poznavanje brzina difuzije važno je ne samo za teoriju adsorpcija, ali i za obračun prom. adsorpcija procesima. U ovom slučaju obično se ne bave pojedinačnim zrncima adsorbensa, već njihovim slojevima. Kinetika procesa u sloju izražena je vrlo složenim ovisnostima. U svakoj točki sloja u određenom trenutku, vrijednost adsorpcija određena je ne samo oblikom jednadžbe izoterme adsorpcija te zakonitosti kinetike procesa, ali i aero- ili hidrodinamičke. uvjetima strujanja plina ili tekućine oko zrna. Kinetika procesa u sloju adsorbensa, za razliku od kinetike u zasebnom zrnu, naziva se. dinamika adsorpcija, opća shemačije je rješenje problema sljedeće: sastavlja se sustav diferencijala. parcijalne diferencijalne jednadžbe, uzimajući u obzir karakteristike sloja, izoterm adsorpcija, karakteristike difuzije (koeficijent difuzije, vrste prijenosa mase kroz sloj i unutar zrna), aero- i hidrodinamika. značajke protoka adsorpcija Navedeni su početni i rubni uvjeti. Rješenje ovog sustava jednadžbi u načelu dovodi do vrijednosti adsorpcija u određenom trenutku u određenom trenutku u sloju. U pravilu, analitički rješenje se može dobiti samo za najjednostavnije slučajeve, pa se ovaj problem rješava numerički pomoću računala.
U eksperimentalnom proučavanju dinamike adsorpcija Struja plina ili tekućine sa zadanim karakteristikama prolazi kroz adsorpcijski sloj i proučava se sastav izlazne struje kao funkcija vremena. Pojava apsorbirane tvari iza sloja tzv. proboj, a vrijeme prije proboja je vrijeme zaštitnog djelovanja. Ovisnost koncentracije određene komponente iza sloja o vremenu naziva se. izlazna krivulja. Ove krivulje služe kao osnova. eksperimentirajmo materijal koji omogućuje prosuđivanje obrazaca dinamike adsorpcija
Dizajn hardvera adsorpcijskih procesa
Postoje mnoge tehnologije. metode adsorpcije. procesima. Rasprostranjena ciklička (periodične) instalacije s fiksnim slojem adsorbensa, osn. čvor od kojih je jedan ili nekoliko. adsorberi izrađeni u obliku šupljih stupova ispunjenih granuliranim adsorbensom. Struja plina (ili tekućine) koja sadrži adsorbirane komponente prolazi kroz sloj adsorbensa do probijanja adsorpcija Nakon toga se adsorbent u adsorberu regenerira, a protok plina se šalje u drugi adsorber. Regeneracija adsorbenta uključuje nekoliko faza, od kojih je glavna desorpcija, tj. oslobađanje prethodno apsorbirane tvari iz adsorbensa adsorpcija Desorpcija se provodi zagrijavanjem, smanjenjem tlaka plinske faze, istiskivanjem (npr. živom parom) ili kombinacijom ovih metoda. Jer vremena adsorpcija a regeneracije se ne poklapaju, odaberite toliki broj istovremeno aktivnih i regeneriranih adsorbera da se cjelokupni proces odvija kontinuirano.
Prema tehn. i ekonomičan iz razloga regeneracije, regeneracija nije dovršena adsorpcija Stoga je radni kapacitet adsorbensa jednak razlici maksimalno postignutog u danim uvjetima adsorpcija i količina adsorbata koja ostaje u adsorbensu nakon regeneracije. Kao rezultat toga, izoterme adsorpcija, koji odgovara procesu u adsorberu, ne smije biti prestrm.
U opisanoj shemi moguće su dvije opcije: 1) ciljni produkt se gotovo potpuno adsorbira iz protoka plina, a zatim se zadržava u desorbatu, odakle se ekstrahira na ovaj ili onaj način; 2) ciljni proizvod se adsorbira lošije od ostalih komponenti plinske smjese, a zatim se nalazi u izlaznoj struji plina. Prema prvoj opciji, primjerice, jedinice za oporabu rade u proizvodnji viskoze, skupljaju CS 2 iz ispušnih plinova i vraćaju ih u ciklus. Produktivnost takvih instalacija doseže stotine tisuća m3 pročišćenog plina na sat; adsorbent-aktivni ugljen s ne pretankim mikroporama, tj. ugljen, u kojemu je konstanta E prema TOZM (vidi gore) iznosi 20-25 kJ/mol. Ova vrijednost E 0 odgovara ne previše strmoj izotermi, koja osigurava dobre uvjete regeneracije. Takvi se ugljeni zovu oporavak. Desorpcija se provodi vrućom vodenom parom. Radi uštede energije, struje hladnog i vrućeg plina prolaze kroz izmjenjivače topline.
Vrlo je važno sušenje plinova i tekućina, npr. naftni plinovi prije njihove prerade ili prirodne. plinovi prije prijevoza; adsorbenti – silika gel ili zeoliti. Desorpcija se provodi zagrijavanjem. Budući da je desorpcija zeolita povezana s velikim utroškom energije koristi se kombinirani adsorbens: bazični. masu vlage apsorbira lako regenerirajući silikagel, a dubinsko sušenje zeolit.
S toplinskom regeneracijom, puni ciklus uključuje adsorpcija, zagrijavanje adsorbensa, njegova desorpcija i hlađenje. Veliki broj faza određuje nizak intenzitet i visok energetski intenzitet procesa adsorpcija Stoga se tzv. biljke kratkog ciklusa, čiji cijeli ciklus traje nekoliko. minuta. U njima se plin dovodi do adsorbera pod značenjem. tlaka, koji se zatim oslobađa i dolazi do desorpcije. Cijeli proces je gotovo izotermalan (odstupanje od izotermnosti nastaje samo oslobađanjem topline adsorpcija i apsorpcija topline tijekom desorpcije). Faze ciklusa: adsorpcija, depresurizacija, desorpcija, porast tlaka. Primjer je postrojenje sa zeolitom za proizvodnju zraka obogaćenog kisikom.
U instalacijama s pokretnim slojem adsorbensa (u takozvanim hipersorberima), potonji se pod utjecajem gravitacije polako spušta i uklanja s dna. dijelove adsorbera i ulazi u tzv. airlift, koji je okomita cijev paralelna s adsorpcijom. stupac. Protok zraka kreće se kroz ovu cijev odozdo prema gore, što podiže zrnca adsorbensa na vrh. dio kolone. Obrađeni tok plina ulazi u središnji dio adsorbera i kreće se prema gore u protustruji prema adsorbensu. Na vrhu stupca nalazi se kontinuirani adsorpcija, na dnu - regeneracija adsorbensa (vidi također Adsorpcijsko pročišćavanje).
U instalacijama s fluidiziranim ("kipućim") slojem adsorbensa, protok plina koji ulazi u adsorber odozdo dovodi adsorbent u suspenziju. U isto vrijeme, učinkovitost prijenosa mase između adsorbensa i plina naglo se povećava i trajanje adsorpcija i desorpcija. Takve instalacije imaju visoku produktivnost. Njihovu široku distribuciju otežavaju visoki zahtjevi za krznom. čvrstoća zrna adsorbensa (nedovoljna čvrstoća uzrokuje značajan gubitak adsorbensa zbog njegove abrazije i uklanjanja iz aparature).
Osnovni, temeljni zahtjevi za adsorbente: veliki adsorbent. kapacitet, tj. trebaju biti raspršena tijela s velikim taktom. površine ili s velikim volumenom pora; kem. priroda površine mora osigurati učinkovito adsorpcija podaci u-u danim uvjetima; kem. i toplinski. trajnost, regenerativnost, dostupnost. max. Široko su se raširili aktivni ugljeni, kserogeli pojedinih oksida (silika gelovi, aluminijevi gelovi itd.), zeoliti; od neporoznih adsorbenata-tehn. ugljik (čađa) i visoko dispergirani SiO 2 (aerosil, “bijela čađa”).
Područja primjene adsorpcijske tehnologije
O fenomenu adsorpcija osnovali mnogi metode pročišćavanja zraka od štetnih nečistoća (vidi. pročišćavanje plina), voda (vidi Obrada vode), kao i šećerni sirupi za proizvodnju šećera, voćni sokovi i druge tekućine u hrani. industrija, otpadna maziva ulja. Uklanjanje vlage kao štetne nečistoće iz plinova i tekućina pomoću krutih adsorbenata jedna je od važnih grana adsorpcije. tehnike (vidi također Sušenje plinom).
Na adsorpciju. postupci koji se temelje na finom razdvajanju smjesa tvari i izdvajanju pojedinih komponenti iz složenih smjesa. Primjeri su odvajanje izomera alkana radi dobivanja normalnih ugljikovodika za proizvodnju površinski aktivnih tvari, odvajanje ulja u proizvodnji motornih goriva. Za plinske smjese adsorpcija metode odvajanja koriste se za dobivanje zraka obogaćenog kisikom (do gotovo čistog O 2); u množini U slučajevima se ove metode uspješno natječu s ispravljanjem (vidi. Odvajanje zraka).
Područje primjene adsorba koji se brzo razvija. medicinske tehnologije, gdje služi za ekstrakciju štetne tvari iz krvi (metoda hemosorpcije) i dr. fiziol. tekućine. Visoki zahtjevi za sterilnošću predstavljaju vrlo težak zadatak odabira odgovarajućih adsorbenata. Tu spadaju posebno pripremljeni aktivni ugljeni.
Lit.: Brunauer S., Adsorpcija plinova i para, trans. s engleskog, sv.1, M., 1948; de Boer I, Dinamička priroda adsorpcije, trans. s engleskog, M., 1962.; Adsorpcija i poroznost, ur. M. M. Dubinina [etc.], M., 1976.; Keliev N.V., Osnove adsorpcijske tehnologije, 2. izdanje, M., 1984.; Young D.M., Crowell A.D., Fizička adsorpcija plinova, L., 1962. M.M.Dubinin, V.V. Sierpinski.
Odaberite prvo slovo u naslovu članka:
Adsorpcija se odvija na granici. Stoga je razumno termodinamički opis površinskih pojava smatrati poseban slučaj termodinamika heterogenih sustava.
Riža. 3.4. Gibbsova adsorpcija: 1- dvofazni sustav usporedbe, 2- realni dvofazni sustav s neuniformnim područjem
U termodinamici heterogenih sustava koristi se princip aditivnostišto je kako slijedi: sva ekstenzivna svojstva heterogenog sustava jednaka su zbroju odgovarajućih ekstenzivnih svojstava koje bi faze imale prije nego što su dovedene u kontakt. Označimo faze s α i β (slika 4). Tada za idealan sustav, takav da se svojstva faza u blizini sučelja podudaraju s njihovim skupnim svojstvima, vrijede sljedeći odnosi za unutarnju energiju U, volumen V, masu (broj molova) n, entropiju S nakon uspostavljanja ravnoteže u heterogeni sustav:
U = U α + U β , V = V α + V β , n = n α + n β , S = S α + S β
Ovo pretpostavlja da su temperatura i tlak u obje faze isti.
Za stvarne heterogene sustave prijelazno područje na granici dviju faza daje dodatni doprinos opsežnim svojstvima sustava. Ako se pojave površinski fenomeni, treba uzeti u obzir razliku između ekstenzivnih svojstava stvarnog heterogenog sustava i ekstenzivnih svojstava modelnog sustava u kojem nema površinskih fenomena. Takav sustav nazivamo sustavom usporedbe. Sustav za usporedbu ima iste intenzivne parametre (T, P, C i ...) i isti volumen V kao i realni sustav (slika 4).
S termodinamičkog gledišta, adsorpcijska vrijednost G shvaća se kao višak tvari n s, izražen u molovima ili gramima, koji pravi heterogeni sustav ima u usporedbi s referentnim sustavom, u odnosu na područje sučelja ili površinu adsorbenta A. Pretpostavlja se da sustav za usporedbu ima iste intenzivne parametre (T, P, C i) i isti volumen (V = V α + V β) kao i stvarni sustav (slika 4.) .
G = (n - n α - n β)/A = n s /A 3.11
Ekscesne termodinamičke funkcije prijelaznog područja realnog sustava (označavamo ih indeksom s) mogu se napisati kao
U s = U - U α - U β , n s = n - n α - n β , S s = S - S α - S β itd.
Eksperimentalna mjerenja adsorpcije uvijek daju adsorpciju upravo kao višak komponente u pravi sustav u odnosu na odabrani sustav usporedbe. Na primjer, pri adsorpciji plina na krutom adsorbensu ili pri adsorpciji komponenata na krutoj fazi, da biste pronašli vrijednosti adsorpcije, odredite promjenu početnih koncentracija adsorbata nakon kontakta faza α i β
n i s = V(C i o - C i),
Gdje C i o– početna koncentracija i-te komponente, C i– koncentracija i-te komponente nakon uspostavljanja ravnoteže između faza u kontaktu. Vjeruje se da volumen V ne mijenja. Međutim, koncentracija ja th komponenta C i, dobiven eksperimentalno, određuje se u volumenu V' iznad fazne površine bez uzimanja u obzir volumena nehomogenog područja prijelaznog sloja V α na sučelju gdje je koncentracija C i α. Dakle, zbog postojanja neuniformnog područja u stvarnom sustavu, ukupni volumen sustava može se predstaviti kao V = V’ + V α. Sva količina ja-ta komponenta C i o bit će raspoređen između ova dva sveska:
V C i o = V’ C i + V α C i α,
i broj molova komponente ja, adsorbirana na sučelju, bit će jednaka
n i s = (V’C i + V α C i α) – (V’ + V α)C i = V α (C i α – C i) 3.12
Oni. Eksperimentalno utvrđena adsorpcija je višak i-te komponente u volumenu V α u odnosu na količinu te komponente u istom volumenu daleko od međupovršine faza. Ova vrsta adsorpcije naziva se Gibbsova adsorpcija. .
V α C i α nazvao puni sadržaj ja- komponenta u adsorpcijskom sloju. U području vrlo niskih koncentracija C i u volumenu V' amandman V α C i jednadžba (3.2) može se zanemariti i uzeti u obzir izmjerena vrijednost V α C i α puni sadržaj ja- komponentu u adsorpcijskom sloju, na primjer, tijekom adsorpcije plina na krutom adsorbensu pri niskim tlakovima.
Trenutna stranica: 6 (knjiga ima ukupno 19 stranica) [dostupan odlomak za čitanje: 13 stranica]
Font:
100% +
34. Priroda adsorpcijskih sila
Interakcija između molekula adsorbensa s površinom adsorbensa tijekom tzv. fizička adsorpcija može biti uzrokovana raznim razlozima. Tada se potencijal koji određuje interakciju jedne molekule adsorbensa s jednim atomom nepolarnog adsorbensa može izraziti na sljedeći način:
θ = −Kr 6 +Br 12 ,
gdje je r udaljenost između središta čestica; C – konstanta privlačenja disperzije; B je konstanta koja karakterizira energiju odbojnih sila.
Sasvim je očito da bi na relativno velikim udaljenostima trebale prevladavati sile privlačenja, a na malim udaljenostima sile odbijanja. Također, na određenim udaljenostima te sile moraju biti jednake, što će odgovarati minimumu slobodna energija. Ali važno je napomenuti da tijekom adsorpcije disperzijske sile djeluju istovremeno između svake nepolarne čestice.
Budući da energija međudjelovanja čestica može brzo opadati s udaljenošću, za određivanje potencijala adsorpcijskih sila dovoljno je provesti zbrajanje na najbližim atomima adsorbensa. Važno je da se tijekom adsorpcije složenih nepolarnih molekula potencijalna energija može približno izračunati kao zbroj svih potencijalnih adsorpcijskih energija molekulskih jedinica.
Ako se adsorbent sastoji od iona, tada se djelovanje već poznatih disperzijskih sila može nadopuniti djelovanjem induktivnih sila privlačenja dipola koje u molekulama adsorbensa inducira električno polje, koje je pak koju stvaraju ioni rešetke adsorbensa.
Uz takvu interakciju, udio induktivnih sila u adsorpcijskoj interakciji može biti proporcionalan polarizabilnosti molekule adsorbensa i kvadratu jakosti polja na ovoj površini adsorbensa.
Ako se adsorpcija polarnih molekula adsorbensa dogodi na polarnom adsorbensu, tada dipoli u tom slučaju polariziraju atome adsorbensa, tj. čini se da u njima induciraju električne momente. Zbog tog utjecaja disperzijskoj interakciji pridodaje se induktivna interakcija.
Sama induktivna interakcija obično je mala i ovisno o dipolu molekule adsorbensa i polarizabilnosti adsorbensa može doseći velike vrijednosti. Ako se molekule adsorbiraju na adsorbensu koji na površini ima ione ili dipole, tzv. interakcija iona ili dipola adsorbensa s elektrostatskim poljem samog adsorbensa.
U tom slučaju molekule adsorbensa mogu čak biti orijentirane u polju adsorbensa i dolazi do orijentacijske Coulombove interakcije. Obično se događa da su energije induktivnih i orijentacijskih međudjelovanja manje od energije disperzijskih međudjelovanja, pa je prihvaćeno da je energija međumolekulskog privlačenja određena energijom disperzivnog privlačenja.
Adsorpcija također može biti uzrokovana stvaranjem vodikove veze. Veza ovog tipa može nastati tijekom adsorpcije na adsorbentima koji na površini sadrže hidroksilne skupine molekula kao što su voda, alkoholi, amonijak i amini. Kada se stvori vodikova veza, energija interakcije između adsorbensa i adsorbensa može biti prilično velika, a toplina koja se oslobađa pri takvoj adsorpciji znatno je veća od topline adsorpcije tvari koje su slične po obliku i veličini molekula. , ali ne tvore vodikovu vezu.
Važno je napomenuti da se, poznavajući termodinamički opis površinskog sloja na granici adsorbent-adsorbent, njegovu strukturu, prirodu različitih vrsta sila i dinamiku procesa, može pristupiti proučavanju složenije adsorpcije. procesima.
35. Adsorpcija kao spontana koncentracija na granici tvari koje smanjuju međufaznu napetost
Surfaktanti se dijele u dvije velike skupine: aktivni i neaktivni tvari.
Surfaktanti se mogu akumulirati u površinskom sloju i dolazi do pozitivne adsorpcije G > 0.
Ove vrste tvari moraju imati površinsku napetost, koja pak mora biti manja od površinske napetosti otapala, inače će nakupljanje tvari u površinskom sloju biti nepovoljno, te moraju imati relativno nisku topljivost. Uz dovoljno dobru topljivost, molekule surfaktanta imaju tendenciju prelaska s površine u dubinu otopine. Posljedično, površinski aktivne tvari će se preferirano istisnuti iz mase tekućine na površinu.
Ali s nakupljanjem tvari na granici otopine u molekulama tih tvari, koje slabo međusobno djeluju, međumolekularna interakcija u površinskom sloju će se smanjiti, a površinska napetost će pasti.
Surfaktanti u odnosu na vodeni sloj nalaze se mnoge vrste organskih spojeva, masne kiseline s dovoljno velikim ugljikovodičnim radikalom, soli tih kiselina (sapuni), sulfonske kiseline i njihove soli, kao i različite vrste alkoholi i amini. Karakteristična značajka Većina molekula karakterizira njihova difilnost: molekula se sastoji od dva dijela polarne skupine i nepolarnog ugljikovodičnog radikala. Polarna skupina koja ima značajan dipolni moment i jako je hidratantna može odrediti afinitet surfaktanta prema vodenom okolišu. Ali ugljikovodični radikal je razlog koji smanjuje topljivost ovih spojeva.
Površinski neaktivne tenzide- ove vrste tvari nastoje napustiti površinu tekućine u njezin volumen, što rezultira tzv. negativna adsorpcija G < 0. Поверностно-инактивные вещества также обладают значительным поверхностным натяжением, значительно большим, чем натяжение у растворителя (иначе эти вещества способны самопроизвольно накапливаться в поверхностном слое), также обладают высокой растворимостью, что способствует их стремлению уйти с поверхности жидкости в объем. Взаимодействие между молекулами поверхностно-инактивного вещества и растворителя всегда больше, чем взаимодействие между самими молекулами растворителя, поэтому они и стремятся перейти в объем раствора. Površinski neaktivne tvari U odnosu na vodu postoje mnogi anorganski elektroliti: kiseline, lužine, soli. Molekule surfaktanta nemaju hidrofobni dio i mogu se u vodi raspasti u visoko hidratantne ione.
Primjeri Surfaktanti su i neki organski spojevi u kojima nepolarni dio molekule nedostaje ili je vrlo malen. Ove tvari uključuju mravlju, aminooctenu kiselinu.
U nevodenim otapalima, anorganski elektroliti također mogu povećati površinsku napetost, ovisno o otapalu.
Na primjer, kada se natrijev jodid uvede u metanol, površinska napetost se jako povećava; za etanol, površinska napetost je otprilike 2 puta veća. Površinska aktivnost tvari može ovisiti ne samo o prirodi tvari, već i o svojstvima otapala. Ako bilo koje otapalo ima visoku površinsku napetost, tada ta otopljena tvar može pokazivati značajnu površinsku aktivnost.
36. Teorije adsorpcije
Razmotrimo najčešće teorije adsorpcije koje opisuju pojedine vrste adsorpcije na međupovršini „krutina-plin” ili „krutina-otopina”.
Teorija monomolekularne adsorpcije I. Langmuira.
1. Adsorpcija je lokalizirana i uzrokovana je silama bliskim kemijskim.
2. Adsorpcija se događa samo na aktivnim središtima - izbočinama ili udubljenjima na površini adsorbensa, karakterizirana prisutnošću slobodnih valencija. Aktivni centri se smatraju neovisnima i identičnima.
3. Svaki aktivni centar može djelovati samo s jednom molekulom adsorbata; Na površini se može formirati samo jedan sloj adsorbiranih molekula.
4. Proces adsorpcije je reverzibilan i ravnotežan; adsorbiranu molekulu neko vrijeme zadržava aktivno mjesto, nakon čega se desorbira; Nakon nekog vremena uspostavlja se dinamička ravnoteža.
Najveća moguća vrijednost adsorpcije G o se postiže pod uvjetom da su svi aktivni centri zauzeti molekulama adsorbata. Jednadžba izoterme monomolekularne adsorpcije koja povezuje veličinu adsorpcije G s koncentracijom adsorbata S, ima oblik:
Gdje b– konstantna vrijednost za dati par adsorbent – adsorbat (omjer konstanti brzine desorpcije i adsorpcije), brojčano jednaka koncentraciji adsorbata pri kojoj je zauzeta polovica aktivnih centara.

Graf Langmuirove adsorpcijske izoterme prikazan je na slici 2. Konstanta b definiramo grafički povlačenjem tangente na adsorpcijsku izotermu u točki S= 0. Kada se u jednadžbi opisuje proces adsorpcije plina, koncentracija se može zamijeniti proporcionalnom vrijednošću parcijalnog tlaka. Teorija monomolekularne adsorpcije I. Langmuir primjenjiv za opisivanje procesa adsorpcije plinova i otopljenih tvari pri niskim tlakovima (koncentracijama) adsorbata.
Polanyijeva teorija polimolekularne adsorpcije opisuje adsorpcijske izoterme u obliku slova S, čiji oblik ukazuje na moguću interakciju adsorbiranih molekula s adsorbatom.
1. Adsorpciju uzrokuju fizičke sile.
2. Površina adsorbensa je homogena, nema aktivnih centara; adsorpcijske sile tvore kontinuirano polje sila blizu površine adsorbensa.
3. Adsorpcijske sile djeluju na udaljenosti većoj od veličine molekule adsorbata, tj. na površini adsorbensa postoji određeni adsorpcijski volumen koji se tijekom adsorpcije ispunjava molekulama adsorbata.
4. Privlačenje molekule adsorbata površinom adsorbensa ne ovisi o prisutnosti drugih molekula u adsorpcijskom volumenu, zbog čega je moguća polimolekularna adsorpcija.
5. Adsorpcijske sile ne ovise o temperaturi, pa se stoga adsorpcijski volumen ne mijenja s promjenom temperature.
Freundlichova jednadžba. Površina adsorbensa je heterogena, dolazi do interakcije između adsorbiranih čestica, a aktivni centri nisu potpuno neovisni jedni o drugima. G. Freundlicha sugerira da je broj molova adsorbiranog plina ili otopljene tvari po jedinici mase adsorbensa (tzv. specifična adsorpcija x/m), mora biti proporcionalan ravnotežnom tlaku (za plin) ili ravnotežnoj koncentraciji (za tvari adsorbirane iz otopine) adsorbensa, podignutoj na određenu snagu, koja je uvijek manja od jedinice:
x / m = aP n ; x / m = aC n.
Eksponenti n i faktor proporcionalnosti A određena eksperimentalno.
37. Termodinamika procesa adsorpcije. Gibbsova jednadžba adsorpcije
Za proučavanje fenomena adsorpcije na granici "otopina-plin" potrebno je utvrditi vezu između viška adsorbirane tvari u sloju na površini ( G), koncentracija surfaktanta u otopini ( S) i površinske napetosti ( σ ) na granici faza "otopina - plin". Svrsishodnije je pojave promatrati s termodinamičkog gledišta i adsorpciju otopljene tvari povezati s promjenom slobodne energije površine ili njezine površinske napetosti. Ova veza je uspostavljena W. Gibbsa V 1876., koja je nazvana "Gibbsova adsorpcijska jednadžba":
G = – S / RT x dσ/dc.
Još možete zamisliti Gibbsova jednadžba, na temelju termodinamike, koristeći izobarno-izotermni potencijal G, kemijski potencijali μ 1 I μ2, a također i koristeći n 1 I n 2 broj molova komponenti. Nakon što ga je analizirao uzimajući u obzir entropiju S, volumen V i pritisak P, možemo napisati sljedeću jednadžbu:
dG=– SDT+VdP+σds+ μ 1 dn 1 + μ 2 dn 2.
Izjednačimo ga s nulom, a uzimajući u obzir konstantnu temperaturu i tlak, pojednostavljuje se u jednadžbu oblika:
SD σ + n 1 d μ 1 + n 2 d μ 1 = 0.
Uzimajući u obzir činjenicu da se za razrijeđene otopine kemijski potencijal druge komponente izražava kako slijedi:
μ 2 = μ 2 0 +RT ul c,
a s obzirom da je temperatura stalna
dμ 2 =RTdnc,
zamjenjujući ovu jednadžbu u
![]()
dobivamo željenu Gibbsovu jednadžbu adsorpcije. Na temelju jednadžbe vidi se da ako površinska napetost σ raste s koncentracijom S, tada je koncentracija otopljene tvari na površinskom sloju manja nego u masi otopine (tzv. negativna adsorpcija), a ako je površinska napetost σ smanjuje s povećanjem koncentracije S, tada je koncentracija u sloju veća nego u volumenu (pozitivna adsorpcija), i konačno, ako σ ne ovisi o S, tada je koncentracija tvari u sloju na površini i u volumenu ista. Gibbsova jednadžba je izvedena korištenjem termodinamike. U praksi je ovu jednadžbu teško provjeriti, što je posljedica poteškoća u određivanju koncentracije otopljene tvari na površini sloja. Iskusan način B. McBen otkrio je da je pomoću uređaja vrlo tanak sloj tekućine odsječen s površine otopine. Daljnje određivanje svih parametara Gibbsove jednadžbe pokazalo je da se eksperimentalno nađene vrijednosti adsorpcije, unutar eksperimentalne pogreške, poklapaju s vrijednostima izračunatim pomoću Gibbsove jednadžbe. Zbog homogenosti i glatkoće površine svake tekućine, uobičajeni koncepti aktivnih centara potpuno su neprimjenjivi pri proučavanju adsorpcije na njezinoj površini. Na kritičnoj temperaturi razlika između susjednih faza nestaje, a površinska napetost u pravilu postaje jednaka nuli. Adsorpcija plinova i para ima tako široku praktičnu primjenu da se u literaturi, posebice u tehničkoj, može naći ovaj koncept koji se primjenjuje samo u odnosu na procese na površini krutina.
Ovaj koncept, kao i najopćenitiji zakoni adsorpcije, kao što je razmatrana Gibbsova jednadžba, primjenjiv je na sve granice faza. Koristeći Gibbsovu jednadžbu i sve odredbe koje iz nje proizlaze, nakon određivanja vrijednosti Γ moguće je konstruirati adsorpcijsku izotermu.
38. Značajke adsorpcije na mikroporoznim materijalima. Polyanyjeva teorija potencijala. Adsorpcijski potencijal
Polyanijeva teorija smatra nelokaliziranu fizičku adsorpciju, koja je izravno uzrokovana van der Waalsovim silama između adsorbensa i adsorbata (ovo se može smatrati prvim stavom). Drugo stajalište ove teorije je ideja o polju sile (ili potencijala) adsorbensa, koji se proteže na znatnoj udaljenosti od površine; adsorpcijski sloj koji se pojavljuje u ovom polju je polimolekularan. Ako uzmemo u obzir adsorpciju plinova, tada se gustoća ovog sloja smanjuje duž određene normale s površine. Ako uzmemo u obzir adsorpciju pare, tada se na površini formira tekući sloj određene debljine. Polje se u Polyanijevoj teoriji smatra nizom ekvipotencijalnih površina, svaka površina odgovara određenoj potencijalnoj vrijednosti ε , a svaka sljedeća površina bit će manja od prethodne. Svaka takva površina u prostoru izrezuje slojeve određenog volumena, označenog kao v i. Zadatak Polyanyijeve teorije je pronaći prijelaz s uobičajenih koordinata izoterme ( x,str) na parametre polja εi I v i, uz daljnje utvrđivanje povezanosti ovih osnovnih parametara. Prvi dio problema, koji je postavio Polyany, prilično je složen iu mnogim slučajevima ne može imati definitivna rješenja, ali za slučaj adsorpcije pare, ovaj dio problema se u prvoj aproksimaciji rješava vrlo jednostavno. Za tekući adsorpcijski sloj, ispunjeni dio volumena bit će jednak:
v i = x(M/d),
Gdje d– gustoća tvari u tekućem stanju.
M. Polyany u svoju teoriju uvodi još jednu odredbu o nepostojanju tzv. polje probira tijekom adsorpcije, vrijednost ε u ovoj teoriji prostor je stalna vrijednost (nešto poput gravitacijskog potencijala) bez obzira na to postoje li određene molekule adsorbata između dane točke i čvrste površine ili je sav prostor slobodan. Polyani uvodi koncept adsorpcijski potencijal ε , koji predstavlja izotermni rad kompresije pare pri njenom prijenosu iz ravnotežnog tlaka R u masovnoj fazi od površine u područje površinskog sloja s tlakom zasićene pare p 0 tada će izraz za određivanje potencijala izgledati ovako:
ε = RT ul R 0 / R.
Koristeći ovu jednadžbu, možete ići od koordinata x, p do koordinata ε I v i dobiti krivulju, koja se naziva "karakteristika". Polyani je u svojim eksperimentima otkrio da takve krivulje, konstruirane iz eksperimentalnih podataka dobivenih izotermi, imaju sljedeće svojstvo: one su invarijantne u odnosu na T, ili, drugim riječima, sve krivulje ovog tipa mogu stati na jednu krivulju ε −ε .
M. Polyany prihvatio je ovaj stav kao postulat, tj.
Navedeno imanje Polyani ima ogroman praktična vrijednost, može konstruirati obitelj izotermi iz jedne eksperimentalne adsorpcijske izoterme.
Polanyijeva teorija ne daje analitički izraz za izotermu ili funkciju potencijalnog volumena, ali dopušta izračunavanje koordinate za bilo koju danu temperaturu ako je poznata barem jedna izoterma. Ovaj rezultat je vrlo važan za tehnološki proračuni, jer za slične plinove na istom adsorbensu, krivulje adsorpcije mogu biti blizu jedna drugoj i mogu se kombinirati u mnogim slučajevima.
39. Karakteristična adsorpcijska krivulja. Temperaturna nepromjenjivost i afinitet karakterističnih krivulja
Polje sile koje nastaje na površini adsorbensa može biti na mnogo načina slično gravitacijskom polju. U adsorpcijskom polju mogu se zamisliti potencijalne površine, tj. površine koje karakterizira isti adsorpcijski potencijal. Pod pojmom adsorpcijskog potencijala θ treba shvatiti kao ništa drugo do rad obavljen protiv adsorpcijskih sila pri pomicanju 1 mola adsorbensa iz određene točke u polju u određenu plinsku fazu. Maksimalni adsorpcijski potencijal postojat će na granici "adsorbent – adsorpcijski volumen". Ali na granici "volumen - plinovita faza" (tu prestaje djelovanje adsorpcijskih sila), adsorpcijski potencijal bi trebao biti jednak nuli. Promjena adsorpcijskog potencijala s promjenom adsorpcijskog volumena može se prikazati u obliku krivulja. To je prvi put učinio M. Polyani. Ove vrste krivulja ne ovise o temperaturi i mogu biti karakteristične za svaki pojedini adsorbent; te se vrste krivulja obično nazivaju karakteristične adsorpcijske krivulje. Teorija polimolekularne adsorpcije pretpostavlja da je plinska jednadžba stanja primjenjiva za adsorpcijski volumen. Posljedično, izoterme koje karakteriziraju ovisnost gustoće adsorbensa o volumenu za različite temperature nalikuju izotermama ovisnosti tlaka o volumenu. Pri niskim temperaturama površinske adsorpcijske sile mogu uzrokovati kondenzaciju pare u tekućinu određene gustoće. Na temperaturama nižim od kritičnih, tijekom kondenzacije, cijeli će adsorpcijski volumen biti ispunjen tekućinom. U tom će slučaju krivulja adsorpcije ići gotovo paralelno s osi apscise, što je povezano s niskom kompresibilnošću tekućine. Tada se adsorpcijska krivulja na granici "volumen - plinovita faza" naglo spušta i, sukladno tome, gustoća adsorbensa doseže određenu gustoću plinovite faze. Na temperaturama višim od kritične, adsorptiv se može ponašati kao idealni plin, a graf će biti izražen kao izoterma idealnog plina, pod uvjetom da pV = RT. U takvim će uvjetima adsorbirani plin imati maksimalnu gustoću na samoj površini adsorbensa, a minimalnu gustoću u neposrednoj blizini plinovite faze. Štoviše, u ovom slučaju važno je napomenuti da gustoća adsorbensa u adsorpcijskom sloju nigdje ne doseže gustoću same tekućine. A ako je temperatura vrlo blizu kritične, ovisnost gustoće o volumenu bit će izražena krivuljom bliskom izgledu izoterme, koja je opisana van der Waalsova jednadžba. U ovom scenariju dio adsorbirane tvari bit će u adsorbiranom volumenu u tekućem stanju, a dio adsorbirane tvari bit će u plinovitom stanju. Tada će se krivulja najjače smanjiti u dijelu koji odgovara prijelazu iz tekućine u plin. Ako se karakteristična krivulja konstruira iz eksperimentalne adsorpcijske izoterme jednog od adsorptiva, a poznavajući odgovarajuće koeficijente afiniteta za neki drugi adsorptiv, može se pronaći adsorpcijska izoterma i konstruirati je za drugi adsorptiv. Potencijalna teorija adsorpcije omogućuje izračunavanje različitih adsorpcijskih izotermi različitih para na istom adsorbensu, štoviše, korištenjem karakteristične krivulje dobivene iz adsorpcijske izoterme jedne pare, budući da omjer adsorpcijskog potencijala ne ovisi o adsorpcijskim volumenima .
Afinitet(od latinskog affinis - "povezano") - afinitetna kromatografija. Metoda pročišćavanja i odvajanja proteina temelji se na njihovoj selektivnoj interakciji s ligandom kovalentno vezanim na inertni nosač (afinitetna kromatografija). Mjerenje afiniteta toksikanta za receptor zapravo je eksperimentalno istraživanje odnosa između količine tvari dodane u medij za inkubaciju i količine kompleksa toksikans-receptor koji nastaje kao rezultat interakcije.
Termodinamika adsorpcijskih procesa.
| Naziv parametra | Značenje |
| Tema članka: | Termodinamika adsorpcijskih procesa. |
| Rubrika (tematska kategorija) | Obrazovanje |
Osnovne definicije i metode klasifikacije adsorpcijskih procesa.
Adsorpcija se odnosi na pojave koje se javljaju kao rezultat spontanog smanjenja površinske energije.
Adsorpcija- proces spontane reverzibilne ili ireverzibilne preraspodjele komponenti heterogenog sustava između površinskog sloja i volumena homogene faze.
U višekomponentnim sustavima, komponenta koja smanjuje međufaznu napetost je poželjnija od površinskog sloja. U jednokomponentnim sustavima tijekom formiranja površinskog sloja dolazi do promjene njegove strukture (određena orijentacija atoma i molekula, polarizacija), tzv. autoadsorpcija.
Gušća faza na kojoj su lokalizirane adsorpcijske interakcije naziva se adsorbent. Tvar koja se redistribuira između volumena homogene faze i površinskog sloja označava se pojmom ʼʼ adsorbatʼʼ.
U nekim slučajevima, proces adsorpcije je reverzibilan. U tom slučaju, pod određenim uvjetima, dio adsorbiranih molekula kao rezultat molekularno kinetičkih pojava može prijeći iz površinskog sloja u masivnu fazu. Obrnuti proces od adsorpcije naziva se desorpcija.
Metode klasifikacije adsorpcijskih procesa.
Klasifikacija adsorpcijskih procesa prema agregacijskom stanju faza koje međusobno djeluju. Uzimajući u obzir ovisnost o agregatnom stanju susjednih faza, razlikuju se sljedeće vrste adsorpcijskih procesa:
Adsorpcija plinova na čvrstim adsorbentima;
Adsorpcija otopljenih tvari na međupovršini "krutina-tekućina" i "tekućina-tekućina";
Adsorpcija površinski aktivnih tvari na granici tekućina-plin.
Podjela adsorpcijskih procesa prema mehanizmu interakcije između adsorbensa i adsorbata. Adsorpcija se može smatrati interakcijom molekula adsorbata s aktivnim centrima adsorbensa. Prema mehanizmu njihove interakcije dijele se sljedeće vrste adsorpcije:
1) fizička (molekularna) adsorpcija– interakcija između molekula adsorbata i adsorbenta odvija se zahvaljujući van der Waalsovim silama, vodikovim vezama (bez kemijske reakcije);
2) kemijska adsorpcija (kemisorpcija)– vezanje molekula adsorbata na aktivne centre adsorbenta događa se kao rezultat kemijskih reakcija različitih vrsta (s izuzetkom reakcija ionske izmjene);
3) adsorpcija ionske izmjene (ionska izmjena) – preraspodjela adsorbatne tvari između otopine i krute faze (ionskog izmjenjivača) prema mehanizmu reakcija ionske izmjene.
Za kvantitativno opisivanje procesa adsorpcije koriste se dvije veličine.
1) Apsolutna adsorpcija– količina (mol) ili masa (kg) adsorbata po jedinici površine ili mase adsorbensa. Oznaka - A; dimenzija: mol/m2, mol/kg, kg/m2, kg/kᴦ.
2) Gibbsova (višak) adsorpcija– višak adsorbatne tvari u površinskom sloju određene debljine u odnosu na njenu količinu u volumenu homogene faze, po jedinici površine ili mase adsorbensa. Oznaka - G; dimenzija: mol/m 2, mol/kᴦ.
Odnos između apsolutne i prekomjerne adsorpcije može se ilustrirati pomoću jednadžbe:
G = A – s * h (3.1)
gdje je c ravnotežna koncentracija tvari u volumenu faze, mol/m3;
h je debljina površinskog sloja, konvencionalno se pretpostavlja da je 10 -9 m.
U višekomponentnim heterogenim sustavima, kada se jedna ili druga komponenta redistribuira između volumena homogene faze i površinskog sloja, vrijedi jednadžba za višak unutarnje energije površine:
U = T * S + s * s + Sm i * n i (3.2)
Dovodeći sve članove jednadžbe na jedinicu površine međufazne površine, dobivamo:
U s = T * S s + s + Sm i * G i (3.3)
gdje je G i = n i / s višak i-te komponente u površinskom sloju, odnosno Gibbsova adsorpcija.
Za jednokomponentni sustav, jednadžba (3.3) će imati oblik:
G s = s + m * G (3.4)
gdje je G s = U s - T * S s Gibbsova energija površine ili rad stvaranja jedinice površine površine;
m * G – zbijenost tvari adsorbirane tvari u površinskom sloju.
Na temelju jednadžbe (3.4) možemo zaključiti da se tijekom adsorpcije rad stvaranja međufazne površine sastoji od rada formiranja površine (kidanja kohezijskih veza u volumenu faze adsorbata) i zbijanja tvari u površinskom sloju.
U stanju dinamičke ravnoteže između adsorbensa i adsorbata, promjena Gibbsove energije heterogenog sustava ΔG = 0, termodinamika procesa adsorpcije opisuje se jednadžbom tzv. Gibbsova temeljna adsorpcijska jednadžba:
Ds = SG i * dm i (3.5)
Ova jednadžba je univerzalna, jer vrijedi za sve vrste adsorpcijskih procesa
Posebni slučajevi Gibbsove adsorpcijske jednadžbe.
1) Adsorpcija iz otopina.
Za kemijski potencijal i-te komponente sustava tijekom adsorpcije na međupovršini „tekućina – kruti adsorbent” i „tekućina – plin” vrijede sljedeće jednadžbe:
m i = m i 0 + R*T*ln a i (3.6)
dm i = R*T* d ln a i (3.7)
gdje je m i 0 kemijski potencijal i-te komponente sustava pri standardne uvjete;
a i je aktivnost i-te komponente sustava u standardnim uvjetima.
Na temelju toga, Gibbsova jednadžba adsorpcije ima oblik:
G i = - a i / R*T * (ds / da i) (3.8)
Za otopine neelektrolita uzimamo a i = c i, tada:
G i = - s / R*T * (ds / ds) (3.9)
Za otopine elektrolita:
G i = - s ± n / R*T * (ds / ds ± n) (3.10)
gdje je s ± prosječna ionska koncentracija otopine;
n je stehiometrijski koeficijent.
2) Adsorpcija tvari iz plinovite faze.
U skladu s Mendeleev-Clayperonovom jednadžbom:
R = s * R*T (3.11)
S tim u vezi, Gibbsova jednadžba za adsorpciju plinova na čvrstim adsorbentima napisana je u sljedećem obliku:
G i = - R / R*T * (ds / dR) (3.12)
U praksi, Gibbsova adsorpcijska jednadžba omogućuje, na temelju mjerenja površinske napetosti pri različitim vrijednostima koncentracije tekućine ili ravnotežnog tlaka plina, izračunavanje količine adsorpcije tvari u međufaznom sloju za koji se određuje površinska napetost.
Termodinamika adsorpcijskih procesa. - pojam i vrste. Klasifikacija i značajke kategorije "Termodinamika adsorpcijskih procesa." 2017., 2018. godine.
U slučaju interakcije između dva atoma:
U – energija interakcije;
U = U PRIJE. + U POVRATAK
 - Lennard-Jonesova jednadžba
, c, b, m = konst
- Lennard-Jonesova jednadžba
, c, b, m = konst
U slučajevima interakcije atoma s čvrstom površinom potrebno je zbrojiti sve interakcije.
x – udaljenost od površine
r – radijus djelovanja privlačnih sila
dV – volumen
n – broj površinskih molekula
U OGLASI. – energija adsorpcijske interakcije



U slučaju adsorpcije, privlačnost se povećava. A u slučaju nepolarne-nepolarne interakcije, adsorpcija je pretežno lokalizirana u udubljenjima.
Elektrostatska interakcija.
Polarni adsorbent – nepolarni adsorbat
Nepolarni adsorbent - polarni adsorbat
Polarni adsorbent je polarni adsorbat.
M  Molekula adsorbata je predstavljena kao dipol, a adsorbent je predstavljen kao vodič u kojem molekula adsorbata inducira dipolno zrcalo simetrično u odnosu na dano.
Molekula adsorbata je predstavljena kao dipol, a adsorbent je predstavljen kao vodič u kojem molekula adsorbata inducira dipolno zrcalo simetrično u odnosu na dano.
X – udaljenost do sredine
Prilikom interakcije nastaje potencijal:
 ,
,
 - dipolni trenutak.
- dipolni trenutak.
Potencijal nastoji poprimiti najveću vrijednost, tj. dipoli se teže orijentirati okomito na površinu.
Budući da povećanje temperature potiče rast Brownovog gibanja, to dovodi do inhibicije procesa adsorpcije.
U slučaju elektrostatske interakcije, adsorbat je pretežno lokaliziran na izbočinama.
Osnovna jednadžba adsorpcije.
U slučaju adsorpcije dolazi do preraspodjele komponente, što znači da se mijenja kemijski potencijal. Proces adsorpcije može se smatrati prijelazom površinske energije u kemijsku energiju.
Volumen sloja = 0, onda generalizirana jednadžba I i II zakona termodinamike:
T = const; (1) = (2) => 

Za dvokomponentni sustav:
,
 ,
,
 =>
=>
=>
 - Gibbsova jednadžba adsorpcije
.
- Gibbsova jednadžba adsorpcije
.
Za slučaj TV adsorpcije. tijelo - plin:, 
 ,
,

 - izoterma
- izoterma
 - izobara
- izobara
 - isopykne
- isopykne
 - izoster
- izoster
Izoterma, izopikna, izostera međusobno su povezani.
Jer adsorpcijska funkcija 



Henryjeva izoterma Langmuirova izoterma



Termodinamika. Adsorpcija.
Za kondenziranu tvar:
 ,
,
 ,
,
 - integralna promjena Gibbsove energije
.
- integralna promjena Gibbsove energije
.

P – pritisak na zakrivljenu površinu, R S – pritisak na ravnu površinu
 - adsorpcijski potencijal
- adsorpcijski potencijal
Diferencijalna promjena entrapije 
 , G = konst
, G = konst
- promjena diferencijalne entropije
- diferencijalna entalpija adsorpcije
 - izosterična toplina adsorpcije
- izosterična toplina adsorpcije
 - toplina kondenzacije
- toplina kondenzacije
 - neto toplina adsorpcije
- neto toplina adsorpcije

 ,
,




Qa – integralna toplina adsorpcije, 
Qra – integralna neto toplina adsorpcije,

Henryjeva jednadžba
Proučavanje adsorpcije otežava heterogenost površine, pa se najjednostavniji zakoni dobivaju za homogene površine.
Razmotrimo međudjelovanje plinova s čvrstom površinom, kada plin prelazi iz ravnotežnog stanja u volumenu u ravnotežno stanje na površini. Ovaj slučaj je analogan ravnoteži plinova u gravitacijskom polju.
 ,
,
 ,
=>
,
=> -Henryjeva jednadžba
-Henryjeva jednadžba
 - koeficijent raspodjele
- koeficijent raspodjele
Tijekom procesa adsorpcije dolazi do promjene kemijskih potencijala.
Za skupnu fazu: 
Za plin na površini: 
U stanju ravnoteže  , tj.
, tj.

U Henryjevoj jednadžbi konstanta ne ovisi o koncentraciji
Henryjeva jednadžba vrijedi u području niskih tlakova i koncentracija. Kako koncentracija raste, moguće su 2 vrste odstupanja od Henryjeva zakona:
1 – pozitivna odstupanja, D opada, A opada
2 – negativna odstupanja, D – raste, A – raste.
Vrsta odstupanja određena je prevladavanjem jedne ili druge vrste interakcije adsorbensa i adsorbata.
S jakom adhezivnom interakcijom, koeficijenti aktivnosti se povećavaju - pozitivno odstupanje. U slučaju kohezivnih interakcija opažaju se negativna odstupanja.
Monomolekularna adsorpcija.
Langmuirova izoterma.
Najjednostavniji uzorci dobiveni su u Henryjevoj teoriji. Langmuir je predložio teoriju prema kojoj se adsorpcija smatra kvazikemijskom reakcijom. pri čemu:
Površina je energetski homogena.
Adsorpcija je lokalizirana, svaki adsorpcijski centar stupa u interakciju s jednom molekulom adsorbata.
Molekule adsorbata ne djeluju jedna na drugu.
Jednoslojna adsorpcija.

 - površina,
- površina,  - adsorbat,
- adsorbat,  - adsorpcijski kompleks.
- adsorpcijski kompleks.
 , tada je koncentracija adsorpcijskih mjesta:
, tada je koncentracija adsorpcijskih mjesta:  ,
, - ograničavanje adsorpcije.
- ograničavanje adsorpcije.
 , tada je konstanta reakcije:
, tada je konstanta reakcije: 

 - Langmuirova jednadžba.
- Langmuirova jednadžba.
Ovisnost adsorpcije o koncentraciji
1 )
)
 ,
,

2) područje visokih koncentracija
 - ograničavanje adsorpcije, stvaranje monomolekularnog sloja
- ograničavanje adsorpcije, stvaranje monomolekularnog sloja
Za Gibbsovu energiju: .
g je faktor entropije.
U slučaju Henryjeve izoterme, Gibbsova energija karakterizira prijelaz adsorbata iz standardnog stanja u masi u standardno stanje na površini. U slučaju Langmuirove izoterme  karakterizira stupanj afiniteta između adsorbensa i adsorbata.
karakterizira stupanj afiniteta između adsorbensa i adsorbata.
 pronađeno iz van't Hoffove izobare.
pronađeno iz van't Hoffove izobare.

 , Zatim
, Zatim  , odavde
, odavde  .
.

 - stupanj ispunjenosti površine.
- stupanj ispunjenosti površine.




 - broj slobodnih mjesta,
- broj slobodnih mjesta,  - broj popunjenih mjesta.
- broj popunjenih mjesta.
 ,
,

Oni. u području visokih koncentracija broj slobodnih mjesta je obrnuto proporcionalan količini adsorbata.
Adsorpcija smjese plinova na homogenu površinu.
U ovom slučaju, proces adsorpcije se promatra kao dvije paralelne reakcije.
 (1)
(1)

 (2)
(2)


Adsorpcija smjese plinova na nejednoliku površinu.
U slučaju neujednačene površine, ne može se ograničiti na prosječne ispune.
Kao rezultat konkurencije, lokalizacija različitih adsorbata moguća je u područjima različitih tipova.
U ovom slučaju odnos  .
.
 ,
,
 - tlak zasićene pare adsorbata.
- tlak zasićene pare adsorbata.
 ,
,
 - toplina adsorpcije.
- toplina adsorpcije.
“+” - ovisnost o simbatu, “-” - ovisnost o antibatu, “N” - nema korelacije.
“+” - adsorpcija se odvija prema istom mehanizmu. U energetski najpovoljnijim područjima pretežno se adsorbira plin s velikim afinitetom prema površini.
"-" - adsorpcija se odvija različitim mehanizmima i do određenog trenutka nema konkurencije za površinu.
Monomolekularna adsorpcija pretežno se ostvaruje pri fizičkoj adsorpciji plinova pri niskim vrijednostima str, kao i na sučelju tekućina/plin.
Polimolekularna adsorpcija.
BET teorija(Brunauer, Emmett, Teller).
U slučaju kada stvaranje monosloja nije dovoljno za kompenzaciju površinske energije, adsorpcija je polimolekularna i može se smatrati rezultatom prisilne kondenzacije pod djelovanjem površinskih sila.
Ključne točke:
Kada molekula adsorbata udari u zauzeto mjesto, formira se višestruki set.
Kako se približavamo str Do str s smanjuje se broj slobodnih adsorpcijskih mjesta. U početku se broj mjesta koja zauzimaju jednokrevetne, parne, itd. povećava, a zatim smanjuje. kompleti.
Na str =str s adsorpcija prelazi u kondenzaciju.
Nema horizontalnih interakcija.
Za prvi sloj ispunjena je Langmuirova izoterma.
Površina se smatra skupom adsorpcijskih mjesta. Vrijedi uvjet dinamičke ravnoteže: brzina kondenzacije u slobodnim mjestima jednaka je brzini isparavanja iz zaposjednutih.
a je koeficijent kondenzacije (udio molekula kondenziranih na površini);
 ,
,
Zm – najveći broj slobodnih mjesta.
 - frekvencija titranja atoma u smjeru okomitom na površinu.
- frekvencija titranja atoma u smjeru okomitom na površinu.
Za prvi sloj, uvjeti dinamičke ravnoteže:



 , Zatim
, Zatim
 - Langmuirova jednadžba.
- Langmuirova jednadžba.
Za drugi sloj vrijedit će: 
Za i-ti sloj: 
Radi jednostavnosti, pretpostavlja se da su a i ν isti za sve slojeve osim za prvi. Za sve slojeve osim za prvi toplina adsorpcije je konstantna. Za posljednji sloj toplina adsorpcije jednaka je toplini kondenzacije. Kao rezultat, dobivena je jednadžba
 (*)
(*)
C- konstantno,
U slučaju BET teorije, konstanta S karakterizira Gibbsovu energiju čiste adsorpcije. Jednadžba sadrži samo jednu konstantu, a ova jednadžba je također vrlo važna za određivanje specifične površine adsorbensa.
Budući da se toplina oslobađa kao rezultat adsorpcije, specifične površine se određuju pri niskim temperaturama.
 ????????????
????????????


Glavni nedostatak teorije– zanemarivanje horizontalnih interakcija u korist vertikalnih.
Jednadžba vrijedi u rasponu  od 0,05 do 0,3.
od 0,05 do 0,3.
Gdje  <
0,05 – существенное влияние оказывает
неоднородность поверхности.
<
0,05 – существенное влияние оказывает
неоднородность поверхности.
 > 0,3 – utječe na interakciju adsorbat – adsorbat.
> 0,3 – utječe na interakciju adsorbat – adsorbat.
Računanje interakcija adsorbat-adsorbat.
Interakcije nastaju kada se razgranate molekule ili molekule adsorbiraju na nepolarnoj površini. Sposoban za formiranje suradnika. U tom se slučaju mijenja oblik adsorpcijskih izotermi.
A  adsorbent nije polaran.
adsorbent nije polaran.
Grafikon 1 odgovara slabim interakcijama adsorbat-adsorbat i jakim interakcijama adsorbat-adsorbent.
Grafikon 2 odgovara jakim interakcijama adsorbat-adsorbat i jakim interakcijama adsorbat-adsorbent.
Grafikon 3 odgovara jakoj interakciji adsorbat-adsorbat i slaboj interakciji adsorbat-adsorbent.
 ,
,

U slučaju interakcije između molekula adsorbata, potrebno je uzeti u obzir promjene koeficijenata aktivnosti. I ova jednadžba je napisana kao:
 - Frunkin, Fowler, Guggenheimova jednadžba.
- Frunkin, Fowler, Guggenheimova jednadžba.
k– konstanta privlačnosti.
Polyanyjeva teorija potencijala.
Ova teorija ne izvodi nikakvu vrstu adsorpcijske izoterme, ali omogućuje izračunavanje izoterme na različitim temperaturama.
Adsorpcija- to je rezultat privlačenja adsorbata na površinu adsorbenta zbog djelovanja adsorpcijskog potencijala, koji ne ovisi o prisutnosti drugih molekula, a ovisi o udaljenosti između površine i molekule adsorbata.
 ,
,
 - adsorpcijski potencijal.
- adsorpcijski potencijal.
Budući da je površina nejednolika, udaljenost se zamjenjuje adsorpcijskim volumenom  .Adsorpcijski volumen je volumen zatvoren između površine i točke koja odgovara danoj vrijednosti
.Adsorpcijski volumen je volumen zatvoren između površine i točke koja odgovara danoj vrijednosti  .
.
Adsorpcijski potencijal je rad prijenosa 1 mola adsorbata izvan zadanog adsorpcijskog volumena do zadane točke adsorpcijskog volumena (ili rad prijenosa 1 mola zasićene pare adsorbata koji je u ravnoteži s tekućim adsorbatom u odsutnosti adsorbensa u parnu fazu u ravnoteži s adsorbensom).

Karakteristična krivulja
 - adsorpcijski potencijal,
- adsorpcijski potencijal, 
Za određeni adsorbent i razne adsorbate vrijedi sljedeće: 
Za različite vrste adsorbata  ,
,
Gdje  potencijali za adsorpcijske izoterme pri relativnim pritiscima
potencijali za adsorpcijske izoterme pri relativnim pritiscima  za adsorbat 1 i za adsorbat 2. Ovaj omjer je konstantna vrijednost.
za adsorbat 1 i za adsorbat 2. Ovaj omjer je konstantna vrijednost.
 - koeficijent afiniteta
- koeficijent afiniteta
Teorija kapilarne kondenzacije.
Tijek procesa adsorpcije uvelike ovisi o građi poroznog tijela.
|
mikroporozan | |
|
Prijelazna porozna | |
|
Makroporozan |
Kod mikroporoznih sorbenata polja adsorpcijskih sila se preklapaju. U slučaju makroporoznih sorbenata, pore djeluju kao transportni kanali. Procesi kondenzacije su najznačajniji u prijelazno poroznim tijelima. Kapilarna kondenzacija počinje kod određenih vrijednosti str I  , kada je dio površinske energije već nadoknađen. Neophodan uvjet je da površina mora biti samokvasna. Proces je opisan Thompson–Kelvinova jednadžba.
, kada je dio površinske energije već nadoknađen. Neophodan uvjet je da površina mora biti samokvasna. Proces je opisan Thompson–Kelvinova jednadžba.

 - za slučaj vlaženja centar zakrivljenosti je u plinovitoj fazi.
- za slučaj vlaženja centar zakrivljenosti je u plinovitoj fazi.
U slučaju kapilarne kondenzacije izoterma adsorpcije ima histerezni oblik. Donja grana odgovara procesu adsorpcije, a gornja grana odgovara procesu desorpcije.
Sve vrste pora mogu se svesti na tri vrste:
|
Stožast |
Cilindričan s jednim zatvorenim krajem |
Cilindričan s dva otvorena kraja |
|
Procesno punjenje se provodi s dna pore. Izoterma adsorpcije i izoterma desorpcije u ovom se slučaju podudaraju, budući da proces adsorpcije počinje od kuglice, a proces desorpcije također počinje nestankom nekih kuglica.
↓ |
Nema histereze. Hod naprijed i nazad opisuje se jednadžbom:
|
Nigdje nema dna, punjenje pora će ići uz stijenke cilindra.
cilindar: Izoterma će imati histerezičan izgled.
↓ |
U  U uvjetima vlaženja dolazi do kondenzacije pri nižim tlakovima, što je energetski povoljno. Iz grane desorpcije dobivaju se krivulje raspodjele veličine pora.
U uvjetima vlaženja dolazi do kondenzacije pri nižim tlakovima, što je energetski povoljno. Iz grane desorpcije dobivaju se krivulje raspodjele veličine pora.
Maksimum diferencijalne krivulje pomaknut je ulijevo u odnosu na točku infleksije integrala. Ukupni volumen malih pora je malen, ali ima velike površine. S povećanjem veličine pora, njihov volumen se povećava kao  , a područje je kao
, a područje je kao  , zbog toga se opaža pomak u maksimumu diferencijalne krivulje.
, zbog toga se opaža pomak u maksimumu diferencijalne krivulje.
Adsorpcija na granici čvrsto-tekuće.
U slučaju adsorpcije na granici čvrsto-plin, zanemarili smo jednu komponentu. U slučaju adsorpcije na granici čvrsto-tekuće, adsorbat istiskuje molekule otapala s površine adsorbensa.
 ,
,
Jednadžba je točna:

 ,
,
N 1, N 2 – molni udjeli otapala i komponente, N 1 + N 2 = 1, zatim
 ,
=>
,
=>
 , onda je adsorpcijska jednadžba za granicu čvrsto-tekuće.
, onda je adsorpcijska jednadžba za granicu čvrsto-tekuće.
Adsorpcija (G) > 0 at  <
0
<
0
Ako vrijednosti  jer su komponenta i otapalo vrlo različiti, u ovom slučaju ovisnost G iz N ima ekstrem na vrijednosti N
~ 0,5.
jer su komponenta i otapalo vrlo različiti, u ovom slučaju ovisnost G iz N ima ekstrem na vrijednosti N
~ 0,5.
E  ako
ako  imaju bliske vrijednosti, u tom se slučaju predznak adsorpcije može promijeniti. Ovisnost G iz N prelazi x-os
imaju bliske vrijednosti, u tom se slučaju predznak adsorpcije može promijeniti. Ovisnost G iz N prelazi x-os
Točka presjeka funkcija G(N) s x-osom se zove adsorpcijski azeotrop. To znači da se dvije komponente ne mogu razdvojiti na određenom adsorbensu.
Jednadžba izoterme adsorpcije s konstantom izmjene.
Tijekom adsorpcije na granici čvrsto-tekuće dolazi do stalne preraspodjele komponenata između površine adsorbensa i volumena otopine.
 - komponente (- - odnose se na površinu)
- komponente (- - odnose se na površinu)

 ,
,
 ,
, .
.
 ,
,


Adsorpcija na granici tekućina-plin
R  Razmotrimo promjenu profila koncentracije kako se prelazi sučelje tekućina-plin. Neka je komponenta 2 nepostojana.
Razmotrimo promjenu profila koncentracije kako se prelazi sučelje tekućina-plin. Neka je komponenta 2 nepostojana.
Cs – koncentracija u površinskom sloju.
Na temelju definicije ekscesne adsorpcije

Ako komponenta nije hlapljiva, tada će vrijednost adsorpcije biti zapisana na sljedeći način:
P  ri
ri 

U jednadžbi  priroda tvari opisuje se njezinim derivatom
priroda tvari opisuje se njezinim derivatom  .
.
Izoterma površinskog napona može biti oblika 1 ili 2:
1 – površinski aktivne tvari
2 – površinski aktivne tvari
Površinska aktivnost g je sposobnost tvari da smanje površinsku napetost u sustavu.

 - debljina površinskog sloja
- debljina površinskog sloja
C s– koncentracija komponente u površinskom sloju
S– volumna koncentracija
Za homologni niz postoji pravilo:
 - Traubo Duclosovo pravilo
- Traubo Duclosovo pravilo
Za homolognu seriju adsorpcijska izoterma izgleda ovako:
Umjesto A pišemo G, jer je adsorpcija prekomjerna u površinskom sloju.
Izoterma površinske napetosti:

 - površinska napetost čistog otapala.
- površinska napetost čistog otapala.
 - temeljna jednadžba adsorpcije;
- temeljna jednadžba adsorpcije;
 - Langmuirova jednadžba.
- Langmuirova jednadžba.
Riješimo ih zajedno:

- jednadžba Šiškovskog.
B– konstanta za homologni niz.
A- pri prelasku s jednog homologa na drugi povećava se 3-3,5 puta 
![]()
1 – područje niske koncentracije
![]()
2 – prosječna koncentracija
3 – monomolekularni sloj
Surfaktanti su difilne molekule, tj. uključuju polarnu skupinu i nepolarni ugljikovodični radikal.
o je polarni dio molekule.
| - nepolarni dio molekule.
U polarnom otapalu molekule surfaktanta su usmjerene na takav način da je polarni dio molekule okrenut prema otapalu, a nepolarni dio je potisnut u plinovitu fazu.
U jednadžbi Šiškovskog  , to je konstantno za homologni niz.
, to je konstantno za homologni niz.
Učinak surfaktanta počinje se pojavljivati s n>5. Pri koncentracijama većim od koncentracija monomolekulskog sloja dolazi do micelizacije u otopinama tenzida.
micela– naziva se skup amfifilnih molekula surfaktanta, čiji ugljikovodični radikali tvore jezgru, a polarne skupine su pretvorene u vodenu fazu.
Micelle mass – micelarna masa.
H  broj molekula – agregacijski broj.
broj molekula – agregacijski broj.
Kuglaste micele
U slučaju micelizacije uspostavlja se ravnoteža u otopini
CMC – kritična koncentracija stvaranja micela.
Budući da micelu smatramo zasebnom fazom:
Za homološki niz postoji empirijska jednadžba:
a– energija rastvaranja funkcionalne skupine.
b – prirast adsorpcijskog potencijala, adsorpcijski rad po metilenskoj jedinici.
– prirast adsorpcijskog potencijala, adsorpcijski rad po metilenskoj jedinici.
Prisutnost ugljikovodične jezgre u micelama stvara mogućnost da se spojevi koji su netopivi u vodi otope u vodenim otopinama površinski aktivnih tvari; taj se fenomen naziva solubilizacija (ono što se otapa je solubilizat, površinski aktivna tvar je solubilizator).
Isplaka može biti potpuno nepolarna, može sadržavati i polarne i nepolarne dijelove i bit će usmjerena poput molekule surfaktanta.
U svakom slučaju, tijekom solubilizacije dolazi do povećanja micelarne mase i agregacijskog broja ne samo zbog uključivanja solubilizata, već i zbog povećanja broja molekula surfaktanta potrebnih za održavanje ravnotežnog stanja.
Solubilizacija je učinkovitija što je niža molekularna težina solubilizata.

 ~ 72 mN\m.
~ 72 mN\m.
 ~ 33 mN\m.
~ 33 mN\m.
Učinkovitost surfaktanata ovisi o vrijednosti CMC.
2D tlak površinskog sloja

→ -sile površinske napetosti.
- dvodimenzionalni pritisak.
Površinski sloj je sila jednaka razlici površinske napetosti otopine surfaktanta i čistog otapala, usmjerena prema čistoj površini.
Između otopine i površinskog sloja uspostavlja se ravnoteža



Na  postoji područje gdje
postoji područje gdje  linearno ovisi o koncentraciji.
linearno ovisi o koncentraciji.
G [mol/m2].
 -površina koju zauzima jedan mol tvari
-površina koju zauzima jedan mol tvari
Tada će dvodimenzionalna izoterma tlaka imati oblik 
 - dvodimenzionalna izoterma tlaka.
- dvodimenzionalna izoterma tlaka.
Ovisnost  od SM:
od SM:

Na  - dvodimenzionalni tlak naglo raste. Na
- dvodimenzionalni tlak naglo raste. Na  dvodimenzionalni je deformiran, uzrokujući nagli rast
dvodimenzionalni je deformiran, uzrokujući nagli rast  .
.
Film koji je s obje strane omeđen identičnim fazama naziva se dvostranim. U takvim filmovima opaža se stalno kretanje matične tekućine.
Filmovi debljine manje od 5 nm nazivaju se crni filmovi.

Adsorpcijski slojevi moraju imati dvije karakteristike: viskoznost i laku pokretljivost, fluidnost i elastičnost.
Marangoni efekt je samoizlječiv.
Gibbsov trokut,  - nadpritisak.
- nadpritisak.
Film se rastegnuo i zbog činjenice da je dio tekućine otišao, površinski aktivne tvari žure u slobodni prostor. Gibbsov trokut.
Učinak adsorpcijske snage tijela.
Na površini filma uvijek postoji adsorpcijski sloj za koji tada
Langmuirova jednadžba:


 u dvodimenzionalni pritisak
u dvodimenzionalni pritisak
 - analog jednadžbe Šiškovskog
- analog jednadžbe Šiškovskog
Elektrokinetički fenomeni. Električni dvoslojni (EDL).
Gelemholtzov model. Gouy-Chapmanova teorija.
Let 1808

U – oblikovanu cijev, u nju uronite 2 elektrode. Narušava se zakon spojenih žila i dolazi do promjene razine tekućine u cijevi – elektrokinetičke pojave.
Kinetički fenomeni:
elektroforeza
Elektroosmoza
Potencijal protoka (protoka).
Potencijal sedimentacije
1 i 2 nastaju pri primjeni razlike potencijala; 3 i 4, probijanje i taloženje koloidnih čestica uzrokuje pojavu razlike potencijala.
Elektroosmoza je kretanje disperzijskog medija u odnosu na stacionarnu disperznu fazu pod utjecajem električne struje.
elektroforeza – to je kretanje čestica disperzne faze u odnosu na stacionarni disperzni medij pod utjecajem električne struje.
P  Razlog nastanka elektrokinetičkih pojava je prostorno razdvajanje naboja i pojava dvostrukog električnog sloja.
Razlog nastanka elektrokinetičkih pojava je prostorno razdvajanje naboja i pojava dvostrukog električnog sloja.
Dvostruki električni sloj je ravni kondenzator, jednu ploču čine ioni koji određuju potencijal, a drugu protuioni. Ioni su kontaminirani na isti način na koji se koioni koji određuju potencijal potiskuju u volumen otopine. Razmak između ploča  . Potencijal pada linearno, razlika potencijala
. Potencijal pada linearno, razlika potencijala  .
.
Vanjska razlika potencijala uzrokuje pojavu modula smicanja  je par sila po jedinici površine koji djeluju duž površine čvrstog tijela.
je par sila po jedinici površine koji djeluju duž površine čvrstog tijela.

U ravnoteži, modul smicanja jednak je modulu viskoznog trenja (  ).
).

U našim uvjetima  ,
,

 - Gelemholtz-Smalukowski jednadžba
- Gelemholtz-Smalukowski jednadžba
 - linearna brzina faznog pomaka.
- linearna brzina faznog pomaka.
E je jakost električnog polja.
 - razlika potencijala između ploča
- razlika potencijala između ploča
 - elektroforetska pokretljivost [m 2 /(V*s)].
- elektroforetska pokretljivost [m 2 /(V*s)].
Helemholtzov model ne uzima u obzir toplinsko gibanje molekula. U stvarnosti je raspodjela iona u dvostrukom sloju složenija.
Gui i Chapman identificirali su sljedeće uzroke DES-a:
Prijelaz iona iz jedne faze u drugu kada se uspostavi ravnoteža.
Ionizacija čvrste faze tvari.
Završetak površine ionima prisutnim u disperzijskom mediju.
Polarizacija iz vanjskog izvora struje.
Dvostruki električni sloj ima nejasnu ili difuznu strukturu. Ioni imaju tendenciju da budu ravnomjerno raspoređeni kroz difuzni sloj.
Difuzni sloj sastoji se od kontrainona, čija je duljina određena kinetičkom energijom. Na temperaturama koje se približavaju apsolutnoj nuli, protuioni su što je moguće bliži ionima koji određuju potencijal.
Danyina teorija temelji se na dvije jednadžbe:
Boltzmannova jednadžba

 - rad protiv sila elektrostatske interakcije.
- rad protiv sila elektrostatske interakcije.
 - volumetrijska gustoća naboja.
- volumetrijska gustoća naboja.

Poissonova jednadžba 
Budući da je debljina EDL puno manja od veličine čestice, a za ravan EDL derivacija u odnosu na koordinate  I
I  se ukida.
se ukida. 
Za e y u y<<1 функцию можно разложить в ряд Маклорена:

Ograničimo se na dva člana niza, dakle:


 - DEL debljina je udaljenost na kojoj se DEL potencijal smanjuje e jednom.
- DEL debljina je udaljenost na kojoj se DEL potencijal smanjuje e jednom.
Što je niža temperatura, to manje  . Na T→0 – ravni DEL. Što je veća koncentracija, što više ja, to manje
. Na T→0 – ravni DEL. Što je veća koncentracija, što više ja, to manje  .
.





 “–” znači da potencijal opada s udaljenošću. =>
“–” znači da potencijal opada s udaljenošću. =>
=>

 ,
,
 - potencijal se eksponencijalno smanjuje.
- potencijal se eksponencijalno smanjuje.
Potencijal za površinsku gustoću naboja: 
Površinski naboj je volumni naboj suprotnog predznaka, integriran po udaljenosti.




=>


Gdje se potencijal smanjuje za 2,7 puta - 
Kapacitet dvostrukog sloja 
Nedostatak teorije je što se ne uzima u obzir prisutnost Helemholtzovog sloja, tj. ne uzima u obzir  , dakle pogreške u određivanju glavnih parametara. Također ne objašnjava utjecaj iona različite prirode na debljinu dvostrukog električnog sloja.
, dakle pogreške u određivanju glavnih parametara. Također ne objašnjava utjecaj iona različite prirode na debljinu dvostrukog električnog sloja.
Sternova teorija. Struktura koloidne micele.
Dvostruki električni sloj sastoji se od dva dijela: gustog i difuznog. Gusti sloj nastaje kao rezultat interakcije iona koji stvaraju potencijal sa specifično adsorbiranim ionima. Ti su ioni u pravilu djelomično ili potpuno dehidrirani i mogu imati isti ili suprotan naboj od iona koji određuju potencijal. Ovisi o omjeru energije elektrostatskog međudjelovanja  i specifični adsorpcijski potencijal
i specifični adsorpcijski potencijal  . Ioni gustog sloja su fiksirani. Drugi dio iona nalazi se u difuznom sloju, ti ioni su slobodni i mogu se kretati dublje u otopinu, tj. iz područja veće koncentracije u područje manje koncentracije. Ukupna gustoća naboja sastoji se od dva dijela.
. Ioni gustog sloja su fiksirani. Drugi dio iona nalazi se u difuznom sloju, ti ioni su slobodni i mogu se kretati dublje u otopinu, tj. iz područja veće koncentracije u područje manje koncentracije. Ukupna gustoća naboja sastoji se od dva dijela.

 -naboj Helmholtzovog sloja
-naboj Helmholtzovog sloja
 -Naboj difuznog sloja
-Naboj difuznog sloja
Površina ima određeni broj adsorpcijskih centara od kojih svaki stupa u interakciju s jednim protuionom. Konstanta takve kvazikemijske reakcije jednaka je:

 , Gdje
, Gdje  - molni udio protuiona u otopini
- molni udio protuiona u otopini
Helmholtzova distribucija
Potencijal opada linearno
Gouyeva raspodjela potencijala. Nema gustog sloja, potencijal se eksponencijalno smanjuje od vrijednosti 
Krmena distribucija.
U početku je smanjenje potencijala linearno, a zatim eksponencijalno.
Kada se u slučaju elektroforeze primjenjuje električno polje, ne kreće se izravno čestica krute faze, već čestica krute faze sa slojem iona koji je okružuje. DES ponavlja oblik čestice disperzne faze. Kada se nanese potencijal, dio difuznog sloja se otkida. Crta prekida se zove klizna granica.
Potencijal koji nastaje na granici klizanja kao rezultat odvajanja dijela difuznog sloja naziva se elektrokinetički potencijal(Zeta potencijal  ).
).
Čestica disperzne faze s okolnim slojem protuiona i dvostrukim električnim slojem naziva se micela.
Pravila za pisanje koloidnih micela:


1-1 elektrolit za punjenje
T – čestica disperzne faze.
AA je granica između gustog i difuznog dijela.
BB – klizna granica.
Klizna granica se može ali ne mora podudarati s linijom AA.
pH vrijednost pri kojoj je zeta potencijal nula naziva se izoelektrična točka.
CaCl 2 + Na 2 SO 4 → CaSO 4 ↓ + 2NaCl
1. Višak CaCl 2
CaCl 2 ↔ Ca 2+ + 2Cl -
(CaSO 4 m∙nCa 2+ 2( n - x)Cl - ) 2 x + x Cl - - micelni zapis.
CaSO 4 m – agregat.
CaSO 4 m∙nCa 2+ – jezgra.
CaSO 4 m∙nCa 2+ 2( n - x)Cl - - čestica.
2. Višak Na 2 SO 4
Na 2 SO 4 ↔2Na + + SO 4 2-
(CaSO 4 m∙nSO 4 2- 2(n-x)Na + ) 2x- 2xNa + - micel
CaSO 4 m – agregat.
CaSO 4 m∙nSO 4 2 + – jezgra.
CaSO 4 m∙nSO 4 2- 2(n-x)Na + - čestica
Gelemholtz-Smoluchowski jednadžba

 - linearna brzina pomicanja granica (u elektroosmozi).
- linearna brzina pomicanja granica (u elektroosmozi).
 - razlika potencijala na pločama kondenzatora (kod elektroosmoze).
- razlika potencijala na pločama kondenzatora (kod elektroosmoze).


 - volumetrijska brzina protoka otopine, S- kvadrat poprečni presjek Stanice.
- volumetrijska brzina protoka otopine, S- kvadrat poprečni presjek Stanice.

E je jakost električnog polja.


 (za elektroosmozu).
(za elektroosmozu).
Za potencijal protoka:

 - potencijal
- potencijal
 - pritisak na membranu
- pritisak na membranu
U pravilu su vrijednosti elektroforetske pokretljivosti i elektroosmotske pokretljivosti manje od izračunatih. To je zbog:
Učinak relaksacije (kada se čestica disperzne faze kreće, narušava se simetrija ionske atmosfere).
Elektroforetska inhibicija (pojava dodatnog trenja kao rezultat kretanja protuiona).
Izobličenje strujnica kod elektrovodljivih čestica.
Odnos površinske napetosti i potencijala. Lippmannova jednadžba.
Stvaranje EDL-a događa se spontano zbog želje sustava da smanji svoju površinsku energiju. U uvjetima konstantnog T I str generalizirana jednadžba prvog i drugog zakona termodinamike izgleda ovako:
 (2)
(2)
(3), (1)=(3) =>
=>

 - 1. Lippmannova jednadžba.
- 1. Lippmannova jednadžba.
 je površinska gustoća naboja.
je površinska gustoća naboja.
 - diferencijalni kapacitet.
- diferencijalni kapacitet.
 - 2. Lippmannova jednadžba.
- 2. Lippmannova jednadžba.
S– kapacitet.
Rješavamo 1. Lippmannovu jednadžbu i temeljnu adsorpcijsku jednadžbu:
 ,
,


 , Zatim
, Zatim
 - Nernstova jednadžba
- Nernstova jednadžba
 ,
,
 ,
,




 - jednadžba elektrokapilarne krivulje (ECC).
- jednadžba elektrokapilarne krivulje (ECC).
U  :
: , Ali
, Ali 
Kationski surfaktanti (CSAS) smanjuju katodnu granu ECC-a.
Anionski tenzidi (ASS) smanjuju anodnu granu ECC-a.
Neionski surfaktanti (NSA) smanjuju srednji dio ECC-a.
Stabilnost disperznih sustava. Pritisak klina.
Disperzni sustavi se mogu podijeliti na:
Sustavi koji su termodinamički nestabilni mogu biti kinetički stabilni zbog prijelaza u metastabilno stanje.
Postoje dvije vrste stabilnosti:
Stabilnost sedimentacije (u odnosu na gravitaciju).
Agregativna stabilnost. (u odnosu na lijepljenje)
Zgrušavanje je proces adhezije čestica, što dovodi do gubitka stabilnosti agregacije. Koagulaciju mogu uzrokovati promjene temperature, pH, miješanje i ultrazvuk.
Razlikovati koagulaciju:
Reverzibilan.
Nepovratno.
Uvođenjem elektrolita dolazi do koagulacije.
Pravila koagulacije:

Film- ovo je dio sustava koji se nalazi između dvije međufazne površine.
rastavljajući pritisak nastaje kada se debljina filma naglo smanji kao rezultat interakcije približavanja površinskih slojeva.

“-” - kako se debljina filma smanjuje, tlak razdvajanja raste.
P 0 je tlak u masivnoj fazi, koja je nastavak međusloja.
P 1 je tlak u filmu.
Teorija stabilnosti. DLFO (Derjagin, Landau, Fairway, Overbeck).
Prema teoriji DLFO, rastavljajući pritisak ima dvije komponente:
elektrostatski P E (pozitivan, nastaje zbog sila elektrostatskog odbijanja). Odgovara smanjenju Gibbsove energije s povećanjem debljine filma.
Molekularni P M (negativno, zbog djelovanja privlačnih sila). Uzrokovana je kompresijom filma uslijed kemijskih površinskih sila, radijus djelovanja sila je desetinke nm uz energiju od oko 400 kJ/mol.
Ukupna energija interakcije:

 - sustav je agregatno stabilan
- sustav je agregatno stabilan
 - nestabilan sustav
- nestabilan sustav
P  pozitivna komponenta.
pozitivna komponenta.
Povećanje je posljedica povećanja potencijalne energije kada se tanki filmovi komprimiraju. Za filmove velike debljine, višak energije iona je kompenziran i jednak je energetskoj interakciji u volumenu disperzijskog medija.
Ako  (
( - debljina filma,
- debljina filma,  - ion radius) stanjivanje filma dovodi do nestanka i redukcije molekula i iona s minimalnom površinskom energijom u njemu. Broj susjednih čestica se smanjuje, zbog čega se povećava potencijalna energija čestica koje ostaju u filmu.
- ion radius) stanjivanje filma dovodi do nestanka i redukcije molekula i iona s minimalnom površinskom energijom u njemu. Broj susjednih čestica se smanjuje, zbog čega se povećava potencijalna energija čestica koje ostaju u filmu.


Teorija DLVO smatra međudjelovanje čestica kao međudjelovanje ploča.

Čestice ne međusobno djeluju



 - Laplaceova jednadžba,
- Laplaceova jednadžba,  ,
,


Za slabo nabijene površine
Za visoko naelektrisane površine:

Molekularna komponenta je interakcija dvaju atoma:
 ~
~
Međudjelovanje atoma s površinom:

Uzmimo dva zapisa:
D  Da bi se dobila molekularna komponenta, potrebno je zbrojiti sve energije međudjelovanja atoma desne i lijeve ploče.
Da bi se dobila molekularna komponenta, potrebno je zbrojiti sve energije međudjelovanja atoma desne i lijeve ploče.
Gdje  - Hamakerova konstanta (uzima u obzir prirodu tijela koja međusobno djeluju).
- Hamakerova konstanta (uzima u obzir prirodu tijela koja međusobno djeluju).
Da. energija interakcije čestica u sustavu može se izraziti pomoću potencijalnih krivulja.
I – primarni potencijalni minimum. Ovo je zona nepovratne koagulacije, prevladavaju sile privlačenja.
II – zona agregativne stabilnosti, prevladavaju odbojne sile.
III – minimum sekundarnog potencijala (ili zona flokulacije). Između čestica disperzne faze nalazi se sloj elektrolita, te se čestice mogu odvojiti i prenijeti u zonu agregacijske stabilnosti.

Krivulja 1 – sustav je agregatno stabilan.
Krivulja 2 – stabilna u zoni I, nestabilna u zoni II.
Krivulja 3 – došlo je do koagulacije u sustavu.
Krivulja 4 – u točki 4 ukupna energija interakcije U=0,  , ova ekstremna točka odgovara početku brze koagulacije.
, ova ekstremna točka odgovara početku brze koagulacije.
Postoje dva slučaja:
1. Slabo naelektrizirane površine:
U = U E + U M = 0
 (1)
(1)
2)

 (2)
(2)



 - ovo je debljina sloja koja odgovara početku procesa koagulacije.
- ovo je debljina sloja koja odgovara početku procesa koagulacije.






 - za slabo nabijene površine
- za slabo nabijene površine
 Zatim
Zatim 
2. Za jako nabijene površine:
 (1)
(1)
2)

 (2)
(2)


 (3)
(3)
 ,
,
Idemo na kvadrat (3)

Zgrušavanje:
U specifičnoj adsorpciji, ioni se mogu adsorbirati u super-ekvivalentnim količinama tako da površina može promijeniti svoj naboj. Površina se ponovno puni.
U slučaju specifične adsorpcije mogu se adsorbirati ioni ne samo suprotnog predznaka, već i istog predznaka.
Ako se adsorbiraju ioni istog predznaka kao i površina, tada u površinskom sloju neće doći do pada potencijala, već do povećanja.

Neutralizacijska koagulacija (javlja se uz sudjelovanje slabo nabijenih čestica i ne ovisi samo o naboju koagulatora elektrolita, već io potencijalu na granici gustih i difuznih slojeva).
Smoluchowskijeva teorija brze koagulacije.

Ovisnost brzine koagulacije o koncentraciji elektrolita.
I – koagulacija je niska,
II – brzina koagulacije je gotovo proporcionalna koncentraciji elektrolita.
III – područje brze koagulacije, brzina praktički ne ovisi o koncentraciji.
Osnovne odredbe:
Početni sol je monodisperzan, slične čestice imaju sferni oblik.
Svi sudari čestica su učinkoviti.
Kada se dvije primarne čestice sudare, nastaje sekundarna čestica. Sekundarni + primarni = tercijarni. Primarni, sekundarni, tercijarni - višestrukost.
U smislu kemijske kinetike, proces koagulacije može se opisati jednadžbom:
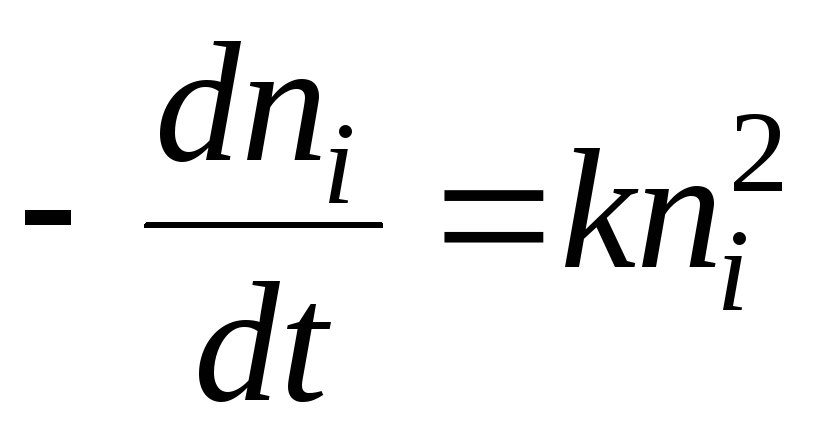
Rješenje će biti jednadžba: 
 - vrijeme polukoagulacije. To je vrijeme tijekom kojeg se broj čestica sola smanji 2 puta.
- vrijeme polukoagulacije. To je vrijeme tijekom kojeg se broj čestica sola smanji 2 puta.

 ,
,
 ,
,
 ,
,


Kako se množina povećava, maksimum koagulacijskih krivulja se pomiče prema većim vrijednostima  .
.
Mane:
Pretpostavka monodisperznosti.
Pretpostavka o učinkovitosti svih sudara.




 - sfera,
- sfera, ,
,





