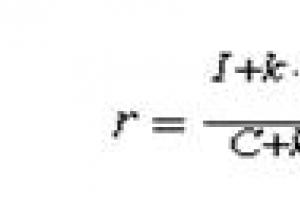Me çfarë ndërveprojnë aldehidet? Aldehidet dhe ketonet. Përfaqësuesit individualë të aldehideve dhe kuptimi i tyre
Fjala aldehid u krijua si një shkurtim i latinishtes alkool dehydrogenatus - alkool i dehidrogjenizuar, aldehidi më i njohur është formaldehidi, prej tij bëhen rrëshira, sintetizohen ilaçet dhe si ruajtës. Formula e një aldehidi është R-CHO, një përbërje në të cilën grupi karbonil është i lidhur me një hidrogjen dhe një radikal.
Fjala keton vjen nga fjala aceton, përbërja më e vogël në familjen e ketoneve. Ketonet përdoren si tretës, ilaçe dhe për sintezën e polimereve. Formula e një ketoni është R-C(O)-R, një përbërje në të cilën grupi karbonil është i lidhur me dy radikale.
Struktura dhe vetitë e grupit karbonil
Grupi karbonil bazohet në lidhjen e një atomi karboni dhe një atomi oksigjeni përmes lidhjeve α- dhe π. Struktura e rezonancës së grupit përcakton polaritetin e lartë të përbërjes dhe reja e elektroneve zhvendoset drejt oksigjenit: C δ+ =O δ- . Futja e elementeve elektronegative në lidhje zvogëlon polaritetin e lidhjes, duke rritur ngarkesën pozitive të molekulës. Zëvendësuesit nukleofilë rrisin ngarkesën negative të oksigjenit.
Atomi i karbonit në grupin karbonil është një elektrofil i fortë (bashkon elektronet), kështu që shumica e reaksioneve të aldehideve dhe ketoneve kryhen nga reagentë nukleofilik (bazat Lewis). Logjikisht, atomi i oksigjenit është një nukleofil i fortë, dhe reagimet me atomin e oksigjenit janë të mundshme duke përdorur elektrofile (acidet Lewis).
Reagimi i një grupi karbonil me një bazë Lewis
(R)(R)C δ+ =O δ- + B: → (R)(R)C(B)-O
Reagimi i një grupi karbonil me një acid Lewis
(R)(R)C δ+ =O δ- + Y: → (R)(R)C-O-Y
Përveç kësaj, elektronet e pandara të oksigjenit i japin atij veti të dobëta bazë, kështu që ato aldehide dhe cetone që janë të patretshme në ujë do të treten në acidin sulfurik të përqendruar.
Vetitë fizike të grupit karbonil
Polariteti i lartë i lidhjes C=O formon një moment të lartë dipoli, prandaj bartësit e grupit karboksil kanë një pikë vlimi më të lartë se hidrokarburet.
Elektronet e pandara në atomin e oksigjenit formojnë një lidhje hidrogjeni me molekulat e ujit, prandaj, duke filluar nga pesë atome karboni në radikale, aldehidet dhe ketonet janë pak të tretshëm në ujë ose nuk treten fare.
Aldehidet dhe ketonet me deri në 12 atome karboni janë lëngje. Komponimet alifatike me një grup karbonil kanë një densitet prej rreth 0.8, prandaj ato notojnë në sipërfaqen e ujit, cikloheksanoni ka një dendësi rreth unitetit, aldehidet aromatike dhe ketonet kanë një densitet pak më të lartë se dendësia e ujit.
Reaksionet e aldehideve dhe ketoneve
Lidhja e ujit
Në procesin e reaksionit të ujit me aldehidet dhe ketonet, formohen diolet (glikolet, alkoolet dihidrike). Reagimi vazhdon duke përdorur një katalizator - një acid ose një bazë dhe është i dyanshëm:
RR-CO + H-OH ↔ R R\ C /OH-OH
Shtimi i karboneve nukleofile
Komponimet e rëndësishme nukleofile që reagojnë me aldehidet dhe ketonet janë përbërje organometalike (përbërje organike në të cilat ekziston një lidhje midis një atomi metali dhe një atomi/atomesh karboni). Një nga përfaqësuesit e përbërjeve organometalike - reagentët Grignard (formula e përgjithshme - R-Mg-X), në reaksionet me aldehidet dhe ketonet formojnë alkoole:
RH-C \u003d O + R-C - H 2 -Mg + -Cl - → RH-C- (O-MgCl) (CH 2 -R)
RH-C-(O-MgCl)(CH 2 -R) + H-OH → RH-C-CH 2 R + OH-Mg-Cl
Oksidimi i aldehideve dhe ketoneve
Kur oksidohen, aldehidet janë ndërmjetës midis alkooleve dhe acideve karboksilike:
Në prani të hidrogjenit dhe oksigjenit:
R-CH 2 -OH ↔ R-C(=O)-H ↔ R-COOH
Aldehidet oksidohen lehtësisht, duke lejuar përdorimin e oksidantëve më të butë se sa oksigjeni i thjeshtë. Aldehidet aromatike oksidohen më lehtë se ato alifatike. Problemi me oksidimin e aldehideve është formimi i nënprodukteve.
Ketonet janë të vështira për t'u oksiduar; për oksidimin e ketoneve nevojiten agjentë të fortë oksidues dhe sasi të mëdha nxehtësie. Pritet si rezultat i oksidimit Lidhja C-C dhe formohet një acid (ka një përjashtim):
Në prani të KMnO 4 , H dhe një sasie të madhe nxehtësie :
CH 3 -C (= O) -CH 2 CH 3 → CH 3 -C (= O) -OH + CH 3 CH 2 -C (= O) -OH
Përjashtim bën oksidimi me dioksid seleniumi, SeO 2, grupi metil pas grupit karbonil oksidohet, duke u shndërruar në një grup tjetër karbonil. Për shembull, metil etil ketoni oksidohet në diacetil:
Oksidimi i metil etil ketonit në diacetil:
CH 3 CH 2 -C (= O) -CH 3 + SeO 2 → CH 3 -C (= O) -C (= O) -CH 3 + H 2 O + Se
Lehtësia me të cilën oksidohen aldehidet e bën të lehtë dallimin e tyre nga ketonet; për këtë përdoren agjentë oksidues të butë, si: reagjenti i Tollens (hidroksidi i argjendit diaminë, Ag (NH 3) 2 OH), reagjenti i Fehling (një tretësirë alkaline). të joneve të bakrit Cu në kripën Rochelle KNaC 4 H 6 O 6 4H 2 O) dhe tretësirën e Benediktit (jonet e bakrit me citrate dhe karbonat natriumi). Aldehidet aromatike reagojnë me reagentin e Tollens, por nuk reagojnë me reagentët e Benediktit dhe Fehling, i cili përdoret për të përcaktuar sasinë e aldehideve alifatike dhe aromatike.
Polimerizimi i aldehideve
Paraldehidi
Acetaldehidi ka një pikë vlimi prej 20°C, duke e bërë të vështirë ruajtjen dhe përdorimin. Kur acetaldehidi trajtohet me acid në temperaturë të ulët, acetaldehidi kombinohet në një molekulë të trefishtë ciklike - paraldehid, me një pikë vlimi prej 120°C. Paraldehidi depolimerizohet me ngrohje të lehtë, duke lëshuar tre molekula acetaldehidi.
Formaldehidi
Për lehtësinë e transportit dhe ruajtjes, formaldehidi shitet jo në formën e gazit, por në formën e formalinës - një zgjidhje ujore që përmban 37-40% paraformaldehid, OH (CH 2 O) n H, me një vlerë mesatare prej n = 30. Paraformaldehidi është një lëndë e ngurtë amorfe e bardhë e marrë nga avullimi i ngadaltë i formalinës në presion të ulët. Polimerizimi ndodh për shkak të shtimit të molekulave të formaldehidit me njëra-tjetrën:
CH 2 \u003d O + H 2 O ↔
+ n→ HO-(CH 2 O) n + 1 -H
Polimeri Derlin (polioksimetileni) është një plastikë e mirë lineare me peshë të lartë molekulare, Derlin ka karakteristika të shkëlqyera të forcës dhe elasticitetit.
(për aldehidin më të thjeshtë R=H)
Klasifikimi i aldehideve
Sipas strukturës së radikalit hidrokarbur:
Limit; Për shembull:

e pakufizuar; Për shembull:

Aromatike; Për shembull:

Aliciklik; Për shembull:

Formula e përgjithshme e aldehideve kufitare

Seritë homologe, izomeria, nomenklatura

Aldehidet janë izomere ndaj një klase tjetër përbërjesh - ketoneve

Për shembull:

Aldehidet dhe ketonet përmbajnë një grup karbonil ˃C=O, prandaj quhen komponime karbonil.
Struktura elektronike e molekulave të aldehidit
Atomi i karbonit i grupit aldehid është në gjendje të hibridizimit sp 2, kështu që të gjitha lidhjet σ në këtë grup ndodhen në të njëjtin rrafsh. Retë e elektroneve p që formojnë një lidhje π janë pingul me këtë plan dhe zhvendosen lehtësisht në atomin më elektronegativ të oksigjenit. Prandaj, lidhja e dyfishtë C=O (ndryshe nga lidhja e dyfishtë C=C në alkenet) është shumë e polarizuar.
Vetitë fizike

Vetitë kimike
Aldehidet janë komponime reaktive që hyjnë në reaksione të shumta. Më karakteristikë e aldehideve:
a) reaksionet e shtimit në grupin karbonil; Reagentët e tipit HX shtohen si më poshtë:

b) reaksionet e oksidimit lidhjet C-H grupi aldehid, si rezultat i të cilit formohen acidet karboksilike:
I. Reaksionet e shtimit
1. Hidrogjenizimi (formohen alkoolet primare

2. Shtimi i alkooleve (formohen hemiacetalet dhe acetalet)

Në një tepricë të alkoolit në prani të HCl, hemiacetalet shndërrohen në acetal:

II. Reaksionet e oksidimit
1. Reagimi i pasqyrës së argjendit

E thjeshtuar:

Ky reagim është një reagim cilësor ndaj grupit aldehid (në muret e enës së reagimit formohet një shtresë pasqyre e argjendit metalik).
2. Reaksioni me hidroksid bakri (II).

Ky reaksion është gjithashtu një reaksion cilësor ndaj grupit aldehid y (precipiton një precipitat i kuq i Cu 2 O).
Formaldehidi oksidohet nga agjentë të ndryshëm oksidues që përmbajnë O, fillimisht në acid formik dhe më pas në H 2 CO 3 (CO 2 + H 2 O ):

III. Reaksionet di-, tri- dhe polimerizimi
1. Kondensimi i aldolit

2. Trimerizimi i acetaldehidit

3. Polimerizimi me formaldehid
Gjatë ruajtjes afatgjatë të formalinës (solucion ujor 40% formaldehid), polimerizimi ndodh në të me formimin e një paraforme të precipitatit të bardhë:

IV. Reaksioni i polikondensimit të formaldehidit me fenol

PËRKUFIZIM
Aldehidet- substanca organike që i përkasin klasës së përbërjeve karbonil që përmbajnë në përbërjen e tyre grupin funksional -CH \u003d O, i cili quhet karbonil.
Formula e përgjithshme për kufizimin e aldehideve dhe ketoneve është C n H 2 n O. Prapashtesa –al është e pranishme në emrin e aldehideve.
Përfaqësuesit më të thjeshtë të aldehideve janë formaldehidi (formaldehidi) -CH 2 \u003d O, acetaldehidi (aldehidi acetik) - CH 3 -CH \u003d O. Ka aldehide ciklike, për shembull, cikloheksan-karbaldehid; aldehidet aromatike kanë emra të parëndësishëm - benzaldehid, vanilinë.
Atomi i karbonit në grupin karbonil është në gjendje hibridizimi sp 2 dhe formon lidhje 3σ (dy lidhje C-H dhe një lidhje C-O). Lidhja π formohet nga p-elektrone të atomeve të karbonit dhe oksigjenit. Lidhja e dyfishtë C = O është një kombinim i lidhjeve σ- dhe π. Dendësia e elektroneve zhvendoset drejt atomit të oksigjenit.
Aldehidet karakterizohen nga izomeria e skeletit të karbonit, si dhe izomeria ndërklasore me ketonet:
CH3-CH2-CH2-CH \u003d O (butanal);
CH3-CH (CH3) -CH \u003d O (2-metilpentanal);
CH3-C (CH2-CH3) \u003d O (metiletil keton).
Vetitë kimike të aldehideve
Ekzistojnë disa qendra reagimi në molekulat e aldehidit: një qendër elektrofile (atom karboni karbonil) i përfshirë në reaksionet e shtimit nukleofilik; qendra kryesore është një atom oksigjeni me çifte elektronesh të pandarë; qendra e acidit α-CH përgjegjëse për reaksionet e kondensimit; Lidhja S-N të grisura në reaksionet e oksidimit.
1. Reaksionet e shtimit:
- ujë me formimin e gem-diols
R-CH \u003d O + H 2 O ↔ R-CH (OH) -OH;
- alkoolet me formimin e hemiacetaleve
CH3 -CH \u003d O + C 2 H 5 OH ↔CH 3 -CH (OH) -O-C 2 H 5;
- tiolet me formimin e ditioacetaleve (në një mjedis acid)
CH 3 -CH \u003d O + C 2 H 5 SH ↔ CH 3 -CH (SC 2 H 5) - SC 2 H 5 + H 2 O;
- hidrosulfit natriumi me formimin e α-hidroksisulfonateve të natriumit
C 2 H 5 -CH \u003d O + NaHSO 3 ↔ C 2 H 5 -CH (OH) -SO 3 Na;
- aminet për të formuar imine të zëvendësuara me N (bazat Schiff)
C 6 H 5 CH \u003d O + H 2 NC 6 H 5 ↔ C 6 H 5 CH \u003d NC 6 H 5 + H 2 O;
- hidrazinat me formimin e hidrazoneve
CH 3 -CH \u003d O + 2 HN-NH 2 ↔ CH 3 -CH \u003d N-NH 2 + H 2 O;
- acidi hidrocianik me formimin e nitrileve
CH3 -CH \u003d O + HCN ↔ CH3 -CH (N) -OH;
- shërim. Kur aldehidet reagojnë me hidrogjenin, fitohen alkoolet primare:
R-CH \u003d O + H2 → R-CH2-OH;
2. Oksidimi
- reagimi i "pasqyrës së argjendit" - oksidimi i aldehideve me një zgjidhje amoniaku të oksidit të argjendit
R-CH \u003d O + Ag 2 O → R-CO-OH + 2Ag ↓;
- oksidimi i aldehideve me hidroksid bakri (II), si rezultat i të cilit precipitohet një precipitat i oksidit të bakrit të kuq (I)
CH 3 -CH \u003d O + 2Cu (OH) 2 → CH 3 -COOH + Cu 2 O ↓ + 2H 2 O;
Këto reaksione janë reaksione cilësore për aldehidet.
Vetitë fizike të aldehideve
Përfaqësuesi i parë i serisë homologe të aldehideve - formaldehid (formaldehid) - një substancë e gaztë (n.o.), aldehide të një strukture dhe përbërjeje të padegëzuar C 2 -C 12 - lëngje, C 13 dhe më të gjata - lëndë të ngurta. Sa më shumë atome karboni të përmbajë një aldehid me zinxhir të drejtë, aq më e lartë është pika e tij e vlimit. Me një rritje të peshës molekulare të aldehideve, vlerat e viskozitetit, densitetit dhe indeksit të thyerjes rriten. Formaldehidi dhe acetaldehidi janë në gjendje të përzihen me ujë në sasi të pakufizuar, megjithatë, me rritjen e zinxhirit hidrokarbur, kjo aftësi e aldehideve zvogëlohet. Aldehidet e poshtme kanë një erë të fortë.
Marrja e aldehideve
Metodat kryesore për marrjen e aldehideve:
- hidroformilimi i alkeneve. Ky reaksion konsiston në shtimin e CO dhe hidrogjenit në një alken në prani të karbonileve të disa metaleve të Grupit VIII, për shembull, oktakarbonil dikobalt (Co 2 (CO) 8) Reaksioni kryhet duke ngrohur në 130C dhe një presion prej 300 atm
CH 3 -CH \u003d CH 2 + CO + H 2 → CH 3 -CH 2 -CH 2 -CH \u003d O + (CH 3) 2 CHCH \u003d O;
- hidratimi i alkineve. Ndërveprimi i alkineve me ujin ndodh në prani të kripërave të merkurit (II) dhe në një mjedis acid:
HC≡CH + H 2 O → CH 3 -CH \u003d O;
- oksidimi i alkooleve primare (reaksioni vazhdon kur nxehet)
CH 3 -CH 2 -OH + CuO → CH 3 -CH \u003d O + Cu + H 2 O.
Aplikimi i aldehideve
Aldehidet kanë gjetur aplikim të gjerë si lëndë e parë për sintezën e produkteve të ndryshme. Pra, formaldehidi (prodhimi në shkallë të gjerë) prodhon rrëshira të ndryshme (fenol-formaldehid, etj.), medikamente(urotropinë); acetaldehidi është lëndë e parë për sintezën e acidit acetik, etanolit, derivateve të ndryshme të piridinës etj. Shumë aldehide (butirik, kanellë, etj.) përdoren si përbërës në parfumeri.
Shembuj të zgjidhjes së problemeve
SHEMBULL 1
| Ushtrimi | Brominimi Me n H 2 n +2 dha 9,5 g monobromid, i cili, kur trajtohej me një tretësirë të holluar të NaOH, u kthye në një përbërje që përmban oksigjen. Avujt e tij me ajrin kalohen mbi një rrjet bakri të nxehtë. Kur substanca e re e gaztë që rezulton u trajtua me një tepricë të një solucioni amoniaku të Ag 2 O, u lëshuan 43.2 g të një precipitati. Çfarë hidrokarbure është marrë dhe në çfarë sasie, nëse rendimenti në fazën e brominimit është 50%, reaksionet e mbetura vazhdojnë në mënyrë sasiore. |
| Zgjidhje | Ne shkruajmë ekuacionet e të gjitha reaksioneve që ndodhin: C n H 2n+2 + Br 2 = C n H 2n+1 Br + HBr; C n H 2n+1 Br + NaOH = C n H 2n+1 OH + NaBr; C n H 2n+1 OH → R-CH \u003d O; R-CH \u003d O + Ag 2 O → R-CO-OH + 2Ag ↓. Precipitati i lëshuar në reaksionin e fundit është argjendi, prandaj mund të gjeni sasinë e substancës së çliruar nga argjendi: M(Ag) = 108 g/mol; v(Ag) \u003d m / M \u003d 43,2 / 108 \u003d 0,4 mol. Sipas gjendjes së problemit, pas kalimit të substancës së përftuar në reaksionin 2 mbi një rrjetë metalike të nxehtë, u formua një gaz dhe i vetmi gaz, aldehidi, është metanali, prandaj, substanca fillestare është metani. CH 4 + Br 2 \u003d CH 3 Br + HBr. Sasia e substancës së bromometanit: v (CH 3 Br) \u003d m / M \u003d 9,5/95 \u003d 0,1 mol. Pastaj, sasia e substancës së metanit që kërkohet për një rendiment 50% të bromometanit është 0.2 mol. M (CH 4) \u003d 16 g / mol. Prandaj masa dhe vëllimi i metanit: m(CH 4) = 0,2×16 = 3,2 g; V (CH 4) \u003d 0,2 × 22,4 \u003d 4,48 l. |
| Përgjigju | Masa e metanit - masa 3,2 g, vëllimi i metanit-4,48 l |
SHEMBULL 2
| Ushtrimi | Shkruani ekuacionet e reaksionit që mund të përdoren për të kryer shndërrimet e mëposhtme: buten-1 → 1-bromobutan + NaOH → A - H 2 → B + OH → C + HCl → D. |
| Zgjidhje | Për të marrë 1-bromobutan nga buteni-1, është e nevojshme të kryhet reaksioni i hidrobrominimit në prani të komponimeve të peroksidit R 2 O 2 (reaksioni vazhdon kundër rregullit Markovnikov): CH 3 -CH 2 -CH \u003d CH 2 + HBr → CH 3 -CH 2 -CH 2 -CH 2 Br. Kur ndërvepron me një zgjidhje ujore të alkalit, 1-bromobutani i nënshtrohet hidrolizës me formimin e butanol-1 (A): CH 3 -CH 2 -CH 2 -CH 2 Br + NaOH → CH 3 -CH 2 -CH 2 -CH 2 OH + NaBr. Butanol-1 gjatë dehidrogjenizimit formon aldehid-butanal (B): CH 3 -CH 2 -CH 2 -CH 2 OH → CH 3 -CH 2 -CH 2 -CH \u003d O. Një tretësirë e amoniakut e oksidit të argjendit oksidon butanalin në një kripë amoniumi - butirati i amonit (C): CH 3 -CH 2 -CH 2 -CH \u003d O + OH →CH 3 -CH 2 -CH 2 -COONH 4 + 3NH 3 + 2Ag ↓ + H 2 O. Butirati i amonit, kur ndërvepron me acidin klorhidrik, formon acid butirik (butanoik) (D): CH 3 -CH 2 -CH 2 -COONH 4 + HCl → CH 3 -CH 2 -CH 2 -COOH + NH 4 Cl. |
Grupi i parë i vetive janë reaksionet e shtimit. Në grupin karbonil, midis karbonit dhe oksigjenit, ekziston një lidhje e dyfishtë, e cila, siç e mbani mend, përbëhet nga një lidhje sigma dhe një lidhje pi. Përveç reaksioneve, lidhja pi prishet dhe krijohen dy lidhje sigma, njëra me karbon, tjetra me oksigjen. Karboni ka një ngarkesë të pjesshme pozitive, dhe oksigjeni ka një ngarkesë të pjesshme negative. Prandaj, një grimcë e ngarkuar negativisht e reagentit, një anion, është ngjitur me karbonin, dhe një pjesë e ngarkuar pozitivisht e molekulës është e lidhur me oksigjenin.
Së pari hidrogjenizimi i vetive, shtimi i hidrogjenit.
Reagimi ndodh kur nxehet. Përdoret katalizatori i hidrogjenizimit i njohur tashmë për ju, nikeli. Alkoolet primare fitohen nga aldehidet, alkoolet sekondare nga ketonet.

Në alkoolet dytësore, grupi hidrokso është i lidhur me një atom karboni sekondar.
Së dyti hidratimi i pronës, shtimi i ujit. Ky reagim është i mundur vetëm për formaldehidin dhe acetaldehidin. Ketonet nuk reagojnë fare me ujin.

Të gjitha reagimet e shtimit zhvillohen në atë mënyrë që plusi shkon në minus dhe minusi në plus.
Siç e mbani mend nga videoja për alkoolet, prania e dy grupeve hidrokso në një atom është një situatë pothuajse e pamundur, substanca të tilla janë jashtëzakonisht të paqëndrueshme. Pra, konkretisht, këto dy raste hidrat formaldehid dhe acetaldehid janë të mundshme, megjithëse ato ekzistojnë vetëm në tretësirë.
Nuk është e nevojshme të njihen vetë reagimet. Me shumë mundësi, pyetja në provim mund të tingëllojë si një deklaratë fakti, për shembull, ata reagojnë me ujë dhe substancat janë të listuara. Në listën e tyre mund të jetë metanali ose etanali.
Së treti shtimi i vetive të acidit hidrocianik.

Përsëri, plus shkon në minus, dhe minus në plus. Përftohen substanca të quajtura hidroksinitrile. Përsëri, vetë reagimi nuk është i zakonshëm, por ju duhet të dini për këtë pronë.
Së katërti shtimi pronësor i alkooleve.
Këtu përsëri, nuk keni nevojë të dini përmendësh ekuacionin e reagimit, thjesht duhet të kuptoni se një ndërveprim i tillë është i mundur.

Si zakonisht në reaksionet e shtimit në një grup karbonil, plus në minus dhe minus në plus.
E pesta reaksioni i vetive me hidrosulfit natriumi.

Dhe përsëri, reagimi është mjaft i ndërlikuar, nuk ka gjasa të mësohet, por ky është një nga reagimet cilësore për aldehidet, sepse kripa e natriumit që rezulton precipiton. Kjo është, në fakt, duhet të dini se aldehidet reagojnë me hidrosulfit natriumi, kjo do të jetë e mjaftueshme.
Kjo përfundon grupin e parë të reagimeve. Grupi i dytë janë reaksionet e polimerizimit dhe polikondensimit.
2. Polimerizimi dhe polikondensimi i aldehideve
Jeni të njohur me polimerizimin: gomat polietileni, butadieni dhe izopreni, polivinilkloruri janë produktet e kombinimit të shumë molekulave (monomere) në një të madh, në një zinxhir të vetëm polimer. Kjo do të thotë, merret një produkt. Gjatë polikondensimit ndodh e njëjta gjë, por përveç polimerit fitohen edhe produkte me peshë të vogël molekulare si uji. Kjo do të thotë, ka dy produkte.
Kështu që, i gjashti polimerizimi i vetive. Ketonet nuk hyjnë në këto reaksione; vetëm polimerizimi i formaldehidit është me rëndësi industriale.
Lidhja pi prishet dhe dy lidhje sigma formohen me monomere fqinje. Rezulton poliformaldehid, i quajtur edhe paraform. Me shumë mundësi, pyetja në provim mund të tingëllojë si kjo: substancat hyjnë në reagimin e polimerizimit. Dhe jepet një listë e substancave, ndër të cilat mund të ketë formaldehid.
Vetia e shtatë është polikondensimi. Edhe një herë: gjatë polikondensimit, përveç polimerit, fitohet edhe një përbërje me molekulare të ulët, për shembull, ujë. Formaldehidi hyn në një reagim të tillë me fenolin. Për qartësi, fillimisht shkruajmë ekuacionin me dy molekula fenoli.

Si rezultat, fitohet një dimer i tillë dhe ndahet një molekulë uji. Tani e shkruajmë ekuacionin e reaksionit në formë të përgjithshme.

Produkti i polikondensimit është rrëshirë fenol-formaldehide. Ka një gamë të gjerë aplikimesh duke filluar nga ngjitësit dhe llaqet deri tek plastika dhe komponentët e pllakave të grimcave.
Tani grupi i tretë i reaksioneve të oksidimit të vetive.
3. Oksidimi i aldehideve dhe ketoneve
E teta reagim në listën e përgjithshmeështë një reaksion cilësor ndaj oksidimit të grupit aldehid me një tretësirë amoniaku të oksidit të argjendit. Reagimi i pasqyrës së argjendit. Unë do të them menjëherë se ketonet nuk hyjnë në këtë reagim, vetëm aldehidet.

Grupi aldehid oksidohet në një grup karboksil, acid, por në prani të amoniakut, i cili është një bazë, ndodh menjëherë një reaksion neutralizimi dhe përftohet një kripë, acetat amoniumi. Argjendi precipiton, duke mbuluar pjesën e brendshme të tubit dhe duke krijuar një sipërfaqe të ngjashme me pasqyrën. Ky reagim ndodh gjatë provimit gjatë gjithë kohës.
Nga rruga, i njëjti reagim është cilësor për substancat e tjera që kanë një grup aldehid, për shembull, acidin formik dhe kripërat e tij, si dhe glukozën.
i nënti Reaksioni është gjithashtu cilësor për oksidimin e grupit aldehid me hidroksid bakri të sapoprecipituar dy. Këtu, gjithashtu, vërej se ketonet nuk hyjnë në këtë reagim.

Vizualisht, fillimisht do të vërehet formimi i një precipitati të verdhë, i cili më pas merr ngjyrë të kuqe. Në disa tekste, ka informacione se hidroksidi i bakrit formohet fillimisht i vetëm, i cili ka e verdhe, i cili më pas dekompozohet vetëm në oksid bakri të kuq dhe ujë. Pra, kjo nuk është e vërtetë sipas të dhënave të fundit, në procesin e reshjeve ndryshon madhësia e grimcave të oksidit të bakrit, të cilat në fund arrijnë madhësi që janë lyer pikërisht me të kuqe. Aldehidi oksidohet në atë përkatës acid karboksilik. Reagimi ndodh në provim shumë shpesh.
Reaksioni i dhjetë është oksidimi i aldehideve me një zgjidhje të acidifikuar të permanganatit të kaliumit kur nxehet.
Ndodh çngjyrosja e tretësirës. Grupi aldehid oksidohet në një grup karboksil, domethënë aldehidi oksidohet në acidin përkatës. Për ketonet, ky reagim nuk ka asnjë kuptim praktik, pasi ndodh shkatërrimi i molekulës dhe rezultati është një përzierje e produkteve.
Është e rëndësishme të theksohet se aldehidi formik, formaldehidi, oksidohet në dioksid karboni, sepse vetë acidi formik përkatës nuk është rezistent ndaj agjentëve të fortë oksidues.
Si rezultat, karboni kalon nga gjendja e oksidimit 0 në gjendjen e oksidimit +4. Më lejoni t'ju kujtoj se metanoli, si rregull, në kushte të tilla oksidohet në maksimum në CO 2, duke anashkaluar fazën e aldehidit dhe acidit. Kjo veçori duhet të mbahet mend.
E njëmbëdhjeta djegia e reaksionit, oksidimi i plotë. Të dy aldehidet dhe ketonet digjen në dioksid karboni dhe ujë.
Le ta shkruajmë ekuacionin e reaksionit në formë të përgjithshme.
Sipas ligjit të ruajtjes së masës, duhet të ketë po aq atome në të majtë sa atome në të djathtë. Sepse në fakt reaksionet kimike atomet nuk shkojnë askund, por rendi i lidhjeve midis tyre thjesht ndryshon. Pra, do të ketë po aq molekula të dioksidit të karbonit sa ka atome karboni në një molekulë të një komponimi karbonil, pasi molekula përmban një atom karboni. Kjo është n molekula CO 2. Do të ketë gjysmë molekula uji sa atomet e hidrogjenit, domethënë 2n/2, që do të thotë vetëm n.
Ka të njëjtin numër atomesh oksigjeni në të majtë dhe në të djathtë. Në të djathtë, ka 2n prej tyre nga dioksidi i karbonit, sepse çdo molekulë ka dy atome oksigjen, plus n ujë, për një total prej 3n. Në të majtë, ka të njëjtin numër të atomeve të oksigjenit 3n, por një nga atomet është në molekulën e aldehidit, që do të thotë se duhet të zbritet nga totali për të marrë numrin e atomeve për oksigjen molekular. Rezulton se atomet 3n-1 përmbajnë oksigjen molekular, që do të thotë se ka 2 herë më pak molekula, sepse një molekulë përmban 2 atome. Kjo është (3n-1) / 2 molekula oksigjeni.
Kështu, ne kemi përpiluar ekuacionin për djegien e përbërjeve karbonil në një formë të përgjithshme.
Dhe së fundi i dymbëdhjeti veti që lidhet me reaksionet e zëvendësimit të halogjenimit në atomin alfa të karbonit. Le të kthehemi edhe një herë te struktura e molekulës së aldehidit. Oksigjeni tërheq densitetin e elektroneve në vetvete, duke krijuar një ngarkesë të pjesshme pozitive në karbon. Grupi metil përpiqet të kompensojë këtë ngarkesë pozitive duke zhvendosur elektronet nga hidrogjeni në të përgjatë një zinxhiri lidhjesh sigma. Lidhja karbon-hidrogjen bëhet më polare dhe hidrogjeni shkëputet më lehtë kur sulmohet me një reagent. Ky efekt vërehet vetëm për atomin alfa të karbonit, domethënë atomin që ndjek grupin aldehid, pavarësisht nga gjatësia e radikalit hidrokarbur.
Kështu, është e mundur të merret, për shembull, 2-kloroacetaldehid. Zëvendësimi i mëtejshëm i atomeve të hidrogjenit në trikloroetan është i mundur.
Aldehidet dhe ketonet janë derivate të hidrokarbureve që përmbajnë një ose më shumë grupe karbonil $C = O$ (okso grupe). Aldehidet janë komponime në të cilat grupi karbonil është i lidhur me një mbetje hidrokarbure dhe hidrogjen, ketone - nëse është i lidhur me dy mbetje hidrokarbure (grupi $C = O$ quhet gjithashtu një grup keto):
Aldehidet dhe ketonet i përkasin grupit të përbërjeve karbonil.
Në varësi të strukturës së radikalit hidrokarbur, aldehidet dhe ketonet ndahen në alifatike, aliciklike dhe aromatike. Ndër aldehidet dhe ketonet alifatike, dallohen të ngopura dhe të pangopura.
Izomerizmi i aldehideve shoqërohet me strukturën e mbetjes hidrokarbure, dhe ketoneve - përveç pozicionit $C = O$ të grupit.
Vetitë fizike
Përkufizimi 1
Aldehidet dhe ketonet e ngopura janë lëngje pa ngjyrë, me përjashtim të formaldehidit, i cili është një gaz në kushte normale. Ato karakterizohen nga një erë e fortë. Pikat e tyre të vlimit janë më të ulëta se ato të alkooleve, pasi lidhja hidrogjenore nuk është tipike për aldehidet dhe ketonet, dhe ketonet ziejnë më shumë. temperaturë të lartë sesa aldehidet me të njëjtin numër atomesh karboni.
Aldehidet formike dhe acetike, si dhe ketonet me peshë të vogël molekulare, janë të tretshëm në ujë. Me rritjen e peshës molekulare, tretshmëria e këtyre substancave në ujë zvogëlohet. Të gjitha aldehidet dhe ketonet treten mirë në tretës organikë (alkool, eter, etj.).
Besohet se grupi karbonil është një osmofor, domethënë një bartës i erës. Aldehidi formik ka një erë mjaft të mprehtë. Aldehidet e tjera të ulëta kanë një erë mbytëse e cila, kur hollohet fort, bëhet e këndshme dhe i ngjan erës së perimeve dhe frutave. Ketonet erë mjaft të mirë.
Struktura elektronike e grupit karbonil
Për shkak të elektronegativitetit të ndryshëm të atomeve të karbonit dhe oksigjenit, grupi karbonil ka një polaritet të lartë (μ $\sim$2,5 D$ për aldehidet dhe $2,7 D$ për ketonet) dhe polarizueshmëri të konsiderueshme. Për shembull, vlera e përthyerjes molekulare $MR$ për një grup oxo është afërsisht 3.4, ndërsa për një lidhje të vetme $C-O$ është vetëm 1.5.
Lidhja e dyfishtë e grupit karbonil përbëhet, si për alkenet, nga lidhjet σ- dhe π:
Figura 2. Lidhja e dyfishtë e grupit karbonil. Autor24 - shkëmbim online i punimeve të studentëve
E veçanta e grupit karbonil qëndron në ndryshimin e dukshëm në elektronegativitetin e atomeve që e formojnë atë. Atomi i oksigjenit ka struktura e jashtme$1s^22s^22p^4$ me shpërndarje të 4 $p$-elektroneve në nënnivele individuale $x,y,z$, por problemi i hibridizimit të tij nuk është zgjidhur përfundimisht.
Supozohet ekzistenca e orbitaleve hibride jo ekuivalente me një karakter të rëndësishëm $p$ të tipit $s^n p^m$, ku $n$ tenton në 1, $m$ tenton në 2, domethënë $C-O $ σ-lidhja ka shumë të ngjarë të formohet nga mbivendosja e orbitaleve hibride $sp^(2_-)$ të karbonit dhe $2p_x - AO$ e oksigjenit. Lidhja $n$ formohet nga bashkëveprimi i karbonit të pahibridizuar $2p_x - AO$ dhe $2p_x - AO$ oksigjenit.
Dy çiftet e mbetura të $n$-elektroneve $2s^2$ dhe $(2p^2)_y$ të atomit të oksigjenit janë në thelb Vetitë kimike grupi karbonil nuk preket.
Më poshtë është struktura e aldehidit më të thjeshtë - formaldehidit me të dhëna për këndet e lidhjes dhe gjatësinë e lidhjes.
Figura 3. Struktura e aldehidit më të thjeshtë. Autor24 - shkëmbim online i punimeve të studentëve
gjatësia e obligacionit, $C=O$ 1,203 $C-H$ 1,101
këndi i lidhjes, $()^\circ$ $H-C=O$ 121,8 $H-C-H$ 116,5
Për shkak të polaritetit të lidhjeve $C = O$, atomi i karbonit fiton një ngarkesë efektive pozitive, dhe quhet qendër elektrofile, dhe oksigjen - ngarkesë negative, dhe quhet qendër nukleofile. Prandaj, atomi i karbonit ndërvepron me nukleofile, që është ndërveprimi kryesor i grupit $C=O$ të aldehideve dhe ketoneve në reaksionet kimike, dhe oksigjeni ndërvepron me elektrofilet. Zëvendësuesit pranues, të cilët rrisin ngarkesën pozitive në atomin e karbonit të grupit karbonil, rrisin shumë reaktivitetin e tij. Efekti i kundërt vërehet me veprimin dhurues të zëvendësuesve:
Figura 4. Veprimi dhurues i zëvendësuesve. Autor24 - shkëmbim online i punimeve të studentëve
Pra, aldehidet dhe ketonet, nga njëra anë, shfaqin veti të rëndësishme elektrofilike, dhe nga ana tjetër, veti të dobëta nukleofile, si alkoolet dhe eteret.
Aldehidet janë më reaktive se ketonet si rezultat i dy faktorëve kryesorë. Së pari, në prani të mbetjes së dytë të hidrokarbureve $R$, pengesa sterike lind kur nukleofili sulmon qendrën elektrofilike. Së dyti, zëvendësuesi $R$ me efektin $+I$ zvogëlon ngarkesën pozitive në atomin elektrofilik të karbonit të grupit karbonil dhe rrit ngarkesën negative në atomin e oksigjenit. Si rezultat, aftësia e grupit karbonil për të reaguar me reagentët nukleofilik dobësohet.
Energjia e lidhjes $C = O$ është 680-760 kJ/mol (për krahasim, energjia e lidhjes së dyfishtë $E_(C=C)$ është 590-640 kJ/mol), por për shkak të polaritetit dhe polarizimit të lartë, grupi karbonil është më reaktiv se lidhja e shumëfishtë karbon-karbon.
Karakteristikat spektrale të aldehideve dhe ketoneve
Në spektrat UV, komponimet karbonil kanë një brez absorbimi intensiv prej -185 nm për shkak të π-π -tranzicioni dhe intensiteti i ulët 270-300 nm për shkak të n-π- tranzicioni:
Figura 5. Spektrat UV: benzaldehidi (I), anilina (II) dhe fluorobenzeni (III). Autor24 - shkëmbim online i punimeve të studentëve
Në rajonin IR të spektrit, vibrimet intensive të shtrirjes së grupit karbonil $v_(C=O)$ janë vërejtur në intervalin 1850-1650 cm $^(-1)$, kështu që spektroskopia IR është një metodë e besueshme për të. vendosmëri.
Në rastin e spektroskopisë NMR për grupin aldehid, ekziston një sinjal protonik karakteristik në 8.5-11.0 ppm, i cili është gjithashtu një kriter i besueshëm për praninë e tij në grupin karbonil.