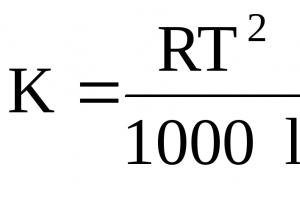Rritja e pikës së vlimit të tretësirave joelektrolitike. Kriopruajtje e objekteve të mëdha biologjike Grafiku i uljes së pikës së ngrirjes së tretësirave ujore
Dy pasoja të rëndësishme rrjedhin nga ligji i Raoult:
1) Tretësirat ziejnë në një temperaturë më të lartë se një tretës i pastër;
2) Tretësirat ngrijnë në një temperaturë më të ulët se një tretës i pastër.
Le t'i shikojmë ato në mënyrë më të detajuar.
Zierja është procesi fizik i një lëngu që kalon në gjendje të gaztë ose avull, në të cilin formohen flluska gazi në të gjithë lëngun.
Një lëng vlon kur presioni i tijavulli i ngopur bëhet i barabartë me presionin e jashtëm. Nëse presioni i jashtëm (për shembull, atmosferik) nuk ndryshon, dheMeqenëse lëngu është një substancë individuale dhe kimikisht e pastër, zierja e tij në një enë të hapur të nxehtë ndodh në një temperaturë konstante derisa faza e lëngshme të zhduket plotësisht.
Pra, në një presion atmosferik prej 101.325 kPa, pika e vlimit të ujit të pastruar (të distiluar) është 100 o C ose 373.16 K.
Nëse një substancë jo e paqëndrueshme tretet në H 2 O, atëherë presioni i avullit të ngopur të tij do të ulet. Në mënyrë që zgjidhja që rezulton të vlojë, është e nevojshme ta ngrohni atë në një temperaturë më të lartë se 373.16 K, pasi vetëm në kushte të tilla presioni i avullit të ngopur të tretësit do të bëhet përsëri i barabartë me presionin atmosferik.
Ngrirja ose kristalizimiështë një fenomen fizik i shoqëruar nga shndërrimi i një lëngu në të ngurtë. Për më tepër, strukturat kristalore formohen në të gjithë vëllimin e lëngut.
Procesi i ngrirjes fillon kur presioni i avullit të ngopur mbi lëng bëhet i barabartë me presionin e avullit të ngopur mbi kristalet e tij të ngurta.
Nëse presioni i jashtëm (atmosferik) mbetet konstant, dheNëse lëngu nuk përmban papastërti të huaja, atëherë gjatë procesit të kristalizimit temperatura e lëngut të ftohur do të mbetet konstante derisa faza e lëngshme të kthehet plotësisht në një gjendje të ngurtë.
Në presionin atmosferik të barabartë me 101.325 kPa, uji i distiluar ngrin në 0 ° C (273.16 K). Presioni i avullit të ngopur të ujit mbi akull dhe lëng në këtë rast është 613.3 Pa.
Për një tretësirë ujore, presioni i avullit të ngopur të tretësit në 0 o C do të jetë më i vogël se 613.3 Pa, dhe sipër akulli mbetet i pandryshuar. Akulli i rënë në një zgjidhje të tillë do të shkrihet shpejt për shkak të kondensimit të avullit të tepërt mbi të.
Vetëm duke ulur temperaturën presioni i avullit të ngopur mbi fazat e lëngëta dhe të ngurta mund të barazohet përsëri dhe të fillojë procesi i kristalizimit.
Eksperimentalisht u vërtetua se një rritje në pikën e vlimit ( t kip. ) dhe një rënie në temperaturën e ngrirjes zgjidhje ( t zv ) në krahasim me një tretës të pastër është drejtpërdrejt proporcional me përqendrimin molal të substancës së tretur. Matematikisht, kjo mund të shkruhet si më poshtë:
t kip. tretësirë –t vlim. p-trup =t vlim. =Em
t deputet r-tel –t deputet zgjidhje =t zëvendës = Km
Kum– përqendrimi molaltretësirë;EDheK– përkatësisht, ebulioskopik (lat.ebulio– valoj) dhe konstante krioskopike (greqisht "krios" - të ftohta), vlerat e të cilave varen vetëm nga natyratretës (Tabela 7).
Tabela 7. Ebulioskopike E dhe konstantet K krioskopike të disa tretësve (deg/mol)
Konstantet ebulioskopike dhe krioskopike tretësi tregon se sa gradë rritet pika e vlimit dhe pika e ngrirjes ulet tretësirë e përftuar duke tretur një mol jo elektrolit në një kilogram tretës ( m = 1 mol/kg).
Për të përcaktuar vlerat e E dhe K, së pari përcaktoni balen Dt në mënyrë eksperimentale. dhe Dt zv tretësira shumë të holluara (m<< 1), а затем полученные данные пересчитывают или экстраполируют для растворов сm= 1 моль/кг.
KuR– konstante universale e gazit;T– pika e vlimit të tretësit; - nxehtësia specifike e avullimit të tretësit.

KuT- temperatura e shkrirjeszgjidhjeartikull;l- nxehtësia specifike e shkrirjestretës.
Kështu, tretësirat e substancave të ndryshme në natyrë, por me të njëjtin përqendrim molal, do të ziejnë dhe ngrijnë në të njëjtën kohëtemperatura.
Ekziston një ndryshim i rëndësishëm për t'u theksuartretësirë nga një tretës i pastër. Nëse kjo e fundit vlon dhe ngrin në konstantetemperatura, atëherëzgjidhjet e bëjnë këtë në intervaltemperaturat, d.m.th. Ndërsa ziejnë, temperatura rritet gjatë gjithë kohës dhe kur ngrijnë, ajo ulet. Kjo për faktin se largimi nga faza e lëngshmetretësi në formën e avullit ose kristaleve të ngurta çon në një rritje të përqendrimit molal të tretësirës, sepse Gjatë procesit të vlimit dhe ngrirjes, substanca e tretur mbetet në një sasi të pandryshuar në fazën e lëngshme (derisa të vlojë plotësisht ose të ngrijë), dhe masa e tretësit të lëngshëm zvogëlohet.
Në matjet praktike pika e ngrirjes ose e vlimit zgjidhje, regjistrohet momenti i shfaqjes së kristaleve të para të ngurtë në të (për t zv ) ose flluska gazi (për t kip. ).
Vetia e solucioneve për të ulur pikën e ngrirjes i lejon ato të përdoren si ftohës.
Kështu, tretësirat e disa substancave organike dhe inorganike përdoren si antifriz për të ftohur motorët me djegie të brendshme kur funksionojnë në kushte të ndryshme klimatike.
Degradimi temperatura e ngrirjes zgjidhjet kanë një rëndësi të madhe për organizmat e gjallë. Kështu, lëngu në qelizat e tyre është një zgjidhje e substancave të ndryshme inorganike dhe organike. E tijtemperatura e ngrirjes është nën 0 O C (273.16 K ), kështu qelizat nuk vdesin nën hipotermi.
Falë këtij fenomeni, bimët ruhen në dimër. Për më tepër, sa më i lartë të jetë përqendrimi i substancave në lëngun qelizor, aq më të ulëta temperaturat e jashtme mund të tolerojë bima.
Në të njëjtën kohë, për të ulur pikën e ngrirjes së tretësirës në qelizat e ftohura, përmirësohet procesi i hidrolizës së përbërjeve me peshë molekulare më të lartë në komponime me peshë molekulare të ulët (për shembull, karbohidratet në glukozë).
Vetitë koligative të tretësirave janë ato veti që varen vetëm nga përqendrimi i grimcave të substancës së tretur, por jo nga përbërja kimike e saj. Në këtë pjesë, do të shqyrtohen katër vetitë e mëposhtme koligative të tretësirave: 1) ulja e presionit të avullit, 2) rritja e pikës së vlimit, 3) ulja e pikës së ngrirjes, 4) presioni osmotik. Të gjitha këto katër veti vlejnë për tretësirat që përmbajnë substanca të tretshme jo të paqëndrueshme, d.m.th. ato substanca të tretshme, presioni i avullit i të cilave është i papërfillshëm.
Ulja e presionit të avullit të tretësirave
Grimcat e tretësit të pastër mund të kalojnë në fazën e avullit nga e gjithë sipërfaqja e lëngut (Fig. 6.34). Megjithatë, në një tretësirë, për shkak të pranisë së grimcave të tretësirës, kalimi i grimcave tretës nga sipërfaqja në fazën e avullit është i vështirë. Nëse substanca e tretur ka një presion avulli më të ulët se tretësi, atëherë presioni i avullit të tretësirës është më i ulët se ai i tretësit të pastër. Ky model mund të kuptohet bazuar në ligjin e Raoult (shih seksionin e mëparshëm). Në rastin ekstrem kur një tretësirë përmban një substancë të tretur plotësisht jo të paqëndrueshme, presioni i avullit të tretësirës krijohet vetëm nga grimcat e tretësit. Në Fig. Figura 6.35 tregon diagramin fazor të presionit të avullit-përbërjes për një rast të tillë. Sigurisht, ky rast ekstrem është thjesht hipotetik, pasi në realitet të gjitha trupat e ngurtë kanë një presion avulli, megjithëse mund të jetë shumë i vogël.
Oriz. Figura 6.35 tregon se me rritjen e fraksionit mol të tretësirës jo të avullueshme B, presioni i avullit të tretësirës zvogëlohet. Duke përdorur ligjin e Raoult
Oriz. 6.34. Grimcat jo të paqëndrueshme të substancës së tretur parandalojnë largimin e grimcave të tretësit nga sipërfaqja e lëngut dhe në këtë mënyrë reduktojnë presionin e avullit.
mund të nxirret një ekuacion që përshkruan uljen e presionit të avullit për tretësirat e holluara. Sipas ligjit të Raoult, presioni i avullit të tretësit është i barabartë me
Për një sistem me dy komponentë kemi
![]()
dhe për këtë arsye
![]()
Nëse e zëvendësojmë këtë shprehje me ekuacionin (5), marrim
Nga kjo rrjedh se
Kjo tregon se ulja e presionit të avullit është proporcionale me fraksionin mol të lëndës së tretur jo të paqëndrueshme.
Rritja e pikës së vlimit të tretësirës
Një tretësirë që përmban një lëndë të tretur jo të paqëndrueshme është më pak e paqëndrueshme se një tretës i pastër. Prandaj, zierja e tij fillon në një temperaturë më të lartë se zierja e një tretësi të pastër. Në Fig. Figura 6.36 tregon varësinë e presionit të avullit nga temperatura për një tretës të pastër dhe për një tretësirë që përmban një substancë të tretshme jo të paqëndrueshme. Rritja e pikës së vlimit është proporcionale me uljen e presionit të avullit:
Duke përdorur këtë shprehje dhe ligjin e Raoult, mund të nxjerrim një shprehje tjetër që lidhet me uljen e pikës së vlimit me përbërjen e tretësirës, përkatësisht
![]()
Në këtë shprehje nënkupton molalitetin e substancës së tretur. Ne kemi hasur tashmë termin "molalitet" në seksion. 4.2. Do të thotë numri i moleve të substancës së tretur në 1 kg tretës.
Vlera quhet konstanta ebulioskopike e tretësit. Quhet gjithashtu konstanta e rritjes së pikës së vlimit molale ose thjesht konstanta e rritjes së pikës së vlimit. Në tabelë Tabela 6.5 tregon vlerat e konstantës për disa tretës.

Oriz. 6.35. Diagrami fazor i përbërjes së presionit të avullit për një tretësirë që përmban një substancë të tretur jo të paqëndrueshme.

Oriz. 6.36. Rritja e pikës së vlimit të një tretësire në presionin atmosferik.
Përcaktimi eksperimental i rritjes së pikës së vlimit të tretësirës
Për të përcaktuar në mënyrë eksperimentale rritjen e pikës së vlimit të një tretësire, mund të përdoret metoda Landsberger. Avulli i tretësit kalohet përmes një tretësi të vendosur në një gotë të shkallëzuar (Fig. 6.37). Lëshimi i entalpisë së avullimit si rezultat i kondensimit të avullit bën që tretësi në gotë të vlojë. Kjo parandalon mbinxehjen, e cila mund të ndodhë nëse temperatura e një lëngu rritet mbi pikën e tij të vlimit.
Pasi të keni matur pikën e vlimit të një tretësi të pastër, ftohet dhe shpërndahet një sasi e peshuar e lëndës së tretur në të. Pastaj avujt e tretësit kalohen përmes tretësirës që rezulton derisa të fillojë zierja. Në këtë moment, matni temperaturën e tretësirës. Meqenëse rritja e pikës së vlimit të një tretësire në krahasim me një tretës të pastër është zakonisht e vogël, është e nevojshme të matet temperatura me saktësi të mjaftueshme. Për këtë qëllim, përdoret një termometër Beckman. Përqendrimi i tretësirës përcaktohet duke ditur masën e substancës së tretur dhe vëllimin përfundimtar të tretësirës, i cili përcaktohet duke përdorur një gotë të shkallëzuar.
Tabela 6.5. Tretës të përhershëm ebulioskopik

Oriz. 6.37. Instalim për përcaktimin e rritjes së pikës së vlimit të një solucioni.
Përcaktimi i masës molare të një lënde duke rritur pikën e vlimit të tretësirës së saj
Metoda Landsberger mund të përdoret për të përcaktuar masën molare të një lënde të tretur. Procedura e përcaktimit përbëhet nga tre faza:
1) përcaktimi eksperimental i rritjes së pikës së vlimit;
2) shprehja e molalitetit të substancës së tretur përmes masës molare të panjohur dhe masave të përcaktuara eksperimentalisht të substancës së tretur dhe tretësit, të cilat korrespondojnë me rritjen e gjetur të pikës së vlimit;
3) përcaktimi i konstantës ebulioskopike duke përdorur tabela ose eksperimentalisht. Në rastin e fundit, eksperimenti duhet të përsëritet duke përdorur të njëjtin tretës, por një tretësirë të ndryshme me një masë molare të njohur.
Shprehja e nevojshme për molalitetin rrjedh nga përkufizimi i tij:
![]()
ku është numri i moleve të substancës së tretur dhe masa e tretësit në gram. Vlera paraqet masën e substancës së tretur në kilogramë. Sepse
![]()
ku është masa e substancës së tretur në gram, masa molare e panjohur e substancës së tretur, ne mund ta transformojmë shprehjen (7) në formën e mëposhtme:
Kjo është shprehja për molalitetin e substancës së tretur, e cila është e nevojshme në fazën e dytë të përcaktimit të masës molare të saj.
Nëse tani e zëvendësojmë këtë shprehje, si dhe vlerën e AT të gjetur në fazën e parë, dhe vlerën e gjetur në fazën e tretë të eksperimentit, në ekuacionin (6), marrim

Duke përdorur këtë ekuacion, le të shprehim tani masën molare të panjohur në terma të sasive të përcaktuara eksperimentalisht:

Propanoni ka pikën e vlimit të propanonit të tretur 1.00 g të një substance jo të paqëndrueshme. Pika e vlimit të tretësirës që rezulton është 57,4°C. Le të llogarisim masën molare dhe masën molekulare relative të substancës së tretur nëse dihet se konstanta ebulioskopike e propanonit është e barabartë me .
Kur 1,00 g lëndë të panjohur shpërndahet në 10 g tretës, pika e vlimit u rrit me 1,2°C. Duke zëvendësuar këtë dhe sasi të tjera të njohura në ekuacionin (8), marrim
Kështu, masa molare e substancës së tretur jo të avullueshme është 142.5 g/mol dhe prandaj masa e saj molekulare relative është 142.5.
Ulja e pikës së ngrirjes së tretësirës
Në pjesën e mëparshme u tregua se shtimi i një komponenti të dytë në një lëng çon në një ulje të pikës së ngrirjes së tij (shih Fig. 6.33). Ulja e pikës së ngrirjes së AT varet nga molaliteti i substancës së tretur (sipas llojit të marrëdhënies që përcakton rritjen e pikës së vlimit të tretësirës):
ku është konstanta krioskopike e tretësit, e quajtur ndryshe konstanta e depresionit të pikës së ngrirjes molale ose thjesht konstanta e depresionit të pikës së ngrirjes.
Vlerat e konstantës krioskopike për disa tretës janë dhënë në tabelë. 6.6.
Për të përcaktuar në mënyrë eksperimentale uljen e temperaturës së ngrirjes, instalimi i paraqitur skematikisht në Fig. 6.38. Në të brendshmen
Tabela 6.6. Tretës të përhershëm krioskopikë

Oriz. 6.38. Instalim për përcaktimin e uljes së pikës së ngrirjes së një solucioni.
Një masë e njohur e tretësit vendoset në një epruvetë qelqi të shkallëzuar. Tretësi ftohet ngadalë, duke e përzier vazhdimisht për të minimizuar superftohjen (shih seksionin e mëparshëm). Në këtë rast, temperatura përcaktohet çdo gjysmë minutë duke përdorur një termometër Beckman. Në bazë të leximeve të saj, ndërtohet një kurbë ftohjeje, mbi të cilën përcaktohet temperatura e ngrirjes. Më pas tretësi nxehet derisa të shkrihet dhe t'i shtohet një masë e njohur e lëndës së tretur. Tretësira përzihet derisa substanca e shtuar të tretet plotësisht. Tretësira më pas ftohet, duke regjistruar temperaturën çdo gjysmë minutë dhe përcaktohet pika e re e ngrirjes.
Përcaktimi i masës molekulare relative të një lënde duke ulur pikën e ngrirjes së tretësirës së saj
Depresioni i pikës së ngrirjes së një solucioni të një substance jo të paqëndrueshme mund të përdoret për të përcaktuar peshën e saj molekulare relative.
Në metodën Rasta bazuar në këtë parim, tretësi është
kamfori, i cili ka një konstante të madhe krioskopike (shih Tabelën 6.6). Metoda të tjera përdorin acid acetik ose tretës të tjerë për këtë qëllim.
Acidi acetik ka një pikë ngrirjeje prej 16.63°C. Kur 2,5 g të një lënde organike të panjohur iu shtuan 40 g të këtij acidi, pika e ngrirjes së tretësirës që rezulton ra në 15,48 ° C. Le të llogarisim masën molekulare relative të lëndës së tretur të panjohur.
Për të zgjidhur problemin, është e nevojshme të nxirret një ekuacion i ngjashëm me ekuacionin (8). Kjo mund të bëhet duke përdorur ekuacionet (9) dhe (7) në të njëjtën mënyrë që ekuacioni (8) u përftua më sipër duke përdorur ekuacionet (6) dhe (7). Si rezultat ne gjejmë
Dihet se. Nga tavolina 6.6 gjejmë. Duke i zëvendësuar këto vlera në ekuacionin (10), gjejmë
Pra, pesha molekulare relative e lëndës së tretur organike është 212.
Presioni osmotik
Osmoza është kalimi spontan i një tretësi përmes një membrane gjysmë të përshkueshme nga një tretësirë e holluar ose tretës i pastër në një tretësirë të koncentruar. Ky fenomen mund të demonstrohet duke përdorur pajisjen e paraqitur në mënyrë skematike në Fig. 6.39. Fundi i gjerë i tubit, i mbyllur me një membranë kafshësh (për shembull, fshikëza e demit), mbushet me një zgjidhje sheqeri dhe zhytet në një gotë me ujë. Pas ca kohësh, uji kalon përmes membranës në tretësirën e sheqerit.
Një membranë që lejon grimcat e tretësit të kalojnë, por nuk lejon grimcat e tretura të kalojnë, quhet membranë gjysmë e përshkueshme. Një membranë gjysmë e përshkueshme lejon që grimcat e tretësit të kalojnë në të dy drejtimet. Sidoqoftë, meqenëse në anën e membranës ku përqendrimi i tretësirës është më i lartë, përqendrimi i tretësit, përkundrazi, është më i ulët, ndodh kalimi që rezulton i tretësit në një tretësirë të koncentruar. Kjo çon në vendosjen e një ndryshimi presioni në të dy anët e membranës. Presioni që duhet të aplikohet në një tretësirë të koncentruar për të parandaluar lëvizjen e tretësit nëpër membranë quhet presion osmotik. Ajo shënohet me shkronjën greke p.
Presioni osmotik është një veti koligative sepse varet vetëm nga përqendrimi i grimcave të tretura dhe jo nga përbërja e tyre kimike.
Presioni osmotik luan një rol të rëndësishëm në proceset biologjike. Për shembull, te kafshët, disa lloje qelizash, të tilla si qelizat e kuqe të gjakut, përmbajnë një zgjidhje të kripur. Këto qeliza kufizohen nga membrana plazmatike. Në një mjedis ujor, qelizat e kuqe të gjakut i nënshtrohen osmozës, fryhen dhe shpërthejnë. Megjithatë, nëse ato ekspozohen ndaj një solucion kripe më të koncentruar, qelizat tkurren.

Oriz. 6.39. Një eksperiment që tregon efektin e presionit osmotik.
Qelizat bimore përmbajnë solucione kripe në zgavra të veçanta - vakuola. Vakuola është e rrethuar nga një shtresë e hollë citoplazme, e cila ka vetitë e një membrane gjysmë të përshkueshme dhe kontrollon thithjen e ujit nga qeliza bimore.
Nëse presioni i aplikuar në një tretësirë të koncentruar tejkalon presionin osmotik, tretësi lëviz nga tretësira e koncentruar përmes membranës në tretësirën e holluar. Ky proces quhet osmozë e kundërt. Ai gjen aplikim industrial për qëllimin e marrjes së ujit të pijshëm nga uji i detit.
Eksperimentet e ngjashme me atë të përshkruar më sipër me një tretësirë sheqeri tregojnë se: 1) në temperaturë konstante, presioni osmotik është drejtpërdrejt proporcional me ndryshimin e përqendrimeve në tretësirat e ndara nga një membranë; 2) në fikse
dallimet e përqendrimit, presioni osmotik është drejtpërdrejt proporcional me temperaturën absolute.
Marrëdhënia midis presionit osmotik dhe temperaturës është e ngjashme me ekuacionin e gjendjes së një gazi ideal (shih seksionin 3.1). Quhet ekuacioni van't Hoff:
Në këtë ekuacion - presioni osmotik, K - vëllimi i tretësirës, - numri i moleve të substancës së tretur, T - temperatura absolute, - konstanta molare e gazit. Ekuacioni (11) mund të paraqitet në një formë tjetër:
ku c është përqendrimi i tretësirës
Ekuacioni van't Hoff është i përafërt dhe vlen vetëm për tretësirat e holluara.
Përcaktimi i masës molekulare relative të një lënde të tretur nga presioni osmotik i tretësirës
Ekuacioni van't Hoff mund të përdoret për të përcaktuar peshën molekulare relative të një lënde të tretur nga presioni osmotik që krijon, i cili përcaktohet në mënyrë eksperimentale. Kjo metodë është veçanërisht e dobishme për përcaktimin e peshës mesatare molekulare relative të polimereve dhe substancave të tjera makromolekulare.
Një tretësirë sheqeri me përqendrim 2,5 g/dm3 krijon një presion osmotik prej atm në 25 °C. Le të llogarisim masën molekulare relative të substancës së tretur.
Vlera e dëshiruar e masës molekulare relative të substancës së tretur mund të gjendet drejtpërdrejt duke përdorur ekuacionin Van't Hoff (11). Të dhënat fillestare të detyrës janë si më poshtë:

Duke i zëvendësuar këto vlera në ekuacionin Van't Hoff, gjejmë
Vlerat jonormale të peshës molekulare relative
Më sipër u tregua se për të përcaktuar peshën molekulare relative, mund të përdoren tre veti të ndryshme koligative të tretësirave, përkatësisht: 1) një rritje në pikën e vlimit; 2) ulja e temperaturës së ngrirjes; 3) presioni osmotik.
Vlerat jonormale të peshës molekulare relative mund të ndodhin kur një substancë e tretur shoqërohet ose shkëputet në tretësirë. Për shembull, acidet karboksilike mund të bashkohen në tretës organikë për të formuar dimerë (shih Figurën 6.26). Kjo ndodh për shkak të formimit të lidhjeve hidrogjenore. Elektrolitet si kloruri i natriumit shpërndahen në tretësirat ujore:
Prandaj, vetitë koligative të tretësirave të elektrolitit varen vetëm nga përqendrimi dhe jo nga natyra kimike e joneve të tretura të pranishme në tretësirë. Në një tretësirë të klorurit të natriumit, për çdo mol lëndë të tretur ka dy mol jone. Për shkak të kësaj, pesha molekulare relative e gjetur duke rritur pikën e vlimit të tretësirës rezulton të jetë afërsisht gjysma e asaj të llogaritur nga formula kimike.
Duke krahasuar vlerat e masës molekulare relative të gjetura eksperimentalisht nga vetitë koligative me ato të llogaritura nga formulat kimike të substancave të tretura, mund të përcaktohet shkalla e lidhjes ose shpërbërjes së substancës së tretur.
Kriopservimi i objekteve të mëdha biologjike
Fusha më intriguese e aplikimit të kriobiologjisë - shkenca e ndikimit të temperaturave të ulëta dhe ultra të ulëta në objektet biologjike - është kërkimi i mundësive të ruajtjes së organizmave të gjallë ose organeve individuale në një gjendje ngrirjeje të thellë. Teknika e kriopruajtjes së qelizave individuale ose, për shembull, embrioneve është zhvilluar mirë, por ngrirja e kthyeshme (d.m.th., ruajtja e qëndrueshmërisë pas shkrirjes) e objekteve të mëdha has në pengesa serioze. Vështirësia kryesore është se me vëllim dhe masë të madhe është e vështirë të arrihet ftohje uniforme. Ngrirja e pabarabartë çon në dëmtime serioze dhe të pakthyeshme të qelizave dhe indeve. Ndërkohë, zgjidhja e këtij problemi mund të ndihmojë, për shembull, në krijimin e një banke organesh për transplantim dhe në këtë mënyrë të shpëtojë jetën e mijëra pacientëve. Edhe më joshëse është mundësia e mbajtjes së një pacienti të sëmurë rëndë në një gjendje ftohjeje të thellë derisa mjekësia të jetë në gjendje ta ndihmojë atë, ndoshta disa dekada nga tani.
Rreziku më i madh gjatë ngrirjes është dëmtimi mekanik i membranave qelizore nga kristalet e akullit që rezultojnë. Duke formuar si jashtë ashtu edhe, shumë më të rrezikshme, brenda qelizave, ato çajnë shtresën bimolekulare lipidike që formon këto membrana.
Për të mbrojtur qelizat nga dëmtimet gjatë ngrirjes, përdoren substanca të veçanta - krioprotektorë. Ato ndahen në dy grupe: depërtuese qelizore, ose endoqelizore (dimetil sulfoksid (DMSO), acetamid, propilen glikol, glicerol, etilenglikol) dhe jo-depërtues ose ekzoqelizor (glikolet polietileni dhe oksidet e polietilenit, Ficoll, saharoza, trehaloza, etj.), të cilat veprojnë nga jashtë. , duke tërhequr në mënyrë osmotike ujin nga qeliza.
Kjo e fundit është e dobishme: sa më pak ujë të mbetet në qelizë, aq më pak akull do të formohet më vonë. Por heqja e ujit çon në një rritje të përqendrimit të kripërave që mbeten brenda qelizës - deri në vlerat në të cilat ndodh denatyrimi i proteinës. Krioprotektorët endoqelizorë jo vetëm që reduktojnë pikën e ngrirjes, por edhe hollojnë "shëllirën" e formuar gjatë kristalizimit, duke parandaluar denatyrimin e proteinave.

Më të përdorurat janë glicerina dhe DMSO. Kur ato shtohen në ujë, pika e ngrirjes së tij ulet, duke arritur vlerën më të ulët në një raport afërsisht 2:1. Kjo temperaturë më e ulët quhet eutektik, ose kriohidrat. Me ftohjen e mëtejshme të përzierjeve të tilla, madhësitë e kristaleve të akullit që rezultojnë rezultojnë të jenë aq të vogla (të krahasueshme me madhësinë e qelizës kristalore) saqë nuk shkaktojnë dëme të konsiderueshme në strukturat e qelizave.
Nëse do të ishte e mundur që përqendrimi i krioprotekantit në indet e gjalla të sillet në eutektik, kjo do të zgjidhte plotësisht problemin e dëmtimit të indeve nga kristalet e akullit. Megjithatë, në përqendrime të tilla, çdo krioprojtës i njohur rezulton të jetë toksik.
Në praktikë përdoren përqendrimet e krioprotektorëve që janë dukshëm më të ulëta se përqendrimet eutektike dhe në të njëjtën kohë një pjesë e ujit ende ngrin. Pra, kur përdoret një zgjidhje 27% e glicerinës, 40% e ujit të pranishëm në qelizë formon një përzierje eutektike me glicerinë, ndërsa pjesa tjetër ngrin. Sidoqoftë, siç treguan eksperimentet e kryera në 1954-1960. Kriobiologia angleze Audrey Smith, hamsterët e artë janë në gjendje të mbijetojnë në një situatë ku deri në 50-60% e ujit që përmbahet në indet e trurit të tyre është kthyer në akull!
Shkalla e ftohjes ka një rëndësi të madhe për zgjidhjen e problemit të ngrirjes së kthyeshme. Gjatë ftohjes së ngadaltë (në avujt e azotit të lëngshëm ose në ngrirësit e programit special), kristalet e akullit formohen kryesisht në hapësirën ndërqelizore. Ndërsa ftohen, ato rriten, duke nxjerrë ujë nga qelizat. Siç është përmendur tashmë, kjo mund të zvogëlojë ndjeshëm dëmtimin e shkaktuar nga kristalet në qeliza - por përqendrimi i kripërave brenda qelizave rritet ndjeshëm, duke rritur rrezikun e denatyrimit të proteinave.
Fatkeqësisht, normat optimale të uljes së temperaturës që komprometojnë efektet e dëmshme të kristaleve të akullit dhe përqendrimeve të larta të lëndëve të tretura ndryshojnë shumë midis llojeve të qelizave. Përqendrimet optimale të krioprojtësve për to janë gjithashtu të ndryshme. Kjo e komplikon shumë kriopruajtjen e organeve dhe indeve që përfshijnë disa lloje të ndryshme qelizash, dhe aq më tepër të organizmave të tërë.
Gjatë ftohjes së shpejtë (për shembull, zhytja e një kampioni në azot të lëngshëm), uji nuk ka kohë të shpërndahet nga qelizat; Kristalet formohen si jashtë ashtu edhe brenda qelizave, por për shkak të ftohjes më të shpejtë ato rezultojnë të jenë shumë më të vogla se në rastin e parë dhe nuk kanë kohë të formohen në të gjitha qelizat. Në këtë rast, përqendrimet toksike të kripërave mund të shmangen dhe kohëzgjatja e ekspozimit të tyre është më e shkurtër, si dhe kohëzgjatja e efekteve të dëmshme të krioprotektorëve. Kjo e fundit lejon përdorimin e përqendrimeve më të larta.
 Me ftohje mjaftueshëm të shpejtë në 0 °C dhe pak më të ulët, uji nuk ngrin (kristalizohet) menjëherë. Së pari, formohet një lëng i superftuar. Në eksperimentet e përmendura nga Smith, ajo në disa raste ishte në gjendje të ftohte hamsterët e artë në -6 ° C pa formimin e kristaleve të akullit. Në të njëjtën kohë, lëkura dhe gjymtyrët e kafshëve mbetën të buta. Dhe pas ngrohjes, hamsterët erdhën në jetë pa asnjë efekt të dëmshëm të dukshëm. Femrat shtatzëna (nëse hipotermia ka ndodhur në gjysmën e parë të shtatzënisë) kanë lindur këlyshë normale.
Me ftohje mjaftueshëm të shpejtë në 0 °C dhe pak më të ulët, uji nuk ngrin (kristalizohet) menjëherë. Së pari, formohet një lëng i superftuar. Në eksperimentet e përmendura nga Smith, ajo në disa raste ishte në gjendje të ftohte hamsterët e artë në -6 ° C pa formimin e kristaleve të akullit. Në të njëjtën kohë, lëkura dhe gjymtyrët e kafshëve mbetën të buta. Dhe pas ngrohjes, hamsterët erdhën në jetë pa asnjë efekt të dëmshëm të dukshëm. Femrat shtatzëna (nëse hipotermia ka ndodhur në gjysmën e parë të shtatzënisë) kanë lindur këlyshë normale.
Ekziston një teknikë për kryerjen e operacioneve kirurgjikale te gjitarët e vegjël të porsalindur - për shembull, minjtë. Anestezia në këtë moshë është praktikisht e pazbatueshme, dhe për këtë arsye këlyshët thjesht ftohen për 15-20 minuta derisa të humbasin lëvizshmërinë dhe ndjeshmërinë. Ekziston një rast i njohur kur, gjatë studimeve të tilla (efekti i heqjes së organit vomeronasal në sjelljen e brejtësve) në laboratorin e një prej instituteve të Moskës, disa këlyshë të porsalindur lloj brejtësi Xhungarian, për shkak të neglizhencës së eksperimentuesit. thjesht i harruar i shtrirë në një shtrat pambuku në një dhomë me një temperaturë prej -12 ° C. Pas nxjerrjes - pas 2-3 orësh - ata ishin plotësisht të fortë, dhe trupat e tyre fjalë për fjalë "bënë një trokitje prej druri". Pas ca kohësh në temperaturën e dhomës, këlyshët erdhën në jetë, filluan të lëviznin dhe të bënin tinguj...
Lëngjet në trup zakonisht fillojnë të ngrijnë në –1... –3 °C. Megjithatë, ndërsa një pjesë e ujit kthehet në akull, përqendrimi i substancave të tretshme në lëngun e mbetur rritet dhe pika e ngrirjes së atij lëngu vazhdon të ulet.
Temperatura e ngrirjes së plotë të lëngjeve të ndryshme biologjike ndryshon shumë, por në çdo rast rezulton të jetë nën –22...–24 °C.
Probabiliteti i formimit të një "bërthame" të një kristali akulli për njësi të kohës në një lëng të superftohur është në proporcion me vëllimin e këtij lëngu dhe varet fuqimisht nga temperatura: në -40 ° C dhe në një presion prej 1 atm. kristalizimi i ujit të pastër ndodh pothuajse menjëherë, por në temperatura edhe më të ulëta (rreth -70 ° C, ritmi i rritjes së kristalit ngadalësohet për shkak të rritjes së viskozitetit të ujit. Së fundi, në një temperaturë prej rreth -130 ° C, kristali rritja ndalon plotësisht.Nëse e ftojeni lëngun mjaft shpejt për të "tejkaluar" temperaturën e kristalizimit aktiv përpara se kristalet me përmasa të rrezikshme të kenë kohë të formohen, viskoziteti rritet aq shumë sa formohet një substancë e ngurtë qelqi. Ky fenomen quhet tranzicioni qelqi ose vitrifikimi.
Nëse është e mundur të ftohen qelizat ose indet në temperaturën e tranzicionit të qelqit, ato mund të qëndrojnë në këtë gjendje për një kohë të pacaktuar dhe dëmtimi që rezulton do të jetë pakrahasueshëm më i vogël se gjatë ftohjes me kristalizimin. Në fakt, kjo do të ishte një zgjidhje për problemin e ruajtjes së objekteve biologjike në një gjendje ngrirjeje të thellë. Vërtetë, kur qelizat shkrihen, për t'i ringjallur ato, do të duhet të kalojnë përsëri një interval të rrezikshëm të temperaturës...
Shpejtësia e rritjes së kristaleve të akullit në një qelizë mund të reduktohet duke shtuar papastërti në ujë që rrisin viskozitetin e tij - glicerinë, sheqerna etj. Përveç kësaj, ka substanca që bllokojnë formimin e kristaleve të akullit. Për shembull, ata kanë veti të tilla. proteina speciale të prodhuara nga organizmat e një numri kafshësh rezistente ndaj të ftohtit - peshku Arktik dhe Antarktik, disa insekte, etj. Molekulat e këtyre substancave kanë zona që janë plotësuese me sipërfaqen e kristalit të akullit - "ulur" në këtë sipërfaqe, ndalojnë rritjen e mëtejshme të saj.
Kur ftohen objekte të mëdha (në krahasim me një qelizë - 1 mm ose më shumë), zakonisht lindin gradient të rëndësishëm të temperaturës brenda tyre. Së pari, shtresat e jashtme ngrijnë dhe formohet një front i ashtuquajtur kristalizimi, duke lëvizur nga jashtë në brendësi. Përqendrimi i kripërave dhe substancave të tjera të tretura në ujë para këtij fronti rritet ndjeshëm. Kjo çon në denatyrim të proteinave dhe dëmtim të makromolekulave të tjera qelizore. Një problem tjetër është plasaritja e pëlhurës. Shkaku i saj është ftohja e pabarabartë dhe heterogjene, veçanërisht në një situatë ku shtresat e jashtme ngurtësohen para atyre të brendshme.
Kthehu në vitet '60. shekulli XX Ideja u propozua për të përdorur presion të lartë për të kontrolluar kristalizimin e ujit. Kjo ide bazohet në uljen e temperaturës së tranzicionit të fazës ujë/akulli me rritjen e presionit. Në orën 2045 atm. Temperatura e kristalizimit të ujit të pastër është –22 °C. Nuk është e mundur të arrihet një ulje më e madhe e temperaturës së ngrirjes në këtë mënyrë - me një rritje të mëtejshme të presionit, ajo fillon të rritet përsëri.
Në vitin 1967, amerikani M.D. Persidsky dhe kolegët e tij eksperimentuan me ngrirjen e veshkave të qenit. Studiuesit perfuzuan veshkat me një zgjidhje 15% dimetil sulfoksid (perfuzioni është futja e substancave në një objekt biologjik përmes një sistemi të enëve të gjakut), dhe më pas i ftohën ato duke rritur njëkohësisht presionin në mënyrë që në çdo moment temperatura të mos ishte nën pikën e ngrirjes që korrespondon me një presion të caktuar. Kur u arrit vlera minimale e temperaturës (në këtë rast, për shkak të pranisë së një krioprojtësi, ishte rreth -25 °C), presioni u ul.
 Me një lëshim të shpejtë të presionit, një lëng i superftuar në një temperaturë të tillë mund të ekzistojë jo më shumë se disa sekonda, pas së cilës ndodh kristalizimi spontan. Por kristalet e formuara në këtë rast shpërndahen në mënyrë të barabartë në të gjithë vëllimin e kampionit, dhe nuk ndodh një front kristalizimi, si dhe një rritje e pabarabartë e përqendrimit të kripërave. Përveç kësaj, kristalet që lindin në këtë rast janë në përmasa të vogla dhe në formë kokrrizore dhe për këtë arsye shkaktojnë relativisht pak dëmtime në qeliza.
Me një lëshim të shpejtë të presionit, një lëng i superftuar në një temperaturë të tillë mund të ekzistojë jo më shumë se disa sekonda, pas së cilës ndodh kristalizimi spontan. Por kristalet e formuara në këtë rast shpërndahen në mënyrë të barabartë në të gjithë vëllimin e kampionit, dhe nuk ndodh një front kristalizimi, si dhe një rritje e pabarabartë e përqendrimit të kripërave. Përveç kësaj, kristalet që lindin në këtë rast janë në përmasa të vogla dhe në formë kokrrizore dhe për këtë arsye shkaktojnë relativisht pak dëmtime në qeliza.
Mirëpo, gjatë procesit të kristalizimit lirohet një sasi e konsiderueshme nxehtësie (nxehtësia latente e kristalizimit), si rezultat i së cilës kampioni nxehet - përfundimisht deri në temperaturën e kristalizimit, d.m.th. kur presioni ulet në atmosferë - në afërsisht 0 °C. Pas së cilës procesi i ngrirjes ndalet natyrshëm. Si rezultat, kur presioni u hoq, vetëm rreth 28% e ujit kishte kohë të kristalizohej, dhe pjesa tjetër mbeti e lëngshme.
Në mënyrë që i gjithë uji të kristalizohet, do të ishte e nevojshme të ftohet kampioni në një temperaturë prej afërsisht -80 ° C përpara se të ulni presionin - megjithatë, në këtë rast, akulli do të fillonte të formohej shumë më herët. M. Persidski e zgjidhi problemin duke ushtruar presion në mënyrë ciklike. Mostra, e cila ishte ngrohur deri në 0 °C pas lëshimit të parë të presionit, filloi të ftohet përsëri - njëkohësisht me një rritje të përsëritur të presionit. Herën tjetër që u "rivendos", pjesa tjetër e lëngut kishte kohë të ngrinte, e kështu me radhë. Si rezultat, ishte e mundur të arrihet kristalizimi pothuajse i plotë dhe "i padëmshëm" i ujit, pas së cilës temperatura mund të ulej në mënyrë të sigurtë në
–130 °C (dhe më poshtë) në presion normal atmosferik dhe mbajeni veshkën në këtë gjendje për një kohë të pacaktuar.
Gjatë shkrirjes, cikli u përsërit në rend të kundërt: veshka u ngroh në -28 ° C, pas së cilës presioni u rrit në 2000 atm. Në këtë rast, ndodhi një shkrirje relativisht uniforme e kristaleve të akullit. Pastaj kampioni u ngroh gradualisht me një ulje të njëkohshme të presionit.
Veshkat e ruajtura në këtë mënyrë, sipas autorëve të eksperimentit, "tregonin më pak shenja të dëmtimit të indeve sesa veshkat e ngrira me çdo metodë tjetër" - megjithëse ato nuk mbetën të zbatueshme...
Më pas, teknika e ngrirjes me presion të lartë u përdor në përgatitjen e mostrave biologjike për studime mikroskopike. Për të bërë një seksion mjaft të hollë, mostra duhet së pari të shndërrohet në një gjendje të ngurtë, por me ngrirjen konvencionale, strukturat e qelizave dëmtohen aq shumë sa praktikisht nuk ka asgjë për të studiuar ...
Presioni i disa mijëra atmosferave përdoret me sukses për ngrirjen e produkteve në industrinë ushqimore. Në këtë rast, ndiqen dy qëllime. Së pari, pas ruajtjes afatgjatë (dhe për rrjedhojë në temperaturën më të ulët të mundshme), shija e një produkti të ngrirë duhet të ndryshojë sa më pak të jetë e mundur nga e freskëta. Për këtë është gjithashtu e rëndësishme që qelizat të mos shkatërrohen gjatë ngrirjes, gjë që mund të arrihet deri në një masë duke ngrirë në një presion prej rreth 2 mijë atm. Një tjetër synim është sterilizimi i njëkohshëm i produktit, i cili arrihet, përkundrazi, duke shkatërruar qelizat e baktereve të pranishme në të. Për këtë, kërkohet një presion shumë më i lartë - 6 mijë atm. dhe me shume.
Autorët nuk janë të vetëdijshëm për përpjekjet e reja për të përdorur presionin e lartë për ruajtjen e kthyeshme të organeve ose organizmave të tërë, dhe megjithatë kjo rrugë duket shumë premtuese. Natyrisht, lind pyetja për efektet e dëmshme të presionit të lartë. Dihet se me rritjen graduale të tij në afërsisht 500 atm. qëndrueshmëria e qelizave nuk zvogëlohet. Në 6000 atm. dhe më shumë, pothuajse të gjitha qelizat vdesin, por vlerat e ndërmjetme mund të kenë efekte të ndryshme, në varësi të llojit dhe gjendjes së qelizave, përmbajtjes së ujit, kripërave dhe substancave të tjera në to, temperaturës, etj.
Megjithatë, mund të pritet që një rritje graduale e presionit në 2 mijë atm të kërkuar. nuk do të shkaktojë dëme në trup. Në të vërtetë, në përgatitje për ngrirje, objekti fillimisht ftohet në afërsisht 0 ° C (nëse është një krijesë e gjallë, ndalon frymëmarrjen) dhe vendoset në një dhomë të mbushur me lëng. Në vitin 1961, studiuesi amerikan S. Jacob e bëri atë nën presion prej rreth 1000 atm për 30 minuta. zemra e një qeni, e sapo nxjerrë nga trupi dhe që vazhdon të tkurret. Pas lehtësimit të presionit, rrahjet e zemrës rifilluan.
Është gjithashtu e rëndësishme që disa substanca krioprojtëse të veprojnë edhe si baroprotektorë, d.m.th., të mbrojnë qelizat nga ekspozimi ndaj presionit të lartë. Një krioprotektor "i mirë" jo vetëm që redukton pikën e ngrirjes së tretësirës, por gjithashtu stabilizon membranat qelizore, duke i bërë ato më elastike.
Natyrisht, është e nevojshme të zgjidhen një sërë problemesh: gjatë eksperimenteve, të përpunohet mënyra optimale e ftohjes, të zgjidhni krioprotektorë të veçantë, etj. Për shembull, kur kaloni nëpër cikle "ngjeshje me ftohje - çlirim presioni", ndodh ftohja. vetëm nga sipërfaqja e objektit. Kjo çon në faktin se akulli do të formohet në periferi, ndërsa në qendër, përkundrazi, akulli ekzistues mund të shkrihet për shkak të rritjes së presionit. Kjo mund të luftohet ose duke ulur temperaturën më ngadalë (dhe duke e lejuar objektin të ftohet në mënyrë më të barabartë) ose duke rritur përqendrimin e substancave krioprojtëse në shtresat e jashtme. Në këtë rast, nuk është e nevojshme të rritet presioni në vlerat maksimale. Është e mundur, duke rritur numrin e cikleve, të mbetet brenda kufijve të njohur të sigurt prej 500-1000 atmosferash.
Për më tepër, siç treguan eksperimentet e Smith me hamsterët e artë, vitrifikimi i vetëm rreth 40% të ujit (dhe kristalizimi i pjesës tjetër) mund të jetë i mjaftueshëm për kriopruajtje të kthyeshme.
Pra, të dhënat e disponueshme na lejojnë plotësisht të shpresojmë për përdorimin e presioneve të larta për të kontrolluar kristalizimin e ujit të lirë dhe kriopruajtjen e objekteve të mëdha biologjike, organeve, madje edhe organizmave të tërë. Puna në këtë drejtim po kryhet në Institutin e Biofizikës Qelizore të Akademisë së Shkencave Ruse (Laboratori i Kriopruajtjes së Burimeve Gjenetike nën udhëheqjen e E.N. Gakhova) së bashku me Institutin e Teknologjive Biomjekësore dhe Institutin Shtetëror të Kërkimeve VT me emrin . S.A. Vekshinsky.
Grafiku (shih Figurën 3) tregon gjithashtu se pika e vlimit të tretësirës është më e lartë se pika e vlimit të një tretësi të pastër. Pika e vlimit është temperatura në të cilën presioni i avullit të ngopur është i barabartë me presionin e jashtëm. Prandaj, është ndryshe: për ujin e pastër është temperatura T1, dhe për një zgjidhje është T2 .
Për tretësirat e holluara, ndërsa temperatura ulet (shih Figurën 3), tretësi i pastër fillon të kristalizohet i pari. Kjo ndodh kur presioni i avullit mbi tretësirën bëhet i barabartë me avullin e ngopur mbi kristal (linja O-B). Temperatura në të cilën fillon kristalizimi për një tretësirë të përbërjes C 1 korrespondon me temperaturën T 3, dhe për përbërjen C 2 - T 4 . Ndërsa përqendrimi i substancës së tretur rritet, pika e ngrirjes zvogëlohet, e cila është gjithashtu e dukshme në diagramin P-T (shih Figurën 3). .
Sa më e përqendruar të jetë tretësira, aq më larg lakoret e presionit të avullit mbi tretësirat janë nga kurba përkatëse e ujit. Prandaj, sa më i lartë të jetë përqendrimi i tretësirës, aq më i madh është ndryshimi midis temperaturave të vlimit ose ngrirjes së ujit dhe tretësirës.
Gjatë studimit të ngrirjes dhe vlimit të tretësirave, Raoult zbuloi se për tretësirat e holluara të jo-elektroliteve, rritja e pikës së vlimit dhe ulja e pikës së ngrirjes janë proporcionale me përqendrimin e tretësirës.
Ligji i dytë i Raoult:rritja e pikës së vlimit (pika e ulët e ngrirjes) e tretësirës në krahasim me pikën e vlimit (ngrirjes) të tretësit është proporcionale me përqendrimin molar të lëndës së tretur.
Matematikisht, këto ndryshime të temperaturës mund të llogariten duke përdorur formulat:
;
;
Ku K E - ebulioskopik (nga latinishtja ebullire - vlim) konstante tretës; Për Republikën e Kirgistanit– konstante krioskopike (nga greqishtja сrios - ftohtë) e tretësit; – rritja e pikës së vlimit; – ulje e temperaturës së ngrirjes; Me m– përqendrimi molal i substancës së tretur.
Nëse pikturoni Me m, atëherë formulat do të marrin formën:
Kuptimi fizik Konstantat ebulioskopike dhe krioskopike përcaktohen si më poshtë. Vlerat e tyre numerike tregohen , Sa gradë më lart ngrin një tretësirë një molare (që përmban 1 mol lëndë të tretur në 1000 g tretës) dhe sa gradë më poshtë ngrin në krahasim me pikat e vlimit dhe ngrirjes së një tretësi të pastër. Njësitë matëse janë 1 deg mol -1 kg.
Konstantet ebulioskopike dhe krioskopike nuk varen nga natyra e substancës së tretur, por janë karakteristika të tretësit. Vlerat e tyre për disa tretës janë dhënë në tabelën 1.
Tabela 1 - Konstantet krioskopike dhe ebulioskopike të disa tretësve
Metodat ebulioskopike dhe krioskopike për përcaktimin e masave molekulare të substancave bazohen në matjet e temperaturave të vlimit dhe ngrirjes së tretësirave. Këto dy metoda përdoren gjerësisht në kimi, pasi, duke përdorur tretës të ndryshëm, mund të përcaktohen peshat molekulare të substancave të ndryshme.
Për të përcaktuar masën molare të një solucioni të tretur, është e përshtatshme të përdoret marrëdhënia e mëposhtme:
Ku - një rritje në pikën e vlimit ose një ulje në pikën e ngrirjes së tretësirës në krahasim me karakteristikat përkatëse të një tretësi të pastër;
K – konstante ebullioskopike ose krioskopike.
Aftësia e tretësirave për të ngrirë në një temperaturë më të ulët se tretësi përdoret në përgatitjen e tretësirave me ngrirje të ulët, të cilat quhen antifriz. Antifrizi përdoret për të zëvendësuar ujin në radiatorët e motorëve të automobilave dhe avionëve në dimër. Mund të përdoren të ashtuquajturit komponentë kryesorë. alkoolet polihidrike - etilen glikol dhe glicerinë:
CH 2 - CH 2 CH 2 - CH 2 - CH 2
HE HE HE HE HE
glicerinë etilen glikol
Një tretësirë ujore e etilenglikolit (58 përqind ndaj peshës), për shembull, ngrin vetëm në një temperaturë prej minus 50 °C.
Osmoza
Kalimi spontan i një tretësi përmes një membrane gjysmë të përshkueshme që ndan një tretësirë nga një tretës ose dy tretësira me përqendrime të ndryshme të lëndës së tretur quhet nga osmoza . Osmoza shkaktohet nga difuzioni i molekulave të tretësit përmes një ndarjeje gjysmë të përshkueshme, e cila lejon që vetëm molekulat e tretësit të kalojnë. Molekulat e tretësit shpërndahen nga një tretës në një tretësirë ose nga një tretësirë më pak e përqendruar në një më të koncentruar, kështu që tretësira e koncentruar hollohet dhe lartësia e kolonës së saj h gjithashtu rritet (Figura 4).
Në ekuilibër, presioni i jashtëm balancon presionin osmotik. Në këtë rast, ritmet e tranzicionit përpara dhe të kundërt të molekulave përmes ndarjes gjysmë të përshkueshme bëhen të njëjta. Nëse presioni i jashtëm i aplikuar në një tretësirë më të koncentruar është më i lartë se p osmotik, d.m.th. p > p, atëherë shkalla e kalimit të molekulave të tretësit nga tretësira e koncentruar do të jetë më e madhe dhe tretësi do të zhvendoset në një tretësirë të holluar (ose të pastër tretës). Ky proces, i quajtur osmozë e kundërt , përdoret për të pastruar ujërat natyrore dhe të zeza, për të marrë ujë të pijshëm nga uji i detit.
Në mënyrë sasiore, osmoza karakterizohet nga presioni osmotik, i barabartë me forcën për njësi sipërfaqeje, e cila detyron molekulat e tretësit të depërtojnë përmes një ndarje gjysmë të depërtueshme. Presioni osmotik rritet me rritjen e përqendrimit dhe temperaturës së lëndës së tretur. Van't Hoff e sugjeroi këtë për presionin osmotik mund të zbatojmë ekuacionin e gjendjes së një gazi ideal:
Ku fq– presioni osmotik, kPa; Me- përqendrimi molar i tretësirës, mol/l; R- konstante universale e gazit, T- temperaturë absolute.
Osmoza luan një rol shumë të rëndësishëm në proceset biologjike, duke siguruar rrjedhjen e ujit në qeliza dhe struktura të tjera. Tretësirat me presion të njëjtë osmotik quhen izotonike. Nëse presioni osmotik është më i lartë se presioni ndërqelizor, atëherë ai quhet hipertonik, nëse është më i ulët se presioni ndërqelizor quhet hipotonik. Për shembull, presioni mesatar osmotik i gjakut në 36 °C është 780 kPa. Tretësirat hipertonike të sheqerit (shurupit) dhe kripës (shëllirë) përdoren gjerësisht për ruajtjen e ushqimit, pasi ato shkaktojnë largimin e ujit nga mikroorganizmat.
Shembuj të zgjidhjes së problemeve
Para se të zgjidhni problemet, duhet të kuptoni sa vijon:
– pika e ngrirjes së tretësirës është më e ulët se pika e ngrirjes së tretësit
– pika e vlimit të tretësirës është më e lartë se pika e vlimit të tretësit
– vlera gjithmonë pozitive dhe ndryshimi i temperaturës në shkallën Celsius dhe shkalla termodinamike Kelvin përkojnë numerikisht, d.m.th dhe .
Shembulli 1. Përcaktimi i pikës së vlimit dhe pikës së ngrirjes së një joelektroliti.
Përcaktoni pikën e vlimit dhe pikën e ngrirjes së një tretësire 2% të naftalinës (C 10 H 8) në benzen.
Zgjidhje
Bazuar në ligjin e dytë të Raoult, mund të shkruajmë:
Vlerën e konstantës ebulioskopike të benzenit, si dhe pikën e vlimit dhe ngrirjes së benzenit e marrim nga tabela 1. M (C 10 H 8) = 128 g/mol. Kujtojmë se përqendrimi në përqindje tregon numrin e gramëve të substancës së tretur në 100 g tretësirë, që do të thotë se masa e naftalinës është 2 g, dhe masa e tretësit, pra benzenit, është 100 – 2 = 98 g. , duke zëvendësuar vlerat e njohura në ekuacion, marrim
Meqenëse benzeni i pastër vlon në 80,1 °C dhe rritja e temperaturës është 0,4 °C, pika e vlimit të një tretësire të naftalinës në benzen është 80,5 °C.
Pika e ngrirjes së kësaj zgjidhjeje përcaktohet në të njëjtën mënyrë:
Pika e ngrirjes së benzenit është 5,5 °C. Ulja e temperaturës është 0,8 gradë, prandaj, pika e ngrirjes së një solucioni 2% të naftalinës në benzen është 4,7 °C.
Shembulli 2. Përcaktimi i përqendrimit joelektrolit në bazë të temperaturës së kristalizimit (vlimit) të tretësirave.
Përcaktoni pjesën masive të saharozës C 12 H 2 20 11 në ujë nëse dihet se pika e ngrirjes së kësaj tretësire është minus 0,21 °C.
Zgjidhje.
Nga të dhënat e problemit rezulton se breshër Për të përcaktuar pjesën masive të saharozës në tretësirë, përdorim ekuacionin
në të cilat zëvendësojmë vlerat e njohura: K KR - konstante krioskopike, K KR = 1,86 deg mol -1 kg, dhe masa molare e saharozës M(C 12 H 2 20 11) = 342 g/mol. Qëndrimi
është masa e lëndës së tretur për 1000 g tretës, atëherë
Ka 38,6 g saharozë për 1000 g tretës, kështu që për të përcaktuar pjesën masive të substancës së tretur, mund të përdorni formulën
ose bëni një proporcion:
1038,6 g tretësirë përmban 38,6 g saharozë;
100 g tretësirë – xg saharozë.
Prandaj, pjesa masive e substancës së tretur është 3.71%.
Shembulli 4. Përcaktimi i masës molare të një joelektroliti nga temperatura e kristalizimit (vlimit).
Një tretësirë jo elektrolit përmban 2,5 g lëndë të tretur në 25 g benzen dhe ngrin në 4,3 °C. Përcaktoni masën molare të substancës së tretur.
Zgjidhje
Duke përdorur këto kushte problemore dhe pikën e ngrirjes së benzenit plus 5,5°C, ne përcaktojmë breshër Masa molare e një lënde të tretur mund të përcaktohet nga relacioni
ku K KR është konstanta krioskopike e benzenit, K KR = 5,12 deg mol -1 kg.
g/mol.
Pyetje kontrolli
1 Çfarë presioni quhet presion i avullit të ngopur?
2 Shkruani shprehjet matematikore për secilin nga ligjet e Raoult dhe shpjegoni kuptimin fizik të sasive të përfshira në këto shprehje.
3 Sasi të barabarta ure CO(NH 2) 2 dhe saharozë C 12 H 22 O 11 u tretën në të njëjtën sasi uji në të njëjtat kushte. Për cilën zgjidhje do të jetë vlera më e madhe?
4 A është i njëjtë ulja e pikës së ngrirjes së tretësirave ujore 0,1 M të glukozës C 6 H 12 O 6 dhe ure CO (NH 2) 2?
Problemi 1. Për sa gradë do të rritet pika e vlimit të tretësirës ujore të ure CO(NH 2) 2 nëse në 300 g ujë treten 8,5 g lëndë?
Detyra 2. Llogaritni pjesën masive të metanolit CH 3 OH në një tretësirë ujore pika e ngrirjes së së cilës është minus 2,79 °C.
Problemi 3. Përcaktoni pikën e vlimit të një tretësire prej 1 g naftaleni C 10 H 8 në 20 g eter, nëse pika e vlimit të eterit është 35,6 °C, K E = 2,16 °C.
Problemi 4. Një tretësirë prej 1,05 g jo-elektroliti në 30 g ujë ngrin në
– 0,7°C. Llogaritni peshën molekulare të joelektrolitit.
Detyra 5. Llogaritni sasinë e etilenglikolit C 2 H 4 (OH) 2 që duhet shtuar në çdo kilogram ujë për të përgatitur antifriz me një pikë ngrirjeje minus 15 ° C.
Detyra 7. Për përgatitjen e antifrizit janë marrë 9 litra glicerinë C 3 H 5 (OH) 3 për 30 litra ujë. Cila është pika e ngrirjes së antifrizit të përgatitur? Dendësia e glicerinës është 1261 kg/m3.
Sisteme të shpërndara
Kimikatet mund të gjenden në formë të pastër ose në përzierje. Përzierjet, nga ana tjetër, mund të ndahen në homo- dhe heterogjene. Përzierjet homogjene njëfazore përfshijnë zgjidhje të vërteta (shih seksionin 1), në të cilat substanca e tretur paraqitet në formën e molekulave ose joneve, madhësitë e të cilave janë të krahasueshme me molekulat e tretësit dhe nuk kalojnë 1 nm. Përzierjet homogjene janë termodinamikisht të qëndrueshme.
Ndërsa madhësia e grimcave rritet, sistemi bëhet heterogjen, i përbërë nga dy ose më shumë faza me një ndërfaqe shumë të zhvilluar. Dhe, siç tregon praktika, një zonë tjetër e copëzimit të materies formon një grup të ri të vetive të qenësishme vetëm për këtë formë të organizimit të materies.
Edhe M.V. Lomonosov zbuloi në 1764 se tretësirat ngrijnë në një temperaturë më të ulët se tretësit e pastër. Një rënie në pikën e ngrirjes së një solucioni shoqërohet me një ulje të elasticitetit (presionit) të avullit të tretësit mbi tretësirën (një ndryshim në përqendrimin e lëngut qelizor në bimë drejt dimrit).
Pika e ngrirjes tretësira është temperatura në të cilën kristalet e tretësit janë në ekuilibër me një tretësirë të një përbërjeje të caktuar.
Diferenca Δt = t 0 ° - ti ° quhet ulje e temperaturës ngrirja e tretësirës dhe do të jetë më e madhe, aq më i lartë është përqendrimi i tretësirës. Kjo varësi shprehet në mënyrë sasiore me ekuacionin:
Δt = K С m (36)
ku Δt është ulja e temperaturës së ngrirjes së tretësirës;
Cm-përqendrimi molal;
K është koeficienti i proporcionalitetit, i quajtur konstante krioskopike tretës ose një ulje molale në pikën e ngrirjes së tretësirës.
Një metodë kërkimore e bazuar në matjen e uljes së pikës së ngrirjes së tretësirave quhet metoda krioskopike.
Tretësirat ngrijnë në temperatura më të ulëta dhe zihen në temperatura më të larta se tretësit e pastër.
Për tretësirat e jo-elektroliteve, sipas ligjit të Raoult-it, ulja e pikës së ngrirjes së tretësirës është drejtpërdrejt proporcionale me përqendrimin molal (ekuacioni 36).
Rritja e pikës së vlimit të tretësirës është gjithashtu drejtpërdrejt proporcionale me përqendrimin molal:
Δt kip = EC m (37)
E - konstante ebulioskopike.
Presioni osmotik i tretësirave llogaritet duke përdorur formulën Van't Hoff:
Р osm =RTC m (38)
R - konstante universale e gazit 8.314 kJ/mol deg
T - temperatura, 0 K, C m - përqendrimi molar.
Pyetje kontrolli
1.Cili është thelbi i ligjit të shpërndarjes?
2. Nxjerrja e ligjit të shpërndarjes.
3. Zbatimi i ligjit të shpërndarjes.
4. Në cilin kusht të ekuilibrit fazor bazohet derivimi i ligjit të shpërndarjes?
5.Cilët faktorë ndikojnë në vlerën e koeficientit të shpërndarjes?
6.Cili ekstraktim është më efektiv: i vetëm apo i pjesshëm?
Detyrat
| Numri i punes | m g H 2 O | m g SUHAROSE | Numri i punes | m g H 2 O | m g SUHAROSE |
| 60 | .2 | ||||
| 55 | |||||
NË ÇFARË TEMPERATURË DO TË VLOJEN TRIRSITËT QË PËRMBAJNË M g UJË m g SHEQER. NDËRTO NJË GRAFIK TË VARËSISË SË temperaturës së vlimit nga përmbajtja e substancës së tretur në tretësirë
| Numri i punes | m g H 2 O | m g SUHAROSE | Numri i punes | m g H 2 O | m g SUHAROSE |
| 60 | |||||
| 55 | |||||
| Numri i punes | m g H 2 O | m g GLUKOZA | Numri i punes | m g H 2 O | m g GLUKOZA |
| 4,57 | 10,01 | ||||
| 12,57 | |||||
| 5,56 | |||||
| 14,40 | |||||
| 8,32 | 11,54 |
PËRCAKTO TEMPERATURËN E NGRIRJES TË NJË TRETJESË NË m g H 2 O QË PËRMBAN m g GLUKOZË KONSTRUKTON NJË GRAFIK TË VARËSISË SË temperaturës së ngrirjes nga përmbajtja e substancës së tretur në tretësirë.