تغییرات در توابع ترمودینامیکی در طول جذب ترمودینامیک فرآیندهای جذب طراحی سخت افزاری فرآیندهای جذب
جذب(از لاتین ad - on، at و sorbeo - absorb)، تغییر (معمولاً افزایش) در غلظت یک ماده در نزدیکی سطح مشترک فاز ("جذب روی سطح"). علت جذب- اشباع نشدن پیوندهای بین مولکولی نزدیک سطح، به عنوان مثال. وجود جذب درست نیروی. جسمی که چنین میدانی ایجاد میکند جاذب، مادهای که مولکولهای آن قابل جذب باشد جاذب و مادهای که قبلاً جذب شده است را جاذب میگویند. روند معکوس جذب، دفع نامیده می شود.
ماهیت میدان جذب متفاوت است. اگر جذب با پیوندهای واندروالسی همراه باشد، پس جذبفیزیکی نامیده می شود. اگر اینها پیوندهای ظرفیتی هستند، یعنی. جذببا تشکیل سطح رخ می دهد ترکیبات شیمیایی، آن جذببه نام شیمیایی، یا جذب شیمیایی. ویژگی های مهم جذب شیمیایینشان می دهد: برگشت ناپذیری، اثرات حرارتی بالا (صدها کیلوژول در مول)، شخصیت فعال. انواع متوسط زیادی وجود دارد جذببین فیزیکی و شیمیایی جذب. مثلا، جذبناشی از تشکیل پیوندهای هیدروژنی است. همچنین ممکن است انواع متفاوتفیزیکی جذب. رایج ترین اتفاق، وقوع نیروهای جاذبه بین مولکولی پراکنده است، به دلیل این واقعیت که آنها برای جاذب هایی با سطحی با هر ماهیت شیمیایی (غیر اختصاصی) تقریباً ثابت هستند. جذب). فیزیکی جذبممکن است توسط نیروهای الکترواستاتیکی (برهمکنش بین یون ها، دوقطبی ها یا چهارقطبی ها) ایجاد شود. که در آن جذبتوسط ماهیت شیمیایی مولکول های جاذب تعیین می شود (به اصطلاح خاص جذب). هندسه رابط نیز نقش مهمی دارد. اگر سطح صاف است، پس آن است جذبسطح باز، در مورد سطح کمی یا به شدت خمیده - حدود جذبدر منافذ جاذب
در تئوری جذبتمایز بین استاتیک (سیستم جاذب-جاذب در تعادل ترمودینامیکی است) و سینتیک (هیچ تعادلی وجود ندارد).
استاتیک جذب
ترمودینامیک جذب
.مبانی ترمودینامیک جذبتوسط جی گیبز در دهه 70 ایجاد شد. قرن نوزدهم به گفته گیبس، در یک سیستم دو فازی تعادلی در نزدیکی رابط فاز، مقداری تغییر در مقادیر محلی همه خواص گسترده (به جز حجم) وجود دارد. با این حال، فازها تا سطح هندسی خاصی که آنها را از هم جدا می کند، همگن در نظر گرفته می شوند. بنابراین، ارزش هر ویژگی گسترده برای سیستم به عنوان یک کل برابر با مجموع مقادیر این ویژگی در فازهای همگن و . این تفاوت به فاز سطحی دو بعدی مرتبط با سطح جداکننده نسبت داده می شود. زیرا پس فاز سطحی ضخامت ندارد V 0=+ و =-، جایی که V-جلد.
ایده های ارائه شده به ما اجازه می دهد تا معادله ترمودینامیکی اساسی را به شکل زیر کاهش دهیم:
که در آن G انرژی آزاد گیبس، S آنتروپی، کشش سطحی، s ناحیه واسط و n است. من- پتانسیل شیمیایی مربوطه و تعداد مول من-آن جزء شاخص مقدار خاصیت مربوطه را در فاز سطحی نشان می دهد. تبدیل لژاندر به شما امکان می دهد معادله (1) را برای شرایط همدما تغییر دهید:
کمیت گیبس نامیده می شود جذبو با نماد G (به صورت mol/cm2 بیان می شود) مشخص می شود. برای یک سیستم دو جزئی:
موقعیت سطح تقسیم را می توان خودسرانه انتخاب کرد. به طور خاص، انتخاب این موقعیت می تواند شرط Г 1 = 0 را برآورده کند. به چنین سطحی هم مولکولی می گویند. برای آن، نام Г 2 = Г 2 (1) معرفی شده است. این به معادله اصلی جذب گیبس اشاره دارد:
اگر جاذب در یکی از دو فاز کاملاً نامحلول باشد =const و انتقال از رابطه (2) به رابطه (3) نیازی به شرط Г 1 = 0 نیست. بنابراین، گیبس جذبمقدار اضافی یک جزء معین در یک سیستم دو فاز واقعی در مقایسه با سیستمی است که در آن هر دو فاز تا سطح تقسیم کاملاً همگن هستند. علاوه بر مقادیر اضافی گیبس جذب، نقش زیادی در نظریه او ایفا می کند جذب، به عنوان محتوای کامل جزء درک می شود مندر فضای دبلیو، که در آن نیروهای جذب خود را نشان می دهند. نشان دادن مطالب کامل توسط آو با فرض اینکه جزء منکاملاً نامحلول در یکی از فازهای حجیم، داریم:
جایی که ج من-تمرکز من-از آن جزء در فاز حجیم. در ج کوچک من:
جذبمی تواند در هر رابط بین هر دو فاز، به ویژه در یک رابط سیال-سیال (مایع-گاز، مایع-مایع) یا جامد-سیال (جامد-گاز، جامد-مایع) رخ دهد. در سیستم های سیال سیال، a را می توان به عنوان یک تابع اندازه گیری کرد و G 2 (1) را می توان به صورت تجربی با استفاده از رابطه (3) تعیین کرد. در حالت دوم، تعیین G 2 (1) با هر روش n اندازه گیری می شود من 0، و غلظت مولفه i در این حجم ها. از اینجا G را محاسبه می کنیم من(1). این روش حجمی (یا حجمی) نامیده می شود. با روش وزنی (گرانشی)، مقدار من-آن جزء در رابط.
ایزوترم جذب
.در یک سیستم جذب تعادلی، پارامترهای تعیین کننده تعادل هستند یک منفشارهای جزئی آر(یا با من) و دما تی. آنها با به اصطلاح معادله حرارتی مرتبط هستند:
در جذبجذب فردی ( من=1) این معادله به شکل زیر است:
سه مورد خاص معادله حرارتی(چه زمانی تی، ریا آ- ثابت ها) نقش ویژه ای در نظریه دارند جذب:
a=- معادله ایزوترم جذب,
T=- معادله ایزوبار جذب,
R-- معادله ایزوستر جذب.
نوع خاص توابع با ویژگی های سیستم مورد بررسی تعیین می شود. اگر یکی از آنها، برای مثال، برای هر مقدار شناخته شده است T=پس بدیهی است که دو مورد دیگر نیز شناخته می شوند. در این صورت لزومی ندارد که نوع تحلیلی وابستگی ها مشخص باشد. آنها را می توان به صورت تجربی به عنوان مجموعه ای از مقادیر مشخص کرد الف، صو تی.
در تئوری جذبمعمولاً در مورد شکل تابع تصمیم گیری می شود آ=(p) g، i.e. در مورد معادله ایزوترم جذب. این مشکل به دلیل اثرات حرارتی همراه است جذب. هنگام محاسبه تغییرات در مقادیر توابع اصلی ترمودینامیکی در صورت انتقال dnمول جاذب از فاز توده به فاز سطحی در یک سیستم تعادلی در p =فقط دو حالت ممکن است: در حالت اول، فقط تبدیل جاذب به جاذب در نظر گرفته می شود، زیرا جاذب در جذباز نظر ترمودینامیکی بدون تغییر است و نقش آن این است که به عنوان منبع میدان جذب عمل کند. در مرحله دوم، تغییر در جاذب نیز در نظر گرفته شده است.
از آنجایی که سیستم در حالت تعادل قرار دارد، پتانسیل شیمیایی ماده جاذب و جاذب یکسان است. آنتروپی جذب به دلیل کاهش تحرک مولکول ها با جذبآنتروپی کمتر جاذب بنابراین، با یک جاذب بی اثر، آنتالپی همیشه منفی است، یعنی. جذبگرمازا. در نظر گرفتن تغییر در آنتروپی جاذب ممکن است این نتیجه را تغییر دهد. به عنوان مثال، هنگامی که موادی که در آنها پلیمر متورم می شود توسط پلیمرها جذب می شوند، آنتروپی دومی (به دلیل افزایش تحرک ماکرومولکول ها) می تواند آنقدر افزایش یابد که جذبگرماگیر می شود. در ادامه مقاله فقط گرمازا را در نظر می گیرد جذب.
گرمای انتگرال، دیفرانسیل، ایزوستریک و متوسط وجود دارد جذب. گرمای یکپارچه سبرابر با از دست دادن آنتالپی (در V= const - انرژی داخلی ثابت) هنگام تغییر جذباز جانب یک 1قبل از یک 2(در یک مورد خاص ممکن است 1 = 0 باشد): Q= -(H 2 - H 1). این مقدار معمولاً مربوط به جرم جاذب است و بر حسب J/kg بیان می شود.
حرارت دیفرانسیل q(J/mol) برابر افت آنتالپی است dHوقتی تغییر می کند آبر دا. با نگرش بیان می شود q = - (dH/da). بدیهی است که
گرمای ایزوستریک q st برابر است با:
تفاوت بین حجم مولی ماده جاذب و جاذب کجاست. می توان نشان داد که  برای یک جاذب گاز ایده آل:
برای یک جاذب گاز ایده آل:
معنی مقدمه qsiاین است که تعیین آن به داده های کالریمتری (مانند سو q) و با استفاده از رابطه (9) بر اساس نتایج اندازه گیری قابل محاسبه است جذب. گرمای متوسط نیز معرفی شده است س(J/mol):
با رشد آپارامتر سهمیشه افزایش می یابد، الف qممکن است کاهش، افزایش یا بدون تغییر باقی بماند. با رشد آبا سطح غیر یکنواخت جذبدر مناطقی که به طور فزاینده ای فعالیت کمتری دارند، رخ می دهد که منجر به کاهش می شود q. با این حال، این باعث کاهش میانگین فواصل بین مولکول های جذب شده می شود که در نتیجه نیروهای جاذبه بین آنها افزایش می یابد. qافزایش. رابطه بین دو اثر ذکر شده سیر وابستگی را تعیین می کند q=f(a). برای خیلی بزرگ آنیروهای دافعه در این منطقه شروع به غلبه می کنند qهمیشه با رشد کاهش می یابد آ.
برای پوشش های سطحی بسیار کوچک، معادله ایزوترم جذبشکل معادله هنری دارد:
که در آن K H ضریب هنری است. در واقع، در بسیار کوچک آلایه جذب شبیه یک گاز ایده آل دو بعدی است، بنابراین معادله حالت آن به شکل زیر است: = RT،جایی که فشار دو بعدی است، مساحت اشغال شده توسط یک مول از یک ماده است. از اینجا با در نظر گرفتن =- و با استفاده از رابطه (3)، معادله (12) را بدست می آوریم. معادله هانری این را ایجاب می کند qثابت بود در پر کردن های بزرگ، این معادله از بین می رود. بنابراین، G. Freundlich (1906) برای توصیف ایزوترم ها پیشنهاد کرد جذبمعادله تجربی زیر (معادله فروندلیچ):
جایی که کو n- ثابت ها این معادله اغلب به عنوان یک فرمول درون یابی استفاده می شود، هرچند برای کوچک آربه معادله (12) تبدیل نمی شود، بلکه برای خیلی بزرگ است آرمنجر به افزایش نامحدود می شود که با تجربه سازگار نیست آ.
نظریه ایزوترم دقیق جذبتوسط I. Langmuir (1914-18) ایجاد شد. نظریه بر اساس موارد زیر است. مدل: 1) سطح جاذب مجموعه ای از مراکز فعال انرژی یکسان است که مولکول های جاذب روی آن ها جذب می شوند (محلی سازی می شوند). 2) فقط یک مولکول در یک مرکز جذب می شود، یعنی. در جذبفقط یک جاذب تشکیل می شود. لایه (تک لایه)؛ 3) جذبدر این مرکز تاثیری ندارد جذبدر مراکز دیگر، یعنی تعامل. مولکول های جذب شده را می توان نادیده گرفت.
مدل لانگمویر نامیده می شود تک مولکولی موضعی جذبروی یک سطح همگن معادله ایزوترم جذب، مربوط به این مدل، m.b. به دست آمده با استفاده از decomp. روشهای (مولکولی-سینتیکی، ترمودینامیکی، آماری-ترمودینامیکی). بله، جذب می شود. تعادل را می توان به صورت زیر بیان کرد. طرح:
بدون مولکول جذب می کند. در گاز + جذب. مرکز فاز مجتمع (مرکز شلوغ)
غلظت مولکول ها در یک گاز با p یعنی غلظت آزاد متناسب است. مراکز قدر ( a t - a),جایی که و تی -تعداد کل مراکز، a-تعداد مراکز اشغال شده، غلظت جذب. مجتمع های اندازه جذببنابراین، ثابت تعادل: K p = p (a t -آ)/ جذباز اینجا معادله لانگمویر را بدست می آوریم:
جایی که ب-تی. تماس گرفت جذب می کند. ضریب، برابر K r -1.در منطقه با فشار بسیار پایین bр" 1 و a = (a m b)p،که با معادله هنری مطابقت دارد که در آن ک اچ= a m b.در ناحیه فشارهای بسیار بالا bр 1 و aa t;که در آن جذبدیگر به فشار بستگی ندارد ثابت تعادل b -1مربوط به مقدار استاندارد پتانسیل واکنش ایزوباریک است:
مدل لانگمویر نیاز به دیفرانسیل دارد گرما و آنتروپی جذببه درجه پر شدن سطح بستگی ندارد.
معادله (14) یک عبارت دقیق مطابق با مدل لانگمویر است، اما به ندرت به صورت تجربی توجیه می شود، زیرا خود مدل ایده آل شده است. جذبدکترین از جذباز دهه 20 قرن 20 در وسایل درجه بر اساس تضعیف یا حذف یک یا آن فرض لانگمویر ساخته شده است جذب
لانگمویر قبلاً راهی برای توصیف پیشنهاد کرده است جذبروی یک سطح غیر یکنواخت (یعنی با این فرض که همه مراکز یکسان نیستند). با ترکیب مراکز یکسان در گروه ها و فرض اینکه معادله (14) برای هر گروه قابل اجرا است، می توانیم فرض کنیم که جذبدر کل سطح با مجموع عبارت های معادله (14) بیان می شود:
با فرض اینکه تعداد جذب ها. مراکز m.b. توسط یک تابع پیوسته توزیع بر اساس مقادیر آزاد توصیف می شود. انرژی، Ya.B.Zeldovich از فرمول (16) برای تابع نمایی معادله ای از نوع (13) به دست آورد.
جذبدر سطوح ناهمگن - فصل بزرگی از نظریه جذباصلی آن حل مسئله معادله انتگرال:
جایی که f(ص) - باصطلاح تجربی ایزوترم جذب، - یک یا تابع دیگر توزیع تعداد مراکز با توجه به مقادیر آزاد. انرژی،( ب، ص)-ایزوترم محلی جذب، که معمولاً ایزوترم لانگمویر در نظر گرفته می شود جذب
تلاش های زیادی برای رد فرض دوم لانگمویر صورت گرفته است. جذبدر این مسیر، نظریه چند مولکولی جذب، پیشنهاد شده توسط S. Brunauer، P. Emmett و E. Teller (نظریه BET). این تئوری فرض می کند که در دماهای کمتر از دمای بحرانی، هر مولکول در لایه اول جذب می شود (گرمای جذب q i،) مرکز مولکول های تشکیل دهنده لایه دوم و غیره است. اعتقاد بر این است که گرما جذبدر تمام لایه ها به جز لایه اول برابر با گرمای چگالش است.این مدل به این معادله منجر می شود:
جایی که c = exp[(q 1 -)/RT]. معادله (18) در مختصات a، p/p sمربوط به یک منحنی S شکل است. در مختصات p/p s،
ایزوترم جذبمطابق رابطه (18) باید خطی باشد. شیب این خط مستقیم (معمولاً در محدوده 0.05 p/p s 0.30) و قطعه بریده شده توسط آن در محور ارتین به ترتیب مقادیر را نشان می دهد. یک تیو با.انتشار گسترده نظریه BET به این دلیل است که نویسندگان آن در واقع معتقدند جذبغیر موضعی، ثابت را شناسایی کنید یک تینه با تعداد جاذب های گسسته. مراکز و با تعداد مولکول های جذب کننده در لایه اول با متراکم ترین بسته بندی (در آر= ps).بنابراین، با معرفی ایده مساحت اشغال شده توسط یک مولکول در این لایه، می پذیریم:
جایی که s-سطح سطح را جذب می کند جذببه عنوان یک قاعده، برای این منظور ایزوترم اندازه گیری می شود جذبنیتروژن و فرض کنید که برای مولکول آن = 0.162 نانومتر 2. یک محاسبه مشابه اغلب انجام می شود سبا توجه به مدل لانگمویر صحیح نیست، زیرا این روش بدیهی است که فقط برای غیر محلی قابل استفاده است جذب
وارد نظریه چند مولکولی جذبسهم عمده ای توسط J. de Boer انجام شد، که به طور تجربی نشان داد که وابستگی میانگین تعداد لایه ها (بالاتر از لایه اول) به تمام سطوحی که از نظر خواص شیمیایی مشابه هستند. طبیعت، از p/p sبا یک منحنی جهانی (به اصطلاح منحنی t) بیان می شود. این همچنین تخمین سطح جاذب ها را ممکن می سازد.
تلاش شده است تا تعامل در مدل لانگمویر در نظر گرفته شود. بین جذب. مولکول ها. بنابراین تی هیل و جی دی بوئر با توجه به این که معادله حالت adsorbc. لایه یک آنالوگ دوبعدی از معادله واندروالس است، ما موارد زیر را به دست آوردیم. معادله ایزوترم جذب:
کجا = a/a t، aو b-ثابت معادله واندروالس جذب R. Fowler و E. Guggenheim با در نظر گرفتن تعامل. جذب. مولکول ها، معادله را به دست آوردیم:
جایی که یک ثابت مرتبط با برهمکنش زوجی مولکول ها است.
مکانیسم دیگری وجود دارد که منجر به مکمل شدن می شود. جذبجاذب ها زیر ارزش بحرانی خود هستند. دما روی جاذب های متخلخل در مقادیر نسبتاً بالا p/p s .این تراکم مویرگی است. اگر منیسک مقعر از ماده جاذب در منافذ تشکیل شده باشد، تراکم در آن شروع می شود. p/p s طبق معادله کلوین:
کشش سطحی ماده جاذب کجاست، V -خودحجم مولی، شعاع r انحنای منیسک جذبتراکم مویرگی منجر به افزایش شدید ایزوترم می شود جذبدر این مورد، به اصطلاح. جذب می کند. هیسترزیس، یعنی عدم تطابق جذب و دفع شاخه های ایزوترم به عنوان یک قاعده، این به دلیل این واقعیت است که شکل منیسک زمانی جذبو دفع منطبق نیستند.
تراکم مویرگی برای تعیین اندازه منافذ جاذب استفاده می شود جذبمطابق رابطه (22) برای هر مقدار p/p sشعاع انحنای منیسک را محاسبه کنید جذباز آن، با در نظر گرفتن ضخامت جاذب ها. لایه (به عنوان مثال، در امتداد منحنی t)، شکل ناحیه انتقال از لایه به منیسک و وابستگی به انحنا در r بسیار کوچک , اندازه خطی (شعاع مؤثر r ef) منافذ پر شده را در یک معین پیدا کنید p/p s .حجم چنین منافذی با افزایش تعیین می شود جذبدر این نقطه ایزوترم با استفاده از داده های به دست آمده، منحنی توزیع حجم منافذ بر روی شعاع آنها ساخته می شود. این روش در r ef 1.5 نانومتر قابل اجرا است. معمولاً محاسبه با استفاده از دفع انجام می شود. شاخه های ایزوترم، اما مدرن دقیق تر. این نظریه مستلزم در نظر گرفتن هر دو شاخه برای ساخت منحنی است.
نظریه پتانسیل جذب و تئوری پر شدن حجمی ریز منافذ.مدل جذبکه اساساً متفاوت از لانگمویر است، در سال 1914 توسط M. Polyaki پیشنهاد شد. طبق این مدل، یک جاذب بالقوه در نزدیکی سطح جاذب وجود دارد. میدان نیرویی که با فاصله از سطح کاهش می یابد. در نتیجه فشار جاذب برابر p دور از سطح در نزدیکی آن افزایش می یابد و در فاصله ای به مقدار ps می رسد که در آن جاذب متراکم می شود. حجم لایه بین رابط و geome. محل نقاط که در آن p = p s، پر از مایع، که مقادیر فیزیکی معمولی به آن اختصاص داده می شود. خواص مایع حجیم ایزوترمال برگشت پذیر کار و جذب نیروهای تعیین شده توسط معادله = RTlnp/p s، نامیده می شود. جذب می کند. پتانسیل، و کل مفهوم یک نظریه بالقوه است جذببرای حجم معین Vجذب می کند. لایه به طور بالقوه مستقل از دما است (به دلیل استقلال نیروهای پراکندگی از دما). این عدم تغییر دما امکان محاسبه مجدد را فراهم می کند جذباز یک دما به دما دیگر، اگرچه معادلات همدما جذببر اساس نظریه ارائه شده امکان استنباط وجود نداشت. مدل پلیانی به طور گسترده و با موفقیت توسط بسیاری مورد استفاده قرار گرفته است. با این حال، توسط نویسندگان، حاوی دو ماده بسیار آسیب پذیر است: 1) این فرض که بهترین ها جذب می شوند. فیلم دارای ارزش فیزیکی طبیعی است. خواص مایع حجیم (این فرض توسط آزمایشات تأیید نشد). 2) عدم تغییر دما تابع =f(V)،تئوری زیربنایی تقریباً با آزمایش فقط برای جاذبهای بسیار ریز متخلخل تأیید شد.
با استفاده از نظریه پتانسیل، M.M. دوبینین نظریه پر کردن حجمی ریز منافذ (VFM) را پیشنهاد و توسعه داد. فرض شده است که این نظریه فقط برای جاذب های ریز متخلخل قابل استفاده است. ویژگی چنین جاذب هایی که در آنها اندازه منافذ خطی r1 نانومتر است، این است که کل حجم منافذ آنها با جاذب ها "پر" شده است. رشته. بنابراین، زمانی که جذبآنها نه لایه به لایه، بلکه به صورت حجمی پر می شوند. مقدار در مورد مورد بررسی جذب نیست. پتانسیل، و تا علامت شیمیایی. پتانسیل جذب، اندازه گیری شده از سطح شیمیایی. پتانسیل یک مایع معمولی در همان دما کل مجموعه منافذ جاذب به سه دسته تقسیم می شود: ریز منافذ ( r 0.6 نانومتر)، مزوپورها (0.6 نانومتر تا 20 نانومتر) و درشت منافذ ( r 20 نانومتر). جذبدر ریز منافذ بر اساس طرح TOZM رخ می دهد، یعنی. به صورت حجمی، در مزوپورها - با توجه به مکانیسم پر شدن لایه به لایه، که توسط تراکم مویرگی تکمیل می شود. ماکروپورها در طول جذب هیچ نقشی در تعادل ندارند.
با ارائه ایده ای از توزیع حجم منافذ بر اساس مقادیر شیمیایی. جذب پتانسیل در آنها، M.M. Dubinin و L.V. Radushkevich معادله ایزوترم جذب TOZM را به دست آوردند که معمولاً در زیر نوشته می شود. فرم:

جایی که پلی اتیلنو یک پارامتر 0 ( a 0 = aدر p = ps). وابستگی به دما آ 0:
کجا = -(da 0 /dT)؛ یک 0 0 = یک 0در T = T 0. گزینه ها پو Eعملاً مستقل از دما در بیشتر موارد پ= 2. فقط برای مواردی که حرارت اولیه جذببسیار بزرگ n > 2.برای محاسبه مجدد ایزوترم ها جذباز یک جاذب به ماده دیگر تقریباً فرض می شود که E 1 /E 2 P 1 /P=و یک 01 /a 02 V 1 /V 2، که در آن P من-پاراچر، V i -حجم مولی جاذب جذب
هر جاذب ریز متخلخل با دو پارامتر با TOZM مشخص می شود: W-حجم ریز منافذ ( W 0 = = a 0 V 0) و E 0 - مشخصه. انرژی؛ W 0و E 0 به عنوان یک جاذب استاندارد، معمولاً بنزن شناخته می شوند.
با استفاده از این ایده که در یک جاذب واقعی منافذ با اندازه های مختلف وجود دارد و معرفی توزیع مقادیر E sپراکندگی برابر با F. Steckley یک تعمیم از معادله (23) را پیشنهاد کرد که معادله Dubinin-Steckley نامیده می شود:

جایی که B 0 -ثابت مرتبط با Eدر معادله (23) و y= ![]() . زیرا در جاذب ها تکنولوژی بیشتر جاذب های میکرو متخلخل (کربن های فعال، زئولیت ها، خشکی ژل های متخلخل ریز) به طور گسترده ای گسترش یافته اند؛ TOZM نه تنها در کاربردهای فیزیکی و شیمیایی استفاده می شود. تحقیق، بلکه در محاسبات مهندسی.
. زیرا در جاذب ها تکنولوژی بیشتر جاذب های میکرو متخلخل (کربن های فعال، زئولیت ها، خشکی ژل های متخلخل ریز) به طور گسترده ای گسترش یافته اند؛ TOZM نه تنها در کاربردهای فیزیکی و شیمیایی استفاده می شود. تحقیق، بلکه در محاسبات مهندسی.
جذب مخلوط گاز و مایع در عمل، ما همیشه نه با یک جاذب فردی، بلکه با مخلوطی از گازها یا محلول های مایع سروکار داریم. بنابراین، تعمیم نظریه لازم است جذبدر مورد جذب چند جزئی جذبدر اصل، شما می توانید از هر مدلی شروع کنید جذبو آن را به این مورد تعمیم دهید. در جذبمخلوط گاز، این امر نه تنها با پیچیده کردن معادلات، بلکه با اضافه کردن اضافات به آنها به دست می آید. تجربی پارامترهای مربوط به یا با تعامل. مولکول های غیر مشابه یا به طور کلی با تأثیر برخی از مواد بر روی ضریب. فعالیت دیگران فقط مدل لانگمویر به ما اجازه می دهد تا معادله ایزوترم را بدست آوریم جذبمخلوط های بدون پارامتر در معادلات برای جذبآیتم های فردی برای انجام این کار، کافی است در نظر بگیرید که در طول جذب kth جزء از مخلوط مناجزای بخشی از جاذب ها مراکز m.b. توسط مولکول های دیگر اشغال می شود. از همین رو:
چه زمانی جذبمحلول های مایع، صرف نظر از غلظت آنها، کل سطح جاذب پر می شود جذبدر نتیجه جذبمولکول های جزء kth با جابجایی تعداد معینی از مولکول های اجزای باقی مانده همراه است، یعنی. جذبماهیت رقابتی دارد
مولکولی و یونی وجود دارد جذبراه حل ها اولین مورد زمانی رخ می دهد که جذبمحلول های غیر الکترولیت ها، محلول دوم الکترولیت ها. مولکولی جذب، به عنوان یک قاعده، بیان می شود مقادیر بیش از حد. ماهیت رقابتی جذبتعیین می کند که ارزش آ MB. هم مثبت و هم منفی بیان کننده جذب من-از آن جزء به عنوان تابع کسر مولی آن در محلول x من-، ما داریم که G من= O در x من= 0 و x من = 1 (تغییر احتمالیحجم ماده در جاذب ها لایه نادیده گرفته شده است). بنابراین ایزوترم جذبیک یا چند دارد افراط.
معادله ایزوترم جذبمحلولهای دوتایی غیرالکترولیتها که بهطور قابل اعتمادی از نظر ترمودینامیکی اثبات شدهاند، به شکل زیر است:

جایی که زیرنویس s میزان جذب را نشان می دهد. فاز، - ( dn s 2 / dn s 1) نشان می دهد که چند مول از جزء دوم با یک مول جزء اول جابجا شده است؛ تفاوت بین اصطلاحات (قطعات استاندارد) ماده شیمیایی. بالقوه، فقط به دما بستگی دارد.
پایه ای مشکل استفاده از این و تعدادی معادله ایزوترم دیگر جذب- روشن شدن وابستگی ضریب. فعالیت اجزاء در جذب لایه از ترکیب آن جذبمهمترین سوال هنگام استفاده جذببرای جداسازی یا خالص سازی مواد - انتخاب یک جاذب انتخابی در رابطه با محلول جزء معین جذب
یونی جذب، به عنوان یک قاعده، معادل نیست جذبمواد غالب از محلول الکترولیت روی سطح جذب می شوند. کاتیون ها یا آنیون ها با تشکر از برق نیروهای (کولن) روی سطح شکل می گیرد دو لایه الکتریکی
اگر جاذب حاوی یون یا عملکردهای سطحی باشد. گروه هایی که قادر به یونیزاسیون در یک حلال هستند، سپس تبادل یونی بین جاذب و محلول الکترولیت رخ می دهد. جاذب در این مورد نامیده می شود. یونیت
سینتیک جذب
جذبمانند هر فرآیند واقعی، در زمان رخ می دهد. بنابراین نظریه کامل جذبباید شامل بخشی در مورد سینتیک باشد جذبعمل ابتدایی جذبتقریباً فوراً انجام می شود (استثنا جذب شیمیایی است). بنابراین، وابستگی های زمانی جذبدر اصل تعیین می شوند با مکانیسم انتشار، یعنی تامین جاذب به سایت جذباگر جذبدر یک سطح باز آنی نیست، چنین فرآیندی در ناحیه انتشار خارجی رخ می دهد. علاوه بر این، قوانین انتشار خاص نیست جذبدر مورد جاذب های متخلخل، علاوه بر خارجی انتشار، داخلی شروع به ایفای نقش مهمی می کند. انتشار، یعنی انتقال جاذب در منافذ جاذب در صورت وجود گرادیان غلظت در آنها. مکانیسم چنین انتقالی ممکن است به غلظت جاذب و اندازه منافذ بستگی داشته باشد.
انتشار مولکولی، نادسن و سطحی (ولمر) وجود دارد. انتشار مولکولی در صورتی رخ می دهد که طول آزاد باشد. مسیر مولکول ها در منافذ کمتر از اندازه منافذ است، Knudsen - اگر این طول از اندازه منافذ بیشتر شود. با انتشار سطحی، مولکول ها در امتداد سطح جاذب بدون وارد شدن به فاز توده حرکت می کنند. با این حال، مقادیر ضرایب. انتشار برای مکانیسم های مختلف انتشار یکسان نیست. به صورت جمع در مواردی، نمی توان به طور تجربی مشخص کرد که دقیقاً چگونه انتشار رخ می دهد و بنابراین به اصطلاح. ضریب موثر انتشار، فرآیند را به عنوان یک کل توصیف می کند.
پایه ای بیایید آزمایش کنیم مطالبی در مورد سینتیک جذببه عنوان به اصطلاح عمل می کند جنبشی منحنی، یعنی تابع = a/a برابر = f(t) کجا-نسبی جذببرابر با نسبت مقدار جذب فعلی است آبه آبرابر با ارزش آن در زمان است تیبرای تفسیر جنبشی منحنی در ساده ترین حالت، فرض بر این است که دانه جاذب دارای ساختار متخلخلی است که از نظر حجمی کاملاً همگن است (به این مدل شبه همگن می گویند). به معنای. یک پیشرفت در مدل شبه همگن این ایده است که هر دانه شامل مناطقی با منافذ بزرگتر و ریزتر است. انتشار در چنین دانه ای توسط دو عامل مختلف توصیف می شود. ضرایب
در مورد سطح باز، با اتخاذ مدل لانگمویر، بدست آوردن سینتیک آسان است. معادله جذبنرخ نزدیک شدن به تعادل، تفاوت در سرعت است جذبو دفع با فرض اینکه طبق معمول در سینتیک سرعت فرآیندها متناسب با غلظت مواد واکنش دهنده باشد، داریم:
که در آن k adc و k des به ترتیب ثابت سرعت هستند. جذبو دفع فشار در فاز گاز ثابت فرض می شود. هنگام ادغام این معادله از تی= 0 به هر مقدار تیما گرفتیم:
بنابراین، برای f داریم: = برابر. بنابراین در نهایت داریم:
که در آن k = k تبلیغات + k des.
تاثیر دما بر سرعت جذببا معادله ای مشابه معادله آرنیوس بیان می شود جذببا افزایش دما، کاد به طور تصاعدی افزایش می یابد. زیرا انتشار در منافذ جاذب با غلبه بر فعال سازی همراه است. موانع، وابستگی دمایی kads و kdes یکسان نیست.
آگاهی از نرخ انتشار نه تنها برای تئوری مهم است جذب، بلکه برای محاسبه صنعتی جذب می کند. فرآیندها در این مورد، آنها معمولاً نه با دانه های جاذب منفرد، بلکه با لایه های آنها سروکار دارند. سینتیک فرآیند در لایه با وابستگی های بسیار پیچیده بیان می شود. در هر نقطه از لایه در یک زمان معین، مقدار جذبنه تنها با شکل معادله ایزوترم تعیین می شود جذبو قوانین سینتیک فرآیند، اما همچنین آیرودینامیکی یا هیدرودینامیکی. شرایط جریان گاز یا مایع در اطراف دانه ها. سینتیک فرآیند در لایه جاذب، بر خلاف سینتیک در یک دانه جداگانه، نامیده می شود. پویایی شناسی جذب, طرح کلیحل مسائل آن به شرح زیر است: سیستمی از دیفرانسیل ها تدوین شده است. معادلات دیفرانسیل جزئی، با در نظر گرفتن ویژگی های لایه، ایزوترم جذب، ویژگی های انتشار (ضریب انتشار، انواع انتقال جرم در سراسر لایه و داخل دانه ها)، هوا و هیدرودینامیک. جریان ویژگی ها جذبشرایط اولیه و مرزی مشخص شده است. حل این سیستم معادلات، در اصل، منجر به مقادیر از جذبدر یک نقطه معین از زمان در یک نقطه معین از لایه. به عنوان یک قاعده، تحلیلی راه حل را می توان تنها برای ساده ترین موارد به دست آورد، بنابراین این مشکل به صورت عددی با استفاده از رایانه حل می شود.
در یک مطالعه تجربی از دینامیک جذبیک جریان گاز یا مایع با ویژگی های داده شده از لایه جاذب عبور می کند و ترکیب جریان خروجی به عنوان تابعی از زمان مورد مطالعه قرار می گیرد. ظاهر ماده جذب شده در پشت لایه به اصطلاح. پیشرفت، و زمان قبل از دستیابی به موفقیت، زمان اقدام محافظتی است. وابستگی غلظت یک جزء معین در پشت یک لایه به زمان نامیده می شود. منحنی خروجی این منحنی ها به عنوان پایه عمل می کنند. بیایید آزمایش کنیم ماده ای که به شخص اجازه می دهد تا در مورد الگوهای دینامیک قضاوت کند جذب
طراحی سخت افزاری فرآیندهای جذب
فن آوری های زیادی وجود دارد. روش های جذب فرآیندها چرخه ای گسترده تاسیسات (دوره ای) با لایه ثابت جاذب، پایه. که گره آن یک یا چند است. جاذب های ساخته شده به شکل ستون های توخالی پر از جاذب دانه ای. یک جریان گاز (یا مایع) حاوی اجزای جذب شده از یک لایه جاذب عبور داده می شود تا زمانی که از آن عبور کند. جذبپس از این، جاذب موجود در جاذب بازسازی می شود و جریان گاز به جاذب دیگری هدایت می شود. بازسازی جاذب شامل چندین مرحله است که اصلی ترین آنها دفع است، یعنی. آزاد شدن ماده جذب شده قبلی از جاذب جذبدفع با گرم کردن، کاهش فشار فاز گاز، جابجایی (به عنوان مثال، بخار داغ)، یا ترکیبی از این روش ها انجام می شود. چون زمان ها جذبو بازسازی ها با هم منطبق نیستند، چنین تعدادی جاذب همزمان با کار و بازسازی شده را انتخاب کنید تا فرآیند کلی به طور مداوم ادامه یابد.
با توجه به فنی و اقتصادی به دلایل بازسازی، بازسازی کامل نشده است جذببنابراین، ظرفیت کاری جاذب برابر است با اختلاف بین حداکثر به دست آمده در شرایط داده شده جذبو مقدار جاذب باقی مانده در جاذب پس از بازسازی. در نتیجه ایزوترم ها جذبمطابق با فرآیند جاذب، نباید خیلی شیب دار باشد.
در طرح توصیف شده، دو گزینه امکان پذیر است: 1) محصول مورد نظر تقریباً به طور کامل از جریان گاز جذب می شود و سپس در ماده دفعی قرار می گیرد و از آنجا به هر طریقی استخراج می شود. 2) محصول هدف بدتر از سایر اجزای مخلوط گاز جذب می شود و سپس در جریان گاز خروجی قرار می گیرد. طبق گزینه اول، به عنوان مثال، واحدهای بازیابی در تولید ویسکوز، جمع آوری CS 2 از گازهای خروجی و بازگرداندن آنها به چرخه فعالیت می کنند. بهره وری چنین تاسیساتی به صدها هزار متر مکعب گاز تصفیه شده در ساعت می رسد. کربن فعال جاذب با ریز منافذ نه چندان نازک، یعنی. زغال سنگ که در آن ثابت است Eطبق TOZM (به بالا مراجعه کنید) 20-25 کیلوژول بر مول است. این معناست E 0 مربوط به ایزوترم نه چندان تند است که شرایط بازسازی خوبی را فراهم می کند. چنین زغال سنگ نامیده می شود بهبودی دفع با بخار آب داغ انجام می شود. برای صرفه جویی در انرژی، جریان های گاز سرد و گرم از مبدل های حرارتی عبور می کنند.
خشک کردن گازها و مایعات بسیار مهم است، به عنوان مثال. گازهای نفتیقبل از پردازش یا طبیعی آنها. گازها قبل از حمل و نقل؛ جاذب ها - ژل سیلیکا یا زئولیت ها. دفع با حرارت دادن انجام می شود. از آنجایی که دفع زئولیت با مصرف انرژی بالا همراه است، از جاذب ترکیبی استفاده می شود: پایه. توده رطوبت توسط ژل سیلیکا که به راحتی بازسازی می شود و خشک شدن عمیق توسط زئولیت جذب می شود.
با بازسازی حرارتی، چرخه کامل شامل می شود جذبحرارت دادن جاذب، دفع و سرد شدن آن. عدد بزرگمراحل، شدت کم و شدت انرژی بالای فرآیند را تعیین می کند جذببنابراین، به اصطلاح. گیاهان با چرخه کوتاه که کل چرخه آنها چندین مورد طول می کشد. دقایق. در آنها گاز به جاذب به معنی عرضه می شود. فشار، که سپس آزاد می شود و دفع رخ می دهد. کل فرآیند تقریباً همدما است (انحراف از همدما فقط با انتشار گرما ایجاد می شود جذبو جذب حرارت در حین دفع). مراحل چرخه: جذبآزاد شدن فشار، دفع، افزایش فشار. به عنوان مثال نصب هایی با زئولیت برای تولید هوای غنی شده با اکسیژن است.
در تاسیسات دارای لایه متحرک جاذب (در اصطلاح ابرجاذب ها)، دومی تحت تاثیر گرانش به آرامی پایین می آید و از پایین خارج می شود. بخش هایی از جاذب و به اصطلاح به پایان می رسد. Airlift که یک لوله عمودی موازی با جاذب است. ستون یک جریان هوا در این لوله از پایین به بالا حرکت می کند که دانه های جاذب را به سمت بالا می برد. بخشی از یک ستون جریان گاز پردازش شده وارد قسمت میانی جاذب می شود و در خلاف جهت جاذب به سمت بالا حرکت می کند. در بالای ستون پیوسته وجود دارد جذب، در پایین - بازسازی جاذب (همچنین ببینید تصفیه جذب).
در تاسیسات با بستر سیال ("جوش") جاذب، جریان گازی که از پایین وارد جاذب می شود، جاذب را به حالت تعلیق در می آورد. در عین حال، راندمان انتقال جرم بین جاذب و گاز به شدت افزایش می یابد و مدت زمان جذبو دفع چنین تاسیساتی بهره وری بالایی دارند. توزیع گسترده آنها به دلیل نیازهای زیاد برای خز مختل شده است. استحکام دانه های جاذب (استحکام ناکافی باعث از بین رفتن قابل توجه جاذب به دلیل ساییدگی و حذف آن از دستگاه می شود).
پایه ای الزامات برای جاذب ها: جذب بالا. ظرفیت، یعنی آنها باید بدن های پراکنده با ضربان بالا باشد. سطح یا با حجم منافذ زیاد؛ شیمی ماهیت سطح باید موثر باشد جذبداده ها در شرایط داده شده؛ شیمی و حرارتی دوام، قابلیت بازسازی، دسترسی. حداکثر کربنهای فعال، زیروژلهای اکسیدهای خاص (ژلهای سیلیکا، ژلهای آلومینیوم، و غیره)، زئولیتها به طور گسترده گسترش یافتهاند. از جاذب های غیر متخلخل-فن. کربن (دوده) و SiO 2 بسیار پراکنده (آئروسیل، "دوده سفید").
زمینه های کاربرد فناوری جذب
در ظاهر جذبتوسط بسیاری تاسیس شد روش های تصفیه هوا از ناخالصی های مضر (نگاه کنید به تصفیه گاز)آب (نگاه کنید به تصفیه آب)،و همچنین شربت های قند برای تولید شکر، آب میوه ها و سایر مایعات موجود در غذا. صنعت، ضایعات روغن های روان کننده. حذف رطوبت به عنوان ناخالصی مضر از گازها و مایعات با استفاده از جاذب جامد یکی از شاخه های مهم جذب است. تکنیک ها (همچنین رجوع کنید به خشک کردن گاز).
روی جاذب ها فرآیندهای مبتنی بر جداسازی دقیق مخلوط مواد و جداسازی اجزای خاص از مخلوط های پیچیده. به عنوان مثال جداسازی ایزومرهای آلکان به منظور به دست آوردن هیدروکربن های معمولی برای تولید سورفکتانت ها، جداسازی روغن ها در تولید سوخت موتور. برای مخلوط های گازیجذب می کند. روش های جداسازی برای به دست آوردن هوای غنی شده با اکسیژن (تا O 2 تقریبا خالص) استفاده می شود. به صورت جمع در مواردی، این روش ها با موفقیت با اصلاح رقابت می کنند (نگاه کنید به. جداسازی هوا).
یک منطقه به سرعت در حال توسعه کاربرد جاذب ها. فن آوری پزشکی، جایی که برای استخراج استفاده می شود مواد مضراز خون (روش هموسورپشن) و غیره فیزیول. مایعات الزامات بالا برای عقیمی کار بسیار دشواری را برای انتخاب جاذب های مناسب ایجاد می کند. اینها شامل کربنهای فعال مخصوص تهیه شده است.
روشن: Brunauer S.، جذب گازها و بخارات، ترانس. از انگلیسی، ج 1، م.، 1948; د بوئر I، ماهیت دینامیکی جذب، ترجمه. از انگلیسی، M., 1962; جذب و تخلخل، ویرایش. M. M. Dubinina [و غیره]، M.، 1976; Keliev N.V., Fundamentals of Adsorption Technology, 2nd ed., M., 1984; Young D.M., Crowell A.D., جذب فیزیکی گازها, L., 1962. M.M.Dubinin، V.V. سیرپینسکی
حرف اول عنوان مقاله را انتخاب کنید:
جذب در رابط صورت می گیرد. بنابراین منطقی است که توصیف ترمودینامیکی پدیده های سطحی را به عنوان مورد خاصترمودینامیک سیستم های ناهمگن
برنج. 3.4. جذب گیبس: 1- سیستم مقایسه دو فاز، 2- سیستم دو فاز واقعی با ناحیه غیر یکنواخت
در ترمودینامیک سیستم های ناهمگن از آن استفاده می شود اصل افزایشیکه به شرح زیر است: تمام خواص گسترده یک سیستم ناهمگن برابر است با مجموع خواص گسترده متناظر که فازها قبل از تماس با یکدیگر داشتند.اجازه دهید فازها را با α و β نشان دهیم (شکل 4). سپس برای یک سیستم ایده آل، به گونه ای که خواص فازهای نزدیک به فصل مشترک با خواص توده ای آنها منطبق باشد، روابط زیر برای انرژی داخلی U، حجم V، جرم (تعداد مول) n، آنتروپی S پس از برقراری تعادل معتبر است. سیستم ناهمگن:
U = U α + U β , V = V α + V β , n = n α + n β , S = S α + S β
فرض بر این است که دما و فشار در هر دو فاز یکسان است.
برای سیستمهای ناهمگن واقعی، ناحیه انتقال در مرز دو فاز سهم بیشتری در خواص گسترده سیستم دارد. اگر پدیده های سطحی رخ دهند، باید تفاوت بین خواص گسترده یک سیستم ناهمگن واقعی و ویژگی های گسترده یک سیستم مدل که در آن پدیده های سطحی وجود ندارند را در نظر گرفت. به چنین سیستمی سیستم مقایسه می گویند. سیستم مقایسه دارای همان پارامترهای فشرده (T, P, C i ...) و همان حجم V با سیستم واقعی است (شکل 4).
از نقطه نظر ترمودینامیکی، مقدار جذب G به عنوان مقدار اضافی ماده n s، بیان شده بر حسب مول یا گرم، که یک سیستم ناهمگن واقعی در مقایسه با سیستم مرجع، مربوط به سطح مشترک یا سطح سطح دارد، درک می شود. از جاذب A. فرض بر این است که سیستم مقایسه دارای پارامترهای فشرده (T, P, C i) و همان حجم (V = V α + V β) با سیستم واقعی است (شکل 4) .
Г = (n - n α - n β)/A = n s /A 3.11
توابع ترمودینامیکی اضافی ناحیه گذار یک سیستم واقعی (آنها را با شاخص s نشان می دهیم) را می توان به صورت زیر نوشت:
U s = U - U α - U β ، n s = n - n α - n β ، S s = S - S α - S βو غیره.
اندازهگیریهای تجربی جذب همیشه جذب را دقیقاً به صورت مازاد بر یک جزء در داخل نشان میدهند سیستم واقعیدر مقایسه با سیستم مقایسه انتخاب شده به عنوان مثال، هنگام جذب گاز بر روی یک جاذب جامد یا هنگام جذب اجزاء در فاز جامد، برای یافتن مقادیر جذب، تغییر غلظت اولیه ماده جاذب را پس از تماس فازهای α و β تعیین کنید.
n i s = V(C i o - C i)،
جایی که C i o- غلظت اولیه مولفه i C i- غلظت مولفه i پس از برقراری تعادل بین فازهای تماس. اعتقاد بر این است که حجم Vتغییر نمی کند. با این حال، غلظت منجزء ام C i، به دست آمده تجربی، در حجم تعیین می شود V'بالای سطح مشترک فاز بدون در نظر گرفتن حجم ناحیه ناهمگن لایه انتقال V αدر سطح مشترکی که غلظت آن است C i α. بنابراین، به دلیل وجود یک منطقه غیر یکنواخت در یک سیستم واقعی، حجم کل سیستم را می توان به صورت V = V’ + Vα. تمام مقدار منجزء -ام C i oبین این دو جلد توزیع خواهد شد:
V C i o = V’ C i + V α C i α،
و تعداد مول های جزء من، جذب شده در رابط، برابر خواهد بود
n i s = (V'C i + V α C i α) - (V' + V α)C i = V α (C i α - C i) 3.12
آن ها جذب تجربی تعیین شده، مازاد مولفه i در حجم V α در مقایسه با مقدار این جزء در همان حجم دور از فصل مشترک است. به این نوع جذب، جذب گیبس می گویند. .
V α C i αتماس گرفت محتوای کامل من-جزء ام در لایه جذب در منطقه با غلظت بسیار پایین C iدر حجم V'اصلاحیه V α C iمعادله (3.2) را می توان نادیده گرفت و مقدار اندازه گیری شده را می توان در نظر گرفت V α C i αمحتوای کامل من-به عنوان مثال، در هنگام جذب گاز روی یک جاذب جامد در فشارهای پایین، جزء جزء لایه جذب است.
صفحه فعلی: 6 (کتاب در مجموع 19 صفحه دارد) [بخش خواندنی موجود: 13 صفحه]
فونت:
100% +
34. ماهیت نیروهای جذب
برهمکنش بین مولکول های جاذب با سطح جاذب در طول به اصطلاح. جذب فیزیکی می تواند به دلایل مختلفی باشد. سپس پتانسیلی که برهمکنش یک مولکول جاذب را با یک اتم جاذب غیرقطبی تعیین می کند را می توان به صورت زیر بیان کرد:
θ = −Cr 6 +برادر 12 ,
جایی که r فاصله بین مراکز ذرات است. ج - ثابت جاذبه پراکندگی؛ B ثابتی است که انرژی نیروهای دافعه را مشخص می کند.
کاملاً بدیهی است که در فواصل نسبتاً دور نیروهای جاذبه باید غالب باشند و در فواصل نزدیک باید نیروهای دافعه غالب شوند. همچنین در فواصل معین این نیروها باید برابر باشند که با حداقل مطابقت دارد انرژی آزاد. اما توجه به این نکته ضروری است که در طول جذب، نیروهای پراکندگی به طور همزمان بین هر ذره غیر قطبی عمل می کنند.
از آنجایی که انرژی برهمکنش ذرات می تواند به سرعت با فاصله کاهش یابد، برای تعیین پتانسیل نیروهای جذب کافی است که جمع را روی نزدیکترین اتم های جاذب انجام دهیم. مهم است که در طول جذب مولکولهای غیرقطبی پیچیده، انرژی پتانسیل را بتوان تقریباً به عنوان مجموع تمام انرژیهای جذب بالقوه واحدهای مولکولی محاسبه کرد.
اگر جاذب متشکل از یون باشد، عمل نیروهای پراکندگی از قبل شناخته شده را می توان با عمل نیروهای جذب القایی دوقطبی که در مولکول های جاذب توسط میدان الکتریکی القا می شود، تکمیل کرد، که به نوبه خود، ایجاد شده توسط یون های شبکه جاذب.
با چنین برهمکنشی، سهم نیروهای القایی در برهمکنش جذب می تواند متناسب با قطبش پذیری مولکول جاذب و مجذور قدرت میدان روی این سطح جاذب باشد.
اگر جذب مولکولهای قطبی جاذب روی یک جاذب قطبی اتفاق بیفتد، در این حالت دوقطبیها اتمهای جاذب را قطبی میکنند، یعنی به نظر میرسد که گشتاورهای الکتریکی را در آنها القا میکنند. به دلیل این تأثیر، اندرکنش استقرایی به اندرکنش پراکندگی اضافه می شود.
برهمکنش القایی خود معمولاً کوچک است و بسته به دوقطبی مولکول جاذب و قطبش پذیری جاذب، می تواند به مقادیر زیادی برسد. اگر مولکول ها روی یک جاذب که دارای یون یا دوقطبی در سطح است جذب شوند، به اصطلاح برهمکنش یون ها یا دوقطبی های جاذب با میدان الکترواستاتیک خود جاذب.
در این حالت، مولکول های جاذب حتی می توانند در میدان جاذب جهت دهی شوند و برهمکنش کولن جهت گیری رخ می دهد. معمولاً اتفاق می افتد که انرژی های برهمکنش های استقرایی و جهت گیری کمتر از انرژی برهمکنش های پراکنده است و بنابراین پذیرفته شده است که انرژی جاذبه بین مولکولی با انرژی جاذبه پراکنده تعیین می شود.
جذب همچنین می تواند در اثر تشکیل پیوند هیدروژنی ایجاد شود. پیوندی از این نوع میتواند در حین جذب روی جاذبهایی که حاوی گروههای هیدروکسیل مولکولهایی مانند آب، الکلها، آمونیاک و آمینهای روی سطح هستند، ایجاد شود. هنگامی که یک پیوند هیدروژنی تشکیل می شود، انرژی برهمکنش بین جاذب و جاذب می تواند بسیار زیاد باشد و گرمایی که در طول چنین جذبی آزاد می شود به طور قابل توجهی بیشتر از گرمای جذب موادی است که از نظر شکل و اندازه مولکول ها مشابه هستند. ، اما پیوند هیدروژنی تشکیل نمی دهند.
توجه به این نکته ضروری است که با دانستن توصیف ترمودینامیکی لایه سطحی در سطح مشترک جاذب-جاذب، ساختار آن، ماهیت انواع نیروها و دینامیک فرآیند، می توان به مطالعه جذب پیچیده تر پرداخت. فرآیندها
35. جذب به عنوان غلظت خود به خود در سطح مشترک موادی که کشش سطحی را کاهش می دهد
سورفکتانت ها به دو گروه بزرگ تقسیم می شوند: فعال و غیر فعالمواد
سورفکتانت ها قادر به تجمع در لایه سطحی هستند و جذب مثبت اتفاق می افتد جی > 0.
این نوع مواد باید کشش سطحی داشته باشند که به نوبه خود باید کمتر از کشش سطحی حلال باشد، در غیر این صورت تجمع ماده در لایه سطحی نامطلوب بوده و باید حلالیت نسبتاً کمی داشته باشد. با حلالیت کافی، مولکول های سورفکتانت تمایل دارند از سطح به اعماق محلول حرکت کنند. در نتیجه، سورفکتانت ها ترجیحاً از قسمت عمده مایع به سطح رانده می شوند.
اما با تجمع مواد در مرز محلول در مولکول های این مواد که برهمکنش ضعیفی با یکدیگر دارند، برهمکنش بین مولکولی در لایه سطحی کاهش می یابد و کشش سطحی کاهش می یابد.
سورفکتانت هانسبت به لایه آبی انواع مختلفی از ترکیبات آلی، اسیدهای چرب با رادیکال هیدروکربنی به اندازه کافی بزرگ، نمک های این اسیدها (صابون ها)، اسیدهای سولفونیک و نمک های آنها و همچنین انواع مختلفالکل ها و آمین ها ویژگی مشخصهبیشتر مولکول ها با دوگانگی مشخص می شوند: مولکول از دو بخش یک گروه قطبی و یک رادیکال هیدروکربنی غیر قطبی تشکیل شده است. یک گروه قطبی که دارای گشتاور دوقطبی قابل توجهی است و به شدت هیدراته است، می تواند تمایل سورفکتانت را برای محیط آبی تعیین کند. اما رادیکال هیدروکربنی دلیلی است که حلالیت این ترکیبات را کاهش می دهد.
سورفکتانت های غیر فعال سطحی- این نوع مواد تمایل دارند سطح مایع را در حجم آن ترک کنند و در نتیجه به اصطلاح. جذب منفی جی < 0. Поверностно-инактивные вещества также обладают значительным поверхностным натяжением, значительно большим, чем натяжение у растворителя (иначе эти вещества способны самопроизвольно накапливаться в поверхностном слое), также обладают высокой растворимостью, что способствует их стремлению уйти с поверхности жидкости в объем. Взаимодействие между молекулами поверхностно-инактивного вещества и растворителя всегда больше, чем взаимодействие между самими молекулами растворителя, поэтому они и стремятся перейти в объем раствора. مواد غیر فعال سطحیدر رابطه با آب، الکترولیت های معدنی زیادی وجود دارد: اسیدها، قلیاها، نمک ها. مولکول های سورفکتانت قسمت آبگریز ندارند و می توانند در آب تجزیه شوند و به یون های بسیار هیدراته تبدیل شوند.
مثال هاسورفکتانت ها نیز برخی از ترکیبات آلی هستند که در آنها قسمت غیر قطبی مولکول وجود ندارد یا بسیار کوچک است. این مواد شامل اسیدهای فرمیک و آمینواستیک هستند.
در حلال های غیر آبی، الکترولیت های معدنی نیز بسته به حلال می توانند کشش سطحی را افزایش دهند.
مثلاهنگامی که یدید سدیم به متانول وارد می شود، کشش سطحی به شدت افزایش می یابد؛ برای اتانول، کشش سطحی تقریباً 2 برابر بیشتر است. فعالیت سطحی مواد نه تنها به ماهیت ماده، بلکه به خواص حلال نیز بستگی دارد. اگر هر حلالی دارای کشش سطحی بالایی باشد، آن ماده حل شده می تواند فعالیت سطحی قابل توجهی از خود نشان دهد.
36. نظریه های جذب
اجازه دهید رایجترین نظریههای جذب را در نظر بگیریم که انواع خاصی از جذب را در رابط «جامد-گاز» یا «محلول جامد» توصیف میکنند.
تئوری جذب تک مولکولی توسط I. Langmuir.
1. جذب موضعی است و توسط نیروهای نزدیک به مواد شیمیایی ایجاد می شود.
2. جذب فقط در مراکز فعال رخ می دهد - برآمدگی ها یا فرورفتگی ها روی سطح جاذب که با وجود ظرفیت های آزاد مشخص می شود. مراکز فعال مستقل و یکسان در نظر گرفته می شوند.
3. هر مرکز فعال قادر است تنها با یک مولکول جذب کننده تعامل داشته باشد. فقط یک لایه از مولکول های جذب شده می تواند روی سطح تشکیل شود.
4. فرآیند جذب برگشت پذیر و متعادل است. مولکول جذب شده برای مدتی توسط سایت فعال حفظ می شود و پس از آن دفع می شود. پس از مدتی، تعادل دینامیکی برقرار می شود.
حداکثر مقدار جذب ممکن جی o به شرطی به دست می آید که تمام مراکز فعال توسط مولکول های جاذب اشغال شده باشند. معادله ایزوترم جذب تک مولکولی مربوط به مقدار جذب جیبا غلظت جاذب با، دارای شکل:
جایی که ب- یک مقدار ثابت برای یک جفت معین "جاذب - جاذب" (نسبت ثابت های سرعت دفع و جذب)، از نظر عددی برابر با غلظت جاذب است که در آن نیمی از مراکز فعال اشغال شده است.

نمودار ایزوترم جذب لانگمویر در شکل 2 نشان داده شده است ببا رسم مماس بر ایزوترم جذب در نقطه به صورت گرافیکی تعیین کنید با= 0. هنگام توصیف فرآیند جذب گاز در معادله، غلظت را می توان با مقدار متناسب فشار جزئی جایگزین کرد. تئوری جذب تک مولکولی I. لانگمویر برای توصیف فرآیندهای جذب گازها و مواد محلول در فشارهای پایین (غلظت) ماده جاذب قابل استفاده است.
نظریه پلیانی در مورد جذب پلی مولکولیایزوترم های جذب s شکل را توصیف می کند که شکل آن برهمکنش احتمالی مولکول های جذب شده با ماده جاذب را نشان می دهد.
1. جذب توسط نیروهای فیزیکی ایجاد می شود.
2. سطح جاذب همگن است، هیچ مرکز فعالی وجود ندارد. نیروهای جذب یک میدان نیروی پیوسته در نزدیکی سطح جاذب تشکیل می دهند.
3. نیروهای جذب در فاصله ای بیشتر از اندازه مولکول جاذب عمل می کنند، یعنی حجم جذب خاصی در سطح جاذب وجود دارد که در طول جذب با مولکول های جاذب پر می شود.
4. جذب یک مولکول جاذب توسط سطح جاذب به وجود مولکول های دیگر در حجم جذب بستگی ندارد که در نتیجه جذب چند مولکولی امکان پذیر است.
5. نیروهای جذب به دما بستگی ندارند، و بنابراین، حجم جذب با تغییر دما تغییر نمی کند.
معادله فروندلیچسطح جاذب ناهمگن است، برهمکنش بین ذرات جذب شده رخ می دهد و مراکز فعال کاملاً مستقل از یکدیگر نیستند. جی. فروندلیچ پیشنهاد کرد که تعداد مول های گاز جذب شده یا ماده محلول در واحد جرم جاذب (به اصطلاح جذب خاص) ایکس/متر) باید متناسب با فشار تعادلی (برای گاز) یا غلظت تعادلی (برای مواد جذب شده از محلول) جاذب باشد که تا توان معینی که همیشه کمتر از واحد است افزایش یابد:
ایکس / متر = aP n ایکس / متر = aC n
شارحان nو عامل تناسب آآزمایشی تعیین می شود.
37. ترمودینامیک فرآیند جذب. معادله جذب گیبس
برای مطالعه پدیده جذب در سطح مشترک "محلول-گاز"، لازم است بین مقدار اضافی ماده جذب شده در لایه روی سطح ارتباط برقرار شود. جیغلظت سورفکتانت در محلول ( با) و کشش سطحی ( σ ) در مرز فاز «محلول – گاز». بهتر است که پدیده ها را از دیدگاه ترمودینامیکی در نظر بگیریم و جذب یک ماده محلول را به تغییر انرژی آزاد سطح یا کشش سطحی آن مرتبط کنیم. این ارتباط برقرار شد دبلیو گیبز V 1876 که نامگذاری شد "معادله جذب گیبس":
جی = – با / RTایکس dσ/دی سی.
شما هنوز هم می توانید تصور کنید معادله گیبس،بر اساس ترمودینامیک، با استفاده از پتانسیل ایزوباریک- همدما جی، پتانسیل های شیمیایی μ 1و μ2،و همچنین با استفاده از n 1 و n 2 تعداد مول اجزاء پس از تجزیه و تحلیل آن با در نظر گرفتن آنتروپی اس، جلد Vو فشار پ، می توانیم معادله زیر را بنویسیم:
dG=– SDT+VdP+σds+ μ 1 dn 1 + μ 2 dn 2.
اجازه دهید آن را با صفر برابر کنیم و با در نظر گرفتن دما و فشار ثابت، به معادله ای به شکل ساده تبدیل می شود:
SD σ + n 1 روز μ 1 + n 2 روز μ 1 = 0.
با در نظر گرفتن این واقعیت که برای محلول های رقیق پتانسیل شیمیایی جزء دوم به صورت زیر بیان می شود:
μ 2 = μ 2 0 +RTلوگاریتم ج,
و با توجه به اینکه دما ثابت است
dμ 2 =RTdnc،
جایگزینی این معادله به
![]()
معادله جذب گیبس مورد نظر را بدست می آوریم. بر اساس معادله می توان دریافت که اگر کشش سطحی σ با تمرکز افزایش می یابد باسپس غلظت املاح در لایه سطحی کمتر از حجم محلول است (به اصطلاح جذب منفی) و اگر کشش سطحی σ با افزایش غلظت کاهش می یابد با، سپس غلظت در لایه بیشتر از حجم (جذب مثبت) است و در نهایت اگر σ بستگی ندارد با، سپس غلظت ماده در لایه روی سطح و در حجم یکسان است. معادله گیبس با استفاده از ترمودینامیک به دست آمد. در عمل، تأیید این معادله دشوار است، که به دلیل دشواری تعیین غلظت ماده محلول در سطح لایه است. روشی با تجربه بی مک بن دریافتند که یک لایه بسیار نازک مایع با استفاده از دستگاه از سطح محلول جدا شده است. تعیین بیشتر پارامترهای معادله گیبس نشان داد که مقادیر جذب تجربی یافته شده در خطای تجربی، با مقادیر محاسبه شده با استفاده از معادله گیبس منطبق است. به دلیل همگن بودن و صاف بودن سطح هر مایعی، مفاهیم معمول مراکز فعال در مطالعه جذب سطحی آن کاملاً غیرقابل استفاده است. در دمای بحرانی، تفاوت بین فازهای مجاور ناپدید می شود و کشش سطحی، به عنوان یک قاعده، برابر با صفر می شود. جذب گازها و بخارات آنقدر کاربرد عملی گسترده ای دارد که در ادبیات به ویژه در ادبیات فنی می توان این مفهوم را یافت که فقط در رابطه با فرآیندهای روی سطح جامدات به کار می رود.
این مفهوم، مانند کلی ترین قوانین جذب، مانند معادله گیبس در نظر گرفته شده، برای تمام مرزهای فاز قابل اجرا است. با استفاده از معادله گیبس و تمام مقررات حاصل از آن، با تعیین مقدار Γ، می توان یک ایزوترم جذب ساخت.
38. ویژگی های جذب روی مواد ریز متخلخل. نظریه بالقوه پلیانی پتانسیل جذب
نظریه پولیانیجذب فیزیکی غیر موضعی را در نظر می گیرد که مستقیماً توسط نیروهای واندروالس بین جاذب و جاذب ایجاد می شود (این را می توان اولین موقعیت در نظر گرفت). موقعیت دوم این نظریه ایده میدان نیرو (یا پتانسیل) جاذب است که در فاصله قابل توجهی از سطح گسترش می یابد. لایه جذبی که در این زمینه ظاهر می شود چند مولکولی است. اگر جذب گازها را در نظر بگیریم، چگالی این لایه در امتداد نرمال خاصی از سطح کاهش می یابد. اگر جذب بخار را در نظر بگیریم، یک لایه مایع با ضخامت معین روی سطح تشکیل می شود. میدان در نظریه پولیانی به عنوان مجموعه ای از سطوح هم پتانسیل در نظر گرفته می شود که هر سطح با مقدار پتانسیل خاصی مطابقت دارد. ε و هر سطح بعدی کوچکتر از سطح قبلی خواهد بود. هر سطحی از این قبیل در فضا، لایه هایی با حجم معینی را که به عنوان مشخص شده است، جدا می کند v i. وظیفه نظریه پولیانی یافتن انتقال از مختصات معمول ایزوترم است. x، ص) به پارامترهای فیلد ε iو v i، با ایجاد ارتباط بیشتر بین این پارامترهای اساسی. بخش اول مسئله، که پلیانی بیان کرد، کاملاً پیچیده است و در بسیاری از موارد نمیتوان راهحلهای مشخصی داشت، اما برای مورد جذب بخار، این بخش از مسئله در یک تقریب اولیه بسیار ساده حل میشود. برای یک لایه جذب مایع، قسمت پر شده از حجم برابر با:
v i = x(M/d),
جایی که د- چگالی ماده در حالت مایع.
M. Polyany در نظریه خود حکم دیگری را در مورد عدم وجود به اصطلاح معرفی می کند. غربالگری میدانی در طول جذب، ارزش ε در این نظریه، فضا یک مقدار ثابت است (چیزی شبیه پتانسیل گرانشی) بدون توجه به اینکه آیا مولکول های جذب کننده خاصی بین یک نقطه معین و یک سطح جامد وجود دارند یا اینکه همه فضا آزاد است. پولیانی این مفهوم را معرفی می کند پتانسیل جذب ε که نشان دهنده کار همدما فشرده سازی بخار هنگام انتقال آن از فشار تعادلی است. آردر فاز توده ای دور از سطح به ناحیه لایه سطحی با فشار بخار اشباع p 0سپس عبارت برای تعیین پتانسیل به صورت زیر خواهد بود:
ε = RTلوگاریتم آر 0 / آر.
با استفاده از این معادله می توانید از مختصات x, p به مختصات بروید ε و vو منحنی به دست آورید که به آن "مشخصه" می گویند. پولیانی در آزمایشات خود دریافت که چنین منحنی هایی که از داده های آزمایشی ایزوترم های به دست آمده ساخته شده اند دارای ویژگی زیر هستند: آنها نسبت به T ثابت هستند یا به عبارت دیگر همه منحنی های این نوع می توانند روی یک منحنی قرار گیرند. ε −ε .
M. Polyany این موضع را به عنوان یک اصل پذیرفت، یعنی:
ملک مشخص شده پولیانی دارای عظمتی است اهمیت عملی، می تواند خانواده ای از ایزوترم ها را از یک ایزوترم جذب تجربی بسازد.
نظریه پولانی بیانی تحلیلی برای ایزوترم یا تابع حجم پتانسیل ارائه نمیکند، اما به فرد اجازه میدهد که مختصات هر دمای معینی را اگر حداقل یک ایزوترم شناخته شده باشد، محاسبه کند. این نتیجه برای محاسبات تکنولوژیکیزیرا برای گازهای مشابه روی یک جاذب، منحنی های جذب ممکن است نزدیک به هم باشند و در بسیاری از موارد با هم ترکیب شوند.
39. منحنی جذب مشخصه. تغییر ناپذیری دما و میل ترکیبی منحنی های مشخصه
میدان نیرویی که در سطح جاذب ایجاد می شود می تواند از بسیاری جهات شبیه میدان گرانشی باشد. در زمینه جذب، می توان سطوح بالقوه را تصور کرد، یعنی سطوحی که با پتانسیل جذب یکسان مشخص می شوند. تحت مفهوم پتانسیل جذب θ نباید چیزی بیش از کار در برابر نیروهای جذب در هنگام جابجایی 1 مول جاذب از یک نقطه معین در میدان به یک فاز گاز معین درک شود. حداکثر پتانسیل جذب در مرز "جاذب - حجم جذب" وجود خواهد داشت. اما در مرز "حجم - فاز گاز" (این جایی است که عمل نیروهای جذب به پایان می رسد)، پتانسیل جذب باید برابر با صفر باشد. تغییر پتانسیل جذب با تغییر در حجم جذب را می توان به صورت منحنی نشان داد. این کار برای اولین بار توسط م. پولیانی انجام شد. این نوع منحنی ها به دما بستگی ندارند و می توانند مشخصه هر جاذب خاصی باشند؛ این نوع منحنی ها معمولاً منحنی های جذب مشخصه نامیده می شوند. تئوری جذب پلی مولکولی فرض می کند که معادله حالت گاز برای حجم جذب قابل استفاده است. در نتیجه، ایزوترم هایی که وابستگی چگالی جاذب به حجم را برای دماهای مختلف مشخص می کنند، شبیه ایزوترم های وابستگی فشار به حجم هستند. در دماهای پایین، نیروهای جذب سطحی می توانند باعث متراکم شدن بخار به مایعی با چگالی معین شوند. در دماهای کمتر از حد بحرانی، در طول تراکم، کل حجم جذب با مایع پر می شود. در این حالت، منحنی جذب تقریباً موازی با محور آبسیسا خواهد بود که با تراکم پذیری کم مایع همراه است. سپس منحنی جذب در مرز "حجم - فاز گاز" به شدت کاهش می یابد و بر این اساس، چگالی جاذب به چگالی معینی از فاز گاز می رسد. در دماهای بالاتر از دمای بحرانی، جاذب میتواند مانند یک گاز ایدهآل رفتار کند و نمودار بهصورت ایزوترم گاز ایدهآل بیان میشود، مشروط بر اینکه pV = RT. در چنین شرایطی، گاز جذب شده دارای حداکثر چگالی در سطح جاذب و حداقل چگالی در مجاورت فاز گاز خواهد بود. علاوه بر این، در این مورد، توجه به این نکته مهم است که چگالی جاذب در لایه جذب هیچ کجا به چگالی خود مایع نمی رسد. و اگر دما بسیار نزدیک به بحرانی باشد، وابستگی چگالی به حجم با منحنی نزدیک از نظر ظاهری به ایزوترم بیان می شود که شرح داده شده است. معادله واندروالسدر این شرایط بخشی از ماده جذب شده در حجم جذب شده در حالت مایع و بخشی از ماده جذب شده در حالت گازی خواهد بود. سپس منحنی به شدت در قسمتی که مربوط به انتقال از مایع به گاز است کاهش می یابد. اگر منحنی مشخصه ای از ایزوترم جذب تجربی یکی از جاذب ها بسازید و با دانستن ضرایب میل ترکیبی مربوط به برخی از جاذب های دیگر، می توانید ایزوترم جذب را پیدا کرده و برای جاذب دیگری بسازید. تئوری پتانسیل جذب این امکان را فراهم می کند که با استفاده از منحنی مشخصه ای که از ایزوترم جذب یک بخار به دست می آید، ایزوترم های مختلف جذب بخارات مختلف را روی یک جاذب محاسبه کنیم، زیرا نسبت پتانسیل جذب به حجم جذب بستگی ندارد. .
قرابت(از لاتین affinis - "مرتبط") - کروماتوگرافی میل ترکیبی. روش خالص سازی و جداسازی پروتئین ها بر اساس برهمکنش انتخابی آنها با لیگاندی است که به صورت کووالانسی به یک حامل بی اثر متصل شده است (کروماتوگرافی میل ترکیبی). اندازه گیری میل ترکیبی یک ماده سمی برای یک گیرنده اساساً یک مطالعه تجربی از رابطه بین مقدار ماده اضافه شده به محیط جوجه کشی و مقدار کمپلکس سم-گیرنده تشکیل شده در نتیجه برهمکنش است.
ترمودینامیک فرآیندهای جذب
| نام پارامتر | معنی |
| موضوع مقاله: | ترمودینامیک فرآیندهای جذب |
| روبریک (دسته موضوعی) | تحصیلات |
تعاریف اساسی و روش های طبقه بندی فرآیندهای جذب.
جذب به پدیده هایی اطلاق می شود که به دلیل کاهش خود به خود در انرژی سطح رخ می دهد.
جذب- فرآیند توزیع مجدد برگشت پذیر یا غیرقابل برگشت خود به خودی اجزای یک سیستم ناهمگن بین لایه سطحی و حجم فاز همگن.
در سیستم های چند جزئی، جزء که به شدت کشش سطحی را کاهش می دهد ترجیحاً به لایه سطحی منتقل می شود. در سیستم های تک جزئی، در حین تشکیل لایه سطحی، تغییری در ساختار آن رخ می دهد (جهت گیری معینی از اتم ها و مولکول ها، قطبش)، به نام جذب خودکار.
فاز متراکم تری که برهمکنش های جذب بر روی آن موضعی می شود نامیده می شود جاذب. ماده ای که بین حجم فاز همگن و لایه سطحی توزیع می شود با عبارت ʼʼ مشخص می شود. جذبʼʼ.
در برخی موارد، فرآیند جذب برگشت پذیر است. در این حالت، تحت شرایط خاصی، بخشی از مولکول های جذب شده در نتیجه پدیده های جنبشی مولکولی می توانند از لایه سطحی به فاز توده ای حرکت کنند. فرآیند معکوس جذب نامیده می شود دفع.
روش های طبقه بندی فرآیندهای جذب
طبقه بندی فرآیندهای جذب بر اساس وضعیت تجمع فازهای متقابل.با در نظر گرفتن وابستگی به حالت کل فازهای مجاور، انواع فرآیندهای جذب زیر متمایز می شوند:
جذب گازها روی جاذب جامد؛
جذب مواد محلول در سطح مشترک «جامد-مایع» و «مایع-مایع»؛
جذب سطحی فعال در سطح مشترک مایع و گاز
طبقه بندی فرآیندهای جذب بر اساس مکانیسم برهمکنش بین جاذب و جاذب.جذب را می توان به عنوان برهمکنش مولکول های جاذب با مراکز فعال جاذب در نظر گرفت. با توجه به مکانیسم اثر متقابل آنها، انواع زیر تقسیم می شوند:
1) جذب فیزیکی (مولکولی).- برهمکنش بین مولکول های جاذب و جاذب به دلیل نیروهای واندروالس، پیوندهای هیدروژنی (بدون واکنش های شیمیایی);
2) جذب شیمیایی (شیمیایی جذب)- اتصال مولکول های جاذب به مراکز فعال جاذب در نتیجه واکنش های شیمیایی انواع مختلف (به استثنای واکنش های تبادل یونی) رخ می دهد.
3) جذب تبادل یونی (تبادل یونی) - توزیع مجدد ماده جاذب بین محلول و فاز جامد (مبدل کننده یون) با توجه به مکانیسم واکنش های تبادل یونی.
برای توصیف کمی فرآیندهای جذب، از دو کمیت استفاده می شود.
1) جذب مطلق- مقدار (مول) یا جرم (کیلوگرم) جاذب در واحد سطح یا جرم جاذب. تعیین - A; ابعاد: mol/m2، mol/kg، kg/m2، kg/kᴦ.
2) جذب گیبس (زیاد).- مازاد ماده جاذب در یک لایه سطحی با ضخامت معین نسبت به مقدار آن در حجم فاز همگن، در واحد سطح یا جرم جاذب. تعیین - G; ابعاد: mol/m 2، mol/kᴦ.
رابطه بین جذب مطلق و اضافی را می توان با استفاده از معادله نشان داد:
Г = А – с * h (3.1)
که در آن c غلظت تعادلی ماده در حجم فاز، mol/m3 است.
h ضخامت لایه سطحی است که به طور معمول 9-10 متر در نظر گرفته می شود.
در سیستم های ناهمگن چند جزئی، هنگامی که یک یا آن جزء بین حجم فاز همگن و لایه سطحی توزیع می شود، معادله انرژی داخلی اضافی سطح معتبر است:
U = T * S + s * s + Sm i * n i (3.2)
با کاهش تمام عبارات معادله به واحد سطح سطح بین فاز، به دست می آوریم:
U s = T * S s + s + Sm i * Г i (3.3)
که در آن Г i = n i / s مازاد مولفه i در لایه سطحی است، یعنی جذب گیبس.
برای یک سیستم تک جزئی، معادله (3.3) به شکل زیر خواهد بود:
G s = s + m * G (3.4)
که در آن G s = U s - T * S s - انرژی گیبس سطح یا کار ایجاد یک واحد سطح.
m * G - متراکم شدن ماده ماده جذب شده در لایه سطحی.
بر اساس رابطه (3.4) می توان نتیجه گرفت که در حین جذب، کار ایجاد سطح بین فازی شامل کار تشکیل سطح (شکستن پیوندهای چسبنده در حجم فاز جاذب) و تراکم ماده در لایه سطحی است.
در حالت تعادل دینامیکی بین جاذب و جاذب، تغییر در انرژی گیبس سیستم ناهمگن ΔG = 0، ترمودینامیک فرآیند جذب با معادله ای به نام توصیف می شود. معادله جذب بنیادی گیبس:
Ds = SГ i * dm i (3.5)
این معادله جهانی است، زیرا برای همه انواع فرآیندهای جذب معتبر است
موارد خاص معادله جذب گیبس.
1) جذب از محلول ها.
برای پتانسیل شیمیایی جزء یکم سیستم در حین جذب در سطح مشترک "جاذب مایع - جامد" و "مایع - گاز" معادلات زیر معتبر است:
m i = m i 0 + R*T*ln a i (3.6)
dm i = R*T* d ln a i (3.7)
که در آن m i 0 پتانسیل شیمیایی جزء i ام سیستم در است شرایط استاندارد;
a i فعالیت جزء i ام سیستم در شرایط استاندارد است.
بر این اساس، معادله جذب گیبس به شکل زیر است:
Г i = - a i / R*T * (ds / da i) (3.8)
برای محلول های غیر الکترولیت ها یک i = c i می گیریم، سپس:
Г i = - с / R*T * (ds / dс) (3.9)
برای محلول های الکترولیت:
Г i = - с ± n / R*T * (ds / dс ± n) (3.10)
که در آن ± میانگین غلظت یونی محلول است.
n ضریب استوکیومتری است.
2) جذب مواد از فاز گاز.
مطابق با معادله مندلیف-کلیپرون:
Р = с * R*T (3.11)
در این رابطه معادله گیبس برای جذب گازها روی جاذب جامد به شکل زیر نوشته شده است:
Г i = - Р / R*T * (ds / dР) (3.12)
در عمل، معادله جذب گیبس، بر اساس اندازهگیریهای کشش سطحی در مقادیر مختلف غلظت مایع یا فشار گاز تعادلی، امکان محاسبه میزان جذب مواد در لایه سطحی را که کشش سطحی برای آن تعیین میشود، میدهد.
ترمودینامیک فرآیندهای جذب - مفهوم و انواع طبقه بندی و ویژگی های رده "ترمودینامیک فرآیندهای جذب". 2017، 2018.
در مورد برهمکنش بین دو اتم:
U – انرژی تعامل؛
U = U PRIOR. + U بازگشت
 - معادله لنارد جونز
, c, b, m = const
- معادله لنارد جونز
, c, b, m = const
در موارد برهمکنش اتم ها با سطح جامد، لازم است همه برهمکنش ها جمع شوند.
x – فاصله تا سطح
r - شعاع عمل نیروهای جاذبه
dV - حجم
n - تعداد مولکول های سطحی
U ADS. – انرژی برهمکنش جذب



در مورد جذب، جاذبه افزایش می یابد. و در مورد برهمکنش غیرقطبی-غیر قطبی، جذب عمدتاً در فرورفتگیها موضعی میشود.
برهم کنش الکترواستاتیکی
جاذب قطبی - جاذب غیر قطبی
جاذب غیر قطبی - جاذب قطبی
جاذب قطبی - جاذب قطبی.
م  مولکول جاذب به عنوان یک دوقطبی و جاذب به عنوان یک رسانا نشان داده می شود که در آن مولکول جاذب یک آینه دوقطبی را به طور متقارن نسبت به آینه داده شده القا می کند.
مولکول جاذب به عنوان یک دوقطبی و جاذب به عنوان یک رسانا نشان داده می شود که در آن مولکول جاذب یک آینه دوقطبی را به طور متقارن نسبت به آینه داده شده القا می کند.
X - فاصله تا وسط
هنگام تعامل، پتانسیل به وجود می آید:
 ,
,
 - لحظه دوقطبی
- لحظه دوقطبی
پتانسیل تمایل به گرفتن حداکثر مقدار دارد، یعنی. دوقطبی ها تمایل دارند عمود بر سطح جهت گیری کنند.
از آنجایی که افزایش دما باعث رشد حرکت براونی می شود، منجر به مهار فرآیند جذب می شود.
در مورد برهمکنش الکترواستاتیکی، جذب عمدتاً روی برآمدگی ها قرار می گیرد.
معادله جذب بنیادی
در مورد جذب، توزیع مجدد جزء رخ می دهد، که به معنای تغییر پتانسیل شیمیایی است. فرآیند جذب را می توان به عنوان انتقال انرژی سطحی به انرژی شیمیایی در نظر گرفت.
حجم لایه = 0، سپس معادله تعمیم یافته قوانین I و II ترمودینامیک:
T = const; (1) = (2) => 

برای یک سیستم دو جزئی:
,
 ,
,
 =>
=>
=>
 - معادله جذب گیبس
.
- معادله جذب گیبس
.
برای مورد جذب تلویزیون. بدن - گاز: 
 ,
,

 - ایزوترم
- ایزوترم
 - ایزوبار
- ایزوبار
 - ایزوپیکنال
- ایزوپیکنال
 - ایزوستر
- ایزوستر
ایزوترم، ایزوپیکن، ایزوستر به یکدیگر مرتبط هستند.
زیرا تابع جذب 



ایزوترم هنری ایزوترم لانگمویر



ترمودینامیک. جذب
برای ماده متراکم:
 ,
,
 ,
,
 - تغییر کامل در انرژی گیبس
.
- تغییر کامل در انرژی گیبس
.

P - فشار روی یک سطح منحنی، Р S - فشار روی یک سطح صاف
 - پتانسیل جذب
- پتانسیل جذب
تغییر دیفرانسیل در دام 
 ، Г = ثابت
، Г = ثابت
- تغییر آنتروپی دیفرانسیل
- آنتالپی دیفرانسیل جذب
 - گرمای ایزوستریک جذب
- گرمای ایزوستریک جذب
 - گرمای تراکم
- گرمای تراکم
 - گرمای خالص جذب
- گرمای خالص جذب

 ,
,




Qa - گرمای یکپارچه جذب، 
Qra - گرمای خالص یکپارچه جذب،

معادله هانری
مطالعه جذب به دلیل ناهمگنی سطح پیچیده است، بنابراین ساده ترین قوانین برای سطوح همگن به دست می آید.
اجازه دهید تعامل گازها با یک سطح جامد را در نظر بگیریم، زمانی که گاز از حالت تعادل در حجم به حالت تعادل روی سطح تبدیل می شود. این حالت مشابه تعادل گازها در میدان گرانشی است.
 ,
,
 ,
=>
,
=> -معادله هانری
-معادله هانری
 - ضریب توزیع
- ضریب توزیع
در طول فرآیند جذب، تغییر در پتانسیل های شیمیایی رخ می دهد.
برای فاز انبوه: 
برای گاز روی سطح: 
در حالت تعادل  ، یعنی
، یعنی

در معادله هنری، ثابت به غلظت بستگی ندارد
معادله هانری در ناحیه فشارها و غلظت های پایین معتبر است. با افزایش تمرکز، 2 نوع انحراف از قانون هنری ممکن است:
1- انحرافات مثبت، D کاهش می یابد، A کاهش می یابد
2 - انحرافات منفی، D - افزایش می یابد، A - افزایش می یابد.
نوع انحراف با غلبه یک یا نوع دیگری از تعامل جاذب-جاذب تعیین می شود.
با تعامل چسب قوی، ضرایب فعالیت افزایش می یابد - یک انحراف مثبت. در مورد تعاملات منسجم، انحرافات منفی مشاهده می شود.
جذب تک مولکولی
ایزوترم لانگمویر
ساده ترین الگوها در نظریه هنری به دست آمد. لانگمویر نظریه ای ارائه کرد که بر اساس آن جذب به عنوان یک واکنش شبه شیمیایی در نظر گرفته می شود. که در آن:
سطح از نظر انرژی همگن است.
جذب موضعی است، هر مرکز جذب با یک مولکول جذب کننده تعامل دارد.
مولکول های جذب شده با یکدیگر برهمکنش ندارند.
جذب تک لایه

 - سطح،
- سطح،  - جذب،
- جذب،  - مجتمع جذب
- مجتمع جذب
 سپس غلظت محل های جذب:
سپس غلظت محل های جذب:  ,
, - محدود کردن جذب
- محدود کردن جذب
 ، سپس ثابت واکنش برابر است با:
، سپس ثابت واکنش برابر است با: 

 - معادله لانگمویر
- معادله لانگمویر
وابستگی جذب به غلظت
1 )
)
 ,
,

2) منطقه با غلظت بالا
 - محدود کردن جذب، تشکیل یک لایه تک مولکولی
- محدود کردن جذب، تشکیل یک لایه تک مولکولی
برای انرژی گیبس: .
g ضریب آنتروپی است.
در مورد ایزوترم هنری، انرژی گیبس انتقال ماده جاذب از حالت استاندارد در حالت عمده به حالت استاندارد روی سطح را مشخص می کند. در مورد ایزوترم لانگمویر  درجه میل ترکیبی بین جاذب و ماده جاذب را مشخص می کند.
درجه میل ترکیبی بین جاذب و ماده جاذب را مشخص می کند.
 از وانت هاف ایزوبار پیدا شد.
از وانت هاف ایزوبار پیدا شد.

 ، سپس
، سپس  ، از اینجا
، از اینجا  .
.

 - درجه پر شدن سطح
- درجه پر شدن سطح




 - تعداد صندلی های رایگان،
- تعداد صندلی های رایگان،  - تعداد مکان های اشغال شده
- تعداد مکان های اشغال شده
 ,
,

آن ها در منطقه با غلظت های بالا، تعداد سایت های آزاد با مقدار جاذب نسبت معکوس دارد.
جذب مخلوطی از گازها در یک سطح همگن.
در این حالت فرآیند جذب به عنوان دو واکنش موازی در نظر گرفته می شود.
 (1)
(1)

 (2)
(2)


جذب مخلوطی از گازها در سطحی غیر یکنواخت.
در مورد سطح غیر یکنواخت، نمی توان خود را به پرکردگی های متوسط محدود کرد.
در نتیجه رقابت، بومی سازی جاذب های مختلف در مناطق با انواع مختلف امکان پذیر است.
در این مورد رابطه  .
.
 ,
,
 - فشار بخار اشباع ماده جاذب
- فشار بخار اشباع ماده جاذب
 ,
,
 - گرمای جذب
- گرمای جذب
"+" - وابستگی به همبستگی، "-" - وابستگی آنتیبیت، "N" - هیچ همبستگی.
"+" - جذب طبق همان مکانیسم انجام می شود. در مناطقی که از نظر انرژی مطلوب هستند، گاز با میل ترکیبی بالا به سطح عمدتاً جذب می شود.
"-" - جذب از طریق مکانیسم های مختلف اتفاق می افتد و تا یک نقطه خاص از زمان رقابت برای سطح وجود ندارد.
جذب تک مولکولی عمدتاً در طول جذب فیزیکی گازها در مقادیر کم انجام می شود. پو همچنین در رابط مایع/گاز.
جذب پلی مولکولی
نظریه BET(برونائر، امت، تلر).
در مواردی که تشکیل تک لایه برای جبران انرژی سطحی کافی نباشد، جذب پلی مولکولی است و می توان آن را به عنوان نتیجه تراکم اجباری تحت تأثیر نیروهای سطحی در نظر گرفت.
امتیاز کلیدی:
هنگامی که یک مولکول جذب شده به یک مکان اشغال شده برخورد می کند، یک مجموعه چندگانه تشکیل می شود.
هر چه نزدیک تر می شویم پبه پ ستعداد سایت های جذب رایگان کاهش می یابد. در ابتدا تعداد مکان های اشغال شده توسط یک نفره، دو نفره و ... افزایش و سپس کاهش می یابد. در مجموعه ها
در پ =پ س جذب به تراکم تبدیل می شود.
هیچ تعامل افقی وجود ندارد.
برای لایه اول، ایزوترم لانگمویر برآورده شده است.
سطح به عنوان مجموعه ای از مکان های جذب در نظر گرفته می شود. شرط تعادل دینامیکی معتبر است: میزان تراکم در مکان های آزاد برابر است با نرخ تبخیر از مکان های اشغال شده.
a ضریب تراکم (کسری از مولکول های متراکم شده روی سطح) است.
 ,
,
Zm - حداکثر تعداد صندلی رایگان.
 - فرکانس ارتعاشات اتمی در جهت عمود بر سطح.
- فرکانس ارتعاشات اتمی در جهت عمود بر سطح.
برای لایه اول، شرایط تعادل دینامیکی:



 ، سپس
، سپس
 - معادله لانگمویر
- معادله لانگمویر
برای لایه دوم درست خواهد بود: 
برای لایه i : 
برای سادگی، فرض می شود که a و ν برای همه لایه ها به جز لایه اول یکسان هستند. برای همه لایه ها به جز لایه اول، گرمای جذب ثابت است. برای لایه آخر، گرمای جذب برابر با گرمای تراکم است. در نتیجه معادله به دست آمد
 (*)
(*)
سی- ثابت،
در مورد نظریه BET، ثابت است باانرژی گیبس جذب خالص را مشخص می کند. معادله فقط شامل یک ثابت است و این معادله برای تعیین سطح ویژه جاذب نیز بسیار مهم است.
از آنجایی که گرما در نتیجه جذب آزاد می شود، مناطق سطح خاصی در دماهای پایین تعیین می شوند.
 ????????????
????????????


اشکال اصلی نظریه- غفلت از تعاملات افقی به نفع تعاملات عمودی.
معادله در محدوده برقرار است  از 0.05 تا 0.3.
از 0.05 تا 0.3.
جایی که  <
0,05 – существенное влияние оказывает
неоднородность поверхности.
<
0,05 – существенное влияние оказывает
неоднородность поверхности.
 > 0.3 - برهمکنش جذب - جذب تحت تأثیر قرار می گیرد.
> 0.3 - برهمکنش جذب - جذب تحت تأثیر قرار می گیرد.
حسابداری برای تعاملات جذب-جذب.
فعل و انفعالات زمانی رخ می دهد که مولکول ها یا مولکول های شاخه دار بر روی یک سطح غیر قطبی جذب شوند. قادر به تشکیل همکاران. در این حالت شکل ایزوترم های جذب تغییر می کند.
آ  جاذب قطبی نیست
جاذب قطبی نیست
نمودار 1 مربوط به برهمکنش های ضعیف جاذب-جاذب و برهمکنش های قوی جاذب-جاذب است.
نمودار 2 مربوط به برهمکنش های قوی جاذب-جاذب و برهمکنش های قوی جاذب-جاذب است.
نمودار 3 مربوط به برهمکنش قوی جاذب-جاذب و برهمکنش ضعیف جاذب-جاذب است.
 ,
,

در مورد برهمکنش بین مولکول های جاذب، لازم است تغییرات در ضرایب فعالیت در نظر گرفته شود. و این معادله به صورت زیر نوشته می شود:
 - معادله فرونکین، فاولر، گوگنهایم.
- معادله فرونکین، فاولر، گوگنهایم.
ک- ثابت جاذبه
نظریه بالقوه پلیانی
این نظریه هیچ نوع ایزوترم جذب را استخراج نمی کند، اما امکان محاسبه ایزوترم ها را در دمای متفاوت فراهم می کند.
جذب- این نتیجه جذب ماده جاذب به سطح جاذب به دلیل عمل پتانسیل جذب است که به حضور مولکول های دیگر بستگی ندارد و به فاصله بین سطح و مولکول جاذب بستگی دارد.
 ,
,
 - پتانسیل جذب
- پتانسیل جذب
از آنجایی که سطح غیر یکنواخت است، فاصله با حجم جذب جایگزین می شود  .حجم جذبحجم محصور شده بین سطح و نقطه مربوط به مقدار معین است
.حجم جذبحجم محصور شده بین سطح و نقطه مربوط به مقدار معین است  .
.
پتانسیل جذبکار انتقال 1 مول جاذب خارج از یک حجم جذب معین به یک نقطه معین از حجم جذب است (یا کار انتقال 1 مول بخار اشباع از یک ماده جاذب که در صورت عدم وجود جاذب در تعادل با یک ماده جاذب مایع است. وارد فاز بخار در حالت تعادل با جاذب).

منحنی مشخصه
 - پتانسیل جذب،
- پتانسیل جذب، 
برای یک جاذب معین و جاذب های مختلف، موارد زیر صادق است: 
برای انواع مختلف جاذب ها  ,
,
جایی که  پتانسیل برای ایزوترم های جذب در فشارهای نسبی
پتانسیل برای ایزوترم های جذب در فشارهای نسبی  برای جذب 1 و برای جذب 2. این نسبت یک مقدار ثابت است.
برای جذب 1 و برای جذب 2. این نسبت یک مقدار ثابت است.
 - ضریب میل ترکیبی
- ضریب میل ترکیبی
تئوری تراکم مویرگی.
سیر فرآیند جذب تا حد زیادی به ساختار جسم متخلخل بستگی دارد.
|
میکرو متخلخل | |
|
متخلخل انتقالی | |
|
درشت متخلخل |
در مورد جاذب های ریز متخلخل، میدان های نیروهای جذب با هم همپوشانی دارند. در مورد جاذب های ماکرو متخلخل، منافذ به عنوان کانال های انتقال عمل می کنند. فرآیندهای تراکم در اجسام متخلخل انتقالی بسیار مهم هستند. تراکم مویرگی در مقادیر مشخصی شروع می شود پو  ، زمانی که بخشی از انرژی سطح قبلاً جبران شده باشد. شرط لازم این است که سطح باید خود خیس شود. روند شرح داده شده است معادله تامپسون-کلوین.
، زمانی که بخشی از انرژی سطح قبلاً جبران شده باشد. شرط لازم این است که سطح باید خود خیس شود. روند شرح داده شده است معادله تامپسون-کلوین.

 - در مورد خیس شدن، مرکز انحنا در فاز گاز است.
- در مورد خیس شدن، مرکز انحنا در فاز گاز است.
در مورد تراکم مویرگی، ایزوترم جذب شکل هیسترتیک دارد. شاخه پایین مربوط به فرآیند جذب و شاخه بالایی مربوط به فرآیند دفع است.
همه انواع منافذ را می توان به سه نوع کاهش داد:
|
مخروطی |
استوانه ای با یک انتهای بسته |
استوانه ای با دو سر باز |
|
پر کردن فرآیند از پایین منافذ انجام می شود. ایزوترم جذب و ایزوترم دفع در این مورد منطبق هستند، زیرا فرآیند جذب از یک کره شروع می شود و فرآیند دفع نیز با ناپدید شدن برخی از کره ها آغاز می شود.
↓ |
هیسترزیس وجود ندارد. حرکت رو به جلو و معکوس با معادله توصیف می شود:
|
ته هیچ کجا وجود ندارد، پر شدن منافذ در امتداد دیواره های سیلندر می رود.
سیلندر: ایزوترم ظاهری هیستراتیک خواهد داشت.
↓ |
که در  در شرایط خیس شدن، تراکم در فشارهای پایینتر اتفاق میافتد که از نظر انرژی مطلوب است. از شاخه دفع، منحنی های توزیع اندازه منافذ به دست می آید.
در شرایط خیس شدن، تراکم در فشارهای پایینتر اتفاق میافتد که از نظر انرژی مطلوب است. از شاخه دفع، منحنی های توزیع اندازه منافذ به دست می آید.
حداکثر منحنی دیفرانسیل نسبت به نقطه عطف منحنی انتگرال به سمت چپ منتقل می شود. حجم کل منافذ کوچک کوچک است، اما دارای سطح وسیعی است. با افزایش اندازه منافذ، حجم آنها افزایش می یابد  ، و منطقه مانند است
، و منطقه مانند است  به همین دلیل یک جابجایی در حداکثر منحنی دیفرانسیل مشاهده می شود.
به همین دلیل یک جابجایی در حداکثر منحنی دیفرانسیل مشاهده می شود.
جذب در رابط جامد-مایع
در مورد جذب در سطح مشترک گاز جامد، ما یک جزء را نادیده گرفتیم. در مورد جذب در سطح مشترک جامد و مایع، ماده جاذب مولکول های حلال را از سطح جاذب جابجا می کند.
 ,
,
معادله درست است:

 ,
,
N 1، N 2 - کسر مولی حلال و جزء، N 1 + N 2 = 1، سپس
 ,
=>
,
=>
 سپس معادله جذب برای رابط جامد-مایع است.
سپس معادله جذب برای رابط جامد-مایع است.
جذب (G) > 0 در  <
0
<
0
اگر مقادیر  برای جزء و حلال بسیار متفاوت است، در این مورد وابستگی جیاز جانب ندارای افراطی در ارزش است ن
~ 0,5.
برای جزء و حلال بسیار متفاوت است، در این مورد وابستگی جیاز جانب ندارای افراطی در ارزش است ن
~ 0,5.
E  اگر
اگر  مقادیر نزدیک دارند، در این حالت ممکن است علامت جذب تغییر کند. اعتیاد جیاز جانب ناز محور x عبور می کند
مقادیر نزدیک دارند، در این حالت ممکن است علامت جذب تغییر کند. اعتیاد جیاز جانب ناز محور x عبور می کند
تابع نقطه تقاطع جی(ن) با محور x نامیده می شود آزئوتروپ جذب. این بدان معنی است که این دو جزء نمی توانند روی یک جاذب معین از هم جدا شوند.
معادله ایزوترم جذب با ثابت مبادله.
در طول جذب در سطح مشترک جامد و مایع، توزیع مجدد ثابت اجزاء بین سطح جاذب و حجم محلول رخ می دهد.
 - اجزاء (- - به سطح مراجعه کنید)
- اجزاء (- - به سطح مراجعه کنید)

 ,
,
 ,
, .
.
 ,
,


جذب در سطح مشترک مایع-گاز
آر  اجازه دهید تغییر در پروفایل غلظت را با عبور از سطح مشترک مایع و گاز در نظر بگیریم. بگذارید جزء 2 فرار باشد.
اجازه دهید تغییر در پروفایل غلظت را با عبور از سطح مشترک مایع و گاز در نظر بگیریم. بگذارید جزء 2 فرار باشد.
Cs - غلظت در لایه سطحی.
بر اساس تعریف جذب اضافی

اگر جزء فرار نباشد، مقدار جذب به صورت زیر نوشته می شود:
پ  ری
ری 

در معادله  ماهیت یک ماده با مشتقات آن توصیف می شود
ماهیت یک ماده با مشتقات آن توصیف می شود  .
.
ایزوترم کشش سطحی می تواند به شکل 1 یا 2 باشد:
1- سورفکتانت ها
2- سورفکتانت ها
فعالیت سطحی g توانایی مواد برای کاهش کشش سطحی در یک سیستم است.

 - ضخامت لایه سطحی
- ضخامت لایه سطحی
سی س- غلظت جزء در لایه سطحی
با– غلظت حجمی
برای سریال های همولوگ یک قانون وجود دارد:
 - قانون ترابو دوکلوس
- قانون ترابو دوکلوس
برای یک سری همولوگ، ایزوترم جذب به شکل زیر است:
به جای A می نویسیم G، زیرا جذب در لایه سطحی بیش از حد است.
ایزوترم کشش سطحی:

 - کشش سطحی یک حلال خالص.
- کشش سطحی یک حلال خالص.
 - معادله اساسی جذب
- معادله اساسی جذب
 - معادله لانگمویر
- معادله لانگمویر
بیایید با هم آنها را حل کنیم:

- معادله شیشکوفسکی
ب- ثابت برای سری همولوگ.
آ- هنگام حرکت از یک همولوگ به دیگری 3-3.5 برابر افزایش می یابد 
![]()
1 - منطقه با غلظت کم
![]()
2- غلظت متوسط
3- لایه تک مولکولی
سورفکتانت ها مولکول های دودوست هستند، به عنوان مثال. شامل یک گروه قطبی و یک رادیکال هیدروکربنی غیر قطبی است.
o قسمت قطبی مولکول است.
| - بخش غیر قطبی مولکول.
در یک حلال قطبی، جهت گیری مولکول های سورفکتانت به گونه ای است که قسمت قطبی مولکول رو به حلال باشد و قسمت غیر قطبی به سمت فاز گاز رانده شود.
در معادله شیشکوفسکی  ، برای سری همسانی ثابت است.
، برای سری همسانی ثابت است.
اثر سورفکتانت با شروع ظاهر می شود n> 5. در غلظت های بالاتر از غلظت لایه تک مولکولی، میسل شدن در محلول های سورفکتانت رخ می دهد.
میسل- به مجموعه ای از مولکول های سورفکتانت آمفیفیلیک گفته می شود که رادیکال های هیدروکربنی آن هسته تشکیل می دهند و گروه های قطبی به فاز آبی تبدیل می شوند.
توده میسلی – توده میسلی.
اچ  تعداد مولکول ها - تعداد تجمع.
تعداد مولکول ها - تعداد تجمع.
میسل های کروی
در مورد میسلی شدن، تعادل در محلول برقرار می شود
CMC - غلظت بحرانی تشکیل میسل.
از آنجایی که ما میسل را یک فاز جداگانه در نظر می گیریم:
برای یک سری همسانی یک معادله تجربی وجود دارد:
آ- انرژی انحلال گروه عاملی.
ب - افزایش پتانسیل جذب، کار جذب در واحد متیلن.
- افزایش پتانسیل جذب، کار جذب در واحد متیلن.
وجود یک هسته هیدروکربنی در میسل ها این فرصت را ایجاد می کند که ترکیباتی که در آب نامحلول هستند در محلول های آبی سورفکتانت ها حل شوند؛ این پدیده حل شدن نامیده می شود (آنچه حل می شود محلول است، سورفکتانت حل کننده است).
گل ممکن است کاملاً غیر قطبی باشد، ممکن است شامل هر دو بخش قطبی و غیر قطبی باشد و مانند یک مولکول سورفکتانت جهت گیری شود.
در هر صورت، در حین حل شدن، جرم میسلی و تعداد تجمع افزایش می یابد نه تنها به دلیل گنجاندن محلول، بلکه به دلیل افزایش تعداد مولکول های سورفکتانت لازم برای حفظ حالت تعادل.
انحلال موثرتر است، هر چه وزن مولکولی محلول کمتر باشد.

 ~ 72 mN\m.
~ 72 mN\m.
 ~ 33 mN\m.
~ 33 mN\m.
اثربخشی سورفکتانت ها به مقدار CMC بستگی دارد.
فشار لایه سطحی دو بعدی

→ -نیروهای کشش سطحی.
- فشار دو بعدی
لایه سطحی نیرویی است برابر با اختلاف کشش سطحی یک محلول سورفکتانت و یک حلال خالص که به سمت یک سطح تمیز هدایت می شود.
بین محلول و لایه سطحی تعادل برقرار می شود



در  منطقه ای وجود دارد که در آن
منطقه ای وجود دارد که در آن  به طور خطی به غلظت بستگی دارد.
به طور خطی به غلظت بستگی دارد.
G [mol/m2].
 -منطقه ای که توسط یک مول از یک ماده اشغال شده است
-منطقه ای که توسط یک مول از یک ماده اشغال شده است
سپس ایزوترم فشار دو بعدی شکل خواهد گرفت 
 - ایزوترم فشار دو بعدی.
- ایزوترم فشار دو بعدی.
اعتیاد  از S M:
از S M:

در  - فشار دو بعدی به شدت افزایش می یابد. در
- فشار دو بعدی به شدت افزایش می یابد. در  دو بعدی تغییر شکل داده و باعث رشد ناگهانی می شود
دو بعدی تغییر شکل داده و باعث رشد ناگهانی می شود  .
.
فیلمی که در هر دو طرف با فازهای یکسان محدود شده باشد، دو طرفه نامیده می شود. در این گونه فیلم ها حرکت دائمی مشروب مادر مشاهده می شود.
به فیلم هایی با ضخامت کمتر از 5 نانومتر، فیلم سیاه می گویند.

لایه های جذب باید دو ویژگی داشته باشند: ویسکوزیته و قابلیت حرکت آسان، سیالیت و کشسانی.
اثر Marangoni خود درمانی است.
مثلث گیبس،  - فشار بیش از حد
- فشار بیش از حد
فیلم کشیده شده است و با توجه به اینکه بخشی از مایع خارج شده است، سورفکتانت ها به سمت فضای آزاد هجوم می آورند. مثلث گیبس
اثر قدرت جذب اجسام.
همیشه یک لایه جذب روی سطح فیلم وجود دارد که پس از آن
معادله لانگمویر:


 به فشار دو بعدی
به فشار دو بعدی
 - آنالوگ معادله شیشکوفسکی
- آنالوگ معادله شیشکوفسکی
پدیده های الکتروکینتیکی دو لایه الکتریکی (EDL).
مدل گلمهولتز. نظریه گوی-چپمن.
1808 پرواز

U – لوله شکل، 2 الکترود را در آن فرو کنید. قانون رگ های ارتباطی نقض می شود و تغییر در سطح مایع در لوله رخ می دهد - پدیده های الکتروکینتیک.
پدیده های جنبشی:
الکتروفورز
الکترواسموز
جریان (جریان) پتانسیل
پتانسیل رسوب گذاری
1 و 2 زمانی بوجود می آیند که اختلاف پتانسیل اعمال شود؛ 3 و 4، پانچ و ته نشین شدن ذرات کلوئیدی باعث ایجاد اختلاف پتانسیل می شود.
الکترواسموز حرکت یک محیط پراکندگی نسبت به یک فاز پراکنده ثابت تحت تأثیر جریان الکتریکی است.
الکتروفورز - این حرکت ذرات فاز پراکنده نسبت به یک محیط پخش ثابت تحت تأثیر جریان الکتریکی است.
پ  علت بروز پدیده های الکتروکینتیکی جدا شدن فضایی بارها و پیدایش یک لایه الکتریکی دوتایی است.
علت بروز پدیده های الکتروکینتیکی جدا شدن فضایی بارها و پیدایش یک لایه الکتریکی دوتایی است.
لایه دوگانه الکتریکی یک خازن مسطح است، یک صفحه توسط یون های تعیین کننده پتانسیل و دیگری توسط یون های مخالف تشکیل می شود. یون ها به همان روشی آلوده می شوند که یون های تعیین کننده پتانسیل به حجم محلول فشار داده می شوند. فاصله بین صفحات  . پتانسیل به صورت خطی کاهش می یابد، اختلاف پتانسیل
. پتانسیل به صورت خطی کاهش می یابد، اختلاف پتانسیل  .
.
اختلاف پتانسیل خارجی باعث پیدایش مدول برشی می شود  یک جفت نیرو در واحد سطح است که در امتداد سطح جسم جامد اعمال می شود.
یک جفت نیرو در واحد سطح است که در امتداد سطح جسم جامد اعمال می شود.

در حالت تعادل، مدول برشی برابر با مدول اصطکاک ویسکوز است (  ).
).

در شرایط ما  ,
,

 - معادله گلمهولتز- اسمالوکوفسکی
- معادله گلمهولتز- اسمالوکوفسکی
 - سرعت خطی جابجایی فاز.
- سرعت خطی جابجایی فاز.
E- قدرت میدان الکتریکی
 - اختلاف پتانسیل بین صفحات
- اختلاف پتانسیل بین صفحات
 - تحرک الکتروفورتیک [m2 /(V*s)].
- تحرک الکتروفورتیک [m2 /(V*s)].
مدل هلمهولتز حرکت حرارتی مولکول ها را در نظر نمی گیرد. در واقع، توزیع یون ها در لایه دوگانه پیچیده تر است.
Gui و Chapman علل زیر را برای DES شناسایی کردند:
انتقال یک یون از یک فاز به فاز دیگر در صورت برقراری تعادل.
یونیزاسیون ماده فاز جامد
تکمیل سطح با یون های موجود در محیط پراکندگی.
قطبش از منبع جریان خارجی
لایه دوگانه الکتریکی ساختاری فازی یا پراکنده دارد. یون ها تمایل دارند به طور مساوی در سراسر لایه منتشر توزیع شوند.
لایه پراکنده متشکل از کنتراینون هاست که طول لایه با انرژی جنبشی آنها تعیین می شود. در دماهای نزدیک به صفر مطلق، یون های ضد تا حد ممکن به یون های تعیین کننده پتانسیل نزدیک هستند.
نظریه دانیا بر اساس دو معادله است:
معادله بولتزمن

 - در برابر نیروهای برهمکنش الکترواستاتیکی کار کنید.
- در برابر نیروهای برهمکنش الکترواستاتیکی کار کنید.
 - چگالی بار حجمی
- چگالی بار حجمی

معادله پواسون 
از آنجایی که ضخامت EDL بسیار کوچکتر از اندازه ذرات است و برای یک EDL مسطح مشتق با توجه به مختصات است.  و
و  لغو می شود.
لغو می شود. 
برای e y در y<<1 функцию можно разложить в ряд Маклорена:

اجازه دهید خودمان را به دو دوره از سریال محدود کنیم، سپس:


 - ضخامت DEL فاصله ای است که پتانسیل DEL در آن کاهش می یابد هیک بار.
- ضخامت DEL فاصله ای است که پتانسیل DEL در آن کاهش می یابد هیک بار.
هر چه دما کمتر باشد، کمتر است  . در T→0 - DEL مسطح. هر چه غلظت بیشتر باشد، من بیشتر، کمتر
. در T→0 - DEL مسطح. هر چه غلظت بیشتر باشد، من بیشتر، کمتر  .
.





 "-" به این معنی است که پتانسیل با فاصله کاهش می یابد. =>
"-" به این معنی است که پتانسیل با فاصله کاهش می یابد. =>
=>

 ,
,
 - پتانسیل به صورت تصاعدی کاهش می یابد.
- پتانسیل به صورت تصاعدی کاهش می یابد.
پتانسیل برای چگالی بار سطحی: 
شارژ سطحی یک شارژ حجمی با علامت مخالف است که در فاصله یکپارچه شده است.




=>


جایی که پتانسیل 2.7 برابر کاهش می یابد - 
ظرفیت دو لایه 
عیب تئوری این است که وجود لایه هلمهولتز در نظر گرفته نمی شود، یعنی. را در نظر نمی گیرد  از این رو خطاها در تعیین پارامترهای اصلی. همچنین تأثیر یونهای ماهیت متفاوت بر ضخامت لایه دوگانه الکتریکی را توضیح نمی دهد.
از این رو خطاها در تعیین پارامترهای اصلی. همچنین تأثیر یونهای ماهیت متفاوت بر ضخامت لایه دوگانه الکتریکی را توضیح نمی دهد.
نظریه استرن. ساختار یک میسل کلوئیدی
لایه دوگانه الکتریکی از دو قسمت متراکم و پراکنده تشکیل شده است. یک لایه متراکم در نتیجه تعامل یون های پتانسیل تشکیل با یون های جذب شده خاص تشکیل می شود. این یونها معمولاً تا حدی یا کاملاً کم آب هستند و میتوانند بار مشابه یا مخالف یونهای تعیینکننده پتانسیل داشته باشند. بستگی به نسبت انرژی برهمکنش الکترواستاتیک دارد  و پتانسیل جذب خاص
و پتانسیل جذب خاص  . یون های لایه متراکم ثابت هستند. قسمت دیگر یون ها در لایه انتشار قرار دارد، این یون ها آزاد هستند و می توانند به عمق محلول حرکت کنند، یعنی. از ناحیه ای با غلظت بیشتر به ناحیه ای با غلظت کمتر. چگالی بار کل از دو قسمت تشکیل شده است.
. یون های لایه متراکم ثابت هستند. قسمت دیگر یون ها در لایه انتشار قرار دارد، این یون ها آزاد هستند و می توانند به عمق محلول حرکت کنند، یعنی. از ناحیه ای با غلظت بیشتر به ناحیه ای با غلظت کمتر. چگالی بار کل از دو قسمت تشکیل شده است.

 - شارژ لایه هلمهولتز
- شارژ لایه هلمهولتز
 -شارژ لایه پراکنده
-شارژ لایه پراکنده
سطح دارای تعداد معینی از مراکز جذب است که هر یک با یک ضد یون برهم کنش دارند. ثابت چنین واکنش شبه شیمیایی برابر است با:

 ، جایی که
، جایی که  - کسر مولی از یون های ضد در محلول
- کسر مولی از یون های ضد در محلول
توزیع هلمهولتز
پتانسیل به صورت خطی کاهش می یابد
توزیع پتانسیل گوی. هیچ لایه متراکمی وجود ندارد، پتانسیل به صورت تصاعدی از مقدار کاهش می یابد 
توزیع استرن.
در ابتدا کاهش پتانسیل خطی و سپس نمایی است.
هنگامی که میدان الکتریکی در مورد الکتروفورز اعمال می شود، این ذره فاز جامد نیست که مستقیما حرکت می کند، بلکه ذره فاز جامد با لایه ای از یون ها آن را احاطه کرده است. DES شکل ذره فاز پراکنده را تکرار می کند. هنگامی که یک پتانسیل اعمال می شود، بخشی از لایه پراکنده کنده می شود. خط شکست نامیده می شود مرز لغزشی.
پتانسیلی که در مرز لغزش در نتیجه جدا شدن بخشی از لایه منتشر ایجاد می شود نامیده می شود. پتانسیل الکتروکینتیک(پتانسیل زتا  ).
).
یک ذره فاز پراکنده با یک لایه احاطه کننده از یون های ضد و یک لایه الکتریکی دوگانه نامیده می شود میسل.
قوانین نوشتن میسل های کلوئیدی:


1-1 الکترولیت شارژ
T - ذره فاز پراکنده.
AA مرز بین قطعات متراکم و پراکنده است.
BB - مرز لغزشی.
مرز لغزشی ممکن است با خط AA منطبق باشد یا نباشد.
مقدار pH که در آن پتانسیل زتا صفر است نامیده می شود نقطه ایزوالکتریک.
CaCl 2 + Na 2 SO 4 → CaSO 4 ↓ + 2 NaCl
1. کلسیم اضافی 2
CaCl 2 ↔ Ca 2 + + 2Cl -
(CaSO 4 m∙nCa 2+ 2( n - x)Cl - ) 2 ایکس + ایکس Cl - - نماد میسلی.
CaSO 4 متر - سنگدانه.
CaSO 4 m∙nCa 2+ – هسته.
CaSO 4 m∙nCa 2 + 2 ( n - x)Cl - - ذره.
2. Na 2 SO 4 اضافی
Na 2 SO 4 ↔2Na + + SO 4 2-
(CaSO 4 m∙nSO 4 2- 2(n-x)Na + ) 2x- 2xNa + - میسل
CaSO 4 متر - سنگدانه.
هسته CaSO 4 m∙nSO 4 2 + –.
CaSO 4 m∙nSO 4 2- 2 (n-x) Na + - ذره
معادله گلمهولتز - اسمولوچوفسکی

 - سرعت خطی جابجایی مرزی (در الکترواسموز).
- سرعت خطی جابجایی مرزی (در الکترواسموز).
 - اختلاف پتانسیل بین صفحات خازن (در الکترواسموز).
- اختلاف پتانسیل بین صفحات خازن (در الکترواسموز).


 - سرعت جریان حجمی محلول، اس- مربع سطح مقطعسلول ها.
- سرعت جریان حجمی محلول، اس- مربع سطح مقطعسلول ها.

E- قدرت میدان الکتریکی


 (برای الکترواسموز).
(برای الکترواسموز).
برای پتانسیل جریان:

 - پتانسیل
- پتانسیل
 - فشار روی غشا
- فشار روی غشا
به عنوان یک قاعده، مقادیر تحرک الکتروفورتیک و تحرک الکترواسموتیک کمتر از مقادیر محاسبه شده است. این اتفاق می افتد به دلیل:
اثر آرامش (هنگامی که یک ذره فاز پراکنده حرکت می کند، تقارن جو یونی شکسته می شود).
مهار الکتروفورتیک (ظهور اصطکاک اضافی در نتیجه حرکت یون های متقابل).
اعوجاج خطوط جریان در مورد ذرات رسانای الکتریکی.
رابطه کشش سطحی و پتانسیل. معادله لیپمن
تشکیل EDL به دلیل تمایل سیستم به کاهش انرژی سطحی خود به طور خود به خود اتفاق می افتد. در شرایط ثابت تیو پمعادله تعمیم یافته قانون اول و دوم ترمودینامیک به صورت زیر است:
 (2)
(2)
(3), (1)=(3) =>
=>

 - 1 معادله لیپمن.
- 1 معادله لیپمن.
 - چگالی بار سطحی
- چگالی بار سطحی
 - ظرفیت دیفرانسیل
- ظرفیت دیفرانسیل
 - معادله 2 لیپمن.
- معادله 2 لیپمن.
با- ظرفیت.
بیایید معادله 1 لیپمن و معادله اساسی جذب را حل کنیم:
 ,
,


 ، سپس
، سپس
 - معادله نرنست
- معادله نرنست
 ,
,
 ,
,




 - معادله منحنی الکتروکاپیلاری (ECC).
- معادله منحنی الکتروکاپیلاری (ECC).
که در  :
: ، ولی
، ولی 
سورفکتانت های کاتیونی (CPAS) شاخه کاتدی EKC را کاهش می دهند.
سورفکتانت های آنیونی (APS) شاخه آندی EKC را کاهش می دهند.
سورفکتانت های غیر یونی (NSAS) قسمت میانی ECC را کاهش می دهند.
پایداری سیستم های پراکنده فشار از هم گسسته
سیستم های پراکنده را می توان تقسیم کرد:
سیستم هایی که از نظر ترمودینامیکی ناپایدار هستند به دلیل انتقال به حالت فراپایدار می توانند از نظر جنبشی پایدار باشند.
دو نوع ثبات وجود دارد:
پایداری رسوب (نسبت به گرانش).
ثبات تجمعی (نسبت به چسبندگی)
انعقادفرآیند چسبندگی ذرات است که منجر به از دست دادن پایداری تجمع می شود. انعقاد می تواند در اثر تغییرات دما، pH، هم زدن و اولتراسوند ایجاد شود.
انعقاد متمایز می شود:
برگشت پذیر.
برگشت ناپذیر.
انعقاد با ورود الکترولیت ها اتفاق می افتد.
قوانین انعقاد:

فیلم- این بخشی از سیستم است که بین دو سطح سطحی قرار دارد.
فشار از هم گسستهزمانی اتفاق میافتد که ضخامت فیلم در نتیجه تعامل لایههای سطحی به شدت کاهش مییابد.

"-" - با کاهش ضخامت فیلم، فشار جدایی افزایش می یابد.
P 0 فشار در فاز حجیم است که ادامه لایه میانی است.
P 1 - فشار در فیلم.
تئوری ثبات. DLFO (Deryagin، Landau، Fairway، Overbeck).
بر اساس تئوری DLFO، فشار از هم گسسته دو جزء دارد:
الکترواستاتیک P E (مثبت، به دلیل نیروهای دافعه الکترواستاتیکی است). مربوط به کاهش انرژی گیبس با افزایش ضخامت لایه است.
مولکولی P M (منفی، به دلیل عمل نیروهای جاذبه). این ناشی از فشرده سازی فیلم در اثر نیروهای سطحی شیمیایی است، شعاع اثر نیروها دهم نانومتر با انرژی حدود 400 کیلوژول بر مول است.
کل انرژی تعامل:

 - سیستم به طور کلی پایدار است
- سیستم به طور کلی پایدار است
 - سیستم ناپایدار
- سیستم ناپایدار
پ  جزء مثبت
جزء مثبت
این افزایش به دلیل افزایش انرژی پتانسیل در هنگام فشرده شدن لایه های نازک است. برای فیلم هایی با ضخامت زیاد، انرژی یون اضافی جبران می شود و برابر است با اندرکنش انرژی در حجم محیط پراکندگی.
اگر  (
( - ضخامت فیلم،
- ضخامت فیلم،  - شعاع یونی) نازک شدن لایه منجر به ناپدید شدن و کاهش مولکول ها و یون ها با حداقل انرژی سطحی در آن می شود. تعداد ذرات مجاور کاهش می یابد، در نتیجه انرژی پتانسیل ذرات باقی مانده در فیلم افزایش می یابد.
- شعاع یونی) نازک شدن لایه منجر به ناپدید شدن و کاهش مولکول ها و یون ها با حداقل انرژی سطحی در آن می شود. تعداد ذرات مجاور کاهش می یابد، در نتیجه انرژی پتانسیل ذرات باقی مانده در فیلم افزایش می یابد.


نظریه DLVO برهمکنش ذرات را برهمکنش صفحات می داند.

ذرات برهم کنش ندارند



 - معادله لاپلاس،
- معادله لاپلاس،  ,
,


برای سطوح با بار ضعیف
برای سطوح با شارژ زیاد:

جزء مولکولی برهمکنش دو اتم است:
 ~
~
برهمکنش اتم با سطح:

بیایید دو رکورد بگیریم:
D  برای به دست آوردن جزء مولکولی، لازم است تمام انرژی های برهمکنش اتم های صفحه راست و چپ جمع شود.
برای به دست آوردن جزء مولکولی، لازم است تمام انرژی های برهمکنش اتم های صفحه راست و چپ جمع شود.
جایی که  - ثابت Hamaker (ماهیت اجسام متقابل را در نظر می گیرد).
- ثابت Hamaker (ماهیت اجسام متقابل را در نظر می گیرد).
که انرژی برهمکنش ذرات در یک سیستم را می توان با استفاده از منحنی های پتانسیل بیان کرد.
I - حداقل پتانسیل اولیه. این منطقه انعقاد برگشت ناپذیر است، نیروهای جذب غالب هستند.
II - منطقه پایداری تجمعی، نیروهای دافعه غالب هستند.
III - حداقل پتانسیل ثانویه (یا منطقه لخته سازی). یک لایه الکترولیت بین ذرات فاز پراکنده وجود دارد و ذرات را می توان جدا کرد و به منطقه پایداری تجمع منتقل کرد.

منحنی 1 - سیستم به طور کلی پایدار است.
منحنی 2 - پایدار در منطقه I، ناپایدار در منطقه II.
منحنی 3 - انعقاد در سیستم رخ داده است.
منحنی 4 - در نقطه 4 کل انرژی اندرکنش U=0،  ، این نقطه افراطی مربوط به آغاز انعقاد سریع است.
، این نقطه افراطی مربوط به آغاز انعقاد سریع است.
دو مورد وجود دارد:
1. سطوح کمی شارژ شده:
U = U E + U M = 0
 (1)
(1)
2)

 (2)
(2)



 - این ضخامت لایه مربوط به آغاز فرآیند انعقاد است.
- این ضخامت لایه مربوط به آغاز فرآیند انعقاد است.






 - برای سطوح با بار ضعیف
- برای سطوح با بار ضعیف
 سپس
سپس 
2. برای سطوح با شارژ بالا:
 (1)
(1)
2)

 (2)
(2)


 (3)
(3)
 ,
,
بیایید مربع (3)

انعقاد:
در جذب خاص، یونها را میتوان در مقادیر فوقالعادهای جذب کرد تا سطح بتواند بار خود را تغییر دهد. سطح شارژ می شود.
در مورد جذب خاص، نه تنها یون های دارای علائم مخالف، بلکه از همان علامت نیز می توانند جذب شوند.
اگر یون هایی با همان علامت سطح جذب شوند، در لایه سطحی نه افت پتانسیل، بلکه افزایش آن وجود خواهد داشت.

انعقاد خنثی سازی (با مشارکت ذرات با بار ضعیف اتفاق می افتد و نه تنها به بار الکترولیت منعقد کننده، بلکه به پتانسیل در مرز لایه های متراکم و پراکنده نیز بستگی دارد).
نظریه اسمولوچوفسکی در مورد انعقاد سریع.

وابستگی سرعت انعقاد به غلظت الکترولیت.
I - میزان انعقاد پایین است،
II - سرعت انعقاد تقریباً متناسب با غلظت الکترولیت است.
III - منطقه انعقاد سریع، سرعت عملا مستقل از غلظت است.
مقررات اساسی:
سل اولیه تک پراکنده است، ذرات مشابه شکل کروی دارند.
همه برخوردهای ذرات موثر هستند.
وقتی دو ذره اولیه با هم برخورد می کنند، یک ذره ثانویه تشکیل می شود. ثانویه + اولیه = درجه سوم. اولیه، ثانویه، ثالثی - کثرت.
از نظر سینتیک شیمیایی، فرآیند انعقاد را می توان با این معادله توصیف کرد:
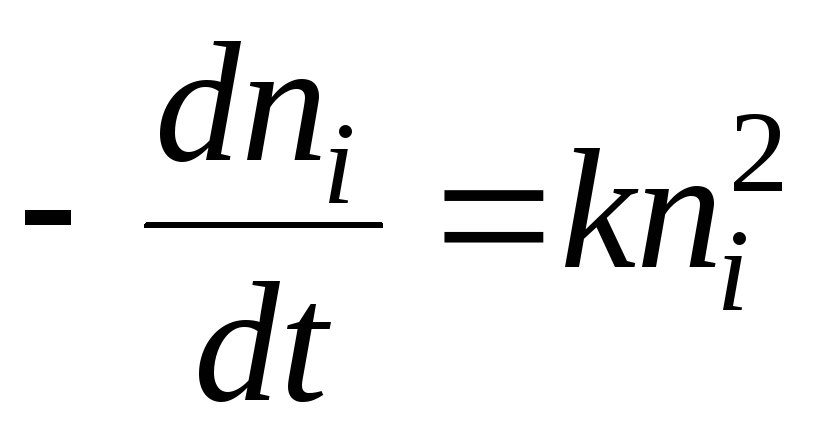
راه حل معادله خواهد بود: 
 - نیمی از زمان انعقاد این زمانی است که در طی آن تعداد ذرات سل 2 برابر کاهش می یابد.
- نیمی از زمان انعقاد این زمانی است که در طی آن تعداد ذرات سل 2 برابر کاهش می یابد.

 ,
,
 ,
,
 ,
,


با افزایش تعدد، حداکثر منحنی های انعقاد به سمت مقادیر بزرگتر تغییر می کند  .
.
ایرادات:
فرض تک پراکندگی.
فرض در مورد اثربخشی همه برخوردها.




 - کره،
- کره، ,
,





