كيمياء. الأيزومرية المكانية من الممكن وجود الأيزومرات الضوئية
محتوى المقال
الأيزوميريا البصرية."عندما ينظر الجزيء في المرآة" مقالة منشورة في عدد يونيو 1996 من مجلة أمريكية مخصصة ل تعليم الكيمياء(مجلة التعليم الكيميائي). وعلى الصفحة الأولى من غلاف هذا العدد كان هناك أيضًا رسم غير عادي. تم تصوير كلب ذيل يهز بشكل جيد على الجانب الصيغة الهيكليةالبنسيلامين. نظر الكلب إلى المرآة، ومن هناك نظر إليه وحش رهيب ذو فم مكشوف وشعر واقف على نهايته. على جانب الوحش تم تصوير نفس الصيغة الهيكلية في شكل صورة معكوسة للأول. لماذا في الواقع نفس المادة لها مظاهر مختلفة؟ ويفسر ذلك خاصية خاصة لبعض المركبات الكيميائية، والتي ترتبط ارتباطا وثيقا بنشاطها البصري.
استقطاب الضوء والنشاط البصري.
في بداية القرن التاسع عشر أظهر الفيزيائي والفلكي والطبيب الإنجليزي توماس يونغ أن الضوء يمكن اعتباره موجة. وجد الفيزيائي الفرنسي أوغستين فريسنل أن موجات الضوء مستعرضة: تحدث التذبذبات فيها بشكل متعامد مع اتجاه الحركة (مثل الأمواج على سطح الماء: تتحرك الموجة للأمام، ويتأرجح الطفو على الماء لأعلى ولأسفل). بالفعل في القرن العشرين لقد وجد أن الضوء عبارة عن موجة كهرومغناطيسية، مثل موجة الراديو، فقط الطول الموجي للضوء أقصر بكثير. ويعني مصطلح "الكهرومغناطيسي" أن الضوء له مجالات كهربائية ومغناطيسية تتأرجح بشكل دوري، مثل الأمواج على سطح البحر. نحن الآن مهتمون فقط بالتقلبات الحقل الكهربائي. وتبين أن هذه التذبذبات لا تحدث بشكل عشوائي، بل فقط بشكل عمودي على اتجاه شعاع الضوء. في الضوء العادي (الذي ينبعث، على سبيل المثال، من الشمس، والمصابيح المتوهجة)، تحدث التذبذبات بشكل عشوائي، في جميع الاتجاهات. ولكن، من خلال المرور عبر بعض البلورات، على سبيل المثال، التورمالين أو الصاري الأيسلندي (نوع شفاف من الكالسيت CaCO 3)، يكتسب الضوء خصائص خاصة: البلورة، كما كانت، "تقطع" جميع تذبذبات المجال الكهربائي، باستثناء تلك الموجودة في مستوى معين. وبالمعنى المجازي، فإن شعاعًا من هذا الضوء يشبه خيطًا صوفيًا يُسحب عبر فجوة ضيقة بين شفرتي حلاقة حادتين.
ويرى عالم الفيزياء الفرنسي إتيان لويس مالوس أن الضوء يتكون من جسيمات ذات قطبين "شمال" و"جنوب"، وفي الضوء الذي يمر عبر الصاري الأيسلندي تتحول جميع الأقطاب في اتجاه واحد. لذلك، دعا هذا الضوء المستقطب. لقد وجد أن الضوء مستقطب جزئيًا من خلال انعكاسه بزوايا معينة من الأسطح اللامعة للعوازل، مثل الزجاج، أو انكسارها بها. ولم يتم تأكيد نظرية مالوس، ولكن بقي الاسم. لا تستطيع العين البشرية التمييز بين الضوء العادي والضوء المستقطب، ولكن يمكن القيام بذلك بسهولة باستخدام أبسط الأدوات البصرية - مقاييس الاستقطاب؛ يتم استخدامها، على سبيل المثال، من قبل المصورين: تساعد مرشحات الاستقطاب على التخلص من الوهج في الصورة، والذي يحدث عندما ينعكس الضوء من سطح الماء.
اتضح أنه عندما يمر الضوء المستقطب عبر بعض المواد، تحدث ظاهرة مثيرة للاهتمام: المستوى الذي توجد فيه "أسهم" المجال الكهربائي المتذبذب يدور تدريجياً حول المحور الذي تسير عليه الحزمة. تم اكتشاف هذه الظاهرة لأول مرة في عام 1811 من قبل الفيزيائي الفرنسي فرانسوا دومينيك أراجو في بلورات الكوارتز. بلورات الكوارتز الطبيعية لها بنية غير منتظمة وغير متماثلة، وهي على نوعين، تختلف في شكلها، مثل الجسم عن صورته في المرآة. تقوم هذه البلورات بتدوير مستوى استقطاب الضوء في اتجاهين متعاكسين؛ لقد تم تسميتهم باليد اليمنى واليسرى.
في عام 1815، أثبت عالم فيزياء فرنسي آخر، جان بابتيست بيوت، وعالم فيزياء ألماني توماس سيبيك، أن بعض المواد العضوية (على سبيل المثال، السكر أو زيت التربنتين) لها أيضًا هذه الخاصية، ليس فقط في الحالة البلورية، ولكن أيضًا في الحالة السائلة والمذابة وحتى الغازية. لذلك ثبت أن النشاط البصري يمكن أن يرتبط ليس فقط بعدم تناسق البلورات، ولكن أيضًا ببعض الخصائص غير المعروفة للجزيئات نفسها. اتضح أنه، كما هو الحال في حالة البلورات، بعض مركبات كيميائيةيمكن أن توجد في شكل كلا النوعين الأيمن والأيسر، والتحليل الكيميائي الأكثر دقة لا يكشف عن أي اختلافات بينهما! في الواقع، كان نوعًا جديدًا من الأيزومرية، والذي كان يسمى الأيزومرية البصرية. اتضح أنه بالإضافة إلى dextrorotatory وlevorotatory، هناك أيضا نوع ثالث من الايزومرات - غير نشطة بصريا. تم اكتشاف هذا في عام 1830 من قبل الكيميائي الألماني الشهير ينس جاكوب بيرسيليوس باستخدام حمض العنب (ثنائي هيدروكسي سوسنيك) HOOCCH(OH)CH(OH)COOH كمثال: هذا الحمض غير نشط بصريًا، وحمض الطرطريك الذي له نفس التركيبة تمامًا له دوران صحيح في حل. في وقت لاحق، تم اكتشاف حمض الطرطريك "الأيسر"، وهو غير موجود في الطبيعة - وهو عكس dextrorotatory.
يمكنك التمييز بين الأيزومرات الضوئية باستخدام مقياس الاستقطاب، وهو جهاز يقيس زاوية دوران مستوى الاستقطاب. بالنسبة للحلول، تعتمد هذه الزاوية خطيا على سمك الطبقة وتركيز المادة الفعالة بصريا (قانون بيوت). بالنسبة للمواد المختلفة، يمكن أن يختلف النشاط البصري على نطاق واسع جدًا. لذلك، في حالة المحاليل المائية للأحماض الأمينية المختلفة عند 25 درجة مئوية، يكون النشاط المحدد (يشار إليه بالرمز D ويقاس للضوء بطول موجي 589 نانومتر بتركيز 1 جم / مل وسمك طبقة 10 سم) هو 232 درجة للسيستين، 86، 2 درجة للبرولين، 11.0 درجة لليوسين، +1.8 درجة للألانين، +13.5 درجة لليسين و +33.2 درجة للأسباراجين. تتيح مقاييس الاستقطاب الحديثة قياس الدوران البصري بدقة عالية جدًا (تصل إلى 0.001 درجة). تسمح لك هذه القياسات بتحديد تركيز المواد الفعالة بصريًا بسرعة ودقة، على سبيل المثال، محتوى السكر في المحاليل في جميع مراحل إنتاجها، بدءًا من المنتجات الخام وحتى المحاليل المركزة ودبس السكر.
اكتشاف باستور.
ارتبط النشاط البصري لبلورات الفيزياء بعدم تناسقها؛ البلورات المتناظرة تمامًا، مثل بلورات الملح المكعبة، تكون غير نشطة بصريًا. ظل سبب النشاط البصري للجزيئات غامضًا تمامًا لفترة طويلة. أول اكتشاف يسلط الضوء على هذه الظاهرة تم في عام 1848 على يد لويس باستور المجهول. حتى عندما كان طالبًا، كان باستور مهتمًا بالكيمياء وعلم البلورات، وعمل تحت إشراف الفيزيائي جي بي بيوت والكيميائي الفرنسي البارز جان بابتيست دوما. بعد تخرجه من المدرسة العليا للمعلمين في باريس، عمل باستور الشاب (كان عمره 26 عامًا فقط) كمساعد مختبر لأنطوان بالارد. كان بالار بالفعل كيميائيًا مشهورًا، وقد اشتهر قبل 22 عامًا باكتشاف عنصر جديد، وهو البروم. أعطى مساعده موضوعا في علم البلورات، ولم يتوقع أن يؤدي ذلك إلى اكتشاف رائع.
وفي سياق الدراسة، حصل باستير على ملح الصوديوم الحمضي لحمض العنب C4H5O6Na، وأشبع المحلول بالأمونيا وبخر الماء ببطء، وحصل على بلورات منشورية جميلة من ملح أمونيوم الصوديوم C4H3O6NaNH 4 . تبين أن هذه البلورات غير متماثلة، وكان بعضها كما لو كانت صورة مرآة للآخرين: كان نصف البلورات جانبًا مميزًا واحدًا على اليمين، بينما كان لدى البعض الآخر وجه واحد على اليسار. مسلحًا بعدسة مكبرة وملاقط، قام باستير بتقسيم البلورات إلى كومتين. حلولهم، كما هو متوقع، كان لها الدوران البصري المعاكس. ولم يتوقف باستور عند هذا الحد. وقام بعزل الحمض الأصلي (الذي كان غير نشط) من كل محلول. وما كانت مفاجأته عندما تبين أن أحد المحلولين هو حمض الطرطريك المعروف، والآخر هو نفس الحمض، ولكن يدور إلى اليسار!
تشهد ذكريات شهود العيان على الإثارة العصبية المذهلة للعالم الشاب التي استولى عليه في تلك اللحظة؛ بعد أن أدرك باستور ما تمكن من فعله، خرج من المختبر، والتقى بمساعد مختبر في مكتب الفيزياء، وهرع إليه واحتضنه وصرخ: "لقد قمت للتو باكتشاف عظيم!" ويتكون ذلك من حقيقة أن حمض الطرطريك غير النشط المعروف منذ فترة طويلة هو ببساطة مزيج من كميات متساوية من حمض الطرطريك "الأيمن" المعروف أيضًا والحمض "الأيسر" غير المعروف سابقًا. ولهذا السبب ليس للخليط نشاط بصري. لمثل هذا الخليط، بدأ استخدام اسم Racemate (من عنب Racemus اللاتيني). وكان يطلق على نقيضي حمض الطرطريك الذي حصل عليه باستور اسم enantiomers (من المقابل اليوناني enantios). قدم لهم باستير التسميات L- و D-isomers (من الكلمات اللاتينية laevus left و dexter right). لاحقًا، ربط الكيميائي الألماني إميل فيشر هذه التسميات ببنية اثنين من المتصاوغات الضوئية لواحدة من أبسط المواد الفعالة بصريًا، وهي جليسرالديهيد OHCH 2 CH(OH)CHO. في عام 1956، بناءً على اقتراح الكيميائيين الإنجليز روبرت كان وكريستوفر إنجولد والكيميائي السويسري فلاديمير بريلوج، تم إدخال التسميات S (من اللاتينية الشريرة على اليسار) وR (باللاتينية المستقيمة على اليمين) للإيزومرات الضوئية؛ يُشار إلى زميل السباق بالرمز RS. ومع ذلك، وفقا للتقاليد، يتم استخدام التسميات القديمة أيضا على نطاق واسع (على سبيل المثال، للكربوهيدرات والأحماض الأمينية). تجدر الإشارة إلى أن هذه الحروف تشير فقط إلى بنية الجزيء (الترتيب "الأيمن" أو "الأيسر" لمجموعات كيميائية معينة) ولا تتعلق باتجاه الدوران البصري؛ يُشار إلى الأخير بعلامات زائد وناقص، على سبيل المثال، D()-فركتوز، D(+)-جلوكوز.
بالإضافة إلى "الطريقة اليدوية"، اكتشف باستير طريقتين أخريين لفصل العنصر إلى نقيضين. تعتمد الطريقة الكيميائية الحيوية على القدرة الانتقائية لبعض الكائنات الحية الدقيقة على امتصاص واحد فقط من الأيزومرات. على سبيل المثال، الفطريات زرق البنسليوم، ينمو في المحاليل المخففة لحمض الطرطريك أو أملاحه، "يأكل" فقط الأيزومر الأيمن، ويترك الأيزومر الأيسر دون تغيير.
الطريقة الثالثة لفصل زملاء العرق كانت كيميائية بحتة. ولكن بالنسبة له، كان من الضروري أن يكون لديك مسبقًا مادة نشطة بصريًا، والتي، عند التفاعل مع خليط راسيمي، سوف "تختار" متماثلًا واحدًا فقط منه. على سبيل المثال، أعطت قاعدة عضوية نشطة بصريًا ملحًا نشطًا بصريًا مع حمض الطرطريك، والذي يمكن من خلاله عزل المجسم المقابل لحمض الطرطريك.
نظرية الايزومرية البصرية.
أدى عمل باستور، الذي أثبت إمكانية "تقسيم" مركب غير نشط بصريًا إلى مضادات الأضداد، إلى إثارة عدم الثقة بين العديد من الكيميائيين في البداية. وحتى بيوت نفسه لم يصدق مساعده، حتى كرر تجربته بيديه واقتنع بأن باستور كان على حق. جذبت هذه الأعمال والأعمال اللاحقة لباستير اهتمامًا وثيقًا من قبل الكيميائيين. وسرعان ما قام جوزيف لو بيل، باستخدام طريقة باستير الثالثة، بتقسيم العديد من الكحوليات إلى أضداد نشطة بصريًا. أثبت يوهان ويسليسينوس أن هناك نوعين من أحماض اللاكتيك: غير نشط بصريًا، ويتكون في اللبن الرائب (حمض اللاكتيك المخمر)، وحمض اللاكتيك الذي يظهر في العضلات العاملة (حمض اللاكتيك الموجود في اللحوم). كان هناك المزيد والمزيد من هذه الأمثلة، وكانت هناك حاجة إلى نظرية لشرح كيفية اختلاف جزيئات الأضداد عن بعضها البعض. تم إنشاء مثل هذه النظرية من قبل العالم الهولندي الشاب فانت هوف. ووفقا لهذه النظرية، فإن الجزيئات، مثل البلورات، يمكن أن تكون "يمنى" و"يسارية"، كونها صورة مرآة لبعضها البعض. أبسط مثالكان مثل هذا. ذرة الكربون في المركبات العضوية رباعية التكافؤ، وتتجه منها أربع روابط كيميائية تحتها زوايا متساويةإلى رؤوس رباعي السطوح. إذا كانت جميع الذرات أو مجموعات الذرات الموجودة في رؤوس رباعي الاسطح والمرتبطة بذرة الكربون المركزية مختلفة، فمن الممكن وجود هيكلين مختلفين لا يتم دمجهما مع بعضهما البعض عن طريق الدوران في الفضاء. إذا كان اثنان على الأقل من البدائل الأربعة متماثلين، فستصبح الجزيئات متطابقة تمامًا (من السهل التحقق من ذلك باستخدام نموذج من أعواد الثقاب والبلاستيك الملون). تسمى هذه الهياكل، التي تختلف عن بعضها البعض مثل اليد اليمنى عن اليسرى، مراوان (من اليد الوريثة اليونانية). وبالتالي، فإن النشاط البصري هو نتيجة الأيزومرية المكانية (الأيزومرية الفراغية) للجزيئات.
تسمى ذرة الكربون المرتبطة بأربعة بدائل مختلفة غير متماثلة. يمكن أيضًا أن تكون ذرات العناصر الأخرى مثل السيليكون والنيتروجين والفوسفور والكبريت غير متماثلة. ومع ذلك، يمكن أيضًا للمركبات التي لا تحتوي على ذرات كربون غير متماثلة أن تكون نشطة بصريًا إذا أمكن وجودها على شكل أيزومرين مرآتين. سيكون الجزيء غير متماثل إذا لم يكن لديه عنصر تناظر واحد، لا مركز ولا محاور ولا مستوى تناظر. ومن الأمثلة على ذلك جزيء الألين H 2 C=C=CH 2 ، الذي له بديلين مختلفين: R 1 R 2 C=C=CR 1 R 2 . والحقيقة هي أن هذه البدائل ليست في نفس المستوى (كما هو الحال، على سبيل المثال، في الألكينات)، ولكن في مستويين متعامدين بشكل متبادل. ولذلك فمن الممكن وجود اثنين من الأيزومرات المرآة، والتي لا يمكن دمجها مع بعضها البعض عن طريق أي إزاحة أو دوران.
تحدث علاقات أكثر تعقيدًا في حالة الجزيئات التي تحتوي على عدة ذرات كربون غير متماثلة. على سبيل المثال، في حمض الطرطريك، يمكن ترتيب مجموعتي هيدروكسيل على ذرتين كربون متجاورتين بحيث يكون الجزيء متماثلًا ولا يحتوي على أيزومرات مرآة. يؤدي هذا إلى تكوين أيزومر آخر غير نشط بصريًا، يسمى حمض الميزو-طرطريك (أو مضاد الطرطريك). وبالتالي، يمكن أن يكون حمض ثنائي هيدروكسي سوتشينيك في شكل أربعة أيزومرات: دكستروتوري (حمض د-طرطريك، والذي يسمى في الطب حمض الطرطريك)، ليفوروتوري (حمض ل-طرطريك)، غير نشط بصريا (حمض ميسوتارتاريك)، وأيضا كخليط من أيزومرات L- وR، أي راسيمات (حمض الطرطريك أو حمض الطرطريك). أحماض الطرطريك النشطة بصريًا، عندما يتم تسخين محاليلها المائية لفترة طويلة، تتجمع وتتحول إلى خليط من الأضداد.
يصبح الوضع أكثر تعقيدًا عندما يكون هناك العديد من المراكز غير المتماثلة في الجزيء. على سبيل المثال، هناك أربعة منهم في جزيء الجلوكوز. لذلك، فمن الممكن نظريًا وجود 16 متصاوغًا مجسمًا، والتي تشكل 8 أزواج من الأضداد المرآة. لقد كانت معروفة منذ زمن طويل لدى الكيميائيين. وهو الجلوكوز نفسه، وكذلك الألوز، والتروز، والمانوز، والجولوز، والإيدوز، والجلاكتوز، والتالوز. العديد منها يحدث بشكل طبيعي، مثل D-glucose (ولكن ليس L-glucose، الذي تم إنتاجه صناعيًا).
إذا كانت المادة تحتوي على عدد متساو من الجزيئات "اليمنى" و"اليسرى"، فستكون غير نشطة بصريًا. يتم الحصول على هذه المواد في القارورة نتيجة للتخليق الكيميائي التقليدي. وفقط في الكائنات الحية، بمشاركة عوامل غير متماثلة (على سبيل المثال، الإنزيمات)، يتم تشكيل المركبات النشطة بصريا. بالطبع، نشأ السؤال على الفور حول كيفية ظهور هذه المركبات على الأرض، على سبيل المثال، نفس حمض الطرطريك الطبيعي، أو الكائنات الحية الدقيقة "غير المتماثلة" التي تتغذى على واحد فقط من المتبلورات الضوئية. وبالفعل، في غياب الإنسان، لم يكن هناك من يقوم بالتوليف الموجه للمواد الفعالة بصريًا، ولم يكن هناك من يقسم البلورات إلى يمين ويسار! ومع ذلك، تبين أن هذه الأسئلة معقدة للغاية بحيث لا توجد إجابة عليها حتى يومنا هذا. على سبيل المثال، لا أحد يعرف لماذا تنتمي جميع الأحماض الأمينية الطبيعية التي تُبنى منها البروتينات إلى السلسلة L (التكوين S)، ولا توجد أضدادها إلا في بعض الأحيان في بعض المضادات الحيوية.
لم تحظى نظرية فانت هوف بالاعتراف على الفور. وهكذا، نشر الكيميائي التجريبي الألماني البارز أدولف كولبي (تم تسمية العديد من التفاعلات العضوية باسمه) مقالًا لاذعًا في مايو 1877 تحدث فيه بشكل سلبي حاد عن النظرية الجديدة. لحسن الحظ، كان كولبي في أقلية واضحة، وحصلت نظرية فانت هوف، التي أرست أسس الكيمياء المجسمة الحديثة، على اعتراف عام، وأصبح منشئها في عام 1901 هو الحائز الأول. جائزة نوبلفي الكيمياء.
مكنت هذه النظرية من تفسير العديد من الظواهر الكيميائية. على سبيل المثال، في تفاعلات استبدال ذرات الهالوجين بمجموعات الهيدروكسيل: في هاليدات الألكيل النشطة بصريًا RX + OH ® ROH + X (X ذرة الهالوجين)، في بعض الحالات، يختفي النشاط البصري، وفي حالات أخرى يبقى، ولكن تتغير الإشارة. اتضح أن رد الفعل هذا يمكن أن يحدث بطرق مختلفة. تتضمن الآلية الأولى تفكك الهاليد وتكوين أيونات R + المتوسطة، والتي تتحد بسرعة مع أنيونات OH، مما يعطي منتج التفاعل الكحول. إذا كان للهاليد الأولي RX نشاط بصري، فإنه يُفقد نتيجة لهذا التفاعل، حيث يمكن للهيدروكسيل أن يقترب من الكاتيون المستوي المتوسط من أي جانب، بحيث يتم تشكيل خليط من المتصاوغات الضوئية. إذا استمر التفاعل وفقًا للآلية الثانية، يقترب أنيون OH من ذرة الكربون من الجانب المقابل لرابطة CX و"يزيح" ذرة الهالوجين على شكل أنيون. إذا كان للهاليد الأولي R 1 R 2 R 3 CX نشاط بصري، فإنه يتم الاحتفاظ به نتيجة لهذا التفاعل، ولكن يتم عكس إشارة الدوران البصري. يحدث هذا لأن البدائل الثلاثة عند ذرة الكربون غير المتماثلة R 1 وR 2 وR 3، والتي، مثل ذرة الهالوجين، الموجودة في رؤوس رباعي السطوح، تغير تكوينها بالنسبة إلى البديل الرابع عندما يقترب العامل المهاجم الهيدروكسيل؛ مثل هذا التغيير في التكوين مشابه لقلب المظلة من الداخل إلى الخارج في ظل ريح قوية.
الايزومرية البصرية والحياة.
يشير الكيميائيون في كثير من الأحيان إلى المتصاوغات الضوئية كمركب واحد لأنها الخواص الكيميائيةمتطابقة. ومع ذلك، يمكن أن يكون نشاطهم البيولوجي مختلفا تماما. وقد أصبح هذا واضحا بعد القصة المأساوية للثاليدومايد، وهو عقار ظهر في الستينيات من القرن العشرين. وصفه الأطباء في العديد من البلدان للنساء الحوامل كحبوب منومة ومهدئة فعالة. ومع ذلك، مع مرور الوقت، له رهيب أثر جانبي: تبين أن المادة ماسخة (تضر بالجنين، من وحش تيراتوس اليوناني، غريب الأطوار)، وولد الكثير من الأطفال المصابين بتشوهات خلقية. لم يكن الأمر كذلك إلا في أواخر الثمانينيات عندما أصبح من الواضح أن واحدًا فقط من مصاوغات الثاليدومايد، وهو شكله الدوراني، هو سبب هذه المحنة. لسوء الحظ، هذا الاختلاف في العمل أشكال الجرعاتلم يكن معروفًا من قبل، وكان الثاليدومايد عبارة عن خليط راسيمي من كلا الأضداد.
في الوقت الحاضر، كثيرة الأدويةمتوفرة كمركبات نقية بصريا. وهكذا، فمن بين الأدوية الـ 25 الأكثر شيوعًا في الولايات المتحدة، هناك ستة فقط عبارة عن مركبات غير كيرالية، وثلاثة منها عبارة عن مركبات عرقية، والباقي عبارة عن متصاوغات ضوئية نقية. يتم الحصول على الأخير من خلال ثلاث طرق: فصل الخلائط الراسيمي، وتعديل المركبات الطبيعية النشطة بصريًا (بما في ذلك الكربوهيدرات، والأحماض الأمينية، والتربين، وأحماض اللاكتيك والطرطريك، وما إلى ذلك) والتوليف المباشر. على سبيل المثال، قامت شركة Merck الكيميائية المعروفة بتطوير طريقة لإنتاج عقار methyldopa الخافض لضغط الدم، والذي يتضمن التبلور التلقائي لل enantiomer المطلوب فقط عن طريق إدخال بذرة صغيرة من هذا الأيزومر في المحلول. يتطلب التوليف المباشر أيضًا مصادر مراوانية، مقارنة بأي مصادر أخرى الطرق التقليديةالتوليف يعطي كلاً من المتصاوغات الضوئية بنسب متساوية من Racemate. بالمناسبة، هذا هو أحد الأسباب التكلفة العاليةبعض الأدوية، لأن التوليف الموجه لواحد منها فقط أمر بالغ الأهمية مهمة صعبة. لذلك، ليس من المستغرب أنه من بين أكثر من 500 عقار كيرالي اصطناعي يتم إنتاجه في جميع أنحاء العالم، فإن حوالي عُشرها فقط نقي بصريًا. في الوقت نفسه، من بين 517 مستحضرًا تم الحصول عليها من مواد خام طبيعية، هناك ثمانية فقط من زملاء السباق.
يتم تفسير الحاجة إلى مضادات بصرية نقية من خلال حقيقة أنه غالبًا ما يكون واحد منهم فقط هو المطلوب تأثير علاجي، في حين أن الضد الثاني يمكن أن يسبب غير مرغوب فيه آثار جانبيةأو حتى تكون سامة. ويحدث أيضًا أن كل enantiomer له تأثيره المحدد. لذلك، S() - هرمون الغدة الدرقية (“ليفوترويد”) هو هرمون الغدة الدرقية الطبيعي. و dextrorotatory R (+) - هرمون الغدة الدرقية ("دكسترويد") يخفض نسبة الكوليسترول في الدم. بعض الشركات المصنعة تأتي بأسماء تجارية متناوبة لمثل هذه الحالات، مثل دارفون ونوفراد.
ما الذي يفسر الإجراءات المختلفة للمضادات الضوئية؟ الإنسان كائن حلزوني. كل من جسده وجزيئات المواد النشطة بيولوجيا التي يتكون منها غير متماثلة. يمكن لجزيئات الدواء اللامركزية، التي تتفاعل مع مراكز معينة في الجسم، مثل الإنزيمات، أن تتصرف بشكل مختلف اعتمادًا على نوع الدواء. يتناسب الدواء "الصحيح" مع مستقبله مثل مفتاح القفل ويبدأ التفاعل الكيميائي الحيوي المطلوب. يمكن تشبيه عمل المضاد "الخاطئ" بمحاولة مصافحة اليد اليمنى لضيفه بيده اليمنى.
إذا كان الدواء عبارة عن راسيمات، فقد يكون أحد المتصاوغات الضوئية غير مبالٍ في أحسن الأحوال، وفي أسوأ الأحوال يسبب تأثيرًا غير مرغوب فيه تمامًا. وهنا بعض الأمثلة. وبالتالي، فإن العامل المضاد لاضطراب النظم S()-anaprilin يعمل أقوى 100 مرة من الشكل R(+)! في حالة فيراباميل، يكون لكل من المتصاوغات الضوئية تأثير مماثل، ولكن شكله R(+) له تأثير جانبي أقل خطورة على الاكتئاب القلبي. يمكن أن يسبب الكيتامين المستخدم للتخدير آثارًا جانبية في شكل هياج وهذيان وما إلى ذلك لدى 50٪ من المرضى، وهذا متأصل بشكل أساسي في أيزومر R () وكذلك في راسيمات السباق. ، فهو نشط بشكل رئيسي في أيزومر S ( ) ، في حين أن مضاده R (+) يسبب الغثيان، لذلك في وقت واحد تم استبدال الليفاميزول الراسيمي بأحد المتصاوغات. ولكن اتضح أنه ليس من المنطقي دائما من الناحية الاقتصادية تجميع الأيزومرات النقية. على سبيل المثال، بالنسبة للإيبوبروفين المسكن المستخدم على نطاق واسع، تحت تأثير الإنزيمات، من الممكن تحويل شكل R() غير النشط علاجيًا إلى أيزومر S(+) النشط، لذلك، في هذه الحالة، يمكن استخدام عنصر سباق أرخص بكثير. مستخدم.
يتجلى العمل البيولوجي المختلف للأيزومرات "اليمنى" و"اليسار" ليس فقط بين الأدوية، ولكن في جميع الحالات عندما يتفاعل المركب اللولبي مع الكائنات الحية. مثال صارخالحمض الأميني آيزوليوسين: أيزومره ديكستروروتوري حلو، وأيزومره أيسومره مر. مثال آخر. الكارفون مادة ذات رائحة قوية جدًا (أنف الإنسان قادر على شمها بمحتوى لا يتجاوز 17 جزءًا من مليون مليجرام لكل لتر في الهواء). يتم عزل الكارفون من الكمون، حيث يحتوي زيته على حوالي 60٪. ومع ذلك، يوجد نفس المركب تمامًا بنفس البنية في زيت النعناع، حيث يصل محتواه إلى 70٪. سيوافق الجميع على أن رائحة النعناع والكمون ليست متماثلة على الإطلاق. اتضح أنه في الواقع هناك كارفونان "يمين" و "يسار". يشير الاختلاف في الرائحة بين هذه المركبات إلى أن الخلايا المستقبلة في الأنف المسؤولة عن إدراك الرائحة يجب أن تكون أيضًا حلزونية.
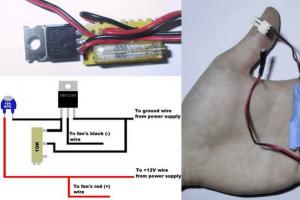
دعونا نعود الآن إلى الصيغة المرسومة على الكلب والذئب. البنسيلامين (3،3-ثنائي ميثيل سيستين) هو مشتق بسيط إلى حد ما من الحمض الأميني السيستين. تستخدم هذه المادة في حالات التسمم الحاد والمزمن بالنحاس والزئبق والرصاص وغيرها من المعادن الثقيلة، حيث أن لها القدرة على تكوين معقدات قوية مع أيونات هذه المعادن؛ تتم إزالة المجمعات الناتجة عن طريق الكلى. يستخدم البنسيلامين أيضًا في أشكال مختلفة من التهاب المفاصل الروماتويدي، وفي تصلب الجلد الجهازي، وفي عدد من الحالات الأخرى. في هذه الحالة، يتم استخدام الشكل S فقط من الدواء، نظرًا لأن الأيزومر R سام ويمكن أن يؤدي إلى العمى.
لم تحظى نظرية فانت هوف بالاعتراف على الفور. وهكذا، نشر الكيميائي التجريبي الألماني البارز أدولف كولبي (تم تسمية العديد من التفاعلات العضوية باسمه) مقالًا لاذعًا في مايو 1877 تحدث فيه بشكل سلبي حاد عن النظرية الجديدة. لحسن الحظ، كان كولبي ضمن أقلية واضحة، وحازت نظرية فانت هوف، التي أرست أسس الكيمياء المجسمة الحديثة، على اعتراف عام، وأصبح منشئها في عام 1901 أول حائز على جائزة نوبل في الكيمياء.
ايليا لينسون
غالبًا ما يُقال في الأدبيات أن الأحماض الأمينية اليسرى فقط هي المناسبة للتغذية وكعناصر هيكلية لعملية التمثيل الغذائي لدينا. من الناحية النفسية، هذا أمر مفهوم: غالبًا ما تنتمي الأحماض الأمينية الطبيعية إلى ما يسمى بسلسلة L، وعادةً ما يرتبط الحرف L بمفهوم "اليسار". ومع ذلك، فإن مثل هذا "التخصيص" للمركبات L إلى اليسار، ومركبات السلسلة D - إلى dextrorotatory هو خطأ تماما. يكفي أن ننظر على الأقل إلى قائمة أهم 23 من الأحماض الأمينية البروتينية (يتم تقديمها، على سبيل المثال، في الكتاب المدرسي لـ A. N. Nesmeyanov و N. A. Nesmeyanov "مبادئ الكيمياء العضوية") للتأكد من أن الدوران الأيسر (للحلول) في حمض الخليك الجليدي) - سبعة فقط، أي أقل من الثلث. أما الباقي فهو عبارة عن دكستروروتاتوري، باستثناء الجليسين غير النشط بصريًا. في "الموسوعة الكيميائية" في قائمة الأحماض الأمينية الـ 26 الأكثر شيوعًا، يوجد عدد أقل، ستة فقط (23٪). كثير من الناس يخلطون بين اتجاه دوران مستوى استقطاب الضوء بواسطة المادة وبنية جزيئاتها، والتي يمكن أن تعزى إلى النوع D أو L.
استقطاب الضوء والنشاط البصري
منذ زمن نيوتن، كانت هناك خلافات في العلم: الضوء عبارة عن موجات أو جسيمات. صاغ توماس يونغ في عام 1800 مبدأ تراكب الموجات وشرح على أساسه ظاهرة تداخل الضوء. في عام 1808، اكتشف إتيان لويس مالوس، أثناء تجاربه على بلورات الصاري الأيسلندي (الكالسيت)، ظاهرة استقطاب الضوء. في عام 1816، اقترح أوغسطين جان فريسنل فكرة أن موجات الضوء مستعرضة. كما أوضح فريسنل ظاهرة استقطاب الضوء: في الضوء العادي، تحدث التذبذبات بشكل عشوائي، في جميع الاتجاهات المتعامدة مع اتجاه الشعاع. ولكن، من خلال المرور عبر بعض البلورات، مثل الصاري الأيسلندي أو التورمالين، يكتسب الضوء خصائص خاصة: تتأرجح الأمواج الموجودة فيه في مستوى واحد فقط. وبالمعنى المجازي، فإن شعاعًا من هذا الضوء يشبه خيطًا صوفيًا يُسحب عبر فجوة ضيقة بين شفرتي حلاقة حادتين. يمكن للعين البشرية فقط في حالات نادرة وبصعوبة التمييز بين الضوء العادي والضوء المستقطب، ولكن يمكن القيام بذلك بسهولة باستخدام أبسط الأدوات البصرية - مقاييس الاستقطاب.
وقد وجد أيضًا أنه عندما يمر الضوء المستقطب عبر مواد معينة، فإن مستوى الاستقطاب يدور. تم اكتشاف هذه الظاهرة لأول مرة في عام 1811 من قبل فرانسوا دومينيك أراجو في بلورات الكوارتز. بلورات الكوارتز الطبيعية لها بنية غير منتظمة وغير متماثلة، وهي على نوعين، تختلف في شكلها، مثل الجسم عن صورته في المرآة. تقوم هذه البلورات بتدوير مستوى استقطاب الضوء في اتجاهين متعاكسين؛ لقد تم تسميتهم باليد اليمنى واليسرى.
في عام 1815، وجد جان بابتيست بيوت وتوماس سيبيك أن بعض المواد العضوية (على سبيل المثال، السكر أو زيت التربنتين) لديها أيضًا القدرة على تدوير مستوى الاستقطاب، ليس فقط في الحالة البلورية، ولكن أيضًا في الحالة السائلة والمذابة وحتى الغازية. . لذلك ثبت أن النشاط البصري يمكن أن يرتبط ليس فقط بعدم تناسق البلورات، ولكن أيضًا ببعض الخصائص غير المعروفة للجزيئات نفسها. كما هو الحال في البلورات، يمكن أن توجد بعض المركبات الكيميائية في شكل أصناف يمينية ويسارية، ولم يتمكن التحليل الكيميائي الأكثر دقة من العثور على أي اختلافات بينهما. كانت تسمى هذه الأصناف بالإيزومرات الضوئية، وكانت المركبات نفسها تسمى النشطة بصريًا. اتضح أن المواد النشطة بصريًا تحتوي أيضًا على نوع ثالث من الأيزومر - غير نشط بصريًا. تم اكتشاف هذا في عام 1830 من قبل الكيميائي الألماني الشهير جين جاكوب بيرزيليوس: حمض الطرطريك C 4 H 6 0 6 غير نشط بصريًا، وحمض الطرطريك الذي له نفس التركيبة تمامًا له دوران يمين في المحلول. في وقت لاحق، تم اكتشاف حمض الطرطريك "الأيسر"، وهو غير موجود في الطبيعة - وهو نقيض dextrorotatory.
في عام 1828، صمم ويليام نيكول، باستخدام بلورات شفافة من الصاري الأيسلندي، مستقطبًا للضوء - "منشور نيكول". وبعد أن أجرى في عام 1839 مزيجًا من اثنين من هذه المنشورات، حصل على مقياس الاستقطاب - جهاز لقياس زاوية دوران مستوى استقطاب الضوء. منذ ذلك الحين، أصبح مقياس الاستقطاب هذا واحدًا من أكثر الأدوات شيوعًا في المختبرات الفيزيائية.
اكتشاف باستور
ارتبط النشاط البصري لبلورات الفيزياء بعدم تناسقها؛ البلورات المتناظرة تمامًا، مثل بلورات الملح المكعبة، تكون غير نشطة بصريًا. ظل سبب النشاط البصري للجزيئات لغزا لفترة طويلة. أول اكتشاف سلط الضوء على هذه الظاهرة تم في عام 1848 على يد لويس باستور. حتى في سنوات دراسته، أصبح مهتما بالكيمياء وعلم البلورات، بعد تخرجه من المدرسة العليا للمعلمين في باريس، عمل باستور البالغ من العمر 26 عاما كمساعد مختبر مع أنطوان بالارد (مكتشف البروم).
أثناء الدراسة، أعد باستور محلول ملح الصوديوم الحمضي لحمض الطرطريك HOOC-CHOH-CHOH-COONa، مشبع المحلول بالأمونيا، وبتبخر الماء ببطء، حصل على بلورات منشورية جميلة من رباعي هيدرات ملح الصوديوم والأمونيوم Na. (NH) 4 C 4 H 4 O 6 4 H 2 O. وتبين أن هذه البلورات غير متماثلة. وكان لبعض البلورات وجه مميز واحد على اليمين، بينما كان لبعضها الآخر وجه مميز على اليسار، وكان شكل النوعين من البلورات بمثابة صورة مرآة لبعضها البعض. تحولت تلك البلورات وغيرها على قدم المساواة. مع العلم أنه في مثل هذه الحالات تدور بلورات الكوارتز في اتجاهات مختلفة، قرر باستور التحقق مما إذا كان سيتم ملاحظة هذه الظاهرة على الملح الذي تلقاه. مسلحًا بعدسة مكبرة وملاقط، قام باستير بتقسيم البلورات بعناية إلى كومتين. كان لحلولهم، كما هو متوقع، دوران بصري معاكس، وكان خليط المحاليل غير نشط بصريًا. ولم يكن من الواضح سبب ظهور بلورات في إحدى المواد الأولية أشكال مختلفة. ولم يتوقف باستور عند هذا الحد. قام بترسيب الرصاص غير القابل للذوبان أو ملح الباريوم من كل محلول، ومن خلال التأثير على هذه الأملاح بحمض الكبريتيك القوي، قام بإزاحة الأملاح العضوية الأضعف منها. ويمكن الافتراض أنه في كلتا الحالتين سيتم الحصول على حمض الطرطريك الأصلي، والذي، كما نتذكر، كان غير نشط. ما كانت مفاجأة باستير عندما تبين أنه ليس حمض العنب، ولكن حمض الطرطريك المعروف، يتكون من محلول ملحي واحد، ويتم الحصول على نفس الحمض، ولكن بالتناوب إلى اليسار، من محلول آخر! حتى ذلك الحين، لم يكن أحد قد رأى حمض الطرطريك أعسر! وتسمى هذه الأحماض د- فينوس للصنف dextrorotatory (من اللات. دكستر- صحيح) و ل- فينوس للأيزومر الأيسر (من خطوط الطول. laevus- غادر).
كان الاكتشاف هو أن حمض الطرطريك الخامل المعروف منذ فترة طويلة تبين أنه عبارة عن خليط من كميات متساوية من حمض الطرطريك "الأيمن" المعروف أيضًا وحمض الطرطريك "الأيسر" غير المعروف سابقًا. هذا هو السبب في أن خليطهم في البلورة أو في المحلول ليس له نشاط بصري. لمثل هذا الخليط، بدأ استخدام اسم Racemate (من اللاتينية سباق- عنب؛ باللاتيني حمض راسميكوم- حمض الطرطريك) واثنين من الأضداد التي عند خلطها بكميات متساوية تعطي خليطًا غير نشط بصريًا تسمى المتقابلات الضوئية (من اليونانية. com.enantios- عكس). كان باستور محظوظاً: ففي المستقبل، لم يتم اكتشاف سوى عدد قليل من حالات التبلور المماثلة عند درجة حرارة معينة لخليط من بلورات مختلفة بصرياً، كبيرة بما يكفي لفصلها تحت عدسة مكبرة باستخدام ملاقط. علاوة على ذلك، فإن ملح الصوديوم والأمونيوم لحمض الطرطريك، الذي عمل به باستير، يشكل بلورات ذات أشكال مختلفة فقط إذا حدث التبلور من محلول درجة حرارته أقل من 28 درجة مئوية. في هذه الحالة، يترسب رباعي الهيدرات. مع المزيد درجات حرارة عاليةتترسب بلورات أحادية الهيدرات المتناظرة من المحلول.
وسرعان ما اكتشف باستير أيضًا الشكل الرابع لحمض الطرطريك. لقد كان غير نشط بصريًا، لكنه لم يكن زميلًا للسباق، لأنه كان من المستحيل فصله إلى أضداد. وقد أطلق باستور على هذا الحمض اسم "ميسوترتاريك" من اليونانية. متوسط- متوسط، متوسط. اكتشف باستير طريقتين إضافيتين لتقسيم العنصر إلى نقيضين. تعتمد الطريقة الكيميائية الحيوية على القدرة الانتقائية لبعض الكائنات الحية الدقيقة على امتصاص واحد فقط من الأيزومرات. وهنا كان باستور محظوظا. أعطاه أحد صيادلة العطارين زجاجة حامض العنب طويلة الأمد، بدأ فيها العفن الأخضر. اكتشف باستور في مختبره أن الحمض الذي كان خاملاً أصبح أعسرًا. فطر العفن الأخضر زرق البنسليومفي محلول حمض الطرطريك المخفف أو أملاحه، فإنه "يأكل" فقط الأيزومر الأيمن، ويترك الأيزومر الأيسر دون تغيير. هذا القالب له نفس التأثير على حمض المندليك "غير النشط"، فقط في هذه الحالة يستوعب الأيزومر اليساري دون لمس الأيزومر الدوار. أصبحت العديد من هذه الحالات معروفة. على سبيل المثال، الخميرة Saccharomycete ellipsoidalis ( السكاروميسيس الإهليلجي)، خلافا زرق البنسليوم، "يتخصص" في الأيزومر الأيمن لحمض المندليك، ويترك الأيزومر الأيسر دون تغيير. هناك طريقة أخرى لفصل زملاء العرق وهي الطريقة الكيميائية. لقد كان مطلوبًا مسبقًا أن يكون لديك مادة نشطة بصريًا، والتي، عند التفاعل مع خليط راسيمي، سوف "تختار" متبلورًا واحدًا فقط منه. على سبيل المثال، أعطت قاعدة نشطة بصريًا ملحًا نشطًا بصريًا مع حمض الطرطريك، والذي يمكن من خلاله عزل المطابق المقابل من الطرطريك والحمض.
أدى عمل باستير، الذي أثبت إمكانية "تقسيم" مركب غير نشط بصريًا إلى أضداد، إلى إثارة عدم الثقة بين العديد من الكيميائيين في البداية. حتى بيوت نفسه لم يصدق مساعده حتى كرر تجربته بيده. وسرعان ما قام جوزيف لو بيل، باستخدام طريقة باستير الثالثة، بتقسيم العديد من الكحوليات إلى أضداد نشطة بصريًا. أثبت يوهان ويسليسينوس أن هناك نوعين من أحماض اللاكتيك: غير نشط بصريًا، ويتكون في اللبن الرائب (حمض اللاكتيك المخمر)، وحمض اللاكتيك الذي يظهر في العضلات العاملة (حمض اللاكتيك الموجود في اللحوم). كان هناك المزيد والمزيد من هذه الأمثلة، وكانت هناك حاجة إلى نظرية لشرح كيفية اختلاف جزيئات الأضداد عن بعضها البعض. تم إنشاء مثل هذه النظرية من قبل العالم الهولندي الشاب فانت هوف ("الكيمياء والحياة"، 2009، رقم 1). ووفقا لهذه النظرية، فإن الجزيئات، مثل البلورات، يمكن أن تكون "يمنى" و"يسارية"، كونها صورة مرآة لبعضها البعض. أبسط مثال هو الجزيئات التي تحتوي على ما يسمى بذرة الكربون غير المتماثلة المحاطة بأربع مجموعات مختلفة. لنأخذ أبسط حمض أميني ألانين: لا يمكن دمج الجزيئين المصورين في الفضاء بأي دورة.
وتسمى هذه الهياكل، التي تختلف عن بعضها البعض مثل اليد اليمنى عن اليسرى، مراوان (من اليونانية. شعر- يُسلِّم).
يحتوي حمض الطرطريك على ذرتين كربون غير متماثلتين. إذا كان كلاهما "على اليمين"، تحصل على حمض ديكستروتوري (+) - طرطريك، إذا كان "يسار" - ليفوروتوري (-) - طرطري، إذا كان أحدهما "يسار" والآخر "يمين"، فستحصل على حمض ميسوترتاريك . إذا كان الخليط عبارة عن جزيئات "يمنى" و"يسار" متساوية، فإن المادة ككل ستكون غير نشطة بصريًا. يتم الحصول على هذه المواد في القارورة نتيجة للتخليق الكيميائي التقليدي. وفقط في الكائنات الحية، بمشاركة عوامل غير متماثلة (على سبيل المثال، الإنزيمات)، يتم تشكيل مركبات غير متماثلة. وهكذا، فإن الأحماض الأمينية والسكريات ذات التكوين الواحد هي السائدة في الطبيعة، ويتم قمع تكوين أضدادها. في بعض الحالات، يمكن تمييز المتصاوغات الضوئية المختلفة بدون أي أدوات - عندما تتفاعل بشكل مختلف مع المستقبلات غير المتماثلة في أجسامنا. ومن الأمثلة الصارخة على ذلك حمض الليوسين الأميني: أيزومره الدكستروروتوري حلو، والليفوروتوري مر. لاحظ أن السؤال الطبيعي - كيف ظهرت أول المركبات الكيميائية النشطة بصريًا على الأرض - ليس له إجابة واضحة حتى الآن.
مشكلة التكوين المطلق
في السابق، لم يكن من الممكن تحديد التكوين المكاني الفعلي لجزيئات مادة فعالة بصريًا أو أخرى، على سبيل المثال، ألانين المذكور أعلاه. ومع ذلك، من خلال الطرق الكيميائية البحتة، كان من الممكن إثبات التشابه في تكوينات المواد المختلفة. على سبيل المثال، جزيئات dextrorotatory د- الجليسرالديهيد كانت متشابهة في تكوينها مع اليد اليسرى ل-حمض اللبنيك ودكستروتوري د- حمض الماليك. في عام 1906، بناءً على اقتراح M. A. Rozanov، تم اختيار الجلسرالديهيد كمعيار لتحديد التكوين النسبي للجزيئات النشطة بصريًا. في الوقت نفسه، اقترح إي جي فيشر أن يتم تخصيص هيكل (بشكل تعسفي بحت) للجلسرالديهيد،

حيث تشير العلامة النجمية إلى ذرة كربون غير متماثلة مرتبطة بأربعة بدائل مختلفة. في مثل هذه الأشكال، يوجد رابطان "أفقيان" (في هذه الحالة، روابط C-H وC-OH) تحت مستوى الشكل، ويوجد رابطان "عموديان" (C-CHO وC-CH 2 OH) فوق الطائرة. تسمى طريقة التصوير هذه بإسقاط فيشر، نسبة إلى إميل هيرمان فيشر، الحائز الثاني على جائزة نوبل في الكيمياء عام 1902.
بضع كلمات عن روزانوف، غير المعروف عمليا بالنسبة لنا. ولد مارتن أندريه روزانوف (1874-1951) في أوكرانيا لأبوين أبراهام وكلارا روزنبرغ. بعد تخرجه من صالة الألعاب الرياضية الكلاسيكية في موطنه نيكولاييف، واصل تعليمه في برلين وباريس، ثم في نيويورك. عمل في جامعة نيويورك، ثم في معهد ميلون في بيتسبرغ، حيث حصل لأول مرة في تاريخ المعهد على أستاذية الكيمياء مدى الحياة. كانت الأخت مارتينا ليليان (1886-1986) عميدة قسم الرياضيات في جامعة لونغ آيلاند. كان الأخ آرون جوشوا طبيبًا نفسيًا أمريكيًا مشهورًا عمل في كاليفورنيا. من بين الأعمال "غير الكيميائية" لـ M. A. Rozanov، يتم تسليط الضوء على مقالة كبيرة بعنوان "Edison في مختبره" (1932)، حيث وصف المؤلف، من بين أمور أخرى، العديد من الحالات المضحكة، بما في ذلك من تجربته في التواصل مع عالم مشهور مخترع.
تم تسمية الهيكل المصور باسم D(+)-glyceraldehyde. وبناء على ذلك، بدأ تخصيص جميع المواد المشابهة كيميائيا للألدهيد إلى السلسلة D. كان المضاد البصري لهذا الألدهيد يسمى L-glyceraldehyde، وبدأت المواد المرتبطة به تُنسب إلى السلسلة L ("+" تعني أن مستوى الاستقطاب يدور إلى اليمين، "-" - إلى اليسار):

يعتبر الجلسرالديهيد من أبسط المركبات النشطة بصريا، ويتم الحصول عليه بسهولة عن طريق أكسدة الجلسرين، والأهم من ذلك أنه يمكن استخدامه للحصول على أكبر قدر من الفائدة. اتصالات مختلفة. وهذا يحدد التكوين النسبي لأحماض الطرطريك والماليك والإيزوسيرين وحمض اللاكتيك اليساري الدوران والعديد من المركبات الأخرى النشطة بصريًا. يؤدي تكثيف الألدول للجلسرالديهيد مع ثنائي هيدروكسي أسيتون إلى إنتاج خليط من الفركتوز والسوربوز، والذي يمكن فصله. ومن الواضح أنه في سياق مثل هذه التوليفات، يجب أن يظل التكوين المطلق لذرة الكربون غير المتماثلة دون تغيير. وهذا ما يحدث إذا لم تنكسر الرابطة الكيميائية لذرة الكربون هذه مع أحد البدائل المجاورة. وبخلاف ذلك، قد يحدث فقدان للنشاط البصري (كما هو الحال، على سبيل المثال، في تفاعلات الاستبدال النيوكليوفيلية من النوع S N 1)، أو تغيير في التكوين إلى العكس. العملية الأخيرة، ما يسمى بالتحويل الولداني، تحدث، على سبيل المثال، في التفاعلات S N 2؛ سُميت على اسم بول (بافيل إيفانوفيتش) والدن (1863–1957)، الذي اكتشفها عام 1889.
تم اعتماد الحروف الكبيرة D وL بدلاً من الأحرف الصغيرة من أجل عدم الخلط بين تكوين المادة، المحدد فيما يتعلق بالجليسرالديهيد، مع اتجاه دوران مستوى استقطاب الضوء بواسطة هذه المادة. وهكذا حدث أن بعض مركبات السلسلة D تدور إلى اليمين، وبعضها إلى اليسار، ولا يرتبط اتجاه الدوران بأي حال من الأحوال بانتماء المادة إلى أي من هذه السلاسل. على سبيل المثال، تم العثور في الطبيعة على الفركتوز D(-) فقط (المعروف أيضًا باسم الليفولوز، لأنه يدور مستوى الاستقطاب إلى اليسار). من ناحية أخرى، كل من الأسباراجينات L و D عبارة عن أحماض أمينية قابلة للدوران. يحتوي حمض المندليك C 6 H 5 CH (OH) COOH على اثنين من الأيزومرات الضوئية: أيزومر D (-)- وأيزومر L (+) دكستروريتوري. وهناك العديد من هذه الأمثلة. لذلك، لا يمكن تحديد العلاقة بين إشارة دوران المفصل وشكله مسبقًا: يمكن أن يكون لمفصلين لهما نفس التكوين النسبي إشارات دوران معاكسة. على العكس من ذلك، قد يكون للمركبات المماثلة التي لها نفس علامة الدوران تكوينات نسبية معاكسة.
يعد التحديد المباشر للتكوين المطلق للجزيء مهمة صعبة، وقد تمكن الكيميائيون لفترة طويلة من مجرد تعيين الجزيئات إلى السلسلة D أو L. وفقط في منتصف القرن العشرين، تم حل هذه المشكلة بواسطة J. Beivut مع الموظفين الذين عملوا في مختبر Van't Hoff بجامعة أوتريخت. نُشر العمل التاريخي بعنوان "تحديد التكوين المطلق للمواد الفعالة بصريًا عن طريق حيود الأشعة السينية" في 18 أغسطس 1951 في مجلة " طبيعة". أظهر المؤلفون، من خلال تحليل حيود الأشعة السينية لبلورات ملح البوتاسيوم والروبيديوم لحمض الطرطريك (+) D، أن فيشر لم يكن مخطئًا في افتراض التكوين المطلق لمضادات الجليسرالديهيد! وهذا يعني أنه لم يتم إنشاء التكوينات النسبية فحسب، بل المطلقة أيضًا لجميع المركبات النشطة بصريًا بشكل صحيح! في الواقع، كان لدى فيشر فرصة 50% بالضبط لتحقيق النجاح الاختيار الصحيحأو ارتكاب خطأ. حدثت قصة مماثلة، قبل وقت طويل من اكتشاف الإلكترون، عندما تم تحديد اتجاه التدفق التيار الكهربائي. و- لقد أخطأوا باختيار الاتجاه من الموجب إلى الناقص.
لأن منشور Beivut الأصلي في المجلة طبيعةلم يتم تقديم البيانات التجريبية الأولية، وظلت مسألة صحة الاستنتاجات التي تم التوصل إليها أساسية، خاصة وأن التقنية التجريبية في تلك الأوقات كانت بعيدة عن الكمال. على وجه الخصوص، لم تكن هناك أجهزة كمبيوتر، والتي بدونها لا يمكن لأي عمل في مجال تحليل حيود الأشعة السينية القيام به الآن. ولإزالة كافة الشكوك المحتملة، قام موظفو المركز البيولوجيا الجزيئيةقام مارتن لوتز وM. M. Schroers من جامعة أوتريخت مؤخرًا باختبار نتائج زملائهم منذ أكثر من نصف قرن باستخدام أحدث المعدات. تم نشر أعمالهم في أغسطس 2008 في المجلة اكتا كريستالوغرافيكا"، القسم ج: " اتصالات الهيكل البلوري"، كان يسمى" هل كان Beivut على حق؟ إعادة التحري عن رباعي هيدرات طرطرات الصوديوم – الروبيديوم”. للحصول على بلورة واحدة، قام الباحثون بتسخين محلول (+) - حمض الطرطريك إلى درجة حرارة 60 درجة مئوية، وبدأوا بإضافة محلول من خليط متساوي المولية من كربونات الصوديوم والروبيديوم إليه قطرة قطرة. يتم ترسيب طرطرات الروبيديوم الحمضية الأقل قابلية للذوبان أولاً. وبعد ذلك، عندما انتهى تطور ثاني أكسيد الكربون، انتقل الراسب بالكامل إلى المحلول. عندما يتبخر درجة حرارة الغرفةتم تكوين مسحوق عديم اللون، وإعادة تبلوره من أقل كمية من الماء يعطي بلورات Na + ·Rb + ·C 4 H 4 O 6 2 – · 4 H 2 O مناسبة للبحث. وعلى السؤال المطروح في عنوان المقال أجاب المؤلفون بنعم.
كان عمل Beivut مع المتعاونين في عام 1951 بمثابة صنع حقبة جديدة حقًا. لأول مرة، أصبح من الممكن التخلص من بعض التناقض في التسميات D و L، والتي تشير فقط إلى العلاقة الوراثية مع ألدهيدات الجلسرين، ولكن ليس اتجاه الدوران البصري. تم تحقيق هذا الاحتمال في عام 1956 بناءً على اقتراح روبرت سيدني خان وكريستوفر كيلك إنجولد والفائز بجائزة نوبل عام 1975 (مع جي دبليو كورنفورث) فلاديمير بريلوج. نُشرت مقالتهم الأولى في مجلة سويسرية غامضة نسبيًا الخبرة"، ومع ذلك تم اعتماد الاقتراح على نطاق واسع. وهكذا، تم وصفها بالتفصيل في كتاب الكيمياء العضوية للويس وماري فيذر (1961، الترجمة الروسية 1966). لكن هذا النظام أصبح أكثر شهرة بعد نشر تسميات كيميائية مجسمة عالمية مفصلة في عام 1966 (انظر Cahn R.S., Ingold S.K., Prelog V. Specification of Molecule Chirality // أنجو. الكيمياء، كثافة العمليات. إد. إنجليزي، 1966، 5، 385-415؛ النص الكامل - PDF، 3.4 ميجابايت).
اقترح المؤلفون تقديم مفهوم اللاتماثلية كخاصية لجسم لا يتوافق مع انعكاسه في مرآة مسطحة مثالية و ر—س- النظام (من اللات. المستقيمة- مستقيم وصحيح و شرير- اليسار) للإشارة إلى عدم التناظر.
يمكن العثور على وصف تفصيلي لتطبيق هذه القاعدة على المركبات النشطة بصريًا في الكتب المدرسية للكيمياء العضوية، وكذلك في الكتاب المدرسي لـ K. P. Butin. يستخدم ترتيبًا معينًا للمجموعات حول المركز اللولبي - في اتجاه عقارب الساعة، وفقًا "لأقدمية" هذه المجموعات. على وجه الخصوص، وفقًا للتسمية الجديدة، يحصل D-glyceraldehyde على التصنيف ر.الرموز رو ستضاف إلى اسم المركب على شكل بادئات. وبالتالي فإن المتصاوغات الضوئية لـ 1-برومو-1-كلوروإيثان هي ر-1-برومو-1-كلوروإيثان و س-1-برومو-1-كلوروإيثان. تم تحديد تعديلهم العرقي غير النشط بصريًا ر، س-1-برومو-1-كلوروإيثان. ومع ذلك، وفقًا للتقاليد، فإن التسميات القديمة D وL تُستخدم أيضًا على نطاق واسع، على سبيل المثال، للسكريات والأحماض الأمينية.
في ختام هذا القسم، نلاحظ فكرة خاطئة أخرى شائعة جدًا - وهي أن جميع الأحماض الأمينية الطبيعية من المفترض أنها تنتمي حصريًا إلى السلسلة L. في الواقع، الأمر ليس كذلك: الأحماض الأمينية D موجودة أيضًا في الطبيعة، على الرغم من أنها أقل تكرارًا من الأحماض الأمينية من السلسلة L، خاصة في عالم الكائنات الحية الأدنى. وهي موجودة، على سبيل المثال، في المضادات الحيوية الببتيدية، في قشرة بعض البكتيريا. تستخدم بعض الكائنات الحية الدقيقة المحبة للحرارة والتي تعيش في الينابيع الساخنة والمياه الحرارية تركيزات عالية من D-alanine كمنظم تناضحي. تحتوي بلازما الدم في الكائنات العليا أيضًا على أحماض أمينية د. ينتج جسم الإنسان د-سيرين كناقل عصبي. تم العثور على D-alanine وD-asparagine وD-serine في الخلايا العصبية للكائنات الحية العليا. إنهم يعملون مع الأحماض الأمينية D، على سبيل المثال، في قسم الإنزيمات الكيميائية، كلية الكيمياء، جامعة موسكو الحكومية. وفي عام 2008، في كلية الأحياء بجامعة موسكو الحكومية، دافع A. V. Dmitriev عن أطروحته للحصول على درجة الدكتوراه في العلوم الفيزيائية والرياضية حول موضوع "الآليات الفيزيائية والكيميائية لنقل الأيونات في القنوات النموذجية الطبيعية والمعدلة كيراليًا". درس المؤلف، على وجه الخصوص، البروتينات النموذجية المعدلة التي تحتوي على الأحماض الأمينية د. لقد ثبت أن عشرة أحماض أمينية D كافية للحصول على البنية الأساسية للبروتين ذي الوظيفة الطبيعية المبنية من الأحماض الأمينية D.
أدوية كيرال
يشير الكيميائيون في كثير من الأحيان إلى المتصاوغات الضوئية كمركب واحد لأن خواصها الكيميائية متطابقة. ومع ذلك، يمكن أن يكون نشاطهم البيولوجي مختلفا تماما. وقد أصبح هذا واضحا بعد القصة المأساوية للثاليدومايد، وهو عقار كان يستخدم على نطاق واسع في أوروبا في ستينيات القرن العشرين من قبل النساء الحوامل كحبة نوم ومهدئ فعال. بمرور الوقت، تجلى تأثيره المسخي، وولد العديد من الأطفال بتشوهات خلقية. بعد ذلك، استعار الأوروبيون نظامًا أمريكيًا أكثر صرامة لإصدار شهادات الأدوية - في أمريكا، لم يُسمح ببيع الثاليدومايد. ولكن فقط في أواخر الثمانينات أصبح من الواضح أن واحداً فقط من مصاوغات الثاليدوميد هو الذي أصبح سبب المحنة. هذا الاختلاف في شكل الجرعة لم يكن معروفًا من قبل، وكان الثاليدومايد المسوق عبارة عن خليط راسيمي.
حاليا، يتم إنتاج العديد من الأدوية في شكل مركبات نقية بصريا. يتم الحصول عليها من خلال ثلاث طرق: فصل الخلائط الراسيمي، وتعديل المركبات الطبيعية النشطة بصريًا (وتشمل هذه الكربوهيدرات، والأحماض الأمينية، والتربين، وأحماض اللاكتيك والطرطريك، وما إلى ذلك) والتوليف المباشر. يتطلب الأخير أيضًا مصادر مراوانية، نظرًا لأن أي طرق اصطناعية تقليدية أخرى تنتج زميلًا للسباق. وهذا هو أحد أسباب ارتفاع تكلفة بعض الأدوية، وليس من المستغرب أنه من بين العديد من الأدوية الكيرالية الاصطناعية المنتجة في جميع أنحاء العالم، جزء صغير فقط نقي بصريًا، والباقي زملاء عرق.
يتم أيضًا تفسير الحاجة إلى مضادات حيوية نقية بصريًا من خلال حقيقة أنه غالبًا ما يكون لواحد منها فقط التأثير العلاجي المطلوب، في حين أن المضاد الثاني يمكن أن يكون عديم الفائدة في أحسن الأحوال، وفي أسوأ الأحوال يسبب آثارًا جانبية غير مرغوب فيها أو يكون سامًا. ويحدث أيضًا أن كل enantiomer له تأثيره المحدد. نعم اليد اليسرى س- الثيروكسين ( المنتجات الطبية Levotroid هو هرمون الغدة الدرقية T4 الطبيعي. دكستروتاتوري ر- هرمون الغدة الدرقية ("دكسترويد") يخفض نسبة الكوليسترول في الدم. بعض الشركات المصنعة تأتي بأسماء تجارية متناظرة لمثل هذه الحالات، على سبيل المثال " دارفون"للمسكنات المخدرة و" نوفراد» لدواء مضاد للسعال.
كما ذكرنا سابقًا في مثال الحمض الأميني الليوسين، فإن الإنسان كائن مراوان. وهذا لا ينطبق فقط على مظهر. يمكن للأدوية المضادة للصخور، التي تتفاعل مع الجزيئات الكيرالية في الجسم، مثل الإنزيمات، أن تعمل بطرق مختلفة. يتناسب الدواء "الصحيح" مع مستقبله مثل مفتاح القفل ويؤدي إلى التفاعل الكيميائي الحيوي المطلوب. عامل مضاد لاضطراب النظم س-أنابريلين يعمل أقوى مائة مرة من ر-استمارة. ينشط عقار الليفاميزول المضاد للديدان بشكل رئيسي في سالأيزومر، في حين أنه ص-يسبب المضاد الغثيان، لذلك في وقت واحد تم استبدال الليفاميزول الراسيمي بأحد المتصاوغات. في الستينيات، تمت تجربة أحد سلائف الأدرينالين في الجسم - ثنائي هيدروكسي فينيل ألانين (L-DOPA) لعلاج مرض باركنسون. وفي الوقت نفسه، اتضح أن هذه المادة، وكذلك الدوبامين والميثيل دوبا ذات الصلة، تكون فعالة فقط في الشكل س-أيزومر. في نفس الوقت ر- يسبب دوبا آثارًا جانبية خطيرة، بما في ذلك اضطرابات الدم. حازم " ميرك"طور طريقة لإنتاج عقار ميثيل دوبا الخافض لضغط الدم، والذي يتضمن التبلور التلقائي للمتشاكل المرغوب فقط عن طريق إدخال بذرة صغيرة من هذا الأيزومر في المحلول.
والمثال الأخير. البنسيلامين (3،3-ثنائي ميثيل سيستين) هو مشتق بسيط إلى حد ما من الحمض الأميني السيستين. تستخدم هذه المادة في حالات التسمم الحاد والمزمن بالنحاس والزئبق والرصاص وغيرها من المعادن الثقيلة، حيث أنها تعطي معقدات قوية مع أيونات هذه المعادن، ويتم إزالة هذه المجمعات عن طريق الكلى. يستخدم البنسيلامين أيضًا في أشكال مختلفة من التهاب المفاصل الروماتويدي، وفي تصلب الجلد الجهازي، وفي عدد من الحالات الأخرى. في هذه الحالة فقط س– شكل الدواء ر- الأيزومر سام ويمكن أن يسبب العمى. ليس بدون سبب على غلاف عدد يونيو من المجلة الأمريكية " مجلة التعليم الكيميائي» لعام 1996، تم وضع مثل هذا الرسم غير العادي. ولم يكن عنوان المقال عن الأدوية المضادة للأرجل أقل بلاغة: "عندما ينظر الجزيء في المرآة".

ايليا ابراموفيتش لينسون,
دكتوراه في الكيمياء
"الكيمياء والحياة" رقم 5، 2009
في السابق، تم وصف الأيزومرية الهيكلية، بسبب اختلاف ترتيب تناوب الذرات والروابط في الجزيئات، ونوعين من الأيزومرية المكانية: الدورانية والهندسية ( رابطة الدول المستقلة العابرة) يرتبط بالترتيب المختلف لشظايا الجزيئات ذات البنية نفسها في الفضاء. هناك نوع آخر من الأيزومرية الفراغية - الأيزومرية الضوئية.
الأيزومرات الضوئية هي نفسها في جميع خواصها الفيزيائية والكيميائية وتختلف فقط في ناحيتين.
1 أثناء التبلور، فإنها تشكل بلورات ليس لها مستوى من التماثل وترتبط ببعضها البعض ككائن لصورته المرآة. سمحت هذه الخاصية لباستور باكتشاف ظاهرة الأيزومرية البصرية. أثناء تبلور حمض الطرطريك، اكتشف بصريًا بلورات ثنائية أنواع مختلفةوبفصلهما، تم عزل الأشكال الفراغية النقية لحمض الطرطريك.
2 ترتبط الأيزومرات الضوئية بشكل مختلف بالضوء المستقطب.
في شعاع الضوء، تحدث تذبذبات النواقل الكهربائية والمغناطيسية في اتجاهات متعامدة بشكل متبادل، وكذلك متعامدة مع اتجاه انتشار الشعاع. علاوة على ذلك، فإن اتجاه التذبذبات، على سبيل المثال، المتجه الكهربائي يتغير بشكل عشوائي مع مرور الوقت، مما يغير اتجاه تذبذب المتجه المغناطيسي وفقًا لذلك. في شعاع مستقطبتحدث تذبذبات في النواقل الكهربائية والمغناطيسية لكل منهما واحد مستوى ثابت تمامًا، مستوى الاستقطاب. عندما يمر شعاع مستقطب عبر بعض المواد السائلة والبلورية الشفافة، يدور مستوى الاستقطاب. تسمى المركبات التي تقوم بتدوير مستوى استقطاب الحزمة المستقطبة بالنشط بصريًا أو النشط بصريًا. للمقارنة الكمية للنشاط البصري مواد مختلفة، احسب القيمة دوران محدد. وبما أن قيمة الزاوية، فإن دوران مستوى استقطاب الضوء، بالإضافة إلى طبيعة المادة، يعتمد أيضًا على درجة الحرارة، والطول الموجي للضوء، وسمك طبقة المادة التي يمر عبرها الضوء المستقطب، وبالنسبة للمحاليل أيضًا المذيب وتركيز المادة، الدوران النوعي عند درجة حرارة ثابتة وطول موجة الضوء
حيث α هي زاوية دوران مستوى الاستقطاب عند سماكة الطبقة لوكثافة المادة د, ر- درجة حرارة، دهو طول موجي ثابت للخط الأصفر من طيف الصوديوم.
للحل
 ,
,
أين مع- تركيز المحلول بالجرام من المادة لكل 100 مل من المحلول.
حامض اللبنيك من تخمير السكروزبمساعدة البكتيريا يدور مستوى استقطاب الضوء إلى اليسار(عكس عقارب الساعه). ويسمى حمض اللاكتيك الأيسر أو اليساري ويرمز له: (-) - حامض اللاكتيك.
يقوم حمض اللاكتيك بتدوير مستوى استقطاب الضوء إلى اليمين، يسمى حمض اللاكتيك الصحيح ويشار إليه: (+) - حمض اللاكتيك. يتم إطلاق هذا الشكل البصري لحمض اللاكتيك من عضلات الحيوانويسمى حمض اللبنيك اللحوم.
فيالمرحلة البلورية يرتبط النشاط البصري للمادةعدم تناسق البنية البلورية. فيمراحل السائل والغاز لقد ربطتمع عدم التماثل الجزيئي. في عام 1874، لاحظ فانت هوف وليبل، مؤسسا النظرية الكيميائية المجسمة، في وقت واحد تقريبًا أن تحتوي المواد الفعالة بصريًا في جزيئاتها على ذرة كربون واحدة على الأقل مرتبطة بهاأربعة مختلفةمجموعات. وتسمى ذرات الكربون هذه غير متماثل.إن وجود ذرة كربون غير متماثلة في بنية الجزيء هو علامة على عدم تناسق جزيئات المركب، وبالتالي على النشاط البصري للمادة.
عند النظر في الأيزومرية الضوئية، عادة ما يتم تمييز ذرات الكربون غير المتماثلة بعلامة النجمة (*):
كما يتبين من الصيغ البنائية، فإن المركبات التي تحتوي على ذرة كربون غير متماثلة لا تحتوي على مستوى تناظر.
الايزومرات الضوئية لحمض اللبنيك، أي. (-) و (+) - أشكال هذا الحمض لها ترتيب مكاني مختلف للمجموعات الفردية في الجزيء وهي صور مرآة لبعضها البعض. انعكاس في المرآة لأي كائن، والتي ليس لديها مستوى التماثل، ليس نفس الموضوع، وهو نقيضه (الإنانتيومر).

على سبيل المثال، انعكاس الشكل البشري في المرآة ليس مطابقًا للأصل. يظهر الجانب الأيسر من الإنسان في المرآة كالجانب الأيمن، والعكس صحيح. يمكن أن نرى من الشكل أن النموذج الأيمن، عند تركيبه في الفضاء، لا يتطابق مع النموذج الأيسر. يُشار عادةً إلى خاصية عدم توافق الجسم مع صورته في المرآة المسطحة باسم مراوغة.
تسمى الأيزومرات الضوئية التي هي صور مرآة لبعضها البعضالأضداد(المضادات الضوئية). يقومون بتدوير مستوى الاستقطابفي اتجاهات مختلفة وبنفس الزوايا.
أحماض اللاكتيك وأحماض اللاكتيك اللحمية هي أضداد (متصاوغات ضوئية). تقوم هذه الأيزومرات الفراغية بتدوير مستوى الاستقطاب في اتجاهات مختلفة وبنفس الزوايا.
خليط من أعداد متساوية من الأضداد يكون غير فعال بصريا بسبب تعويض الدوران ويسمىزميل السباق.
وبالتالي، فإن حمض اللاكتيك الذي يتم الحصول عليه صناعيًا لا يؤثر على الضوء المستقطب. وهو يتألف من خليط من كميات متساوية من الأشكال اليمنى واليسرى، وهو غير نشط بصريا ويشار إليه (±) - حمض اللاكتيك.
لراحة تصوير الهيكل المكاني للمركبات النشطة بصريا، ما يسمى صيغ الإسقاط التي اقترحها فيشرتم الحصول عليها عن طريق إسقاط نماذج رباعية السطوح من الجزيئات على مستوى الرسم

عند استخدامها، يجب أن نتذكر أن حركة صيغ الإسقاط، وفرضها على بعضها البعض مسموح به فقط في مستوى الرسم. ومن المفهوم أيضًا أن المجموعتين العلوية والسفلية تقعان خلف مستوى الرسم، والمجموعات الجانبية أمامه. من الطبيعي أن صيغ الإسقاط لأحماض اللاكتيك اليمنى واليسرى، الخاضعة لهذه القواعد، لا تتحد.
هناك نقطة مهمة جدًا في الأيزومرية الضوئية وهي أن حجم واتجاه دوران مستوى استقطاب الضوء لا يعتمدان بشكل مباشر على التكوين (البنية المكانية) روابط.
على سبيل المثال، استرات وإثيرات حمض اللاكتيك الأيمن، التي لها نفس تكوين الحمض نفسه، قد تركت الدوران.

ويترتب على ذلك أن علامة دوران أحد أعضاء سلسلة المواد المتشابهة في التركيب الكيميائي لا يمكن أن تكون بعد بمثابة خاصية لتكوين وعلامة دوران بقية أعضائها.
السؤال الذي يطرح نفسه هو ما إذا كانت تكوينات الأيزومرات الضوئية للمواد المختلفة معروفة وكيف يتم تحديدها. لا تسمح الطرق الكيميائية بتحديد التكوين المطلق (الحقيقي) للأضداد نظرًا لهوية الخواص الكيميائية للأضداد. وفي الوقت نفسه، يمكن لهذه الطرق تحديد التكوين النسبي للايزومرات الضوئية. يمكن تحويل المركبات النشطة بصريًا كيميائيًا إلى بعضها البعض دون تغيير التكوين. وبعد ذلك، إذا كان تكوين الاتصال "المرجعي" الأصلي معروفًا، فسيكون الاتصال الذي تم الحصول عليه منه بنفس التكوين.
في عام 1891، اقترح فيشر وروزانوف في عام 1906 استخدام اليمين (+)- جلسرالديهيد. تم تكليفه بالتكوين بشكل تعسفي " د". نقيضها، (-)- جلسرالديهيدعلى التوالي، نظرا للتكوين " ل».

هذا جعل من الممكن التثبيت التكوين النسبيأيزومرات مجسمة بصرية بالوسائل الكيميائية. في هذه الحالة، يتم تعيين تكوين نسبي لمشتقات D(+)-glyceraldehyde.
على سبيل المثال، تم تحديد التكوين النسبي لحمض اللاكتيك عن طريق تحويل الجليسرالديهيد إلى حمض اللاكتيك.

اتضح أن D(+)-glyceraldehyde يتوافق في التكوين مع حمض اللاكتيك D(-) الأيسر.
لم يتم تحديد التكوين المطلق لـ D-glyceraldehyde إلا في عام 1951 عن طريق تحليل الأشعة السينية. اتضح أن اختيار التكوين الخاص به كان صحيحًا. وهكذا، أصبحت التكوينات المطلقة للعديد من المواد معروفة الآن.
بالإضافة إلى الموصوفة دي إل- التسمياتلتعيين تكوين الأيزومرات المجسمة الضوئية، ما يسمى روبية- تسمية خان، إنجولد، بريلوج، لا يتعلق بتكوين الاتصال المرجعي ("قياسي"). وقد ورد وصفه في الأدب التربوي.
حمض اللاكتيك, CH 3 -CHOH-COOH
يتم الحصول على حمض اللاكتيك من نيتريل حمض اللاكتيك أو تخمير حمض اللاكتيك للمواد السكرية.

يدخل في صناعة الجلود وفي صباغة الأقمشة.
حمض التفاح

وهو حمض ثنائي القاعدة، حمض الترياتوميك. من الناحية الكيميائية، فإنه يظهر خصائص أحماض ألفا وبيتا هيدروكسي، حيث أن الهيدروكسيل يكون في موضع α بالنسبة إلى مجموعة حمضية واحدة، وفي موضع β بالنسبة إلى المجموعة الأخرى. عند استعادتها، فإنه يعطي حمض السكسينيكمع الجفاف - الماليك أو الفوماريك:
HOOC - CH - CH - COOH → HOOC - CH \u003d CH - COOH + H 2 O
يحتوي حمض الماليك على ذرة كربون واحدة غير متماثلة وهو نشط بصريًا.

تذوب أحماض الماليك اليسرى واليمنى عند 100 درجة مئوية. Racemate - عند 130-131 درجة مئوية. في الطبيعة، تم العثور على الشكل الأيسر من حمض الماليك: في روان، التفاح، العنب.
أحماض الطرطريك (ثنائي هيدروكسي سوتشينيك)
لديهم نفس الصيغة الهيكلية

وتختلف في البنية المكانية.
كما يلي من الصيغة، يحتوي حمض الطرطريك على ذرتين كربون غير متماثلتين. تم العثور على عدد الأيزومرات الضوئية للمركبات التي تحتوي على عدة ذرات كربون غير متماثلة في التركيب الجزيئي من خلال الصيغة ن=2 ن ، أيننهو عدد ذرات الكربون غير المتماثلة.
لذلك، بالنسبة لحمض الطرطريك، ينبغي توقع أربعة أيزومرات مجسمة بصرية:

وفقًا لقواعد التعامل مع صيغ الإسقاط، عندما يتم فرض النموذجين الأخيرين على بعضهما البعض، يصبحان متطابقين (يجب تدوير أحد النماذج في مستوى الرسم بمقدار 180 درجة). وهكذا، بدلا من أربعة أشكال أيسومرية فراغية، يتم تحقيق حمض الطرطريك في ثلاثة أشكال. بالإضافة إلى ذلك، يتبين أن الأيزومر الفراغي الثالث (III) غير نشط بصريًا بسبب تماثله (يظهر مستوى التماثل في الشكل): يتم تعويض دوران مستوى استقطاب الضوء الناتج عن رباعي السطوح العلوي بالكامل عن طريق دوران رباعي السطوح السفلي، وهو متساوي في الحجم ولكنه معاكس في الإشارة. أمامنا مثال على شكل أيزومري مجسم يحتوي على ذرات كربون غير متماثلة، غير نشطة بصريًا بسبب تناظرها. تسمى هذه الأيزومرات الفراغية mesoforms.
تسمى الأيزومرات المجسمة لمادة ليست صورًا مرآة لبعضها البعض بالمتزامرات غير المجسمة.وفقًا لهذا التعريف، فإن الأشكال المكانية الأولى والثانية لحمض الطرطريك هي diastereomers بالنسبة لحمض الميزوتارتريك (والعكس صحيح).
بسبب ال الأضدادلها نفس البنية (فقط معكوسة بشكل مرآوي)، وخصائصها، باستثناء علاقتها بالضوء المستقطب، هي نفسها أيضًا. diastereomersليست متطابقة في بنيتها المكانية، وبالتالي فإن خصائصها مختلفة بعض الشيء.
في ختام تحليل الأيزومرية المكانية لحمض الطرطريك، يمكننا القول أنه يتم تمثيله بواسطة اثنين من الأضداد (الشكل الأول والثاني)، زميلهما المسمى حمض الطرطريك، والشكل الوسطي ثنائي الأطوار (III).
Dextrorotatory، (+) - حمض الطرطريك شائع جدًا في الطبيعة، خاصة في عصير العنب. أثناء تخمير عصير العنب، يتم إطلاقه على شكل جير، يتكون من طرطرات البوتاسيوم الحمضية.
ويستخدم هذا الملح كمادة في صباغة وطباعة المنسوجات.
آخر، ملح بوتاسيوم-صوديوم (+)-حمض الطرطريك - ما يسمى بملح روشيل،
تستخدم كبلورة ضغطية في هندسة الراديو. وهو جزء من سائل فهلنج، الذي يستخدم في التحديد التحليلي لعوامل الاختزال (على سبيل المثال، الألدهيدات).
يتم الحصول على حمض الطرطريك مع حمض العنب عن طريق غليان حمض الطرطريك (+) مع كمية زائدة من الصودا الكاوية لعدة ساعات.
حمض الليمون

غالبًا ما يوجد في الطبيعة: في البنجر وعنب الثعلب والعنب والليمون والتوت وأوراق التبغ. غير نشط بصريا.
يستخدم حامض الستريك في صناعة المواد الغذائية والصباغة والتصوير وحفظ الدم وما إلى ذلك.
أحماض الألدونيك
أحماض الألدونيك هي أحماض متعددة الهيدروكسي كربوكسيليك من الصيغة العامة HOCH 2 n COOH، وهي رسميًا منتجات أكسدة مجموعة الألدهيد الكربوهيدرات(الدوز). الطريقة المختبرية الأكثر شيوعًا لتخليق أحماض الألدونيك هي أكسدة الألدوسات المتوفرة بسهولة مع البروم في محلولها المائي.

تلعب أحماض الألدونيك ومشتقاتها دورًا مهمًا في الكيمياء الاصطناعية للسكريات الأحادية.
طرق فصل العرقيات إلى مكونات نشطة بصريا
في الوقت الحالي، تتزايد بسرعة الحاجة إلى مواد نقية تجسيديًا لإنتاج مستحضرات طبية حديثة عالية الفعالية، وكذلك لتلبية احتياجات الزراعة وحماية الغابات: إنتاج مبيدات حشرية جديدة عالية النشاط ومبيدات الأعشاب ومبيدات الفطريات وغيرها من المواد الانتقائية للآفات. يتحكم. يمكن الحصول على مواد نقية تجسيديًا لهذه الأغراض إما من خلال تطوير طرق لتركيبها الكيميائي الكامل (تم منح عدد من الإنجازات في هذا المجال جوائز نوبل في الكيمياء)، أو عن طريق فصل الخلائط الراسيمي. دعونا نفكر في مبادئ بعض الطرق لفصل زملاء العرق إلى مكونات نشطة بصريًا.
– الاختيار الميكانيكي.أثناء التبلور، يتبلور زملاء العرق أحيانًا بشكل منفصل على شكل أشكال يمينية ويسارية. علاوة على ذلك، فإن بلوراتهم في الشكل ترتبط ببعضها البعض ككائن لصورته المرآة. في هذه الحالة، يمكن اختيارهم ميكانيكيا من خلال مظهرهم.
– الفصل البيوكيميائي.يعتمد ذلك على حقيقة أن الكائنات الحية الدقيقة خلال نشاطها الحيوي قادرة على استهلاك واحد فقط من الأيزومرات الضوئية بشكل تفضيلي. عادةً ما يكون هذا الشكل البصري أكثر شيوعًا في الطبيعة. لذلك، أثناء تكاثر الفطريات وإنباتها في محلول راسيمات، بعد فترة من الزمن يبقى شكل واحد فقط نشط بصريًا.
– طرق تعتمد على الاختلاف في خصائص الدياستيريومرات
وبالتالي، فإن أملاح أضداد الحمض النشط بصريًا مع نفس القاعدة النشطة بصريًا يجب أن تعطي diastereomers ذات قابلية ذوبان مختلفة. وهذا يسمح لهم بالفصل عن طريق التبلور.

مقدمة
1. النشاط البصري
1.1 المواد الفعالة بصريا
1.2 الأسباب الجسدية للنشاط البصري
1.2 أ. النموذج الظاهري
1.2 ب. نظرية الكم
1.2 بوصة. النظرية الجسيمية
2. الجزيئات اللولبية
2.1 مجموعات التماثل النقطية
2.1 أ. محور التماثل الخاص
2.1 ب. محور التماثل غير لائق
2.1 بوصة. أنواع مجموعات التماثل النقطي
2.2 التعريف المتماثل لللامركزية
2.3 أنواع اللامركزية
3. تسمية المتصاوغات
3.1 حسب التكوين: R - وS
3.2 النشاط البصري: +/-
3.3 حسب التكوين: D - وL-
4. طرق التكوين
4.1 تعريف التكوين المطلق
4.1 أ. حيود الأشعة السينية
4.1 ب. الحساب النظري للدوران البصري
4.2 تعريف التكوين النسبي
4.2 أ. الارتباط الكيميائي
4.2 ب. إنشاء التكوين النسبي باستخدام الطرق الفيزيائية
5. طرق فصل المتصاوغات الضوئية
5.1 الانقسام عن طريق diastereomers
5.2 الدقة الكروماتوغرافية
5.3 التقسيم الميكانيكي
5.4 الهضم الأنزيمي
5.5 إثبات النقاء البصري
خاتمة
الأدب
مقدمة
من بين المركبات العضوية هناك مواد قادرة على تدوير مستوى استقطاب الضوء. وتسمى هذه الظاهرة بالنشاط البصري، وتسمى المواد المقابلة لها بالنشاط البصري. تم العثور على المواد الفعالة بصريًا على شكل أزواج من الأضداد الضوئية - الأيزومرات، التي تكون خواصها الفيزيائية والكيميائية متماثلة في الظروف العادية، باستثناء واحد - علامة دوران مستوى الاستقطاب. (إذا كان أحد الأضداد البصرية له، على سبيل المثال، دوران محدد (+20 درجة، فإن الآخر له دوران محدد - 20 درجة).
تظهر الأيزومرية الضوئية عند وجود ذرة كربون غير متماثلة في الجزيء؛ هذا هو اسم ذرة الكربون المرتبطة بأربعة بدائل مختلفة. من الممكن وجود ترتيبين رباعي السطوح للبدائل حول ذرة غير متماثلة. لا يمكن الجمع بين كلا الشكلين المكانيين بأي دوران؛ أحدهما صورة مرآة للآخر:
ويسمى هذا النوع من الأيزومرية أيضًا الأيزومرية الضوئية أو الأيزومرية المرآة أو التماثلية. يشكل كلا الشكلين المرآة زوجًا من الأضداد الضوئية أو المتصاوغات الضوئية.
في عام 1815، أثبت الفيزيائي الفرنسي جان بابتيست بيوت والفيزيائي الألماني توماس سيبيك أن بعض المواد العضوية (على سبيل المثال، السكر أو زيت التربنتين) لديها القدرة على تدوير مستوى استقطاب الضوء، في حالة بلورية وسائلة ومذابة وحتى غازية. (تم اكتشاف هذه الظاهرة لأول مرة في عام 1811 من قبل الفيزيائي الفرنسي فرانسوا دومينيك أراغو بالقرب من بلورات الكوارتز). لذلك ثبت أن النشاط البصري يمكن أن يرتبط ليس فقط بعدم تناسق البلورات، ولكن أيضًا ببعض الخصائص غير المعروفة للجزيئات نفسها. وتبين أن بعض المركبات الكيميائية يمكن أن توجد في شكل كلا النوعين الأيمن والأيسر، والتحليل الكيميائي الأكثر دقة لا يكشف عن أي اختلافات بينهما. كان هذا نوعًا جديدًا من الأيزومرية، والذي كان يسمى الأيزومرية الضوئية. اتضح أنه بالإضافة إلى اليمين واليسار، هناك نوع ثالث من الأيزومرات - غير نشط بصريا. تم اكتشاف ذلك في عام 1830 من قبل الكيميائي الألماني الشهير ينس جاكوب بيرزيليوس باستخدام مثال حمض العنب (ثنائي هيدروكسي سوسنيك) HOOC-CH (OH) - CH (OH) - COOH: هذا الحمض غير نشط بصريًا، وحمض الطرطريك له نفس التركيب تمامًا. لديه الدوران الصحيح في الحل. في وقت لاحق، تم اكتشاف حمض الطرطريك "الأيسر"، وهو غير موجود في الطبيعة - وهو نقيض dextrorotatory.
يمكن تمييز الأيزومرات الضوئية باستخدام مقياس الاستقطاب - وهو جهاز يقيس زاوية دوران مستوى الاستقطاب. بالنسبة للحلول، تعتمد هذه الزاوية خطيا على سمك الطبقة وتركيز المادة الفعالة بصريا (قانون بيوت). بالنسبة للمواد المختلفة، يمكن أن يختلف النشاط البصري على نطاق واسع جدًا. لذلك، في حالة المحاليل المائية للأحماض الأمينية المختلفة عند 25 درجة مئوية، يكون النشاط المحدد (يشار إليه بالرمز D ويقاس للضوء بطول موجي 589 نانومتر بتركيز 1 جم / مل وسمك طبقة 10 سم) هو - 232 درجة للسيستين، - 86، 2 درجة للبرولين، -11.0 درجة لليوسين، +1.8 درجة للألانين، +13.5 درجة لليسين و +33.2 درجة للأسباراجين.
تتيح مقاييس الاستقطاب الحديثة قياس الدوران البصري بدقة عالية جدًا (تصل إلى 0.001 درجة). تتيح هذه القياسات إمكانية تحديد تركيز المواد الفعالة بصريًا بسرعة ودقة، على سبيل المثال، محتوى السكر في المحاليل في جميع مراحل إنتاجها - من المنتجات الخام إلى المحاليل المركزة ودبس السكر.
ارتبط النشاط البصري لبلورات الفيزياء بعدم تناسقها؛ البلورات المتناظرة تمامًا، مثل بلورات الملح المكعبة، تكون غير نشطة بصريًا. ظل سبب النشاط البصري للجزيئات غامضًا تمامًا لفترة طويلة. أول اكتشاف يسلط الضوء على هذه الظاهرة تم في عام 1848 على يد لويس باستور المجهول. باستور، الذي حدد اثنين من الأضداد من حمض الطرطريك، والتي كانت تسمى enantiomers (من enantios اليونانية - العكس). قدم لهم باستور التسميات L - و D-isomers (من الكلمات اللاتينية laevus - يسار ودكستر - يمين). في وقت لاحق، ربط الكيميائي الألماني إميل فيشر هذه التسميات ببنية اثنين من المتصاوغات الضوئية لواحدة من أبسط المواد الفعالة بصريًا - جليسرالديهيد OHCH2-CH (OH) - CHO. في عام 1956، بناءً على اقتراح الكيميائيين الإنجليز روبرت كان وكريستوفر إنجولد والكيميائي السويسري فلاديمير بريلوج، تم تقديم التسميات S (من اللاتينية الشريرة - اليسار) وR (اللاتينية المستقيمة - اليمين) للإيزومرات الضوئية؛ يُشار إلى زميل السباق بالرمز RS. ومع ذلك، وفقا للتقاليد، يتم استخدام التسميات القديمة أيضا على نطاق واسع (على سبيل المثال، للكربوهيدرات والأحماض الأمينية). تجدر الإشارة إلى أن هذه الحروف تشير فقط إلى بنية الجزيء (الترتيب ("الأيمن" أو "الأيسر") لمجموعات كيميائية معينة) ولا تتعلق باتجاه الدوران البصري؛ يتم الإشارة إلى الأخير بعلامات زائد وناقص، على سبيل المثال، D (-) - الفركتوز، D (+) - الجلوكوز.
تم إنشاء النظرية التي تشرح الفرق بين جزيئات الأضداد من قبل العالم الهولندي فانت هوف. ووفقا لهذه النظرية، فإن الجزيئات، مثل البلورات، يمكن أن تكون "يمنى" و"يسارية"، كونها صورة مرآة لبعضها البعض. تسمى هذه الهياكل التي تختلف عن بعضها البعض مثل اليد اليمنى عن اليسرى، مراوان (من اليونانية. وريث - يد). وبالتالي، فإن النشاط البصري هو نتيجة الأيزومرية المكانية (الأيزومرية الفراغية) للجزيئات.
الأيزومرية الضوئية
حازت نظرية فانت هوف، التي أرست أسس الكيمياء المجسمة الحديثة، على اعتراف عام، وأصبح منشئها في عام 1901 أول حائز على جائزة نوبل في الكيمياء.
1. النشاط البصري
النشاط البصري هو قدرة الوسط (البلورات والمحاليل وأبخرة المادة) على التسبب في دوران مستوى استقطاب الإشعاع البصري (الضوء) الذي يمر عبره.
يتجلى في تلك الحالات عندما تكون أيزومرات نفس المركب متصلة مع مواقف مختلفة من البدائل تأكيدمركز, غير متوافق في الفضاء. بالنسبة لمشتقات السلسلة الأليفاتية، ترتبط الأيزومرية بالخصائص الكيميائية المجسمة لذرة الكربون الهجين sp3.
حتى لو بيل في نهاية القرن الثامن عشر اقترح البنية الرباعية لذرة الكربون. إذا كانت ذرة الكربون متصلة مع أربعة مختلفةالبدائل، هناك احتمال وجود 2 أيزومرات، وهي صور مرآة لبعضها البعض.
تسمى ذرة الكربون التي تحتوي على جميع البدائل المختلفة غير متماثلأو غير متناظرالمركز ("هيروس" - اليد).
خذ بعين الاعتبار مثال الصيغ الواعدة:
الأيزومرات المجسمة I و II غير متوافقة في الفضاء، فهي متضادات أو أيزومرات بصرية ( متصاوغات ضوئية، ستريومر).
صيغ إسقاط فيشر
دعونا نفكر في صيغ المنظور في مستوى آخر.
دعونا نضع المركز غير المتماثل (ذرة الكربون) في مستوى الورقة؛ النواب أو بخلف الطائرة الورقية ( منمراقب)؛ النواب Fو دفوق مستوى الورقة ( أقرب الىالمراقب) - حسب الأسهم التي تشير إلى اتجاه نظر المراقب. نحصل على اتجاه عمودي متبادل للسندات مع المركز اللولبي. يسمى هذا البناء للأيزومرات بصيغ إسقاط فيشر.
وهكذا، في صيغ إسقاط فيشر، يتم توجيه البدائل الموجودة أفقيًا نحو المراقب، وعموديًا - خارج مستوى الورقة.
عند إنشاء صيغ الإسقاط، يتم ترتيب البدائل الأكثر ضخامة عموديا. إذا كانت البدائل ذرات أو مجموعات صغيرة لا علاقة لها بالسلسلة الرئيسية، فإنها مرتبة أفقيا. ل2-بروموبوتان
هناك اثنان نقيض:
لا يمكن تمييز Enantiomers، Antipods، Stereomers عمليًا في الخصائص (الغليان t، الانصهار t، وما إلى ذلك)، ولها أيضًا ثوابت ديناميكية حرارية مماثلة. وفي نفس الوقت لديهم اختلافات:
4) - تتبلور الأضداد الصلبة مع تكوين بلورات تشبه المرآة بعضها البعض ولكنها غير متوافقة في الفضاء.
5) - تقوم الأضداد بتدوير مستوى الضوء المستقطب بنفس الزاوية ولكن في اتجاهات مختلفة. إذا كانت زاوية دوران الضوء موجبة (في اتجاه عقارب الساعة)، فإن القطب المضاد يسمى dextrorotatory، وإذا كان سالبًا (عكس اتجاه عقارب الساعة)، فهو أعسر.
يُشار إلى زاوية الدوران البصري للضوء المستقطب المستوي بـ [ αد]. لو [ αد]= -31.2°، ثم تمت دراسة المضاد اليساري الدوراني.
جهاز قياس القطبية
تسمى المواد القادرة على تدوير مستوى الضوء المستقطب بأنها نشطة بصريًا أو نشطة بصريًا.
لا يؤدي خليط من اثنين من المتصاوغات بنسبة 1:1 إلى تدوير مستوى الضوء المستقطب ويسمى خليط راسيمي، أو زميل سباق.
إذا تغلب أحد الأضداد على الآخر في الخليط، فهذا يعني أنه يتحدث عن نقائه البصري (هـ). يتم حسابه من خلال الفرق في محتوى المقابلات الضوئية في الخليط.
II - 30%، ee=70 - 30 = 40 (%)
الأمينات الثانوية والثالثيةقد يكون لها أيضًا نشاط بصري. البديل الرابع هو زوج الإلكترونات الوحيد الموجود في ذرة النيتروجين.
5.4.1 الدياستيريومرات
قياس الانكسار هو ظاهرة لها تأثير أكبر على خواص المواد ويتم ملاحظتها في الحالات التي يوجد فيها مركزان غير متماثلين أو أكثر في المركب. على سبيل المثال:
4-كلوروبنتانول-2
دعونا نصور جميع الأضداد الممكنة للاتصال (I-IV):
تسمى الأيزومرات الضوئية (الإيزومرات المجسمة) لنفس المركب والتي لا تعتبر متضادات diastereomers. وهذا يعني أن أزواج الأيزومرات I و III و I و IV و II و III و II و IV هي أزواج دياستيريوميرية. يتم حساب عدد الأيزومرات بالصيغة: q \u003d 2 n، أين
q هو العدد الإجمالي للإيزومرات الفراغية،
n هو عدد المراكز غير المتماثلة (C*).
على سبيل المثال، يحتوي الجلوكوز على 4 مراكز مراوانية، ثم q = 2 4 = 16 (D-glucose - 8 أيزومرات، L-glucose - 8 أيزومرات).
د- الجلوكوز
في الطبيعة، هناك حالات تكون فيها الذرات غير المتماثلة في المركب لها نفس البيئة. وهذا يؤدي إلى حقيقة أن نصف الأضداد غير نشطة بصريًا.
حمض النبيذ
å α =0 å α =0 å α =2α å α =-2α
mesoform
الميزوفورم هو شكل غير نشط بصريًا ناتج عن التماثل الداخلي في مادة نشطة بصريًا.
على عكس الأضداد المضادة، تختلف الدياستيريومرات في نقطة الغليان، والكثافة (د 4 20)، ومعامل الانكسار (ن 4 20)، وما إلى ذلك.