Definicja wiązania peptydowego. Właściwości wiązania peptydowego. Zdolność do tworzenia wiązań wodorowych
Zawartość:
Korzyści z aminokwasów podczas treningu siłowego. Cztery grupy odzwierciedlające tworzenie struktury cząsteczki białka.
Białko to cząsteczka polimeru zawierająca grupę monomerów (czyli małych pierwiastków) - aminokwasów. Właściwości i działanie białka zależą od tego, które aminokwasy tworzą skład białka, a także od ich naprzemienności. W sumie w organizmie człowieka można znaleźć dwadzieścia aminokwasów, które występują w różnych kombinacjach w białkach o różnej budowie. Konwencjonalnie wszystkie składniki cząsteczki białka można uznać za litery alfabetu, na których zapisana jest pewna ilość informacji. Tylko słowo może wskazywać na dowolny przedmiot lub działanie, a zestaw aminokwasów może wskazywać na funkcję konkretnego białka, jego możliwości i wydajność.
O korzyściach
Na temat cech i zalet takich przydatnych elementów napisano setki artykułów i książek. Czemu nie, bo tak naprawdę tworzą nasz organizm, są składnikami białek i pomagają rozwijać się pod każdym względem. Główne właściwości obejmują:
- przyspieszenie syntezy białek. Obecność w organizmie pełnego kompleksu aminokwasów pomaga pobudzić produkcję insuliny i aktywować mTor. Razem te mechanizmy pomagają wywołać wzrost mięśni;
- Źródło energii. Składniki takie przechodzą innym szlakiem metabolicznym i różnią się funkcją od węglowodanów. Dzięki temu organizm otrzymuje duże ilości energii i zostaje wypełniony pulą aminokwasów. W rezultacie mięśnie rosną znacznie szybciej;
- tłumienie procesów katabolicznych. Z ich pomocą możesz na zawsze zapomnieć, co to znaczy niszczyć własne mięśnie, ponieważ organizm zawsze będzie miał materiał do budowy nowych cząsteczek białka;
- redukcja tkanki tłuszczowej. Przydatną funkcją jest to, że pomaga w tworzeniu leptyny, która sprzyja najszybszemu spalaniu złogów tłuszczu. Wszystko to pozwala osiągnąć maksymalny efekt.
Dobroczynne działanie grup aminokwasów może obejmować także udział w metabolizmie azotu w organizmie, odbudowę uszkodzonych obszarów tkankowych, zapewnienie procesów metabolicznych, pełną regenerację mięśni i obniżenie poziomu cukru we krwi. Ponadto do korzystnych działań należy stymulacja hormonu wzrostu, zwiększenie wytrzymałości, dostarczenie organizmowi niezbędnej ilości energii, normalizacja procesów metabolicznych, pobudzenie układu odpornościowego, normalizacja procesu trawienia, ochrona przed promieniowaniem i tak dalej.
Struktura
Chemicy wyróżniają cztery główne grupy, które odzwierciedlają istotę strukturalnego tworzenia cząsteczki składnika tak niezbędnego i ważnego dla organizmu ludzkiego. Istnieją tylko cztery takie grupy i każda z nich ma swoją własną charakterystykę formacji - pierwotną, wtórną, trzeciorzędową i czwartorzędową. Rozważmy te niuanse bardziej szczegółowo:

Wniosek
Przyjrzeliśmy się więc pokrótce, w jaki sposób aminokwasy tworzą pierwiastek tak niezbędny dla człowieka.
Wiązanie peptydowe ma charakter kowalencyjny w swojej naturze chemicznej i nadaje wysoką wytrzymałość pierwotnej strukturze cząsteczki białka. Będąc powtarzalnym elementem łańcucha polipeptydowego i posiadającym specyficzne cechy strukturalne, wiązanie peptydowe wpływa nie tylko na kształt struktury pierwszorzędowej, ale także na wyższe poziomy organizacji łańcucha polipeptydowego.
Grupa peptydowa (amidowa) ma oryginalną strukturę.
Wszystkie cztery atomy - N, C, O i C - znajdują się w tej samej płaszczyźnie, co odpowiada hybrydyzacji sp 2 atomów węgla i tlenu grupy karbonylowej. Samotna para elektronów atomu azotu wchodzi w koniugację z elektronami podwójnego wiązania grupy karbonylowej. W rezultacie wiązanie C–N w peptydach i białkach ulega znacznemu skróceniu, a wiązanie podwójne C=O – wydłużeniu. Z punktu widzenia struktury elektronowej grupa peptydów jest trójśrodkowym układem sprzężonym p–, w którym gęstość elektronów jest przesunięta w stronę bardziej elektroujemnego atomu tlenu. W tym przypadku powstają właściwości o wysokim oddawaniu elektronów (=atom O) i akceptujące elektrony (atom H z azotem), które gwałtownie zwiększają zdolność tych atomów do tworzenia wiązań wodorowych, dzięki czemu powstaje najważniejsza właściwość białek - tworzyć struktury o nieskończenie różnorodnych kształtach:

Każda grupa peptydowa może tworzyć dwa wiązania wodorowe z innymi grupami, w tym z peptydowymi. Wyjątkiem są grupy peptydowe utworzone z udziałem aminokwasów proliny lub hydroksyproliny, które są zdolne do tworzenia tylko jednego wiązania wodorowego. Łańcuch peptydowy w miejscu, w którym znajduje się prolina lub hydroksyprolina, łatwo się wygina, ponieważ nie jest utrzymywany, jak zwykle, przez drugie wiązanie wodorowe.
W związku z tym, że wiązanie peptydowe może występować w formie keto-enolowej (obecność płaskiego układu sprzężonego),

rotacja wokół wiązania C – N jest zabroniona, a wszystkie atomy wchodzące w skład grupy peptydowej mają konfigurację trans. Konfiguracja cis jest mniej korzystna energetycznie i występuje tylko w niektórych peptydach cyklicznych.
Jako część łańcucha polipeptydowego sztywne elementy strukturalne (płaskie grupy peptydowe) występują naprzemiennie ze stosunkowo ruchomymi regionami (–CHR), które są zdolne do obracania się wokół wiązań, chociaż taka rotacja może być bardzo ograniczona ze względu na trudności w przestrzennym rozmieszczeniu rodników bocznych ( R) reszt aminokwasowych. Tym samym struktura elektronowa i przestrzenna grupy peptydowej wpływa na przestrzenny układ łańcucha polipeptydowego, a przede wszystkim warunkuje powstawanie struktury drugorzędowej białka.
Struktura wtórna
Struktura drugorzędowa białek to sposób składania łańcucha polipeptydowego w uporządkowaną formę dzięki układowi wiązań wodorowych, tj. określa orientację przestrzenną łańcucha polipeptydowego. Istnieją dwie formy struktury wtórnej: spirala ( -spirala), występujące w obrębie jednego łańcucha polipeptydowego i warstwowo-składany ( -Struktura) - pomiędzy sąsiednimi łańcuchami polipeptydowymi.
Chociaż struktura helikalna w łańcuchach polipeptydowych białek występuje w postaci odrębnych odcinków, nadaje cząsteczce białka dość dużą wytrzymałość i wyznacza w niej zarówno krótko-, jak i daleki zasięg sił biorących udział w tworzeniu wiązań wodorowych.
-helisa uwzględnia wszystkie właściwości wiązania peptydowego, a jej konfiguracja ma symetrię helikalną. Zwoje spirali są regularne; wszystkie reszty aminokwasowe w szkielecie helisy są równoważne, niezależnie od struktury ich rodników bocznych, a te ostatnie nie biorą udziału w tworzeniu α-helisy. W jednym zwoju α-helisy znajduje się 3,6 reszt aminokwasowych. Spiralę można opisać sekwencją

z 13 atomami w pierścieniu (reszty R-aminokwasowe), gdzie O...H oznacza wiązanie wodorowe.
Każda grupa peptydowa tworzy wiązanie wodorowe z czwartą z niej grupą peptydową.
-Spirala zapewnia najniższe napięcie wiązania, minimalne wymiary wolnej przestrzeni w pobliżu osi i minimalne wymiary zwoju spirali. α-helisę odkryto po raz pierwszy w hemoglobinie krystalicznej, a później w prawie wszystkich białkach globularnych.
Struktura warstwowa (struktura ) ma lekko zakrzywioną konfigurację atomu węgla y łańcucha polipeptydowego i jest utworzona przez międzyłańcuchowe wiązania wodorowe.
-Złożone arkusze mogą być utworzone przez równoległe (końce N skierowane w tym samym kierunku) i antyrównoległe (końce N skierowane w różne kierunki) łańcuchy polipeptydowe. Złożone struktury stwierdzono w wielu białkach strukturalnych (kolagen, keratyna, fibroina jedwabiu).
Zbiór α-helis i β-struktur jest ważnym kryterium pozwalającym ocenić stopień uporządkowania struktury cząsteczki białka oraz stabilność białek pod wpływem fizykochemicznych czynników środowiskowych.
Na podstawie ostatnich badań białek globularnych ustalono jeszcze dwa poziomy: struktura nadwtórna, charakteryzujące preferowane energetycznie agregaty o strukturze drugorzędowej, oraz domeny – części globuli białkowej, które są dość oddzielnymi regionami kulistymi.
Struktura nadwtórna (superhelisa)– są to zespoły struktur drugorzędnych oddziałujących na siebie. Występowanie tych zespołów wskazuje, że są one korzystne zarówno z punktu widzenia kinetyki procesu zwijania, jak i pozyskiwania darmowej energii w już zwiniętym białku. Superskręcona α-helisa występuje w białkach fibrylarnych.
Pod domeny Powszechnie przyjmuje się, że należy rozumieć zwarte podregiony autonomiczne w obrębie białka, charakteryzujące się minimalnym stosunkiem powierzchni do objętości, a także tym, że liczba połączeń funkcjonalnych w obrębie domeny znacznie przewyższa liczbę domen sąsiednich. Zazwyczaj domeny pełnią określone funkcje i dlatego są nazywane domeny funkcjonalne.
Wiązanie peptydowe to silne połączenie fragmentów dwóch aminokwasów, które leży u podstaw powstawania liniowych struktur białek i peptydów. W takich cząsteczkach każdy aminokwas (z wyjątkiem końcowych) jest połączony z poprzednim i kolejnym.
W zależności od liczby jednostek wiązania peptydowe mogą tworzyć dipeptydy (składają się z dwóch aminokwasów), tripeptydy (z trzech), tetrapeptydy, pentapeptydy itp. Krótkie łańcuchy (od 10 do 50 monomerów) nazywane są oligopeptydami, a długie łańcuchy nazywane są polipeptydy i białka (masa cząsteczkowa powyżej 10 tys. Tak).
Charakterystyka wiązania peptydowego
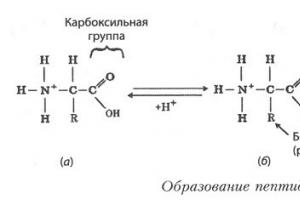
Wiązanie peptydowe to kowalencyjne wiązanie chemiczne pomiędzy pierwszym atomem węgla jednego aminokwasu i atomem azotu innego aminokwasu, powstające w wyniku oddziaływania grupy alfa-karboksylowej (COOH) z grupą alfa-aminową (NH2). W tym przypadku następuje nukleofilowe zastąpienie grupy OH-hydroksylowej grupą aminową, z której oddziela się wodór. W rezultacie powstaje pojedyncze wiązanie C-N i cząsteczka wody.
Ponieważ podczas reakcji następuje utrata niektórych składników (grupy OH i atomu wodoru), jednostki peptydowe nie są już nazywane aminokwasami, ale resztami aminokwasów. Ze względu na to, że te ostatnie zawierają 2 atomy węgla, w łańcuchu peptydowym występują naprzemiennie wiązania C-C i C-N, które tworzą szkielet peptydowy. Po bokach znajdują się rodniki aminokwasowe. Odległość między atomami węgla i azotu waha się od 0,132 do 0,127 nm, co wskazuje na niepewną zależność.
Wiązanie peptydowe jest bardzo silnym rodzajem interakcji chemicznej. W standardowych warunkach biochemicznych odpowiadających środowisku komórkowemu nie ulega samoistnemu zniszczeniu.
Wiązanie peptydowe białek i peptydów charakteryzuje się właściwością współpłaszczyznowości, ponieważ wszystkie atomy biorące udział w jego tworzeniu (C, N, O i H) znajdują się w tej samej płaszczyźnie. Zjawisko to tłumaczy się sztywnością (czyli brakiem możliwości obracania się elementów wokół wiązania) wynikającą ze stabilizacji rezonansowej. W obrębie łańcucha aminokwasowego, pomiędzy płaszczyznami grup peptydowych, znajdują się atomy węgla α związane z rodnikami.

Typy konfiguracji
W zależności od położenia atomów węgla alfa względem wiązania peptydowego, to ostatnie może mieć 2 konfiguracje:
- „cis” (umieszczony po jednej stronie);
- „trans” (umieszczony po różnych stronach).
Forma trans charakteryzuje się większą stabilnością. Czasami konfiguracje charakteryzują się ułożeniem rodników, co nie zmienia istoty, ponieważ są one związane z atomami węgla alfa.
Zjawisko rezonansu
Osobliwością wiązania peptydowego jest to, że jest ono dwukrotnie większe o 40% i występuje w trzech postaciach:
- Ketol (0,132 nm) - wiązanie C-N jest stabilizowane i całkowicie pojedyncze.
- Przejściowa lub mezomeryczna - forma pośrednia, ma częściowo nieokreślony charakter.
- Enol (0,127 nm) - wiązanie peptydowe staje się całkowicie podwójne, a połączenie C-O staje się całkowicie pojedyncze. W tym przypadku tlen uzyskuje częściowo ładunek ujemny, a atom wodoru częściowo dodatni.

Cecha ta nazywana jest efektem rezonansu i jest wyjaśniona delokalizacją wiązania kowalencyjnego pomiędzy atomami węgla i azotu. W tym przypadku hybrydowe orbitale sp 2 tworzą chmurę elektronów rozprzestrzeniającą się na atom tlenu.
Tworzenie wiązań peptydowych
Tworzenie wiązań peptydowych jest typową reakcją polikondensacji, która jest niekorzystna termodynamicznie. W warunkach naturalnych równowaga przesuwa się w stronę wolnych aminokwasów, dlatego synteza wymaga katalizatora, który aktywuje lub modyfikuje grupę karboksylową w celu łatwiejszego usunięcia grupy hydroksylowej.
W żywej komórce tworzenie wiązania peptydowego zachodzi w centrum syntezy białek, gdzie rolę katalizatora pełnią specyficzne enzymy, które działają przy wydatku energii z wiązań wysokoenergetycznych.
Wiązanie peptydowe powstaje, gdy grupa aminowa jednego aminokwasu reaguje z grupą karboksylową innego, uwalniając cząsteczkę wody:
CH 3 -CH (NH 2) -COOH + CH 3 - CH (NH 2) -COOH → CH 3 -CH (NH 2) -CO-NH-(CH 3) CH-COOH + H 2 O
Aminokwasy połączone wiązaniami peptydowymi tworzą łańcuch polipeptydowy. Wiązanie peptydowe ma płaską strukturę: atomy C, O i N znajdują się w hybrydyzacji sp 2; atom N ma orbital p z wolną parą elektronów; powstaje układ sprzężony p-p, co prowadzi do skrócenia wiązania C-N (0,132 nm) i ograniczenia rotacji (bariera rotacji wynosi ~63 kJ/mol). Dominuje wiązanie peptydowe trans-konfiguracja względem płaszczyzny wiązania peptydowego. Ta struktura wiązania peptydowego wpływa na tworzenie drugorzędowej i trzeciorzędowej struktury białka. Wiązanie peptydowe- sztywne, kowalencyjne, zdeterminowane genetycznie. We wzorach strukturalnych jest ono przedstawiane jako wiązanie pojedyncze, ale w rzeczywistości to wiązanie pomiędzy węglem i azotem ma charakter częściowo podwójnego wiązania:
Jest to spowodowane różną elektroujemnością atomów C, N i O. Rotacja wokół wiązania peptydowego jest niemożliwa, wszystkie cztery atomy leżą w tej samej płaszczyźnie, tj. współpłaszczyznowy. Rotacja innych wiązań wokół szkieletu polipeptydowego jest całkiem swobodna.
Pierwotną strukturę odkrył profesor Uniwersytetu Kazańskiego A.Ya. Danilewskiego w 1989 r. W 1913 r. E. Fischer zsyntetyzował pierwsze peptydy. Sekwencja aminokwasów każdego białka jest unikalna i genetycznie ustalona.

Tripeptyd: glicyloalanylolizyna
Aby określić strukturę pierwszorzędową oddzielnego, chemicznie jednorodnego łańcucha polipeptydowego, skład aminokwasów określa się poprzez hydrolizę: stosunek każdego z dwudziestu aminokwasów w próbce jednorodnego polipeptydu. Następnie zaczynają określać charakter chemiczny końcowych aminokwasów łańcucha polipeptydowego zawierającego jedną wolną grupę NH2 i jedną wolną grupę COOH.
Aby określić naturę Aminokwas N-końcowy Zaproponowano szereg metod, w szczególności metodę Sangera (za jej opracowanie F. Sanger otrzymał Nagrodę Nobla w 1958 r.). Metoda ta opiera się na reakcji arylowania polipeptydu z 2,4-dinitrofluorobenzenem. Roztwór polipeptydu traktuje się 2,4-dinitrofluorobenzenem, który reaguje z wolną grupą α-aminową peptydu. Po hydrolizie kwasowej produktu reakcji, z odczynnikiem wiąże się tylko jeden aminokwas w postaci 2,4-dinitrofenyloaminokwasu. W przeciwieństwie do innych aminokwasów ma kolor żółty. Wyodrębnia się go z hydrolizatu i identyfikuje metodą chromatografii.
Do ustalenia Aminokwas C-końcowy Często stosuje się metody enzymatyczne. Traktowanie polipeptydu karboksypeptydazą, która rozrywa wiązanie peptydowe od końca peptydu, na którym znajduje się wolna grupa COOH, prowadzi do uwolnienia C-końcowego aminokwasu, którego charakter można zidentyfikować metodą chromatografii. Istnieją inne metody oznaczania aminokwasu C-końcowego, w szczególności metoda chemiczna Akabori, oparta na hydrazynolizie polipeptydu.
Kolejnym etapem pracy jest określenie sekwencji aminokwasów w polipeptydzie. W tym celu najpierw przeprowadza się częściową (chemiczną i enzymatyczną) hydrolizę łańcucha polipeptydowego na krótkie fragmenty peptydowe, których sekwencję można dokładnie określić. Po hydrolizie generowane są mapy peptydów za pomocą elektroforezy i chromatografii. Następnie określa się sekwencję aminokwasów w wyizolowanych peptydach oraz pierwotną strukturę całej cząsteczki.
Możliwość łączenia się ze sobą peptyd Św. (powstaje cząsteczka polimeru).
Wiązanie peptydowe - pomiędzy grupą α-karboksylową jednego aminokwasu. Iα-aminogr.inna amino..
Podczas nadawania nazwy należy dodać przyrostek „-il”, ostatni to amino. nie edytowane jego nazwa.
(alanylo-serylo-tryptofan)
Właściwości wiązania peptydowego
1. Transpozycja rodników aminokwasów w stosunku do wiązania C-N
2. Współpłaszczyznowość - wszystkie atomy wchodzące w skład grupy peptydowej znajdują się w tej samej płaszczyźnie, przy czym „H” i „O” znajdują się po przeciwnych stronach wiązania peptydowego.
3. Obecność formy ketonowej (o-c=n) i formy enolowej (o=s-t-n)
4. Zdolność do tworzenia dwóch wiązań wodorowych z innymi peptydami
5. Wiązanie peptydowe ma częściowo charakter wiązania podwójnego, ma długość mniejszą niż wiązanie pojedyncze, jest strukturą sztywną i obrót wokół niego jest utrudniony.
Do wykrywania białek i peptydów - reakcja biuretowa (od niebieskiej do fioletowej)
4) FUNKCJE BIAŁEK:
białka strukturalne (kolagen, keratyna),
Enzymatyczne (pepsyna, amylaza),
Transport (transferyna, albumina, hemoglobina),
Żywność (białka jaj, płatki zbożowe),
Skurczowe i motoryczne (aktyna, miozyna, tubulina),
Ochronne (immunoglobuliny, trombina, fibrynogen),
Regulacyjne (hormon somatotropowy, hormon adrenokortykotropowy, insulina).
POZIOMY ORGANIZACJI STRUKTURY BIAŁKA
Białko to sekwencja aminokwasów połączonych ze sobą Wiązania peptydowe.
Peptyd jest amino. nie więcej niż 10
Polipeptyd - od 10 do
Białko - ponad 40 aminokwasów.
PODSTAWOWA STRUKTURA -liniowa cząsteczka białka, obraz. podczas łączenia aminokwasów. w łańcuch.
polimorfizm białek- mogą zostać odziedziczone i pozostać w populacji
Sekwencja i stosunek aminokwasów w strukturze pierwszorzędowej determinuje powstawanie struktur drugorzędowych, trzeciorzędowych i czwartorzędowych.
STRUKTURA WTÓRNA- interakcja motywujący. grupy z arr. wodór znajomości. Istnieją 2 rodzaje konstrukcji - układanie w postaci liny i garnka.
Dwie opcje struktury wtórnej: α-helisa (struktura α lub równoległa) i warstwa β-plisowana (struktura β lub antyrównoległa).
Z reguły obie struktury występują w jednym białku, ale w różnych proporcjach.
W białkach globularnych dominuje α-helisa, w białkach fibrylarnych dominuje struktura β.
Struktura drugorzędowa powstaje tylko przy udziale wiązań wodorowych pomiędzy grupami peptydowymi: atom tlenu jednej grupy reaguje z atomem wodoru drugiej grupy, jednocześnie tlen drugiej grupy peptydowej wiąże się z wodorem trzeciej, itp.