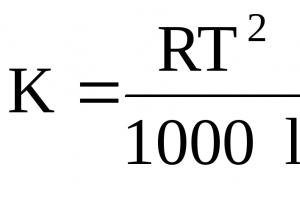Zwiększanie temperatury wrzenia roztworów nieelektrolitów. Kriokonserwacja dużych obiektów biologicznych Wykres spadku temperatury zamarzania roztworów wodnych
Z prawa Raoulta wynikają dwie ważne konsekwencje:
1) Roztwory wrzą w wyższej temperaturze niż czysty rozpuszczalnik;
2) Roztwory zamarzają w niższej temperaturze niż czysty rozpuszczalnik.
Przyjrzyjmy się im bardziej szczegółowo.
Wrzenie to fizyczny proces zmiany cieczy w stan gazowy lub parę, podczas którego w cieczy tworzą się pęcherzyki gazu.
Ciecz wrze pod ciśnieniempara nasycona staje się równa ciśnieniu zewnętrznemu. Jeśli ciśnienie zewnętrzne (na przykład atmosferyczne) nie ulegnie zmianie, aPonieważ ciecz jest substancją indywidualną i czystą chemicznie, jej wrzenie w otwartym, ogrzewanym naczyniu zachodzi w stałej temperaturze, aż do całkowitego zaniku fazy ciekłej.
Zatem przy ciśnieniu atmosferycznym 101,325 kPa temperatura wrzenia oczyszczonej (destylowanej) wody wynosi 100 o C lub 373,16 K.
Jeśli w H2O rozpuści się jakąś nielotną substancję, wówczas prężność jej pary nasyconej spadnie. Aby powstały roztwór wrzał, konieczne jest podgrzanie go do temperatury wyższej niż 373,16 K, ponieważ tylko w takich warunkach prężność pary nasyconej rozpuszczalnika ponownie stanie się równa ciśnieniu atmosferycznemu.
Zamrażanie lub krystalizacjajest zjawiskiem fizycznym, któremu towarzyszy przemiana cieczy w ciało stałe. Ponadto w całej objętości cieczy tworzą się struktury krystaliczne.
Proces zamrażania rozpoczyna się, gdy ciśnienie pary nasyconej nad cieczą zrówna się z ciśnieniem pary nasyconej nad jej stałymi kryształami.
Jeśli ciśnienie zewnętrzne (atmosferyczne) pozostaje stałe iJeżeli ciecz nie zawiera obcych zanieczyszczeń, wówczas podczas procesu krystalizacji temperatura schłodzonej cieczy pozostanie stała, aż faza ciekła całkowicie zamieni się w ciało stałe.
Przy ciśnieniu atmosferycznym równym 101,325 kPa woda destylowana zamarza w temperaturze 0 ° C (273,16 K). Prężność pary nasyconej wody nad lodem i cieczą wynosi w tym przypadku 613,3 Pa.
W przypadku roztworu wodnego prężność pary nasyconej rozpuszczalnika w temperaturze 0 o C będzie mniejsza niż 613,3 Pa, a nad lodem pozostanie niezmieniona. Lód wrzucony do takiego roztworu szybko się stopi na skutek kondensacji nadmiaru pary nad nim.
Dopiero obniżenie temperatury umożliwia ponowne wyrównanie ciśnienia pary nasyconej nad fazą ciekłą i stałą i zainicjowanie procesu krystalizacji.
Ustalono doświadczalnie, że wzrost temperatury wrzenia ( T wyrko. ) i obniżenie temperatury zamarzania rozwiązanie ( T zastępca ) w porównaniu z czystym rozpuszczalnikiem jest wprost proporcjonalna do stężenia molowego substancji rozpuszczonej. Matematycznie można to zapisać w następujący sposób:
kip. roztwór – zagotować. p-ciało =t wrzeć. =Em
t zastępca r-tel –t zastępca rozwiązanie =t zastępca =Km
GdzieM– stężenie molowesubstancja rozpuszczona;miIK– odpowiednio ebulioskopowy (łac.wzburzenie– zagotowanie) i krioskopowe (gr. krios – zimno) stałe, których wartości zależą wyłącznie od naturyrozpuszczalnik (Tabela 7).
Tabela 7. Ebulioskopowe stałe E i krioskopowe K niektórych rozpuszczalników (stopnie/mol)
Stałe ebulioskopowe i krioskopowe rozpuszczalnik pokazuje, o ile stopni wzrasta temperatura wrzenia i temperatura zamarzania spada roztwór otrzymywany przez rozpuszczenie jednego mola nieelektrolitu w jednym kilogramie rozpuszczalnika ( M = 1 mol/kg).
Aby wyznaczyć wartości E i K należy w pierwszej kolejności wyznaczyć doświadczalnie Dt beli. i zastępca Dt silnie rozcieńczone roztwory (m<< 1), а затем полученные данные пересчитывают или экстраполируют для растворов сm= 1 моль/кг.
GdzieR– uniwersalna stała gazowa;T– temperatura wrzenia rozpuszczalnika; - ciepło właściwe parowania rozpuszczalnika.

GdzieT- temperatura topnieniarozwiązanieprzedmiot;l– ciepło właściwe topnieniarozpuszczalnik.
Zatem, roztwory substancji o różnym charakterze, ale o tym samym stężeniu molowym, będą jednocześnie wrzeć i zamarzaćtemperatura.
Warto zwrócić uwagę na istotną różnicęroztwór czystego rozpuszczalnika. Jeśli ten ostatni wrze i zamarza na stałym poziomietemperatura, wtedyrozwiązania robią to w przedzialetemperatury, tj. Gdy się zagotują, temperatura cały czas rośnie, a gdy zamarzają, spada. Wynika to z faktu usunięcia go z fazy ciekłejrozpuszczalnik w postaci pary lub stałych kryształów prowadzi do wzrostu stężenia molowego roztworu, ponieważ Podczas procesu wrzenia i zamrażania substancja rozpuszczona pozostaje w niezmienionej ilości w fazie ciekłej (aż do całkowitego wrzenia lub zamrożenia), a masa ciekłego rozpuszczalnika maleje.
W praktycznych pomiarach temperatura zamarzania lub wrzenia roztworu rejestruje się moment pojawienia się w nim pierwszych stałych kryształów (np T zastępca ) lub pęcherzyki gazu (np T wyrko. ).
Właściwość roztworów obniżających temperaturę zamarzania pozwala na ich wykorzystanie jako chłodziwa.
Dlatego roztwory niektórych substancji organicznych i nieorganicznych stosuje się jako środki przeciw zamarzaniu do chłodzenia silników spalinowych pracujących w różnorodnych warunkach klimatycznych.
Degradacja temperatura zamarzania rozwiązań ma ogromne znaczenie dla organizmów żywych. Zatem ciecz w ich komórkach jest roztworem różnych substancji nieorganicznych i organicznych. Jegotemperatura zamarzania jest poniżej 0 O C (273.16 K ), więc komórki nie umierają w wyniku hipotermii.
Dzięki temu zjawisku rośliny zachowują się zimą. Co więcej, im wyższe stężenie substancji w płynie komórkowym, tym niższe temperatury zewnętrzne roślina może tolerować.
Jednocześnie, aby obniżyć temperaturę zamarzania roztworu w chłodzonych ogniwach, nasila się proces hydrolizy związków o wyższej masie cząsteczkowej do związków o niskiej masie cząsteczkowej (na przykład węglowodanów do glukozy).
Właściwości koligatywne roztworów to te właściwości, które zależą tylko od stężenia cząstek rozpuszczonej substancji, ale nie od jej składu chemicznego. W tej części rozważone zostaną cztery właściwości koligatywne roztworów: 1) spadek prężności pary, 2) wzrost temperatury wrzenia, 3) spadek temperatury krzepnięcia, 4) ciśnienie osmotyczne. Wszystkie te cztery właściwości dotyczą roztworów zawierających nielotne substancje rozpuszczalne, tj. te substancje rozpuszczalne, których prężność pary jest znikoma.
Zmniejszanie prężności par roztworów
Cząsteczki czystego rozpuszczalnika mogą przedostawać się do fazy gazowej z całej powierzchni cieczy (rys. 6.34). Jednakże w roztworze, ze względu na obecność cząstek substancji rozpuszczonej, przejście cząstek rozpuszczalnika z powierzchni do fazy gazowej jest utrudnione. Jeżeli substancja rozpuszczona ma niższą prężność pary niż rozpuszczalnik, wówczas prężność pary roztworu jest niższa niż czystego rozpuszczalnika. Ten wzór można zrozumieć w oparciu o prawo Raoulta (patrz poprzednia sekcja). W skrajnym przypadku, gdy roztwór zawiera całkowicie nielotną substancję rozpuszczoną, prężność pary roztworu jest generowana wyłącznie przez cząstki rozpuszczalnika. Na ryc. Rysunek 6.35 przedstawia diagram fazowy ciśnienia pary i składu pary dla takiego przypadku. Oczywiście ten skrajny przypadek jest czysto hipotetyczny, ponieważ w rzeczywistości wszystkie ciała stałe mają pewną prężność pary, chociaż może ona być bardzo mała.
Ryż. Rysunek 6.35 pokazuje, że wraz ze wzrostem ułamka molowego nielotnej substancji rozpuszczonej B, prężność pary roztworu maleje. Korzystanie z prawa Raoulta
Ryż. 6.34. Nielotne cząstki substancji rozpuszczonej zapobiegają usuwaniu cząstek rozpuszczalnika z powierzchni cieczy, a tym samym zmniejszają prężność pary.
można wyprowadzić równanie opisujące spadek prężności pary dla roztworów rozcieńczonych. Zgodnie z prawem Raoulta prężność pary rozpuszczalnika jest równa
Dla układu dwuskładnikowego mamy
![]()
i dlatego
![]()
Jeśli podstawimy to wyrażenie do równania (5), otrzymamy
Wynika, że
To pokazuje, że spadek prężności pary jest proporcjonalny do ułamka molowego nielotnej substancji rozpuszczonej.
Zwiększanie temperatury wrzenia roztworu
Roztwór zawierający nielotną substancję rozpuszczoną jest mniej lotny niż czysty rozpuszczalnik. Dlatego jego wrzenie rozpoczyna się w wyższej temperaturze niż wrzenie czystego rozpuszczalnika. Na ryc. Rysunek 6.36 pokazuje zależność prężności pary od temperatury dla czystego rozpuszczalnika i roztworu zawierającego nielotną substancję rozpuszczalną. Wzrost temperatury wrzenia jest proporcjonalny do spadku prężności pary:
Korzystając z tego wyrażenia i prawa Raoulta, możemy wyprowadzić inne wyrażenie wiążące spadek temperatury wrzenia ze składem roztworu, a mianowicie
![]()
W tym wyrażeniu oznacza to molalność substancji rozpuszczonej. Z terminem „molalność” spotkaliśmy się już w rozdz. 4.2. Oznacza liczbę moli substancji rozpuszczonej w 1 kg rozpuszczalnika.
Wartość nazywa się stałą ebulioskopową rozpuszczalnika. Nazywa się ją również stałą wzrostu temperatury wrzenia molowego lub po prostu stałą wzrostu temperatury wrzenia. W tabeli Tabela 6.5 pokazuje wartości stałej dla niektórych rozpuszczalników.

Ryż. 6.35. Diagram fazowy składu ciśnienia pary dla roztworu zawierającego nielotną substancję rozpuszczoną.

Ryż. 6.36. Zwiększanie temperatury wrzenia roztworu pod ciśnieniem atmosferycznym.
Eksperymentalne określenie wzrostu temperatury wrzenia roztworu
Aby eksperymentalnie określić wzrost temperatury wrzenia roztworu, można zastosować metodę Landsbergera. Opary rozpuszczalnika przepuszcza się przez rozpuszczalnik umieszczony w zlewce miarowej (ryc. 6.37). Uwolnienie entalpii parowania w wyniku kondensacji pary powoduje wrzenie rozpuszczalnika w zlewce. Zapobiega to przegrzaniu, które może wystąpić, jeśli temperatura cieczy wzrośnie powyżej temperatury wrzenia.
Po zmierzeniu temperatury wrzenia czystego rozpuszczalnika ostudź go i rozpuść w nim odważoną ilość substancji rozpuszczonej. Następnie pary rozpuszczalników przepuszcza się przez powstały roztwór aż do rozpoczęcia wrzenia. W tym momencie zmierz temperaturę roztworu. Ponieważ wzrost temperatury wrzenia roztworu w porównaniu z czystym rozpuszczalnikiem jest zwykle niewielki, konieczne jest zmierzenie temperatury z wystarczającą dokładnością. W tym celu stosuje się termometr Beckmana. Stężenie roztworu określa się znając masę rozpuszczonej substancji i końcową objętość roztworu, którą ustala się za pomocą zlewki miarowej.
Tabela 6.5. Ebulioskopowe, trwałe rozpuszczalniki

Ryż. 6.37. Instalacja do określania wzrostu temperatury wrzenia roztworu.
Określanie masy molowej substancji poprzez zwiększenie temperatury wrzenia jej roztworu
Metodę Landsbergera można zastosować do określenia masy molowej substancji rozpuszczonej. Procedura ustalania składa się z trzech etapów:
1) doświadczalne określenie wzrostu temperatury wrzenia;
2) wyrażenie molalności substancji rozpuszczonej poprzez nieznaną masę molową oraz wyznaczone doświadczalnie masy substancji rozpuszczonej i rozpuszczalnika, które odpowiadają stwierdzonemu wzrostowi temperatury wrzenia;
3) wyznaczanie stałej ebulioskopowej za pomocą tablic lub eksperymentalnie. W tym drugim przypadku doświadczenie należy powtórzyć stosując ten sam rozpuszczalnik, ale inną substancję rozpuszczoną o znanej masie molowej.
Niezbędne wyrażenie molalności wywodzi się z jego definicji:
![]()
gdzie jest liczbą moli substancji rozpuszczonej i masą rozpuszczalnika w gramach. Wartość reprezentuje masę substancji rozpuszczonej w kilogramach. Ponieważ
![]()
gdzie jest masa rozpuszczonej substancji w gramach, nieznana masa molowa rozpuszczonej substancji, możemy przekształcić wyrażenie (7) do postaci:
Jest to wyrażenie na molalność substancji rozpuszczonej, niezbędne w drugim etapie określania jej masy molowej.
Jeśli teraz podstawimy to wyrażenie oraz wartość AT z pierwszego etapu i wartość z trzeciego etapu doświadczenia do równania (6) otrzymamy

Korzystając z tego równania, wyrażmy teraz nieznaną masę molową w postaci doświadczalnie określonych wielkości:

Propanon ma temperaturę wrzenia propanonu rozpuszczonego w 1,00 g nielotnej substancji. Temperatura wrzenia powstałego roztworu wynosi 57,4°C. Obliczmy masę molową i względną masę cząsteczkową substancji rozpuszczonej, jeśli wiadomo, że stała ebulioskopowa propanu jest równa .
Po rozpuszczeniu 1,00 g nieznanej substancji w 10 g rozpuszczalnika temperatura wrzenia wzrosła o 1,2°C. Podstawiając tę i inne znane wielkości do równania (8), otrzymujemy
Zatem masa molowa nielotnej substancji rozpuszczonej wynosi 142,5 g/mol, a zatem jej względna masa cząsteczkowa wynosi 142,5.
Obniżenie temperatury zamarzania roztworu
W poprzednim podrozdziale wskazano, że dodanie do cieczy drugiego składnika powoduje obniżenie jej temperatury zamarzania (patrz rys. 6.33). Spadek temperatury zamarzania AT zależy od molalności substancji rozpuszczonej (w zależności od rodzaju zależności determinującej wzrost temperatury wrzenia roztworu):
gdzie jest stałą krioskopową rozpuszczalnika, zwaną inaczej stałą obniżenia temperatury krzepnięcia molowej lub po prostu stałą obniżenia temperatury krzepnięcia.
Wartości stałej krioskopowej dla niektórych rozpuszczalników podano w tabeli. 6.6.
Aby doświadczalnie wyznaczyć spadek temperatury zamarzania, należy zastosować instalację pokazaną schematycznie na rys. 6.38. We wnętrzu
Tabela 6.6. Krioskopowe rozpuszczalniki trwałe

Ryż. 6.38. Instalacja do określania obniżenia temperatury zamarzania roztworu.
Znaną masę rozpuszczalnika umieszcza się w szklanej probówce z podziałką. Rozpuszczalnik chłodzi się powoli, ciągle mieszając, aby zminimalizować przechłodzenie (patrz poprzednia sekcja). W tym przypadku temperaturę określa się co pół minuty za pomocą termometru Beckmana. Na podstawie jego odczytów tworzona jest krzywa chłodzenia, na podstawie której wyznaczana jest temperatura zamarzania. Następnie rozpuszczalnik ogrzewa się aż do stopienia i dodaje się do niego znaną masę substancji rozpuszczonej. Roztwór miesza się aż do całkowitego rozpuszczenia dodanej substancji. Następnie roztwór schładza się, rejestrując temperaturę co pół minuty i wyznacza nową temperaturę zamarzania.
Wyznaczanie względnej masy cząsteczkowej substancji poprzez obniżenie temperatury zamarzania jej roztworu
Obniżenie temperatury krzepnięcia roztworu substancji nielotnej można wykorzystać do określenia jego względnej masy cząsteczkowej.
W metodzie Rasta opartej na tej zasadzie rozpuszczalnikiem jest
kamfora, która ma dużą stałą krioskopową (patrz tabela 6.6). Inne metody wykorzystują w tym celu kwas octowy lub inne rozpuszczalniki.
Kwas octowy ma temperaturę zamarzania 16,63°C. Po dodaniu 2,5 g nieznanej substancji organicznej do 40 g tego kwasu temperatura zamarzania powstałego roztworu spadła do 15,48°C. Obliczmy względną masę cząsteczkową nieznanej substancji rozpuszczonej.
Aby rozwiązać problem, należy wyprowadzić równanie podobne do równania (8). Można tego dokonać za pomocą równań (9) i (7) w taki sam sposób, w jaki równanie (8) otrzymano powyżej za pomocą równań (6) i (7). W rezultacie znajdujemy
Wiadomo, że . Ze stołu 6,6 znajdujemy. Podstawiając te wartości do równania (10), znajdujemy
Zatem względna masa cząsteczkowa substancji organicznej wynosi 212.
Ciśnienie osmotyczne
Osmoza to spontaniczne przejście rozpuszczalnika przez półprzepuszczalną membranę z rozcieńczonego roztworu lub czystego rozpuszczalnika do stężonego roztworu. Zjawisko to można zademonstrować wykorzystując urządzenie pokazane schematycznie na rys. 6.39. Szeroki koniec rurki, zamknięty błoną zwierzęcą (na przykład pęcherzem byka), napełnia się roztworem cukru i zanurza w szklance wody. Po pewnym czasie woda przechodzi przez membranę do roztworu cukru.
Membrana, która umożliwia przejście cząstek rozpuszczalnika, ale nie pozwala na przejście cząstek substancji rozpuszczonej, nazywana jest membraną półprzepuszczalną. Półprzepuszczalna membrana umożliwia przepływ cząstek rozpuszczalnika w obu kierunkach. Ponieważ jednak po stronie membrany, gdzie stężenie roztworu jest wyższe, stężenie rozpuszczalnika, wręcz przeciwnie, jest niższe, następuje przejście rozpuszczalnika w stężony roztwór. Prowadzi to do powstania różnicy ciśnień po obu stronach membrany. Ciśnienie, które należy zastosować do stężonego roztworu, aby zapobiec przemieszczaniu się rozpuszczalnika przez membranę, nazywa się ciśnieniem osmotycznym. Oznacza się to grecką literą p.
Ciśnienie osmotyczne jest właściwością koligatywną, ponieważ zależy tylko od stężenia rozpuszczonych cząstek, a nie od ich składu chemicznego.
Ciśnienie osmotyczne odgrywa ważną rolę w procesach biologicznych. Na przykład u zwierząt niektóre typy komórek, takie jak czerwone krwinki, zawierają roztwór soli. Komórki te są ograniczone błoną plazmatyczną. W środowisku wodnym czerwone krwinki ulegają osmozie, pęcznieją i pękają. Jeśli jednak zostaną wystawione na działanie bardziej stężonego roztworu soli, komórki kurczą się.

Ryż. 6.39. Eksperyment pokazujący wpływ ciśnienia osmotycznego.
Komórki roślinne zawierają roztwory soli w specjalnych wnękach - wakuolach. Wakuola otoczona jest cienką warstwą cytoplazmy, która ma właściwości półprzepuszczalnej błony i kontroluje wchłanianie wody przez komórkę roślinną.
Jeżeli ciśnienie przyłożone do stężonego roztworu przekracza ciśnienie osmotyczne, rozpuszczalnik przemieszcza się ze stężonego roztworu przez membranę do roztworu rozcieńczonego. Proces ten nazywa się odwróconą osmozą. Znajduje zastosowanie przemysłowe w celu pozyskiwania wody pitnej z wody morskiej.
Doświadczenia podobne do opisanych powyżej z roztworem cukru pokazują, że: 1) w stałej temperaturze ciśnienie osmotyczne jest wprost proporcjonalne do różnicy stężeń w roztworach oddzielonych membraną; 2) o stałej porze
przy różnicach stężeń ciśnienie osmotyczne jest wprost proporcjonalne do temperatury bezwzględnej.
Zależność pomiędzy ciśnieniem osmotycznym a temperaturą jest podobna do równania stanu gazu doskonałego (patrz rozdział 3.1). Nazywa się to równaniem van't Hoffa:
W tym równaniu - ciśnienie osmotyczne, K - objętość roztworu, - liczba moli rozpuszczonej substancji, T - temperatura bezwzględna, - stała molowa gazu. Równanie (11) można przedstawić w innej postaci:
gdzie c jest stężeniem roztworu
Równanie van't Hoffa jest przybliżone i obowiązuje tylko dla roztworów rozcieńczonych.
Oznaczanie względnej masy cząsteczkowej substancji rozpuszczonej na podstawie ciśnienia osmotycznego roztworu
Równanie van't Hoffa można zastosować do określenia względnej masy cząsteczkowej substancji rozpuszczonej na podstawie wytwarzanego przez nią ciśnienia osmotycznego, które określa się eksperymentalnie. Metoda ta jest szczególnie przydatna do określania średniej względnej masy cząsteczkowej polimerów i innych substancji wielkocząsteczkowych.
Roztwór cukru o stężeniu 2,5 g/dm3 wytwarza w temperaturze 25°C ciśnienie osmotyczne atm. Obliczmy względną masę cząsteczkową substancji rozpuszczonej.
Pożądaną wartość względnej masy cząsteczkowej substancji rozpuszczonej można znaleźć bezpośrednio za pomocą równania Van't Hoffa (11). Wstępne dane zadania są następujące:

Podstawiając te wartości do równania Van't Hoffa, znajdujemy
Nieprawidłowe wartości względnej masy cząsteczkowej
Wykazano powyżej, że do określenia względnej masy cząsteczkowej można wykorzystać trzy różne właściwości koligatywne roztworów, a mianowicie: 1) wzrost temperatury wrzenia; 2) obniżenie temperatury zamarzania; 3) ciśnienie osmotyczne.
Nieprawidłowe wartości względnej masy cząsteczkowej mogą wystąpić, gdy substancja rozpuszczona łączy się lub dysocjuje w roztworze. Na przykład kwasy karboksylowe mogą łączyć się w rozpuszczalnikach organicznych, tworząc dimery (patrz rysunek 6.26). Dzieje się tak na skutek tworzenia się wiązań wodorowych. Elektrolity, takie jak chlorek sodu, dysocjują w roztworach wodnych:
Dlatego właściwości koligatywne roztworów elektrolitów zależą tylko od stężenia, a nie od charakteru chemicznego jonów substancji rozpuszczonej obecnych w roztworze. W roztworze chlorku sodu na każdy mol substancji rozpuszczonej przypadają dwa mole jonów. Z tego powodu względna masa cząsteczkowa stwierdzona poprzez zwiększenie temperatury wrzenia roztworu okazuje się być w przybliżeniu o połowę mniejsza niż obliczona ze wzoru chemicznego.
Porównując względne wartości masy cząsteczkowej ustalone eksperymentalnie na podstawie właściwości koligatywnych z wartościami obliczonymi na podstawie wzorów chemicznych substancji rozpuszczonych, można określić stopień asocjacji lub dysocjacji substancji rozpuszczonej.
Kriokonserwacja dużych obiektów biologicznych
Najbardziej intrygującym obszarem zastosowań kriobiologii – nauki o wpływie niskich i ultraniskich temperatur na obiekty biologiczne – jest poszukiwanie możliwości utrzymania żywych organizmów lub poszczególnych narządów w stanie głębokiego zamrożenia. Technika kriokonserwacji pojedynczych komórek czy np. zarodków jest dobrze rozwinięta, jednak odwracalne (tj. zachowanie żywotności po rozmrożeniu) zamrażanie dużych obiektów napotyka poważne przeszkody. Główną trudnością jest to, że przy dużej objętości i masie trudno jest uzyskać równomierne chłodzenie. Nierównomierne zamrażanie prowadzi do poważnych i nieodwracalnych uszkodzeń komórek i tkanek. Tymczasem rozwiązanie tego problemu mogłoby pomóc np. w stworzeniu banku narządów do przeszczepów i tym samym uratować życie tysięcy pacjentów. Jeszcze bardziej kusząca jest możliwość utrzymania ciężko chorego pacjenta w stanie głębokiego wychłodzenia do czasu, aż medycyna będzie w stanie mu pomóc, być może za kilka dekad.
Największym niebezpieczeństwem podczas zamrażania jest mechaniczne uszkodzenie błon komórkowych przez powstające kryształki lodu. Tworząc się zarówno na zewnątrz, jak i, co jest znacznie bardziej niebezpieczne, wewnątrz komórek, rozrywają lipidową warstwę dwumolekularną, która tworzy te błony.
Aby chronić komórki przed uszkodzeniem podczas zamrażania, stosuje się specjalne substancje - krioprotektory. Dzieli się je na dwie grupy: przenikające do komórek, czyli wewnątrzkomórkowe (sulfotlenek dimetylu (DMSO), acetamid, glikol propylenowy, glicerol, glikol etylenowy) i niepenetrujące czyli zewnątrzkomórkowe (glikole polietylenowe i tlenki polietylenu, Ficoll, sacharoza, trehaloza, itp.), które działają zewnętrznie, osmotycznie wysysając wodę z komórki.
To drugie jest korzystne: im mniej wody pozostanie w ogniwie, tym mniej lodu utworzy się później. Jednak usunięcie wody prowadzi do wzrostu stężenia soli pozostających wewnątrz komórki - aż do wartości, przy których następuje denaturacja białka. Wewnątrzkomórkowe krioprotektory nie tylko obniżają temperaturę zamarzania, ale także rozcieńczają „solankę” powstałą podczas krystalizacji, zapobiegając denaturacji białek.

Najszerzej stosowane są gliceryna i DMSO. Po dodaniu do wody jej temperatura zamarzania spada, osiągając najniższą wartość w stosunku około 2:1. Ta najniższa temperatura nazywa się eutektyczny, Lub kriohydrat. Przy dalszym chłodzeniu takich mieszanin rozmiary powstałych kryształków lodu okazują się na tyle małe (porównywalne z rozmiarem komórki krystalicznej), że nie powodują znaczących uszkodzeń struktur komórkowych.
Gdyby możliwe było doprowadzenie stężenia krioprotektanta w żywych tkankach do poziomu eutektyki, rozwiązałoby to całkowicie problem uszkodzeń tkanek przez kryształki lodu. Jednak przy takich stężeniach wszelkie znane krioprotektory okazują się toksyczne.
W praktyce stosuje się stężenia krioprotektantów znacznie niższe od stężeń eutektyki, a jednocześnie część wody nadal zamarza. Zatem przy zastosowaniu 27% roztworu gliceryny 40% wody obecnej w ogniwie tworzy mieszaninę eutektyczną z gliceryną, a reszta zamarza. Jak wykazały jednak eksperymenty przeprowadzone w latach 1954–1960. Angielska kriobiolog Audrey Smith, złote chomiki są w stanie przetrwać w sytuacji, gdy nawet 50-60% wody zawartej w tkankach ich mózgu zamieniło się w lód!
Szybkość chłodzenia ma ogromne znaczenie dla rozwiązania problemu odwracalnego zamrażania. Podczas powolnego chłodzenia (w parach ciekłego azotu lub w zamrażarkach o specjalnym programie) kryształki lodu tworzą się głównie w przestrzeni międzykomórkowej. Gdy ostygną, rosną, czerpiąc wodę z komórek. Jak już wspomniano, może to znacznie zmniejszyć szkody wyrządzane komórkom przez kryształy - ale stężenie soli wewnątrz komórek znacznie wzrasta, zwiększając ryzyko denaturacji białek.
Niestety, optymalne tempo obniżania temperatury, będące kompromisem pomiędzy szkodliwym działaniem kryształków lodu a wysokim stężeniem substancji rozpuszczonych, znacznie się różni w zależności od typu komórek. Różnią się także optymalne dla nich stężenia krioprotektantów. To znacznie komplikuje kriokonserwację narządów i tkanek zawierających kilka różnych typów komórek, a jeszcze bardziej całych organizmów.
Podczas szybkiego chłodzenia (na przykład zanurzenia próbki w ciekłym azocie) woda nie ma czasu na dyfundację z komórek; kryształy tworzą się zarówno na zewnątrz, jak i wewnątrz komórek, ale ze względu na szybsze chłodzenie okazują się znacznie mniejsze niż w pierwszym przypadku i nie mają czasu na uformowanie się we wszystkich komórkach. Można w tym przypadku uniknąć toksycznych stężeń soli, a czas ich narażenia jest krótszy, podobnie jak czas trwania szkodliwego działania krioprotektorów. Ta ostatnia pozwala na stosowanie wyższych stężeń.
 Przy wystarczająco szybkim ochłodzeniu do 0°C i nieco niżej, woda nie zamarza (krystalizuje) od razu. Najpierw tworzy się przechłodzona ciecz. W eksperymentach, o których wspomniała Smith, w niektórych przypadkach udało jej się schłodzić złote chomiki do -6 ° C bez tworzenia się kryształków lodu. Jednocześnie skóra i kończyny zwierząt pozostały miękkie. A po rozgrzewce chomiki ożyły bez widocznych szkodliwych skutków. Ciężarne samice (jeśli w pierwszej połowie ciąży wystąpiła hipotermia) rodziły normalne młode.
Przy wystarczająco szybkim ochłodzeniu do 0°C i nieco niżej, woda nie zamarza (krystalizuje) od razu. Najpierw tworzy się przechłodzona ciecz. W eksperymentach, o których wspomniała Smith, w niektórych przypadkach udało jej się schłodzić złote chomiki do -6 ° C bez tworzenia się kryształków lodu. Jednocześnie skóra i kończyny zwierząt pozostały miękkie. A po rozgrzewce chomiki ożyły bez widocznych szkodliwych skutków. Ciężarne samice (jeśli w pierwszej połowie ciąży wystąpiła hipotermia) rodziły normalne młode.
Istnieje technika wykonywania operacji chirurgicznych na nowonarodzonych małych ssakach - na przykład myszach. Znieczulenie w tym wieku praktycznie nie ma zastosowania, dlatego młode są po prostu schładzane przez 15–20 minut, aż stracą ruchliwość i wrażliwość. Znany jest przypadek, gdy podczas takich badań (wpływ usunięcia narządu lemieszowo-nosowego na zachowanie gryzoni) w laboratorium jednego z moskiewskich instytutów kilka nowonarodzonych młodych chomików dżungarskich z powodu zaniedbania eksperymentatora zostało po prostu zapomniany leżąc na bawełnianej pościeli w komorze o temperaturze –12°C. Po ekstrakcji – po 2-3 godzinach – były zupełnie twarde, a ich korpusy dosłownie „pukały drewnem”. Po pewnym czasie w temperaturze pokojowej młode ożyły, zaczęły się poruszać i wydawać dźwięki...
Płyny w organizmie zwykle zaczynają zamarzać w temperaturze –1... –3°C. Jednakże, gdy część wody zamienia się w lód, stężenie substancji rozpuszczonych w pozostałej cieczy wzrasta, a temperatura zamarzania tej cieczy w dalszym ciągu spada.
Temperatura całkowitego zamarzania różnych płynów biologicznych jest bardzo zróżnicowana, ale w każdym przypadku okazuje się, że jest niższa niż –22...–24°C.
Prawdopodobieństwo powstania „jądra” kryształka lodu w jednostce czasu w przechłodzonej cieczy jest proporcjonalne do objętości tej cieczy i silnie zależy od temperatury: przy –40°C i przy ciśnieniu 1 atm. krystalizacja czystej wody następuje niemal natychmiast, jednak w jeszcze niższych temperaturach (ok. -70°C tempo wzrostu kryształów spowalnia ze względu na wzrost lepkości wody. Wreszcie w temperaturze ok. -130°C kryształy wzrost całkowicie zatrzymuje się. Jeśli ciecz schłodzi się wystarczająco szybko, aby „przekroczyć” temperaturę aktywnej krystalizacji, zanim kryształy niebezpiecznej wielkości zdążą uformować się, lepkość wzrasta tak bardzo, że tworzy się stała szklista substancja. Zjawisko to nazywa się przejście szkliste Lub witryfikacja.
Jeśli uda się schłodzić komórki lub tkanki do temperatury zeszklenia, to mogą one pozostawać w tym stanie przez czas nieokreślony, a powstałe w ten sposób uszkodzenia będą nieporównywalnie mniejsze niż podczas chłodzenia z krystalizacją. Właściwie byłoby to rozwiązaniem problemu konserwacji obiektów biologicznych w stanie głębokiego zamrożenia. To prawda, że gdy komórki się rozmrożą, aby je ożywić, będą musiały ponownie przejść przez niebezpieczny zakres temperatur...
Tempo wzrostu kryształków lodu w komórce można zmniejszyć dodając do wody zanieczyszczenia zwiększające jej lepkość - glicerynę, cukry itp. Oprócz tego istnieją substancje, które blokują tworzenie się kryształków lodu. Mają na przykład takie właściwości. specjalne białka wytwarzane przez organizmy wielu odpornych na zimno zwierząt - ryby arktyczne i antarktyczne, niektóre owady itp. Cząsteczki tych substancji mają obszary komplementarne z powierzchnią kryształu lodu - „siedzą” na tej powierzchni, zatrzymują jego dalszy rozwój.
Podczas chłodzenia dużych (w porównaniu do ogniwa - 1 mm lub więcej) obiektów zwykle powstają w nich znaczne gradienty temperatury. Najpierw zamarzają zewnętrzne warstwy i tworzy się tzw. front krystalizacji, przemieszczający się od zewnątrz do wewnątrz. Stężenie soli i innych substancji rozpuszczonych w wodzie przed tym frontem gwałtownie wzrasta. Prowadzi to do denaturacji białek i uszkodzeń innych makrocząsteczek komórkowych. Kolejnym problemem jest pękanie tkanin. Jego przyczyną jest nierównomierne i niejednorodne chłodzenie, zwłaszcza w sytuacji, gdy warstwy zewnętrzne twardnieją przed warstwami wewnętrznymi.
Jeszcze w latach 60. XX wiek Zaproponowano pomysł wykorzystania wysokiego ciśnienia do kontrolowania krystalizacji wody. Idea ta opiera się na spadku temperatury przejścia fazowego woda/lód wraz ze wzrostem ciśnienia. O godzinie 20:45 Temperatura krystalizacji czystej wody wynosi –22°C. Większego obniżenia temperatury zamarzania w ten sposób nie da się osiągnąć – wraz z dalszym wzrostem ciśnienia zaczyna ona ponownie rosnąć.
Już w 1967 roku amerykański lekarz M.D. Persidsky i jego koledzy eksperymentowali z zamrażaniem nerek psów. Badacze perfundowali nerki 15% roztworem sulfotlenku dimetylu (perfuzja to wprowadzenie substancji do obiektu biologicznego poprzez układ naczyń krwionośnych), a następnie schładzali je, jednocześnie zwiększając ciśnienie, tak aby w dowolnym momencie temperatura nie przekraczała poniżej punktu zamarzania odpowiadającego danemu ciśnieniu. Po osiągnięciu minimalnej wartości temperatury (w tym przypadku ze względu na obecność krioprotektanta wynosiła ona około –25°C) ciśnienie obniżono.
 Przy szybkim spadku ciśnienia ciecz przechłodzona do takiej temperatury może istnieć nie dłużej niż kilka sekund, po czym następuje spontaniczna krystalizacja. Ale kryształy utworzone w tym przypadku są równomiernie rozmieszczone w całej objętości próbki i nie występuje front krystalizacji, a także nierównomierny wzrost stężenia soli. Ponadto kryształy powstające w tym przypadku są małe i mają ziarnisty kształt, dzięki czemu powodują stosunkowo niewielkie uszkodzenia komórek.
Przy szybkim spadku ciśnienia ciecz przechłodzona do takiej temperatury może istnieć nie dłużej niż kilka sekund, po czym następuje spontaniczna krystalizacja. Ale kryształy utworzone w tym przypadku są równomiernie rozmieszczone w całej objętości próbki i nie występuje front krystalizacji, a także nierównomierny wzrost stężenia soli. Ponadto kryształy powstające w tym przypadku są małe i mają ziarnisty kształt, dzięki czemu powodują stosunkowo niewielkie uszkodzenia komórek.
Jednak podczas procesu krystalizacji wydziela się znaczna ilość ciepła (utajonego ciepła krystalizacji), w wyniku czego próbka zostaje nagrzana – ostatecznie do temperatury krystalizacji, tj. gdy ciśnienie spada do atmosferycznego - do około 0°C. Po czym proces zamrażania w sposób naturalny zatrzymuje się. W rezultacie po usunięciu ciśnienia tylko około 28% wody miało czas na krystalizację, a reszta pozostała płynna.
Aby cała woda wykrystalizowała, konieczne byłoby schłodzenie próbki do temperatury około -80°C przed zmniejszeniem ciśnienia – jednak w tym przypadku lód zacząłby tworzyć się znacznie wcześniej. M. Persidski rozwiązał problem poprzez cykliczne wywieranie nacisku. Próbkę, która po pierwszym zwolnieniu ciśnienia ogrzała się do temperatury 0°C, zaczęto ponownie chłodzić – jednocześnie z powtarzającym się wzrostem ciśnienia. Przy następnym „resetowaniu” następna porcja płynu miała czas zamarznąć i tak dalej. Dzięki temu udało się osiągnąć niemal całkowitą i „nieszkodliwą” krystalizację wody, po której można było bezpiecznie obniżyć temperaturę do
–130°C (i poniżej) przy normalnym ciśnieniu atmosferycznym i utrzymywać nerkę w tym stanie przez nieokreślony czas.
Podczas rozmrażania cykl powtarzano w odwrotnej kolejności: nerkę podgrzewano do –28°C, po czym ciśnienie zwiększono do 2000 atm. W tym przypadku nastąpiło stosunkowo równomierne topnienie kryształków lodu. Następnie próbkę stopniowo ogrzewano, jednocześnie zmniejszając ciśnienie.
Zakonserwowane w ten sposób nerki, zdaniem autorów eksperymentu, „wykazywały mniej oznak uszkodzenia tkanek niż nerki zamrożone jakąkolwiek inną metodą” – choć nie zachowały żywotności…
Następnie do przygotowania próbek biologicznych do badań mikroskopowych wykorzystano technikę zamrażania wysokociśnieniowego. Aby wykonać wystarczająco cienki przekrój, próbkę należy najpierw przekształcić w stan stały, jednak przy konwencjonalnym zamrażaniu struktury komórkowe są tak zniszczone, że praktycznie nie ma co badać...
Ciśnienie kilku tysięcy atmosfer z powodzeniem wykorzystuje się do zamrażania produktów w przemyśle spożywczym. W tym przypadku realizowane są dwa cele. Po pierwsze, po długotrwałym (a więc w możliwie najniższej temperaturze) przechowywaniu, smak mrożonego produktu powinien jak najmniej różnić się od świeżego. Do tego ważne jest również, aby komórki nie uległy zniszczeniu podczas zamrażania, co w pewnym stopniu można osiągnąć zamrażając pod ciśnieniem około 2 tys. atm. Kolejnym celem jest jednoczesna sterylizacja produktu, którą wręcz przeciwnie osiąga się poprzez zniszczenie obecnych w nim komórek bakterii. Do tego wymagane jest znacznie wyższe ciśnienie - 6 tys. atm. i więcej.
Autorom nie są znane nowe próby wykorzystania wysokiego ciśnienia do odwracalnego utrwalania narządów lub całych organizmów, a mimo to droga ta wydaje się bardzo obiecująca. Oczywiście pojawia się pytanie o szkodliwy wpływ wysokiego ciśnienia. Wiadomo, że wraz ze stopniowym wzrostem do około 500 atm. żywotność komórek nie jest zmniejszona. O 6000 atm. i więcej, prawie wszystkie komórki umierają, ale wartości pośrednie mogą mieć różne skutki, w zależności od rodzaju i stanu komórek, zawartości wody, soli i innych substancji w nich zawartych, temperatury itp.
Można się jednak spodziewać stopniowego wzrostu ciśnienia do wymaganych 2 tys. atm. nie spowoduje uszkodzeń ciała. Rzeczywiście, przygotowując się do zamrożenia, obiekt najpierw schładza się do temperatury około 0°C (jeśli jest to żywa istota, przestaje oddychać) i umieszcza w komorze wypełnionej cieczą. W 1961 roku amerykański badacz S. Jacob poddał go działaniu ciśnienia około 1000 atm przez 30 minut. serce psa, właśnie wyjęte z ciała i nadal kurczące się. Po ustąpieniu ciśnienia serce ponownie biło.
Ważne jest również to, że niektóre substancje krioprotekcyjne pełnią także funkcję baroprotektorów, czyli chronią komórki przed działaniem wysokiego ciśnienia. „Dobry” krioprotektor nie tylko obniża temperaturę zamarzania roztworu, ale także stabilizuje błony komórkowe, czyniąc je bardziej elastycznymi.
Oczywiście konieczne jest rozwiązanie szeregu problemów: podczas eksperymentów, ustalenie optymalnego trybu chłodzenia, wybranie konkretnych krioprotektorów itp. Na przykład podczas przechodzenia przez cykle „sprężanie z chłodzeniem - zwolnienie ciśnienia” następuje chłodzenie tylko z powierzchni obiektu. Prowadzi to do tego, że lód utworzy się na obrzeżach, podczas gdy w centrum, wręcz przeciwnie, istniejący lód może stopić się z powodu zwiększonego ciśnienia. Można temu zaradzić, wolniej obniżając temperaturę (i pozwalając obiektowi na bardziej równomierne ochłodzenie) lub zwiększając stężenie substancji krioprotekcyjnych w warstwach zewnętrznych. W takim przypadku nie jest konieczne zwiększanie ciśnienia do wartości maksymalnych. Zwiększając liczbę cykli, można utrzymać się w znanych bezpiecznych granicach 500–1000 atmosfer.
Ponadto, jak wykazały eksperymenty Smitha ze złotymi chomikami, witryfikacja jedynie około 40% wody (i krystalizacja reszty) może wystarczyć do odwracalnej kriokonserwacji.
Zatem dostępne dane w pełni pozwalają mieć nadzieję na zastosowanie wysokich ciśnień do kontroli krystalizacji wolnej wody i kriokonserwacji dużych obiektów biologicznych, narządów, a nawet całych organizmów. Prace w tym kierunku prowadzone są w Instytucie Biofizyki Komórki Rosyjskiej Akademii Nauk (Laboratorium Kriokonserwacji Zasobów Genetycznych pod kierownictwem E.N. Gakhowej) wraz z Instytutem Technologii Biomedycznych i Państwowym Instytutem Badawczym VT im. . SA Wekszyński.
Wykres (patrz rysunek 3) pokazuje również, że temperatura wrzenia roztworu jest wyższa niż temperatura wrzenia czystego rozpuszczalnika. Temperatura wrzenia to temperatura, w której ciśnienie pary nasyconej jest równe ciśnieniu zewnętrznemu. Dlatego jest inaczej: dla czystej wody jest to temperatura T1, a dla roztworu T2 .
W przypadku rozcieńczonych roztworów, wraz ze spadkiem temperatury (patrz rysunek 3), czysty rozpuszczalnik zaczyna krystalizować jako pierwszy. Dzieje się tak, gdy prężność pary nad roztworem staje się równa pary nasyconej nad kryształem (linia O–B). Temperatura, w której rozpoczyna się krystalizacja dla roztworu kompozycji C 1 odpowiada temperaturze T 3, a dla kompozycji C 2 – T 4 . Wraz ze wzrostem stężenia rozpuszczonej substancji temperatura krzepnięcia maleje, co jest również wyraźnie widoczne na wykresie P–T (patrz rysunek 3) .
Im bardziej stężony roztwór, tym dalej krzywe prężności pary nad roztworami znajdują się od odpowiedniej krzywej wody. Dlatego im wyższe stężenie roztworu, tym większa różnica między temperaturą wrzenia lub zamarzania wody i roztworu.
Badając zamrażanie i wrzenie roztworów, Raoult odkrył, że w przypadku rozcieńczonych roztworów nieelektrolitów wzrost temperatury wrzenia i spadek temperatury krzepnięcia są proporcjonalne do stężenia roztworu.
Drugie prawo Raoulta:wzrost temperatury wrzenia (niższej temperatury zamarzania) roztworu w porównaniu z temperaturą wrzenia (zamarzania) rozpuszczalnika jest proporcjonalny do stężenia molowego substancji rozpuszczonej.
Matematycznie te zmiany temperatury można obliczyć za pomocą wzorów:
;
;
Gdzie KE – ebulioskopowa (od łac. ebullire - gotować) stała rozpuszczalnika; Do Republiki Kirgiskiej– stała krioskopowa (z gr. сrios – zimny) rozpuszczalnika; – wzrost temperatury wrzenia; – obniżenie temperatury zamarzania; Z m– stężenie molowe substancji rozpuszczonej.
Jeśli malujesz Z m, wówczas formuły przyjmą postać:
Znaczenie fizyczne Stałe ebulioskopowe i krioskopowe wyznacza się w następujący sposób. Pokazują ich wartości liczbowe , O ile stopni wyżej zamarza roztwór jednomolowy (zawierający 1 mol substancji rozpuszczonej w 1000 g rozpuszczalnika) i o ile stopni poniżej zamarza w porównaniu z temperaturami wrzenia i zamarzania czystego rozpuszczalnika. Jednostką miary jest 1 stopień mol -1 kg.
Stałe ebulioskopowe i krioskopowe nie zależą od rodzaju substancji rozpuszczonej, ale są charakterystyką rozpuszczalnika. Ich wartości dla niektórych rozpuszczalników podano w tabeli 1.
Tabela 1 – Stałe krioskopowe i ebulioskopowe niektórych rozpuszczalników
Metody ebulioskopowe i krioskopowe oznaczania mas cząsteczkowych substancji opierają się na pomiarach temperatur wrzenia i zamarzania roztworów. Te dwie metody są szeroko stosowane w chemii, ponieważ przy użyciu różnych rozpuszczalników można określić masy cząsteczkowe różnych substancji.
Aby określić masę molową substancji rozpuszczonej, wygodnie jest skorzystać z następującej zależności:
Gdzie – wzrost temperatury wrzenia lub spadek temperatury zamarzania roztworu w porównaniu z odpowiednimi właściwościami czystego rozpuszczalnika;
K – stała ebulioskopowa lub krioskopowa.
Zdolność roztworów do zamarzania w temperaturze niższej niż rozpuszczalnik wykorzystuje się do przygotowania roztworów niskozamarzających, tzw. płyn przeciw zamarzaniu. Płyn niezamarzający służy do zastępowania wody w chłodnicach silników samochodowych i lotniczych zimą. Można zastosować tak zwane główne komponenty. alkohole wielowodorotlenowe – glikol etylenowy i gliceryna:
CH 2 - CH 2 CH 2 - CH 2 - CH 2
HE HE HE HE HE
gliceryna glikolu etylenowego
Na przykład wodny roztwór glikolu etylenowego (58 procent wagowych) zamarza dopiero w temperaturze minus 50°C.
Osmoza
Samoistne przejście rozpuszczalnika przez półprzepuszczalną membranę oddzielającą roztwór od rozpuszczalnika lub dwóch roztworów o różnym stężeniu substancji rozpuszczonej nazywa się przez osmozę . Osmoza powstaje w wyniku dyfuzji cząsteczek rozpuszczalnika przez półprzepuszczalną przegrodę, przez którą przedostają się tylko cząsteczki rozpuszczalnika. Cząsteczki rozpuszczalnika dyfundują z rozpuszczalnika do roztworu lub z mniej stężonego roztworu do bardziej stężonego, w związku z czym stężony roztwór ulega rozcieńczeniu, a wysokość jego kolumny h również wzrasta (rysunek 4).
W stanie równowagi ciśnienie zewnętrzne równoważy ciśnienie osmotyczne. W tym przypadku szybkości przejść cząsteczek do przodu i do tyłu przez półprzepuszczalną przegrodę stają się takie same. Jeżeli ciśnienie zewnętrzne przyłożone do bardziej stężonego roztworu jest wyższe od osmotycznego p, tj. p > p, to szybkość przejścia cząsteczek rozpuszczalnika ze stężonego roztworu będzie większa, a rozpuszczalnik przejdzie do roztworu rozcieńczonego (lub czystego) rozpuszczalnik). Proces ten, tzw odwrócona osmoza , stosowany do oczyszczania wód naturalnych i ściekowych, w celu uzyskania wody pitnej z wody morskiej.
Ilościowo osmoza charakteryzuje się ciśnieniem osmotycznym równym sile na jednostkę powierzchni, która wymusza przenikanie cząsteczek rozpuszczalnika przez półprzepuszczalną przegrodę. Ciśnienie osmotyczne wzrasta wraz ze wzrostem stężenia i temperatury substancji rozpuszczonej. van't Hoff to zasugerował dla ciśnienia osmotycznego można zastosować równanie stanu gazu doskonałego:
Gdzie P– ciśnienie osmotyczne, kPa; Z- stężenie molowe roztworu, mol/l; R– uniwersalna stała gazowa, T- temperatura absolutna.
Osmoza odgrywa bardzo ważną rolę w procesach biologicznych, zapewniając przepływ wody do komórek i innych struktur. Roztwory o tym samym ciśnieniu osmotycznym nazywane są izotonicznymi. Jeżeli ciśnienie osmotyczne jest wyższe od ciśnienia wewnątrzkomórkowego, wówczas nazywa się je hipertonicznym, jeżeli jest niższe od ciśnienia wewnątrzkomórkowego, nazywa się je hipotonicznym. Na przykład średnie ciśnienie osmotyczne krwi w temperaturze 36°C wynosi 780 kPa. Hipertoniczne roztwory cukru (syrop) i soli (solanka) są szeroko stosowane do utrwalania żywności, ponieważ powodują usuwanie wody z mikroorganizmów.
Przykłady rozwiązywania problemów
Przed rozwiązaniem problemów powinieneś zrozumieć, co następuje:
– temperatura zamarzania roztworu jest niższa niż temperatura zamarzania rozpuszczalnika
– temperatura wrzenia roztworu jest wyższa niż temperatura wrzenia rozpuszczalnika
- wartość zawsze dodatnia, a temperatura zmienia się w skali Celsjusza i termodynamiczną skalę Kelvina numerycznie pokrywają się, tj. i .
Przykład 1. Oznaczanie temperatury wrzenia i temperatury krzepnięcia nieelektrolitu.
Określ temperaturę wrzenia i temperaturę krzepnięcia 2% roztworu naftalenu (C 10 H 8) w benzenie.
Rozwiązanie
Bazując na drugim prawie Raoulta możemy napisać:
Wartość stałej ebulioskopowej benzenu, a także temperaturę wrzenia i krzepnięcia benzenu przyjmujemy z tabeli 1. M (C 10 H 8) = 128 g/mol. Pamiętajmy, że stężenie procentowe oznacza liczbę gramów substancji rozpuszczonej w 100 g roztworu, co oznacza, że masa naftalenu wynosi 2 g, a masa rozpuszczalnika, czyli benzenu, wynosi 100 – 2 = 98 g. Wtedy , zastępując znane wartości do równania, otrzymujemy
Ponieważ czysty benzen wrze w temperaturze 80,1°C, a wzrost temperatury wynosi 0,4°C, temperatura wrzenia roztworu naftalenu w benzenie wynosi 80,5°C.
Temperaturę zamarzania tego roztworu określa się w ten sam sposób:
Temperatura zamarzania benzenu wynosi 5,5°C. Spadek temperatury wynosi 0,8 stopnia, zatem temperatura zamarzania 2% roztworu naftalenu w benzenie wynosi 4,7°C.
Przykład 2. Oznaczanie stężenia nieelektrolitów na podstawie temperatury krystalizacji (wrzenia) roztworów.
Określ udział masowy sacharozy C 12 H 2 20 11 w wodzie, jeśli wiadomo, że temperatura zamarzania tego roztworu wynosi minus 0,21 °C.
Rozwiązanie.
Z danych problemowych wynika, że grad Aby określić udział masowy sacharozy w roztworze, używamy równania
do którego podstawiamy znane wartości: K KR - stała krioskopowa, K KR = 1,86 deg mol -1 kg, i masa molowa sacharozy M(C 12 H 2 20 11) = 342 g/mol. Postawa
oznacza wówczas masę substancji rozpuszczonej na 1000 g rozpuszczalnika
Na 1000 g rozpuszczalnika przypada 38,6 g sacharozy, dlatego do określenia udziału masowego rozpuszczonej substancji można skorzystać ze wzoru
lub zrób proporcję:
1038,6 g roztworu zawiera 38,6 g sacharozy;
100 g roztworu – xg sacharozy.
Dlatego udział masowy substancji rozpuszczonej wynosi 3,71%.
Przykład 4. Wyznaczanie masy molowej nieelektrolitu na podstawie temperatury krystalizacji (wrzenia).
Roztwór nieelektrolitowy zawiera 2,5 g substancji rozpuszczonej w 25 g benzenu i zamarza w temperaturze 4,3°C. Określ masę molową substancji rozpuszczonej.
Rozwiązanie
Wykorzystując te warunki problemowe i temperaturę zamarzania benzenu plus 5,5°C, wyznaczamy grad Masę molową substancji rozpuszczonej można wyznaczyć z zależności
gdzie K KR jest stałą krioskopową benzenu, K KR = 5,12 deg mol -1 kg.
g/mol.
Pytania kontrolne
1 Jakie ciśnienie nazywa się ciśnieniem pary nasyconej?
2 Zapisz wyrażenia matematyczne dla każdego z praw Raoulta i wyjaśnij fizyczne znaczenie wielkości zawartych w tych wyrażeniach.
3 Równe ilości mocznika CO(NH 2) 2 i sacharozy C 12 H 22 O 11 rozpuszczono w tej samej ilości wody w tych samych warunkach. Dla którego rozwiązania wartość będzie większa?
4 Czy spadek temperatury krzepnięcia 0,1 M wodnych roztworów glukozy C 6 H 12 O 6 i mocznika CO (NH 2) 2 jest taki sam?
Zadanie 1. O ile stopni wzrośnie temperatura wrzenia wodnego roztworu mocznika CO(NH 2) 2, jeśli 8,5 g substancji rozpuści się w 300 g wody?
Zadanie 2. Oblicz udział masowy metanolu CH 3 OH w roztworze wodnym o temperaturze zamarzania minus 2,79°C.
Zadanie 3. Wyznacz temperaturę wrzenia roztworu 1 g naftalenu C 10 H 8 w 20 g eteru, jeśli temperatura wrzenia eteru wynosi 35,6 °C, K E = 2,16 °C.
Zadanie 4. Roztwór 1,05 g nieelektrolitu w 30 g wody zamarza w temperaturze
– 0,7°C. Oblicz masę cząsteczkową nieelektrolitu.
Zadanie 5. Oblicz ilość glikolu etylenowego C 2 H 4 (OH) 2, którą należy dodać na każdy kilogram wody, aby przygotować środek przeciw zamarzaniu o temperaturze zamarzania minus 15 ° C.
Zadanie 7. Aby przygotować środek przeciw zamarzaniu, pobrano 9 litrów gliceryny C 3 H 5 (OH) 3 na 30 litrów wody. Jaka jest temperatura zamarzania przygotowanego środka przeciw zamarzaniu? Gęstość gliceryny wynosi 1261 kg/m3.
Systemy rozproszone
Substancje chemiczne można znaleźć w czystej postaci lub w mieszaninach. Mieszaniny z kolei można podzielić na homo- i heterogeniczne. Do jednorodnych mieszanin jednofazowych zalicza się roztwory prawdziwe (patrz rozdział 1), w których rozpuszczona substancja występuje w postaci cząsteczek lub jonów, których rozmiary są porównywalne z cząsteczkami rozpuszczalnika i nie przekraczają 1 nm. Mieszanki jednorodne są trwałe termodynamicznie.
Wraz ze wzrostem wielkości cząstek układ staje się niejednorodny, składający się z dwóch lub więcej faz z wysoce rozwiniętą granicą międzyfazową. I, jak pokazuje praktyka, kolejny obszar fragmentacji materii tworzy nowy zestaw właściwości właściwych tylko tej formie organizacji materii.
Nawet M.V. Łomonosow odkrył w 1764 r., że roztwory zamarzają w niższej temperaturze niż czyste rozpuszczalniki. Obniżenie temperatury zamarzania roztworu wiąże się ze spadkiem elastyczności (ciśnienia) par rozpuszczalnika nad roztworem (zmiana stężenia soku komórkowego w roślinach w kierunku zimy).
Punkt zamarzania roztwór to temperatura, w której kryształy rozpuszczalnika znajdują się w równowadze z roztworem o danym składzie.
Różnica Δt = t 0 ° - ti ° nazywa się spadkiem temperatury zamrożenie roztworu i będzie tym większe, im wyższe będzie stężenie roztworu. Zależność tę wyraża się ilościowo równaniem:
Δt = K·m (36)
gdzie Δt jest spadkiem temperatury zamarzania roztworu;
Cm – stężenie molowe;
K jest współczynnikiem proporcjonalności, tzw stała krioskopowa rozpuszczalnika lub molowego obniżenia temperatury zamarzania roztworu.
Metodę badawczą polegającą na pomiarze spadku temperatury zamarzania roztworów nazywa się metodą krioskopową.
Roztwory zamarzają w niższych temperaturach i wrzą w wyższych temperaturach niż czyste rozpuszczalniki.
W przypadku roztworów nieelektrolitów, zgodnie z prawem Raoulta, spadek temperatury zamarzania roztworu jest wprost proporcjonalny do stężenia molowego (równanie 36).
Wzrost temperatury wrzenia roztworu jest również wprost proporcjonalny do stężenia molowego:
Δt kip =EC m (37)
E - stała ebulioskopowa.
Ciśnienie osmotyczne roztworów oblicza się za pomocą wzoru Van't Hoffa:
Р osm =RTC m (38)
R - uniwersalna stała gazowa 8,314 kJ/mol st
T - temperatura, 0 K, C m - stężenie molowe.
Pytania kontrolne
1. Jaka jest istota prawa dystrybucji?
2. Wyprowadzenie prawa dystrybucji.
3. Stosowanie prawa dystrybucyjnego.
4. Na jakim warunku równowagi fazowej opiera się wyprowadzenie prawa rozkładu?
5. Jakie czynniki wpływają na wartość współczynnika podziału?
6. Która ekstrakcja jest bardziej efektywna: pojedyncza czy frakcyjna?
Zadania
| Numer pracy | mg H2O | m g SUCHAROZA | Numer pracy | mg H2O | m g SUCHAROZA |
| 60 | .2 | ||||
| 55 | |||||
W JAKIEJ TEMPERATURZE BĘDĄ GOTOWAĆ ROZTWORY ZAWIERAJĄCE m g WODY m g CUKRU. ZBUDUJ WYKRES ZALEŻNOŚCI TEMPERATURY WRZENIA od zawartości substancji rozpuszczonej w roztworze
| Numer pracy | mg H2O | m g SUCHAROZA | Numer pracy | mg H2O | m g SUCHAROZA |
| 60 | |||||
| 55 | |||||
| Numer pracy | mg H2O | mg GLUKOZY | Numer pracy | mg H2O | mg GLUKOZY |
| 4,57 | 10,01 | ||||
| 12,57 | |||||
| 5,56 | |||||
| 14,40 | |||||
| 8,32 | 11,54 |
OKREŚLIĆ TEMPERATURĘ ZAMRAŻANIA ROZTWORU W mg H 2 O KTÓRY ZAWIERA mg GLUKOZY ZBUDUJ WYKRES ZALEŻNOŚCI TEMPERATURY ZAMRAŻANIA od zawartości substancji rozpuszczonej w roztworze