Адсорбция кезінде термодинамикалық функциялардың өзгеруі. Адсорбциялық процестердің термодинамикасы. Адсорбциялық процестерді аппараттық жобалау
Адсорбция(латын тілінен ad – on, at және sorbeo – сіңіремін), шекара маңындағы зат концентрациясының өзгеруі (әдетте – жоғарылау) («бетіндегі сіңіру»). Себеп адсорбция- бетке жақын молекулааралық байланыстардың қанықпауы, т.б. адсорбцияның болуы күш өрісі. Мұндай өріс тудыратын денені адсорбент, молекулалары адсорбцияланатын затты адсорбат, ал қазірдің өзінде адсорбцияланған затты адсорбат деп атайды. Процесс кері адсорбциядесорбция деп аталады.
Адсорбция өрісінің табиғаты әртүрлі. Егер адсорбция ван-дер-Ваальс байланыстарымен байланысты болса, онда адсорбцияфизикалық деп аталады. Егер бұл валенттік байланыстар болса, яғни. адсорбциябетінің түзілуімен өтеді химиялық қосылыстар, Бұл адсорбцияхимиялық деп аталады хемосорбция. Маңызды мүмкіндіктер хемосорбциякөрсетеді: қайтымсыз, жоғары термиялық әсерлер (жүздеген кДж/моль), белсендірілген сипат. Көптеген аралық түрлері бар адсорбцияфизикалық және химиялық арасында адсорбция. Мысалы, адсорбциясутектік байланыстардың түзілуіне байланысты. Сондай-ақ мүмкін әртүрлі түрлеріфизикалық адсорбция. Дисперсиялық молекулааралық тартылыс күштерінің пайда болуы көбінесе кез келген химиялық табиғаттағы (спецификалық емес) адсорбенттер үшін шамамен тұрақты болуына байланысты. адсорбция). Физикалық адсорбцияэлектростатикалық күштердің әсерінен болуы мүмкін (иондар, дипольдер немесе төртполюстер арасындағы өзара әрекеттесу); Сонымен бірге адсорбцияадсорбцияның молекулаларының химиялық табиғатымен анықталады (спецификалық деп аталатын). адсорбция). Интерфейстің геометриясы да маңызды рөл атқарады. егер беті тегіс болса, онда ол адсорбцияашық беті, аздап немесе қатты қисық беті болған жағдайда - шамамен адсорбцияадсорбенттің кеуектерінде.
Теорияда адсорбцияСтатиканы (адсорбент-адсорбат жүйесі термодинамикалық тепе-теңдікте) және кинетиканы (тепе-теңдік жоқ) ажыратыңыз.
Адсорбциялық статика
Адсорбцияның термодинамикасы
.Термодинамика негіздері адсорбция 70-жылдары Дж.Гиббс жасаған. 19 ғасыр Гиббстің пікірінше, интерфейске жақын тепе-теңдік екі фазалы жүйеде барлық экстенсивті қасиеттердің (көлемнен басқа) жергілікті мәндерінде біршама өзгерістер болады. Дегенмен, фазалар оларды бөлетін кейбір геометриялық бетке дейін біртекті болып саналады. Демек, жалпы жүйе үшін кез келген экстенсивті қасиеттің мәні біртекті фазалардағы осы қасиет мәндерінің қосындысына тең емес және . Айырмашылық бөлу бетімен байланысты екі өлшемді беттік фазаға жатады. Өйткені онда беттік фазаның қалыңдығы болмайды V0=+ және =-, мұнда V-көлемі.
Ұсынылған көріністер негізгі термодинамикалық теңдеуді келесі түрге келтіруге мүмкіндік береді:
мұндағы G – Гиббстің бос энергиясы, S – энтропия, фазааралық керілу, s – интерфейс аймағы, n мен- сәйкес химиялық потенциал және моль саны мен-сол компонент. Индекс беттік фазадағы сәйкес қасиеттің мәнін көрсетеді. Леджендре түрлендіру изотермиялық жағдайлар үшін (1) теңдеуді өзгертуге мүмкіндік береді:
Бұл шама Гиббс деп аталады адсорбцияжәне G белгісімен белгіленеді (моль/см 2). Екі компонентті жүйе үшін:
Бөлу бетінің орнын ерікті түрде таңдауға болады. Атап айтқанда, бұл ережені таңдау Г 1 =0 шартын қанағаттандыруы мүмкін. Мұндай бет эквимолекулалық деп аталады. Ол үшін Г 2 = Г 2 (1) белгісі енгізілген. Бұл Гиббс адсорбциясының негізгі теңдеуін білдіреді:
Егер адсорбент екі фазаның бірінде толық ерімейтін болса, =const, ал (2) теңдеуден (3) теңдеуге көшу Г 1 =0 шартын қажет етпейді. Осылайша, Гиббс адсорбцияекі фазасы бөлінетін бетке дейін қатаң біртекті болатын жүйемен салыстырғанда нақты екі фазалы жүйеде осы компоненттің артық болуы. Гиббс артық мөлшерлеріне қосымша адсорбция, оның теориясында маңызды рөл атқарады адсорбция, компоненттің толық мазмұны ретінде түсініледі менғарышта В, ол адсорбциялық күштерді көрсетеді. арқылы толық мазмұнды белгілеу Ажәне құрамдас деп есептей отырып менкөлемді фазалардың бірінде толығымен ерімейтін, бізде:
қайда в мен-концентрация мен- көлемдік фазадағы ші компонент. Кішкентай с мен:
Адсорбциякез келген екі фазаның кез келген шекарасында, атап айтқанда сұйықтық-сұйықтық (сұйық-газ, сұйық-сұйық) немесе қатты-сұйықтық (қатты-газ, қатты-сұйық) интерфейсінде болуы мүмкін. Сұйықтық-сұйықтық жүйелерінде α-ны функция ретінде өлшеуге болады және (3) теңдеу арқылы Г 2 (1) эксперименталды түрде анықталуы мүмкін. Екінші жағдайда, анықтау үшін G 2 (1) кез келген n әдісімен өлшенеді мен 0 , , және осы көлемдердегі i-ші компоненттің концентрациясы. Осы жерден G есептеледі мен(1) . Бұл әдіс көлемдік (немесе көлемдік) деп аталады. Салмақтық (гравиметриялық) әдіспен мөлшер тікелей анықталады мен-интерфейстегі компонент.
Адсорбция изотермасы
.Тепе-теңдік адсорбция жүйесінде тепе-теңдікті анықтайтын параметрлер болып табылады а иішінара қысымдар Р(немесе бірге мен) және температура Т. Олар жылулық теңдеу деп аталады:
Сағат адсорбцияжеке адсорбент ( мен=1) бұл теңдеу келесі түрде болады:
Үш ерекше жағдай жылу теңдеуі(Қашан Т, рнемесе а- тұрақтылар) теорияда ерекше рөл атқарады адсорбция:
a=- изотерма теңдеуі адсорбция,
T=- изобар теңдеуі адсорбция,
R-- изостриялық теңдеу адсорбция.
Функциялардың нақты түрі және қарастырылатын жүйенің ерекшеліктерімен анықталады. Олардың біреуі, мысалы, кез келген құндылығымен белгілі болса T= const болса, қалған екеуі де белгілі болатыны анық. Бұл жағдайда тәуелділіктердің аналитикалық формасы белгілі болуы міндетті емес. Оларды мәндер жиынтығы ретінде эмпирикалық түрде беруге болады a, rЖәне Т.
Теорияда адсорбцияәдетте сұрақ функцияның пішіні туралы болады А=(p)r, яғни. изотерма теңдеуі туралы адсорбция. Бұл мәселе ілеспе термиялық әсерлерге байланысты адсорбция. Көшу жағдайында негізгі термодинамикалық функциялардың мәндерінің өзгеруін есептеу кезінде д.нтепе-теңдік жүйесінде көлемдік фазадан беттік фазаға адсорбцияның мольдері p = const, екі жағдай мүмкін: бірінші жағдайда адсорбаттың адсорбатқа айналуы ғана ескеріледі, өйткені адсорбент адсорбциятермодинамикалық өзгеріссіз және оның рөлі адсорбциялық өрістің көзі ретінде қызмет етеді; екіншісінде адсорбенттің өзгеруі де есепке алынады.
Жүйе тепе-теңдікте болғандықтан, адсорбат пен адсорбаттың химиялық потенциалдары бірдей; кезінде молекулалардың қозғалғыштығының төмендеуіне байланысты адсорбаттық энтропия адсорбцияадсорбцияның энтропиясынан аз. Сондықтан инертті адсорбентпен энтальпия әрқашан теріс болады, яғни. адсорбцияэкзотермиялық. Адсорбент энтропиясының өзгеруін ескере отырып, бұл тұжырымды өзгертуге болады. Мысалы, полимер ісінетін заттардың полимерлерімен сорбциясы кезінде соңғысының энтропиясы (макромолекулалардың қозғалғыштығының артуына байланысты) соншалықты күшті артады. адсорбцияэндотермиялық болады. Келесіде тек экзотермиялық адсорбция.
Интегралдық, дифференциалдық, изотериялық және орташа жылуды ажырату адсорбция. интегралдық жылу Qэнтальпияның жоғалуына тең (ат V= const – тұрақты ішкі энергия) өзгергенде адсорбциябастап а 1бұрын а 2(белгілі бір жағдайда ол 1 \u003d 0 болуы мүмкін): Q \u003d - (H 2 - H 1). Бұл шама әдетте адсорбенттің массасына жатады және Дж/кг түрінде көрсетіледі.
Дифференциалды жылу q(Дж/моль) энтальпияның жоғалуына тең dHөзгерген кезде Ақосулы да. Ол көзқараспен көрінеді q = - (dH/d). Ол анық
Изостериялық жылу q ст мынаған тең қабылданады:
мұндағы адсорбат пен адсорбаттың молярлық көлемдерінің айырмашылығы. Мұны көрсетуге болады  идеалды газ адсорбенті үшін:
идеалды газ адсорбенті үшін:
Кіріспенің мағынасы qsiөйткені оны анықтау үшін калориметриялық мәліметтер қажет емес (мысалы QЖәне q) және оны өлшеу нәтижелерінен (9) теңдеу арқылы есептеуге болады адсорбция. Біз сондай-ақ орташа жылуды енгіземіз Q(Дж/моль):
Өсуімен Апараметр Qүнемі өсу, а qтөмендеуі, жоғарылауы немесе өзгеріссіз қалуы мүмкін. Өсуімен Абіркелкі емес бетімен адсорбцияазырақ белсенді аймақтарда кездеседі, бұл азаюына әкеледі q. Бірақ бұл жағдайда адсорбцияланған молекулалар арасындағы орташа қашықтық азаяды, нәтижесінде олардың арасындағы тартылыс күштері артады және qартады. Аталған екі әсердің арақатынасы тәуелділіктің барысын анықтайды q=f(a). Өте үлкен Абұл аймақта да итеруші күштер басым бола бастайды. qөскен сайын төмендейді а.
Өте аз беттік жабулар үшін изотерма теңдеуі адсорбцияГенри теңдеуінің түрі бар:
мұндағы K H – Генри коэффициенті. Шынында да, өте кішкентай үшін ААдсорбциялық қабат екі өлшемді идеал газға ұқсас, сондықтан оның күй теңдеуі: rt,мұндағы екі өлшемді қысым, заттың бір моль алып жатқан ауданы. Демек, =- екенін ескеріп, (3) теңдеуді қолданып, (12) теңдеуді аламыз. Генри теңдеуі мұны талап етеді qтұрақты болды. Үлкен толтырулар үшін бұл теңдеу сақталуын тоқтатады. Сондықтан Г.Фрейндлих (1906) изотермаларды сипаттауды ұсынды адсорбциякелесі эмпирикалық теңдеу (Фрейндлих теңдеуі):
Қайда кЖәне n- тұрақтылар. Бұл теңдеу аз болса да интерполяция формуласы ретінде жиі пайдаланылады Р(12) теңдеуіне кірмейді және өте үлкен Ртәжірибеге сәйкес келмейтін шексіз өсуге әкеледі А.
Қатаң изотерма теориясы адсорбцияИ.Лэнгмюр (1914-18) жасаған. Теория мыналарға негізделген. модель: 1) адсорбенттің беті адсорбат молекулалары адсорбцияланатын (локализацияланған) энергетикалық жағынан бірдей белсенді орталықтардың жиынтығы; 2) бір орталықта бір ғана молекула адсорбцияланады; сағ адсорбциябір ғана адсорбция түзіледі. қабат (бір қабатты); 3) адсорбциябұл орталыққа әсер етпейді адсорбциябасқа орталықтарда, яғни өзара әрекеттесуде. адсорбцияланған молекулаларды елемеуге болады.
Лангмюр үлгісі шақырылды. локализацияланған мономолекулалық адсорбциябіркелкі бетінде. изотерма теңдеуі адсорбцияосы үлгіге сәйкес болуы мүмкін. көмегімен алынған әдістері (молекулалық-кинетикалық, термодинамикалық, статистикалық-термодинамикалық). Сонымен, адсорбция тепе-теңдікті былай көрсетуге болады. схема:
Молекуласыз. Адсорбция газда + адсорбцияда. күрделі фазалық орталық (бос емес орталық)
Газдағы молекулалардың концентрациясы р, бос концентрациясына пропорционал. орталық мән ( a t - a),Қайда және t -орталықтардың жалпы саны, а-жұмысталған орталықтар саны, адсорбция концентрациясы. комплекстер-мән адсорбцияДемек, тепе-теңдік константасы: K p \u003d p (a t - A)/ адсорбцияОсы жерден біз Ленгмюр теңдеуін аламыз:
Қайда б-Т. шақырды адсорбция коэффициентіне тең K p -1.Өте төмен қысым аймағында bp " 1 және a = (a m b)p,ол Генри теңдеуіне сәйкес келеді, онда Қ Х= a m b.Өте жоғары қысым аймағында б 1 және aa t;Сонымен бірге адсорбцияқысымға тәуелді емес. Тепе-теңдік константасы b-1реакцияның изобарлық потенциалының стандартты мәнімен байланысты:
Langmuir моделі бұл айырмашылықты талап етеді. жылу және энтропия адсорбциябетінің толтыру дәрежесіне байланысты емес.
(14) теңдеу Ленгмюр моделіне сәйкес келетін қатаң өрнек, бірақ тәжірибеде ол сирек негізделеді, өйткені модельдің өзі идеалдандырылған. адсорбциядоктринасы адсорбция 20-шы жылдардан бастап 20 ғасыр білдіреді. дәрежесі бір немесе басқа Ленгмюр жорамалын әлсірету немесе жою негізінде құрылды адсорбция
Ленгмюр сипаттау тәсілін ұсынып үлгерді адсорбциябіртекті емес бетінде (яғни, барлық орталықтар бірдей емес деген болжам бойынша). Бірдей орталықтарды топтарға біріктіріп, (14) теңдеу әр топқа қолданылады деп болжауға болады адсорбциябүкіл бет бойынша (14) теңдеу мүшелерінің қосындысымен өрнектеледі:
Адсорбция саны деп есептесек орталықтар болуы мүмкін бос мәндерінің таралу үздіксіз функциясымен сипатталады. энергия, Я.Б.Зельдович көрсеткіштік функция үшін (16) формуласынан (13) типті теңдеуді алды.
адсорбциябіртекті емес беттерде - теорияның үлкен тарауы адсорбцияОның басты интегралдық теңдеуді шешу:
Қайда f(б) - деп аталады. эмпирикалық изотерма адсорбция, -орталықтардың санының еркін мәндер бойынша бөлінуінің сол немесе басқа f-циясы. энергия,( б, п)-жергілікті изотерма адсорбция, ол әдетте Ленгмюр изотермасы ретінде қабылданады адсорбция
Ленгмюрдің екінші болжамын жоққа шығаруға көптеген әрекеттер жасалды. адсорбцияБұл жолда полимолекулярлық теория адсорбция, С.Брунауэр, П.Эммет және Э.Теллер ұсынған (BET теориясы). Теория критикалық температурадан төмен температурада әрбір молекула бірінші қабатта адсорбцияланады (адсорбция жылуы) деп тұжырымдайды. q i,), екінші қабатты құрайтын молекулалар үшін орталық және т.б. Жылу деп болжануда адсорбциябіріншіден басқа барлық қабаттарда конденсация жылуына тең.Бұл модель мына теңдеуге әкеледі:
Қайда c = exp[(q 1 -)/RT]. a координатасында (18) теңдеу, p/p с S-қисығына сәйкес келеді. Координатада p/p с ,
изотерма адсорбция(18) теңдеуіне сәйкес сызықтық болуы керек. Бұл түзудің еңісі (әдетте 0,05 p/p s 0,30 диапазонында) және y осінде онымен кесілген сегмент resp мәндерін береді. а тЖәне бірге. BET теориясының кеңінен қолданылуы оның авторларының, шын мәнінде, қарастыратындығына байланысты адсорбциялокализацияланбаған, тұрақтыны анықтаңыз а тдискретті адсорбенттер санымен емес. орталықтар, бірақ ең жақын қаптамада бірінші қабаттағы адсорбат молекулаларының санымен Р= ps).Сондықтан, осы қабаттағы бір молекула алып жатқан аудан идеясын енгізе отырып, біз қабылдаймыз:
Қайда s-адсорбациялық бетінің ауданы адсорбцияӘдетте бұл үшін изотерма өлшенеді адсорбцияазот және оның молекуласы = 0,162 нм 2 үшін алыңыз. Әдетте орындалатын ұқсас есептеу сЛангмюр моделіне сәйкес дұрыс емес, өйткені бұл әдіс локализацияланбағандарға ғана қатысты екені анық адсорбция
полимолекулярлық теорияда адсорбцияүлкен үлес қосты Дж.де Бур, ол эксперименталды түрде қабаттардың орташа санының (біріншіден көп) барлық беттерге тәуелділігін химиялық тұрғыдан жақын деп көрсетті. табиғат, бастап p/p сәмбебап қисықпен (t-қисығы деп аталатын) өрнектеледі. Бұл сонымен қатар адсорбенттердің беткі аудандарын бағалауға мүмкіндік береді.
Лангмюр моделінде өзара әрекеттесуді де ескеруге талпыныс жасалды. адсорберлер арасында. молекулалар. Сонымен, Т.Хилл мен Дж.де Бур адсорбция күйінің теңдеуі деп есептей отырып. қабат Ван-дер-Ваальс теңдеуінің екі өлшемді аналогы болып табылады, біз келесіні алдық. изотерма теңдеуі адсорбция:
мұнда = a/a t, aВан-дер-Ваальс теңдеуінің b тұрақтылары адсорбцияР.Фаулер және Э.Гуггенхайм өзара әрекеттесуін ескере отырып. адсорбер молекулалардың теңдеуін шығарды:
мұндағы – молекулалардың жұптық әсерлесуімен байланысты константа.
Қосымшаға әкелетін тағы бір механизм бар адсорбцияадсорбенттер критикалық деңгейден төмен. салыстырмалы жоғары мәндерде кеуекті адсорбенттердегі температура p/p s .Бұл капиллярлық конденсация. Егер кеуекте ойыс адсорбатты мениск түзілсе, онда конденсация келесіде басталады: p/p s Кельвин теңдеуі бойынша:
адсорбаттың беттік керілуі мұндағы, V -оныңмолярлық көлем, r-менискустың қисаю радиусы адсорбцияКапиллярлық конденсация изотерманың күрт көтерілуіне әкеледі адсорбцияБұл жағдайда жиі деп аталатын (бірақ әрқашан емес) байқалады. адсорбция гистерезис, яғни. адсорбцияның сәйкессіздігі. және десорбциялайды. изотерма тармақтары. Әдетте, бұл менискустың пішіні кезінде адсорбцияжәне десорбция сәйкес келмейді.
Капиллярлық конденсация адсорбенттің кеуек өлшемін анықтау үшін қолданылады адсорбцияӘрбір мән үшін (22) теңдеуіне сәйкес p/p сменисктің қисаю радиусын есептеңіз адсорбцияОдан адсорбцияның қалыңдығын ескере отырып. қабат (мысалы, t-қисығы бойымен), қабаттан менискаға өту аймағының пішіні және өте аз r кезінде қисықтыққа тәуелділік , берілген кезде толтырылған кеуектердің сызықтық өлшемін (тиімді радиусы r ef) табыңыз p/p s .Мұндай кеуектердің көлемі өсумен анықталады адсорбцияизотерманың осы нүктесінде. Алынған мәліметтерді пайдалана отырып, олардың радиустары бойынша кеуектер көлемінің таралу қисығы салынады. Әдіс ref 1,5 нм кезінде қолданылады. Әдетте есептеу десорбция арқылы жүзеге асырылады. изотерманың тармақтары, бірақ неғұрлым қатаң заманауи. теория қисық сызықты салу үшін екі тармақтың да ескерілуін талап етеді.
Адсорбцияның потенциалдық теориясы және микрокеуектерді көлемді толтыру теориясы.Үлгі адсорбция, Лэнгмюрден түбегейлі өзгеше, 1914 жылы М.Поляки ұсынған. Бұл модельге сәйкес адсорбент бетінің жанында потенциалды адсорбция бар. күш өрісі бетінен қашықтыққа қарай азаяды. Нәтижесінде бетінен алыс жерде р-ге тең болатын адсорбцияның қысымы оған жақын жерде артады және белгілі бір қашықтықта адсорбция конденсацияланатын p s мәніне жетеді. Интерфейс пен геома арасындағы қабаттың көлемі. нүктелердің орны, онда p = p s , сұйықтықпен толтырылған, бұл физикалық қалыпты мәндерге жатады. көлемді сұйықтық қасиеттері. Қайтымды изотермиялық жұмыс және адсорбция. = RTlnp / p s теңдеуімен анықталатын күштер, деп аталады. адсорбция потенциал, ал бүкіл концепция потенциалдық теория болып табылады адсорбцияБерілген көлем үшін Вадсорбция қабат температураға тәуелді потенциал (дисперсиялық күштердің температураға тәуелсіздігіне байланысты). Бұл температура инварианты қайта есептеуге мүмкіндік береді адсорбцияизотерма теңдеулері болса да, бір т-рден екіншісіне адсорбцияайтылған теория негізінде қорытынды шығару мүмкін болмады. Поляни моделін көптеген адамдар кеңінен және сәтті қолданды. авторлар, алайда, ол өте осал екі ережені қамтыды: 1) ең жақсы адсорбция деген болжам. фильм қалыпты физикалық мәндерге ие. сусымалы сұйықтықтың қасиеттері (бұл болжам тәжірибелермен расталмады); 2) функцияның температуралық инварианттылығы =f(V),Теорияның негізі тек өте ұсақ кеуекті адсорбенттер үшін тәжірибе арқылы шамамен расталды.
Потенциалдық теорияны пайдалана отырып, М.М. Дубинин микро кеуектерді көлемді толтыру теориясын (ТОЗМ) ұсынды және дамытты. Бұл теория тек микрокеуекті адсорбенттерге қатысты деп тұжырымдалған. Кеуектерінің сызықтық өлшемдері r1 нм болатын мұндай адсорбенттердің ерекшелігі олардың кеуектерінің барлық көлемі адсорбенттермен «толтырылған» болып табылады. өріс. Сондықтан, қашан адсорбцияолар қабаттармен толтырылмайды, бірақ көлемдік түрде. Қарастырылып отырған жағдайдағы мән адсорбция емес. потенциал және химиялық белгіге дейін. химиялық деңгейден өлшенетін адсорбаттық потенциал. бірдей температурадағы қалыпты сұйықтықтың потенциалы. Адсорбент кеуектерінің барлық жиынтығы үш класқа бөлінеді: микрокеуектер ( r 0,6 нм), мезокеуектер (0,6 нм-20 нм) және макрокеуектер ( r 20 нм). адсорбциямикрокеуектерде TOZM схемасы бойынша жүреді, яғни. көлемдік, мезопораларда – қабат-қабат толтыру механизмі бойынша, капиллярлық конденсациямен аяқталады. Адсорбция кезіндегі макрокеуектер. тепе-теңдік ешқандай рөл атқармайды.
Химиялық заттардың мәндері бойынша кеуектер көлемін f-tsii бөлу тұжырымдамасын енгізу. олардағы адсорбаттық потенциал, М.М. Дубинин мен Л.В.Радушкевич TOZM адсорбция изотермасының теңдеуін алды, ол әдетте төмендегідей жазылады. пішін:

Қайда н, Ежәне 0 -параметрлері ( a 0 = aсағ p = ps). Температураға тәуелділік а 0:
мұнда = -(да 0 /дТ); 0 0 = а 0 T \u003d T 0 кезінде. Опциялар ПЖәне Етемпературадан іс жүзінде тәуелсіз. Көп жағдайда П= 2. Тек бастапқы қыздыру жағдайлары үшін адсорбцияөте үлкен n > 2.Изотермаларды қайта есептеу адсорбциябір адсорбциядан екінші адсорбцияға, бұл шамамен болжанады E 1 /E 2 P 1 /P=және бұл a 01 /a 02 V 1 /V 2, мұндағы P мен- парашор, Vi-адсорбенттің молярлық көлемі адсорбция
Әрбір микрокеуекті адсорбент TOZM бойынша екі параметрмен сипатталады: W-микрокеуек көлемі ( W 0 = = a 0 V 0) және E 0 -сипаттамасы. энергия; W0және E 0 стандартты адсорбентке, әдетте бензолға жатады.
Нағыз адсорбентте әртүрлі көлемдегі кеуектер бар деген түсінікті қолдану және мәндердің таралуымен таныстыру. Е сФ.Стеклиге тең дисперсия Дубинин-Стөкли теңдеуі деп аталатын (23) теңдеудің жалпылауын ұсынды:

Қайда B0-байланысты тұрақты Е(23) теңдеуінде және у= ![]() . Өйткені адсорбцияда наиб техникасы. микрокеуекті адсорбенттер (белсенді көміртектер, цеолиттер, ұсақ кеуекті ксерогельдер) кең тарады, ТОЗМ тек физикалық және химиялық емес қолданылады. зерттеу, сонымен қатар инженерлік есептеулерде.
. Өйткені адсорбцияда наиб техникасы. микрокеуекті адсорбенттер (белсенді көміртектер, цеолиттер, ұсақ кеуекті ксерогельдер) кең тарады, ТОЗМ тек физикалық және химиялық емес қолданылады. зерттеу, сонымен қатар инженерлік есептеулерде.
Газ және сұйық қоспалардың адсорбциясы. Іс жүзінде олар әрқашан жеке адсорбентпен емес, газдар немесе сұйық ерітінділер қоспасымен айналысады. Сондықтан теорияны жалпылау қажет адсорбциякөпкомпонентті адсорбция жағдайында адсорбцияНегізінде кез келген модельден бастауға болады адсорбцияжәне оны осы жағдайға дейін кеңейтіңіз. Сағат адсорбциягаз қоспасы, бұған теңдеулердің күрделілігі ғана емес, сонымен қатар оларға толықтырулар енгізу арқылы қол жеткізіледі. эмпирикалық өзара әрекеттесумен байланысты параметрлер. гетерогенді молекулалар немесе жалпы алғанда, кейбір кірістің коэффициентке әсерімен. басқалардың әрекеттері. Тек Ленгмюр моделі изотерма теңдеуін алуға мүмкіндік береді адсорбциятеңдеулеріне қосылмаған параметрлері жоқ қоспалар адсорбцияжеке кіріс. Ол үшін қоспадан к-ші компонентті адсорбциялау кезінде болатынын ескеру жеткілікті. менадсорбцияның құрамдас бөлігі. орталықтар болуы мүмкін басқа молекулалар алады. Сондықтан:
Егер адсорбциясұйық ерітінділер, олардың концентрациясына қарамастан, адсорбенттің бүкіл беті толтырылады адсорбцияДемек адсорбция k-ші компоненттің молекулалары қалған компоненттердің молекулаларының белгілі бір санының орын ауыстыруымен бірге жүреді, яғни. адсорбциябәсекеге қабілетті.
Молекулярлық және иондықты ажырату адсорбцияшешімдер. Біріншісі қашан пайда болады адсорбциябейэлектролиттердің ерітінділері, электролиттердің екінші ерітіндісі. Молекулалық адсорбцияәдетте көрсетіледі артық мәндер. Бәсекелестік сипаты адсорбциямәнді тудырады Ам.б. оң және теріс. білдіру адсорбция мен-сол компоненттің х ерітіндісіндегі мольдік бөлігінің f-тұлғасы ретінде мен-, бізде бұл Г мен= О x кезінде мен= 0 және x мен = 1 (ықтимал өзгерісадсорбциядағы заттың көлемі. қабаты ескерілмейді). Демек, изотерма адсорбциябіреуі немесе бірнешеуі бар шектен тыс.
изотерма теңдеуі адсорбцияТермодинамикалық тұрғыдан сенімді түрде дәлелденген бейэлектролиттердің екілік ерітінділері келесідей болады:

мұндағы s индексі адсорбцияны көрсетеді. фаза, - ( dn s 2 /dn s 1) екінші компоненттің қанша моль біріншісінің бір мольімен ығыстырылғанын, химиялық заттардың терминдерінің (стандартты бөліктері) арасындағы айырмашылықты көрсетеді. температураға ғана тәуелді потенциал.
Негізгі осы және басқа да бірқатар изотерма теңдеулерін пайдалану мәселесі адсорбция-коэффиценттің тәуелділігін анықтау. адсорбциядағы компоненттердің белсенділігі. оның құрамынан қабат адсорбцияӨтініштегі ең маңызды сұрақ адсорбциязаттарды бөлу немесе тазарту үшін – осы компонент ерітіндісіне қатысты селективті адсорбентті таңдау адсорбция
Иондық адсорбция, әдетте, эквивалент емес адсорбцияПреим электролит ерітіндісінен бетіне адсорбцияланады. катиондар немесе аниондар. Электрге рахмет бетінде (кулондық) күштер пайда болады электрлік қос қабат.
Егер адсорбентте иондар немесе беттік функция болса. берілген еріткіште иондануға қабілетті топтар, содан кейін адсорбент пен электролит ерітіндісі арасында ион алмасу жүреді. Бұл жағдайда адсорбент деп аталады. ион алмастырғыш.
Адсорбция кинетикасы
адсорбция, кез келген нақты процесс сияқты, уақыт өте келе болады. Сонымен, толық теория адсорбциякинетика бөлімі болуы керек адсорбцияқарапайым әрекет адсорбциядерлік бірден жүзеге асырылады (хемосорбцияны қоспағанда). Сонымен, уақытқа тәуелділік адсорбциянегізінен анықталады диффузиялық механизм, яғни сайтқа адсорбция беру адсорбцияЕгер адсорбцияашық бетінде лезде болмайды, мұндай процесс сыртқы диффузиялық аймақта жүреді; ал диффузия заңдары арнайы емес адсорбцияКеуекті адсорбенттер жағдайында эксттен басқа. диффузия, маңызды рөл vnutr ойнай бастайды. диффузия, яғни. адсорбенттің адсорбенттің кеуектерінде концентрация градиенті болған кезде тасымалдануы. Мұндай тасымалдау механизмі адсорбат концентрациясына және кеуектер мөлшеріне байланысты болуы мүмкін.
Молекулярлық, Кнудсендік және беттік (Вольмер) диффузиясы бар. Молекулярлық диффузия ұзындығы бос болса жүзеге асады. кеуектердегі молекулалар диапазоны кеуек өлшемінен аз болса, Кнудсен ұзындығы, егер бұл ұзындық кеуек өлшемінен асып кетсе. Беттік диффузия кезінде молекулалар массалық фазаға өтпей-ақ адсорбент бетінде қозғалады. Дегенмен, коэффициент мәндері диффузия әртүрлі диффузиялық механизмдер үшін бірдей емес. Көпшілікте жағдайларда диффузияның қалай болатынын эксперименталды түрде анықтау мүмкін емес, демек, деп аталады. тиімді коэффициент. процесті тұтастай сипаттайтын диффузия.
Негізгі эксперименттік кинетика бойынша материал адсорбциядеп аталатынға қызмет етеді. кинетикалық қисық, яғни. f-tion \u003d a / a тең \u003d f(т) қай жерде салыстырмалы адсорбцияадсорбцияның ағымдағы шамасының қатынасына тең АКімге ауақыттағы мәніне тең т.Кинетиканы түсіндіру ең қарапайым жағдайда қисық, адсорбент түйірінің көлемі бойынша толығымен біркелкі кеуекті құрылымы бар деп болжанады (бұл модель квазигомогенді деп аталады). білдіреді. квазигомогенді модельді жетілдіру – әрбір дәнде үлкенірек және ұсақ кеуектері бар аймақтар бар деген түсінік. Мұндай дәндегі диффузия екі декпен сипатталады. коэффициенттер.
Ашық бет жағдайында, Ленгмюр үлгісін алып, кинетиканы алу оңай. теңдеу адсорбцияТепе-теңдікке жақындау жылдамдығы жылдамдықтардағы айырмашылық болып табылады адсорбцияжәне десорбция. Кинетикадағы әдеттегідей процестердің жылдамдығы әрекеттесуші заттардың концентрацияларына пропорционалды деп есептесек, бізде:
мұндағы k жарнама және k дек сәйкесінше жылдамдық константалары. адсорбцияжәне десорбция. Газ фазасындағы қысым тұрақты деп қабылданады. Бұл теңдеуді интегралдау кезінде т= 0 кез келген мәнге тБіз алып жатырмыз:
Демек, f үшін бізде:= тең. Сонымен, бізде ақырында:
мұндағы k = k хабарландыру + k дек.
Температураның жылдамдыққа әсері адсорбцияАррениус теңдеуіне ұқсас теңдеумен өрнектеледі адсорбцияТемператураның жоғарылауымен k жарнама экспоненциалды түрде артады. Өйткені адсорбенттің кеуектеріндегі диффузия активацияны жеңумен байланысты. кедергілер, k ads және k des температуралық тәуелділіктері бірдей емес.
Диффузия жылдамдығын білу тек теория үшін ғана маңызды емес адсорбция, сонымен қатар бітіру кешін есептеу үшін. адсорбция процестер. Бұл жағдайда олар әдетте адсорбенттің жеке түйіршіктерімен емес, олардың қабаттарымен айналысады. Қабаттағы процестің кинетикасы өте күрделі тәуелділіктермен өрнектеледі. Берілген уақытта қабаттың әрбір нүктесінде мән адсорбцияизотерма теңдеуінің түрімен ғана анықталмайды адсорбцияжәне процестің кинетикасының заңдары, сонымен қатар аэро- немесе гидродинамикалық. дәндердің айналасындағы газдың немесе сұйықтықтың ағуы үшін жағдайлар. Бір түйірдегі кинетикадан айырмашылығы адсорбент қабатындағы процестің кинетикасы деп аталады. динамикасы адсорбция, жалпы схемаесептерді шешу келесідей: дифференциалдар жүйесі құрастырылады. қабаттың, изотерманың сипаттамаларын ескере отырып, жартылай туындылардағы теңдеулер адсорбция, диффузиялық сипаттамалары (диффузия коэффициенті, қабат бойымен және түйір ішіндегі масса алмасу түрлері), аэро- және гидродинамикалық. ағынының ерекшеліктері адсорбцияБастапқы және шекаралық шарттар белгіленеді. Бұл теңдеулер жүйесін шешу негізінен шамалардың мәндеріне әкеледі адсорбцияуақыттың берілген нүктесінде қабаттың берілген нүктесінде. Әдетте, аналитикалық шешімін ең қарапайым жағдайларда ғана алуға болады, сондықтан мұндай есеп компьютердің көмегімен сандық түрде шешіледі.
Динамиканың эксперименталды зерттеуінде адсорбцияадсорбент қабаты арқылы белгіленген сипаттамалары бар газ немесе сұйықтық ағыны өтеді және уақыт функциясы ретінде шығатын ағынның құрамы зерттеледі. Қабаттың артындағы сіңірілген заттың пайда болуы деп аталады. серпіліс, ал серпіліс уақыты - қорғаныс әрекетінің уақыты. Бұл компонент концентрациясының қабаттың артындағы уақытқа тәуелділігі. шығыс қисығы. Бұл қисықтар негізгі болып қызмет етеді эксперименттік динамиканың заңдылықтарын бағалауға мүмкіндік беретін материал адсорбция
Адсорбциялық процестерді аппараттық жобалау
Көптеген технологиялар бар. адсорбциялау әдістері. процестер. Кең таралған циклдік. (периодтық) бекітілген адсорбент қабаты бар қондырғылар, осн. түйіні бір немесе бірнеше. түйіршікті адсорбентпен толтырылған қуыс колонналар түрінде жасалған адсорберлер. Адсорбцияланған компоненттері бар газ (немесе сұйық) ағыны адсорбент қабаты арқылы серпіліске дейін өтеді. адсорбцияОсыдан кейін адсорбердегі адсорбент регенерацияланады, ал газ ағыны басқа адсорберге жіберіледі. Адсорбент регенерациясы бірқатар кезеңдерді қамтиды, оның ішінде негізгісі десорбция, яғни. адсорбенттен бұрын сіңірілген заттардың босатылуы адсорбцияДесорбция қыздыру, газ фазасының қысымын төмендету, ығыстыру (мысалы, тірі бу) немесе осы әдістерді біріктіру арқылы жүзеге асырылады. Өйткені уақыт адсорбцияжәне регенерация сәйкес келмесе, бүкіл процесс үздіксіз жүретіндей бір уақытта жұмыс істейтін және регенерацияланатын адсорберлердің санын таңдаңыз.
Техникаға сәйкес. және экономикалық регенерация аяқталмайды деп есептейді адсорбцияДемек, адсорбенттің жұмыс қабілеттілігі берілген жағдайларда максималды қол жеткізуге болатын айырмашылыққа тең адсорбцияжәне регенерациядан кейін адсорбентте қалған адсорбат мөлшері. Нәтижесінде изотермалар адсорбцияадсорбердегі процеске сәйкес тым тік болмауы керек.
Сипатталған схемада екі нұсқа мүмкін: 1) мақсатты өнім газ ағынынан толығымен дерлік адсорбцияланады, содан кейін ол десорбатта болады, ол жерден бір жолмен немесе басқа жолмен алынады; 2) мақсатты өнім газ қоспасының басқа компоненттеріне қарағанда нашар адсорбцияланады, содан кейін ол шығатын газ ағынында болады. Бірінші нұсқаға сәйкес, мысалы, вискоза зауыттарындағы рекуперациялық қондырғылар пайдаланылған газдардан ұстап, CS 2 цикліне қайтарады. Мұндай қондырғылардың өнімділігі сағатына жүздеген мың м 3 тазартылған газға жетеді; тым жұқа емес микрокеуектері бар адсорбент белсендірілген көмір, т. көмір, онда тұрақты ЕТОЗМ бойынша (жоғарыдан қараңыз) 20-25 кДж/моль құрайды. Бұл мән Е 0 тым тік емес изотермаға сәйкес келеді, ол жақсы регенерация жағдайларын қамтамасыз етеді. Мұндай көмірлер деп аталады қалпына келтіру. Десорбция тірі бумен жүргізіледі. Энергияны үнемдеу үшін суық және ыстық газ ағындары жылу алмастырғыштар арқылы өтеді.
Мысалы, газдар мен сұйықтықтарды кептіру өте маңызды мұнай газдарыөңдеу алдында немесе табиғи. тасымалдау алдындағы газдар; силикагельді адсорбенттер немесе цеолиттер. Десорбция қыздыру арқылы жүзеге асады. Цеолиттің десорбциясы жоғары энергия шығындарымен байланысты болғандықтан, аралас адсорбент қолданылады: негізгі. ылғалдың массасы оңай қалпына келетін силикагельмен, ал терең кептіруден кейін цеолитпен сіңеді.
Термиялық регенерация кезінде толық цикл кіреді адсорбция, адсорбентті қыздыру, оны десорбциялау және салқындату. Үлкен санкезеңдері процестің төмен қарқындылығын және жоғары энергия сыйымдылығын анықтайды адсорбцияСондықтан, деп аталатын. қысқа циклді қондырғылар, бүкіл цикл бірнеше уақытты алады. минут. Оларда газ адсорберге орташа мәнмен беріледі. қысым пайда болады, содан кейін ол босатылады және десорбция пайда болады. Бүкіл процесс дерлік изотермиялық (изотермиялықтан ауытқу тек жылудың бөлінуінен туындайды адсорбцияжәне десорбция кезінде жылуды сіңіру). Цикл кезеңдері: адсорбция, қысымның төмендеуі, десорбция, қысымның көтерілуі. Мысал ретінде оттегімен байытылған ауаны өндіру үшін цеолиті бар зауытты келтіруге болады.
Адсорбенттің қозғалмалы қабаты бар қондырғыларда (гиперсорберлер деп аталатындар) соңғысы ауырлық күшінің әсерінен баяу төмендейді, түбінен жойылады. адсорбер бөліктері және деп аталатын кіреді. адсорбцияға параллель тік құбыр болып табылатын аэролифт. баған. Бұл құбыр арқылы төменнен жоғарыға қарай ауа ағыны қозғалады, ол адсорбент түйірлерін жоғарыға көтереді. бағанның бөлігі. Өңделген газ ағыны адсорбердің ортаңғы бөлігіне түседі және адсорбентке қарсы ағынмен жоғары жылжиды. Бағананың жоғарғы жағында үздіксіз бар адсорбция, төменгі жағында - адсорбенттің регенерациясы (сонымен қатар қараңыз адсорбциялық тазалау).
Сұйықталған («қайнайтын») адсорбент қабаты бар қондырғыларда адсорберге төменнен түсетін газ ағыны адсорбентті суспензияға әкеледі. Бұл адсорбент пен газ арасындағы масса алмасудың тиімділігін күрт арттырады және ұзақтығын қысқартады адсорбцияжәне десорбция. Мұндай қондырғылардың өнімділігі жоғары. Олардың кең таралуына жүнге қойылатын жоғары талаптар кедергі келтіреді. адсорбент түйірлерінің беріктігі (беріктіктің жеткіліксіздігі оның абразиясы мен аппараттан тартылуы салдарынан адсорбенттің айтарлықтай жоғалуына әкеледі).
Негізгі адсорбенттерге қойылатын талаптар: үлкен адсорбент. сыйымдылық, яғни. олар үлкен соққымен шашыраңқы денелер болуы керек. беті немесе үлкен кеуек көлемімен; хим. бетінің табиғаты тиімді қамтамасыз етуі керек адсорбцияосы шарттардағы деректер; хим. және термиялық. төзімділік, қалпына келтірушілік, қолжетімділік. макс. белсенді көміртектер, кейбір оксидтердің ксерогельдері (силикагельдер, алюминий тотығы гельдері және т.б.), цеолиттер кең тарады; кеуекті емес адсорбенттер-технологиясынан. көміртек (күйе) және жоғары дисперсті SiO 2 (аэрозил, «ақ күйе»).
Адсорбциялық технологияны қолдану салалары
Феномен туралы адсорбциянегізін қалаған ауаны зиянды қоспалардан тазарту жолдары (қараңыз. газды тазалау),су (қараңыз Суды тазарту),сондай-ақ қант жасауға арналған қант сироптары, жеміс шырындары және тағамдағы басқа сұйықтықтар. пром-сти, майлау майларының қалдықтары. Қатты адсорбенттер көмегімен газдар мен сұйықтықтардан ылғалды зиянды қоспа ретінде жою адсорбцияның маңызды салаларының бірі болып табылады. әдістері (сонымен қатар қараңыз газды кептіру).
Адсорбция бойынша. процестер заттар қоспаларын жұқа бөлуге және күрделі қоспалардан белгілі бір компоненттерді оқшаулауға негізделген. Мысал ретінде БАЗ алу үшін қалыпты көмірсутектерді алу үшін алкандардың изомерлерін бөлу, мотор отындарын өндіруде майларды бөлу жатады. Үшін газ қоспаларыадсорбция оттегімен байытылған ауаны алу үшін бөлу әдістері қолданылады (таза дерлік O 2 дейін); көпте жағдайларда бұл әдістер дистилляциямен сәтті бәсекелеседі (қараңыз. ауаны бөлу).
Адсорбенттерді қолданудың қарқынды дамып келе жатқан саласы. технология-медицина, онда ол алу үшін қызмет етеді зиянды заттарқаннан (гемосорбция әдісі) және т.б. физиол. сұйықтықтар. Стерилділікке қойылатын жоғары талаптар қолайлы адсорбенттерді таңдаудың өте қиын міндетін қояды. Оларға арнайы дайындалған белсендірілген көмірлер жатады.
Лит.:Брунауэр С., Газдар мен булардың адсорбциясы, транс. ағылшын тілінен, 1-том, М., 1948; де Бур Я, Адсорбцияның динамикалық табиғаты, транс. ағылшын тілінен, М., 1962; Адсорбция және кеуектілік, ред. М.М.Дубинина [және т.б.], М., 1976; Келиев Н.В., Адсорбциялық технология негіздері, 2-бас., М., 1984; Жас Д.М., Кроуэлл А.Д., Газдардың физикалық адсорбциясы, Л., 1962 ж. М.М.Дубинин, В.В. Серпинский.
Мақала тақырыбындағы бірінші әріпті таңдаңыз:
Адсорбция фазалар шекарасында жүреді. Сондықтан беттік құбылыстардың термодинамикалық сипаттамасын ретінде қарастыру орынды жеке оқиғагетерогенді жүйелердің термодинамикасы.
Күріш. 3.4. Гиббс адсорбциясы: 1- екі фазалы анықтамалық жүйе, 2- біртекті емес аймағы бар нақты екі фазалы жүйе
Гетерогенді жүйелердің термодинамикасы қолданылады аддитивтік принцип, ол келесідей: гетерогенді жүйенің барлық экстенсивті қасиеттері фазалар байланысқанға дейін болатын сәйкес экстенсивті қасиеттердің қосындысына тең.Фазаларды α және β арқылы белгілейік (4-сурет). Олай болса, интерфейс маңындағы фазалардың қасиеттері олардың көлемдік қасиеттерімен сәйкес келетін идеалды жүйе үшін, ішкі энергия үшін U, көлемі V, массасы (моль саны) n, гетерогенді жүйеде тепе-теңдік орнатылғаннан кейінгі S энтропия, қатынастар жарамды:
U = U α + U β , V = V α + V β , n = n α + n β , S = S α + S β
Бұл екі фазадағы температура мен қысымның бірдей болуын болжайды.
Нақты гетерогенді жүйелер үшін екі фазаның интерфейсіндегі өтпелі аймақ жүйенің экстенсивті қасиеттеріне қосымша үлес қосады. Егер беттік құбылыстар орын алса, онда нақты гетерогенді жүйенің экстенсивті қасиеттері мен беттік құбылыстар жоқ модельдік жүйенің экстенсивті қасиеттері арасындағы айырмашылықты ескеру керек. Мұндай жүйе салыстыру жүйесі деп аталады. Салыстыру жүйесі нақты жүйемен бірдей қарқынды параметрлерге (T, P, C i …) және V көлеміне ие (4-сурет).
Термодинамикалық тұрғыдан алғанда, адсорбциялық шамасы G деп фаза бетінің ауданына қатысты нақты гетерогенді жүйенің эталондық жүйемен салыстырғанда мольмен немесе грамммен көрсетілген n s затының артық мөлшері түсініледі. бөлу немесе адсорбент бетінің ауданына A. Салыстыру жүйесі нақты жүйе сияқты бірдей қарқынды параметрлерге (T, P, C i) және бірдей көлемге (V = V α + V β) ие деп есептеледі. (Cурет 4).
G \u003d (n - n α - n β) / A \u003d n s / A 3.11
Нақты жүйенің ауысу аймағының артық термодинамикалық функцияларын (s индексімен белгіленеді) былай жазуға болады.
U s = U - U α - U β , n s = n - n α - n β , S s = S - S α - S βжәне т.б.
Адсорбцияның тәжірибелік өлшемдері әрқашан адсорбцияны құрамдас бөліктің артық мөлшері ретінде береді. нақты жүйетаңдалған салыстыру жүйесімен салыстырғанда. Мысалы, қатты адсорбентке газды адсорбциялағанда немесе қатты фазадағы компоненттерді адсорбциялағанда адсорбция мәндерін табу үшін адсорбаттың бастапқы концентрацияларының өзгеруі α және β фазаларының жанасуынан кейін анықталады.
n i s = V(C i o - C i),
Қайда C i o– i-ші компоненттің бастапқы концентрациясы, C iіргелес фазалар арасында тепе-теңдік орнағаннан кейінгі i-ші компоненттің концентрациясы. көлемі деп болжануда Вөзгерген емес. Дегенмен, концентрация мен-ші компонент C i, тәжірибелік жолмен алынған көлемде анықталады V'өтпелі қабаттың біртекті емес аймағының көлемін есепке алмай, интерфейстің үстінде Vαконцентрация орналасқан интерфейсте C i α. Осылайша, нақты жүйеде біртекті емес аймақтың болуына байланысты жүйенің жалпы көлемін келесідей көрсетуге болады. V = V' + Vα. Толық мөлшер мен-ші компонент C i oосы екі том арасында бөлінеді:
V C i o = V' C i + V α C i α ,
және компоненттің моль саны мен, интерфейсте адсорбцияланған, тең болады
n i s = (V’C i + V α C i α) – (V’ + V α)C i = V α (C i α – C i) 3.12
Анау. эксперименттік жолмен анықталған адсорбция деп V α көлеміндегі i-ші құрамдас бөлігінің осы құрамдас бөлігінің шекарадан алыс сол көлемдегі мөлшерімен салыстырғанда артық болуын айтады. Адсорбцияның бұл түрі Гиббс адсорбциясы деп аталады. .
V α C i αшақырды толық мазмұн мен-адсорбциялық қабаттағы th компонент. Өте төмен концентрация аймағында C iкөлемде V'түзету V α C i(3.2) теңдеуін елемеу және өлшенген мәнді қарастыруға болады V α C i αтолық мазмұн мен-адсорбциялық қабаттағы th компоненті, мысалы, газды төмен қысымда қатты адсорбентке адсорбциялау кезінде.
Ағымдағы бет: 6 (кітаптың жалпы саны 19 бет) [оқуға болатын үзінді: 13 бет]
Қаріп:
100% +
34. Адсорбциялық күштердің табиғаты
Адсорбент молекулаларының адсорбент бетімен әрекеттесуі деп аталады. физикалық адсорбция әртүрлі себептерге байланысты болуы мүмкін. Сонда бір адсорбент молекуласының полярсыз адсорбцияның бір атомымен әрекеттесуін анықтайтын потенциалды келесі түрде көрсетуге болады:
θ = −Cr 6 +Бр 12 ,
мұндағы r – бөлшектердің орталықтары арасындағы қашықтық; С – дисперстік тартылыс тұрақтысы; В – итеруші күштердің энергиясын сипаттайтын тұрақты шама.
Салыстырмалы түрде алыс қашықтықта тартымды күштер, ал жақын қашықтықта итеруші күштер басым болуы керек екені анық. Сондай-ақ, белгілі бір қашықтықта бұл күштер тең болуы керек, бұл минимумға сәйкес келеді бос энергия. Бірақ адсорбция кезінде дисперсиялық күштер әр полярлы емес бөлшектер арасында бір уақытта әрекет ететінін ескеру маңызды.
Бөлшектердің өзара әрекеттесу энергиясы қашықтыққа қарай тез төмендеуі мүмкін болғандықтан, адсорбциялық күштердің потенциалын анықтау үшін ең жақын адсорбент атомдары бойынша жинақтауды орындау жеткілікті. Күрделі полярлы емес молекулалардың адсорбциясы жағдайында потенциалдық энергияны шамамен молекула бірліктерінің барлық потенциалдық адсорбциялық энергияларының қосындысы ретінде есептеуге болатыны маңызды.
Егер адсорбент иондардан тұрса, онда бұрыннан белгілі дисперсиялық күштердің әрекетін адсорбент молекулаларында электр өрісімен индукцияланатын дипольдердің тартылу индукциялық күштерінің әрекетімен толықтыруға болады, ол өз кезегінде пайда болады. адсорбент торының иондары арқылы.
Мұндай әрекеттесу кезінде адсорбциялық әрекеттесудегі индуктивті күштердің үлесі адсорбциялық молекуланың поляризацияланғыштығына және осы адсорбент бетіндегі өріс кернеулігінің квадратына пропорционал болуы мүмкін.
Егер, керісінше, полярлы адсорбент молекулалары полярлы адсорбентте адсорбцияланса, онда бұл жағдайда дипольдер адсорбент атомдарын поляризациялайды, яғни оларда электрлік моменттерді индукциялағандай болады. Осы әсерге байланысты дисперсиялық әсерге индуктивті әрекеттесу қосылады.
Индуктивті әсерлесудің өзі әдетте аз және адсорбциялық молекуланың дипольіне және адсорбенттің поляризациялануына байланысты үлкен мәндерге жетуі мүмкін. Молекулалар бетінде иондары немесе дипольдері бар адсорбентке адсорбцияланған жағдайда, деп аталады. адсорбенттің иондарының немесе дипольдерінің адсорбенттің өзінің электростатикалық өрісімен әрекеттесуі.
Бұл жағдайда адсорбциялық молекулалар тіпті адсорбент өрісінде бағдарлана алады және ориентациялық кулондық әрекеттесу пайда болады. Әдетте индуктивті және бағдарлық әрекеттесу энергиясы дисперсиялық әрекеттесу энергиясынан аз болады, сондықтан молекулааралық тартылыс энергиясы дисперсиялық тартылыс энергиясымен анықталады деп болжанады.
Сондай-ақ, сутегі байланысының түзілуі адсорбцияның себебі болуы мүмкін. Бұл түрдегі байланыс бетінде су, спирттер, аммиак және аминдер сияқты молекулалардың гидроксил топтары бар адсорбцияларда адсорбция кезінде пайда болуы мүмкін. Сутектік байланыс түзілген кезде адсорбенттің адсорбентпен әрекеттесу энергиясы айтарлықтай үлкен болуы мүмкін, ал мұндай адсорбция кезінде бөлінетін жылу молекулаларының пішіні мен өлшемдері бойынша ұқсас заттардың адсорбция жылуынан әлдеқайда көп, бірақ сутектік байланыс түзбейді.
«Адсорбент – адсорбент» шекарасындағы беткі қабаттың термодинамикалық сипаттамасын, оның құрылымын, әртүрлі күштердің табиғатын, процестің динамикасын біле отырып, күрделірек зерттеуге көшуге болатынын атап өту маңызды. адсорбциялық процестер.
35. Адсорбция фаза аралық керілуді төмендететін заттардың фазалық шекарасындағы өздігінен концентрация ретінде.
Беттік белсенді заттар екі үлкен топқа бөлінеді: белсенді және белсенді емесзаттар.
Беттік-белсенді заттар беткі қабатта жинақтауға қабілетті және бұл жағдайда оң адсорбция пайда болады. Г > 0.
Мұндай заттардың түрлері беттік керілуге ие болуы керек, ол өз кезегінде еріткіштің беттік керілуінен аз болуы керек, әйтпесе заттың беткі қабатта жиналуы қолайсыз болады және салыстырмалы түрде төмен ерігіштікке ие болуы керек. Жеткілікті жақсы ерігіштігімен беттік-белсенді заттың молекулалары бетті ерітіндіге терең қалдыруға бейім. Сондықтан беттік белсенді заттар сұйықтықтың негізгі бөлігінен бетіне шығарылады.
Бірақ бір-бірімен әлсіз әрекеттесетін бұл заттардың молекулаларында ерітінді шекарасында заттардың жиналуымен беткі қабаттағы молекулааралық әсерлесу төмендейді, беттік керілу төмендейді.
Беттік белсенді заттарсу қабатына қатысты органикалық қосылыстардың көптеген түрлері, жеткілікті үлкен көмірсутекті радикалы бар май қышқылдары, осы қышқылдардың тұздары (сабындар), сульфон қышқылдары және олардың тұздары, сонымен қатар әртүрлі түрлеріспирттер мен аминдер. тән ерекшелігімолекулалардың көпшілігі олардың дифильділігі болып табылады: молекула полярлы топтың екі бөлігінен және полярлы емес көмірсутек радикалынан тұрады. Елеулі дипольдік моментке ие және жақсы ылғалдандыратын полярлы топ су ортасына беттік белсенді заттың жақындығын анықтай алады. Бірақ көмірсутек радикалы бұл қосылыстардың ерігіштігін төмендететін себеп болып табылады.
Беттік белсенді емес беттік белсенді заттар- сұйықтықтың бетін оның көлеміне қалдыруға бейім заттардың бұл түрлері, нәтижесінде деп аталады. теріс адсорбция Г < 0. Поверностно-инактивные вещества также обладают значительным поверхностным натяжением, значительно большим, чем натяжение у растворителя (иначе эти вещества способны самопроизвольно накапливаться в поверхностном слое), также обладают высокой растворимостью, что способствует их стремлению уйти с поверхности жидкости в объем. Взаимодействие между молекулами поверхностно-инактивного вещества и растворителя всегда больше, чем взаимодействие между самими молекулами растворителя, поэтому они и стремятся перейти в объем раствора. Беттік белсенді емес заттарсуға қатысты көптеген бейорганикалық электролиттер: қышқылдар, сілтілер, тұздар. Беттік белсенді емес заттардың молекулаларының гидрофобты бөлігі болмайды және суда жоғары гидратациялы иондарға ыдырай алады.
Мысалдарбеттік белсенді емес заттар молекуласының полярсыз бөлігі жоқ немесе өте аз болатын кейбір органикалық қосылыстарға да жатады. Бұл заттарға құмырсқа, амин сірке қышқылдары жатады.
Сусыз еріткіштерде бейорганикалық электролиттер де беттік керілуді жоғарылатуға қабілетті және бұл еріткішке байланысты.
Мысалы, натрий йодидін метанолға енгізгенде беттік керілу айтарлықтай артады, этанол үшін беттік керілу шамамен 2 есе жоғары. Заттардың беттік белсенділігі заттың табиғатына ғана емес, еріткіштің қасиеттеріне де байланысты болуы мүмкін. Кез келген еріткіш жоғары беттік керілуге ие болса, онда бұл еріген зат маңызды беттік белсенділікті көрсете алады.
36. Адсорбциялық теориялар
«Қатты газ» немесе «қатты ерітінді» интерфейсіндегі адсорбцияның жеке түрлерін сипаттайтын ең көп таралған адсорбция теорияларын қарастырайық.
И.Лангмюрдің мономолекулалық адсорбция теориясы.
1. Адсорбция локализацияланған және химиялық күштерге жақын күштерден туындайды.
2. Адсорбция тек белсенді орталықтарда жүреді – адсорбент бетіндегі бос валенттіліктердің болуымен сипатталатын шығыңқы жерлер немесе ойыстар. Белсенді орталықтар тәуелсіз және бірдей болып саналады.
3. Әрбір белсенді орталық бір ғана адсорбат молекуласымен әрекеттесуге қабілетті; бетінде адсорбцияланған молекулалардың бір ғана қабаты түзілуі мүмкін.
4. Адсорбция процесі қайтымды және тепе-теңдік; адсорбцияланған молекула белсенді орталықта біраз уақыт сақталады, содан кейін ол десорбцияланады; Біраз уақыттан кейін динамикалық тепе-теңдік орнайды.
Максималды мүмкін болатын адсорбция мәні Г o барлық белсенді орталықтарды адсорбат молекулалары алып жатқан жағдайда қол жеткізіледі. Адсорбция мәніне қатысты мономолекулалық адсорбция изотермасының теңдеуі Гадсорбат концентрациясы бар МЕН, келесідей көрінеді:
Қайда б- «адсорбент – адсорбат» шамасының берілген жұбы үшін константасы (десорбция мен адсорбция жылдамдығының константаларының қатынасы), сан жағынан белсенді орталықтардың жартысы орналасқан адсорбат концентрациясына тең.

Ленгмюр адсорбция изотермасының графигі 2-суретте көрсетілген. Тұрақты бнүктедегі адсорбция изотермасына жанама сызу арқылы графикалық түрде анықтаймыз МЕН= 0. Теңдеудегі газдардың адсорбциялану процесін сипаттау кезінде концентрацияны парциалды қысымның пропорционалдық мәнімен ауыстыруға болады. Мономолекулалық адсорбция теориясы И.Лэнгмюр адсорбаттың төмен қысымында (концентрациясында) газдар мен еріген заттардың адсорбциялану процестерін сипаттау үшін қолданылады.
Поланидің полимолекулалық адсорбция теориясы s-тәрізді адсорбция изотермаларын сипаттайды, олардың пішіні адсорбцияланған молекулалардың адсорбатпен ықтимал әрекеттесуін көрсетеді.
1. Адсорбция физикалық күштердің әсерінен болады.
2. Адсорбенттің беті біртекті, белсенді орталықтары жоқ; адсорбциялық күштер адсорбент бетіне жақын үздіксіз күш өрісін құрайды.
3. Адсорбциялық күштер адсорбат молекуласының өлшемінен үлкен қашықтықта әрекет етеді, яғни адсорбция кезінде адсорбция молекулаларымен толтырылатын адсорбент бетінің жанында белгілі бір адсорбциялық көлем болады.
4. Адсорбат молекуласының адсорбент бетінің тартылуы адсорбция көлемінде басқа молекулалардың болуына байланысты емес, соның нәтижесінде полимолекулалық адсорбция мүмкін болады.
5. Адсорбциялық күштер температураға тәуелді емес, демек, температураның өзгеруімен адсорбция көлемі де өзгермейді.
Фрейндлих теңдеуі.Адсорбенттің беті біртекті емес, адсорбцияланған бөлшектер арасында әрекеттесу жүреді, белсенді орталықтар бір-бірінен толық тәуелсіз емес. Г. Фрейндлих адсорбцияланған газдың немесе еріген заттың адсорбент массасына шаққанда моль саны (спецификалық адсорбция деп аталатын) деп ұсынды. X/м), белгілі бір қуатқа дейін көтерілген адсорбенттің тепе-теңдік қысымына (газ үшін) немесе тепе-теңдік концентрациясына (ерітіндіден адсорбцияланған заттар үшін) пропорционал болуы керек, ол әрқашан бірліктен аз:
x / м = aP n x / м = aC n.
дәрежелер nжәне пропорционалдық факторы Аэксперименталды түрде анықталады.
37. Адсорбция процесінің термодинамикасы. Гиббс адсорбция теңдеуі
«Ерітінді – газ» шекарасындағы адсорбция құбылысын зерттеу үшін беттегі қабаттағы адсорбцияланған заттың артық мөлшері арасындағы байланысты орнату қажет ( Г), ерітіндідегі беттік белсенді заттың концентрациясы ( бірге) және беттік керілу ( σ ) «ерітінді-газ» фазасының шекарасында. Құбылыстарды термодинамикалық тұрғыдан қарастырып, еріген заттың адсорбциясын беттің бос энергиясының немесе оның беттік керілуінің өзгеруімен байланыстырған орынды. Бұл байланыс жасалды У.ГиббсВ 1876 ж., ол аталды «Гиббс адсорбция теңдеуі»:
Г = – бірге / RT x dσ/DC.
Сіз әлі де елестете аласыз Гиббс теңдеуі,изобарлық-изотермиялық потенциалды пайдалана отырып, термодинамикаға негізделген Г, химиялық потенциалдар μ 1Және μ 2,және де пайдаланады n 1 Және n 2 компоненттердің моль саны. Оны энтропияны ескере отырып талдап С, көлемі Вжәне қысым П, келесі теңдеуді жаза аламыз:
dG=– SDT+VdP+σds+ μ 1 d n 1 + μ 2 күн 2.
Біз оны нөлге теңестіреміз және тұрақты температура мен қысымды ескере отырып, ол келесі түрдегі теңдеуді жеңілдетеді:
SD σ + n 1 d μ 1 + n2d μ 1 = 0.
Сұйылтылған ерітінділер үшін екінші компоненттің химиялық потенциалы келесідей өрнектелетінін ескере отырып:
μ 2 = μ 2 0 +RTлн в,
және температураның тұрақты екенін ескерсек
dμ 2 =rtdnc,
осы теңдеуді ауыстырыңыз
![]()
қажетті Гиббс адсорбция теңдеуін аламыз. Теңдеу негізінде, егер беттік керілу болатынын көруге болады σ концентрациясы артады бірге, онда беткі қабаттағы еріген заттың концентрациясы ерітінді көлемінен аз болады (теріс адсорбция деп аталады), ал егер беттік керілу σ концентрациясы жоғарылаған сайын төмендейді бірге, онда қабаттағы концентрация көлемнен жоғары (оң адсорбция) және, ең соңында, егер σ тәуелді емес бірге, онда қабаттағы заттың бетіндегі және көлемдегі концентрациясы бірдей болады. Гиббс теңдеуі термодинамика көмегімен шығарылды. Бұл теңдеуді тәжірибеде тексеру қиын, бұл қабатталған беттегі еріген заттың концентрациясын анықтаудың күрделілігіне байланысты. Тәжірибелі B. McBen құрылғының көмегімен ерітіндінің бетінен өте жұқа сұйықтық қабаты кесілгенін анықтады. Гиббс теңдеуінің барлық параметрлерін одан әрі анықтау адсорбцияның эксперименталды түрде табылған мәндері тәжірибелік қателік шегінде Гиббс теңдеуімен есептелген мәндермен сәйкес келетінін көрсетті. Кез келген сұйықтық бетінің біртектілігі мен тегістігіне байланысты оның бетіндегі адсорбцияны зерттегенде белсенді орталықтар туралы әдеттегі идеялар мүлдем қолданылмайды. Критикалық температурада іргелес фазалар арасындағы айырмашылық жойылады, ал беттік керілу, әдетте, нөлге тең болады. Газдар мен булардың адсорбциясының практикалық қолданысы соншалық, әдебиетте, әсіресе техникалық жағынан, қатты денелер бетіндегі процестерге қатысты ғана қолданылатын бұл ұғымды табуға болады.
Бұл концепция, сондай-ақ адсорбцияның ең жалпы заңдылықтары, қарастырылған Гиббс теңдеуі сияқты, барлық фазалық шекараларға қатысты. Гиббс теңдеуін және одан туындайтын барлық ережелерді пайдаланып, Г мәнін анықтап, адсорбция изотермасын құруға болады.
38. Микрокеуекті материалдардағы адсорбцияның ерекшеліктері. Поланның потенциалдық теориясы. Адсорбциялық потенциал
Глейд теориясылокализацияланбаған физикалық адсорбцияны қарастырады, ол адсорбент пен адсорбат арасындағы ван-дер-Ваальс күштеріне тікелей байланысты (бұл бірінші позиция деп санауға болады). Бұл теорияның екінші позициясы - бетінен едәуір қашықтыққа созылатын адсорбенттің күш (немесе потенциал) өрісі туралы түсінік; осы өрісте пайда болатын адсорбциялық қабат полимолекулярлық болып табылады. Егер газдардың адсорбциясын қарастыратын болсақ, онда бұл қабаттың тығыздығы бетінен белгілі норма бойынша төмендейді. Будың адсорбциясын қарастыратын болсақ, онда бетінде белгілі бір қалыңдықтағы сұйық қабат түзіледі. Поланьи теориясындағы өріс эквипотенциалдық беттер қатары ретінде қарастырылады, әрбір бет потенциалдың белгілі бір мәніне сәйкес келеді. ε , және әрбір келесі бет алдыңғысынан кішірек болады. Кеңістіктегі әрбір мұндай бет ретінде белгіленген белгілі бір көлемдегі қабаттарды кесіп тастайды v i. Поланьи теориясының міндеті изотерманың әдеттегі координаталарынан ауысуын табу ( x, б) өріс параметрлеріне ε iЖәне v i, осы негізгі параметрлер арасындағы байланысты одан әрі орнату арқылы. Поланьи келтірген есептің бірінші бөлімі біршама күрделі және көп жағдайда нақты шешімдерге ие бола алмайды, бірақ бу адсорбциясы жағдайында есептің бұл бөлігі бірінші жуықтауда өте қарапайым шешіледі. Сұйық адсорбциялық қабат үшін көлемнің толтырылған бөлігі мынаған тең болады:
v i \u003d x (M / d),
Қайда гсұйық күйдегі заттың тығыздығы.
М.Поляный өз теориясында аталғанның жоқтығы туралы тағы бір ережені енгізеді. адсорбция процесіндегі далалық скрининг, мәні ε бұл кеңістік теориясында берілген нүкте мен қатты бет арасында белгілі адсорбат молекулаларының бар-жоғына немесе барлық кеңістіктің бос болуына қарамастан тұрақты шама (гравитациялық потенциал сияқты нәрсе). Поляни тұжырымдамасымен таныстырады адсорбциялық потенциал ε , бұл тепе-теңдік қысымнан ауысқан кезде буды сығудың изотермиялық жұмысы Рсусымалы фазада бетінен қашықтағы қаныққан бу қысымымен беткі қабаттың аймағына дейін p 0онда потенциалды анықтауға арналған өрнек келесідей болады:
ε = RTлн Р 0 / Р.
Мұндай теңдеудің көмегімен х, р координаталарынан координаталарға өтуге болады ε Және vжәне «сипаттама» деп аталатын қисық сызықты алыңыз. Полани өз тәжірибелерінде алынған изотермалардың тәжірибелік мәліметтерінен құрастырылған мұндай қисықтардың келесі қасиетке ие екенін анықтады: олар Т-ға қатысты инвариантты, немесе басқаша айтқанда, осы типтегі барлық қисық сызықтар бір қисықта жатуы мүмкін. ε −ε .
М.Поляни бұл ұстанымды постулат ретінде қабылдады, яғни:
Полянияның көрсетілген қасиеті орасан зор практикалық құндылығы, ол бір тәжірибелік адсорбция изотермасынан изотермалар тобын құра алады.
Полани теориясы изотерма үшін аналитикалық өрнекті немесе потенциалға қарсы көлем функциясын бермейді, бірақ ол кем дегенде бір изотерма белгілі болса, кез келген берілген температура үшін координатаны есептеуге мүмкіндік береді. Бұл нәтиже үшін өте маңызды технологиялық есептеулер, өйткені бір адсорбенттегі ұқсас газдар үшін адсорбция қисықтары бір-біріне жақын болуы мүмкін және көп жағдайда қабаттасуы мүмкін.
39. Адсорбцияның сипаттамалық қисығы. Температураның инварианттылығы және сипаттамалық қисықтардың жақындығы
Адсорбенттің бетінде пайда болатын күш өрісі гравитациялық өріске көп жағынан ұқсас болуы мүмкін. Адсорбциялық өрісте потенциалды беттерді, яғни бірдей адсорбциялық потенциалы тән беттерді көрсетуге болады. Адсорбциялық потенциал түсінігі бойынша θ 1 моль адсорбатты кен орнының белгілі бір нүктесінен белгілі бір газ фазасына жылжытқанда адсорбция күштеріне қарсы жасалған жұмыс деп түсіну керек. Максималды адсорбциялық потенциал «адсорбент – адсорбция көлемі» шекарасында болады. Бірақ «көлем – газ фазасы» шекарасында (осы жерде адсорбциялық күштердің әрекеті аяқталады) адсорбциялық потенциал нөлге тең болуы керек. Адсорбция көлемінің өзгеруімен адсорбциялық потенциалдың өзгеруін қисық түрінде көрсетуге болады. Мұны алғаш рет М.Поляни жасады. Бұндай қисық түрлері температураға тәуелді емес және әрбір нақты адсорбентке тән болуы мүмкін, мұндай қисық түрлері әдетте адсорбцияның сипаттамалық қисықтары деп аталады. Полимолекулалық адсорбция теориясы газ күйінің теңдеуі адсорбция мөлшеріне қолданылады деп есептейді. Демек, әртүрлі температуралар үшін адсорбат тығыздығының көлемге тәуелділігін сипаттайтын изотермалар қысымның көлемге тәуелділігінің изотермаларына ұқсайды. Төмен температурада беттегі адсорбциялық күштер будың белгілі бір тығыздықтағы сұйықтыққа конденсациялануына әкелуі мүмкін. Критикалық температурадан төмен температурада конденсация кезінде адсорбцияның барлық көлемі сұйықтықпен толтырылады. Бұл жағдайда адсорбция қисығы абсцисса осіне дерлік параллель болады, бұл сұйықтықтың төмен сығылғыштығымен байланысты. Содан кейін «көлем – газ фазасы» шекарасындағы адсорбция қисығы күрт төмендейді, сәйкесінше адсорбаттың тығыздығы газ фазасының белгілі бір тығыздығының мәніне жетеді. Критикалық температурадан жоғары температурада адсорбент идеалды газ сияқты әрекет етуі мүмкін және график идеал газға тәуелділіктің изотермасы ретінде өрнектеледі. pV = RT. Мұндай жағдайларда адсорбцияланған газ адсорбенттің бетінде максималды тығыздыққа ие болады және газ фазасына тікелей жақын жерде минималды тығыздыққа ие болады. Сонымен қатар, бұл жағдайда адсорбциялық қабаттағы адсорбаттың тығыздығы сұйықтықтың өзінің тығыздығына еш жерде жетпейтінін ескеру маңызды. Ал егер температура критикалық мәнге өте жақын болса, тығыздықтың көлемге тәуелділігі сыртқы түрі бойынша изотермаға жақын қисық арқылы өрнектеледі, ол сипатталған. Ван дер Ваальс теңдеуі.Бұл сценарийде адсорбцияланған заттың бір бөлігі сұйық күйде адсорбцияланған көлемде болады, ал адсорбцияланған заттың бір бөлігі газ тәрізді күйде болады. Сонда қисық сұйықтықтан газға өтуге сәйкес келетін бөлікте ең күрт төмендейді. Егер адсорбциялардың бірінің тәжірибелік адсорбция изотермасынан сипаттамалық қисық тұрғызылса және басқа адсорбцияға сәйкес сәйкестік коэффициенттерін біле отырып, адсорбция изотермасын табуға және оны басқа адсорбцияға салуға болады. Адсорбцияның потенциалдық теориясы бір адсорбенттегі әртүрлі булардың әртүрлі адсорбция изотермаларын есептеуге мүмкіндік береді, сонымен қатар бір будың адсорбция изотермасынан алынған сипаттамалық қисық сызығын пайдалана отырып, адсорбциялық потенциалдың қатынасы адсорбция көлеміне тәуелді емес. .
жақындық(латын тілінен affinis – «байланысты») – жақындық хроматографиясы. Белоктарды тазарту және бөлу әдісі олардың инертті тасымалдаушымен ковалентті байланысқан лигандпен селективті әсерлесуіне негізделген (аффинділік хроматографиясы). Токсиканттың рецепторға жақындығын өлшеу, шын мәнінде, инкубациялық ортаға қосылған зат мөлшері мен өзара әрекеттесу нәтижесінде түзілген токсикант-рецепторлық кешеннің мөлшері арасындағы байланысты эксперименттік зерттеу болып табылады.
Адсорбциялық процестердің термодинамикасы.
| Параметр аты | Мағынасы |
| Мақаланың тақырыбы: | Адсорбциялық процестердің термодинамикасы. |
| Рубрика (тақырыптық санат) | Білім |
Адсорбциялық процестерді жіктеудің негізгі анықтамалары мен әдістері.
Адсорбция деп беттік энергияның өздігінен азаюы нәтижесінде пайда болатын құбылыстарды айтады.
Адсорбция- беттік қабат пен біртекті фаза көлемі арасындағы гетерогенді жүйенің құрамдас бөліктерінің өздігінен қайтымды немесе қайтымсыз қайта бөліну процесі.
Көпкомпонентті жүйелерде беттік қабатқа қарағанда, фазааралық керілуді төмендететін компонент артықшылық береді. Бір компонентті жүйелерде беттік қабаттың пайда болуы кезінде оның құрылымы өзгереді (атомдар мен молекулалардың белгілі бір бағыты, поляризация) деп аталады. автоадсорбция.
Адсорбциялық әрекеттесу локализацияланатын неғұрлым тығыз фаза деп аталады адсорбент. Біртекті фаза көлемі мен беткі қабат арасында қайта бөлінген зат ʼʼ терминімен белгіленеді. адсорбатʼʼ.
Кейбір жағдайларда адсорбция процесі қайтымды болады. Бұл жағдайда белгілі бір жағдайларда адсорбцияланған молекулалардың бір бөлігі молекулалық кинетикалық құбылыстардың нәтижесінде беткі қабаттан фаза көлеміне өте алады. Адсорбцияның кері процесі деп аталады десорбция.
Адсорбциялық процестерді жіктеу әдістері.
Әсерлесетін фазалардың агрегаттық күйіне қарай адсорбциялық процестердің жіктелуі.Көршілес фазалардың агрегаттық күйіне тәуелділігін ескере отырып, адсорбциялық процестердің келесі түрлері бөлінеді:
Газдардың қатты адсорбенттерге адсорбциясы;
ʼʼҚатты-сұйықʼʼ және ʼʼсұйық-сұйықʼʼ беткейлерінде еріген заттардың адсорбциясы;
ʼʼсұйық-газʼʼ интерфейсіндегі беттік белсенді заттардың адсорбциясы.
Адсорбент пен адсорбаттың әрекеттесу механизмі бойынша адсорбциялық процестердің жіктелуі.Адсорбцияны адсорбат молекулаларының адсорбенттің белсенді орталықтарымен әрекеттесуі ретінде қарастыруға болады. Олардың әрекеттесу механизмі бойынша адсорбцияның келесі түрлері бөлінеді:
1) физикалық (молекулалық) адсорбция- адсорбат пен адсорбент молекулалары арасындағы әрекеттесу ван-дер-Ваальс күштерінің, сутектік байланыстардың есебінен жүзеге асады. химиялық реакциялар);
2) химиялық адсорбция (химсорбция)– адсорбат молекулаларының адсорбенттің белсенді жерлеріне қосылуы әртүрлі типтегі химиялық реакциялар нәтижесінде жүреді (ион алмасу реакцияларын қоспағанда);
3) ион алмастырғыш адсорбция (ионалмасу) – ион алмасу реакцияларының механизмі бойынша адсорбатты заттың ерітінді мен қатты фаза (ион алмастырғыш) арасында қайта бөлінуі.
Адсорбция процестерін сандық сипаттау үшін екі шама қолданылады.
1) Абсолютті адсорбция- бетінің бірлігіне немесе адсорбенттің массасына шаққанда адсорбаттың мөлшері (моль) немесе массасы (кг). Белгіленуі - A; өлшемі: моль / м 2, моль / кг, кг / м 2, кг / кᴦ.
2) Гиббс (артық) адсорбциясы- белгілі бір қалыңдықтағы беткі қабаттағы адсорбатты заттың оның біртекті фаза көлеміндегі мөлшерімен салыстырғанда, бетінің бірлігіне немесе адсорбенттің массасына шамадан тыс артық болуы. Белгіленуі - G; бірлік: моль/м 2 , моль/кᴦ.
Абсолютті және артық адсорбция арасындағы байланысты мына теңдеу арқылы көрсетуге болады:
G \u003d A - c * h (3.1)
мұндағы с – фаза көлеміндегі заттың тепе-теңдік концентрациясы, моль/м3;
h - беткі қабаттың қалыңдығы, шартты түрде 10 -9 м-ге тең қабылданады.
Көпкомпонентті гетерогенді жүйелерде бір немесе басқа компонент біртекті фазаның көлемі мен беткі қабат арасында қайта бөлінген кезде беттің артық ішкі энергиясының теңдеуі дұрыс болады:
U = T * S + s * s + Sm i * n i (3.2)
Теңдеудің барлық мүшелерін аралық беттің бірлік ауданына келтіріп, мынаны аламыз:
U s = T * S s + s + Sm i * Г i (3.3)
Мұндағы Г i = n i/s – беттік қабаттағы i-ші компоненттің артық мөлшері, яғни Гиббс адсорбциясы.
Бір компонентті жүйе үшін (3.3) теңдеу келесі түрде болады:
G s = s + m * Г (3.4)
мұндағы G s = U s - T * S s - беттің Гиббс энергиясы немесе беттің бірлік ауданын құру жұмысы;
m * Г – адсорбцияланған зат затының беткі қабатта тығыздалуы.
(3.4) теңдеуге сүйене отырып, адсорбция кезінде фаза аралық бетті құру жұмысы бетті қалыптастыру (адсорбат фазасының негізгі бөлігіндегі когезиялық байланыстарды үзу) және беттік қабаттағы затты тығыздау жұмыстарынан тұрады деген қорытынды жасауға болады.
Адсорбент пен адсорбат арасындағы динамикалық тепе-теңдік күйінде гетерогенді жүйенің Гиббс энергиясының өзгеруі ΔG = 0, адсорбция процесінің термодинамикасы деп аталатын теңдеумен сипатталады. Гиббстің негізгі адсорбция теңдеуі:
Ds = SГ i * dm i (3,5)
Бұл теңдеу әмбебап болып табылады, өйткені ол адсорбциялық процестердің барлық түрлеріне жарамды
Гиббс адсорбция теңдеуінің жеке жағдайлары.
1) Ерітінділерден адсорбция.
Жүйенің i-ші компонентінің химиялық потенциалы үшін адсорбция кезінде «сұйық – қатты адсорбент» және «сұйық – газ» интерфейстеріндегі теңдеулер дұрыс:
m i = m i 0 + R*T*ln a i (3,6)
dm i = R*T* d ln a i (3,7)
мұндағы m i 0 - жүйенің i-ші компонентінің химиялық потенциалы at стандартты шарттар;
a i – стандартты жағдайларда жүйенің i-ші құрамдас бөлігінің белсенділігі.
Осының негізінде Гиббс адсорбция теңдеуі келесі формада болады:
Г i = - a i / R*T * (ds / da i) (3.8)
Электролиттік емес ерітінділер үшін i \u003d c i аламыз, содан кейін:
Г i \u003d - s / R * T * (ds / ds) (3.9)
Электролит ерітінділері үшін:
Г i = - с ± n / R*T * (ds / dс ± n) (3.10)
мұндағы c ± - ерітіндінің орташа иондық концентрациясы;
n – стехиометриялық коэффициент.
2) Газ фазасынан заттардың адсорбциясы.
Менделеев-Клайперон теңдеуіне сәйкес:
P \u003d c * R * T (3.11)
Осыған байланысты қатты адсорбенттердегі газдардың адсорбциялануының Гиббс теңдеуі келесі түрде жазылады:
Г i = - Р / R*T * (ds / dР) (3.12)
Тәжірибеде Гиббс адсорбция теңдеуі сұйық концентрациясының немесе тепе-теңдік газ қысымының әртүрлі мәндеріндегі беттік керілуді өлшеуге негізделген беттік керілу анықталатын фазааралық қабаттағы заттардың адсорбция мөлшерін есептеуге мүмкіндік береді. .
Адсорбциялық процестердің термодинамикасы. - түсінігі және түрлері. «Адсорбциялық процестердің термодинамикасы» категориясының классификациясы және ерекшеліктері. 2017, 2018 ж.
Екі атомның әрекеттесуі жағдайында:
U – әрекеттесу энергиясы;
U = U + ТАРТЫҢЫЗ.
 - Ленард-Джонс теңдеуі
, c, b, m = const
- Ленард-Джонс теңдеуі
, c, b, m = const
Атомдардың қатты бетпен әрекеттесуі жағдайында барлық әрекеттесулерді қорытындылау қажет.
x - бетке дейінгі қашықтық
r – тартылыс күштерінің әсер ету радиусы
dV - көлем
n – беттік молекулалардың саны
U ADS. адсорбциялық әрекеттесу энергиясы болып табылады



Адсорбция жағдайында тартылыс күшейеді. Ал полярсыз-полярлы емес түрдегі өзара әрекеттесу жағдайында адсорбция негізінен ойыстарда локализацияланады.
электростатикалық әрекеттесу.
Полярлы адсорбент – полярсыз адсорбат
Полярлы емес адсорбент – полярлы адсорбат
Полярлы адсорбент - полярлы адсорбат.
М  адсорбат молекуласы диполь, ал адсорбент өткізгіш ретінде берілген, онда адсорбат молекуласы берілгенге қатысты симметриялы түрде диполь айнасын индукциялайды.
адсорбат молекуласы диполь, ал адсорбент өткізгіш ретінде берілген, онда адсорбат молекуласы берілгенге қатысты симметриялы түрде диполь айнасын индукциялайды.
X - ортаға дейінгі қашықтық
Өзара әрекеттесу кезінде потенциал пайда болады:
 ,
,
 дипольдік момент болып табылады.
дипольдік момент болып табылады.
Потенциал максималды мәнді қабылдауға бейім, яғни. дипольдер бетке перпендикуляр бағытталған.
Температураның жоғарылауы броундық қозғалыстың өсуіне ықпал ететіндіктен, адсорбция процесінің тежелуіне әкеледі.
Электростатикалық әрекеттесу жағдайында адсорбат негізінен шығыңқы жерлерде локализацияланады.
Негізгі адсорбция теңдеуі.
Адсорбция жағдайында компонент қайта бөлінеді, яғни химиялық потенциал өзгереді. Адсорбция процесін беттік энергияның химиялық энергияға өтуі ретінде қарастыруға болады.
Қабат көлемі = 0, онда термодинамика заңының I және II жалпыланған теңдеуі:
T = const; (1) = (2) => 

Екі компонентті жүйе үшін:
,
 ,
,
 =>
=>
=>
 - Гиббс адсорбция теңдеуі
.
- Гиббс адсорбция теңдеуі
.
Теледидарды адсорбциялау жағдайы үшін. дене – газ:, 
 ,
,

 - изотерма
- изотерма
 - изобар
- изобар
 - изопикне
- изопикне
 - изостер
- изостер
Изотерма, изопикн, изостера бір-бірімен байланысты.
Өйткені адсорбциялық функция 



Генри изотермасы Ленгмюр изотермасы



Термодинамика. Адсорбция.
Конденсацияланған тасымалдағыштар үшін:
 ,
,
 ,
,
 - Гиббс энергиясының интегралдық өзгерісі
.
- Гиббс энергиясының интегралдық өзгерісі
.

Қисық беттегі P-қысым, P S-тегіс беттегі қысым
 - адсорбциялық потенциал
- адсорбциялық потенциал
Энтрапияның дифференциалды өзгеруі 
 , Г = const
, Г = const
- дифференциалды энтропияның өзгеруі
- адсорбцияның дифференциалды энтальпиясы
 - адсорбцияның изотериялық жылуы
- адсорбцияның изотериялық жылуы
 - конденсация жылуы
- конденсация жылуы
 - адсорбцияның таза жылуы
- адсорбцияның таза жылуы

 ,
,




Qa – адсорбцияның интегралдық жылуы, 
Qra – адсорбцияның интегралды таза жылуы,

Генри теңдеуі
Адсорбцияны зерттеуге беттің біртекті еместігі кедергі келтіреді, сондықтан біртекті беттер үшін қарапайым заңдылықтар алынады.
Газ көлемдік тепе-теңдік күйден беттегі тепе-теңдік күйге өткен кездегі газдардың қатты бетпен әрекеттесуін қарастырайық. Бұл жағдай гравитациялық өрістегі газдардың тепе-теңдігіне ұқсас.
 ,
,
 ,
=>
,
=> -Генри теңдеуі
-Генри теңдеуі
 - бөлу коэффициенті
- бөлу коэффициенті
Адсорбция процесінде химиялық потенциалдар өзгереді.
Жаппай фаза үшін: 
Жер үсті газы үшін: 
Тепе-теңдік күйінде  , яғни.
, яғни.

Генри теңдеуінде тұрақты шама концентрацияға тәуелді емес
Генри теңдеуі төмен қысымдар мен концентрациялар аймағында жарамды. Концентрация өскен сайын Генри заңынан ауытқудың 2 түрі мүмкін:
1 – оң ауытқулар, D төмендейді, А төмендейді
2 – теріс ауытқулар, D – артады, А – артады.
Ауытқу түрі адсорбент-адсорбат әрекетінің сол немесе басқа түрінің басым болуымен анықталады.
Күшті адгезиялық өзара әрекеттесу кезінде белсенділік коэффициенттері артады - оң ауытқу. Біріктірілген өзара әрекеттесу жағдайында теріс ауытқулар байқалады.
мономолекулалық адсорбция.
Ленгмюр изотермасы.
Ең қарапайым заңдылықтар Генри теориясында алынды. Ленгмюр адсорбцияны квазихимиялық реакция ретінде қарастыратын теорияны ұсынды. Бола тұра:
Беті энергетикалық жағынан біркелкі.
Адсорбция локализацияланған, әрбір адсорбциялық орталық бір адсорбат молекуласымен әрекеттеседі.
Адсорбат молекулалары бір-бірімен әрекеттеспейді.
Адсорбция бір қабатты.

 - беті,
- беті,  - адсорбат,
- адсорбат,  - адсорбциялық кешен.
- адсорбциялық кешен.
 , содан кейін адсорбция учаскелерінің концентрациясы:
, содан кейін адсорбция учаскелерінің концентрациясы:  ,
, - адсорбцияны шектеу.
- адсорбцияны шектеу.
 , онда реакция тұрақтысы:
, онда реакция тұрақтысы: 

 - Ленгмюр теңдеуі.
- Ленгмюр теңдеуі.
Концентрацияға қарсы адсорбция
1 )
)
 ,
,

2) жоғары концентрация аймағы
 - адсорбцияны шектеу, мономолекулалық қабаттың түзілуі
- адсорбцияны шектеу, мономолекулалық қабаттың түзілуі
Гиббс энергиясы үшін: .
g – энтропия факторы.
Генри изотермасы жағдайында Гиббс энергиясы адсорбаттың массадағы стандартты күйден бетіндегі стандартты күйге өтуін сипаттайды. Ленгмюр изотермасы жағдайында  адсорбент пен адсорбаттың жақындық дәрежесін сипаттайды.
адсорбент пен адсорбаттың жақындық дәрежесін сипаттайды.
 Van't Hoff isobar көлігінен табылған.
Van't Hoff isobar көлігінен табылған.

 , Содан кейін
, Содан кейін  , демек
, демек  .
.

 - бетті толтыру дәрежесі.
- бетті толтыру дәрежесі.




 - бос жұмыс орындарының саны,
- бос жұмыс орындарының саны,  - алып жатқан орындардың саны.
- алып жатқан орындардың саны.
 ,
,

Анау. жоғары концентрация аймағында бос орындар саны адсорбат мөлшеріне кері пропорционал.
Газдар қоспасының біртекті бетке адсорбциясы.
Бұл жағдайда адсорбция процесі екі параллель реакция ретінде қарастырылады.
 (1)
(1)

 (2)
(2)


Газдар қоспасының біртекті емес бетке адсорбциясы.
Біртекті емес бет жағдайында орташа толтырулармен шектелмеу керек.
Бәсекелестік нәтижесінде әртүрлі адсорбаттарды локализациялау әртүрлі сайттарда мүмкін болады.
Бұл жағдайда қатынас  .
.
 ,
,
 - адсорбаттың қанығу буының қысымы.
- адсорбаттың қанығу буының қысымы.
 ,
,
 адсорбция жылуы болып табылады.
адсорбция жылуы болып табылады.
«+» - симбатикалық тәуелділік, «-» - антибатикалық тәуелділік, «Н» - корреляция жоқ.
«+» - адсорбция сол механизм бойынша жүреді. Энергетикалық жағынан ең қолайлы аймақтарда бетіне жоғары жақындығы бар газ басым түрде адсорбцияланады.
«-» - адсорбция әртүрлі механизмдер арқылы жүреді және белгілі бір уақытқа дейін бет үшін бәсекелестік болмайды.
Мономолекулалық адсорбция негізінен төмен мәндерде газдардың физикалық адсорбциясы кезінде жүзеге асады. б, сондай-ақ сұйық/газ интерфейсінде.
Полимолекулалық адсорбция.
BET теориясы(Брунауэр, Эммет, Теллер).
Бір қабаттың түзілуі беттік энергияның орнын толтыру үшін жеткіліксіз болған жағдайда адсорбция полимолекулярлық болып табылады және оны беттік күштердің әсерінен еріксіз конденсацияның нәтижесі ретінде қарастыруға болады.
Негізгі ережелер:
Адсорбат молекуласы басып тұрған жерге тиген кезде көп жиынтық түзіледі.
Жақындаған сайын бКімге б сбос адсорбция учаскелерінің саны азаяды. Бастапқыда дара, қос және т.б. алатын орындардың саны артып, кейін азаяды. жинақтар.
Сағат б =б с адсорбция конденсацияға айналады.
Көлденең өзара әрекеттесулер жоқ.
Бірінші қабат үшін Ленгмюр изотермасы орындалады.
Беткей адсорбциялық учаскелердің жиынтығы ретінде қарастырылады. Динамикалық тепе-теңдік шарты дұрыс: бос орындардағы конденсация жылдамдығы, орналасқан жерлердегі булану жылдамдығына тең.
a - конденсация коэффициенті (бетінде конденсацияланған молекулалардың үлесі);
 ,
,
Zm – бос орындардың максималды саны.
 - бетке перпендикуляр бағытта атомдардың тербеліс жиілігі.
- бетке перпендикуляр бағытта атомдардың тербеліс жиілігі.
Бірінші қабат үшін динамикалық тепе-теңдік шарттары:



 , Содан кейін
, Содан кейін
 - Ленгмюр теңдеуі.
- Ленгмюр теңдеуі.
Екінші қабат үшін дұрыс болады: 
i-ші қабат үшін: 
Қарапайымдылық үшін a және ν біріншіден басқа барлық қабаттар үшін бірдей деп есептеледі. Біріншіден басқа барлық қабаттар үшін адсорбция жылуы тұрақты болады. Соңғы қабат үшін адсорбция жылуы конденсация жылуына тең. Нәтижесінде теңдеу
 (*)
(*)
C- тұрақты,
BET теориясы жағдайында тұрақты МЕНтаза адсорбцияның Гиббс энергиясын сипаттайды. Теңдеу тек бір тұрақтыдан тұрады және бұл теңдеу адсорбенттің меншікті бетінің ауданын анықтау үшін де өте маңызды.
Адсорбция нәтижесінде жылу бөлінетіндіктен, меншікті беттерді анықтау төмен температурада жүргізіледі.
 ????????????
????????????


Теорияның негізгі кемшілігі– тік әсерлердің пайдасына көлденең өзара әрекеттесулерді елемеу.
Теңдеу аралықта  0,05-тен 0,3-ке дейін.
0,05-тен 0,3-ке дейін.
Қайда  <
0,05 – существенное влияние оказывает
неоднородность поверхности.
<
0,05 – существенное влияние оказывает
неоднородность поверхности.
 > 0,3 - адсорбаттың әрекеттесуі - адсорбат әсер етеді.
> 0,3 - адсорбаттың әрекеттесуі - адсорбат әсер етеді.
Адсорбат-адсорбат әрекетін есепке алу.
Тармақталған молекулалардың немесе молекулалардың полярлы емес бетінде адсорбция кезінде әрекеттесу пайда болады. бірлестіктер құруға қабілетті. Бұл жағдайда адсорбциялық изотермалардың пішіні өзгереді.
А  сорбент полярлы емес.
сорбент полярлы емес.
1-график адсорбат-адсорбат, күшті адсорбат-адсорбент әлсіз әрекеттесулеріне сәйкес келеді.
2-график күшті адсорбат-адсорбат әрекеттесуі, күшті адсорбат-адсорбент әрекеттесуіне сәйкес келеді.
3-график күшті адсорбат-адсорбат әрекеттесуі, әлсіз адсорбат-адсорбент әрекеттесуіне сәйкес келеді.
 ,
,

Адсорбат молекулаларының өзара әрекеттесу жағдайында белсенділік коэффициенттерінің өзгеруін ескеру қажет. Және бұл теңдеу былай жазылады:
 - Фрункин, Фаулер, Гуггенхайм теңдеуі.
- Фрункин, Фаулер, Гуггенхайм теңдеуі.
ктартылыс константасы болып табылады.
Поланның потенциалдық теориясы.
Бұл теория адсорбция изотермасының кез келген түрін шығармайды, бірақ басқа температурада изотермаларды есептеуге мүмкіндік береді.
Адсорбциябасқа молекулалардың болуына байланысты емес және бет пен адсорбат молекуласы арасындағы қашықтыққа тәуелді адсорбциялық потенциалдың әсерінен адсорбаттың адсорбент бетіне тартылуының нәтижесі болып табылады.
 ,
,
 - адсорбциялық потенциал.
- адсорбциялық потенциал.
Беткей біртекті емес болғандықтан, қашықтық адсорбция көлемімен ауыстырылады  .адсорбция көлеміберілген мәнге сәйкес бет пен нүктенің арасына жабылған көлем
.адсорбция көлеміберілген мәнге сәйкес бет пен нүктенің арасына жабылған көлем  .
.
Адсорбциялық потенциалберілген адсорбция көлемінен тыс 1 моль адсорбатты адсорбция көлемінің берілген нүктесіне ауыстыру жұмысы (немесе адсорбаттың 1 моль қаныққан буы жоқ кезде сұйық адсорбатпен тепе-теңдікте болатын жұмыс) адсорбент, адсорбентпен тепе-теңдікте бу фазасына).

Сипаттама қисығы
 - адсорбциялық потенциал;
- адсорбциялық потенциал; 
Берілген адсорбент және әртүрлі адсорбаттар үшін мыналар дұрыс: 
Адсорбаттардың әртүрлі түрлері үшін  ,
,
Қайда  салыстырмалы қысымдағы адсорбция изотермаларының потенциалдары
салыстырмалы қысымдағы адсорбция изотермаларының потенциалдары  адсорбат 1 және адсорбат 2 үшін. Бұл қатынас тұрақты мән болып табылады.
адсорбат 1 және адсорбат 2 үшін. Бұл қатынас тұрақты мән болып табылады.
 - жақындық коэффициенті
- жақындық коэффициенті
Капиллярлық конденсация теориясы.
Адсорбция процесінің жүруі көбінесе кеуекті дененің құрылымына байланысты.
|
микрокеуекті | |
|
Өтпелі кеуекті | |
|
Макрокеуекті |
Микрокеуекті сорбенттер жағдайында адсорбциялық күштердің өрістері қабаттасады. Макрокеуекті сорбенттер жағдайында кеуектер тасымалдау арналарының рөлін атқарады. Конденсация процестері өтпелі кеуекті денелерде ең маңызды болып табылады. Капиллярлық конденсация белгілі бір мәндерде басталады бЖәне  беттік энергияның бір бөлігі өтелген кезде. Қажетті шарт - бұл беті өзін-өзі ұстауы керек. Процесс сипатталған Томпсон-Кельвин теңдеуі.
беттік энергияның бір бөлігі өтелген кезде. Қажетті шарт - бұл беті өзін-өзі ұстауы керек. Процесс сипатталған Томпсон-Кельвин теңдеуі.

 - сулану жағдайында қисықтық центрі газ фазасында болады.
- сулану жағдайында қисықтық центрі газ фазасында болады.
Капиллярлық конденсация жағдайында адсорбция изотермасы гистерезис формасына ие болады. Төменгі тармақ адсорбция процесіне, ал жоғарғы тармақ десорбция процесіне сәйкес келеді.
Кеуектің барлық түрлерін үш түрге дейін азайтуға болады:
|
конустық |
Бір жабық ұшы бар цилиндрлік |
Екі ашық ұшы бар цилиндрлік |
|
Процесті толтыру кеуектің түбінен жүзеге асырылады. Бұл жағдайда адсорбция изотермасы мен десорбция изотермасы сәйкес келеді, өйткені адсорбция процесі шардан басталады және десорбция процесі де кейбір сфералардың жойылуымен басталады.
↓ |
Гистерезис жоқ. Тура және кері инсульт мына теңдеумен сипатталады:
|
Еш жерде түбі жоқ, кеуекті толтыру цилиндрдің қабырғалары бойымен өтеді.
цилиндр: Изотерма және гистерезис формасы болады.
↓ |
IN  ылғалдану жағдайында конденсация төмен қысымда пайда болады, бұл энергетикалық жағынан қолайлы. Десорбция тармағынан кеуектер көлемінің таралу қисықтары алынады.
ылғалдану жағдайында конденсация төмен қысымда пайда болады, бұл энергетикалық жағынан қолайлы. Десорбция тармағынан кеуектер көлемінің таралу қисықтары алынады.
Дифференциал қисығының максимумы интегралдың иілу нүктесіне қатысты солға ығысады. Кішкентай тері тесігінің жалпы көлемі аз, бірақ оның бетінің үлкен аумақтары бар. Кеуектер көлемі ұлғайған сайын олардың көлемі де артады  , және ауданы ретінде
, және ауданы ретінде  , осыған байланысты дифференциалдық қисық максимумының ығысуы байқалады.
, осыған байланысты дифференциалдық қисық максимумының ығысуы байқалады.
Қатты-сұйықтық интерфейсіндегі адсорбция.
Қатты-газ интерфейсіндегі адсорбция жағдайында біз бір компонентті елемейміз. Қатты-сұйықтық шекарасында адсорбция болған жағдайда адсорбат адсорбент бетінен еріткіш молекулаларын ығыстырады.
 ,
,
Дұрыс теңдеу:

 ,
,
N 1, N 2 - еріткіш пен компоненттің мольдік фракциялары, N 1 + N 2 \u003d 1, содан кейін
 ,
=>
,
=>
 , онда - қатты - сұйық фазалық шекара үшін адсорбция теңдеуі.
, онда - қатты - сұйық фазалық шекара үшін адсорбция теңдеуі.
Адсорбция (G) > 0 ат  <
0
<
0
Мәндер болса  үшін компонент пен еріткіш өте әртүрлі, бұл жағдайда тәуелділік Гбастап Нмәні бойынша экстремумы бар Н
~ 0,5.
үшін компонент пен еріткіш өте әртүрлі, бұл жағдайда тәуелділік Гбастап Нмәні бойынша экстремумы бар Н
~ 0,5.
Е  егер
егер  ұқсас мәндерге ие, бұл жағдайда адсорбция белгісі өзгеруі мүмкін. Тәуелділік Гбастап Нх осін кесіп өтеді
ұқсас мәндерге ие, бұл жағдайда адсорбция белгісі өзгеруі мүмкін. Тәуелділік Гбастап Нх осін кесіп өтеді
Функция қиылысы Г(Н) абсцисса осі деп аталады адсорбциялық азеотроп. Бұл екі компонентті осы адсорбентте бөлуге болмайтынын білдіреді.
Алмасу константасы бар адсорбция изотермасының теңдеуі.
Қатты-сұйықтық шекарасында адсорбция кезінде компоненттер адсорбент беті мен ерітіндінің көлемі арасында үнемі қайта бөлінеді.
 - құрамдас бөліктер (- - бетіне қараңыз)
- құрамдас бөліктер (- - бетіне қараңыз)

 ,
,
 ,
, .
.
 ,
,


Сұйық-газ интерфейсіндегі адсорбция
Р  Сұйық-газ шекарасы қиылысу кезінде концентрация профилінің өзгеруін қарастырайық. 2-компонент тұрақсыз болсын.
Сұйық-газ шекарасы қиылысу кезінде концентрация профилінің өзгеруін қарастырайық. 2-компонент тұрақсыз болсын.
Cs – беткі қабаттағы концентрация.
Артық адсорбцияның анықтамасына негізделген

Егер компонент ұшпа болмаса, онда адсорбция мәні келесідей жазылады:
П  ri
ri 

Теңдеуде  заттың табиғаты туынды арқылы сипатталады
заттың табиғаты туынды арқылы сипатталады  .
.
Беттік керілу изотермасы 1 немесе 2 түрінде болуы мүмкін:
1 - беттік белсенді заттар
2 - беттік белсенді заттар
Беттік белсенділік g – заттардың жүйедегі беттік керілуді азайту қабілеті.

 - беткі қабаттың қалыңдығы
- беткі қабаттың қалыңдығы
C с- беттік қабаттағы компоненттің концентрациясы
МЕН– көлемдік концентрация
Гомологиялық қатар үшін мынадай ереже бар:
 - Трабо Дюклоның билігі
- Трабо Дюклоның билігі
Гомологиялық қатар үшін адсорбция изотермасы келесідей болады:
Беттік қабатта адсорбция шамадан тыс болғандықтан, А орнына D жазамыз.
Беттік керілу изотермиясы:

 таза еріткіштің беттік керілуі болып табылады.
таза еріткіштің беттік керілуі болып табылады.
 - адсорбцияның негізгі теңдеуі;
- адсорбцияның негізгі теңдеуі;
 - Ленгмюр теңдеуі.
- Ленгмюр теңдеуі.
Оларды бірге шешейік:

- Шишковский теңдеуі.
Бгомологтық қатар үшін тұрақты шама.
А- бір гомологтан екіншісіне ауысқанда 3-3,5 есе артады 
![]()
1 - концентрациясы төмен аймақ
![]()
2 – орташа концентрация
3 – мономолекулалық қабат
Беттік белсенді заттар амфифилді молекулалар, яғни. полярлы топты және полярлы емес көмірсутекті радикалды қамтиды.
o - молекуланың полярлық бөлігі.
| молекуланың полярсыз бөлігі болып табылады.
Полярлы еріткіште беттік белсенді заттың молекулалары молекуланың полярлы бөлігі еріткішке қарайтындай, ал полярлы емес бөлігі газ фазасына итерілетіндей бағытталған.
Шишковский теңдеуінде  , ол гомологтық қатар үшін тұрақты.
, ол гомологтық қатар үшін тұрақты.
Беттік-белсенді әрекет пайда бола бастайды n>5. Мономолекулярлық қабаттың концентрациясынан жоғары концентрацияларда беттік белсенді заттардың ерітінділерінде мицелдену жүреді.
Микелла- көмірсутекті радикалдары өзегін құрайтын, ал полярлы топтары сулы фазаға айналатын амфифильді БАЗ молекулаларының жиынтығы деп аталады.
Мицелла массасы – мицеллярлық масса.
Х  молекулалар саны агрегация саны.
молекулалар саны агрегация саны.
Сфералық мицеллалар
Мицеллизация жағдайында ерітіндіде тепе-теңдік орнайды
CMC – мицеллалардың критикалық концентрациясы.
Мицеллаларды жеке фаза деп есептейтіндіктен:
Гомологиялық қатар үшін эмпирикалық теңдеу бар:
афункционалдық топтың еру энергиясы болып табылады.
б - адсорбциялық потенциал өсімі, метилен бірлігіне адсорбцияның жұмысы.
- адсорбциялық потенциал өсімі, метилен бірлігіне адсорбцияның жұмысы.
Мицеллалардағы көмірсутек өзегінің болуы суда ерімейтін қосылыстардың беттік белсенді заттардың сулы ерітінділерінде еруіне мүмкіндік береді, бұл құбылыс ерігіштік деп аталады (ерітетін зат - ерігіш, БАЗ - еріткіш).
Балшық толығымен полярлы емес болуы мүмкін, полярлық және полярлы емес бөліктерді қамтуы мүмкін және беттік белсенді зат молекуласы сияқты бағытталған болады.
Кез келген жағдайда, еріту кезінде мицеллярлық масса мен агрегация санының артуы солюбилизацияның қосылуынан ғана емес, сонымен қатар тепе-теңдік күйін сақтау үшін қажетті беттік-активті заттар молекулаларының санының көбеюінен де болады.
Ерітіндінің молекулалық салмағы неғұрлым төмен болса, еріту тиімдірек болады.

 ~ 72 мН/м.
~ 72 мН/м.
 ~ 33 мН/м.
~ 33 мН/м.
Беттік-активті заттардың тиімділігі ЦМС шамасына байланысты.
2D беттік қабат қысымы

→ -беттік керілу күштері.
- екі өлшемді қысым.
Беттік қабат - бұл таза бетке бағытталған беттік белсенді зат ерітіндісі мен таза еріткіштің беттік керілулерінің айырмашылығына тең күш.
Ерітінді мен беткі қабат арасында тепе-теңдік орнатылады



Сағат  аймақ бар
аймақ бар  концентрацияға сызықтық тәуелді.
концентрацияға сызықтық тәуелді.
G [моль / м 2].
 заттың бір моль алып жатқан ауданы
заттың бір моль алып жатқан ауданы
Сонда екі өлшемді қысым изотермасы пішінге ие болады 
 екі өлшемді қысым изотермасы болып табылады.
екі өлшемді қысым изотермасы болып табылады.
Тәуелділік  SM-ден:
SM-ден:

Сағат  - екі өлшемді қысым күрт артады. Сағат
- екі өлшемді қысым күрт артады. Сағат  екі өлшемді деформацияланған, бұл күрт өсуді тудырады
екі өлшемді деформацияланған, бұл күрт өсуді тудырады  .
.
Екі жағынан бірдей фазалармен шектелген пленка екі жақты деп аталады. Мұндай фильмдерде аналық сұйықтықтың тұрақты қозғалысы байқалады.
Қалыңдығы 5 нм-ден аз қабықшалар қара пленкалар деп аталады.

Адсорбциялық қабаттардың екі сипаттамасы болуы керек: тұтқырлық және жеңіл қозғалғыштық, аққыштық және серпімділік.
Марангони әсері өзін-өзі емдейді.
Гиббс үшбұрышы,  - артық қысым.
- артық қысым.
Пленка созылады және сұйықтықтың бір бөлігі жоғалып кетуіне байланысты беттік белсенді заттар бос кеңістікке асығады. Гиббс үшбұрышы.
Денелердің адсорбциялық беріктігінің әсері.
Пленка бетінде әрқашан адсорбциялық қабат болады, ол үшін , содан кейін
Ленгмюр теңдеуі:


 екі өлшемді қысымға айналады
екі өлшемді қысымға айналады
 - Шишковский теңдеуінің аналогы
- Шишковский теңдеуінің аналогы
электрокинетикалық құбылыстар. Қос электр қабаты (DES).
Гельемгольц үлгісі. Гуи-Чапман теориясы.
1808 ұшу

У – пішінді түтік, оған 2 электрод батырылған. Байланыстағы ыдыстар заңы бұзылып, түтіктегі сұйықтық деңгейінің өзгеруі – электрокинетикалық құбылыстар байқалады.
Кинетикалық құбылыстар:
электрофорез
Электросмос
Ағын (ағын) потенциалы
Седиментация потенциалы
1 және 2 потенциалдар айырмасын қолданғанда пайда болады, 3 және 4 коллоидтық бөлшектердің тесу және тұндыру потенциалдар айырмасының пайда болуын тудырады.
Электросмос электр тогының әсерінен дисперсиялық ортаның стационарлық дисперсті фазаға қатысты қозғалысы.
электрофорез электр тогының әсерінен қозғалмайтын дисперсиялық ортаға қатысты дисперстік фаза бөлшектерінің қозғалысы.
П  Электркинетикалық құбылыстардың пайда болу себебі зарядтардың кеңістікте бөлінуі және қос электр қабатының пайда болуы.
Электркинетикалық құбылыстардың пайда болу себебі зарядтардың кеңістікте бөлінуі және қос электр қабатының пайда болуы.
Қос электрлік қабат жазық конденсатор болып табылады, бір пластина потенциалды анықтайтын иондардан, екіншісі контринолардан құралған. Потенциалды анықтайтын ко-иондар ерітіндінің негізгі бөлігіне итерілгендіктен иондар да ластанған. Пластиналар арасындағы қашықтық  . Потенциал сызықтық төмендейді, потенциалдар айырмасы
. Потенциал сызықтық төмендейді, потенциалдар айырмасы  .
.
Сыртқы потенциалдар айырмасы ығысу модулінің пайда болуын тудырады  қатты дененің беті бойымен әсер ететін бірлік ауданға келетін күш жұбы.
қатты дененің беті бойымен әсер ететін бірлік ауданға келетін күш жұбы.

Тепе-теңдікте ығысу модулі тұтқыр үйкеліс модуліне тең (  ).
).

Біздің жағдайда  ,
,

 - Гельемгольц-Смалуковский теңдеуі
- Гельемгольц-Смалуковский теңдеуі
 - сызықтық жылдамдықты ауыстыру i фазалары.
- сызықтық жылдамдықты ауыстыру i фазалары.
Еэлектр өрісінің кернеулігі болып табылады.
 - пластиналар арасындағы потенциалдар айырмасы
- пластиналар арасындағы потенциалдар айырмасы
 - электрофоретикалық ұтқырлық [м 2 /(V * с)].
- электрофоретикалық ұтқырлық [м 2 /(V * с)].
Гелемгольц моделі молекулалардың жылулық қозғалысын есепке алмайды. Шындығында қос қабаттағы иондардың таралуы күрделірек.
Гуи мен Чапман DES-тің келесі себептерін анықтады:
Тепе-теңдік орнаған кезде ионның бір фазадан екінші фазаға өтуі.
Қатты фазалық заттардың иондануы.
Дисперсиялық ортада бар иондар арқылы беттің аяқталуы.
Сыртқы ток көзінен поляризация.
Электрлік қос қабат бұлыңғыр немесе диффузиялық құрылымға ие. Иондар диффузиялық қабатта біркелкі таралады.
Диффузиялық қабат қарсы иондардан тұрады, қабаттың ұзындығы олардың кинетикалық энергиясымен анықталады. Абсолютті нөлге бейім температурада контринолар потенциалды анықтаушы иондарға барынша жақын болады.
Бұл теория екі теңдеуге негізделген:
Больцман теңдеуі

 - электростатикалық әсерлесу күштеріне қарсы жұмыс істеу.
- электростатикалық әсерлесу күштеріне қарсы жұмыс істеу.
 зарядтың көлемдік тығыздығы болып табылады.
зарядтың көлемдік тығыздығы болып табылады.

Пуассон теңдеуі 
DEL қалыңдығы бөлшектердің өлшемінен әлдеқайда аз болғандықтан және жазық DEL үшін координаттарға қатысты туынды  Және
Және  жойылады.
жойылады. 
e y және y үшін<<1 функцию можно разложить в ряд Маклорена:

Біз серияның екі мүшесімен шектелеміз, содан кейін:


 - DEL қалыңдығы - DEL потенциалы төмендейтін қашықтық eбір рет.
- DEL қалыңдығы - DEL потенциалы төмендейтін қашықтық eбір рет.
Температура неғұрлым төмен болса, соғұрлым аз  . Т→0 кезінде – жазық DES. Концентрация неғұрлым жоғары болса, соғұрлым I, соғұрлым аз
. Т→0 кезінде – жазық DES. Концентрация неғұрлым жоғары болса, соғұрлым I, соғұрлым аз  .
.





 «–» потенциал қашықтыққа қарай азаяды дегенді білдіреді. =>
«–» потенциал қашықтыққа қарай азаяды дегенді білдіреді. =>
=>

 ,
,
 - потенциал экспоненциалды түрде төмендейді.
- потенциал экспоненциалды түрде төмендейді.
Зарядтың беттік тығыздығының потенциалы: 
Беттік заряд - қашықтыққа біріктірілген қарама-қарсы таңбалы ғарыштық заряд.




=>


Потенциал 2,7 есе төмендегенде - 
Екі қабатты сыйымдылық 
Теорияның кемшілігі - Гельемгольц қабатының болуы ескерілмейді, яғни. есепке алмайды  , демек, негізгі параметрлерді анықтаудағы қателер. Ол сондай-ақ әртүрлі табиғаттағы иондардың электрлік қос қабаттың қалыңдығына әсерін түсіндірмейді.
, демек, негізгі параметрлерді анықтаудағы қателер. Ол сондай-ақ әртүрлі табиғаттағы иондардың электрлік қос қабаттың қалыңдығына әсерін түсіндірмейді.
Штерн теориясы. Коллоидты мицелланың құрылысы.
Электрлік қос қабат екі бөліктен тұрады: тығыз және диффузиялық. Потенциал түзуші иондардың арнайы адсорбцияланғандармен әрекеттесуі нәтижесінде тығыз қабат түзіледі. Бұл иондар, әдетте, ішінара немесе толық сусызданған және потенциалды анықтайтын иондарға бірдей немесе қарама-қарсы зарядқа ие болуы мүмкін. Ол электростатикалық әрекеттесу энергиясының қатынасына байланысты  және арнайы адсорбциялық потенциал
және арнайы адсорбциялық потенциал  . Тығыз қабаттың иондары бекітілген. Иондардың басқа бөлігі диффузиялық қабатта орналасқан, бұл иондар бос және ерітіндіге тереңдей жылжи алады, яғни. жоғары концентрация аймағынан төмен концентрация аймағына дейін. Зарядтың жалпы тығыздығы екі бөліктен тұрады.
. Тығыз қабаттың иондары бекітілген. Иондардың басқа бөлігі диффузиялық қабатта орналасқан, бұл иондар бос және ерітіндіге тереңдей жылжи алады, яғни. жоғары концентрация аймағынан төмен концентрация аймағына дейін. Зарядтың жалпы тығыздығы екі бөліктен тұрады.

 - Гельмгольц қабатының заряды
- Гельмгольц қабатының заряды
 -Диффузиялық қабат заряды
-Диффузиялық қабат заряды
Бетінде әрқайсысы бір қарсы ионмен әрекеттесетін адсорбциялық орталықтардың белгілі саны бар. Мұндай квазихимиялық реакцияның тұрақтысы:

 , Қайда
, Қайда  - ерітіндідегі қарсы иондардың мольдік үлесі
- ерітіндідегі қарсы иондардың мольдік үлесі
Гельмгольцтың таралуы
Потенциал сызықты түрде төмендейді
Gouy әлеуетті таралуы. Тығыз қабат жоқ, потенциал мәннен экспоненциалды түрде төмендейді 
Қатты бөлу.
Бастапқыда потенциалдың төмендеуі сызықтық, содан кейін экспоненциалды түрде болады.
Электрофорез жағдайында электр өрісі әсер еткенде қатты фазаның бөлшектері емес, қоршаған иондар қабаты бар қатты фазаның бөлшектері қозғалады. DES дисперсті фазаның бөлшектерінің пішінін қайталайды. Потенциал әсер еткенде диффузиялық қабаттың бір бөлігі үзіліп кетеді. Үзіліс сызығы деп аталады сырғымалы шекара.
Диффузиялық қабаттың бір бөлігінің ажырауы нәтижесінде сырғанау шекарасында пайда болатын потенциал деп аталады. электрокинетикалық потенциал(Зета потенциалы  ).
).
Айнала қарсы иондар қабаты және қос электр қабаты бар дисперсті фазаның бөлшектері деп аталады. мицелла.
Коллоидты мицеллаларды жазу ережелері:


1-1 зарядтау электролиті
T – дисперсті фазаның бір бөлігі.
АА - тығыз және диффузиялық бөліктер арасындағы шекара.
BB - сырғанау шекарасы.
Сырғанау шекарасы АА сызығымен сәйкес келуі немесе сәйкес келмеуі мүмкін.
Зета потенциалы нөлге тең рН мәні деп аталады изоэлектрлік нүкте.
CaCl 2 + Na 2 SO 4 → CaSO 4 ↓ + 2NaCl
1. CaCl 2 артық
CaCl 2 ↔ Ca 2+ + 2Cl -
(CaSO 4 m∙nCa 2+ 2( n-x)Cl - ) 2 x + x Cl - - мицеллаларды жазады.
CaSO 4 м - толтырғыш.
CaSO 4 m∙nCa 2+ ядро болып табылады.
CaSO 4 m∙nCa 2+ 2( n-x)Cl - бөлшек.
2. Na 2 SO 4 артық
Na 2 SO 4 ↔2Na + + SO 4 2-
(CaSO 4 m∙nSO 4 2- 2(n-x)Na + ) 2x- 2xNa + - мицелла
CaSO 4 м - толтырғыш.
CaSO 4 m∙nSO 4 2 + ядро болып табылады.
CaSO 4 m∙nSO 4 2- 2(n-x)Na + - бөлшек
Гельемгольц-Смолуховский теңдеуі

 - шекаралардың орын ауыстыруының сызықтық жылдамдығы (электросмоста).
- шекаралардың орын ауыстыруының сызықтық жылдамдығы (электросмоста).
 - конденсатор пластиналарындағы потенциалдар айырымы (электросмоста).
- конденсатор пластиналарындағы потенциалдар айырымы (электросмоста).


 - ерітіндінің көлемдік шығыны, С- шаршы көлденең қимажасушалар.
- ерітіндінің көлемдік шығыны, С- шаршы көлденең қимажасушалар.

Еэлектр өрісінің кернеулігі болып табылады.


 (электросмос үшін).
(электросмос үшін).
Ағын потенциалы үшін:

 - потенциал
- потенциал
 - мембраналық қысым
- мембраналық қысым
Әдетте, электрофоретикалық және электроосмотикалық қозғалғыштықтардың мәні есептелгеннен аз. Бұл мыналарға байланысты:
Релаксациялық әсер (дисперсті фазаның бір бөлігінің қозғалысы кезінде иондық атмосфераның симметриясы бұзылады).
Электрофоретикалық тежеу (қарсы иондардың қозғалысы нәтижесінде қосымша үйкелістің пайда болуы).
Электр өткізгіш бөлшектер жағдайында ағын сызығының бұрмалануы.
Беттік керілу мен потенциал арасындағы байланыс. Липпман теңдеуі.
DEL түзілуі жүйенің оның беттік энергиясын азайтуға ұмтылуына байланысты өздігінен жүреді. Тұрақтылық контекстінде ТЖәне бТермодинамиканың бірінші және екінші заңдарының жалпыланған теңдеуі келесідей:
 (2)
(2)
(3), (1)=(3) =>
=>

 - 1-ші Липпман теңдеуі.
- 1-ші Липпман теңдеуі.
 зарядтың беттік тығыздығы болып табылады.
зарядтың беттік тығыздығы болып табылады.
 - дифференциалды сыйымдылық.
- дифференциалды сыйымдылық.
 - 2-ші Липпман теңдеуі.
- 2-ші Липпман теңдеуі.
МЕН- сыйымдылық.
1-ші Липпман теңдеуін және негізгі адсорбция теңдеуін шешеміз:
 ,
,


 , Содан кейін
, Содан кейін
 - Нернст теңдеуі
- Нернст теңдеуі
 ,
,
 ,
,




 - электрокапиллярлық қисық теңдеуі (ЭКС).
- электрокапиллярлық қисық теңдеуі (ЭКС).
IN  :
: , Бірақ
, Бірақ 
Катиондық беттік белсенді заттар (БАЗ) ЭКК катодтық тармағын азайтады.
Анионды беттік-белсенді заттар (БАЗ) ЭКҚ-ның анодтық тармағын азайтады.
Иондық емес беттік-белсенді заттар (NSA) ECC ортаңғы бөлігін азайтады.
Дисперсті жүйелердің тұрақтылығы. Сына қысымы.
Дисперстік жүйелерді бөлуге болады:
Термодинамикалық тұрақсыз жүйелер метатұрақты күйге өтуіне байланысты кинетикалық тұрақты болуы мүмкін.
Тұрақтылықтың екі түрі бар:
Седиментацияның тұрақтылығы (ауырлық күшіне қатысты).
Агрегативті тұрақтылық. (жабысуға қатысты)
Коагуляцияагрегаттық тұрақтылықтың жоғалуына әкелетін бөлшектердің бір-біріне жабысу процесі. Коагуляция температура, рН, араластыру, ультрадыбыстық өзгерістерден туындауы мүмкін.
Коагуляцияны ажыратыңыз:
Қайтымды.
Қайтымсыз.
Коагуляция электролиттерді енгізу арқылы жүреді.
Коагуляция ережелері:

Фильм- бұл екі интерфейс арасында орналасқан жүйенің бөлігі.
бөлінетін қысымжақындап келе жатқан беткі қабаттардың өзара әрекеттесуі нәтижесінде пленка қалыңдығының күрт төмендеуімен пайда болады.

«-» - пленка қалыңдығы азайған кезде ажырау қысымы артады.
P 0 – аралық қабаттың жалғасы болып табылатын көлемді фазадағы қысым.
P 1 - пленкадағы қысым.
Тұрақтылық теориясы. DLFO (Дерягин, Ландау, Фэйрвэй, Овербек).
DLVO теориясына сәйкес ажырау қысымында екі компонент бөлінеді:
электростатикалық P E (оң, ол электростатикалық серпіліс күштеріне байланысты). Қабық қалыңдығының жоғарылауымен Гиббс энергиясының төмендеуіне сәйкес келеді.
Молекулалық PM (теріс, тартымды күштердің әрекетіне байланысты). Ол химиялық беттік күштердің әсерінен қабықтың қысылуынан туындайды, күштердің әсер ету радиусы 400 кДж/моль ретті энергиямен оннан бір нм құрайды.
Толық әрекеттесу энергиясы:

 - жүйе жалпы тұрақты
- жүйе жалпы тұрақты
 - тұрақсыз жүйе
- тұрақсыз жүйе
П  оң компонент.
оң компонент.
Көбею жұқа қабықшаларды сығу кезінде потенциалдық энергияның артуына байланысты. Қалың қабықшалар үшін артық ион энергиясы компенсацияланады және дисперсиялық ортаның негізгі бөлігіндегі энергетикалық әрекеттесуге тең.
Егер  (
( - пленка қалыңдығы,
- пленка қалыңдығы,  - ионның радиусы) қабықшаның жұқаруы ондағы ең аз беттік энергиясы бар молекулалар мен иондардың жойылып, азаюына әкеледі. Көршілес бөлшектердің саны азаяды, соның нәтижесінде қабықшада қалған бөлшектердің потенциалдық энергиясы артады.
- ионның радиусы) қабықшаның жұқаруы ондағы ең аз беттік энергиясы бар молекулалар мен иондардың жойылып, азаюына әкеледі. Көршілес бөлшектердің саны азаяды, соның нәтижесінде қабықшада қалған бөлшектердің потенциалдық энергиясы артады.


DLVO теориясы бөлшектердің өзара әрекеттесуін пластиналардың өзара әрекеттесуі ретінде қарастырады.

Бөлшектер өзара әрекеттеспейді



 - Лаплас теңдеуі,
- Лаплас теңдеуі,  ,
,


Әлсіз зарядталған беттерге арналған
Жоғары зарядталған беттер үшін:

Молекулалық компонент екі атомның әрекеттесуі болып табылады:
 ~
~
Атомның бетпен әрекеттесуі:

Екі жазбаны алайық:
D  Молекулалық компонентті алу үшін оң және сол пластиналар атомдарының барлық әрекеттесу энергияларын жинақтау керек.
Молекулалық компонентті алу үшін оң және сол пластиналар атомдарының барлық әрекеттесу энергияларын жинақтау керек.
Қайда  - Гамакер тұрақтысы (өзара әрекеттесетін денелердің табиғатын ескереді).
- Гамакер тұрақтысы (өзара әрекеттесетін денелердің табиғатын ескереді).
Бұл. жүйедегі бөлшектердің әрекеттесу энергиясын потенциалдық қисық сызықтар арқылы көрсетуге болады.
I – негізгі әлеуетті минимум. Бұл қайтымсыз коагуляция аймағы, тарту күштері басым.
II – агрегаттық тұрақтылық аймағы, итеруші күштер басым.
III – қайталама потенциалдық минимум (немесе флокуляция аймағы). Дисперсті фаза бөлшектерінің арасында электролит қабаты болады, ал бөлшектер бөлініп, агрегаттық тұрақтылық аймағына ауыса алады.

1-қисық – жүйе агрегаттық тұрақты.
2-қисық I аймақта тұрақты, II аймақта тұрақты емес.
3-қисық – жүйеде коагуляция пайда болды.
4 қисық – 4 нүктеде, әрекеттесудің толық энергиясы U=0,  , бұл экстремум нүктесі жылдам коагуляцияның басталуына сәйкес келеді.
, бұл экстремум нүктесі жылдам коагуляцияның басталуына сәйкес келеді.
Екі жағдай бар:
1. Әлсіз зарядталған беттер:
U \u003d U E + U M \u003d 0
 (1)
(1)
2)

 (2)
(2)



 - бұл коагуляция процесінің басына сәйкес келетін қабаттың қалыңдығы.
- бұл коагуляция процесінің басына сәйкес келетін қабаттың қалыңдығы.






 - әлсіз зарядталған беттер үшін
- әлсіз зарядталған беттер үшін
 Содан кейін
Содан кейін 
2. Жоғары зарядталған беттер үшін:
 (1)
(1)
2)

 (2)
(2)


 (3)
(3)
 ,
,
Шаршы алайық (3)

Коагуляция:
Арнайы адсорбцияда иондар үстіңгі эквивалентті мөлшерде адсорбциялануы мүмкін, осылайша бет өзінің зарядын өзгерте алады. Беткі қабат қайта зарядталуда.
Арнайы адсорбция жағдайында тек қарама-қарсы таңбалы иондар ғана емес, сонымен қатар бір ион да адсорбциялануы мүмкін.
Егер беттік таңбалы иондар адсорбцияланса, онда беткі қабатта потенциалдың төмендеуі емес, оның өсуі болады.

Бейтараптандыру коагуляциясы (әлсіз зарядталған бөлшектердің қатысуымен жүреді және коагуляциялық электролиттің зарядына ғана емес, сонымен қатар тығыз және диффузиялық қабаттар шекарасындағы потенциалға байланысты).
Смолуховскийдің жылдам коагуляция теориясы.

Коагуляция жылдамдығының электролит концентрациясына тәуелділігі.
I – коагуляция жылдамдығы төмен,
II – коагуляция жылдамдығы электролит концентрациясына іс жүзінде пропорционал.
III – жылдам коагуляция аймағы, жылдамдығы іс жүзінде концентрацияға тәуелді емес.
Негізгі нүктелер:
Бастапқы золь монодисперсті, ұқсас бөлшектер сфералық пішінге ие.
Барлық бөлшектердің соқтығысуы тиімді.
Екі негізгі бөлшек соқтығысқанда екінші реттік бөлшек пайда болады. Екінші + бастапқы = үшінші. Біріншілік, екіншілік, үшіншілік – көптік.
Химиялық кинетика тұрғысынан коагуляция процесін мына теңдеумен сипаттауға болады:
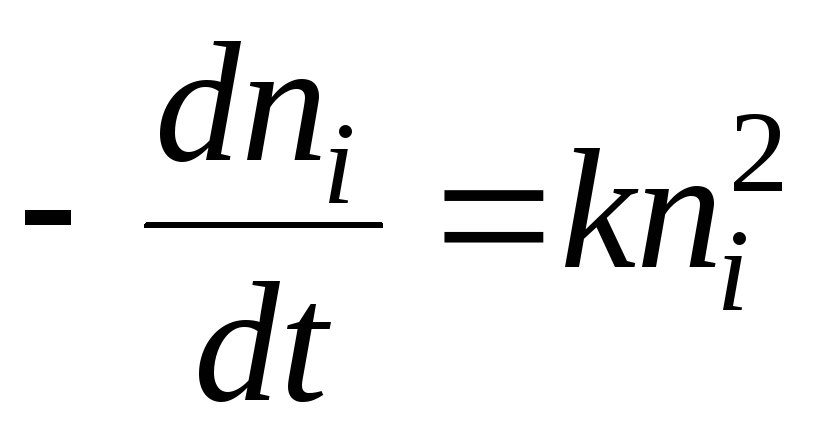
Шешімі мына теңдеу болады: 
 - жартылай коагуляция уақыты. Бұл золь бөлшектерінің саны 2 есе азайған уақыт.
- жартылай коагуляция уақыты. Бұл золь бөлшектерінің саны 2 есе азайған уақыт.

 ,
,
 ,
,
 ,
,


Көбейту артқан сайын коагуляция қисықтарының максимумы үлкен мәндерге қарай жылжиды  .
.
Кемшіліктері:
Монодисперстілік туралы болжам.
Барлық соқтығыстардың тиімділігі туралы болжам.




 - шар,
- шар, ,
,





