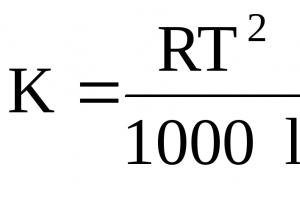افزایش نقطه جوش محلول های غیر الکترولیتی. انجماد اجسام بزرگ بیولوژیکی نمودار کاهش نقطه انجماد محلول های آبی
دو پیامد مهم از قانون رائول به دست می آید:
1) محلول ها در دمای بالاتر از یک حلال خالص می جوشند.
2) محلول ها در دمای کمتری نسبت به حلال خالص منجمد می شوند.
بیایید با جزئیات بیشتری به آنها نگاه کنیم.
جوشش فرآیند فیزیکی تبدیل مایع به حالت گازی یا بخار است که در آن حباب های گاز در سراسر مایع ایجاد می شود.
یک مایع با فشار آن می جوشدبخار اشباع شده برابر با فشار خارجی می شود. اگر فشار خارجی (به عنوان مثال، اتمسفر) تغییر نمی کند، واز آنجایی که مایع یک ماده منفرد و از نظر شیمیایی خالص است، جوشاندن آن در یک ظرف گرم شده باز در دمای ثابت اتفاق می افتد تا زمانی که فاز مایع کاملاً از بین برود.
بنابراین، در فشار اتمسفر 101.325 کیلو پاسکال، نقطه جوش آب تصفیه شده (مقطر) 100 درجه سانتیگراد یا 373.16 کلوین است.
اگر مقداری ماده غیر فرار در H 2 O حل شود، فشار بخار اشباع آن کاهش می یابد. برای اینکه محلول حاصل بجوشد، لازم است آن را تا دمای بالاتر از 373.16 کلوین گرم کنید، زیرا فقط در چنین شرایطی فشار بخار اشباع حلال دوباره برابر فشار اتمسفر می شود.
انجماد یا کریستالیزاسیونیک پدیده فیزیکی است که با تبدیل مایع به جامد همراه است. علاوه بر این، ساختارهای کریستالی در کل حجم مایع تشکیل می شود.
فرآیند انجماد زمانی شروع می شود که فشار بخار اشباع بالای مایع برابر با فشار بخار اشباع بالای بلورهای جامد آن شود.
اگر فشار خارجی (اتمسفر) ثابت بماند، واگر مایع حاوی ناخالصی های خارجی نباشد، در طول فرآیند تبلور، دمای مایع خنک شده تا زمانی که فاز مایع کاملاً به جامد تبدیل شود، ثابت می ماند.
در فشار اتمسفر برابر با 101.325 کیلو پاسکال، آب مقطر در دمای 0 درجه سانتیگراد (273.16 کلوین) منجمد می شود. فشار بخار اشباع آب بالای یخ و مایع در این حالت 613.3 Pa است.
برای یک محلول آبی، فشار بخار اشباع حلال در دمای صفر درجه سانتی گراد کمتر از 613.3 Pa خواهد بود و یخ بالای آن بدون تغییر باقی می ماند. یخ ریخته شده در چنین محلولی به دلیل متراکم شدن بخار اضافی بالای آن به سرعت ذوب می شود.
تنها با کاهش دما می توان فشار بخار اشباع بالای فاز مایع و جامد را دوباره یکسان کرد و فرآیند کریستالیزاسیون را آغاز کرد.
به طور تجربی ثابت شد که افزایش نقطه جوش ( تی کیپ ) و کاهش دمای انجماد راه حل ( تی قائم مقام ) در مقایسه با یک حلال خالص به طور مستقیم با غلظت مولی املاح متناسب است. از نظر ریاضی، این را می توان به صورت زیر نوشت:
تی کیپ محلول -t جوش. p-body =t جوش. =ام
t معاون معاون r-tel –t راه حل =t معاون = کیلومتر
جایی کهمتر– غلظت مولیحل شونده؛Eوک- به ترتیب، بولیوسکوپی (لات.ابولیو- ثابت) و کرایوسکوپیک (یونانی "krios" - سرد) که مقادیر آنها فقط به طبیعت بستگی داردحلال (جدول 7).
جدول 7.ثابت های E بولیوسکوپی و K کرایوسکوپیک برخی از حلال ها (درجه بر مول)
ثابت های بولیوسکوپی و کرایوسکوپی حلال نشان می دهد که چند درجه افزایش می یابد نقطه جوش و نقطه انجماد کاهش می یابد محلولی که از حل یک مول غیر الکترولیت در یک کیلوگرم حلال به دست می آید. متر = 1 مول در کیلوگرم).
برای تعیین مقادیر E و K ابتدا به صورت تجربی بیل Dt را تعیین کنید. و معاون Dt محلول های بسیار رقیق (m<< 1), а затем полученные данные пересчитывают или экстраполируют для растворов сm= 1 моль/кг.
جایی کهآر- ثابت گاز جهانی؛تی- نقطه جوش حلال؛ - گرمای ویژه تبخیر حلال.

جایی کهتی- دمای ذوبراه حلموردل- گرمای ویژه همجوشیحلال.
بدین ترتیب، محلول های مواد با طبیعت متفاوت، اما با غلظت مولی یکسان، به طور همزمان می جوشند و منجمد می شونددرجه حرارت.
یک تفاوت مهم وجود دارد که باید به آن توجه کردمحلول از یک حلال خالص اگر دومی به طور ثابت بجوشد و یخ بزندسپس دماراه حل ها این کار را در بازه زمانی انجام می دهنددما، یعنی با جوشیدن آنها، دما دائماً افزایش می یابد و وقتی یخ می زنند، کاهش می یابد. این به دلیل این واقعیت است که حذف از فاز مایع استحلال به شکل بخار یا کریستال های جامد منجر به افزایش غلظت مولی محلول می شود، زیرا در طی فرآیند جوشاندن و انجماد، ماده محلول به مقدار بدون تغییر در فاز مایع باقی می ماند (تا زمانی که کاملاً بجوشد یا منجمد شود) و جرم حلال مایع کاهش می یابد.
در اندازه گیری های عملی نقطه انجماد یا جوش محلول، لحظه ظهور اولین بلورهای جامد در آن ثبت می شود (برای تی قائم مقام ) یا حباب های گاز (برای تی کیپ ).
خاصیت محلول ها برای پایین آوردن نقطه انجماد باعث می شود از آنها به عنوان خنک کننده استفاده شود.
بنابراین، محلول های برخی از مواد آلی و معدنی به عنوان ضد یخ برای خنک کردن موتورهای احتراق داخلی هنگام کار در شرایط مختلف آب و هوایی استفاده می شود.
تنزل دادن دمای انجماد محلول ها برای موجودات زنده اهمیت زیادی دارد. بنابراین، مایع موجود در سلول های آنها محلولی از مواد معدنی و آلی مختلف است. خوددمای انجماد زیر صفر است O C (273.16 ک ) بنابراین سلول ها تحت هیپوترمی نمی میرند.
به لطف این پدیده، گیاهان در زمستان حفظ می شوند. علاوه بر این، هر چه غلظت مواد در مایع سلولی بیشتر باشد، گیاه دمای خارجی کمتری را تحمل می کند.
در عین حال، برای کاهش نقطه انجماد محلول در سلول های سرد شده، فرآیند هیدرولیز ترکیبات با وزن مولکولی بالاتر به ترکیبات با وزن مولکولی پایین (به عنوان مثال کربوهیدرات به گلوکز) افزایش می یابد.
خواص تجمعی محلول ها آن دسته از خواصی هستند که فقط به غلظت ذرات ماده محلول بستگی دارد، اما به ترکیب شیمیایی آن بستگی ندارد. در این بخش، چهار خاصیت تجمعی محلول ها مورد بررسی قرار می گیرد: 1) کاهش فشار بخار، 2) افزایش نقطه جوش، 3) کاهش نقطه انجماد، 4) فشار اسمزی. تمام این چهار ویژگی برای محلول های حاوی مواد محلول غیرفرار، یعنی. آن دسته از مواد محلول که فشار بخار آنها ناچیز است.
کاهش فشار بخار محلول ها
ذرات حلال خالص می توانند از کل سطح مایع وارد فاز بخار شوند (شکل 6.34). اما در محلول به دلیل وجود ذرات املاح، انتقال ذرات حلال از سطح به فاز بخار مشکل است. اگر فشار بخار ماده حل شده کمتر از حلال باشد، فشار بخار محلول کمتر از حلال خالص است. این الگو را می توان بر اساس قانون رائول درک کرد (به بخش قبل مراجعه کنید). در حالت شدید که یک محلول حاوی یک املاح کاملاً غیر فرار است، فشار بخار محلول تنها توسط ذرات حلال ایجاد میشود. در شکل شکل 6.35 نمودار فاز فشار بخار-ترکیب را برای چنین موردی نشان می دهد. البته، این حالت شدید کاملاً فرضی است، زیرا در واقع همه جامدات دارای مقداری فشار بخار هستند، اگرچه ممکن است بسیار کوچک باشد.
برنج. شکل 6.35 نشان می دهد که با افزایش کسر مولی املاح غیر فرار B، فشار بخار محلول کاهش می یابد. با استفاده از قانون رائول
برنج. 6.34. ذرات املاح غیرفرار مانع از حذف ذرات حلال از سطح مایع می شوند و در نتیجه فشار بخار را کاهش می دهند.
می توان معادله ای به دست آورد که کاهش فشار بخار را برای محلول های رقیق توصیف می کند. طبق قانون رائول، فشار بخار حلال برابر است با
برای یک سیستم دو جزئی ما داریم
![]()
و بنابراین
![]()
اگر این عبارت را با معادله (5) جایگزین کنیم، به دست می آید
نتیجه می شود که
این نشان می دهد که کاهش فشار بخار متناسب با کسر مولی املاح غیر فرار است.
افزایش نقطه جوش محلول
محلولی حاوی املاح غیر فرار نسبت به حلال خالص فرار کمتری دارد. بنابراین جوشش آن در دمای بالاتری نسبت به جوشاندن یک حلال خالص شروع می شود. در شکل شکل 6.36 وابستگی فشار بخار به دما را برای یک حلال خالص و برای محلولی حاوی یک ماده محلول غیرفرار نشان می دهد. افزایش نقطه جوش متناسب با کاهش فشار بخار است:
با استفاده از این عبارت و قانون رائول، میتوانیم عبارت دیگری را که کاهش نقطه جوش را به ترکیب محلول مرتبط میکند، استخراج کنیم.
![]()
در این عبارت به معنای مولی بودن املاح است. ما قبلاً در بخش با اصطلاح "مولالیته" مواجه شده ایم. 4.2. یعنی تعداد مول های املاح در 1 کیلوگرم حلال.
مقدار ثابت بولیوسکوپی حلال نامیده می شود. به آن ثابت افزایش نقطه جوش مولال یا به سادگی ثابت افزایش نقطه جوش نیز می گویند. روی میز جدول 6.5 مقادیر ثابت را برای برخی از حلال ها نشان می دهد.

برنج. 6.35. نمودار فاز ترکیب فشار بخار برای محلولی حاوی املاح غیر فرار.

برنج. 6.36. افزایش نقطه جوش یک محلول در فشار اتمسفر.
تعیین تجربی افزایش نقطه جوش یک محلول
برای تعیین تجربی افزایش نقطه جوش یک محلول می توان از روش لندزبرگر استفاده کرد. بخار حلال از یک حلال واقع در یک فنجان مدرج عبور داده می شود (شکل 6.37). آزاد شدن آنتالپی تبخیر در نتیجه تراکم بخار باعث می شود که حلال در بشر بجوشد. این امر از گرمای بیش از حد جلوگیری می کند، که اگر دمای مایع از نقطه جوش آن بالاتر رود، می تواند رخ دهد.
پس از اندازه گیری نقطه جوش یک حلال خالص، آن را خنک کرده و مقدار وزن شده املاح را در آن حل کنید. سپس بخارات حلال از محلول حاصل عبور داده می شود تا زمانی که جوشیدن شروع شود. در این لحظه دمای محلول را اندازه گیری کنید. از آنجایی که افزایش نقطه جوش یک محلول در مقایسه با یک حلال خالص معمولاً اندک است، لازم است دما را با دقت کافی اندازه گیری کرد. برای این منظور از دماسنج بکمن استفاده می شود. غلظت محلول با دانستن جرم ماده محلول و حجم نهایی محلول که با استفاده از یک بشر مدرج تعیین می شود، تعیین می شود.
جدول 6.5. حلال های دائمی بولیوسکوپی

برنج. 6.37. نصب برای تعیین افزایش نقطه جوش یک محلول.
تعیین جرم مولی یک ماده با افزایش نقطه جوش محلول آن
برای تعیین جرم مولی املاح می توان از روش لندزبرگر استفاده کرد. فرآیند تعیین شامل سه مرحله است:
1) تعیین تجربی افزایش نقطه جوش.
2) بیان مولالیته املاح از طریق جرم مولی ناشناخته و جرم های آزمایشی تعیین شده املاح و حلال، که مربوط به افزایش یافت شده در نقطه جوش است.
3) تعیین ثابت بولیوسکوپی با استفاده از جداول یا تجربی. در مورد دوم، آزمایش باید با استفاده از همان حلال، اما یک املاح متفاوت با جرم مولی مشخص تکرار شود.
عبارت لازم برای molality از تعریف آن به دست آمده است:
![]()
تعداد مول های املاح و جرم حلال بر حسب گرم است. مقدار نشان دهنده جرم املاح بر حسب کیلوگرم است. از آنجا که
![]()
که جرم ماده محلول بر حسب گرم، جرم مولی ناشناخته ماده محلول است، می توانیم عبارت (7) را به شکل زیر تبدیل کنیم:
این عبارت برای مولالیته املاح است که در مرحله دوم تعیین جرم مولی آن ضروری است.
اگر اکنون این عبارت و همچنین مقدار AT یافت شده در مرحله اول و مقدار یافت شده در مرحله سوم آزمایش را با معادله (6) جایگزین کنیم، به دست می آوریم.

با استفاده از این معادله، اجازه دهید جرم مولی مجهول را بر حسب مقادیر تعیین شده تجربی بیان کنیم:

پروپانون دارای نقطه جوش پروپانون محلول 1.00 گرم از یک ماده غیر فرار است. نقطه جوش محلول حاصل 57.4 درجه سانتیگراد است. اجازه دهید جرم مولی و جرم مولکولی نسبی ماده حل شونده را در صورتی محاسبه کنیم که ثابت بولیوسکوپی پروپانون برابر است.
هنگامی که 1.00 گرم از یک ماده ناشناخته در 10 گرم حلال حل شد، نقطه جوش 1.2 درجه سانتیگراد افزایش یافت. با جایگزینی این و سایر کمیت های شناخته شده به معادله (8)، به دست می آوریم
بنابراین، جرم مولی املاح غیرفرار 142.5 گرم بر مول است و از این رو جرم مولکولی نسبی آن 142.5 است.
کاهش نقطه انجماد محلول
در بخش قبل نشان داده شد که افزودن جزء دوم به مایع منجر به کاهش نقطه انجماد آن می شود (شکل 6.33 را ببینید). کاهش نقطه انجماد AT به مولالیته املاح بستگی دارد (با توجه به نوع رابطه ای که افزایش نقطه جوش محلول را تعیین می کند):
ثابت کرایوسکوپیک حلال کجاست، که در غیر این صورت ثابت فرورفتگی نقطه انجماد مولی یا به سادگی ثابت فرورفتگی نقطه انجماد نامیده می شود.
مقادیر ثابت کرایوسکوپی برای برخی از حلال ها در جدول آورده شده است. 6.6.
برای تعیین تجربی کاهش دمای انجماد، نصب به صورت شماتیک در شکل 1 نشان داده شده است. 6.38. در باطن
جدول 6.6. حلال های دائمی کرایوسکوپی

برنج. 6.38. نصب برای تعیین کاهش نقطه انجماد یک محلول.
جرم شناخته شده ای از حلال در یک لوله آزمایش شیشه ای مدرج قرار می گیرد. حلال به آرامی سرد می شود و به طور مداوم هم می شود تا خنک شدن فوق العاده به حداقل برسد (بخش قبل را ببینید). در این حالت دما هر نیم دقیقه با استفاده از دماسنج بکمن تعیین می شود. بر اساس قرائت های آن، یک منحنی خنک کننده ساخته می شود که بر روی آن دمای انجماد تعیین می شود. سپس حلال را حرارت می دهند تا ذوب شود و جرم مشخصی از املاح به آن اضافه شود. محلول را هم می زنیم تا ماده اضافه شده به طور کامل حل شود. سپس محلول سرد می شود و هر نیم دقیقه دما را ثبت می کند و نقطه انجماد جدید تعیین می شود.
تعیین جرم مولکولی نسبی یک ماده با کاهش نقطه انجماد محلول آن
فرورفتگی نقطه انجماد محلول یک ماده غیرفرار را می توان برای تعیین وزن مولکولی نسبی آن استفاده کرد.
در روش رستا بر اساس این اصل، حلال است
کافور، که دارای یک ثابت کرایوسکوپی بزرگ است (جدول 6.6 را ببینید). روش های دیگر برای این منظور از اسید استیک یا حلال های دیگر استفاده می کنند.
نقطه انجماد اسید استیک 16.63 درجه سانتیگراد است. هنگامی که 2.5 گرم از یک ماده آلی ناشناخته به 40 گرم از این اسید اضافه شد، نقطه انجماد محلول حاصل به 15.48 درجه سانتیگراد کاهش یافت. بیایید جرم مولکولی نسبی املاح ناشناخته را محاسبه کنیم.
برای حل مسئله باید معادله ای شبیه معادله (8) استخراج کرد. این را می توان با استفاده از معادلات (9) و (7) به همان روشی که معادله (8) در بالا با استفاده از معادلات (6) و (7) به دست آمد انجام داد. در نتیجه ما پیدا می کنیم
مشخص است که . از روی میز 6.6 پیدا می کنیم. با جایگزینی این مقادیر به معادله (10)، پیدا می کنیم
بنابراین وزن مولکولی نسبی املاح آلی 212 است.
فشار اسمزی
اسمز عبور خود به خودی یک حلال از یک غشای نیمه تراوا از محلول رقیق یا حلال خالص به محلول غلیظ است. این پدیده را می توان با استفاده از دستگاه نشان داده شده به صورت شماتیک در شکل 1 نشان داد. 6.39. انتهای عریض لوله که با یک غشای حیوانی (مثلاً مثانه گاو نر) بسته شده است، با محلول قند پر شده و در یک لیوان آب غوطه ور می شود. پس از مدتی، آب از غشاء به محلول قند عبور می کند.
غشایی که اجازه عبور ذرات حلال را می دهد اما اجازه عبور ذرات املاح را نمی دهد غشای نیمه تراوا نامیده می شود. یک غشای نیمه تراوا اجازه می دهد تا ذرات حلال در هر دو جهت عبور کنند. با این حال، از آنجایی که در سمت غشاء که غلظت محلول بیشتر است، برعکس، غلظت حلال کمتر است، در نتیجه انتقال حلال به محلول غلیظ رخ می دهد. این منجر به ایجاد اختلاف فشار در دو طرف غشا می شود. فشاری که باید به محلول غلیظ وارد شود تا از حرکت حلال در غشا جلوگیری شود، فشار اسمزی نامیده می شود. با حرف یونانی p نشان داده می شود.
فشار اسمزی یک خاصیت جمعی است زیرا فقط به غلظت ذرات محلول بستگی دارد و به ترکیب شیمیایی آنها بستگی ندارد.
فشار اسمزی نقش مهمی در فرآیندهای بیولوژیکی دارد. به عنوان مثال، در حیوانات، برخی از انواع سلول ها مانند گلبول های قرمز حاوی محلول نمکی هستند. این سلول ها توسط غشای پلاسمایی محدود می شوند. در یک محیط آبی، گلبول های قرمز تحت اسمز قرار می گیرند، متورم می شوند و می ترکند. با این حال، اگر آنها در معرض محلول نمک غلیظ تری قرار گیرند، سلول ها کوچک می شوند.

برنج. 6.39. آزمایشی که اثر فشار اسمزی را نشان می دهد.
سلول های گیاهی حاوی محلول های نمکی در حفره های ویژه - واکوئل ها هستند. واکوئل توسط یک لایه نازک از سیتوپلاسم احاطه شده است که دارای خواص یک غشای نیمه تراوا است و جذب آب توسط سلول گیاهی را کنترل می کند.
اگر فشار وارد شده به محلول غلیظ از فشار اسمزی بیشتر شود، حلال از محلول غلیظ از طریق غشاء به محلول رقیق حرکت می کند. این فرآیند اسمز معکوس نامیده می شود. کاربرد صنعتی برای به دست آوردن آب آشامیدنی از آب دریا پیدا می کند.
آزمایشات مشابه آنچه در بالا توضیح داده شد با محلول قند نشان می دهد که: 1) در دمای ثابت، فشار اسمزی مستقیماً با اختلاف غلظت در محلول های جدا شده توسط یک غشاء متناسب است. 2) در ثابت
اختلاف غلظت، فشار اسمزی مستقیماً با دمای مطلق متناسب است.
رابطه بین فشار اسمزی و دما شبیه معادله حالت یک گاز ایده آل است (به بخش 3.1 مراجعه کنید). این معادله وانت هاف نامیده می شود:
در این معادله - فشار اسمزی، K - حجم محلول، - تعداد مولهای ماده محلول، T - دمای مطلق، - ثابت گاز مولی. معادله (11) را می توان به شکل دیگری ارائه کرد:
که در آن c غلظت محلول است
معادله van't Hoff تقریبی است و فقط برای محلول های رقیق معتبر است.
تعیین جرم مولکولی نسبی یک املاح با فشار اسمزی محلول
برای تعیین وزن مولکولی نسبی یک املاح از روی فشار اسمزی که به صورت تجربی تعیین می شود، می توان از معادله وانت هاف استفاده کرد. این روش به ویژه برای تعیین میانگین وزن مولکولی نسبی پلیمرها و سایر مواد درشت مولکولی مفید است.
محلول قندی با غلظت 2.5 گرم بر دسی متر مکعب فشار اسمزی اتمسفر در دمای 25 درجه سانتی گراد ایجاد می کند. بیایید جرم مولکولی نسبی املاح را محاسبه کنیم.
مقدار مورد نظر جرم مولکولی نسبی ماده حل شونده را می توان مستقیماً با استفاده از معادله وانت هاف (11) یافت. داده های اولیه کار به شرح زیر است:

با جایگزینی این مقادیر در معادله Van't Hoff، متوجه می شویم
مقادیر غیر طبیعی وزن مولکولی نسبی
در بالا نشان داده شد که برای تعیین وزن مولکولی نسبی، می توان از سه ویژگی جمعی مختلف محلول ها استفاده کرد، یعنی: 1) افزایش نقطه جوش. 2) کاهش دمای انجماد؛ 3) فشار اسمزی
مقادیر غیر طبیعی وزن مولکولی نسبی می تواند زمانی رخ دهد که یک املاح در محلول به هم متصل یا جدا شود. به عنوان مثال، اسیدهای کربوکسیلیک می توانند در حلال های آلی ترکیب شوند تا دایمرها را تشکیل دهند (شکل 6.26 را ببینید). این به دلیل تشکیل پیوندهای هیدروژنی رخ می دهد. الکترولیت هایی مانند کلرید سدیم در محلول های آبی تجزیه می شوند:
بنابراین، خواص تجمعی محلول های الکترولیت تنها به غلظت و نه به ماهیت شیمیایی یون های املاح موجود در محلول بستگی دارد. در محلول کلرید سدیم به ازای هر مول املاح دو مول یون وجود دارد. به همین دلیل، وزن مولکولی نسبی که با افزایش نقطه جوش محلول بدست می آید تقریباً نصف آن چیزی است که از فرمول شیمیایی محاسبه می شود.
با مقایسه مقادیر جرم مولکولی نسبی که به طور تجربی از خواص جمعی با مقادیر محاسبه شده از فرمول های شیمیایی املاح بدست می آید، می توان درجه ارتباط یا تفکیک املاح را تعیین کرد.
انجماد اجسام بیولوژیکی بزرگ
جالبترین حوزه کاربرد کرایوبیولوژی - علم تأثیر دماهای پایین و فوقپایین بر روی اجسام بیولوژیکی - جستجوی احتمالات برای حفظ موجودات زنده یا اندامهای فردی در حالت انجماد عمیق است. تکنیک انجماد سلولهای منفرد یا مثلاً جنینها به خوبی توسعه یافته است، اما انجماد قابل برگشت (یعنی حفظ حیات پس از ذوب) اجسام بزرگ با موانع جدی روبرو میشود. مشکل اصلی این است که با حجم و جرم زیاد دستیابی به خنک کننده یکنواخت دشوار است. انجماد ناهموار منجر به آسیب جدی و غیرقابل برگشت به سلول ها و بافت ها می شود. در همین حال، حل این مشکل می تواند به عنوان مثال به ایجاد بانکی از اعضای بدن برای پیوند و در نتیجه نجات جان هزاران بیمار کمک کند. وسوسهانگیزتر این است که ممکن است یک بیمار به شدت بیمار را در حالت خنکی عمیق نگه دارید تا زمانی که دارو بتواند به او کمک کند، شاید چند دهه بعد.
بزرگترین خطر در هنگام انجماد آسیب مکانیکی به غشای سلولی از کریستال های یخ حاصل است. آنها با تشکیل هر دو در خارج و که بسیار خطرناک تر است، در داخل سلول ها، لایه دو مولکولی لیپیدی را که این غشاها را تشکیل می دهد، پاره می کنند.
برای محافظت از سلول ها از آسیب در هنگام انجماد، از مواد خاصی استفاده می شود - محافظ های سرما. آنها به دو گروه نافذ سلولی یا درون سلولی (دی متیل سولفوکسید (DMSO)، استامید، پروپیلن گلیکول، گلیسرول، اتیلن گلیکول) و غیرنفوذ یا برون سلولی (پلی اتیلن گلیکول ها و پلی اتیلن اکسیدها، فیکل، ساکارز، ترهالوز، و غیره) که به صورت بیرونی عمل می کنند، به صورت اسمزی آب را از سلول خارج می کنند.
دومی مفید است: هرچه آب کمتری در سلول باقی بماند، دیرتر یخ کمتری تشکیل می شود. اما حذف آب منجر به افزایش غلظت نمک های باقی مانده در داخل سلول می شود - تا مقادیری که در آن دناتوره شدن پروتئین رخ می دهد. انجمادهای درون سلولی نه تنها نقطه انجماد را کاهش می دهند، بلکه "آب نمک" تشکیل شده در طی کریستالیزاسیون را رقیق می کنند و از دناتوره شدن پروتئین ها جلوگیری می کنند.

پرمصرف ترین آنها گلیسیرین و DMSO هستند. هنگامی که آنها به آب اضافه می شوند، نقطه انجماد آن کاهش می یابد و با نسبت تقریباً 2:1 به کمترین مقدار خود می رسد. این پایین ترین دما نامیده می شود یوتکتیک، یا کرایوهیدرات. با سرد شدن بیشتر چنین مخلوط هایی، اندازه بلورهای یخ به دست آمده آنقدر کوچک است (مقایسه با اندازه سلول کریستالی) که آسیب قابل توجهی به ساختار سلول وارد نمی کند.
اگر بتوان غلظت انجماد را در بافتهای زنده به یوتکتیک رساند، مشکل آسیب بافتهای ناشی از کریستالهای یخ را کاملاً حل میکرد. با این حال، در چنین غلظت هایی، هر محافظ سرمای شناخته شده ای سمی است.
در عمل، از غلظتهای یخساز استفاده میشود که بهطور قابلتوجهی کمتر از غلظتهای یوتکتیک است و در عین حال مقداری از آب همچنان یخ میزند. بنابراین، هنگام استفاده از محلول 27٪ گلیسرول، 40٪ از آب موجود در سلول یک مخلوط یوتکتیک با گلیسرول تشکیل می دهد، در حالی که بقیه منجمد می شوند. با این حال، همانطور که آزمایش های انجام شده در سال های 1954-1960 نشان داد. آدری اسمیت، کریوبیولوژیست انگلیسی، همسترهای طلایی می توانند در شرایطی زنده بمانند که 50 تا 60 درصد از آب موجود در بافت های مغز آنها به یخ تبدیل شده است!
نرخ سرمایش برای حل مشکل انجماد برگشت پذیر اهمیت زیادی دارد. در طول خنک شدن آهسته (در بخار نیتروژن مایع یا در فریزرهای ویژه برنامه)، کریستال های یخ عمدتاً در فضای بین سلولی تشکیل می شوند. با سرد شدن، رشد می کنند و از سلول ها آب می گیرند. همانطور که قبلا ذکر شد، این می تواند به طور قابل توجهی آسیب ناشی از کریستال ها را به سلول ها کاهش دهد - اما غلظت نمک ها در داخل سلول ها به طور قابل توجهی افزایش می یابد و خطر دناتوره شدن پروتئین را افزایش می دهد.
متأسفانه، نرخهای بهینه کاهش دما که بین اثرات مخرب کریستالهای یخ و غلظتهای بالای املاح به خطر میافتد، در بین انواع سلول بسیار متفاوت است. غلظت بهینه مواد برودتی برای آنها نیز متفاوت است. این امر انجماد اندامها و بافتهایی را که شامل چندین نوع مختلف سلول و حتی بیشتر از کل موجودات میشود، پیچیده میکند.
در طول خنک شدن سریع (به عنوان مثال، غوطه ور کردن یک نمونه در نیتروژن مایع)، آب زمان پخش شدن از سلول ها را ندارد. کریستال ها هم در خارج و هم در داخل سلول ها تشکیل می شوند، اما به دلیل خنک شدن سریع تر، بسیار کوچکتر از حالت اول هستند و زمان تشکیل در همه سلول ها را ندارند. در این حالت می توان از غلظت سمی نمک ها اجتناب کرد و مدت زمان قرار گرفتن در معرض آنها و همچنین مدت زمان اثرات مضر انجمادها کوتاهتر است. دومی اجازه استفاده از غلظت های بالاتر را می دهد.
 با سرد شدن به اندازه کافی سریع تا 0 درجه سانتی گراد و کمی پایین تر، آب بلافاصله یخ نمی زند (بلور می شود). ابتدا یک مایع فوق خنک تشکیل می شود. در آزمایشهایی که اسمیت ذکر کرد، او در برخی موارد توانست همسترهای طلایی را تا -6 درجه سانتیگراد بدون تشکیل کریستالهای یخ خنک کند. در همان زمان، پوست و اندام حیوانات نرم باقی ماند. و پس از گرم شدن، همسترها بدون هیچ گونه اثرات مضر قابل مشاهده زنده شدند. زنان باردار (اگر هیپوترمی در نیمه اول بارداری اتفاق افتاده باشد) توله های طبیعی به دنیا آوردند.
با سرد شدن به اندازه کافی سریع تا 0 درجه سانتی گراد و کمی پایین تر، آب بلافاصله یخ نمی زند (بلور می شود). ابتدا یک مایع فوق خنک تشکیل می شود. در آزمایشهایی که اسمیت ذکر کرد، او در برخی موارد توانست همسترهای طلایی را تا -6 درجه سانتیگراد بدون تشکیل کریستالهای یخ خنک کند. در همان زمان، پوست و اندام حیوانات نرم باقی ماند. و پس از گرم شدن، همسترها بدون هیچ گونه اثرات مضر قابل مشاهده زنده شدند. زنان باردار (اگر هیپوترمی در نیمه اول بارداری اتفاق افتاده باشد) توله های طبیعی به دنیا آوردند.
تکنیکی برای انجام عملیات جراحی بر روی پستانداران کوچک تازه متولد شده - به عنوان مثال، موش ها وجود دارد. بیهوشی در این سن عملاً قابل اجرا نیست و به همین دلیل توله ها به سادگی به مدت 15 تا 20 دقیقه خنک می شوند تا تحرک و حساسیت خود را از دست بدهند. یک مورد شناخته شده وجود دارد که طی چنین مطالعاتی (تاثیر برداشتن اندام وومرونازال بر رفتار جوندگان) در آزمایشگاه یکی از مؤسسات مسکو، چندین توله همستر جونگاری تازه متولد شده، به دلیل سهل انگاری آزمایشگر، انجام شد. به سادگی فراموش شده است که روی یک ملافه پنبه ای در اتاقی با دمای -12 درجه سانتیگراد دراز بکشید. پس از استخراج - پس از 2-3 ساعت - آنها کاملاً سفت شدند و بدن آنها به معنای واقعی کلمه "یک ضربه چوبی ایجاد کرد". پس از مدتی در دمای اتاق، توله ها زنده شدند، شروع به حرکت کردند و صداهایی تولید کردند...
مایعات در بدن معمولاً در دمای -1 ... -3 درجه سانتیگراد شروع به یخ زدن می کنند. با این حال، زمانی که مقداری از آب به یخ تبدیل می شود، غلظت املاح در مایع باقی مانده افزایش می یابد و نقطه انجماد آن مایع همچنان کاهش می یابد.
دمای انجماد کامل سیالات بیولوژیکی مختلف بسیار متفاوت است، اما در هر صورت معلوم می شود که زیر -22...-24 درجه سانتیگراد است.
احتمال تشکیل "هسته" کریستال یخ در واحد زمان در یک مایع فوق سرد شده متناسب با حجم این مایع است و به شدت به دما بستگی دارد: در -40 درجه سانتیگراد و در فشار 1 اتمسفر. تبلور آب خالص تقریباً بلافاصله اتفاق می افتد، اما در دماهای حتی پایین تر (حدود 70- درجه سانتیگراد، سرعت رشد کریستال به دلیل افزایش ویسکوزیته آب کاهش می یابد. در نهایت، در دمای حدود 130- درجه سانتیگراد، کریستال رشد به طور کامل متوقف می شود.اگر مایع را به سرعت سرد کنید تا دمای تبلور فعال قبل از اینکه کریستال هایی با اندازه خطرناک زمان تشکیل دهند "بیش از حد" شود، ویسکوزیته آنقدر افزایش می یابد که یک ماده شیشه ای جامد تشکیل می شود. این پدیده نامیده می شود. انتقال شیشه اییا شیشه ای شدن.
اگر بتوان سلول ها یا بافت ها را تا دمای انتقال شیشه ای خنک کرد، می توانند به طور نامحدود در این حالت باقی بمانند و آسیب حاصله به طور غیرقابل مقایسه ای کمتر از سرد شدن با کریستالیزاسیون خواهد بود. در واقع، این می تواند راه حلی برای مشکل حفظ اشیاء بیولوژیکی در حالت انجماد عمیق باشد. درست است، زمانی که سلول ها ذوب می شوند، برای احیای آنها، باید دوباره از محدوده دمایی خطرناک عبور کنند...
سرعت رشد کریستال های یخ در یک سلول را می توان با افزودن ناخالصی هایی به آب که ویسکوزیته آن را افزایش می دهد - گلیسیرین، قندها و غیره کاهش داد. علاوه بر این، موادی وجود دارند که از تشکیل کریستال های یخ جلوگیری می کنند. مثلاً چنین خواصی دارند. پروتئین های ویژه تولید شده توسط ارگانیسم های تعدادی از حیوانات مقاوم به سرما - ماهی های قطب شمال و قطب جنوب، برخی از حشرات و غیره. رشد بیشتر آن را متوقف می کنند.
هنگام خنک کردن اجسام بزرگ (در مقایسه با یک سلول - 1 میلی متر یا بیشتر)، معمولاً شیب دمایی قابل توجهی در داخل آنها ایجاد می شود. ابتدا لایه های بیرونی یخ می زنند و یک جبهه به اصطلاح کریستالیزاسیون تشکیل می شود که از بیرون به داخل حرکت می کند. غلظت املاح و سایر مواد محلول در آب قبل از این جبهه به شدت افزایش می یابد. این منجر به دناتوره شدن پروتئین و آسیب به سایر ماکرومولکول های سلولی می شود. مشکل دیگر ترک خوردن پارچه است. علت آن سرد شدن ناهمگون و ناهمگن است، به خصوص در شرایطی که لایه های بیرونی قبل از لایه های داخلی سخت می شوند.
به دهه 60 برگشت. قرن XX ایده استفاده از فشار بالا برای کنترل کریستالیزاسیون آب پیشنهاد شد. این ایده مبتنی بر کاهش دمای انتقال فاز آب/یخ با افزایش فشار است. در اتمسفر 2045 دمای تبلور آب خالص 22- درجه سانتیگراد است. دستیابی به کاهش بیشتر در دمای انجماد به این روش امکان پذیر نیست - با افزایش بیشتر فشار، دوباره شروع به افزایش می کند.
در سال 1967، M.D. پرسیدسکی و همکارانش انجماد کلیه سگ ها را آزمایش کردند. محققین کلیه ها را با محلول دی متیل سولفوکسید 15 درصد پرفیوژن کردند (پرفیوژن عبارت است از ورود مواد به یک جسم بیولوژیکی از طریق سیستم رگ های خونی) و سپس آنها را خنک کردند و همزمان فشار را افزایش دادند به طوری که در هر لحظه دما بالا نمی رفت. زیر نقطه انجماد مربوط به فشار معین. هنگامی که مقدار حداقل دما (در این مورد، به دلیل وجود یک محافظ سرما، حدود 25- درجه سانتیگراد بود) رسید، فشار کاهش یافت.
 با آزاد شدن سریع فشار، یک مایع فوق سرد شده تا چنین دمایی می تواند بیش از چند ثانیه وجود نداشته باشد و پس از آن تبلور خود به خود رخ می دهد. اما کریستال های تشکیل شده در این حالت به طور مساوی در سراسر حجم نمونه توزیع می شوند و جلوی کریستالیزاسیون و همچنین افزایش ناهموار غلظت نمک ها رخ نمی دهد. علاوه بر این، کریستال هایی که در این حالت به وجود می آیند اندازه کوچک و دانه ای شکل دارند و بنابراین آسیب نسبتا کمی به سلول ها وارد می کنند.
با آزاد شدن سریع فشار، یک مایع فوق سرد شده تا چنین دمایی می تواند بیش از چند ثانیه وجود نداشته باشد و پس از آن تبلور خود به خود رخ می دهد. اما کریستال های تشکیل شده در این حالت به طور مساوی در سراسر حجم نمونه توزیع می شوند و جلوی کریستالیزاسیون و همچنین افزایش ناهموار غلظت نمک ها رخ نمی دهد. علاوه بر این، کریستال هایی که در این حالت به وجود می آیند اندازه کوچک و دانه ای شکل دارند و بنابراین آسیب نسبتا کمی به سلول ها وارد می کنند.
با این حال، در طول فرآیند تبلور، مقدار قابل توجهی گرما آزاد می شود (گرمای نهان تبلور)، در نتیجه نمونه گرم می شود - در نهایت به دمای تبلور، یعنی. هنگامی که فشار به اتمسفر کاهش می یابد - تقریباً به 0 درجه سانتیگراد. پس از آن فرآیند انجماد به طور طبیعی متوقف می شود. در نتیجه، زمانی که فشار برداشته شد، تنها حدود 28 درصد از آب زمان کریستالی شدن داشت و بقیه مایع باقی ماند.
برای اینکه تمام آب متبلور شود، لازم است نمونه قبل از کاهش فشار تا دمای 80- درجه سانتیگراد خنک شود - اما در این حالت یخ خیلی زودتر شروع به تشکیل می کند. M. Persidski با اعمال فشار چرخه ای مشکل را حل کرد. نمونه ای که پس از اولین آزادسازی فشار تا 0 درجه سانتیگراد گرم شده بود، دوباره شروع به خنک شدن کرد - همزمان با افزایش مکرر فشار. دفعه بعد که "تنظیم مجدد" شد، قسمت بعدی مایع زمان یخ زدن داشت و غیره. در نتیجه، امکان دستیابی به تبلور تقریباً کامل و "بی ضرر" آب وجود داشت که پس از آن می توان دما را با خیال راحت به پایین آورد.
-130 درجه سانتیگراد (و کمتر) در فشار اتمسفر طبیعی و کلیه را برای مدت نامحدودی در این حالت نگه دارید.
هنگام ذوب، چرخه به ترتیب معکوس تکرار شد: کلیه تا 28- درجه سانتیگراد گرم شد و پس از آن فشار به 2000 اتمسفر افزایش یافت. در این مورد، ذوب نسبتاً یکنواخت کریستال های یخ رخ داد. سپس نمونه به تدریج با کاهش همزمان فشار حرارت داده شد.
به گفته نویسندگان این آزمایش، کلیههایی که به این روش حفظ شدهاند، «نشانههای آسیب بافتی کمتری نسبت به کلیههایی که با هر روش دیگری منجمد شدهاند نشان میدهند» - اگرچه آنها زنده نمیمانند.
متعاقباً از روش انجماد با فشار بالا در تهیه نمونه های بیولوژیکی برای مطالعات میکروسکوپی استفاده شد. برای ایجاد یک مقطع به اندازه کافی نازک، ابتدا باید نمونه را به حالت جامد تبدیل کرد، اما با انجماد معمولی، ساختارهای سلولی آنقدر آسیب می بینند که عملاً چیزی برای مطالعه وجود ندارد.
فشار چند هزار اتمسفر با موفقیت برای انجماد محصولات در صنایع غذایی استفاده می شود. در این صورت دو هدف دنبال می شود. اولاً، پس از نگهداری طولانی مدت (و در نتیجه در کمترین درجه حرارت ممکن)، طعم یک محصول منجمد باید تا حد امکان با تازه تفاوت داشته باشد. برای این امر همچنین مهم است که سلول ها در حین انجماد از بین نروند که با انجماد در فشار حدود 2 هزار اتمسفر تا حدودی می توان به آن دست یافت. هدف دیگر استریل سازی همزمان محصول است که برعکس با از بین بردن سلول های باکتری موجود در آن حاصل می شود. برای این، فشار بسیار بالاتری مورد نیاز است - 6 هزار اتمسفر. و بیشتر.
نویسندگان از تلاشهای جدید برای استفاده از فشار بالا برای حفظ برگشتپذیر اندامها یا کل ارگانیسمها آگاه نیستند، و با این حال این مسیر بسیار امیدوارکننده به نظر میرسد. البته این سوال در مورد اثرات مخرب فشار بالا مطرح می شود. مشخص است که با افزایش تدریجی آن به حدود 500 اتمسفر. زنده ماندن سلول کاهش نمی یابد. در 6000 atm. و بیشتر، تقریباً همه سلول ها می میرند، اما مقادیر میانی بسته به نوع و وضعیت سلول ها، محتوای آب، نمک ها و سایر مواد موجود در آنها، دما و غیره می توانند تأثیرات متفاوتی داشته باشند.
با این حال، می توان انتظار داشت که فشار تدریجی به 2 هزار اتمسفر مورد نیاز افزایش یابد. آسیبی به بدن وارد نخواهد کرد. در واقع، برای آماده شدن برای انجماد، ابتدا جسم را تا حدود 0 درجه سانتیگراد خنک می کنند (اگر موجود زنده باشد، تنفس متوقف می شود) و در محفظه ای پر از مایع قرار می گیرد. در سال 1961، محقق آمریکایی S. Jacob آن را به مدت 30 دقیقه تحت فشار حدود 1000 اتمسفر قرار داد. قلب سگی که به تازگی از بدن خارج شده و به انقباض خود ادامه می دهد. پس از کاهش فشار، ضربان قلب دوباره شروع شد.
همچنین مهم است که برخی از مواد محافظت کننده در برابر سرما نیز به عنوان محافظ بارو عمل کنند، یعنی سلول ها را از قرار گرفتن در معرض فشار بالا محافظت می کنند. یک انجماد "خوب" نه تنها نقطه انجماد محلول را کاهش می دهد، بلکه غشاهای سلولی را تثبیت می کند و آنها را انعطاف پذیرتر می کند.
البته، حل تعدادی از مشکلات ضروری است: در طول آزمایش، برای کار کردن حالت خنک کننده بهینه، انتخاب محافظ های سرمایشی خاص، و غیره. به عنوان مثال، هنگام گذراندن چرخه های "فشرده سازی با خنک کننده - آزادسازی فشار"، خنک سازی رخ می دهد. فقط از سطح جسم. این منجر به این واقعیت می شود که یخ در حاشیه تشکیل می شود، در حالی که در مرکز، برعکس، یخ موجود ممکن است به دلیل افزایش فشار ذوب شود. با این کار می توان با کاهش دما به آرامی (و اجازه دادن به جسم به طور یکنواختتر خنک شود) یا با افزایش غلظت مواد محافظ برودتی در لایه های بیرونی مبارزه کرد. در این حالت نیازی به افزایش فشار به حداکثر مقادیر نیست. این امکان وجود دارد که با افزایش تعداد چرخه ها، در محدوده ایمن شناخته شده 500-1000 اتمسفر باقی بمانند.
علاوه بر این، همانطور که آزمایشهای اسمیت با همسترهای طلایی نشان داد، شیشهای شدن تنها حدود 40 درصد آب (و تبلور بقیه) ممکن است برای انجماد برگشتپذیر کافی باشد.
بنابراین داده های موجود به طور کامل به ما اجازه می دهد تا به استفاده از فشارهای بالا برای کنترل تبلور آب آزاد و حفظ انجماد اشیاء بیولوژیکی بزرگ، اندام ها و حتی کل موجودات امیدوار باشیم. کار در این راستا در مؤسسه بیوفیزیک سلولی آکادمی علوم روسیه (آزمایشگاه انجماد ذخایر ژنتیکی تحت رهبری E.N. Gakhova) همراه با مؤسسه فناوری های زیست پزشکی و مؤسسه تحقیقات دولتی VT در حال انجام است. . S.A. وکشینسکی.
نمودار (نگاه کنید به شکل 3) همچنین نشان می دهد که نقطه جوش محلول بالاتر از نقطه جوش یک حلال خالص است. نقطه جوش دمایی است که در آن فشار بخار اشباع شده برابر با فشار خارجی است.بنابراین، متفاوت است: برای آب خالص دمای T1 و برای محلول T2 است .
برای محلول های رقیق، با کاهش دما (نگاه کنید به شکل 3)، حلال خالص ابتدا شروع به کریستال شدن می کند. این زمانی اتفاق می افتد که فشار بخار بالای محلول برابر با بخار اشباع بالای کریستال (خط O-B) شود.دمایی که در آن تبلور برای محلول ترکیب C 1 شروع می شود با دمای T 3 و برای ترکیب C 2 - T 4 مطابقت دارد. . با افزایش غلظت ماده محلول، نقطه انجماد کاهش می یابد که در نمودار P-T نیز به وضوح قابل مشاهده است (شکل 3 را ببینید). .
هر چه محلول غلیظ تر باشد، منحنی های فشار بخار بر روی محلول ها از منحنی آب مربوطه دورتر است. بنابراین، هر چه غلظت محلول بیشتر باشد، تفاوت بین دمای جوش یا انجماد آب و محلول بیشتر است.
رائول در حین مطالعه انجماد و جوشاندن محلول ها دریافت که برای محلول های رقیق غیرالکترولیت ها، افزایش نقطه جوش و کاهش نقطه انجماد متناسب با غلظت محلول است.
قانون دوم رائول:افزایش نقطه جوش (نقطه انجماد پایین) محلول در مقایسه با نقطه جوش (انجماد) حلال متناسب با غلظت مولی املاح است.
از نظر ریاضی، این تغییرات دما را می توان با استفاده از فرمول های زیر محاسبه کرد:
;
;
جایی که K E -ثابت حلال ebulioscopic (از لاتین ebullire - boil). به جمهوری قرقیزستان- ثابت کرایوسکوپیک (از یونانی сrios - سرد) حلال؛ - افزایش نقطه جوش؛ - کاهش دمای انجماد؛ با م- غلظت مولی ماده محلول.
اگر نقاشی می کنید با م، سپس فرمول ها به شکل زیر در می آیند:
معنای فیزیکیثابت های بولیوسکوپی و کرایوسکوپی به صورت زیر تعیین می شوند. مقادیر عددی آنها را نشان می دهد , محلول یک مولی (حاوی 1 مول املاح در 1000 گرم حلال) چند درجه بالاتر و چند درجه پایین تر از نقطه جوش و انجماد یک حلال خالص یخ می زند.واحدهای اندازه گیری 1 درجه مول - 1 کیلوگرم است.
ثابت های بولیوسکوپی و کرایوسکوپی به ماهیت املاح بستگی ندارند، اما ویژگی های حلال هستند. مقادیر آنها برای برخی از حلالها در جدول 1 آورده شده است.
جدول 1 - ثابت های کرایوسکوپی و بولیوسکوپی برخی از حلال ها
روش های ابولیوسکوپی و کرایوسکوپی برای تعیین جرم مولکولی مواد بر اساس اندازه گیری دمای جوش و انجماد محلول ها است. این دو روش به طور گسترده در شیمی مورد استفاده قرار می گیرند، زیرا با استفاده از حلال های مختلف می توان وزن مولکولی مواد مختلف را تعیین کرد.
برای تعیین جرم مولی یک املاح، استفاده از رابطه زیر راحت است:
جایی که - افزایش نقطه جوش یا کاهش نقطه انجماد محلول در مقایسه با ویژگی های مربوط به یک حلال خالص.
K - ثابت بولیوسکوپی یا کرایوسکوپی.
از قابلیت انجماد محلول ها در دمای کمتر از حلال در تهیه محلول های کم انجماد استفاده می شود که به آن ها می گویند. ضد یخ ضد یخ برای جایگزینی آب در رادیاتور موتورهای خودرو و هواپیما در زمستان استفاده می شود. می توان از اجزای به اصطلاح اصلی استفاده کرد. الکل های پلی هیدریک - اتیلن گلیکول و گلیسیرین:
CH 2 - CH 2 CH 2 - CH 2 - CH 2
HE HE HE HE HE
اتیلن گلیکول گلیسیرین
به عنوان مثال، محلول آبی اتیلن گلیکول (58 درصد وزنی)، تنها در دمای منفی 50 درجه سانتیگراد منجمد می شود.
اسمز
عبور خود به خودی یک حلال از یک غشای نیمه تراوا که یک محلول و یک حلال یا دو محلول با غلظت های متفاوت از املاح را جدا می کند، نامیده می شود. توسط اسمز . اسمز در اثر انتشار مولکول های حلال از طریق یک پارتیشن نیمه تراوا ایجاد می شود که فقط به مولکول های حلال اجازه عبور می دهد. مولکول های حلال از یک حلال به یک محلول یا از یک محلول با غلظت کمتر به محلول غلیظ تر منتشر می شوند، بنابراین محلول غلیظ رقیق می شود و ارتفاع ستون h آن نیز افزایش می یابد (شکل 4).
در حالت تعادل، فشار خارجی فشار اسمزی را متعادل می کند. در این حالت، سرعت انتقال رو به جلو و معکوس مولکول ها از طریق پارتیشن نیمه تراوا یکسان می شود. اگر فشار خارجی اعمال شده به محلول غلیظ تر از p اسمزی بیشتر باشد، یعنی p > p، سرعت انتقال مولکول های حلال از محلول غلیظ بیشتر خواهد بود و حلال به یک محلول رقیق (یا خالص) حرکت می کند. حلال). این فرآیند، به نام اسمز معکوس ، برای تصفیه آب های طبیعی و فاضلاب، برای به دست آوردن آب آشامیدنی از آب دریا استفاده می شود.
از نظر کمی، اسمز با فشار اسمزی برابر با نیروی واحد سطح مشخص می شود، که مولکول های حلال را مجبور می کند از طریق یک پارتیشن نیمه تراوا نفوذ کنند. فشار اسمزی با افزایش غلظت املاح و دما افزایش می یابد. وانت هاف این را پیشنهاد کرد برای فشار اسمزی می توانیم معادله حالت یک گاز ایده آل را اعمال کنیم:
جایی که پ- فشار اسمزی، کیلو پاسکال؛ با- غلظت مولی محلول، مول در لیتر؛ آر- ثابت گاز جهانی، تی- دمای مطلق
اسمز نقش بسیار مهمی در فرآیندهای بیولوژیکی ایفا می کند و جریان آب را به سلول ها و سایر ساختارها تضمین می کند. محلول هایی با فشار اسمزی یکسان را ایزوتونیک می نامند. اگر فشار اسمزی بیشتر از فشار داخل سلولی باشد به آن هیپرتونیک و اگر کمتر از فشار داخل سلولی باشد هیپوتونیک می گویند. به عنوان مثال، فشار اسمزی متوسط خون در دمای 36 درجه سانتیگراد 780 کیلو پاسکال است. محلول های هیپرتونیک شکر (شربت) و نمک (نمک) به طور گسترده برای نگهداری مواد غذایی استفاده می شود، زیرا باعث حذف آب از میکروارگانیسم ها می شود.
نمونه هایی از حل مسئله
قبل از حل مشکلات، باید موارد زیر را درک کنید:
- نقطه انجماد محلول کمتر از نقطه انجماد حلال است
- نقطه جوش محلول بالاتر از نقطه جوش حلال است
- ارزش همیشه مثبت است و دما در مقیاس سلسیوس تغییر می کند و مقیاس ترمودینامیکی کلوین از نظر عددی منطبق هستند، یعنی و .
مثال 1. تعیین نقطه جوش و نقطه انجماد یک غیر الکترولیت.
نقطه جوش و نقطه انجماد محلول 2% نفتالین (C 10 H 8) در بنزن را تعیین کنید.
راه حل
بر اساس قانون دوم رائول می توانیم بنویسیم:
مقدار ثابت بولیوسکوپی بنزن و همچنین نقطه جوش و انجماد بنزن را از جدول 1 می گیریم. M (C 10 H 8) = 128 g/mol. به یاد داشته باشیم که درصد غلظت، تعداد گرم ماده محلول در 100 گرم محلول را نشان می دهد، یعنی جرم نفتالین 2 گرم و جرم حلال یعنی بنزن 100 - 2 = 98 گرم است. ، با جایگزینی مقادیر شناخته شده در معادله، دریافت می کنیم
از آنجایی که بنزن خالص در دمای 80.1 درجه سانتیگراد می جوشد و افزایش دما 0.4 درجه سانتیگراد است، نقطه جوش محلول نفتالین در بنزن 80.5 درجه سانتیگراد است.
نقطه انجماد این محلول به همین ترتیب تعیین می شود:
نقطه انجماد بنزن 5.5 درجه سانتی گراد است. کاهش دما 0.8 درجه است، بنابراین، نقطه انجماد محلول 2٪ نفتالین در بنزن 4.7 درجه سانتیگراد است.
مثال 2. تعیین غلظت غیر الکترولیت بر اساس دمای تبلور (جوش) محلول ها.
کسر جرمی ساکارز C 12 H 2 20 11 را در آب تعیین کنید اگر مشخص شود که نقطه انجماد این محلول منفی 0.21 درجه سانتیگراد است.
راه حل.
از داده های مشکل چنین نتیجه می شود تگرگ برای تعیین کسر جرمی ساکارز در محلول، از معادله استفاده می کنیم
که در آن مقادیر شناخته شده را جایگزین می کنیم: K KR - ثابت کرایوسکوپی، K KR = 1.86 درجه مول -1 کیلوگرم، و جرم مولی ساکارز M(C 12 H 2 20 11) = 342 گرم در مول. نگرش
پس جرم ماده حل شده در هر 1000 گرم حلال است
در هر 1000 گرم حلال 38.6 گرم ساکارز وجود دارد، بنابراین برای تعیین کسر جرمی ماده محلول، می توانید از فرمول استفاده کنید.
یا یک نسبت بسازید:
1038.6 گرم محلول حاوی 38.6 گرم ساکارز است.
100 گرم محلول - xg ساکارز.
بنابراین، کسر جرمی املاح 3.71٪ است.
مثال 4. تعیین جرم مولی یک غیر الکترولیت از دمای تبلور (جوش).
محلول غیر الکترولیتی حاوی 2.5 گرم املاح در 25 گرم بنزن است و در دمای 4.3 درجه سانتی گراد منجمد می شود. جرم مولی املاح را تعیین کنید.
راه حل
با استفاده از این شرایط مشکل و نقطه انجماد بنزن به اضافه 5.5 درجه سانتیگراد، تعیین می کنیم تگرگ جرم مولی یک املاح را می توان از این رابطه تعیین کرد
که در آن K KR ثابت کرایوسکوپی بنزن است، K KR = 5.12 درجه مول -1 کیلوگرم.
g/mol.
کنترل سوالات
1 چه فشاری را فشار بخار اشباع می گویند؟
2 عبارات ریاضی هر یک از قوانین رائول را بنویسید و معنای فیزیکی کمیت های موجود در این عبارات را توضیح دهید.
3 مقادیر مساوی از اوره CO(NH 2) 2 و ساکارز C 12 H 22 O 11 در همان مقدار آب در شرایط یکسان حل شد. برای کدام راه حل ارزش بیشتر خواهد بود؟
4 آیا کاهش نقطه انجماد محلول های آبی 0.1 مولار گلوکز C 6 H 12 O 6 و اوره CO (NH 2) 2 یکسان است؟
مسئله 1. اگر 8.5 گرم از این ماده در 300 گرم آب حل شود، نقطه جوش محلول آبی اوره CO(NH 2) 2 چند درجه افزایش می یابد؟
وظیفه 2. کسر جرمی متانول CH 3 OH را در محلول آبی که نقطه انجماد آن منفی 2.79 درجه سانتیگراد است محاسبه کنید.
مسئله 3. نقطه جوش محلول 1 گرم نفتالین C 10 H 8 را در 20 گرم اتر تعیین کنید، اگر نقطه جوش اتر 35.6 درجه سانتیگراد باشد، K E = 2.16 درجه سانتیگراد.
مسئله 4. محلولی از 1.05 گرم غیر الکترولیت در 30 گرم آب یخ می زند.
– 0.7 درجه سانتی گراد وزن مولکولی غیرالکترولیت را محاسبه کنید.
وظیفه 5. مقدار اتیلن گلیکول C 2 H 4 (OH) 2 را که برای تهیه ضدیخ با نقطه انجماد منفی 15 درجه سانتیگراد باید به هر کیلوگرم آب اضافه شود محاسبه کنید.
وظیفه 7. برای تهیه ضدیخ، 9 لیتر گلیسرول C 3 H 5 (OH) 3 در هر 30 لیتر آب مصرف شد. نقطه انجماد ضد یخ تهیه شده چقدر است؟ چگالی گلیسیرین 1261 کیلوگرم بر متر مکعب است.
سیستم های پراکنده
مواد شیمیایی را می توان به صورت خالص یا مخلوط یافت. مخلوط ها به نوبه خود به دو دسته همگن و ناهمگن تقسیم می شوند. مخلوطهای تک فازی همگن شامل محلولهای واقعی هستند (به بخش 1 مراجعه کنید)، که در آنها ماده محلول به شکل مولکولها یا یونها ارائه میشود که اندازههای آنها با مولکولهای حلال قابل مقایسه است و از 1 نانومتر تجاوز نمیکند. مخلوط های همگن از نظر ترمودینامیکی پایدار هستند.
با افزایش اندازه ذرات، سیستم ناهمگن می شود و شامل دو یا چند فاز با یک رابط بسیار توسعه یافته است. و همانطور که تمرین نشان می دهد، ناحیه دیگری از تکه تکه شدن ماده مجموعه جدیدی از ویژگی های ذاتی فقط برای این شکل از سازماندهی ماده را تشکیل می دهد.
حتی M.V. Lomonosov در سال 1764 کشف کرد که محلول ها در دمای پایین تری نسبت به حلال های خالص منجمد می شوند. کاهش نقطه انجماد یک محلول با کاهش کشش (فشار) بخار حلال بالای محلول (تغییر غلظت شیره سلولی در گیاهان به سمت زمستان) همراه است.
نقطه انجمادمحلول دمایی است که در آن کریستال های حلال با محلولی از یک ترکیب معین در تعادل هستند.
تفاوت Δt = t 0 ° - ti ° کاهش دما نامیده می شودانجماد محلول و بیشتر خواهد بود، غلظت محلول بیشتر می شود. این وابستگی به صورت کمی با معادله بیان می شود:
Δt = K С m (36)
که در آن Δt کاهش دمای انجماد محلول است.
سانتی متر - غلظت مولال؛
K ضریب تناسب نامیده می شود ثابت کرایوسکوپیحلال یا کاهش مولالی در نقطه انجماد محلول.
روش تحقیقی مبتنی بر اندازه گیری کاهش نقطه انجماد محلول ها را روش کرایوسکوپی می نامند.
محلول ها در دماهای پایین تر منجمد می شوند و در دمای بالاتر از حلال های خالص می جوشند.
برای محلول های غیرالکترولیت ها، طبق قانون رائول، کاهش نقطه انجماد محلول با غلظت مولی نسبت مستقیم دارد (معادله 36).
افزایش نقطه جوش محلول نیز مستقیماً با غلظت مولی متناسب است:
Δt kip = EC m (37)
E - ثابت بولیوسکوپی.
فشار اسمزی محلول ها با استفاده از فرمول Van't Hoff محاسبه می شود:
Р osm =RTC m (38)
R - ثابت گاز جهانی 8.314 kJ/mol درجه
T - دما، 0 K، C m - غلظت مولی.
کنترل سوالات
1. ماهیت قانون توزیع چیست؟
2. استنباط قانون توزیع.
3. اعمال قانون توزیع.
4. اشتقاق قانون توزیع بر چه شرطی از تعادل فاز است؟
5. چه عواملی بر مقدار ضریب توزیع تأثیر می گذارد؟
6. کدام استخراج موثرتر است: تکی یا کسری؟
وظایف
| شماره شغل | m g H 2 O | m g SUCHAROSE | شماره شغل | m g H 2 O | m g SUCHAROSE |
| 60 | .2 | ||||
| 55 | |||||
در چه دمایی محلول های حاوی میلی گرم آب در متر گرم قند می جوشند. ایجاد نموداری از وابستگی دمای جوش به محتوای ماده محلول در محلول
| شماره شغل | m g H 2 O | m g SUCHAROSE | شماره شغل | m g H 2 O | m g SUCHAROSE |
| 60 | |||||
| 55 | |||||
| شماره شغل | m g H 2 O | میلی گرم گلوکز | شماره شغل | m g H 2 O | میلی گرم گلوکز |
| 4,57 | 10,01 | ||||
| 12,57 | |||||
| 5,56 | |||||
| 14,40 | |||||
| 8,32 | 11,54 |
تعیین دمای انجماد محلولی بر حسب میلی گرم H 2 O که حاوی میلی گرم گلوکز است نموداری از وابستگی دمای انجماد به محتوای ماده محلول در محلول بسازید.